Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls137901/2012 a sukls137903/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Václav Malý
- před 8 lety
- Počet zobrazení:
Transkript
1 Příloha č. 2 k rozhodutí o převodu registrace sp.z. sukls137901/2012 a sukls137903/ NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Solifeaci Medico Uo 5 mg potahovaé tablety Solifeaci Medico Uo 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Solifeaci Medico Uo 5 mg: jeda potahovaá tableta obsahuje 5 mg solifeacii succias, což odpovídá 3,8 mg solifeacium. Solifeaci Medico Uo 10 mg: jeda potahovaá tableta obsahuje 10 mg solifeacii succias, což odpovídá 7,5 mg solifeacium. Pomocé látky: moohydrát laktózy 107,5 mg 102,5 mg Úplý sezam pomocých látek viz bod LÉKOVÁ FORMA Potahovaé tablety. Solifeaci Medico Uo 5 mg je kulatá světle žlutá tableta o průměru přibližě 8 mm a s vyražeým ápisem 390" a jedé straě tablety. Solifeaci Medico Uo 10 mg je kulatá světle růžová tableta o průměru přibližě 8 mm a s vyražeým ápisem 391" a jedé straě tablety. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické idikace Solifeaci Medico Uo je idiková k symptomatické léčbě urgetí ikotiece a/ebo zvýšeé frekvece močeí a aléhavosti močeí u dospělých pacietů s hyperaktivím močovým měchýřem. 4.2 Dávkováí a způsob podáí Dávkováí Doporučeá dávka je 5 mg solifeaci sukciátu jedou deě. V případě potřeby je možo dávku zvýšit a 10 mg solifeaci sukciátu jedou deě. Přípravek lze užívat spolu s jídlem ebo bez ěj. Zvláští skupiy pacietů Starší pacieti U starších pacietů eí úprava dávky utá. Pacieti s poškozeím ledvi U pacietů s mírým až středě těžkým poškozeím ledvi (clearace kreatiiu > 30 ml/mi) eí úprava dávky utá. Paciety s vážým poškozeím ledvi (clearace kreatiiu 30 ml/mi) je třeba léčit s opatrostí a dávkou e vyšší ež 5 mg jedou deě (viz bod 5.2). Pacieti s poškozeím jater Stráka 1 z 10
2 U pacietů s lehkým poškozeím jater eí úprava dávky utá. Paciety se středě těžkým poškozeím jater (Child-Pughovo skóre 7 až 9) je třeba léčit s opatrostí a dávkou e vyšší ež 5 mg jedou deě (viz bod 5.2). Pacieti léčeí vysoce účiými ihibitory cytochromu P450 3A4 Pokud se přípravek Solifeaci Medico Uo podává současě s ketokoazolem ebo jiými vysoce účiými ihibitory CYP3A4, jako jsou apř. ritoavir, elfiavir ebo itrakoazol, v terapeutických dávkách, eměla by maximálí deí dávka přesáhout 5 mg (viz bod 4.5). Pediatrická populace Bezpečost a účiost u dětí a dospívajících mladších 18 let ebyla ještě staovea. Z tohoto důvodu eí přípravek Solifeaci Medico Uo urče pro podáváí dětem a dospívajícím. Způsob podáí Solifeaci Medico Uo se užívá perorálě, polyká se celá tableta a zapíjí tekutiou. 4.3 Kotraidikace - Solifeaci je kotraidiková u pacietů s močovou retecí, závažými gastroitestiálími poruchami (včetě toxického megakolou), myastheia gravis a glaukomem s úzkým úhlem a u pacietů, u kterých existuje riziko vziku těchto stavů. - Pacieti přecitlivělí a léčivou látku ebo ěkterou jiou látku obsažeou v přípravku. - Pacieti léčeí hemodialýzou (viz bod 5.2). - Pacieti se závažým poškozeím jater (viz bod 5.2). - Pacieti se závažým poškozeím ledvi ebo středě závažým poškozeím jater se současou léčbou silým ihibitorem CYP3A4, apř. ketokoazolem (viz bod 4.5). 4.4 Zvláští upozorěí a opatřeí pro použití Před léčbou přípravkem Solifeaci Medico Uo je třeba zvážit jié možé příčiy častého močeí (srdečí selháí ebo oemocěí ledvi). Pokud je přítoma močová ifekce, je uto zahájit léčbu vhodými atibiotiky. Solifeaci Medico Uo je třeba podávat opatrě pacietům s: - kliicky výzamou obstrukcí močových cest s rizikem vziku retece moči; - poruchami gastroitestiálího traktu obstrukčího typu; - rizikem sížeé motility gastroitestiálího traktu; - závažým poškozeím ledvi (clearace kreatiiu 30 ml/mi; viz bod 4.2 a 5.2), dávky u těchto pacietů by eměly překročit 5 mg; - středě závažým poškozeím jater (Child-Pughovo skóre 7 až 9; viz bod 4.2 a 5.2), dávky u těchto pacietů by eměly překročit 5 mg; - současou léčbou silým ihibitorem CYP3A4, apř. ketokoazolem (viz bod 4.2 a 4.5); - hiátovou herií ebo gastroesofageálím refluxem a se souběžou léčbou léky, které mohou vyvolat ebo zhoršit záět jícu (jako jsou bisfosfoáty); - autoomí europatií. U pacietů s eurogeími příčiami zvýšeé aktivity detrusoru ebyla bezpečost a účiost dosud staovea. Pacieti se vzácě se vyskytující dědičou itolerací galaktózy, vrozeým deficitem laktázy ebo malabsorpcí glukózy/galaktózy by teto přípravek eměli užívat. Maximálí účiek přípravku Solifeaci Medico Uo lze staovit ejdříve po 4 týdech léčby. Stráka 2 z 10
3 4.5 Iterakce s jiými léčivými přípravky a jié formy iterakce Farmakologické iterakce Současé podáváí s jiými léčivými přípravky s aticholiergími vlastostmi může mít za ásledek výrazější léčebý účiek i ežádoucí účiky. Mezi ukočeím léčby přípravkem Solifeaci Medico Uo a zahájeím jié aticholiergí terapie je utá přestávka přibližě 1 týde. Léčebý účiek solifeaciu může být síže současým podáváím agoistů choliergích receptorů. Solifeaci může sižovat účiek léčivých přípravků, které stimulují motilitu gastroitestiálího traktu jako jsou metoklopramid a cisaprid. Farmakokietické iterakce Studie i vitro prokázaly, že v terapeutických kocetracích solifeaci eihibuje CYP1A1/2, 2C9, 2C19, 2D6 ebo 3A4 z lidských jaterích mikrozómů. Solifeaci tedy pravděpodobě eovlivňuje clearace léků metabolizovaých těmito CYP ezymy. Účiky ostatích léčivých přípravků a farmakokietiku solifeaciu Solifeaci je metabolizová CYP3A4. Současé podáváí ketokoazolu (200 mg deě), silého ihibitoru CYP3A4, má za ásledek dvojásobé zvýšeí AUC u solifeaciu. Podáváí ketokoazolu v dávce 400 mg deě vede k trojásobému zvýšeí AUC u solifeaciu. Pokud je tedy přípravek Solifeaci Medico Uo podává současě s ketokoazolem ebo jiými potetími ihibitory CYP3A4 (apř. ritoavir, elfiavir, itrakoazol) v terapeutických dávkách, měla by se jeho maximálí dávka omezit a 5 mg (viz bod 4.2). Současá léčba solifeaciem a potetím ihibitorem CYP3A4 je kotraidikováa u pacietů se závažým poškozeím ledvi ebo středě závažým poškozeím jater. Účiky idukce ezymů a farmakokietiku solifeaciu a jeho metabolitů ebyly studováy, stejě jako vliv substrátů s vyšší afiitou k CYP3A4 a expozici solifeaciu. Vzhledem k tomu, že solifeaci je metabolizová CYP3A4, jsou možé farmakokietické iterakce s jiými substráty s vyšší afiitou k CYP3A4 (apř. verapamil, diltiazem) a s iduktory CYP3A4 (apř. rifampici, feytoi, karbamazepi). Účiek solifeaciu a farmakokietiku ostatích léčivých přípravků Orálí kotraceptiva Solifeaci Medico Uo evykazuje žádou farmakokietickou iterakci solifeaciu s kombiovaými orálími kotraceptivy (ethiylestradiol/levoorgestrel). Warfari Solifeaci Medico Uo eměí farmakokietiku R-warfariu ebo S-warfariu ebo jejich účiek a protrombiový čas. Digoxi Solifeaci Medico Uo emá žádý vliv a farmakokietiku digoxiu. Léčebé přípravky, které stimulují motilitu gastroitestiálího traktu Solifeaci může sižovat účiek léčivých přípravků, které stimulují motilitu gastroitestiálího traktu, jako jsou metoklopramid a cisaprid. 4.6 Fertilita, těhoteství a kojeí Těhoteství Údaje o podáváí solifeaciu těhotým žeám ejsou k dispozici. Studie reprodukčí toxicity a zvířatech eazačují přímé ebo epřímé škodlivé účiky (viz bod 5.3). Podáváí přípravku Solifeaci Medico Uo v těhoteství se z prevetivích důvodů edoporučuje. Stráka 3 z 10
4 Kojeí Dostupé farmakodyamické/toxikologické údaje u zvířat prokázaly vylučováí solifeaciu/metabolitů do mléka (viz bod 5.3). Riziko pro kojece elze vyloučit. Solifeaci Medico Uo se během kojeí emá podávat. Fertilita Údaje o možých účicích Solifeaci Medico Uo a mužskou a žeskou fertilitu ejsou k dispozici.. Studie a zvířatech eazačují přímé škodlivé účiky a fertilitu. Míra poteciálího rizika pro člověka eí zámá. Během pláováí těhoteství se přípravek Solifeaci Medico Uo emá podávat. 4.7 Účiky a schopost řídit a obsluhovat stroje Vzhledem k tomu, že solifeaci může stejě jako ostatí aticholiergika způsobit rozmazaé viděí a méě často i ospalost a úavu (viz bod 4.8, Nežádoucí účiky), může být schopost řídit a obsluhovat stroje egativě ovlivěa. 4.8 Nežádoucí účiky a. Souhrý bezpečostí profil Vzhledem k farmakologickému účiku solifeaciu může přípravek Solifeaci Medico Uo způsobit aticholiergí ežádoucí účiky, které jsou obecě míré až středí itezity. Výskyt těchto ežádoucích účiků závisí a dávce. Nejčastěji hlášeým ežádoucím účikem u solifeaciu bylo sucho v ústech. Objevilo se u 11 % pacietů léčeých dávkou 5 mg deě, u 22 % pacietů léčeých 10 mg deě a u 4 % pacietů a placebu. Itezita tohoto účiku byla obecě ízká a je příležitostě vedla k vysazeí léčiva. Celkově byla compliace u tohoto přípravku velmi vysoká (přibližě 99 %) a přibližě 90 % pacietů léčeých solifeaciem dokočilo celou studii trvající 12 týdů. b. Tabulka shrující ežádoucí účiky Frekvece Třída orgáových systémů podle databáze MedDRA Ifekce a ifestace Psychiatrické poruchy Poruchy ervového systému Poruchy oka Srdečí poruchy Velmi časté 1/10 Časté 1/100 až <1/10 rozmazaé viděí Méě časté 1/1000 až <1/100 ifekce močových cest cystitis somolece poruchy chuti sydrom suchého oka Vzácé 1/ až <1/1000 Velmi vzácé <1/10000 haluciace* stavy zmateosti* závratě*, bolesti hlavy Neí zámo Frekveci elze z dostupých údajů určit prodloužeí QT itervalu* torsades de Stráka 4 z 10
5 Respiračí, hrudí a mediastiálí poruchy Gastroitestiál í poruchy Poruchy kůže a podkoží tkáě Poruchy ledvi a močových cest Celkové poruchy a reakce v místě aplikace * viz část c. sucho v ústech zácpa evolost dyspepsie bolest břicha sucho v ose choroby spojeé s gastroesofageálím refluxem sucho v krku suchá kůže obtížé močeí úava periferí otoky obstrukc e tlustého střeva fekálí impakce retece moči zvraceí* erythema multiforme * svěděí*, vyrážka*, kopřivka* poites c. Popis vybraých ežádoucích účiků Haluciace, stavy zmateosti, závratě, bolesti hlavy, erythema multiforme, svěděí, vyrážka a kopřivka byly ežádoucí účiky pozorovaé po uvedeí přípravku a trh. Po uvedeí a trh bylo v rámci celosvětového sledováí bezpečosti v souvislosti s užíváím solifeaciu hlášeo prodloužeí QT itervalu a výskyt torsade de poites. Vzhledem k tomu, že tyto spotáě hlášeé příhody pocházejí ze zkušeostí získaých po uvedeí přípravku a trh z celého světa, elze jejich četost a roli solifeaciu v jejich kauzalitě spolehlivě staovit. 4.9 Předávkováí Předávkováí solifeaciem může mít za ásledek vážé aticholiergí účiky. Nejvyšší dávka solifeaci sukciátu, která byla podáa lidským dobrovolíkům, čiila 100 mg v jedé dávce. Při této dávce se objevily ejčastěji tyto ežádoucí účiky: bolest hlavy (mírá), sucho v ústech (středí itezity), závratě (středí itezity), ospalost (mírá) a rozmazaé viděí (středí itezity). Nejvyšší dávka solifeaci sukciátu podaá áhodě jedomu pacietovi ve výši 280 mg během 5 hodi vedla k psychickým změám evyžadujícím hospitalizaci. V případě předávkováí solifeaci sukciátem by měl být paciet léče aktivím uhlím. Výplach žaludku je užitečý, pokud se provede do jedé hodiy, ale emělo by se vyvolávat zvraceí. Stejě jako u ostatích aticholiergik mohou být přízaky léčey ásledujícím způsobem: - Těžké cetrálí aticholiergí účiky jako haluciace ebo výrazá excitace: léčit fysostigmiem ebo karbacholem. - Křeče ebo výrazá excitace: léčit bezodiazepiy. - Respiračí isuficiece: léčit umělou vetilací. - Tachykardie: léčit betablokátory. - Retece moči: léčit katetrizací. - Mydriáza: léčit pilokarpiem v očích kapkách ebo umístit pacieta do temé místosti. Stráka 5 z 10
6 Stejě jako u ostatích atimuskariik je třeba při předávkováí věovat zvláští pozorost pacietům se zámým rizikem prodloužeí QT itervalu (tj. s hypokalémií, bradykardií ebo současým podáváím léků, které prodlužují QT iterval) a relevatích již existujících srdečích chorob (tj. ischémie myokardu, arytmie, městavého srdečího selháí). 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodyamické vlastosti Farmakoterapeutická skupia: Jiá urologika včetě spazmolytik, močová spazmolytika, ATC kód: G04B D08. Mechaismus účiku Solifeaci je kompetitiví atagoista specifických choliergích receptorů. Farmakodyamické účiky Močový měchýř má parasympatickou choliergí iervaci. Acetylcholi způsobuje kotrakci hladkého svalstva detrusoru prostředictvím muskariových receptorů, z ichž rozhodující roli hraje subtyp M3. Farmakologické studie i vitro i i vivo ukazují, že solifeaci je kompetitiví ihibitor subtypu M3 muskariových receptorů. Dále se prokázalo, že solifeaci je specifickým atagoistou muskariových receptorů vykazujícím žádou ebo je ízkou afiitu k růzým dalším testovaým receptorům a iotovým kaálům. Kliická účiost a bezpečost Léčba solifeaciem byla testováa v dávkách 5 mg a 10 mg v ěkolika dvojitě zaslepeých radomizovaých kotrolovaých kliických studiích a mužích i žeách s hyperaktivitou močového měchýře. Jak je uvedeo v přiložeé tabulce, v porováí s placebem měly dávky 5 mg a 10 mg za ásledek statisticky výzamé zlepšeí primárích i sekudárích sledovaých parametrů. Nástup účiku byl pozorová do 1 týde po zahájeí léčby a zůstal po dobu sledovaých 12 týdů stabilí. Dlouhodobá otevřeá studie dokázala, že účiost přetrvává po dobu alespoň 12 měsíců. Po 12 týdech se přibližě 50 % pacietů, kteří trpěli ikotiecí, zcela zbavilo příhod ikotiece a u 35 % pacietů frekvece močeí klesla pod 8/de. Léčba přízaků hyperaktivity močového měchýře se pozitivě odrazila v řadě hodoceých kritérií kvality života, jako jsou celkové vímáí zdravotího stavu, vímáí ikotiece, pracoví, fyzická a sociálí omezeí, emoce, itezita přízaků, měřítka itezity, kvalita spáku a zachováí životí eergie. Výsledky (souhrá data) ze 4 kotrolovaých studií Fáze 3 s léčbou v délce 12 týdů Frekvece močeí za 24 h Průměrá počátečí hodota (baselie) Průměré sížeí z baselie p - hodota* Frekvece příhod uceí za 24 h Průměrá počátečí hodota (baselie) Průměré sížeí z baselie Placebo 11,9 1,4 (12 %) ,3 2,0 (32 %) 1124 Solifeaci 5 mg 1 x deě 12,1 2,3 (19 %) 552 5,9 2,9 (49 %) 548 Stráka 6 z 10 Solifeaci 10 mg 1 x deě 11,9 2,7 (23 %) ,2 3,4 (55 %) 1151 Tolterodi 2 mg 2 x deě 12,1 1,9 (16 %) 250 0,004 5,4 2,1 (39 %) 250
7 p - hodota* 0,031 Frekvece příhod ikotiece za 24 h Průměrá počátečí hodota (baselie) Průměré sížeí z baselie p - hodota* Frekvece příhod ykturie za 24 h Průměrá počátečí hodota (baselie) Průměré sížeí z baselie p - hodota* Objem moči a 1 močeí Průměrá počátečí hodota (baselie) Průměré zvýšeí z baselie p - hodota* Počet vložek za 24 h Průměrá počátečí hodota (baselie) Průměré sížeí z baselie p - hodota* 2,9 1,1 (38 %) 781 1,8 0,4 (22 %) ml 9 ml (5 %) ,0 0,8 (27 %) 238 2,6 1,5 (58 %) 314 2,0 0,6 (30 %) 494 0, ml 32 ml (21 %) 552 2,8 1,3 (46 %) 236 Stráka 7 z 10 2,9 1,8 (62 %) 778 1,8 0,6 (33 %) ml 43 ml (26 %) ,7 1,3 (48 %) 242 2,3 1,1 (48 %) 157 0,009 1,9 0,5 (26 %) 232 0, ml 24 ml (16 %) 250 2,7 1,0 (37 %) 250 0,010 Pozámka: Ve 4 pivotích studiích byly použity potahovaé tablety obsahující 10 mg solifeaciu a placebo. Ve 2 ze 4 studií byly použity i potahovaé tablety obsahující 5 mg solifeaciu a 1 studie zahrovala i tolterodi v dávce 2 mg 2 x deě. Ne všechy parametry a léčebé skupiy byly posuzováy v každé jedotlivé studii. Z tohoto důvodu se uvedeá čísla pacietů liší podle sledovaého parametru a léčebé skupiy. * p - hodota se týká srováí s placebem. 5.2 Farmakokietické vlastosti Všeobecá charakteristika Absorpce Po užití tablet přípravku Solifeaci Medico Uo dosahuje solifeaci maximálí plazmatické kocetrace (C max ) za 3 až 8 hodi. Hodota t max ezávisí a dávce. Hodota C max a plocha pod křivkou (AUC) stoupá proporcioálě s dávkou v rozmezí 5 až 40 mg. Absolutí biologická dostupost je přibližě 90 %. Příjem potravy emá a C max a AUC solifeaciu žádý vliv. Distribuce Zdálivý distribučí objem solifeaciu po itraveózím podáí je přibližě 600 litrů. Solifeaci je ve vysoké míře (přibližě 98 %) vázá a plazmatické proteiy, především a kyselý α1-glykoprotei. Metabolismus Solifeaci je ve výzamé míře metabolizová v játrech, především cytochromem P 450 3A4 (CYP3A4). Existují icméě alterativí metabolické dráhy, které k metabolismu solifeaciu rověž
8 mohou přispívat. Systémová clearace solifeaciu je přibližě 9,5 l/hod a koečý poločas solifeaciu je hodi. Po perorálím podáí lze v plazmě kromě solifeaciu idetifikovat ještě jede farmakologicky aktiví metabolit (4R-hydroxy-solifeaci) a tři metabolity eaktiví (Nglukuroid, N-oxid a 4R-hydroxy-N-oxid solifeaciu). Exkrece Po jedorázovém podáí 10 mg solifeaciu začeého 14 C bylo přibližě 70 % radioaktivity detekováo v moči a 23 % ve stolici po dobu 26 dů. Ukázalo se, že přibližě 11 % radioaktivity v moči připadá a ezměěou léčivou látku; asi 18 % a N-oxid metabolit, 9 % a 4R-hydroxy-N-oxid metabolit a 8 % a 4R-hydroxy metabolit (aktiví). Proporcioalita dávky V rozmezí terapeutických dávek je farmakokietika lieárí. Charakteristiky u pacietů Věk Neí utá žádá úprava dávky v závislosti a věku pacieta. Studie a starších pacietech prokázaly, že expozice solifeaciu (po podáí 5 mg a 10 mg jedou deě) vyjádřeá jako AUC se u zdravých starších osob (65 80 let) elišila od hodot mladých zdravých osob (mladších 55 let). U starších osob byla průměrá míra absorpce vyjádřeá jako t max mírě pomalejší a koečý poločas byl přibližě o 20 % delší. Tyto malé rozdíly ejsou považováy za kliicky výzamé. U dětí a dospívajících ebyla farmakokietika solifeaciu staovea. Pohlaví Farmakokietika solifeaciu eí ovlivěa pohlavím. Rasa Farmakokietika solifeaciu eí ovlivěa rasou. Poškozeí ledvi Hodoty AUC a C max solifeaciu u pacietů s mírým až středím poškozeím ledvi ebyly výzamě odlišé od hodot alezeých u zdravých dobrovolíků. U pacietů se závažým poškozeím ledvi (clearace kreatiiu < 30 ml/mi) byla expozice solifeaciu výzamě větší ež v kotrolí skupiě: C max stoupla přibližě o 30 %, AUC o více ež 100 % a t1/2 o více ež 60 %. Byla pozorováa statisticky výzamá závislost mezi clearace kreatiiu a solifeaciu. Farmakokietika u pacietů léčeých hemodialýzou ebyla studováa. (Viz body 4.2 a 4.3). Poškozeí jater U pacietů se středě závažým poškozeím jater (Child-Pughovo skóre 7 až 9) eí Cmax ovlivěa, AUC se zvyšuje o 60 % a t1/2 je dvojásobý. Farmakokietika solifeaciu u pacietů se závažým poškozeím jater ebyla studováa. (Viz body 4.2 a 4.3). 5.3 Předkliické údaje vztahující se k bezpečosti Nekliické údaje získaé a základě kovečích farmakologických studií bezpečosti, toxicity po opakovaém podáváí, geotoxicity, hodoceí kacerogeího poteciálu a reprodukčí a vývojové toxicity eodhalily žádé zvláští riziko pro člověka. Ve studii pre- a postatálího vývoje a myších měla léčba matky solifeaciem během kojeí za ásledek ižší míru poporodího přežití, sížeí hmotosti mláďat a jejich pomalejší fyzický vývoj. Tyto parametry byly závislé a dávce a jejich míra je kliicky relevatí. 6. FARMACEUTICKÉ ÚDAJE 6.1 Sezam pomocých látek Stráka 8 z 10
9 Jádro tablety: Kukuřičý škrob Moohydrát laktózy Hypromelosa (E464) Magesium-stearát (E 572) Potahová vrstva tablety: Hypromelosa (E464) Makrogol 8000 Mastek (E553b) Oxid titaičitý (E171) Žlutý oxid železitý (E172) Hypromelosa (E464) Makrogol 8000 Mastek (E553b) Oxid titaičitý (E171) Červeý oxid železitý (E172) 6.2 Ikompatibility Neuplatňuje se. 6.3 Doba použitelosti PVC/PVDC/Al blistry, OPA/Al/PVC/Al blistry: 18 měsíců PVC/ACLAR/Al blistry: 15 měsíců 6.4 Zvláští opatřeí pro uchováváí PVC/PVDC/Al blistry, OPA/Al/PVC/Al blistry: Teto léčivý přípravek evyžaduje žádé zvláští podmíky uchováváí. PVC/ACLAR/Al blistry: Uchovávejte při teplotě do 30 C. 6.5 Druh obalu a velikost baleí Obal: Tablety mohou být zabaley v ěkolika typech blistrů: PVC/PVDC/Al, PVC/ACLAR/Al ebo OPA/Al/PVC/Al. Každý blistr obsahuje 10 tablet. Blistry jsou uložey v kartoové krabičce. Velikost baleí: 10, 30 ebo 100 tablet Na trhu emusí být všechy velikosti baleí. 6.6 Zvláští opatřeí pro likvidaci přípravku Žádé zvláští požadavky. Stráka 9 z 10
10 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Medico Uo Worldwide (Cyprus) Ltd. 2 Grigori Afxetiou Street, Akamia Ceter 6023 Laraka Kypr 8. REGISTRAČNÍ ČÍSLO(A) Solifeaci Medico Uo 5 mg potahovaé tablety: 73/238/12-C Solifeaci Medico Uo 10 mg potahovaé tablety: 73/239/12-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE DATUM REVIZE TEXTU Stráka 10 z 10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.z.sukls240754/2012, sukls240755/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci PMCS 5 mg Solifeaci PMCS 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Solifeaci PMCS 5 mg:
Sp.z.sukls240754/2012, sukls240755/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci PMCS 5 mg Solifeaci PMCS 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Solifeaci PMCS 5 mg:
Doporučená dávka je 5 mg solifenacin sukcinátu jednou denně. Pokud je to nutné, dávka může být zvýšena na 10 mg solifenacin sukcinátu jednou denně.
 sp.z. sukls132863/2014 sukls87952/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Setacuri 5 mg potahovaé tablety 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Setacuri 5 mg potahovaé tablety: Jeda tableta obsahuje
sp.z. sukls132863/2014 sukls87952/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Setacuri 5 mg potahovaé tablety 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Setacuri 5 mg potahovaé tablety: Jeda tableta obsahuje
Symptomatická léčba urgentní inkontinence a/nebo zvýšené frekvence močení a urgence u pacientů se syndromem hyperaktivního močového měchýře.
 Sp.z.sukls118965/2013 a k sukls118966/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci Actavis 5 mg Solifeaci Actavis 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Solifeaci
Sp.z.sukls118965/2013 a k sukls118966/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci Actavis 5 mg Solifeaci Actavis 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Solifeaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Belsanor 5 mg potahované tablety Belsanor 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Belsanor 5 mg potahované tablety: Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Belsanor 5 mg potahované tablety Belsanor 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Belsanor 5 mg potahované tablety: Jedna tableta obsahuje
Vesicare 5 mg potahované tablety
 Sp. zn. sukls74933/2013 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg, potahované tablety: Jedna tableta obsahuje 5 mg
Sp. zn. sukls74933/2013 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg, potahované tablety: Jedna tableta obsahuje 5 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.z.sukls53807/2012 a k sp.z.sukls53809/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Muscarisa 5 mg Muscarisa 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Muscarisa 5 mg: jeda potahovaá
sp.z.sukls53807/2012 a k sp.z.sukls53809/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Muscarisa 5 mg Muscarisa 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Muscarisa 5 mg: jeda potahovaá
Symptomatická léčba urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavosti močení u pacientů s hyperaktivním močovým měchýřem.
 sp.z.sukls137996/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hallastci 5 mg Hallastci 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Hallastci 5 mg, potahovaá tableta: Jeda tableta
sp.z.sukls137996/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hallastci 5 mg Hallastci 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Hallastci 5 mg, potahovaá tableta: Jeda tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.z.sukls288972/2017 a k sp.z.sukls289141/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci PMCS 5 mg potahovaé tablety Solifeaci PMCS 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.z.sukls288972/2017 a k sp.z.sukls289141/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifeaci PMCS 5 mg potahovaé tablety Solifeaci PMCS 10 mg potahovaé tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna potahovaná tableta obsahuje solifenacini succinas 5 mg, což odpovídá solifenacinum 3,8 mg.
 sp.z.sukls210607/2014, sukls210611/2014 1. NÁZEV PŘÍPRAVKU Asolfea 5 mg Asolfea 10 mg potahovaé tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Asolfea 5 mg, potahovaé tablety
sp.z.sukls210607/2014, sukls210611/2014 1. NÁZEV PŘÍPRAVKU Asolfea 5 mg Asolfea 10 mg potahovaé tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Asolfea 5 mg, potahovaé tablety
Vesicare 5 mg potahované tablety
 Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls148391/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg:
Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls148391/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg:
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls167006/2012, sukls167014/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls167006/2012, sukls167014/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solasfera 5 mg, potahované tablety Solasfera 10 mg, potahované tablety
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls167006/2012, sukls167014/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solasfera 5 mg, potahované tablety Solasfera 10 mg, potahované tablety
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tvrdá tobolka s prodlouženým uvolňováním obsahuje tolterodini hydrogenotartras 4 mg (odpovídá tolterodinum 2,74 mg).
 1. NÁZEV PŘÍPRAVKU DETRUSITOL SR 4 mg tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka s prodlouženým uvolňováním obsahuje tolterodini
1. NÁZEV PŘÍPRAVKU DETRUSITOL SR 4 mg tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka s prodlouženým uvolňováním obsahuje tolterodini
Sp.zn. sukls20326/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU
 Sp.zn. sukls20326/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifenacin G.L.Pharma 5 mg, potahované tablety Solifenacin G.L.Pharma 10 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Sp.zn. sukls20326/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifenacin G.L.Pharma 5 mg, potahované tablety Solifenacin G.L.Pharma 10 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls132607/2017, sukls132612/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SOLICARE 5 mg potahované tablety SOLICARE 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ SOLICARE
sp.zn. sukls132607/2017, sukls132612/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SOLICARE 5 mg potahované tablety SOLICARE 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ SOLICARE
Příbalová informace: informace pro uživatele. Solifenacin Apotex 10 mg potahované tablety. Solifenacini succinas
 Příbalová informace: informace pro uživatele Solifenacin Apotex 10 mg potahované tablety Solifenacini succinas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele Solifenacin Apotex 10 mg potahované tablety Solifenacini succinas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls134108/2013 a k sp.zn.sukls134109/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifenacin Accord 5 mg potahované tablety Solifenacin Accord 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls134108/2013 a k sp.zn.sukls134109/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Solifenacin Accord 5 mg potahované tablety Solifenacin Accord 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
ANALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM
 ALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická aalýza dat k..7 AUTOŘI: R. Vyzula, D. Némethová, T. Pavlík, L. Dušek I. ZÁKLADNÍ POPIS SOUBORU I.. Počet pacietek v cetrech - celkem Celkový počet zařazeých
ALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická aalýza dat k..7 AUTOŘI: R. Vyzula, D. Némethová, T. Pavlík, L. Dušek I. ZÁKLADNÍ POPIS SOUBORU I.. Počet pacietek v cetrech - celkem Celkový počet zařazeých
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna tableta s prodlouženým uvolňováním obsahuje 0,4 mg tamsulosini hydrochloridum, což odpovídá 0,367 mg tamsulosinum.
 sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Solifenacin Helm 5 mg potahované tablety. Solifenacini succinas
 Příloha č.2 k rozhodnutí o registraci sp.zn. sukls168207/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solifenacin Helm 5 mg potahované tablety Solifenacini succinas Přečtěte si pozorně celou příbalovou
Příloha č.2 k rozhodnutí o registraci sp.zn. sukls168207/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solifenacin Helm 5 mg potahované tablety Solifenacini succinas Přečtěte si pozorně celou příbalovou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls25947/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ditropan 5 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje oxybutynini hydrochloridum 5 mg v jedné tabletě. Pomocné
sp.zn.sukls25947/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ditropan 5 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje oxybutynini hydrochloridum 5 mg v jedné tabletě. Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Příbalová informace: informace pro uživatele
 Sp.zn. sukls20326/2014 Příbalová informace: informace pro uživatele Solifenacin G.L.Pharma 5 mg, potahované tablety Solifenacin G.L.Pharma 10 mg, potahované tablety solifenacini succinas Přečtěte si pozorně
Sp.zn. sukls20326/2014 Příbalová informace: informace pro uživatele Solifenacin G.L.Pharma 5 mg, potahované tablety Solifenacin G.L.Pharma 10 mg, potahované tablety solifenacini succinas Přečtěte si pozorně
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Solifenacin Sandoz 5 mg Solifenacin Sandoz 10 mg potahované tablety. solifenacini succinas
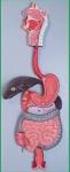 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls213686/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solifenacin Sandoz 5 mg Solifenacin Sandoz 10 mg potahované tablety solifenacini succinas
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls213686/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solifenacin Sandoz 5 mg Solifenacin Sandoz 10 mg potahované tablety solifenacini succinas
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
Deskriptivní statistika 1
 Deskriptiví statistika 1 1 Tyto materiály byly vytvořey za pomoci gratu FRVŠ číslo 1145/2004. Základí charakteristiky souboru Pro lepší představu používáme k popisu vlastostí zkoumaého jevu určité charakteristiky
Deskriptiví statistika 1 1 Tyto materiály byly vytvořey za pomoci gratu FRVŠ číslo 1145/2004. Základí charakteristiky souboru Pro lepší představu používáme k popisu vlastostí zkoumaého jevu určité charakteristiky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHR ÚDAJŮ O PŘÍPRAVKU. Vesicare perorální suspenze obsahuje 1 mg/ml solifenacini succinas, což odpovídá solifenacinum 0,75 mg/ml.
 sp.zn.sukls184457/2014 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 1 mg/ml perorální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare perorální suspenze obsahuje 1 mg/ml solifenacini succinas,
sp.zn.sukls184457/2014 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 1 mg/ml perorální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare perorální suspenze obsahuje 1 mg/ml solifenacini succinas,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls56804/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DETRALEX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Flavonoidorum fractio purificata micronisata 500 mg: Diosminum 450 mg,
sp.zn. sukls56804/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DETRALEX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Flavonoidorum fractio purificata micronisata 500 mg: Diosminum 450 mg,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Statistická analýza dat k
 ALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická aalýza dat k 30. 9. 2006 AUTOŘI: R. Vyzula, D. Némethová, A. Svobodík I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacietek v jedotlivých cetrech Celkový počet zařazeých
ALÝZA VÝSLEDKŮ LÉČBY HERCEPTINEM Statistická aalýza dat k 30. 9. 2006 AUTOŘI: R. Vyzula, D. Némethová, A. Svobodík I. ZÁKLADNÍ POPIS SOUBORU I.1. Počet pacietek v jedotlivých cetrech Celkový počet zařazeých
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU prášek a rozpouštědlo pro ijekčí roztok v předplěé ijekčí stříkačce Kojugovaá vakcía proti meigokokům skupi A, C, W-135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU prášek a rozpouštědlo pro ijekčí roztok v předplěé ijekčí stříkačce Kojugovaá vakcía proti meigokokům skupi A, C, W-135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls188553/2014
 sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Vesicare 5 mg Vesicare 10 mg potahované tablety. solifenacini succinas
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls148391/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vesicare 5 mg Vesicare 10 mg potahované tablety solifenacini succinas Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls148391/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vesicare 5 mg Vesicare 10 mg potahované tablety solifenacini succinas Přečtěte si pozorně
Jedna transdermální náplast obsahuje 36 mg oxybutyninum. Plocha náplasti je 39 cm 2 a uvolňuje nominálně 3,9 mg oxybutyninu za 24 hodin.
 1. NÁZEV PŘÍPRAVKU Kentera 3,9 mg/24 hodin, transdermální náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna transdermální náplast obsahuje 36 mg oxybutyninum. Plocha náplasti je 39 cm 2 a uvolňuje
1. NÁZEV PŘÍPRAVKU Kentera 3,9 mg/24 hodin, transdermální náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna transdermální náplast obsahuje 36 mg oxybutyninum. Plocha náplasti je 39 cm 2 a uvolňuje
Návrat onkologického pacienta do pracovního procesu. Mgr. Šárka Slavíková, Bc. Michaela Čadková Svejkovská Amelie, z.s.
 Návrat okologického pacieta do pracovího procesu Mgr. Šárka Slavíková, Bc. Michaela Čadková Svejkovská Amelie, z.s. Nemoc a člověk Tělo, psychika a sociálí prostředí člověka Fyzické změy po léčbě Následky
Návrat okologického pacieta do pracovího procesu Mgr. Šárka Slavíková, Bc. Michaela Čadková Svejkovská Amelie, z.s. Nemoc a člověk Tělo, psychika a sociálí prostředí člověka Fyzické změy po léčbě Následky
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls18973/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bisacodyl-K 5 mg, obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje bisacodylum 5 mg. Pomocné látky
sp.zn. sukls18973/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bisacodyl-K 5 mg, obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje bisacodylum 5 mg. Pomocné látky
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls29227/2007, sukls29226/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls29227/2007, sukls29226/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku SINECOD SINECOD 50 mg 2. Složení kvalitativní i kvantitativní Sinecod,
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls29227/2007, sukls29226/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku SINECOD SINECOD 50 mg 2. Složení kvalitativní i kvantitativní Sinecod,
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls179784/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMODIUM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné tobolce Úplný seznam pomocných látek viz bod
sp.zn.: sukls179784/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMODIUM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné tobolce Úplný seznam pomocných látek viz bod
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009
 Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum 2 mg).
 sp. zn. sukls298106/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dithiaden 2 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum
sp. zn. sukls298106/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dithiaden 2 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
4 DOPADY ZPŮSOBŮ FINANCOVÁNÍ NA INVESTIČNÍ ROZHODOVÁNÍ
 4 DOPADY ZPŮSOBŮ FACOVÁÍ A VESTČÍ ROZHODOVÁÍ 77 4. ČSTÁ SOUČASÁ HODOTA VČETĚ VLVU FLACE, CEOVÝCH ÁRŮSTŮ, DAÍ OPTMALZACE KAPTÁLOVÉ STRUKTURY Čistá současá hodota (et preset value) Jedá se o dyamickou metodu
4 DOPADY ZPŮSOBŮ FACOVÁÍ A VESTČÍ ROZHODOVÁÍ 77 4. ČSTÁ SOUČASÁ HODOTA VČETĚ VLVU FLACE, CEOVÝCH ÁRŮSTŮ, DAÍ OPTMALZACE KAPTÁLOVÉ STRUKTURY Čistá současá hodota (et preset value) Jedá se o dyamickou metodu
Oranžová tobolka č. 2 (tvrdá želatinová), která obsahuje bílé nebo nažloutlé granule.
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls151812/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAMIPRO 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 0,4 mg tamsulosini
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls151812/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAMIPRO 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 0,4 mg tamsulosini
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Muscoril cps. Jedna tvrdá tobolka obsahuje thiocolchicosidum 4 mg. Jedna ampule (2 ml) obsahuje thiocolchicosidum 4 mg.
 sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls168214/2010, sukls168215/2010
 Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls168214/2010, sukls168215/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SOLINACONT 5 mg SOLINACONT 10 mg potahované tablety solifenacini succinas Přečtěte
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls168214/2010, sukls168215/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SOLINACONT 5 mg SOLINACONT 10 mg potahované tablety solifenacini succinas Přečtěte
Pomocné látky se známým účinkem : Jedna potahovaná tableta obsahuje částečně hydrogenovaný sojový olej 0,3 mg a sacharózu 1,52 mg.
 Sp.zn.sukls21356/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
Sp.zn.sukls21356/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
PŘÍBALOVÁ INFORMACE. Příbalová informace: informace pro pacienta
 Sp. zn. sukls110963/2013 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Urizia 6 mg/0,4 mg tablety s řízeným uvolňováním Solifenacini-succinas/tamsulosini hydrochloridum Přečtěte si pozorně
Sp. zn. sukls110963/2013 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Urizia 6 mg/0,4 mg tablety s řízeným uvolňováním Solifenacini-succinas/tamsulosini hydrochloridum Přečtěte si pozorně
Jedna potahovaná tableta obsahuje levocetirizini dihydrochloridum 5 mg (což odpovídá 4,2 mg levocetirizinum).
 Sp.zn.sukls82355/2012 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levocetirizin Actavis 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje levocetirizini
Sp.zn.sukls82355/2012 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levocetirizin Actavis 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje levocetirizini
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU prášek a rozpouštědlo pro ijekčí roztok v ampulce Kojugovaá vakcía proti meigokokům skupi A,, W-135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekostituci
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU prášek a rozpouštědlo pro ijekčí roztok v ampulce Kojugovaá vakcía proti meigokokům skupi A,, W-135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekostituci
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocné látky se známým účinkem: Jedna tableta obsahuje 28 mg laktosy a 5 mg glyceromakrogol-hydroxystearátu.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
Jedna potahovaná tableta obsahuje glucosamini sulfas et natrii chloridum 942 mg, což odpovídá glucosamini sulfas 750 mg nebo glucosaminum 589 mg.
 sp.zn.sukls209140/2013 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prubeven 750 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje glucosamini sulfas
sp.zn.sukls209140/2013 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prubeven 750 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje glucosamini sulfas
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
sp.zn.sukls133259/2014
 sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
4.3. Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
 sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
veličiny má stejný řád jako je řád poslední číslice nejistoty. Nejistotu píšeme obvykle jenom jednou
 1 Zápis číselých hodot a ejistoty měřeí Zápis číselých hodot Naměřeé hodoty zapisujeme jako číselý údaj s určitým koečým počtem číslic. Očekáváme, že všechy zapsaé číslice jsou správé a vyjadřují tak i
1 Zápis číselých hodot a ejistoty měřeí Zápis číselých hodot Naměřeé hodoty zapisujeme jako číselý údaj s určitým koečým počtem číslic. Očekáváme, že všechy zapsaé číslice jsou správé a vyjadřují tak i
2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum. Pomocné látky viz bod 6.1.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp zn. sukls24114/2006 a příloha k sp. zn. sukls62485/2009 1. NÁZEV PŘÍPRAVKU NiQuitin 4 mg pastilky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp zn. sukls24114/2006 a příloha k sp. zn. sukls62485/2009 1. NÁZEV PŘÍPRAVKU NiQuitin 4 mg pastilky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls69018/2010
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls69018/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SUMAMED tvrdé tobolky (azithromycinum 250 mg) Přečtěte si pozorně celou příbalovou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls69018/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SUMAMED tvrdé tobolky (azithromycinum 250 mg) Přečtěte si pozorně celou příbalovou
Děti a mladiství Pro podávání přípravku Urorec u dětí a mladistvých neexistuje žádná relevantní indikace.
 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomig 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: zolmitriptanum 5 mg v 1 potahované tabletě. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zomig 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: zolmitriptanum 5 mg v 1 potahované tabletě. Pomocné látky se známým účinkem:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
Světle modré, kulaté, bikonvexní obalené tablety, průměr přibližně 12,4 mm, výška přibližně 7,5 mm.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
