PŘÍLOHA I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI
|
|
|
- Emil Kříž
- před 5 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY V REGISTRACI 1
2 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) mofetil-mykofenolátu, kyseliny mykofenolové dospěl výbor CHMP k těmto vědeckým závěrům: Po přezkoumání všech dostupných informací o těhotenství po expozici otce mofetil-mykofenolátem nebo kyselinou mykofenolovou, včetně přezkoumání všech neklinických údajů a informací o přenosu kyseliny mykofenolové prostřednictvím spermatu, dospěl výbor PRAC k závěru, že údaje nevykazují žádný obraz nebo nárůst výskytu vrozených malformací nebo spontánních potratů. Výbor PRAC proto doporučil upravit informace o přípravku prostřednictvím aktualizace informací o teratogenních účincích a těhotenství a doporučení antikoncepce u mužů. Další změny byly provedeny z důvodu potřeby upřesnění požadavků týkajících se používání antikoncepce u žen a těhotenských testů. Výbor CHMP souhlasí s vědeckými závěry výboru PRAC. Zdůvodnění změny v registraci Na základě vědeckých závěrů týkajících se mofetil-mykofenolátu výbor CHMP zastává stanovisko, že poměr přínosů a rizik léčivého přípravku obsahujícího mofetil-mykofenolát, kyselinu mykofenolovou zůstává nezměněný, a to pod podmínkou, že v informacích o přípravku budou provedeny navrhované změny. 2
3 PŘÍLOHA II ZMĚNY V INFORMACÍCH O PŘÍPRAVKU PRO LÉČIVÝ PŘÍPRAVEK REGISTROVANÝ / LÉČIVÉ PŘÍPRAVKY REGISTROVANÉ NA VNITROSTÁTNÍ ÚROVNI 3
4 Změny, které mají být vloženy do příslušných bodů informací o přípravku (nový text a tučně, vymazaný text přeškrtnutý) Souhrn údajů o přípravku Bod 4.4 Upozornění má být upraveno následovně: Teratogenní účinky Mykofenolát je silný lidský teratogen. Spontánní potraty (četnost 45 % až 49 %) a vrozené malformace (odhadovaná četnost 23 % až -27 %) byly hlášeny následně po expozici MMF v průběhu těhotenství. Z tohoto důvodu je přípravek <smyšlený název> kontraindikován během těhotenství s výjimkou případů, kdy není k dispozici jiná alternativní léčba k prevenci rejekce transplantovaného orgánu. Pacientky a pacienti ve reprodukčním fertilním věku musí být upozorněni upozorněny na rizika před, v průběhu a po ukončení léčby přípravkem <smyšlený název> a musí být poučeni poučeny o doporučeních uvedených v bodě 4.6 (např. metody antikoncepce, těhotenský test). Lékaři se musí ujistit o tom, že ženy i muži užívající mofetil-mykofenolát rozumí rizikům poškození dítěte, nutnosti účinné antikoncepce a nutnosti informovat okamžitě lékaře, pokud je zde riziko otěhotnění. Antikoncepce (viz bod 4.6) Vzhledem k silným klinickým důkazům o vysokém riziku potratů a vrozených vad je třeba zabránit těhotenství během léčby. možné genotoxicitě a teratogenitě přípravku <smyšlený název> musí žženy ve fertilním věku tak musí před zahájením léčby přípravkem <smyšlený název>, v průběhu léčby a po dobu šesti týdnů po ukončení léčby používat dvě alespoň jednu spolehlivé spolehlivou formy formu antikoncepce (viz bod 4.3)současně; pokud abstinence není zvolena jako metoda antikoncepce (viz bod 4.5). Dvě spolehlivé formy antikoncepce současně jsou upřednostňovány, aby byla minimalizována možnost selhání antikoncepce a neúmyslného těhotenství. U sexuálně aktivních mužů se doporučuje používat kondomy v průběhu léčby a po dobu nejméně 90 dní po ukončení léčby. Použití kondomu platí jak pro muže schopné reprodukce, tak i pro muže s vazektomií, protože rizika spojená s přenosem semenné tekutiny se vztahují také na muže, kteří podstoupili vazektomii. Kromě toho u žen, partnerek pacientů mužů, se doporučuje používat vysoce účinnou antikoncepci v průběhu léčby a po dobu celkem 90 dní po poslední dávce přípravku <smyšlený název>. Pokyny ohledně antikoncepce pro muže jsou uvedeny v bodě 4.6. Bod 4.6 Antikoncepce u mužů a žen Přípravek <smyšlený název> je kontraindikován u žen ve fertilním věku, které nepoužívají vysoce účinné metody antikoncepce. Vzhledem k možné genotoxicitě a teratogenitě přípravku <smyšlený název> musí ženy ve fertilním věku před zahájením léčby přípravkem <smyšlený název>, v průběhu léčby a po dobu šesti týdnů po ukončení léčby používat dvě spolehlivé formy antikoncepce současně; pokud abstinence není zvolena jako metoda antikoncepce (viz bod 4.5). U sexuálně aktivních mužů se doporučuje používat kondomy v průběhu léčby a po dobu nejméně 90 dní po ukončení léčby. Použití kondomu platí jak pro muže schopné reprodukce, tak i pro muže s vazektomií, protože rizika spojená s přenosem semenné tekutiny se vztahují také na muže, kteří podstoupili vazektomii. Kromě toho u žen, partnerek pacientů mužů, se doporučuje používat vysoce účinnou antikoncepci v průběhu léčby a po dobu celkem 90 dní po poslední dávce přípravku <smyšlený název>. 4
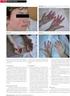
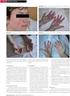
5 Ženy ve fertilním věku Během užívání mykofenolátu je třeba zabránit těhotenství. Ženy ve fertilním věku tak musí před zahájením léčby přípravkem <smyšlený název>, v průběhu léčby a po dobu šesti týdnů po ukončení léčby používat alespoň jednu spolehlivou formu antikoncepce (viz bod 4.3); pokud abstinence není zvolena jako metoda antikoncepce. Dvě spolehlivé formy antikoncepce současně jsou upřednostňovány. Těhotenství Přípravek <smyšlený název> je kontraindikován v průběhu těhotenství s výjimkou případů, kdy není k dispozici jiná alternativní léčba k prevenci rejekce transplantovaného orgánu. Léčba nesmí být zahájena dříve, než bude proveden negativní těhotenský test k vyloučení použití v průběhu těhotenství. Ženy a muži v reprodukčním věku si musí být na začátku léčby vědomy zvýšeného rizika potratu a vrozených malformací a musí být poučeny o prevenci těhotenství a jeho plánování. Před zahájením léčby přípravkem <smyšlený název> musí být u žen ve fertilním věku provedeny dva negativní těhotenský těhotenské testy se sérem nebo močí s citlivostí nejméně 25 miu/ml proveden těhotenský test k vyloučení expozice embrya mykofenolátu. Je doporučeno provést dva těhotenské testy se sérem nebo močí s citlivostí nejméně 25 miu/ml; provést druhý test je třeba provést 8-10 dní po prvním testování a bezprostředně před zahájením léčby mykofenolát mofetilem. U transplantací od zemřelých dárců, pokud není možné před zahájením léčby provést dva testy v rozmezí 8 až 10 dnů (kvůli načasování dostupnosti transplantačních orgánů), musí být bezprostředně před zahájením léčby proveden těhotenský test a další test o 8-10 dní později. Těhotenské testy mají být opakovaně prováděny dle klinické potřeby (např. po jakémkoli ohlášení selhání antikoncepce). Výsledky všech těhotenských testů mají být projednány s pacientkou. Pacientky mají být upozorněny, aby se v případě otěhotnění okamžitě poradily s ošetřujícím lékařem. Mykofenolát je silný lidský teratogen se zvýšeným rizikem výskytu případu spontánních potratů a vrozených malformací v případě expozice během těhotenství: Bylo hlášeno 45 až 49 % spontánních potratů u těhotných žen po expozici mofetil-mykofenolátu ve srovnání s hlášenou četností mezi 12 a 33 % u pacientek po transplantaci orgánu léčených jinými imunosupresivy než je mofetil-mykofenolátu. Dle lékařské literatury byl výskyt malformací u 23 až 27 % živě narozených dětí žen po expozici mofetil-mykofenolátu v těhotenství (ve srovnání s 2 až 3 % živě narozených dětí z celkové populace a přibližně 4 až 5 % u pacientek po transplantaci orgánu léčených jinými imunosupresivy než je mofetil-mykofenolátu). U dětí žen, které byly během těhotenství vystaveny přípravku <smyšlený název> v kombinaci s dalšími imunosupresivy, byly v postmarketingovém sledování zaznamenány kongenitální malformace, včetně hlášení vícečetných malformací. Nejčastěji byly hlášeny následující malformace: Abnormality ucha (např. abnormálně tvarované nebo chybějící vnější/střední ucho), atrézie zevního zvukovodu (střední ucho); Vrozená srdeční vada jako je defekt síňového a komorového septa; Malformace obličeje jako jsou rozštěp rtu, rozštěp patra, mikrognácie a hypertelorismus orbity; Abnormality očí (např. kolobom); Vrozená srdeční vada jako je defekt síňového a komorového septa; Malformace prstů (např. polydaktylie, syndaktylie); Tracheoezofageální malformace (např. atrézie jícnu); Malformace nervového systému jako jsou spina bifida; Renální abnormality. 5
6 Kromě toho byla zaznamenána ojedinělá hlášení následujících malformací: Mikroftalmie; Vrozená cysta plexus chorioideus Ageneze septum pellucidum Ageneze čichového nervu Muži Omezené klinické důkazy nepoukazují na zvýšené riziko vrozených vad nebo potratu po expozici otce mofetil-mykofenolátu. MPA je silný teratogen. Není známo, zda je MPA přítomen ve spermatu. Výpočty na základě informací získaných od zvířat ukazují, že maximální množství MPA, které by mohlo být potenciálně přeneseno na ženu je tak nízké, že je nepravděpodobný jakýkoliv účinek. Ukázalo se, že mykofenolát je ve studiích se zvířaty genotoxický při koncentracích překračujících expozice u lidí během léčby pouze o malé rozpětí, takže riziko genotoxických účinků na spermatické buňky nemůže být zcela vyloučeno. Doporučuje se proto následující opatření: sexuálně aktivní muži nebo jejich partnerky mají během léčby pacienta a po dobu 90 dní po ukončení léčby mofetil-mykofenolátem užívat spolehlivou antikoncepci. Muži v reprodukčním věku mají být informováni kvalifikovaným zdravotnickým pracovníkem o možných rizicích při zplození dítěte. Změny, které mají být vloženy do příslušných bodů příbalové informace (nový text podtržený a tučně, vymazaný text přeškrtnutý) Příbalová informace Těhotenství, antikoncepce a kojení Antikoncepce u žen, které užívají přípravek <smyšlený název> Pokud jste žena, která může otěhotnět, musíte vždy při užívání přípravku <smyšlený název> používat dvě účinné metody účinnou metodu antikoncepce. To znamená: před zahájením léčby přípravkem <smyšlený název> během celé léčby přípravkem <smyšlený název> po dobu 6 týdnů po ukončení léčby přípravkem <smyšlený název>. O nejvhodnější antikoncepci se poraďte se svým lékařem. Bude záležet na Vaší individuální situaci. Dvě spolehlivé formy antikoncepce současně jsou upřednostňovány, aby bylo sníženo riziko neúmyslného těhotenství. Bude záležet na Vaší individuální situaci. Kontaktujte svého lékaře ihned jak je to možné, pokud se domníváte, že došlo k selhání antikoncepce nebo jste si zapomněla vzít antikoncepční pilulku. Jste žena, která není schopna otěhotnět, pokud pro Vás platí některá z následujících skutečností: jste již po menopauze, tzn. je Vám alespoň 50 let a poslední menstruaci jste měla před více než jedním rokem (pokud Vám menstruace skončila, protože jste byla léčena z důvodu nádorového onemocnění, je zde stále možnost, že můžete otěhotnět) byly Vám chirurgicky odstraněny vejcovody a oba vaječníky (oboustranné odnětí vejcovodů a vaječníků) byla Vám chirurgicky odstraněna děloha (hysterektomie) Vaše vaječníky již nefungují (předčasné selhání vaječníků potvrzené gynekologem) narodila jste se s jedním z následujících vzácných stavů, které znemožňují otěhotnění: genotyp XY, Turnerův syndrom nebo vrozené nevyvinutí dělohy jste dítě nebo dospívající dívka, která zatím nemá menstruaci. Antikoncepce u mužů, kteří užívají přípravek <smyšlený název> Dostupné důkazy nenaznačují zvýšené riziko vrozených vad nebo potratů v případě, že otec užívá mykofenolát. Riziko však nemůže být s jistotou vyloučeno. Jako prevence je doporučeno, abyste vy nebo vaše partnerka používali spolehlivou antikoncepci během léčby a 90 dní po ukončení léčby přípravkem <smyšlený název> musíte vždy používat kondomy. 6
7 Pokud plánujete mít dítě, promluvte si s Vaším lékařem o potenciálních rizicích. Pokud plánujete mít dítě, Váš lékař si s Vámi promluví o rizicích a alternativní léčbě, kterou můžete užívat k prevenci odmítnutí Vašeho transplantovaného orgánu. 7
Příloha I Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Příloha II Vědecké závěry 74 Vědecké závěry Dne 7. července 2016 zahájila Velká Británie na základě farmakovigilančních údajů postup podle článku 31 směrnice 2001/83/ES a požádalo výbor PRAC, aby přezkoumal
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se aktualizovaných zpráv o bezpečnosti (PSUR) testosteron-undekanoátu (inekce)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se aktualizovaných zpráv o bezpečnosti (PSUR) testosteron-undekanoátu (inekce)
TOCTINO (ALITRETINOIN)
 EDUKAČNÍ MATERIÁLY TOCTINO (ALITRETINOIN) PROGRAM PREVENCE TĚHOTENSTVÍ POKYNY PRO LÉKAŘE A LÉKÁRNÍKY Pokyny pro lékaře předepisující TOCTINO Prosíme, abyste si tyto pokyny pečlivě přečetli před tím, než
EDUKAČNÍ MATERIÁLY TOCTINO (ALITRETINOIN) PROGRAM PREVENCE TĚHOTENSTVÍ POKYNY PRO LÉKAŘE A LÉKÁRNÍKY Pokyny pro lékaře předepisující TOCTINO Prosíme, abyste si tyto pokyny pečlivě přečetli před tím, než
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Změny příslušných bodů informace o přípravku
 Příloha III Změny příslušných bodů informace o přípravku Poznámka: Tyto změny v příslušných bodech souhrnu údajů a přípravku a příbalové informace jsou výsledkem postupu přezkoumání. Informace o přípravku
Příloha III Změny příslušných bodů informace o přípravku Poznámka: Tyto změny v příslušných bodech souhrnu údajů a přípravku a příbalové informace jsou výsledkem postupu přezkoumání. Informace o přípravku
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky
 Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
EDUKAČNÍ MATERIÁLY. Erivedge (vismodegib) Program prevence početí při léčbě přípravkem Erivedge:
 EDUKAČNÍ MATERIÁLY Erivedge (vismodegib) Program prevence početí při léčbě přípravkem Erivedge: Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Erivedge (vismodegib) Program prevence početí při léčbě přípravkem Erivedge: Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Program prevence těhotenství a expozice plodu Neotigason 10 mg, Neotigason 25 mg tvrdé tobolky acitretinum
 EDUKAČNÍ MATERIÁL Program prevence těhotenství a expozice plodu Neotigason 10 mg, Neotigason 25 mg tvrdé tobolky acitretinum Obsah 1. Úvod k edukačním materiálům 2. Příručka pro lékaře předepisujícího
EDUKAČNÍ MATERIÁL Program prevence těhotenství a expozice plodu Neotigason 10 mg, Neotigason 25 mg tvrdé tobolky acitretinum Obsah 1. Úvod k edukačním materiálům 2. Příručka pro lékaře předepisujícího
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. MYGREF 250 MG tvrdá tobolka. mofetilis mycophenolas
 Sp.zn. sukls82417/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Sp.zn. sukls82417/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas
 sp. zn. sukls6975/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls6975/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ přijetí hlášení společností Roche (den-měsíc-rok): Lokální číslo: AER: OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení:
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ přijetí hlášení společností Roche (den-měsíc-rok): Lokální číslo: AER: OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení:
Volibris 5mg Volibris 10mg. Informace pro zdravotníky
 Volibris 5mg Volibris 10mg Informace pro zdravotníky Obsah Úvod 1 Edukační materiály pro pacienty 1 Důležité informace o rizikových faktorech 2 Teratogenita 2 Ženy, které mohou otěhotnět 2 Pokud žena otěhotní
Volibris 5mg Volibris 10mg Informace pro zdravotníky Obsah Úvod 1 Edukační materiály pro pacienty 1 Důležité informace o rizikových faktorech 2 Teratogenita 2 Ženy, které mohou otěhotnět 2 Pokud žena otěhotní
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
PREKLINIKA V KH. MUDr. Lucie Kraváčková Oddělení klinického hodnocení STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 PREKLINIKA V KH MUDr. Lucie Kraváčková Oddělení klinického hodnocení 2 Požadavky na prekliniku dle Guideline ICH Topic M3 (R2) (June 2009) 3 R proti předchozí - reduce, refine, replace Studie farmakologie
1 PREKLINIKA V KH MUDr. Lucie Kraváčková Oddělení klinického hodnocení 2 Požadavky na prekliniku dle Guideline ICH Topic M3 (R2) (June 2009) 3 R proti předchozí - reduce, refine, replace Studie farmakologie
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
Příloha III. Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace 26 Stávající informace o přípravcích se mění (vložení, náhrada nebo zrušení textu podle potřeby) tak, aby odpovídaly
Příloha III Úpravy příslušných bodů souhrnu údajů o přípravku a příbalové informace 26 Stávající informace o přípravcích se mění (vložení, náhrada nebo zrušení textu podle potřeby) tak, aby odpovídaly
Informace ze zdravotnictví Moravskoslezského kraje
 Informace ze zdravotnictví Moravskoslezského kraje Ústavu zdravotnických informací a statistiky České republiky Ostrava 8 21.8.2003 Vrozené vady v Moravskoslezském kraji v roce 2002 Národní registr vrozených
Informace ze zdravotnictví Moravskoslezského kraje Ústavu zdravotnických informací a statistiky České republiky Ostrava 8 21.8.2003 Vrozené vady v Moravskoslezském kraji v roce 2002 Národní registr vrozených
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příloha č. 1b k rozhodnutí o změně registrace sp. zn. sukls266536/2011 a příloha k sp. zn. sukls65540/2011
 Příloha č. 1b k rozhodnutí o změně registrace sp. zn. sukls266536/2011 a příloha k sp. zn. sukls65540/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MYCOPHENOLATE MOFETIL Apotex 500 mg tablety (Mofetilis
Příloha č. 1b k rozhodnutí o změně registrace sp. zn. sukls266536/2011 a příloha k sp. zn. sukls65540/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MYCOPHENOLATE MOFETIL Apotex 500 mg tablety (Mofetilis
Informační brožura. pro pacientky a pacienty užívající perorální izotretinoin
 Informační brožura pro pacientky a pacienty užívající perorální izotretinoin Informace pro ženy a muže užívající perorální izotretinoin Dokument slouží k minimalizaci rizika při užívání perorálního izotretinoinu.
Informační brožura pro pacientky a pacienty užívající perorální izotretinoin Informace pro ženy a muže užívající perorální izotretinoin Dokument slouží k minimalizaci rizika při užívání perorálního izotretinoinu.
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pro pacienty. Imnovid (pomalidomid) Brožura pro pacienty.
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pro pacienty Imnovid (pomalidomid) Brožura pro pacienty Celgene Strana 1 z 24 Tento přípravek podléhá dalšímu sledování. To umožní
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pro pacienty Imnovid (pomalidomid) Brožura pro pacienty Celgene Strana 1 z 24 Tento přípravek podléhá dalšímu sledování. To umožní
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Mycophenolat mofetil Sandoz 500 mg. Mofetilis mycophenolas potahované tablety
 sp. zn. sukls6973/2016 a k sp. zn. sukls144832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Mycophenolat mofetil Sandoz 500 mg Mofetilis mycophenolas potahované tablety Přečtěte si pozorně celou příbalovou
sp. zn. sukls6973/2016 a k sp. zn. sukls144832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Mycophenolat mofetil Sandoz 500 mg Mofetilis mycophenolas potahované tablety Přečtěte si pozorně celou příbalovou
Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
 22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 12 Vědecké závěry Celkové shrnutí vědeckého hodnocení léčivých přípravků obsahujících thiokolchikosid pro systémové použití
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 12 Vědecké závěry Celkové shrnutí vědeckého hodnocení léčivých přípravků obsahujících thiokolchikosid pro systémové použití
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III. Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral procedury.
 Příloha III Změny příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral procedury.
Příloha III Změny příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral procedury.
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
RADA A POUČENÍ LÉKAŘE
 RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 17 December 2015 EMA/PRAC/835770/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
17 December 2015 EMA/PRAC/835770/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 132 Vědecké závěry Výbor CHMP zvážil níže uvedené doporučení výboru PRAC ze dne 5. prosince 2013 s ohledem na postup podle
CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH KYSELINU VALPROOVOU/VALPROÁT (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Pokud se Vás něco z výše uvedeného týká, poraďte se se svým lékařem před nebo během léčby přípravkem Mygref.
 Sp. zn. sukls 123803/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO PACIENTA MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls 123803/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO PACIENTA MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
sp. zn. sukls144760/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas
 sp. zn. sukls144760/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls144760/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA MYCOPHENOLAT MOFETIL SANDOZ 250 mg tvrdé tobolky Mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha I. Seznam názvů, léková forma, koncentrace, způsob podání, držitelé rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů, léková forma, koncentrace, způsob podání, držitelé rozhodnutí o registraci v členských státech 1 Členský stát (v EHP) Držiteľ rozhodnutí o registraci Mezinárodní nechráněný název
Příloha I Seznam názvů, léková forma, koncentrace, způsob podání, držitelé rozhodnutí o registraci v členských státech 1 Členský stát (v EHP) Držiteľ rozhodnutí o registraci Mezinárodní nechráněný název
Varovné signály (Red flags) pro klinickou praxi vodítko pro zvýšené riziko genetické příčiny onemocnění u pacienta
 Varovné signály (Red flags) pro klinickou praxi vodítko pro zvýšené riziko genetické příčiny onemocnění u pacienta Obecné varovné signály pro klinickou praxi Přítomnost jednoho nebo více varovných signálů
Varovné signály (Red flags) pro klinickou praxi vodítko pro zvýšené riziko genetické příčiny onemocnění u pacienta Obecné varovné signály pro klinickou praxi Přítomnost jednoho nebo více varovných signálů
Celkové shrnutí vědeckého hodnocení přípravku Lipitor a související názvy (viz Příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalových informací předkládané Evropskou agenturou pro léčivé přípravky 23 Vědecké závěry Celkové
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
sp.zn. sukls107935/2012
 sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myclausen 500 mg potahované tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje mycophenolatum mofetilii 500 mg. Úplný
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myclausen 500 mg potahované tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje mycophenolatum mofetilii 500 mg. Úplný
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myclausen 500 mg potahované tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje mycophenolatum mofetilii 500 mg. Úplný
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myclausen 500 mg potahované tablety. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje mycophenolatum mofetilii 500 mg. Úplný
Příbalová informace: informace pro uživatele Mycofenolat Actavis 500 mg potahované tablety. mofetilis mycophenolas
 sp. zn. sukls141595/2014 Příbalová informace: informace pro uživatele Mycofenolat Actavis 500 mg potahované tablety mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls141595/2014 Příbalová informace: informace pro uživatele Mycofenolat Actavis 500 mg potahované tablety mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
http://www.vrozene-vady.cz
 Primární prevence vrozených vývojových vad MUDr. Antonín Šípek,CSc., odd. lékařské genetiky, Fakultní Thomayerova nemocnice v Praze Vrozená vada je následek nebo projev abnormálních vývojových pochodů,
Primární prevence vrozených vývojových vad MUDr. Antonín Šípek,CSc., odd. lékařské genetiky, Fakultní Thomayerova nemocnice v Praze Vrozená vada je následek nebo projev abnormálních vývojových pochodů,
Příloha II. Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Yvidually a souvisejících
Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Yvidually a souvisejících
RADA A POUČENÍ LÉKAŘE
 RADA A POUČENÍ LÉKAŘE KOMBINOVANÁ HORMONÁLNÍ ANTIKONCEPCE (MOŽNÉ UŽITÍ K YUZPEHO METODĚ) Obsah: a. Uživatelky kombinované hormonální antikoncepce b. Léčebné účinky kombinované hormonální antikoncepce c.
RADA A POUČENÍ LÉKAŘE KOMBINOVANÁ HORMONÁLNÍ ANTIKONCEPCE (MOŽNÉ UŽITÍ K YUZPEHO METODĚ) Obsah: a. Uživatelky kombinované hormonální antikoncepce b. Léčebné účinky kombinované hormonální antikoncepce c.
Klinické hodnocení u bolestí spojených s endometriózou. Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523
 Klinické hodnocení u bolestí spojených s endometriózou Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523 Studie SOLSTICE se provádí v přibližně 200 výzkumných centrech na celém světě.
Klinické hodnocení u bolestí spojených s endometriózou Bolest, kterou cítíte, je skutečná... i když to ostatní nevidí. A822523 Studie SOLSTICE se provádí v přibližně 200 výzkumných centrech na celém světě.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myfenax 250 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myfenax 250 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných
Fluorochinolonová antibiotika omezení používání potvrzeno
 Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
TOCTINO (ALITRETINOIN) INFORMACE O ANTIKONCEPCI. Obsah 1. FAKTA A MÝTY... 2 2. PREVENCE TĚHOTENSTVÍ A TOCTINO... 2 3. TĚHOTENSKÉ TESTY...
 EDUKAČNÍ MATERIÁLY Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky
EDUKAČNÍ MATERIÁLY Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU CellCept 250 mg tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných látek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU CellCept 250 mg tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných látek
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI
 Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) bimatoprostu
Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) bimatoprostu
Příbalová informace: Informace pro pacienta
 sp.zn.sukls17470/2014 Příbalová informace: Informace pro pacienta ERMM-1 111 MBq/ml, injekční suspenze Erbii-( 169 Er) citras (Citronan erbný-( 169 Er) v koloidní suspenzi) (V této příbalové informaci
sp.zn.sukls17470/2014 Příbalová informace: Informace pro pacienta ERMM-1 111 MBq/ml, injekční suspenze Erbii-( 169 Er) citras (Citronan erbný-( 169 Er) v koloidní suspenzi) (V této příbalové informaci
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
45 let oficiální registrace vrozených vad v České republice
 45 let oficiální registrace vrozených vad A. Šípek 1, 2, V. Gregor 1 1 Oddělení lékařské genetiky, Fakultní Thomayerova nemocnice, Praha 2 3.Lékařská fakulta Univerzity Karlovy, Praha Pracovní den Společnosti
45 let oficiální registrace vrozených vad A. Šípek 1, 2, V. Gregor 1 1 Oddělení lékařské genetiky, Fakultní Thomayerova nemocnice, Praha 2 3.Lékařská fakulta Univerzity Karlovy, Praha Pracovní den Společnosti
SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP)
 PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myfenax 250 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Myfenax 250 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg. Úplný seznam pomocných
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
Příbalová informace: Informace pro uživatele. Pregnyl 1500 Pregnyl 5000 gonadotropinum chorionicum humanum prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele Pregnyl 1500 Pregnyl 5000 gonadotropinum chorionicum humanum prášek a rozpouštědlo pro injekční roztok Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro uživatele Pregnyl 1500 Pregnyl 5000 gonadotropinum chorionicum humanum prášek a rozpouštědlo pro injekční roztok Přečtěte si pozorně celou příbalovou informaci dříve,
Léčba přípravkem. co byste měli vědět
 Informace pro pacienty, kterým byl předepsán přípravek Volibris. Léčba přípravkem co byste měli vědět Tato brožurka přináší informace a doporučení týkající se léčby přípravkem Volibris. Pečlivě si ji pročtěte
Informace pro pacienty, kterým byl předepsán přípravek Volibris. Léčba přípravkem co byste měli vědět Tato brožurka přináší informace a doporučení týkající se léčby přípravkem Volibris. Pečlivě si ji pročtěte
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycophenolate mofetil Teva 250 mg tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycophenolate mofetil Teva 250 mg tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje mycophenolatum mofetilii 250 mg.
