VII. skupina PS, ns 2 np 5
|
|
|
- Veronika Burešová
- před 5 lety
- Počet zobrazení:
Transkript
1 VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo fluor lze očekávat tvorbu až formálního oxidačního stupně VII+ (např. HClO 4, IF 7 ) s elektropozitivnějšími prvky očekáváme tvorbu oxidačního stupně I. Fluor je nejelektronegativnější prvek vůbec a známe tedy pouze sloučeniny obsahující fluor v oxidačních stupních 0 a I.
2 Vlastnosti prvků VII. sk. PS F Cl Br I At atomové číslo At. hmotnost rel. 18, ,453 79, , ,99 hustota kapaliny (při C) 1,513 (-188) 1,655 (-70) 3,187 (0) 3,960 (120) - - teplota tání C -218,6-101,0-7,25 113,6 302 teplota varu C -188,1-34,0 59,50 185,2 330 iont. poloměr pro X - [pm] I. ionizační energie [kj/mol] elektronegativita (Allred-Rochow) ,6 1255,7 1142,7 1008,7 (926) 4,10 2,83 2,74 2,21 1,96
3 Halogeny vazebné poměry Charakter vazeb ve sloučeninách závisí jak na halogenu samotném, jeho oxidačním stupni, tak i na prvku se kterým se vazba tvoří. Od ostatních halogenů se v tomto ohledu dosti liší fluor, jehož vazby k ostatním prvkům mají, do značné míry, iontový charakter. Např. v HF je iontovost vazby přibližně 60 %, zatímco v HCl činí podíl iontovosti pouze 20 %. Kovalentní atom fluoru tvoří prakticky vždy jedinou vazbu σ s výjimkou, kdy se uplatňuje jako můstek nebo v iontu H 2 F +. Ostatní halogeny tvoří běžně sloučeniny s větším počtem vazeb σ, např. kyslíkaté sloučeniny nebo interhalogenové sloučeniny, zvláště pak s fluorem. S rostoucím protonovým číslem se ve sloučeninách s větším počtem vazeb mohou uplatňovat mimo orbitalů s a p rovněž orbitaly d a v případě jodu i orbitaly f.
4 Halogeny výskyt
5 Fluor - výroba Fluor je extrémně reaktivní prvek, který se slučuje prakticky se všemi prvky. získává se výhradně elektrolyticky elektrolýzou taveniny KF : HF = 1:1 až 1:3 při teplotách mezi C (vysokoteplotní elektrolyzér pro směs KF:HF 1:1, nízkoteplotní pro směs KF:HF = 1:3) Výrobní zařízení - elektrolyzér z čistého niklu nebo Monelova kovu (slitina Cu Ni) ocelová katoda uhlíková anoda oddělené elektrodové prostory. Fluor se dodává v tlakových lahvích, nebo se připravuje pro laboratorní účely elektrolyticky v malých elektrolyzérech výše popsaným způsobem.
6 Chlor - příprava v menších se chlor množstvích připravuje reakcemi se silnějšími oxidačními činidly než je samotný chlor: 2 KMnO HCl 5 Cl MnCl KCl + 8 H 2 O MnO HCl Cl 2 + MnCl H 2 O K 2 Cr 2 O HCl 3 Cl CrCl KCl + 7 H 2 O Chlor vzniká rovněž rozkladem chlornanu (např. chlorového vápna) kyselinou chlorovodíkovou. Nejprve je vytěsněna slabší kyselina chlorná a následně proběhne reakce: HClO + HCl Cl 2 + H 2 O
7 Chlor - výroba Elektrolýza, nejčastěji jako vedlejší produkt při výrobě hydroxidu sodného. Elektrolytem je téměř nasycený roztok chloridu sodného ve vodě (solanka). Výrobní zařízení: uhlík (anoda) ocel (katoda) prostory elektrod jsou odděleny běžná teplota Za zvýšené teploty však vzniká chlornan a chlorečnan - pak nejsou naopak elektrodové prostory odděleny a je zajištěno míchání elektrolytu. O konečném produktu pak rozhoduje teplota reakční směsi (viz dále). Do laboratoří se dodává chlor v tlakových lahvích.
8 Brom výroba a příprava Brom se průmyslově vyrábí výhradně oxidací bromidů chlorem. Zdrojem je nejčastěji solanka z Mrtvého moře, nebo ze slaných michiganských bažin. V laboratoři se připravuje nejčastěji reakcí bromidu s vhodným oxidačním činidlem, např. dichromanem draselným, v přítomnosti kyseliny sírové: K 2 Cr 2 O KBr + 7 H 2 SO 4 3 Br 2 + Cr 2 (SO 4 ) K 2 SO H 2 O Do laboratoří se dodává v zatavených skleněných ampulích z tmavého skla v bezpečnostním balení obsahujícím inertní materiál.
9 Jod výroba a příprava Jod se průmyslově vyrábí několika způsoby: a) Nejčastěji se ze solanky (obsahující jodidy) vytěsní chlorem a následně se vyhání proudem vzduchu. Surový produkt se čistí sublimací. b) Z přečištěné solanky se jod někdy vyrábí reakcí s dusičnanem stříbrným postupem, který vystihují rovnice: I - + Ag + AgI 2 AgI + Fe FeI Ag FeI 2 + Cl 2 FeCl 2 + I 2 přičemž stříbro se po rozpuštění v kyselině dusičné vrací zpět do výrobního procesu. Z jodičnanu obsaženého v chilském ledku se jod vyrábí tak, že se nejprve redukcí siřičitanem převede část jodičnanu na jodid, který pak reaguje s jodičnanem za vzniku volného jodu: 2 IO HSO 3-2 I SO H + 3I - + IO H + 3 I H 2 O
10 Halogeny - vlastnosti Všechny halogeny vytvářejí ve volném stavu dvouatomové molekuly X 2 Atomy prvků jsou v těchto molekulách vázány jednoduchou σ - vazbou, (viz MO diagram) U halogenů s vyšším atomovým číslem rozšířena o příspěvek π d -vazby, vznikající částečným překryvem p a d orbitalů. Všechny halogeny jsou barevné absorbují elektromagnetické záření ve viditelné oblasti spektra. Zbarvení se prohlubuje s rostoucím atomovým číslem v důsledku posunu absorpčního pásu k delším vlnovým délkám. Tato vlastnost vysvětluje, proč jsou mnohé reakce halogenů ovlivnitelné světlem.
11 Halogeny - rozpustnost Rozpustnost ve vodě U fluoru se o rozpustnosti ani nemluví (reaguje) Rozpustnost chloru a bromu ve vodě dovoluje vznik klathrátů, které se z vody po ochlazení těchto roztoků vyloučí v krystalické podobě. Jod se rozpouští v čisté vodě jen málo. V přítomnosti jodidů se však rozpustnost, v důsledku vzniku polyjodidů, značně zvýší. I 2 + I - I 3 - Halogeny jsou dobře rozpustné v nepolárních rozpouštědlech (sirouhlík, diethylether, chloroform, chlorid uhličitý, ethanol aj.)
12 Halogeny reaktivita fluoru Všechny halogeny jsou velmi reaktivní Fluor reaguje velmi prudce s většinou prvků. S vodíkem reaguje za výbuchu ještě při teplotách kolem -252 C. Přímo nereaguje pouze s některými kovy (Cu, Ni) ale také s dusíkem. Fluor reaguje také s většinou sloučenin tak, že v nich oxiduje elektronegativnější složky: S kyslíkem reaguje fluor v doutnavém elektrickém výboji, za nízkých teplot, za vzniku nestálého difluoridu dikyslíku O 2 F 2.
13 Halogeny reaktivita chloru Chlor reaguje rovněž s velkou většinou prvků přímo. Reakce mívají prudký průběh. S vodíkem hoří chlor po zapálení nebo ozáření světlem za vzniku chlorovodíku. Neslučuje se přímo pouze s kyslíkem a dusíkem. Reakcí s vodou vzniká pomalu kyselina chlorná a chlorovodíková: Cl 2 + H 2 O HClO + HCl chlorová voda
14 Halogeny reaktivita bromu a jodu Brom a jod se chemicky podobají chloru avšak jejich reaktivita je podstatně nižší. Oxidační účinky volných halogenů klesají s rostoucím atomovým číslem. Z halogenidů je tedy možno vytěsnit volný halogen halogenem s nižším atomovým číslem. Užití volných halogenů Všechny halogeny v elementárním stavu jsou silná oxidační činidla, což vede k řadě praktických aplikací (chlorování vody, jodová tinktura). Velmi rozsáhlá je chemie halogenderivátů organických sloučenin, používaných jako rozpouštědla, v průmyslu plastických hmot apod.
15 Sloučeniny halogenů halogenovodíky a halogenidy Halogenovodíky jsou binární sloučeniny vodíku s halogeny a oxidační číslo halogenu v nich je I. HF HCl HBr HI teplota tání C -83,4-114,7-88,6-51,0 teplota varu C 19,5-84,2-67,1-35,1 H o sluč (při 298,15 K) [kj mol -1 ] 0 H sluč dipólový moment µ [C m] -271,12-92,31-36,4 26,48 5,79 3,56 2,62 1,27 molekuly HX jsou polární
16 Sloučeniny halogenů halogenovodíky a halogenidy Vliv vodíkových můstků na t.v. PCl 3, PBr 3 HF (g) a kyselina fluorovodíková reaguje s oxidem křemičitým (a tedy i se sklem) za vzniku fluoridu křemičitého: SiO HF SiF H 2 O
17 Sloučeniny halogenů Halogenovodíky a halogenidy Sloučeniny halogenů halogenovodíky a halogenidy Kyselina jodovodíková a bromovodíková podléhají při styku se vzduchem oxidaci a uvolňuje se halogen. K vytěsnění těchto halogenovodíků nelze použít kyselinu sírovou pro její oxidační účinky P H 2 O + 6 Br 2 12 HBr + 4 H 3 PO 3 H 3 PO 3 + H 2 O + Br 2 2 HBr + H 3 PO 4 Menší množství kyseliny jodovodíkové je možno připravit např. reakcemi jodu se sulfanem: I 2 + H 2 S 2 HI + S nebo s hydrazinem ve vodě: 2 I 2 + N 2 H 4 4 HI + N 2
18 Sloučeniny halogenů halogenovodíky a halogenidy Volné halogenovodíky tvoří s vodou definované hydráty Vodné roztoky halogenovodíků označujeme jako kyseliny halogenovodíkové. Síla těchto kyselin roste s rostoucím atomovým číslem halogenu. Kyselina fluorovodíková se chová jako slabá kyselina s pk a = 3,14 při 25 C (důsledek tvorby vodíkových můstků), její síla roste s koncentrací. Následující kyseliny halogenovodíkové jsou silné kyseliny, které jsou ve vodných roztocích zcela disociovány. Všechny halogenovodíky tvoří s vodou azeotropní směsi: HF 35 % HCl 20 % HBr 48 % HI 57 % Koncentrovaná kyselina fluorovodíková přichází na trh nejčastěji o koncentraci 40 %, koncentrovaná kyselina chlorovodíková 36 %. Posledně jmenovaná kyselina má značný praktický význam a je vyráběna pro průmyslové účely ve velkých množstvích.
19 Sloučeniny halogenů halogenovodíky a halogenidy
20 Sloučeniny halogenů iontové halogenidy Iontové halogenidy jako soli halogenovodíkových kyselin - halogenidy alkalických kovů a kovů alkalických zemin i halogenidy některých přechodných kovů (prvků vzácných zemin a thoria. vazba má do značné míry iontový charakter S rostoucím poměrem náboje iontu k jeho poloměru se zvyšuje kovalentní charakter vazby. S rostoucím poloměrem halogenidového aniontu se zvyšuje jeho polarizovatelnost a tím rovněž kovalentní charakter vazby. Halogenidy alkalických kovů a kovů alkalických zemin představují základní strukturní typy iontových sloučenin (typ NaCl, CsCl, CaF 2 apod.) Většina těchto halogenidů se vyznačuje vysokými teplotami tání a v roztaveném stavu vedeouelektrický proud. Pokud jsou rozpustné ve vodě, chovají se většinou jako silné elektrolyty.
21 Sloučeniny halogenů iontové halogenidy Ve vodě rozpustné halogenidy se z roztoků vylučují často jako krystalohydráty LiCl H 2 O BaCl 2 2H 2 O AlCl 3 6H 2 O Některé z nich lze dehydratovat prostým zahříváním hydrátu jiné se při tomto procesu hydrolyzují NiCl 2 6H 2 O FeCl 3 6H 2 O AlCl 3 6H 2 O V některých případech je možno získat bezvodé soli zahříváním jejich hydrátů v proudu suchého halogenovodíku nebo odstraněním vody vhodným dehydratačním činidlem: CrCl 3.6H 2 O + 6 SOCl 2 CrCl HCl + 6 SO 2
22 Sloučeniny halogenů iontové halogenidy Ve vodě špatně rozpustné chloridy, bromidy a jodidy jsou : Cu I Ag I Tl l Hg I Pb II Velmi špatně jsou ve vodě rozpustné fluoridy kovů alkalických a vzácných zemin. Chlorid a bromid rtuťnatý nejsou ve vodných roztocích prakticky vůbec disociovány, Rozpouštějí se jako ve formě nedisociovaných elektroneutrálních molekul HgX 2. HgX I - HgX 4 2-
23 Sloučeniny halogenů kovalentní halogenidy Strukturně velmi pestrá skupina látek Jednoduché molekuly zachovávají si molekulovou strukturu i v pevném stavu TiCl 4, SnCl 4, WF 6, NbCl 5 aj. halogenidy nekovů S, N, P, ale i polokovů, jako např. Si, Te, Se, As, Sb. vesměs kapaliny, které vedou velmi špatně elektrický proud. mají relativně nízké teploty tání a varu, většinou plynné, nebo kapalné, případně snadno sublimující látky
24 Sloučeniny halogenů kovalentní halogenidy Jde o vysoce kondenzované systémy s nekonečnými atomovými strukturami, vytvářejícími řetězce, vrstvy, případně prostorové systémy. Patří sem: - halogenidy kovů s elektronegativitami v intervalu asi 1,5 2,2 v oxidačních stupních III a II (výjimečně I). - Řada chloridů s vrstevnatou strukturou typu CdCl 2 (bezvodý CrCl 3, FeCl 2, MnCl 2, CoCl 2, NiCl 2 aj.). Ve srovnání s iontovými halogenidy mají rovněž nižší teploty tání a varu, případně snáze sublimují. Některé z nich zachovávají dimerní uspořádání i v plynném stavu. Al 2 Cl 6, Fe 2 Cl 6
25 Sloučeniny halogenů kovalentní halogenidy Některé halogenidy se vodou prudce hydrolyzují za vzniku příslušného halogenovodíku. Těchto reakcí se využívá k jejich přípravě. SiCl H 2 O SiO HCl BCl H 2 O 3 HCl + H 3 BO 3 V některých případech, např. použijeme-li k hydrolýze vodný roztok příslušné kyseliny, dochází jen k částečné hydrolýze, která vede ke vzniku halogenoxidů: Pozn.: SbCl 3 + H 2 O SbOCl + 2 HCl Tyto reakce mají charakter rovnováh a hydrolýza může být značně potlačena přídavkem příslušné kyseliny do reakční směsi a tím posunutí rovnováhy ve prospěch výchozích reaktantů.
26 Sloučeniny halogenů kovalentní halogenidy SF 6, CF 4, NF 3, CCl 4 apod. jsou značně inertní, nereagují s vodou, ani se s ní nemísí. Tuto skutečnost vysvětlujeme nepřítomností vhodných orbitalů (vakantních d orbitalů) na centrálním atomu.
27 Sloučeniny halogenů polyhalogenidy Halogenidové anionty, které vznikají disociací halogenidů v roztocích mají schopnost vytvářet s molekulami volných halogenů dukty, X - + nx 2 X - 2n+1 Schopnost tvořiz polyhalogenidy roste s rostoucím atomovým číslem F < Cl < Br < I U jodu jsou známy polyhalogenidy až do I 9 - Adovat se mohou i molekuly nestejných halogenů a interhalogenových sloučenin: I - + ICl I 2 Cl - Tuhé polyhalogenidy alkalických kovů se snadno rozkládají na volný halogen a halogenid.
28 Interhalogeny Chemická podobnost halogenů je jednou z příčin, proč jsou schopny vytvářet sloučeniny označované jako interhalogeny. Interhalogenové sloučeniny jsou těkavé nízkomolekulární látky. Jsou velmi reaktivní a svou reaktivitou velmi připomínají volné halogeny. Mají žlutou, červenou nebo hnědočervenou barvu a vznikají nejčastěji přímou syntézou. S vodou reagují za vzniku HY a kyslíkaté kyseliny elektropozitivnějšího halogenu s odpovídající oxidačním stavem halogenu X: ClF + H 2 O HF + HClO V bezvodém prostředí tvoří v některých případech s halogenidovými ionty komplexní iontové interhalogenové sloučeniny, např.: ICl 3 + Cl - ICl 4 - Některé z interhalogenů nalézají využití jako halogenační činidla: Mo + 2 BrF 3 MoF 6 + Br 2
29 typ vzorec vlastnosti Struktura XY ClF bezbarvý plyn teplota tání 156 C teplota varu 101 C BrF světle hnědý plyn teplota tání -33 C teplota varu 20 C IF nestálý při 20 C XY 3 ClF 3 bezbarvý plyn teplota tání 83 C teplota varu 12 C BrF 3 XY 5 ClF 5 plyn IF 5 žl. zelená kapalina teplota tání 8,8 C teplota varu 126 C bezbarvá kapalina teplota tání 9,6 C teplota varu 97 C XY 7 IF 7 bezbarvý plyn teplota tání 5,5 C sublimuje 4,5 C sp lineární sp 3 d tvar T sp 3 d 2 tetragonální pyramida fsp 3 d 2 pentagonální bipyramida
30 Sloučeniny halogenů kyslíkaté sloučeniny Oxidy Cl 2 O chlorný ClO 2 chloričitý Cl 2 O 6 chlorový Cl 2 O 7 chloristý Br 2 O bromný a BrO 2 bromičitý I 2 O 5 - jodičný Oxokyseliny halogenů síla kyseliny oxidační účinky
31 Sloučeniny halogenů kyslíkaté sloučeniny Fluoridy kyslíku 2 % roztok Oproti například oxidům chloru, je tento fluorid neexplozivní a poměrně stálý. Chová se však jako velmi silné oxidační činidlo. Fluorací ledu při nižších teplotách vzniká velmi nestálá kyselina fluorná : F 2 + H 2 O HFO + HF
32 Sloučeniny halogenů kyslíkaté sloučeniny Oxidy chloru - poměrně nestálé endotermní látky, které se rozkládají za výbuchu na kyslík a chlor. Oxid chlorný Cl 2 O Příprava reakcí chloru s oxidem rtuťnatým za chlazení vzniká Cl 2 O: HgO + 2 Cl 2 Cl 2 O + HgCl 2 Průmyslově se získává oxid chlorný reakcí chloru s vlhkým uhličitanem sodným: Cl Na 2 CO 3 + H 2 O 2 NaHCO NaCl + Cl 2 O Jde o žlutohnědý plyn, který se po zahřátí explozivně rozkládá. Je anhydridem kyseliny chlorné: Cl 2 O + H 2 O 2 HClO
33 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina chlorná vzniká při reakci chloru s vodou Cl 2 + H 2 O HClO + HCl nestálá slabá kyselina (pka = 7,47 při 25 C) postupně se rozkládá za vzniku kyslíku, chloru a kyseliny chlorečné. má silné oxidační účinky HClO + H + + e - ½ Cl 2 + H 2 O E = +1,63 V oxiduje soli chromité na chromany, hydroxid olovnatý na oxid olovičitý.
34 Sloučeniny halogenů kyslíkaté sloučeniny Chlornany Cl O mimo σ-vazbu Cl O se uplatňuje slabá interakce π d d orbitaly na atomu chloru a vhodně orientovaným p orbitalem na atomu kyslíku mezi ve vodných roztocích značně hydrolyzují. Připravit se dají reakcí chloru se silně chlazenými roztoky alkalických hydroxidů, nebo elektrolýzou roztoků chloridu sodného při neoddělených elektrodových prostorech opět za silného chlazení. Roztoky chlornanů mají bělicí a desinfekční účinky. Roztokem chlornanu sodného je například čisticí a desinfekční prostředek známý jako SAVO. Ve velkých množstvích se rovněž vyrábí tzv. chlorové vápno, které má složení nejblíže vzorci Ca(ClO)Cl (chlorid-chlornan vápenatý), které slouží jako účinné desinfekční činidlo. Při vyšších teplotách se chlornany disproporcionují za vzniku chlorečnanu a chloridu: 3ClO - ClO Cl -
35 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina chloritá a chloritany volná kyselina chloritá je velmi nestálá a je možno připravit její zředěné roztoky, například vytěsněním z jejich solí: Ba(ClO 2 ) 2 + H 2 SO 4 BaSO HClO 2 středně silná kyselina s hodnotou pk 2. má silné oxidační účinky Chloritany vznikají vedle chlorečnanu reakcí oxidu chloričitého s roztoky alkalických hydroxidů: 2 ClO OH - ClO ClO H 2 O Chloritany mají rovněž silné oxidační a dezinfekční účinky. Anion má lomený tvar s úhlem O Cl O 110,5 což je v souladu s předpokladem hybridizace sp 3 centrálního atomu. Vazby Cl O mají z důvodů interakce π d částečně násobný charakter.
36 Sloučeniny halogenů kyslíkaté sloučeniny Chloritany lze připravit reakcí oxidu chloričitého s roztoky peroxidů: 2 ClO 2 + O ClO 2- + O 2 nebo reakcí se zinkovým prachem 2 ClO 2 + Zn 2 ClO Zn 2+ zahříváním vodných roztoků se chloritany disproporcionují: 3 ClO 2-2 ClO Cl -
37 Sloučeniny halogenů kyslíkaté sloučeniny Oxid chloričitý Žlutohnědý plyn, který lze snadno zkapalnit. V kapalném stavu a ve vysokých koncentracích je značně nestálý a snadno exploduje. Rozpouští se za vývoje tepla velmi dobře ve vodě, roztok je tmavozelený a obsahuje až 8 g oxidu na 1000 g vody. Z tohoto roztoku lze získat hydrát oxidu chloričitého s proměnlivým složením Vznik ClO 2 3 KClO H 2 SO 4 2 ClO 2 + HClO 4 + 3KHSO 4 + H 2 O nebo lépe (bezpečněji) s kyselinou šťavelovou: 2KClO (COOH) 2 2 ClO CO 2 + K 2 C 2 O H 2 O
38 Sloučeniny halogenů kyslíkaté sloučeniny Pozor! Přelití pevného chlorečnanu koncentrovanou kyselinou sírovou je velmi nebezpečné. V případě přítomnosti organických látek v takové směsi, dojde k okamžitému výbuchu. Pokud nejsou organické látky přítomny může explodovat samotný oxid chloričitý. Ve velmi čisté podobě vzniká rovněž reakcí: 2 AgClO 3 + Cl 2 2 ClO AgCl + O 2 Laboratorně a průmyslově se získává reakcí: 2 NaClO 2 + Cl 2 2 ClO NaCl Oxid chloričitý se uplatňuje: zejména v bělicím procesu při výrobě celulózy, neboť ji nepoškozuje jako dezinfekční prostředek v ochraně předmětů kulturního dědictví desinfeční činidlo pro přípravu pitné vody
39 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina chlorečná Ba(ClO 3 ) 2 + H 2 SO 4 BaSO HClO 3 v čisté podobě ji nelze připravit samovolně se rozkládá při koncentracích nad 30 % za vzniku chloru, kyseliny chloristé a kyslíku a při vyšších koncentracích vzniká ještě oxid chloričitý. 8 HClO 3 4 HClO Cl O H 2 O 3 HClO 3 HClO ClO 2 + H 2 O roztoky kyseliny chlorečné mají velmi silné oxidační účinky.
40 Sloučeniny halogenů kyslíkaté sloučeniny Chlorečnany Chlorečnany vznikají disproporcionací chloru v horkých roztocích hydroxidů alkalických kovů nebo alkalických zemin 3 Cl OH - ClO Cl H 2 O Dnes se vyrábějí chlorečnany výhradně elektrolýzou téměř nasycených roztoků chloridu sodného při neoddělených elektrodových prostorech a za horka.
41 Sloučeniny halogenů kyslíkaté sloučeniny Vlastnosti chlorečnanů Čisté chlorečnany alkalických kovů se termicky rozkládají za vzniku chloristanu: 4 KClO 3 3 KClO 4 + KCl ale současně také v přítomnosti nečistot, nebo katalytickým účinkem např. oxidu manganičitého již za nižších teplot. 2 KClO 3 2 KCl + 3 O 2 Chlorečnan draselný je součástí pyrotechnických výrobků jako například směsi na výrobu zápalkových hlaviček. Chlorečnan sodný TRAVEX (herbicid) Pozor! Směsi chlorečnanů s organickými látkami velmi snadno vybuchují!
42 Sloučeniny halogenů kyslíkaté sloučeniny Oxid chlorový t. v. 4 C Tmavočervená kapalina, vzniká působením ozonu na oxid chloričitý 2 ClO O 3 Cl 2 O O 2 Hydrolýza vede k disproporcionaci Cl 2 O 6 + H 2 O HClO 3 + HClO 4 S roztoky hydroxidů reaguje oxid chlorový za vzniku ekvimolární směsi chlorečnanu a chloristanu.
43 Sloučeniny halogenů kyslíkaté sloučeniny Oxid chloristý t. v. 83 C bezbarvá olejovitá kapalina Snadno vybuchuje prudkým zahřátím nebo stykem s organickými látkami Vzniká dehydratací bezv. kyseliny chloristé pomocí P 4 O 10 při teplotě -10 C 4 HClO 4 + P 4 O 10 2 Cl 2 O (HPO 3 ) x Z reakční směsi ho lze získat snadno opatrnou vakuovou destilací Jeho reakcí s vodou vzniká zpět kyselina chloristá, je tedy jejím anhydridem
44 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina chloristá KClO 4 + H 2 SO 4 HClO 4 + KHSO 4 Z reakční směsi se izoluje vakuovou destilací jako bezvodá. V prodeji je 72% kyselina (azeotropní směs s teplotou varu 203 C) Tato velmi silná kyselina (prakticky nejsilnější známá anorganická kyselina) se s vodou mísí v každém poměru a její roztoky jsou stálé. S vodou tvoří pevný monohydrát, který je možno formulovat jako chloristan hydroxonia H 3 O + ClO 4 - I tato kyslíkatá kyselina chloru má silné oxidační účinky, ale je kineticky značně inertní a ve zředěných roztocích probíhají její reakce velmi pomalu. Pozor! V koncentrovaném stavu již při koncentracích kolem 70 % však při styku s oxidovatelnými látkami, zejména organickými, vybuchuje.
45 Sloučeniny halogenů kyslíkaté sloučeniny Chloristany Chloristany se průmyslově vyrábějí elektrolytickou oxidací chlorečnanů (ocelová katoda, anoda z platiny nebo oxidu olovičitého) Využití nacházejí zejména jako zdroj pro výrobu kyseliny chloristé a při výrobě chloristanu amonného, který slouží v současnosti k výrobě tuhých paliv pro pohonné systémy raket. Chloristan draselný je rovněž využíván jako součást pyrotechnických složí. Chloristan hořečnatý je silně hygroskopický a má využití jako sušidlo pod označením anhydron. Chloristan hořečnatý slouží rovněž jako pevný elektrolyt v tzv. suchých článcích.
46 Sloučeniny halogenů kyslíkaté sloučeniny Oxid bromný Br 2 + HgO Br 2 O + HgBr 2 S vodou reaguje oxid bromný za vzniku kyseliny bromné Kyselina bromná Br 2 O + H 2 O 2 HBrO vzniká disproporcionační hydrolýzou bromu (podobně jako u chloru) Br 2 + H 2 O HBrO + HBr bromová voda Její soli vznikají rovněž obdobně jako je tomu u chloru, reakcí bromu s roztoky alkalických hydroxidů za silného chlazení: Br OH - BrO - + Br - + H 2 O
47 Sloučeniny halogenů kyslíkaté sloučeniny Oxid bromičitý je produktem reakce ozonu s bromem při teplotě - 78 C v CF 3 Cl jako rozpouštědle: Br 2 + O 3 2 BrO O 2 Oxid bromičitý se disproporcionuje v roztocích alkalických hydroxidů: 6 BrO OH - 5 BrO Br H 2 O
48 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina bromičná Br Cl H 2 O 2 HBrO HCl Chemicky se vodné roztoky kyseliny bromičné podobají kyselině chlorečné, mají silné oxidační účinky. Volný brom se disproporcionuje v horkých roztocích alkalických hydroxidů obdobně jako chlor: 3 Br OH - BrO Br H 2 O Bromičnanyjsou termicky nestálé a při žíhání se rozkládají 2 KBrO 3 2 KBr + 3 O 2 Bromičnany se používají v bromatometrii volumetrická metoda
49 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina bromistá Větší množství bylo poprvé připraveno oxidací bromičnanu vodným roztokem XeF 2 : BrO XeF 2 + H 2 O BrO 4- + Xe + 2HF Kyselinu bromistou lze bez rizika zahustit na koncentraci asi 55 %. Volná, koncentrovaná bromistá je silné oxidační činidlo, které rychle rozpouští i korozivzdorné oceli. Bromistany V současnosti se však připravují bromistany výhradně reakcí: BrO F OH - BrO F - + H 2 O Zředěné roztoky bromistanů se chovají jako mírná oxidační činidla.
50 Sloučeniny halogenů kyslíkaté sloučeniny Oxidy jodu Jediným pravým oxidem jodu je I 2 O 5 + Oxid jodičný lze získat termickou dehydratací kyseliny jodičné při 240 C 2 HIO 3 I 2 O 5 + H 2 O dalším zahříváním nad 300 C dochází k rozkladu oxidu na prvky. oxid jodičný je anhydridem kyseliny jodičné. Detekce CO Ostatní binární sloučeniny jodu s kyslíkem
51 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina jodná - nestabilní, velmi slabá kyselina Vzniká podobně jako chloru a bromu reakcí prvku s vodou I 2 + H 2 O HIO + HI nebo reakcí jodu s oxidem rtuťnatým 2 I HgO + H 2 O HgO.HgI HIO Ve vodných roztocích se může ionizovat i jako zásada: HIO + H 2 O I(H 2 O) + + OH - Má oxidační účinky a rozkládá se disproporcionačně na jodičnan a jodid. Její soli vznikají obdobně jako chlornany a bromnany reakcí volného jodu s chlazenými roztoky alkalických hydroxidů I OH - IO - + I - + H 2 O
52 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina jodičná Jodičnany I 2 + NaClO 3 2 NaIO 3 + Cl 2 Kyselina i soli mají silné oxidační účinky.
53 Sloučeniny halogenů kyslíkaté sloučeniny Kyseliny jodisté kyselina orthojodistá kyselina metajodistá Tetraoxojodistany je možno připravit také oxidací jodičnanu chlornanem IO ClO - IO Cl -
54 Sloučeniny halogenů kyslíkaté sloučeniny Kyselina pentahydrogenjodistá (orthojodistá) Vzniká termickým rozkladem některých jodičnanů 5 Ba(IO 3 ) 2 Ba 5 (IO 6 ) I O 2 Ba 5 (IO 6 ) H 2 SO 4 2 H 5 IO BaSO 4 Soli této kyseliny vznikají rovněž oxidací jodičnanů chlorem v alkalickém prostředí IO OH - + Cl 2 IO Cl H 2 O Termický rozklad kyseliny probíhá na oxid jodičný, kyslík a vodu.
55 Sloučeniny halogenů kyslíkaté sloučeniny Vlastnosti kyseliny jodisté Silné oxidační účinky, Oxiduje například ionty Mn(II) ve vodném prostředí kvantitativně až na manganistany. Na rozdíl od chloristanů, vystupuje anion ochotně jako ligand v komplexních sloučeninách Oktaedrické anionty hexaoxojodistanové mohou vázat bidentátně za vzniku chelátového kruhu Uplatňuje se jako jeden z ligandů stabilizujících centrální atomy ve vysokých oxidačních stupních.
56 ASTAT Chemie astatu je málo prozkoumána (radioaktivní prvek s velmi krátkým poločasem přeměny 211 At má poločas rozpadu 7,21 hodin, bez praktického významu. Astat může existovat v oxidačních stupních 0, -I, V a možná I (nebo III) a VII. Je jediným halogenem, který v oxidačním stupni 0 až V nepodléhá disproporcionačním reakcím. Astat poskytuje interhalogenové sloučeniny typu AtX, extrahovatelné do chloridu uhličitého. Jediné praktické využití by mohlo být v lékařství, kde jeho použití k ničení nemocných tkání štítné žlázy by bylo vhodnější, než v současnosti praktikované aplikace radioaktivního jodu.
VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat
 VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
VII. skupina PS, ns 2 np 5 Fluor, chlor, brom, jod, astat Charakteristika: název halogeny (halové prvky) je odvozen z řečtiny a znamená solitvorný. se silně elektronegativními prvky jako je kyslík nebo
Astat - radioaktivní pevná látka - krátký poločas rozpadu (8,3 hod) - nejstabilnější je izotop At 210. Sloučeniny
 Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
Halogeny - název od řeckého hals = sůl (pro jejich schopnost tvořit velkou řadu solí) - prvky 17. skupiny - mají sedm valenčních elektronů - tvoří dvouatomové molekuly - jsou jedovaté s dráždivými účinky
DUM č. 19 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 19 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
16.5.2010 Halogeny 1
 16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
16.5.010 Halogeny 1 16.5.010 Halogeny Prvky VII.A skupiny: F, Cl, Br, I,(At) Obecnávalenčníkonfigurace:ns np 5 Pro plné zaplnění valenční vrstvy potřebují 1 e - - nejčastější sloučeniny s oxidačním číslem
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At)
 Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Prvky VII. hlavní skupiny (F, Cl, Br,, I, At) I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Modul 02 Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty VII.A skupina 17. skupina
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty VII.A skupina 17. skupina
DUM č. 18 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 18 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
12.CHALKOGENY A HALOGENY
 12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
12.CHALKOGENY A HALOGENY Chalkogeny ( česky se jedná o prvky ) 1) Popiš obecnou charakteristiku dané skupiny (počet valenčních elektronů, obecná elektronová konfigurace valenční vrstvy, způsoby dosažení
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN
VY_32_INOVACE_30_HBENO6
 Halogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 8. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Halogeny jejich vlastnos a důležité sloučeniny
Halogeny Temacká oblast : Chemie anorganická chemie Datum vytvoření: 8. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Halogeny jejich vlastnos a důležité sloučeniny
Halogeny a jejich sloučeniny
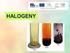 Halogeny a jejich sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného
Halogeny a jejich sloučeniny Mgr. Jana Pertlová Copyright istudium, 2008, http://www.istudium.cz Žádná část této publikace nesmí být publikována a šířena žádným způsobem a v žádné podobě bez výslovného
DUM č. 14 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 14 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 14 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
6. Nekovy chlor a vodí k
 6. Nekovy chlor a vodí k 1) Obecná charakteristika nekovů 2) Chlor a jeho sloučeniny 3) Vodík a jeho sloučeniny Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu.
6. Nekovy chlor a vodí k 1) Obecná charakteristika nekovů 2) Chlor a jeho sloučeniny 3) Vodík a jeho sloučeniny Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu.
Gymnázium Jana Pivečky a Střední odborná škola Slavičín. III/2 Inovace a zkvalitnění výuky prostřednictvím ITC
 Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
Název projektu Číslo projektu Název školy Autor Název šablony Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková
Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou.
 NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
NÁZVOSLOVÍ Oxidační číslo je rovno náboji, který by atom získal po p idělení všech vazebných elektronových párů atomům s větší elektronegativitou. -II +III -II +I O N O H Oxidační čísla se značí ímskými
-ičelý -natý -ičitý - ečný (-ičný) -istý -ný -itý -ový
 1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
1 Halogenidy dvouprvkové sloučeniny halogenů s jinými prvky atomy halogenů mají v halogenidech oxidační číslo -I 1) Halogenidy - názvosloví Podstatné jméno názvu je zakončeno koncovkou.. Zakončení přídavného
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
II. Chemické názvosloví
 II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
II. Chemické názvosloví 1. Oxidy jsou dvouprvkové sloučeniny kyslíku a jiného prvku. Názvy oxidů jsou dvouslovné. Tvoří je podstatné jméno oxid (postaru kysličník) a přídavné jméno utvořené od názvu prvku
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/9 Procvičování názvosloví v
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/9 Procvičování názvosloví v
1H 1s. 8O 1s 2s 2p - - - - - - H O H
 OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
OXIDAČNÍ ČÍSLO 1H 1s 8O 1s 2s 2p 1H 1s - - - - + - - + - - + - - H O H +I -II +I H O H - - - - Elektronegativita: Oxidační číslo vodíku: H +I Oxidační číslo kyslíku: O -II Platí téměř ve všech sloučeninách.
Názvosloví anorganických sloučenin
 Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
Názvosloví anorganických sloučenin Oxidační číslo udává náboj, kterým by byl atom prvku nabit, kdyby všechny elektrony vazeb v molekule patřily elektronegativnějším vazebným partnerům (atomům) udává náboj,
Příklad Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7
 Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Příklad 2.2.9. Sestavte rovnice následujících dějů: reakce hydroxidu sodného s kyselinou tetrahydrogendifosforečnou 4NaOH + H 4 P 2 O 7 Na 4 P 2 O 7 + 4H 2 O reakce dimerního oxidu antimonitého s kyselinou
Vyšší odborná škola, Obchodní akademie a Střední odborná škola EKONOM, o. p. s. Litoměřice, Palackého 730/1
 DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
DUM Základy přírodních věd DUM III/2-T30 Téma: Kyseliny Střední škola Rok: 2012 2013 Varianta: A Kyseliny Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník VÝKLAD jsou to sloučeniny KYSELINY ve vodných roztocích
CZ.1.07/1.5.00/ Zkvalitnění výuky prostřednictvím ICT. Halogeny VY_32_INOVACE_18_18. Mgr. Věra Grimmerová
 Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
Průvodka Číslo projektu Název projektu Číslo a název šablony klíčové aktivity CZ.1.07/1.5.00/34.0802 Zkvalitnění výuky prostřednictvím ICT III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce
VY_52_INOVACE_08_II.1.7_SOLI SOLI. PROCVIČOVÁNÍ a) PRACOVNÍ LIST
 VY_52_INOVACE_08_II.1.7_SOLI SOLI PROCVIČOVÁNÍ a) PRACOVNÍ LIST PRACOVNÍ LIST 1. Pojmenuj kyselinu a odděl aniontovou skupinu. H 2 SO 4 HClO 3 H 2 SO 3 H 2 CO 3 H 2 SiO 4 HCl HNO 3 H 2 Se HClO H 2 WO 4
VY_52_INOVACE_08_II.1.7_SOLI SOLI PROCVIČOVÁNÍ a) PRACOVNÍ LIST PRACOVNÍ LIST 1. Pojmenuj kyselinu a odděl aniontovou skupinu. H 2 SO 4 HClO 3 H 2 SO 3 H 2 CO 3 H 2 SiO 4 HCl HNO 3 H 2 Se HClO H 2 WO 4
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Halogeny prvky s 2 p 5
 Halogeny prvky s 2 p 5 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti
Halogeny prvky s 2 p 5 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K Ca Sc Ti
I II III IV V VI VII VIII I II III IV V VI VII VIII. Li Be B C N O F Ne. K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
 Halogeny prvky s 2 p 5 ACH 09 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K
Halogeny prvky s 2 p 5 ACH 09 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 I II III IV V VI VII VIII I II III IV V VI VII VIII 1 H n s n p He 2 Li Be B C N O F Ne 3 3 Na Mg (n-1) d Al Si P S Cl Ar 4 K
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Vzácné plyny, vodík, halogeny Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Předmět: LRR/CHPB1/Chemie pro biology 1 Vzácné plyny, vodík, halogeny Mgr. Karel Doležal Dr. Cíl přednášky: seznámit posluchače
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Inovace studia molekulární a buněčné biologie
 Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Investice do rozvoje vzdělávání Inovace studia molekulární a buněčné biologie Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Investice do rozvoje vzdělávání
Ukázky z pracovních listů B
 Ukázky z pracovních listů B 1) Označ každou z uvedených rovnic správným názvem z nabídky. nabídka: termochemická, kinetická, termodynamická, Arrheniova, 2 HgO(s) 2Hg(g) + O 2 (g) H = 18,9kJ/mol v = k.
Ukázky z pracovních listů B 1) Označ každou z uvedených rovnic správným názvem z nabídky. nabídka: termochemická, kinetická, termodynamická, Arrheniova, 2 HgO(s) 2Hg(g) + O 2 (g) H = 18,9kJ/mol v = k.
Kuchyňská sůl = chlorid sodný. Modrá skalice = síran měďnatý SO 4. Potaš = uhličitan draselný K 2 CO 3
 SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
SOLI Kuchyňská sůl Modrá skalice Potaš Kuchyňská sůl = chlorid sodný Na Cl Modrá skalice = síran měďnatý Cu SO 4 Potaš = uhličitan draselný K 2 CO 3 Chemické názvosloví solí Soli = sloučeniny odvozené
1 mol (ideálního) plynu, zaujímá za normálních podmínek objem 22,4 litru. , Cl 2 , O 2
 10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
10.výpočty z rovnic praktické provádění výpočtů z rovnic K výpočtu chemických rovnic je důležité si shrnout tyto poznatky: Potřebujem znát vyjadřování koncentrací, objemový zlomek, molární zlomek, molární
1) BEZKYSLÍKATÉ KYSELINY:
 KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
KYSELINY Jsou to látky, které se ve vodě štěpí na kationty H + a anionty (radikály) kyseliny (např. Cl -, NO 3-, SO 4 2- ). 1) BEZKYSLÍKATÉ KYSELINY: (koncovka -vodíková) Kyselina fluorovod vodíková chlorovod
Triviální Voda (H 2 O) Amoniak Soda. Systematické. Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík např. jodid draselný (KI)
 Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
Názvosloví anorganických sloučenin České názvosloví je jednoznačné Názvosloví anorganických sloučenin Triviální Voda (H 2 O) Amoniak Soda Systematické Většina názvů se skládá ze 2 slov Výjimka: např. chlorovodík
zadání příkladů 10. výsledky příkladů 7. 3,543 litru kyslíku
 zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
zadání Jaký bude objem vodíku při tlaku 105 kpa a teplotě 15 stupňů Celsia, který vznikne reakcí 8 gramů zinku s nadbytkem kyseliny trihydrogenfosforečné? Jaký bude objem vodíku při tlaku 97 kpa a teplotě
2. Laboratorní den Příprava jodičnanu draselného oxidačně-redukční reakce v roztoku. 15 % přebytek KMnO 4. jméno: datum:
 2. Laboratorní den 2.2.4. Příprava jodičnanu draselného oxidačně-redukční reakce v roztoku Str. 91 správné provedení oxidačně-redukční reakce v roztoku krystalizace produktu z připraveného roztoku soli
2. Laboratorní den 2.2.4. Příprava jodičnanu draselného oxidačně-redukční reakce v roztoku Str. 91 správné provedení oxidačně-redukční reakce v roztoku krystalizace produktu z připraveného roztoku soli
DOUČOVÁNÍ KVINTA CHEMIE
 1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
1. ÚVOD DO STUDIA CHEMIE 1) Co studuje chemie? 2) Rozděl chemii na tři důležité obory. DOUČOVÁNÍ KVINTA CHEMIE 2. NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN 1) Pojmenuj: BaO, N 2 0, P 4 O 10, H 2 SO 4, HMnO 4,
atomová hmotnost S + O 2 -> SO 2 Fe + S -> FeS
 PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
PRVKY ŠESTÉ SKUPINY - CHALKOGENY Mezi chalkogeny (nepřechodné prvky 6.skupiny) zařazujeme kyslík, síru, selen, tellur a radioaktivní polonium. Společnou vlastností těchto prvků je šest valenčních elektronů
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné
 Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Jméno autora: Mgr. Ladislav Kažimír Datum vytvoření: 03.04.2013 Číslo DUMu: VY_32_INOVACE_14_Ch_OB Ročník: I. Vzdělávací oblast: Přírodovědné vzdělávání Vzdělávací obor: Chemie Tematický okruh: Obecná
Chemické názvosloví anorganických sloučenin 2
 Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Chemické názvosloví anorganických sloučenin 2 Tříprvkové sloučeniny Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je. Mgr. Vlastimil Vaněk. Dostupné z Metodického portálu www.rvp.cz, ISSN:
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT-PZC_2_6 Test obecná chemie Střední
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT-PZC_2_6 Test obecná chemie Střední
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939. Název projektu: Investice do vzdělání - příslib do budoucnosti
 Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
Registrační číslo projektu: CZ.1.07/1.4.00/21.2939 Název projektu: Investice do vzdělání - příslib do budoucnosti Číslo přílohy: VY_číslo šablony_inovace_číslo přílohy Autor Datum vytvoření vzdělávacího
DUM VY_52_INOVACE_12CH01
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH01 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN
 NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN univerzální jazyk chemiků ( abeceda; chem. vzorce ; chem. rovnice ) české názvosloví je jedno z nejdokonalejších na světě (prof. Emil Votoček) OXIDAČNÍ ČÍSLO = náboj,
NÁZVOSLOVÍ ANORGANICKÝCH SLOUČENIN univerzální jazyk chemiků ( abeceda; chem. vzorce ; chem. rovnice ) české názvosloví je jedno z nejdokonalejších na světě (prof. Emil Votoček) OXIDAČNÍ ČÍSLO = náboj,
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA VY_32_INOVACE_03_3_07_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA Volné atomy v přírodě
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA VY_32_INOVACE_03_3_07_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou CHEMICKÁ VAZBA Volné atomy v přírodě
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Očekávané ročníkové výstupy z chemie 8. ročník
 Očekávané ročníkové výstupy z chemie 8. ročník Pomůcky: kalkulačka, tabulky, periodická tabulka prvků Témata ke srovnávací písemné práci z chemie (otázky jsou pouze orientační, v testu může být zadání
Očekávané ročníkové výstupy z chemie 8. ročník Pomůcky: kalkulačka, tabulky, periodická tabulka prvků Témata ke srovnávací písemné práci z chemie (otázky jsou pouze orientační, v testu může být zadání
Modul 02 - Přírodovědné předměty
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 - Přírodovědné předměty Hana Gajdušková Výskyt
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný
 Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
Ukázky z pracovních listů 1) Vyber, který ion je: a) ve vodném roztoku barevný b) nejstabilnější c) nejlépe oxidovatelný Fe 3+ Fe 3+ Fe 3+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ Fe 2+ Fe 6+ 2) Vyber správné o rtuti:
4. CHEMICKÉ ROVNICE. A. Vyčíslování chemických rovnic
 4. CHEMICKÉ ROVNICE A. Vyčíslování chemických rovnic Klíčová slova kapitoly B: Zachování druhu atomu, zachování náboje, stechiometrický koeficient, rdoxní děj Čas potřebný k prostudování učiva kapitoly
4. CHEMICKÉ ROVNICE A. Vyčíslování chemických rovnic Klíčová slova kapitoly B: Zachování druhu atomu, zachování náboje, stechiometrický koeficient, rdoxní děj Čas potřebný k prostudování učiva kapitoly
materiál č. šablony/č. sady/č. materiálu: Autor:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_02_19
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_02_19
p 8 prvky vzácné plyny
 p 8 prvky vzácné plyny He, Ne, Ar, Kr, Xe, Rn charakteristika: p prvky celkem 8 elektronů mají v orbitalech s a p proto jejich atomy netvoří vazby s jinými atomy byly považovány za nereaktivní = inertní,
p 8 prvky vzácné plyny He, Ne, Ar, Kr, Xe, Rn charakteristika: p prvky celkem 8 elektronů mají v orbitalech s a p proto jejich atomy netvoří vazby s jinými atomy byly považovány za nereaktivní = inertní,
Název školy: Číslo a název sady: klíčové aktivity: Jméno a příjmení autora: Mgr. Alexandra Šlegrová
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: Číslo a název sady: Téma: Jméno a příjmení autora: STŘEDNÍ ODBORNÁ
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
45. ročník. ŠKOLNÍ KOLO kategorie D. Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády
 Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 45. ročník 2008 2009 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH Národní institut dětí
Národní institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 45. ročník 2008 2009 ŠKOLNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH Národní institut dětí
DUM VY_52_INOVACE_12CH06
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH06 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH06 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Opakování
 Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Slabé vazebné interakce Opakování Co je to atom? Opakování Opakování Co je to atom? Atom je nejmenší částice hmoty, chemicky dále nedělitelná. Skládá se z atomového jádra obsahujícího protony a neutrony
Gymnázium, Brno, Elgartova 3
 Gymnázium, Brno, Elgartova 3 GE - Vyšší kvalita výuky CZ.1.07/1.5.00/34.0925 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Téma: Základy názvosloví Autor: Název: Mgr. Petra Holzbecherová Anorganické
Gymnázium, Brno, Elgartova 3 GE - Vyšší kvalita výuky CZ.1.07/1.5.00/34.0925 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Téma: Základy názvosloví Autor: Název: Mgr. Petra Holzbecherová Anorganické
Názvosloví anorganických sloučenin
 Názvosloví anorganických sloučenin CHEMICKÁ NOMENKLATURA Milan Haminger, BiGy Brno Chemické názvosloví Název chemické sloučeniny = slovní záznam chemického vzorce. Název anorganické sloučeniny: - podstatné
Názvosloví anorganických sloučenin CHEMICKÁ NOMENKLATURA Milan Haminger, BiGy Brno Chemické názvosloví Název chemické sloučeniny = slovní záznam chemického vzorce. Název anorganické sloučeniny: - podstatné
DUM VY_52_INOVACE_12CH19
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH19 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium
 VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium O a S jsou nekovy (tvoří kovalentní vazby), Se, Te jsou polokovy, Po je typický kov O je druhý nejvíce elektronegativní prvek vytváření oktetové
VI. skupina PS, ns 2 np4 Kyslík, síra, selen, tellur, polonium O a S jsou nekovy (tvoří kovalentní vazby), Se, Te jsou polokovy, Po je typický kov O je druhý nejvíce elektronegativní prvek vytváření oktetové
Základy analýzy potravin Přednáška 1
 ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
ANALÝZA POTRAVIN Význam a využití kontrola jakosti surovin, výrobků jakost výživová jakost technologická jakost hygienická autenticita, identita potravinářských materiálů hodnocení stravy (diety) Analytické
VY_32_INOVACE_30_HBEN11
 Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Sloučeniny síry Temacká oblast : Chemie anorganická chemie Datum vytvoření: 15. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný obsah: Sloučeniny síry sulfan, oxidy a
Chemické děje a rovnice procvičování Smart Board
 Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
SMĚSI. 3. a) Napiš 2 typy pevné směsi:... b) Napiš 2 typy kapalné směsi:... c) Napiš 2 typy plynné směsi:... krev
 1 SMĚSI 1. Zakroužkuj stejnorodé směsi: destilovaná voda slaná voda polévka med krev sirup 2. a) Směs kapaliny a pevné látky se nazývá:... b) Směs dvou nemísitelných kapalin se nazývá:... c) Směs kapaliny
1 SMĚSI 1. Zakroužkuj stejnorodé směsi: destilovaná voda slaná voda polévka med krev sirup 2. a) Směs kapaliny a pevné látky se nazývá:... b) Směs dvou nemísitelných kapalin se nazývá:... c) Směs kapaliny
ANODA KATODA elektrolyt:
 Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovnívh listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Názvosloví kyselin a hydroxidů
 Názvosloví kyselin a hydroxidů Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Kyseliny Kyseliny
Názvosloví kyselin a hydroxidů Dostupné z Metodického portálu www.rvp.cz, ISSN: 1802-4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze. Kyseliny Kyseliny
Výukový materiál zpracován v rámci operačního projektu. EU peníze školám. Registrační číslo projektu: CZ.1.07/1.5.00/34.0512
 Výukový materiál zpracován v rámci operačního projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0512 Střední škola ekonomiky, obchodu a služeb SČMSD Benešov, s.r.o. CHEMIE Anorganická
Výukový materiál zpracován v rámci operačního projektu EU peníze školám Registrační číslo projektu: CZ.1.07/1.5.00/34.0512 Střední škola ekonomiky, obchodu a služeb SČMSD Benešov, s.r.o. CHEMIE Anorganická
Acidobazické reakce. 1. Arrheniova teorie. 2. Neutralizace
 Acidobazické reakce 1. Arrheniova teorie Kyseliny látky schopné ve vodných roztocích odštěpit H + např: HCl H + + Cl -, obecně HB H + + B - Zásady látky schopné ve vodných roztocích poskytovat OH - např.
Acidobazické reakce 1. Arrheniova teorie Kyseliny látky schopné ve vodných roztocích odštěpit H + např: HCl H + + Cl -, obecně HB H + + B - Zásady látky schopné ve vodných roztocích poskytovat OH - např.
Autorem materiálu je Ing. Dagmar Berková, Waldorfská škola Příbram, Hornická 327, Příbram, okres Příbram Inovace školy Příbram, EUpenizeskolam.
 Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
Šablona č. I, sada č. 2 Vzdělávací oblast Vzdělávací obor Tematický okruh Téma Člověk a příroda Chemie Obecná a anorganická chemie Oxidy, sulfidy, halogenovodíky a halogenovodíkové kyseliny, redoxní reakce
Chemie. Mgr. Petra Drápelová Mgr. Jaroslava Vrbková. Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou
 Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
Chemie Mgr. Petra Drápelová Mgr. Jaroslava Vrbková Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH ROVNIC VY_32_INOVACE_03_3_18_CH Gymnázium, SOŠ a VOŠ Ledeč nad Sázavou VÝPOČTY Z CHEMICKÝCH
název soli tvoří podstatné a přídavné jméno
 OPAKOVÁNÍ název soli tvoří podstatné a přídavné jméno podstatné jméno charakterizuje anion soli a jeho náboj: chlorid Cl - přídavné jméno charakterizuje kation soli a jeho oxidační číslo: sodný Na + podstatné
OPAKOVÁNÍ název soli tvoří podstatné a přídavné jméno podstatné jméno charakterizuje anion soli a jeho náboj: chlorid Cl - přídavné jméno charakterizuje kation soli a jeho oxidační číslo: sodný Na + podstatné
PRVKY 17. (VII. A) SKUPINY
 PRVKY 17. (VII. A) SKUPINY TEST Úkol č. 1 Doplň následující text správnými informacemi o prvcích 17. skupiny: Prvky 17. skupiny periodické soustavy prvků jsou společným názvem označovány halogeny. Do této
PRVKY 17. (VII. A) SKUPINY TEST Úkol č. 1 Doplň následující text správnými informacemi o prvcích 17. skupiny: Prvky 17. skupiny periodické soustavy prvků jsou společným názvem označovány halogeny. Do této
Přehled zakončení názvů anorganických sloučenin a iontů
 Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
Hodnota kladného oxidačního čísla Přehled zakončení názvů anorganických sloučenin a iontů Zakončení příd. jména binární sl. hydroxidu soli kationtu Zakončení přídavného jména kyseliny jejího aniontu Zakončení
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
ANODA KATODA elektrolyt:
 Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
Ukázky z pracovních listů 1) Naznač pomocí šipek, které částice putují k anodě a které ke katodě. Co je elektrolytem? ANODA KATODA elektrolyt: Zn 2+ Cl - Zn 2+ Zn 2+ Cl - Cl - Cl - Cl - Cl - Zn 2+ Cl -
13. Chalkogeny kyslík a síra. AZ Smart Marie Poštová
 13. Chalkogeny kyslík a síra AZ Smart Marie Poštová m.postova@gmail.com Kyslík Výskyt: Je to nejrozšířenější prvek na Zemi. Ve vzduchu: (O 2 ) = 21 % Do vzduchu je uvolňován fotosyntézou. V litosféře:
13. Chalkogeny kyslík a síra AZ Smart Marie Poštová m.postova@gmail.com Kyslík Výskyt: Je to nejrozšířenější prvek na Zemi. Ve vzduchu: (O 2 ) = 21 % Do vzduchu je uvolňován fotosyntézou. V litosféře:
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. KRAJSKÉ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Seminář z chemie. RNDr. Jana Fauknerová Matějčková místnost: 617,
 Seminář z chemie RNDr. Jana Fauknerová Matějčková místnost: 617, 615 email: Jana.Matejckova@lf3.cuni.cz Semináře týden datum název semináře či praktika 1. 30.9. Názvosloví v anorganické chemii 2. 11.10.
Seminář z chemie RNDr. Jana Fauknerová Matějčková místnost: 617, 615 email: Jana.Matejckova@lf3.cuni.cz Semináře týden datum název semináře či praktika 1. 30.9. Názvosloví v anorganické chemii 2. 11.10.
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK
 CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
CHEMICKÉ REAKCE A HMOTNOSTI A OBJEMY REAGUJÍCÍCH LÁTEK Význam stechiometrických koeficientů 2 H 2 (g) + O 2 (g) 2 H 2 O(l) Počet reagujících částic 2 molekuly vodíku reagují s 1 molekulou kyslíku za vzniku
Otázky a jejich autorské řešení
 Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
Otázky a jejich autorské řešení Otázky: 1a Co jsou to amfoterní látky? a. látky krystalizující v krychlové soustavě b. látky beztvaré c. látky, které se chovají jako kyselina nebo jako zásada podle podmínek
NABÍDKA PRODUKTŮ PRO ŠKOLY
 NABÍDKA PRODUKTŮ PRO ŠKOLY Naše společnost Puralab s.r.o. se zaměřuje na výrobu chemických látek, především pak na výrobu vysoce čistých látek, nejčastěji anorganických solí kovů. Jako doplňkový sortiment
NABÍDKA PRODUKTŮ PRO ŠKOLY Naše společnost Puralab s.r.o. se zaměřuje na výrobu chemických látek, především pak na výrobu vysoce čistých látek, nejčastěji anorganických solí kovů. Jako doplňkový sortiment
1 Prvky 1. skupiny (alkalické kovy )
 1 Prvky 1. skupiny (alkalické kovy ) Klíčové pojmy: alkalický kov, s 1 prvek, sodík, draslík, lithium, rubidium, cesium, francium, sůl kamenná, chilský ledek, sylvín, biogenní prvek, elektrolýza taveniny,
1 Prvky 1. skupiny (alkalické kovy ) Klíčové pojmy: alkalický kov, s 1 prvek, sodík, draslík, lithium, rubidium, cesium, francium, sůl kamenná, chilský ledek, sylvín, biogenní prvek, elektrolýza taveniny,
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 2 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y
![[ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y [ ] d[ Y] rychlost REAKČNÍ KINETIKA X Y](/thumbs/78/77051926.jpg) REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
REAKČNÍ KINETIKA Faktory ovlivňující rychlost chemických reakcí Chemická povaha reaktantů - reaktivita Fyzikální stav reaktantů homogenní vs. heterogenní reakce Teplota 10 C zvýšení rychlosti 2x 3x zýšení
DUM VY_52_INOVACE_12CH04
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH04 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH04 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
