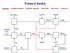
3. Oxid uhlenatý. 1. Syntézní plyn. 5. Formaldehyd. 4. Metanol. 2. Vodík. Základní organické sloučeniny
|
|
|
- Kateřina Bartošová
- před 8 lety
- Počet zobrazení:
Transkript
1 Základní organické sloučeniny 1. Syntézní plyn 2. Vodík 3. Oxid uhlenatý 4. Metanol 5. Formaldehyd 1
2 1. Syntézní plyn směs CO a H2 v různém poměru k syntéze některých organických poloproduktů metanol, aldehydy a alkoholy uhlovodíky (FT proces) Další pojmenování A. podle původu vodní plyn z uhlí a vodní páry (CO + H2) štěpný plyn z metanu a vodní páry (CO + 3 H2) B. podle použití metanolový syntézní plyn (CO + 2 H2) na výrobu metanolu oxonační plyn (CO + H2) pro hydroformylace Pozn. syntézní plyn stejný název i pro směs N2 + 3 H2 pro výrobu amoniaku 2
3 Metody 1. Parní štěpení (parní reforming) štěpení metanu (ZP), propanu, butanu štěpení nízkovroucích uhlovodíků do bodu varu 200 C (lehkých ropných frakcí) (propan, butan, nafta, primární benzíny) 2. Parciální oxidace parciální oxidace metanu parciální oxidace nízkovroucích uhlovodíků do bodu varu 200 C BASF, Texaco, Hydrocarbon Research, Shell (ParRef + ParOx) 3. Zplyňování uhlí Regulace složení syntézního plynu při zplyňování: nastavení poměru H2O a O2 dodatečná konverze CO + odstranění CO2 3
4 1.1 Parní reforming (štěpení vodní parou) Parní štěpení metanu, propanu, butanu Katalytické štěpení vodní parou CH4 + H2O = CO + 3 H2 Hr 0 = 205 kj/mol, C, 1,96 MPa další reakce CO + H2O = CO2 + H2 konverze CO (nižší teploty) CH4 + 2 H2O = CO2 + 4 H2 CH4 + CO2 = 2 CO + 2 H2 potřebné teplo se dodává z vnějšího zdroje katalyzátor: Ni, Co s přísadou MgO nebo Al2O3, Ce, Zr, Th nanesené na šamotu nebo jiném nosiči) zbytkový obsah metanu: 7 9 % hm. CH4 reaktor: trubkový reaktor otápěný spalováním zemního plynu 4
5 1.1.2 Parní štěpení níževroucích uhlovodíků Proces ICI (1962) surovina: níževroucí uhlovodíky o bodu varu 200 C výhody: nevznikají saze neklesá aktivita katalyzátoru odpadá regenerace katalyzátoru reaktor: trubkový reaktor, svislé trubky naplněné katalyzátorem a zvenku ohřívané katalyzátor: Ni katalyzátor: NiO na nosiči redukce vodíkem na Ni katalytické jedy: sloučeniny síry, arsenu, halogeny Postup 1. hydrogenační odsíření (desulfurizace) 2. primární reforming 3. sekundární refoming 5
6 Blokové schéma procesu ICI Hydrogenační odsíření Hydrogenační odsíření = přeměna síry na H2S ; (příklad hydrorafinace) Odstranění vzniklého H2S adsorpcí na ZnO Odsíření nutné kvůli primárnímu reformingu ; obsah S < 1 ppm Katalyzátor: CoO + MoO3 na nosiči Al2O3 teplota T = C Přídavek H2O (g) Ohřev ohřev na C Primární reforming Katalytické štěpení Katalyzátor: Ni + K2O na Al2O3 ; citlivý na síru Teplota C, p = 1,5 4 MPa ; p konc. CH4 Trubkový reaktor vyhřívaný spalováním zemního plynu Konstrukční a materiálové důvody neumožňují dosáhnout v trubkách naplněných katalyzátorem vyšší teplotu než 830 C zbytkový CH4 7 9 % hm. nutno sekundární reforming 6
7 Sekundární reforming Katalytické štěpení metanu vodní parou při teplotě 1200 C Potřebné teplo se kryje částečným spalováním plynu přidávaným O2 Vyzděný věžový/šachtový reaktor s termostabilním Ni katalyzátorem Využití tepla horkých plynů na výrobu páry zbytkový obsah CH4: 0,2 0,3 obj. % (při dalším zpracování již nevadí) 7
8 1.2 Parciální oxidace metanu nebo nízkovroucích uhlovodíků 2.1 Parciální oxidace metanu CH4 + 1/2 O2 = CO + 2 H2 vedlejší reakce CH4 + 2 O2 CO2 + 2 H2O úplné spálení CH4 = C + 2 H2 úplný rozklad 2.2 Parciální oxidace nízkovroucích uhlovodíků topný olej, mazut, primární benzín 2 CnH2n+2 + n O2 2n CO + 2.(n + 1) H2 termická oxidace ; 1400 C, p = 2 4 MPa ; nutno speciální hořák výhoda: nekatalytický proces nevadí síra není nutno odsiřovat nevýhody: vyžaduje zdroj kyslíku (zařízení na zkapalňování vzduchu) vedlejší produkt: saze (odstranění vypírkou vodou) 8
9 Proces SHELL kombinace termická parciální oxidace + parní reforming autotermický proces (teplo potřebné pro reforming se získává parciální oxidací) surovina: uhlovodíky (metan těžký topný olej) přednost: lze použít různé ropné frakce 1. Spalovací část reaktoru 2. Konverzní část reaktoru Parciální oxidace uhlovodíku Bezkatalytické spalování části předehřáté suroviny podstechiometrickým množstvím kyslíku Teplota T = C ; p = 3 8 MPa Použití oleje: vznik sazí při spalování odstranění vypírkou vodou nebo olejem odpadající saze se zpracovávají s topným olejem na pelety vzniklé teplo se spotřebuje na vlastní refoming Parní reforming 9
10 1.3 Zplyňování uhlí reakce: redukce vody uhlíkem kombinace: exotermické spalování uhlíku + endotermní tvorba směsi CO + H2 (vodního plynu) reakční teploty: C, potřebné teplo dodáváno částečným spalováním suroviny na vytvoření potřebného tepla se spálí % uhlí hlavní reakce 2 C + O2 = 2 CO Hr 0 = 222 kj/mol C + H2O = CO + H2 Hr 0 = kj/mol další reakce Boudouardova reakce C + CO2 = 2 CO Hr 0 = kj/mol Konverzní reakce CO + H2O = CO2 + H2 Hr 0 = 42 kj/mol Hydrogenační zplyňování C + 2 H2 = CH4 Hr 0 = 75 kj/mol Metanizace (redukční tvorba metanu) CO + 3 H2 = CH4 + H2O Hr 0 = 205 kj/mol 10
11 Řízení procesu < 900 C kineticky C vnitřní difúze > 1100 C vnější difúze Rozdělení technologií podle způsobu přívodu tepla allotermické autotermické podle mechanického uspořádání s nepohyblivou vrstvou s unášenou vrstvou s fluidní vrstvou Vývoj hydrogenační zplyňování (Rheinbraun) zplyňování vodní parou (Bergbau Forschung) zplyňování v tavenině Na2CO3 (Kellog) SNG syntetický zemní plyn (substitute natural gas) proces: Synthane, Bi gas, Hy Gas, Hydrane 11
12 Winklerův proces 1931 Leuna surovina: jemnozrnné nespékavé uhlí hnědé uhlí: H2 : CO = 1,4 : 1 médium: vzdušný kyslík + vodní pára teplota C, p = 100 kpa technologie: fluidní vrstva Koppers Totzek 1952 Finsko surovina: práškové uhlí, ropný koks složení: % H2 + CO médium: kyslík + vodní pára teplota C, p = 100 kpa vysoká teplota potlačena tvorba kondenzovatelných uhlovodíků technologie: unášená vrstva 12
13 Tlakové zplyňování LURGI 30. léta 20. století surovina: kusové uhlí, hnědouhelné brikety médium: kyslík + vodní pára ; přívod spodem do uhelného lože tlak: 2 3 MPa tvorba koláče při spékání, který se musí rozbíjet rameny teplota: 1. odplyňování C 2. vlastní zplyňování 1200 C technologie: uhelná vrstva kontinuálně dopravovaná do reaktoru, posunována a dopravována otočnými rameny promíchávaná vrstva za tlaku 2 3 MPa výhody: stlačený surový plyn Tlakové zplyňování LURGI průměrné složení: uhlí Ruhr (SRN): 9 11 % obj. CH % obj. CO % obj. H % obj. CO2 13
14 1.4 Čištění syntézního plynu Úpravy: odstranění H2S, COS, CO2 Důvody: síra: katalytický jed pro mnoho katalyzátorů CO2: reakce při procesu, tvorba polštářů inertního plynu v zařízení Postupy čištění A. Absorpce fyzikální (F) chemická (CH) fyzikálně-chemická (F+CH) B. Adsorpce 14
15 A. Absorpce Proces RECTISOL (Lurgi) tlakové praní metanolem (F) Proces SELEXOL (Allied Chemical Corp.) využití tlakové závislosti rozpustnosti plynů v dimethyleterech polyglykolů (F, polyethylenglykoldimethyleter) Proces SULFINOL (Shell) směs sulfonal + diisopropanolamin + voda (F+CH) Proces PURISOL (Lurgi) N-methylpyrrolidon (F) Proces CATACARB (Benfield) tlakové praní K2CO3 (CH) Proces ALKAZID (BASF) alkalické soli aminokarboxylových kyselin (např. kyseliny N-methylaminopropanové ; monomethylaminopropionan draselný) (CH) Proces FLUOR Solvent propylenkarbonát (F) Další absorpční činidla: organické aminy (mono-, di-, trietanolamin), diglykolamin (CH) B. Adsorpce molekulová síta regenerace: odplyňování za zvýšené teploty a sníženého tlaku Odstranění CO2 tlakové praní ethanolamin 15
16 1.5 Konverze oxidu uhelnatého vodní parou CO (g) + H2O (g) = CO2 (g) + H2 (g) Termodynamická a kinetická analýza Td.: T výtěžek Kin.: snížení teploty vhodné katalyzátory Vysokoteplotní konverze t = C katalyzátor: směs Fe2O3 Cr2O3 ; citlivé na síru, nečistoty kat. Co Mo ; necitlivé k síře výstupní obsah: 3 4 % obj. CO Nízkoteplotní konverze t = C katalyzátor: kat. CuO ZnO ; silně citlivý na síru, obsah síry musí být < 0,1 ppm výstupní obsah: < 0,3 % obj. CO používá se, pokud se syntézní plyn používá jako zdroj vodíku 16
17 1.6 Výroba čistých složek A. Oxid uhelnatý CO 1. Parciální kondenzace a nízkoteplotní destilace 2. Absorpce ve vodném roztoku měďných solí 1. Parciální kondenzace a nízkoteplotní destilace nevýhoda: nesmí obsahovat dusík (pn2 pco) dusík nutno odstranit před zplyňováním nebo štěpením postup 1. Snížení CO2 na max. 50 ppm ethanolamin + voda 2. Odstranění zbytku CO2 a vody molekulové síto Pozn. nedokonalé odstranění by způsobilo zamrzání nízkoteplotních zařízení. 3. Parciální kondenzace CH4 a CO (-180 C, p = 4 MPa) 4. Frakční destilace CH4 a CO (CO těkavější složka) p = 0,25 MPa, destilát: CO (max. 0,1 % CH4) 17
18 2. Absorpce ve vodném roztoku měďných solí A.Využití tlakově závislé reverzibilní tvorby [Cu(CO)] + Postup 1. Absorpce CO při tlaku až 30 MPa ve vodném roztoku CuCl v HCl v roztoku soli Cu/NH3/H2O (amoniakální roztok Cu2CO3) (postup Uhde) v roztoku mravenčanu měďného v roztoku CuCl a AlCl3 v toluenu (proces COSORB (Tenneco)) 2. Desorpce snížení tlaku, zahřátí na C B.Využití teplotní závislosti tvorby karbonylového komplexu s Cu[AlCl4] v toluenu 1. Absorpce CO roztok CuCl a AlCl3 v toluenu (proces COSORB (Tenneco)) teplota 25 C, p = 2 MPa 2. Desorpce zvýšení teploty: C, snížení tlaku: p = 0,1 0,4 MPa 3. Nutné předčištění: odstranit vodu (hydrolýza AlCl3), acetylen (tvorba acetylidu), olefiny 18
19 2. Vodík H2 Vlastnosti tnv = - 252,8 C ; tt = - 259,2 C ; Tk = - 239,9 C ; pk = 1,32 MPa vysoká hustota energie ρ E = 121 kj/g (CH4: ρ E = 50,3 kj/g ) bezbarvý, nejedovatý, bez chuti a zápachu dobrá transportovatelnost (kryogenně 253 C, vodíkovod Rhein-Ruhr 200 km) skladovatelnost (hydridy y Me + x H2 = MeyH2x + H ; TiFeH1,95, MgNiH4,2) Použití syntéza amoniaku (56 %) petro (25 % ; hydrokrakování, hydrotreating (hydrogenační odsíření) výroba metanolu (7 %) organická (hydrogenace, syntéza anilinu (10 %), cyklohexan) potravinářský průmysl (hydrogenace (ztužování tuků)) metalurgie (přímá redukce železné rudy na houbové železo, redukční nebo ochranný plyn při temperovacích procesech) 19
20 Metody 1. Izolace ze syntézního plynu Parní reforming Parciální oxidace metanu nebo nízkovroucích uhlovodíků Zplyňování uhlí 2. Vedlejší produkt z koksárenství, zpracování ropy, petro 3. Elektrolýza vody 1. Izolace ze syntézního plynu Postup: 1. Odstranění síry (H2S, COS) 2. Konverze CO vodní parou na CO2 a H2 3. Odstranění CO2 tlakovým praním 4. Dočišťování methanizací odstranění stop CO reakcí s vodíkem na CH4 + H2O na Ni katalyzátoru ( C) 20
21 2. Vedlejší produkt z koksárenství, zpracování ropy, petro Vedlejší produkt zpracování ropy (katalytické reformovací procesy) petrochemické a chemické procesy (syntéza olefinů, acetylenu, styrenu, acetonu) výroba koksu (koksárenský plyn: obj. % H2, obj. % CH4) elektrolýza chloridů Izolace vodíku z rafinérských plynů frakční nízkoteplotní kondenzace adsorpce na molekulových sítech Izolace vodíku z koksárenských plynů postup: 1. postupná kondenzace jednotlivých plynných frakcí při stálé nižších teplotách 2. dočištění vodíkové frakce od zbytků CO a CH4 vypírkou kapalným dusíkem 21
22 3. Elektrolýza vody Elektrolýza s alkalickým elektrolytem (25 30 % KOH) anoda 2 (OH) H2O + 1/2 O2 + 2 e E 0 = 0,401 V poniklované anody katoda 2 H2O + 2 e H2 + 2 (OH) E 0 = 0,828 V železné katody teoretické rozkladné napětí 1,239 V praktické rozkladné napětí 1,9 2,3 V (efekt přepětí) ; σ = 1 ka/m 2 teplota elektrolýzy C měrná spotřeba energie pro 1 m 3 vodíku a 1/2 m 3 kyslíku je 4,5 5,45 kwh Tlaková elektrolýza : spotřeba energie 20 % Bipolární elektrolyzéry bipolární elektrodové desky jedna strana desky je anoda v jednom článku a druhá strana katodou v druhém článku ke zdroji napětí je připojena první a poslední elektroda elektrolyzéru výhody: menší zastavěná plocha, menší počet přívodů 22
23 3. Oxid uhelnatý Syntézy s CO/(CO + H2) výroba metanolu (syntézní plyn) výroba kyseliny akrylové karbonylace acetylenu za přítomnosti vody nebo alkoholů C2H2 + CO + H2O (kat) C3H4O2 výroba kyseliny octové (+ estery, vinylacetát, acetát celulózy) karbonylace metanolu CH3OH + CO (kat) CH3COOH výroba butanolu karbonylace propylenu C3H6 + 3 CO + 2 H2O (kat) C4H10O 23
24 Použití: Hydroformylace Karbonylace Kochova reakce Hydroformylace (oxonace) výroba aldehydů z olefinů (nejčastěji C2 C20 ; např. etylen, propylen), CO a H2 prodloužení řetezce olefinů o jeden uhlíkový atom adicí CO a H2 za vzniku aldehydu produkty: směsi aldehydů použití aldehydů: (meziprodukty pro výrobu alkoholů, karboxylových kyselin (např. kyselina octová, máselná), primárních aminů (reakce s H2, NH3) příklady aldehydů: formaldehyd, acetaldehyd (meziprodukt pro výrobu kyseliny octové, zralé ovoce), benzaldehyd 24
25 Karbonylace (Reppeho karbonylace) reakce olefinů s CO a nukleofilními činidly (činidla obsahující volné elektronové páry (např. H2O, NH3, (OH) - ) katalyzovaná karbonyly kovů (Ni (Ni(CO)4), Co, Fe, Rh, Ru, Pb) za vzniku karboxylových kyselin nebo jejich derivátů příklad: karbonylace metanolu za vzniku kyseliny octové (CH3OH + CO (kat) CH3COOH) speciální případ: hydrokarboxylace (reakce s CO a H2O) karbonylace etylenu za vzniku k. propionové (C2H4 + CO + H2O (kat) CH3CH2COOH) Kochova reakce reakce olefinů s CO a H2O katalyzovaná protickými katalyzátory (H + ; H2SO4, HF, H3PO4 nebo jejich směsi s BF3, SbF5 (účinnou složkou je pak komplex H[SbF6] za vzniku karboxylových kyselin s karboxylovou skupinou vázanou na terciární uhlík 25
26 4. Metanol CH3OH Použití výroba formaldehydu ( výroba formaldehydových plastů) výroba DMT (dimetyltereftalát) (výchozí surovina pro výrobu polyesterů, např. PET (polyethylenglykoltereftalát) výroba methylmetakrylátu Výhledy surovina pro další syntézy výroba uhlovodíků katalyzovanou kondenzací (směs aromatických a alifatických uhlovodíků C4 C10 (vysooktanový benzín) výroba etylenu (C2H4) a propylenu (C3H6) pomocí katalyzátoru při odštěpení vody výroba etanolu (event. výroba etylenu dehydratací etanolu) CH3OH + CO + 2 H2 (kat) C2H5OH + H2O C2H5OH C2H4 + H2O 26
27 nosič energie přímo jako palivo syntetický zemní plyn (endotermické štěpení metanolu) 4 CH3OH = 3 CH4 + CO2 + 2 H2O H 0 = kj/mol MTBE (methyl-terc.butyleter ; CH3OC(CH3)3) derivát metanolu * adice metanolu na isobutylen katalyzovaná protony CH3OH + C4H8 = CH3OC(CH3)3) H 0 = 37 kj/mol * vysoké oktanové číslo antidetonační přísada * výhody(proti MeOH): nižší obsah CO ve výfukových plynech téměř nerozpustný ve vodě ( nezpůsobuje oddělování vodní fáze v nádržích) Pozn. PET: esterifikace tereftalové kyseliny (TPA ; oxidace p-xylenu v kapalné fázi) metanolem nebo reesterifikace DMT s přebytkem etylenglykolu 27
28 Výroba výroba ze syntézního plynu s řadou alternativních postupů s různými katalyzátory CO + 2 H2 = CH3OH H 0 = 92 kj/mol syntézní plyn ze zemního plynu bohatého na metan (složení CO + 3 H2) se musí upravit přídavkem CO2: CO + 2 H2 = CH3OH H 0 = 92 kj/mol CO2 + 3 H2 = CH3OH + H2O H 0 = 50 kj/mol společný znak katalyzátorů: směs modifikovaných oxidů kovů na bázi ZnO + Cr2O3 nebo CuO + ZnO použití katalyzátorů na bázi oxidů mědi umožňuje snížení tlaku x extrémní citlivost na síru (< 1 ppm) Procesy Vysokotlaké p MPa Středotlaké p MPa Nízkotlaké p 4 10 MPa 28
29 A. Vysokotlaký proces BASF (1923) Mittasch (1913) teplota C, tlak p 34 MPa katalyzátor: ZnO + Cr2O3 (Zn : Cr = 70 : 30) vedlejší produkty odolný proti běžným katalytickým jedům (výdrž až několik let) dimetyleter, metylformiát, vyšší alkoholy odstranění ve dvou destilačních kolonách (pro nízkovroucí podíly a vysokovroucí podíly) potlačení tvorby: doba styku s katalyzátorem 1 2 s x nedosáhne se rovnováhy (konverze při 1 průchodu % nutnost recirkulace plynu + nutnost kondenzace metanolu při recirkulaci) reaktor quench reaktory (chlazení přívodem studené směsi plynů do vrstvy katalyzátoru) 29
30 B. Vysokotlaký proces UK Wesseling teplota 350 C, tlak p 30 MPa katalyzátor: ZnO + Cr2O3 (Zn : Cr = 70 : 30) parciální tlak CO pco 1,3 MPa výhody: nižší recykl nedochází k tvorbě Fe (CO)5, který katalyzuje metanizační reakci lze použít nezušlechtěnou uhlíkovou ocel velmi čistý metanol s nepatrným podílem vedlejších produktů reaktor patrový reaktor (katalyzátor ve vrstvách) 30
31 C. Nízkotlaký proces ICI (1966) teplota C, tlak p = 5 10 MPa katalyzátor: oxidy Cu, Zn, Al ( syntézní plyn prostý S, Cl) produkt velmi čistý metanol (až 99,99 %) D. Nízkotlaký proces Lurgi (1973) teplota C, tlak p = 4 5 MPa katalyzátor: CuO + ZnO ( syntézní plyn prostý síry) reaktor trubkový reaktor (katalyzátor v trubkách) řízení teploty vroucí vodou ; výroba páry (soběstačnost v dodávce páry) 31
32 E. Středotlaké procesy Proces Katalyzátor T ( C) p (MPa) NISUI TOPSOE CuO + ZnO + Cr2O VULCAN ZnO + Cr2O PRITCHARD CuO Catalysts and Chem Inc. CuO + ZnO na Al2O BASF CuO + ZnO na Al2O
33 5. Formaldehyd HCHO Použití dezinfekční prostředek (vodný roztok) konzervační činidlo (vodný roztok) výroba plastů (kondenzace s fenoly, močovinou nebo melaminem Metody 1. Výroba z metanolu Dehydrogenace metanolu (dehydrogenace/oxohydrogenace) Oxidace metanolu (proces Formox) 2. Výroba z alkanů (metan butan) 33
34 A. Dehydrogenace metanolu BASF, Degussa, DuPont, ICI, Monsanto dehydrogenace metanolu na stříbrném nebo měděném katalyzátoru CH3OH = HCHO + 2 H2 H 0 = + 84 kj/mol katalyzátor: krystaly stříbra 0,5 3 mm stříbrné síťky (vrstva několik cm) stříbro na karborundovém nosiči citlivost na přítomnost jiných kovů, halogenů, síry regenerace elektrolytická regenerace katalyzátoru (anodické rozpouštění stříbra a jeho vyloučení na katodě) postup: reaktor (krátká doba styku s katalyzátorem) + rychlé ochlazení na 150 C (během cca 0,1 0,3 s pro potlačení tepelného rozpadu HCHO na CO a H2) protiproudé vyprání vodou (absorber) destilace (koncentrace na %) produkt zbytkový obsah 1 2 % hm. MeOH (stabilizuje FMD proti polymeraci) 1 t FMD 1,22 t MeOH vedlejší produkty: CO, CO2 výtěžek formaldehydu 87,5 %, selektivita až 91 %, 34
35 Modifikace: oxyhydrogenace sekundární spalování vodíku vzdušným kyslíkem pro získání tepla potřebného pro hydrogenaci CH3OH = HCHO + 2 H2 H 0 = + 84 kj/mol H2 + 1/2 O2 = H2O H 0 = 243 kj/mol sumárně CH3OH + 1/2 O2 = HCHO + H2O H 0 = 159 kj/mol podstechiometrické množství vzduchu v množství pro zajištění adiabatického provozu tak, aby T = konst. ± 5 C v rozsahu C C: konverze neúplná nutno recyklovat C + přídavek vody: úplná konverze Přídavek vody zvýšení konverze metanolu omezení rekrystalizace stříbra zmenšení tvorby sazí na povrchu katalyzátoru prodloužení životnosti katalyzátoru (na 2 4 měsíce ; omezení poklesu aktivity v důsledku slinování krystalků katalyzátoru rozžhaveného do slabě červeného žáru) 35
36 B. Oxidace metanolu proces FORMOX CH3OH + 1/2 O2 = HCHO + H2O H 0 = 159 kj/mol katalyzátor: molybdenan železitý Fe(MoO4)3 příprava: směs MoO3 (81 82%) + Fe2O3 (18 19%) + promotory (oxidy Cr, Co) citlivost na přehřátí (sublimace MoO3 ; úlet molybdenové modře) životnost: až 2 roky reaktor: trubkový katalytický reaktor chlazený kapalinou postup: páry metanolu s přebytkem vzduchu při teplotě C do reaktoru rychlé ochlazení na 100 C vyprání vodou v probublávané koloně (umožňuje koncentraci % regulací množstvím přiváděné vody) konverze metanolu %, selektivita pro formaldehyd % vedlejší produkty: CO, CO2, kyselina mravenčí (odstraní se na koloně s iontoměniči) 36
37 Výhody nízká teplota ( menší nároky na materiál) větší koncentrace formaldehydu bez destilace Nevýhody potřeba velkého přebytku vzduchu (investiční náklady, spotřeba energie ) odplyny obsahující formaldehyd nejsou hořlavé speciální postupy odstraňování zbytkového produktu 37
38 6. Fischer Tropschova syntéza katalytická hydrogenace CO v přítomnosti kobaltového nebo železného katalyzátoru za vzniku směsi olefínů a parafínů, s různým počtem uhlíků, počínaje metanem až po vysokomolekulární uhlovodíky Kobaltové katalyzátory teplota 200 C, normální tlak nebo podtlak CO + 2 H2 = CH2 + H2O H 0 = 164,7 kj/mol n CO + (2n + 1) H2 = CnH2n+2 + n H2O katalyzátor příprava: směs MoO3 (81 82%) + Fe2O3 (18 19%) + promotory (oxidy Cr, Co) značná hydrogenační aktivita olefiny parafiny životnost: až 2 roky 1 Nm g uhlovodíků problémy: citlivost na přehřátí (sublimace MoO3 ; úlet molybdenové modře) udržování konstantní teploty (± 1 C) špatná tepelná vodivost katalyzátoru problém s odvodem tepla zatížení pouze 100 m 3 /m 3 kat.h 38
39 Železné katalyzátory teplota 320 C, tlak 2,5 MPa 2 CO + H2 = CH2 + CO2 H 0 = 204,4 kj/mol n CO + (2n + 1) H2 = CnH2n+2 + n H2O katalyzátor méně hydrogenační produkty: převážně olefiny parafiny lepší tepelná vodivost katalyzátoru než Co menší problém s odvodem tepla 39
40 Reaktory pevné katalytické lože pohyblivé katalytické lože Kölbel Rheinpreussen katal.lože: katalyzátor v olejové suspenzi (břečkový způsob ; spolu s kapal. produkty) odvod tepla: trubkový systém v reaktoru s tlakovou horkou vodou (regulace změnou tlaku) možno až 6 8 x větší zatížení než u Co katalyzátorů produkt: 80 % benzínu a zkapalnitelného plynu s obsahem % olefinů 50 % plynového oleje s obsahem % olefinů Ruhr Lurgi katal.lože: pevně uložený katalyzátor odvod tepla: chladící plochy v reaktoru 40
41 Fluidní způsob (Hydrocol process) katal.lože: jemný železný prach ve vznosu (fluidace syntézními plyny) odvod tepla: výměníky tepla v reaktoru Srovnání: konvenční x GTL diesel GTL gas-to liquid Parametr Konvenční diesel FT diesel teplota varu ( C) hustota (kg/m 3 ) (15 C) síra (ppm obj.) < 1 aromáty (% obj.) 30 < 0,1 cetanové číslo > 51 > 70 CFPP ( C) CP ( C) 8 (zimní nafta) 15 CFPP (cold filter plug point), CP (cloud point) 41
42 Firma Syngas Fischer Tropsch BP BP/Davy Compact Reformer BP fixed-bed process / Co catalyst ConocoPhillips Catalytic Partial Oxidation (CoPox) Slurry phase process / Co catalyst ENI/IFP ENI/IFP slurry phase process Co catalyst Exxon Mobil EM Fluidized Combined reforming Autothermal Reforming Haldor Topsoe EM AGC-21 slurry phase process Co catalyst RenTech Slurry phase process / Fe catalyst SASOL SASOL slurry phase process Co catalyst Shell Shell Partial OXidation Shell fixed-bed process Co catalyst Statoil Slurry phase process / Co catalyst Syntroleum Syntroleum Air Blown Autothermal Reforming Slurry phase process / Co catalyst Radek
Technické plyny. kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny)
 Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Technické plyny kapalný vzduch kyslík dusík vzácné plyny vodík (syntézní plyny) Kapalný vzduch složení vzduchu Před zkapalněním odstranění nežádoucích složek, např. vodní pára, CO 2, prach Zkapalňování
Ropa Kondenzované uhlovodíky
 Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Nejdůležitější surovina pro výrobu organických sloučenin Nejvýznamnější surovina světové ekonomiky Výroba energie Chemické zpracování - 15 % Cena a zásoby ropy (70-100 let) Ropné krize Nutnost hledání
Zplyňování biomasy. Sesuvný generátor. Autotermní zplyňování Autotermní a alotermní zplyňování
 Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Zplyňování = termochemická přeměna uhlíkatého materiálu v pevném či kapalném skupenství na výhřevný energetický plyn pomocí zplyňovacích médií a tepla. Produktem je plyn obsahující výhřevné složky (H 2,
Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt. Presentace vypracovaná pro ČAPPO Praha 2.10.2002
 Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt Presentace vypracovaná pro ČAPPO Praha 2.10.2002 GTL (Gas-to-Liquid) představuje obecný pojem používaný pro technologie konverze plynu na kapalné produkty
Ing.Hugo Kittel, CSc., MBA, ČeR a.s. Kralupy n.vlt Presentace vypracovaná pro ČAPPO Praha 2.10.2002 GTL (Gas-to-Liquid) představuje obecný pojem používaný pro technologie konverze plynu na kapalné produkty
11. Zemní plyn jako energetická a chemická surovina. Ing. Tomáš Hlinčík, Ph.D.
 11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
11. Zemní plyn jako energetická a chemická surovina Ing. Tomáš Hlinčík, Ph.D. Zpracování zemního plynu Nepřímá přeměna methanu syntézní plyn (chemikálie, paliva) - výroba vodíku pro syntézu amoniaku -
zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek)
 Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Ropa štěpné procesy zpracování těžkých frakcí na motorová paliva (mazut i vakuový zbytek) typy štěpných procesů: - termické krakování - katalytické krakování - hydrogenační krakování (hydrokrakování) podmínky
Průmysl dusíku. amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin. NaClO NaOH CO(NH 2 ) 2.
 Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Průmysl dusíku amoniak - kyselina dusičná - dusičnan amonný - močovina - chloramin - hydrazin CO(NH 2 ) 2 NaClO NaOH NH 2 Cl N 2 H 4 methan CO 2 (uhlí, ropa) H 2 NH 3 NO 2 HNO 3 O 2 vzduch voda vzduch
Amoniak. 1913 průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
H H C C C C C C H CH 3 H C C H H H H H H
 Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Alkany a cykloalkany sexta Martin Dojiva uhlovodíky obsahující pouze jednoduché vazby obecný vzorec alkanů: C n 2n+2 cykloalkanů: C n 2n homologický přírůstek C 2 Dělení alkanů přímé větvené u větvených
Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 4. přednáška Rafinace pohonných hmot, zpracování sulfanu, výroba vodíku
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN. Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc.
 TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
TERMICKÉ PROCESY PŘI VYUŽITÍ ALTERNATIVNÍCH SUROVIN Most, 13.6.2013 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH PRINCIPY POUŽÍVANÝCH TERMOCHEMICKÝCH PROCESŮ VELKOKAPACITNÍ REALIZACE TERMOCHEMICKÝCH PROCESŮ
C1 Chemie Nepřímá přeměna methanu Výroba syntézního plynu Zemní plyn Primární benzíny Těžký topný olej Tuhá paliva Využití Výroba chemikálií Paliva
 Methan (zemní plyn) - prokázaná světová zásoba = 1,5.10 14 m 3 - předpoklad zhruba na 60-70 let - 93 % - palivo (topení, výroba energie) - 7 % - chemický průmysl Doprava zemního plynu - plynovody (6-8
Methan (zemní plyn) - prokázaná světová zásoba = 1,5.10 14 m 3 - předpoklad zhruba na 60-70 let - 93 % - palivo (topení, výroba energie) - 7 % - chemický průmysl Doprava zemního plynu - plynovody (6-8
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE. Ing. Stanislav HONUS
 NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
NEKONVENČNÍ ZPŮSOBY VÝROBY TEPELNÉ A ELEKTRICKÉ ENERGIE Ing. Stanislav HONUS ORGANICKÝ MATERIÁL Spalování Chemické přeměny Chem. přeměny ve vodním prostředí Pyrolýza Zplyňování Chemické Biologické Teplo
Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc.
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zplyňování a zkapalňování uhlí Doc. Ing. Karel Ciahotný, CSc. Zplyňování uhlí technologický proces přeměny pevných
Fosfor a sloučeniny fosforu. Suroviny. Sloučeniny. kalcinace pro oddělení organických. Kyselina trihydrogenfosforečná H3PO4
 Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Fosfor a sloučeniny fosforu Sloučeniny Fosfor bílý Kyselina trihydrogenfosforečná H3PO4 Suroviny Apatit Ca5 (PO4)3(F, OH, Cl) fluoroapatity úpravy mletí promývání sítování magnetické oddělování oxidů železa
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Dusík a sloučeniny dusíku. 1. Amoniak NH3. Sloučeniny. Haber Bosch Mitaschův postup. amonné soli chladivo. močovina anorganické a organické syntézy
 Dusík a sloučeniny dusíku Sloučeniny Amoniak NH3 Kyselina dusičná HNO3 Kyanovodík Močovina Hydroxylamin ( kaprolaktam polyamid 6) 1. Amoniak NH3 Použití: výroba HNO3 plasty a vlákna močovina anorganické
Dusík a sloučeniny dusíku Sloučeniny Amoniak NH3 Kyselina dusičná HNO3 Kyanovodík Močovina Hydroxylamin ( kaprolaktam polyamid 6) 1. Amoniak NH3 Použití: výroba HNO3 plasty a vlákna močovina anorganické
Omezování plynných emisí. Ochrana ovzduší ZS 2012/2013
 Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2012/2013 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
EVROPSKÝ PARLAMENT C6-0267/2006. Společný postoj. Dokument ze zasedání 2003/0256(COD) 06/09/2006
 EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
EVROPSKÝ PARLAMENT 2004 Dokument ze zasedání 2009 C6-0267/2006 2003/0256(COD) CS 06/09/2006 Společný postoj Společný postoj Rady k přijetí nařízení Evropského parlamentu a Rady o registraci, hodnocení,
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Charakteristika Teorie kyselin a zásad. Příprava kyselin Vlastnosti + typické reakce. Významné kyseliny. Arrheniova teorie Teorie Brönsted-Lowryho
 Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Petra Ustohalová 1 harakteristika Teorie kyselin a zásad Arrheniova teorie Teorie Brönsted-Lowryho Příprava kyselin Vlastnosti + typické reakce Fyzikální a chemické Významné kyseliny 2 Látky, které ve
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: Číslo šablony: CZ.1.07/1.5.00/34.0410 III/2 Inovace a zkvalitnění výuky prostřednictvím ICT. Název materiálu: Fosilní zdroje
Omezování plynných emisí. Ochrana ovzduší ZS 2010/2011
 Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
Omezování plynných emisí Ochrana ovzduší ZS 2010/2011 1 Úvod Různé fyzikální a chemické principy + biotechnologie Principy: absorpce adsorpce oxidace a redukce katalytická oxidace a redukce kondenzační
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N VÝROBA MTBE
 CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
CHEMICKÉ TECHNOLOGIE PRO PROCESNÍ INŽENÝRSTVÍ N409059 VÝROBA MTBE Fyzikální a chemické vlastnosti Suroviny Reakce Technologie Dvoustupňová výroba Jednostupňová výroba Charakteristiky technologií Zdroje
Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 3. přednáška Termické a katalytické krakování a hydrokrakování těžkých
Vodík jako alternativní ekologické palivo. palivové články a vodíkové hospodářství
 Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
Vodík jako alternativní ekologické palivo palivové články a vodíkové hospodářství Charakteristika vodíku vodík je nejrozšířenějším prvkem ve vesmíru na Zemi je třetím nejrozšířenějším prvkem po kyslíku
ZŠ ÚnO, Bratří Čapků 1332
 Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Animovaná chemie Top-Hit Analytická chemie Analýza anorganických látek Důkaz aniontů Důkaz kationtů Důkaz kyslíku Důkaz vody Gravimetrická analýza Hmotnostní spektroskopie Chemická analýza Nukleární magnetická
Kolik energie by se uvolnilo, kdyby spalování ethanolu probíhalo při teplotě o 20 vyšší? Je tato energie menší nebo větší než při teplotě 37 C?
 TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
TERMOCHEMIE Reakční entalpie při izotermním průběhu reakce, rozsah reakce 1 Kolik tepla se uvolní (nebo spotřebuje) při výrobě 2,2 kg acetaldehydu C 2 H 5 OH(g) = CH 3 CHO(g) + H 2 (g) (a) při teplotě
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
zemní plyn a propan-butan (LPG) kapalný vzduch kyslík dusík vzácné plyny acetylén vodík Zemní plyn a technické plyny
 zemní plyn a propan-butan (LPG) kapalný vzduch kyslík dusík vzácné plyny acetylén vodík Zemní plyn a technické plyny Zemní plyn (natural gas) přírodní, hořlavý plyn různého složení dle místa původu, lehčí
zemní plyn a propan-butan (LPG) kapalný vzduch kyslík dusík vzácné plyny acetylén vodík Zemní plyn a technické plyny Zemní plyn (natural gas) přírodní, hořlavý plyn různého složení dle místa původu, lehčí
Zplyňování. Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství
 Zplyňování Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství Projekt je spolufinancován Evropským sociálním fondem a Statním rozpočtem ČR Technologie zpracování biomasy
Zplyňování Ing. Martin Lisý, PhD. Energetický ústav VUT v Brně Fakulta strojního inženýrství Projekt je spolufinancován Evropským sociálním fondem a Statním rozpočtem ČR Technologie zpracování biomasy
Přírodní zdroje uhlovodíků. a jejich zpracování
 Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Přírodní zdroje uhlovodíků a jejich zpracování 1 Rozdělení: Přírodní zdroje org. látek fosilní - zemní plyn, ropa, uhlí (vznikají geochemickými procesy miliony let) recentní (současné) - dřevo, rostlinné
Denitrifikace. Ochrana ovzduší ZS 2012/2013
 Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
Denitrifikace Ochrana ovzduší ZS 2012/2013 1 Úvod Pojem oxidy dusíku NO NO 2 Další formy NO x Vznik NO x 2 Vlastnosti NO Oxid dusnatý Vlastnosti M mol,no = 30,01 kg/kmol V mol,no,n = 22,41 m 3 /kmol ρ
V. Soustavy s chemickou reakcí
 V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
V. Soustavy s chemickou reakcí 1 5. Soustavy s chemickou reakcí 5.1 Základní pojmy 5.2 Rozdělení reakcí 5.3 Reakční kinetika 5.3.1 Podmínky pro zreagování dvou molekul 5.3.2 Mechanismy reakce 5.3.3 Rychlost
Karboxylové kyseliny a jejich funkční deriváty
 Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Karboxylové kyseliny a jejich funkční deriváty Úvod Karboxylové kyseliny jsou nejdůležitější organické kyseliny. Jejich funkční skupina je karboxylová skupina a tento název je složen ze slov karbonyl a
Průmyslově vyráběná paliva
 Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Kyslíkaté deriváty. 1) Hydroxyderiváty: a) Alkoholy b) Fenoly. řešení. Dle OH = hydroxylová skupina
 Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Kyslíkaté deriváty řešení 1) Hydroxyderiváty: a) Alkoholy b) Fenoly Dle = hydroxylová skupina 1 Hydroxyderiváty Alifatické alkoholy: náhrada 1 nebo více atomů H. hydroxylovou skupinou (na 1 atom C vázaná
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru. Předmět: Vícefázové reaktory Jméno: Veronika Sedláková
 Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
Třífázové trubkové reaktory se zkrápěným ložem katalyzátoru Předmět: Vícefázové reaktory Jméno: Veronika Sedláková 3-fázové reakce Autoklávy (diskontinuální) Trubkové reaktory (kontinuální) Probublávané
DUM VY_52_INOVACE_12CH27
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH27 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH27 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 9. vzdělávací oblast: vzdělávací obor:
CH 3 -CH 3 -> CH 3 -CH 2 -OH -> CH 3 -CHO -> CH 3 -COOH ethan ethanol ethanal kyselina octová
 KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
KARBOXYLOVÉ KYSELINY Karboxylové kyseliny jsou sloučeniny, v jejichž molekule je karboxylová funkční skupina: Jsou nejvyššími organickými oxidačními produkty uhlovodíků: primární aldehydy uhlovodíky alkoholy
Škola: Gymnázium, Brno, Slovanské náměstí 7 III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
VY_32_INOVACE_C.3.01 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT
Gymnázium Vysoké Mýto nám. Vaňorného 163, Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto H 3 C Vymezení arenů V aromatickém cyklu dochází k průniku orbitalů kolmých k rovině cyklu. Vzniká tzv. delokalizovaná vazba π. Stabilita benzenu
Ch - Uhlovodíky VARIACE
 Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukových materiálů je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl kompletně vytvořen, sestaven a vytištěn
Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 5. přednáška Reformování a izomerace benzinů, výroba benzinových složek
www.zlinskedumy.cz Inovace výuky prostřednictvím šablon pro SŠ
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Digitální učební materiál
 Digitální učební materiál Číslo projektu Označení materiálu Název školy Autor Tematická oblast Ročník Anotace Metodický pokyn Zhotoveno CZ.1.07/1.5.00/34.0061 VY_32_ INOVACE_E.3.13 Integrovaná střední
Digitální učební materiál Číslo projektu Označení materiálu Název školy Autor Tematická oblast Ročník Anotace Metodický pokyn Zhotoveno CZ.1.07/1.5.00/34.0061 VY_32_ INOVACE_E.3.13 Integrovaná střední
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ
 TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
TVORBA UHLÍKATÝCH PRODUKTŮ PŘI I PYROLÝZE UHLOVODÍKŮ Martin Hrádel 5. ročník Školitel: Doc. Ing. Zdeněk Bělohlav, CSc. Obsah Úvod Mechanismus vzniku a vlastnosti uhlíkatých produktů Provozního sledování
Karbonylové sloučeniny
 Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Karbonylové sloučeniny více než 120 o 120 o C O C C d + d - C O C sp 2 C sp 2 R C O H R 1 C O R 2 1.aldehydy, ketony Nu E R C O R C O 2. karboxylové kyseliny a funkční deriváty O H 3. deriváty kys. uhličité
Aldehydy, ketony, karboxylové kyseliny
 Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Aldehydy, ketony, karboxylové kyseliny Aldehydy jsou organické sloučeniny, které obsahují aldehydickou funkční
Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Aldehydy, ketony, karboxylové kyseliny Aldehydy jsou organické sloučeniny, které obsahují aldehydickou funkční
Kyselina fosforečná Suroviny: Výroba: termický způsob extrakční způsob
 Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Kyselina fosforečná bezbarvá krystalická sloučenina snadno rozpustná ve vodě komerčně dodávané koncentrace 75% H 3 PO 4 s 54,3% P 2 O 5 80% H 3 PO 4 s 58.0% P 2 O 5 85% H 3 PO 4 s 61.6% P 2 O 5 po kyselině
Směšovací poměr a emise
 Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Směšovací poměr a emise Hmotnostní poměr mezi palivem a okysličovadlem - u motorů provozovaných v atmosféře, je okysličovadlem okolní vzduch Složení vzduchu: (objemové podíly) - 78% dusík N 2-21% kyslík
Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška
 ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
ODBORNÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PRO VÝKON STÁTNÍ SPRÁVY OCHRANY OVZDUŠÍ V ČESKÉ REPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 6. přednáška Vlastnosti a výroba minerálních olejů ZÁKLADOVÉ OLEJE Oleje:
Škola: Střední škola obchodní, České Budějovice, Husova 9
 Škola: Střední škola obchodní, České Budějovice, Husova 9 Projekt MŠMT ČR: EU PENÍZE ŠKOLÁM Číslo projektu: CZ.1.07/1.5.00/34.0536 Název projektu školy: Výuka s ICT na SŠ obchodní České Budějovice Šablona
Škola: Střední škola obchodní, České Budějovice, Husova 9 Projekt MŠMT ČR: EU PENÍZE ŠKOLÁM Číslo projektu: CZ.1.07/1.5.00/34.0536 Název projektu školy: Výuka s ICT na SŠ obchodní České Budějovice Šablona
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/
 Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Využití ICT pro rozvoj klíčových kompetencí CZ.1.07/1.5.00/34.0448 Číslo projektu Číslo materiálu Název školy Autor Tematický celek Ročník CZ.1.07/1.5.00/34.0448 ICT- PZC 2/11 Zdroje uhlovodíků Střední
Zpracování ropy doc. Ing. Josef Blažek, CSc.
 ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
ODBONÉ VZDĚLÁVÁNÍ ÚŘEDNÍKŮ PO VÝKON STÁTNÍ SPÁVY OCHANY OVZDUŠÍ V ČESKÉ EPUBLICE Zpracování ropy doc. Ing. Josef Blažek, CSc. 2. přednáška Složení ropy, základní schémata zpracování ropy, odsolování a
Amoniak průmyslová výroba syntetického amoniaku
 Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
Amoniak 1913 průmyslová výroba syntetického amoniaku využití 20 % výroba dusíkatých hnojiv 80 % nejrůznější odvětví průmyslu (plasty, vlákna, výbušiny, hydrazin, aminy, amidy, nitrily a další organické
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Seminář, Bratislava, 6.6.2013 Autor: J.LEDERER OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ UHLÍKOVÝCH
Bezpečnostní inženýrství - Chemické procesy -
 Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
Bezpečnostní inženýrství - Chemické procesy - M. Jahoda Nebezpečí a prevence chemických procesů 2 Chemické reakce Tepelné efekty exotermní procesy (teplo se uvolňuje => nutnost chlazení) endotermní procesy
materiál č. šablony/č. sady/č. materiálu: Autor:
 Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
Masarykova základní škola Klatovy, tř. Národních mučedníků 185, 339 01 Klatovy; 376312154, fax 376326089 E-mail: skola@maszskt.investtel.cz; internet: www.maszskt.investtel.cz Kód přílohy vzdělávací VY_32_INOVACE_CH8SA_01_03_14
ČESKÉ RAFINÉRSKÉ, a.s.
 Bilance vodíku v ČESKÉ RAFINÉRSKÉ, a.s. APROCHEM 2010 Kouty nad Desnou 19 21.4.2010 Ing.Hugo Kittel, CSc., MBA www.ceskarafinerska.cz 1 Obsah Úvod do problému Zdroje vodíku pro rafinérie Využití vodíku
Bilance vodíku v ČESKÉ RAFINÉRSKÉ, a.s. APROCHEM 2010 Kouty nad Desnou 19 21.4.2010 Ing.Hugo Kittel, CSc., MBA www.ceskarafinerska.cz 1 Obsah Úvod do problému Zdroje vodíku pro rafinérie Využití vodíku
Chemické procesy v ochraně životního prostředí
 Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
Chemické procesy v ochraně životního prostředí 1. Vliv výroby energie na životní prostředí 2. Zpracování výfukových plynů ze spalovacích motorů 3. Zachycování oxidů síry ve spalinách 4. Výroba paliv pro
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ)
 TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
TECHNOLOGIE KE SNIŽOVÁNÍ EMISÍ (SEKUNDÁRNÍ OPATŘENÍ K OMEZOVÁNÍ EMISÍ) 5. část TĚKAVÉ ORGANICKÉ SLOUČENINY A PACHOVÉ LÁTKY Zpracoval: Tým autorů EVECO Brno, s.r.o. TĚKAVÉ ORGANICKÉ SLOUČENINY Těkavé organické
1932 H. C. 1934 M.L.E.
 Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
Vodík Historie 1671 Robert Boyle uvolnění vodíku rozpouštěním Fe v HCl nebo H 2 SO 4 1766 Henry Cavendish podrobný popis vlastností 1932 H. C. Urey objev deuteria 1934 M.L.E. Oliphant, P. Harteck a E.
HYDROXYDERIVÁTY. Alkoholy Fenoly Bc. Miroslava Wilczková
 HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
HYDROXYDERIVÁTY Alkoholy Fenoly Bc. Miroslava Wilczková HYDROXYDERIVÁTY Alkoholy -OH skupina vázána na uhlíkový atom alifatického řetězce Fenoly -OH skupina vázána na uhlíku, který je součástí aromatického
VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ FAKULTA STROJNÍHO INŽENÝRSTVÍ - ENERGETICKÝ ÚSTAV ODBOR TERMOMECHANIKY A TECHNIKY
 VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ FAKULTA STROJNÍHO INŽENÝRSTVÍ - ENERGETICKÝ ÚSTAV ODBOR TERMOMECHANIKY A TECHNIKY PROSTŘEDÍ doc. Ing. Josef ŠTETINA, Ph.D. Předmět 3. ročníku BS http://ottp.fme.vutbr.cz/sat/
VYSOKÉ UČENÍ TECHNICKÉ V BRNĚ FAKULTA STROJNÍHO INŽENÝRSTVÍ - ENERGETICKÝ ÚSTAV ODBOR TERMOMECHANIKY A TECHNIKY PROSTŘEDÍ doc. Ing. Josef ŠTETINA, Ph.D. Předmět 3. ročníku BS http://ottp.fme.vutbr.cz/sat/
Základní škola a mateřská škola Hutisko Solanec. žák uvede základní druhy uhlovodíků, jejich použití a zdroje. Chemie - 9. ročník
 Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Základní škola a mateřská škola Hutisko Solanec Digitální učební materiál Anotace: Autor: Jazyk: Očekávaný výstup: Speciální vzdělávací potřeby: Klíčová slova: Druh učebního materiálu: Druh interaktivity:
Přírodní zdroje uhlovodíků
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Kyselina dusičná. jedna z nejdůležitějších chemikálií
 Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Kyselina dusičná jedna z nejdůležitějších chemikálií Výroba: minulost - surovinou pro průmyslovou výrobu dusičnan sodný (ledek sodný, guano) současnost - katalytické spalování amoniaku (první výrobní jednotka
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: kvarta. Očekávané výstupy. Poznámky. Přesahy. Průřezová témata.
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
VLASTNOSTI ALKANŮ 2. RADIKÁLOVÁ SUBSTITUCE 3. ELIMINAČNÍ REAKCE VÝZNAMNÉ ALKANY. Substituční reakce. Sulfochlorace alkanů. Termolýza.
 Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
Kromě CO 2 vznikají i saze roste svítivost Substituční reakce vazby: C C C H jsou nepolární => jsou radikálové S R...radikálová substituce 3 fáze... VLASTNOSTI ALKANŮ tady něco chybí... 2. RADIKÁLOVÁ SUBSTITUCE
1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině
 Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Otázka: Areny Předmět: Chemie Přidal(a): I. Prokopová 3 podmínky: 1)uhlovodík musí být cyklický, všechny atomy musí být v jedné rovině 2) musí existovat minimálně dvě možnosti uspořádání π elektronů 3)
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Názvosloví Konformace Isomerie. Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o )
 ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
ALKANY 1 Názvosloví Konformace Isomerie Uhlíky: primární (1 o ) sekundární (2 o ) terciární (3 o ) kvartérní (4 o ) 2 Alkany (resp. cykloalkany) jsou nejzákladnější organické sloučeniny složené pouze z
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ. Most, Autor: Doc. Ing. J.LEDERER, CSc.
 OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
OMEZOVÁNÍ NEGATIVNÍCH ENVIRONMENTÁLNÍCH DOPADŮ PŘI VÝROBĚ PALIV A PETROCHEMIKÁLIÍ Most, 29.11.2012 Autor: Doc. Ing. J.LEDERER, CSc. OBSAH - CESTY K REDUKCI NOVOTVORBY CO 2 NEOBNOVITELNÉ SUROVINY OMEZENÍ
BENZIN A MOTOROVÁ NAFTA
 BENZIN A MOTOROVÁ NAFTA BENZIN je směs kapalných uhlovodíků s pěti až jedenácti atomy uhlíku v řetězci (C 5 - C 11 ). Jeho složení je proměnlivé podle druhu a zpracování ropy, ze které pochází. 60-65%
BENZIN A MOTOROVÁ NAFTA BENZIN je směs kapalných uhlovodíků s pěti až jedenácti atomy uhlíku v řetězci (C 5 - C 11 ). Jeho složení je proměnlivé podle druhu a zpracování ropy, ze které pochází. 60-65%
Vývoj a vzájemn. jemná konkurence automobilového. automobily. 57. sjezd chemických společnost. ností 2005
 Vývoj a vzájemn jemná konkurence automobilového benzínu nu a motorové nafty jako rozhodujících ch paliv pro automobily Ing.Josef SVÁTA, Ing.Hugo KITTEL,, CSc., MBA Česká rafinérsk rská a.s., Wichterleho
Vývoj a vzájemn jemná konkurence automobilového benzínu nu a motorové nafty jako rozhodujících ch paliv pro automobily Ing.Josef SVÁTA, Ing.Hugo KITTEL,, CSc., MBA Česká rafinérsk rská a.s., Wichterleho
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D.
 Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Negativní vliv energetického využití biomasy Ing. Marek Baláš, Ph.D. Osnova 2 Legislativa Biomasa druhy složení Emise vznik, množství, vlastnosti, dopad na ŽP a zdraví, opatření CO SO 2 NO x Chlor TZL
Rozdělení uhlovodíků
 Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Rozdělení uhlovodíků 1/8 Alkany a cykloalkany Obecné vzorce: alkany C n H 2n+2, cykloalkany C n H 2n, kde n je přirozené číslo Homologický přírustek: - CH 2 - Alkany přímé ( n - alkany) rozvětvené Primární,
Název odpadu. 010307 N Jiné odpady z fyzikálního a chemického zpracování rudných nerostů obsahující nebezpečné látky x
 5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
5. Stabilizace CELIO a.s. Název odpadu 010304 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo kyselinotvorné látky x 010305 N Jiná hlušina obsahující nebezpečné látky x 010307 N Jiné odpady
Alkany a cykloalkany
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Září 2010 Mgr. Alena Jirčáková Charakteristika alkanů: Malá reaktivita, odolné chemickým činidlům Nasycené
BIOPALIVA II. GENERACE ČZU/FAPPZ
 BIOPALIVA II. GENERACE - biopaliva druhé generace se od biopaliv první generace odlišují svým vlivem na životní prostředí a především druhem biomasy jako suroviny pro jejich výrobu; - biopaliva I. generace
BIOPALIVA II. GENERACE - biopaliva druhé generace se od biopaliv první generace odlišují svým vlivem na životní prostředí a především druhem biomasy jako suroviny pro jejich výrobu; - biopaliva I. generace
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
11 Plynárenské soustavy
 11 Plynárenské soustavy Roman Vavřička ČVUT v Praze, Fakulta strojní Ústav techniky prostředí 1/22 http://utp.fs.cvut.cz Roman.Vavricka@fs.cvut.cz Plynárenské soustavy - historie Rok 1847 první městská
11 Plynárenské soustavy Roman Vavřička ČVUT v Praze, Fakulta strojní Ústav techniky prostředí 1/22 http://utp.fs.cvut.cz Roman.Vavricka@fs.cvut.cz Plynárenské soustavy - historie Rok 1847 první městská
ZDROJE UHLOVODÍKŮ. a) Ropa je hnědočerná s hustotou než voda. b) Je to směs, především. Ropa však obsahuje také sloučeniny dusíku, kyslíku a síry.
 VY_52_INOVACE_03_08_CH_KA 1. ROPA ZDROJE UHLOVODÍKŮ Doplň do textu chybějící pojmy: a) Ropa je hnědočerná s hustotou než voda. b) Je to směs, především. Ropa však obsahuje také sloučeniny dusíku, kyslíku
VY_52_INOVACE_03_08_CH_KA 1. ROPA ZDROJE UHLOVODÍKŮ Doplň do textu chybějící pojmy: a) Ropa je hnědočerná s hustotou než voda. b) Je to směs, především. Ropa však obsahuje také sloučeniny dusíku, kyslíku
Karboxylové kyseliny
 Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Karboxylové kyseliny Názvosloví pokud je karboxylováskupina součástířetězce, sloučenina mákoncovku -ovákyselina. Pokud je mimo řetězec má sloučenina koncovku karboxylová kyselina. butanová kyselina cyklohexankarboxylová
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Nerozvětvené (atomy C jsou spojeny maximálně s dvěma dalšími C) Rozvětvené (atomy C jsou spojeny s více než dvěma dalšími C)
 Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
Otázka: Uhlovodíky Předmět: Chemie Přidal(a): Majdush Obsahují ve svých molekulách pouze atomy uhlíku a vodíku Nejjednodušší org. sloučeniny Uhlík je schopný řetězit se a vytvářet tak nejrůznější řetězce,
ALKOHOLY, FENOLY A ETHERY. b. Jaké zdroje cukru znáte a jak se nazývají produkty jejich kvašení?
 ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
ALKOLY, FENOLY A ETHERY Kvašení 1. S použitím literatury nebo internetu odpovězte na následující otázky: a. Jakým způsobem v přírodě vzniká etanol? Napište rovnici. b. Jaké zdroje cukru znáte a jak se
Reálné gymnázium a základní škola města Prostějova Školní vzdělávací program pro ZV Ruku v ruce
 6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
6 ČLOVĚK A PŘÍRODA UČEBNÍ OSNOVY 6. 2 Chemie Časová dotace 8. ročník 2 hodiny 9. ročník 2 hodiny Celková dotace na 2. stupni je 4 hodiny. Charakteristika: Vyučovací předmět chemie vede k poznávání chemických
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší?
 16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
16.IZOMERIE a UHLOVODÍKY 1) Co je to izomerie a jak se dělí? 2) Co je konstituce, konfigurace a konformace? 3) V čem se izomery shodují a v čem liší? 4) Urči typy konstituční izomerie. 5) Co je tautomerie
T E C H N I C K Á chemická odolnost membrána čistá polyurea TECNOCOAT P-2049
 TEKUTÁ OCHRANNÁ HYDROIZOLAČNÍ MEMBRÁNA T E C H N I C K Á S L O Ž K A chemická odolnost membrána čistá polyurea TECNOCOAT P-2049 t93 568 21 11 f93 568 02 11 e-mail: info@ Voda Solanka xxxxxx Odolná Chlorovaná
TEKUTÁ OCHRANNÁ HYDROIZOLAČNÍ MEMBRÁNA T E C H N I C K Á S L O Ž K A chemická odolnost membrána čistá polyurea TECNOCOAT P-2049 t93 568 21 11 f93 568 02 11 e-mail: info@ Voda Solanka xxxxxx Odolná Chlorovaná
Karboxylové kyseliny
 Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Registrační číslo projektu: CZ.1.07/1.1.38/02.0025 Název projektu: Modernizace výuky na ZŠ Slušovice, Fryšták, Kašava a Velehrad Tento projekt je spolufinancován z Evropského sociálního fondu a státního
Operační program Vzdělávání pro konkurenceschopnost Název projektu: Inovace magisterského studijního programu Fakulty ekonomiky a managementu
 Operační program Vzdělávání pro konkurenceschopnost Název projektu: Inovace magisterského studijního programu Fakulty ekonomiky a managementu Registrační číslo projektu: CZ.1.07/2.2.00/28.0326 PROJEKT
Operační program Vzdělávání pro konkurenceschopnost Název projektu: Inovace magisterského studijního programu Fakulty ekonomiky a managementu Registrační číslo projektu: CZ.1.07/2.2.00/28.0326 PROJEKT
Linka na úpravu odpadů stabilizace / neutralizace
 CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
CELIO a.s. CZU00168 Linka na úpravu odpadů stabilizace / neutralizace Původce musí doložit výluh č. III. Kód Název odpadu Přijetí 01 03 04 N Hlušina ze zpracování sulfidické rudy obsahující kyseliny nebo
Fotokatalytická oxidace acetonu
 Fotokatalytická oxidace acetonu Hana Žabová 5. ročník Doc. Ing. Bohumír Dvořák, CSc Osnova 1. ÚVOD 2. CÍL PRÁCE 3. FOTOKATALYTICKÁ OXIDACE Mechanismus Katalyzátor Nosič-typy Aparatura 4. VÝSLEDKY 5. ZÁVĚR
Fotokatalytická oxidace acetonu Hana Žabová 5. ročník Doc. Ing. Bohumír Dvořák, CSc Osnova 1. ÚVOD 2. CÍL PRÁCE 3. FOTOKATALYTICKÁ OXIDACE Mechanismus Katalyzátor Nosič-typy Aparatura 4. VÝSLEDKY 5. ZÁVĚR
Kovy a metody jejich výroby
 Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
Kovy a metody jejich výroby Kovy v periodické tabulce Základní vlastnosti kovů 80 % prvků v přírodě jsou kovy, v PSP stoupá kovový charakter směrem DOLEVA Vlastnosti: Fyzikální kovový lesk kujnost a tažnost
