Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls19177/2006
|
|
|
- Ondřej Mareš
- před 8 lety
- Počet zobrazení:
Transkript
1 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls19177/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-ALLOPURINOL tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje allopurinolum 100 mg. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Tablety. Popis přípravku: bílé kulaté bikonvexní tablety, z jedné strany vyryto "APO", z druhé strany "ALL" nad a "100" pod půlicí rýhou. 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace léčba dny, a to primární i sekundární, která se vyskytuje u krevních dyskrázií a při jejich léčbě. léčba primární nebo sekundární nefropatie podmíněné zvýšenou hladinou kyseliny močové a provázené i neprovázené známkami nebo příznaky dny profylakticky k zábraně ukládání urátů do tkání a k zábraně vzniku ledvinových kamenů u pacientů s leukémií, lymfomy nebo jinými nádory léčenými protinádorovou léčbou (ozařováním nebo cytotoxickými látkami), která může zvýšit hladiny kyseliny močové v krvi. Také při léčbě a profylaxi akutní urátové nefropatie a následného selhání ledvin u pacientů s nádorovými onemocněními se zvýšenou citlivostí vůči hyperurikémii a náchylností ke tvorbě urátových kamenů. prevence vzniku a recidivy ledvinové urátové a kalciumoxalátové nefrolitiázy u pacientů s hyperurikémií a nebo hyperurikosúrií. u dětí se alopurinol podává pouze k léčbě sekundární hyperurikémie provázející maligní onemocnění a Lesch-Nyhanův syndrom Dávkování a způsob podání Dospělí Obecné pokyny Celková denní dávka by měla být podána v 1 až 3 dílčích dávkách. Denní dávky do 300 mg by měly být podány v jediné dávce po jídle. Denní dávky vyšší než 300 mg by měly být rozděleny do dílčích dávek nepřesahujících 300 mg. APO-ALLOPURINOL je obvykle lépe snášen, je-li užíván po jídle. Léčba dny 1/9
2 Dávka APO-ALLOPURINOLu kolísá podle závažnosti onemocnění. Minimální účinná dávka je 100 až 200 mg. Průměrná dávka u pacientů s mírnou dnou je 200 až 300 mg alopurinolu denně, u pacientů se středně těžkou dnou s tofy je 400 až 600 mg alopurinolu denně a u těžké dny 700 až 800 mg alopurinolu denně. Maximální doporučená denní dávka u pacientů s normální funkcí ledvin je 800 mg alopurinolu. Jelikož alopurinol a jeho metabolity jsou vylučovány pouze ledvinami, může při selhání ledvin dojít ke kumulaci alopurinolu a jeho dávka by proto měla být přiměřeně snížena. Při clearance kreatininu 0,33 až 0,167 ml/sek. (19,8-10,02 ml/min.) je vhodná dávka 200 mg alopurinolu denně. Při clearance kreatininu menší než 0,167 ml/sek.(10,02 ml/min.) by denní dávka alopurinolu neměla přesáhnout 100 mg. Při extrémně těžkém poškození ledvin (clearance kreatininu menší než 0,05 ml/sek. (3,00 ml/min) může být nutné i prodloužení dávkovacího intervalu. Jelikož neexistuje žádná jednoduchá metoda stanovení koncentrace alopurinolu v krvi, je nejlépe stanovit dávky a dávkovací intervaly alopurinolu vhodné k udržení hladiny močové kyseliny v séru v normálním rozmezí podle hladin kyseliny močové v séru. Po stanovení denní dávky alopurinolu potřebné k udržení hladiny kyseliny močové v séru na požadované výši by měla být tato dávka alopurinolu podávána tak dlouho, dokud hladiny kyseliny močové v séru neindikují potřebu další úpravy dávkování. Normální hladiny urátů v séru jsou dosaženy během 1 až 3 týdnů. Horní hranice normálních hladin kyseliny močové je 357 µmol/l pro muže a pro ženy po menopauze a 297,5 µmol/l pro ženy před menopauzou. Podáním vhodné dávky alopurinolu a u některých pacientů i současným podáváním urikosurik je možné snížit hladiny kyseliny močové v séru na normální hodnoty a je-li třeba, je možné je udržet na úrovni ,5 µmol/l. Kombinovaná léčba alopurinolem a urikosurikem často umožní snížení dávek obou léčiv. Pro snížení možnosti zvýšení počtu akutních dnavých záchvatů během časné fáze podávání alopurinolu se doporučuje zahájit léčbu nízkými dávkami alopurinolu (100 až 200 mg denně) a dávkování v týdenních intervalech zvyšovat o 100 mg, dokud není dosaženo hladiny kyseliny močové v séru okolo 357 µmol/l nebo méně. Během prvních 3-6 měsíců léčby alopurinolem by rovněž měla být podávána profylaktická dávka kolchicinu (nebo nesteroidních protizánětlivých látek u pacientů, kteří nemohou být léčeni kolchicinem) a u pacienta by měl být zajištěn vysoký příjem tekutin. U pacientů léčených urikosuriky, kolchicinem a nebo antiflogistiky je vhodné pokračovat v této léčbě během úpravy dávkování alopurinolu až do dosažení normální hladiny kyseliny močové v séru a absence akutních záchvatů po dobu několika měsíců. Je-li to žádoucí, může být poté pacient převeden na léčbu samotným alopurinolem. Prevence urátové nefropatie během intenzívní léčby nádorových onemocnění Doporučuje se podávání 600 až 800 mg alopurinolu denně po dva až tři dny před chemoterapií nebo radioterapií. Léčba by měla pokračovat v dávkách upravených podle hladin kyseliny močové v séru až do doby, kdy již nehrozí nebezpečí hyperurikémie a hyperurikosúrie. V léčbě APO-ALLOPURINOLem je možné pokračovat během antimitotické léčby pro profylaxi hyperurikémie, která může vzniknout během přirozených krizí onemocnění. Při prolongované léčbě obvykle ke kontrole hladiny kyseliny močové v séru postačí denní dávka 300 až 400 mg APO- ALLOPURINOLu. Během léčby APO-ALLOPURINOLem je nezbytné udržovat denní výdej moči v množství 2 litrů nebo více a je žádoucí zajistit neutrální nebo zásadité ph moči a uplatnit zákaz požívání alkoholických nápojů. Profylaxe renální urátové litiázy Podává se mg alopurinolu 1-4krát denně nebo 300 mg v jediné denní dávce. Profylaxe renální kalciumoxalátové litiázy 2/9
3 Doporučená úvodní dávka APO-ALLOPURINOLu pro prevenci recidivujících kalcium-oxalátových kaménků je 200 až 300 mg denně v jediné dávce nebo ve více dílčích dávkách. V léčbě je možné pokračovat po neomezenou dobu. Někteří pacienti užívali udržovací dávku mg denně po více než sedm let. U některých pacientů je možné udržovací dávku snížit na mg denně. Děti a mladiství od 6 let: Při léčbě sekundární hyperurikéme provázející maligní onemocnění a u Lesch-Nyhanova syndromu by měl být podáván APO-ALLOPURINOL v dávce mg/kg/den. Odpověď by měla být zhodnocena po přibližně 48 hodinách monitorováním hladiny kyseliny močové v séru a nebo v moči a dávka by měla být podle potřeby upravena. Dětem od 6 let se obvykle podává 100 mg 3krát denně nebo 300 mg v jediné denní dávce. Dávkování u starších osob: jelikož nejsou k dispozici specifické údaje, je nutno použít nejnižší dávku, která navodí uspokojující snížení tvorby urátů. Zejména je nutno věnovat pozornost pokynům uvedeným v částech Dávkování při poruše funkce ledvin a Zvláštní upozornění a opatření pro použití Dávkování při poruše funkce ledvin: jelikož se alopurinol a jeho metabolity vylučují ledvinami, může porucha funkce ledvin vést k retenci léčiva a/nebo jeho metabolitů s následným prodloužením plasmatických poločasů. Při těžké renální nedostatečnosti může být vhodné používat méně než 100 mg za den nebo používat jednotlivé 100mg dávky v delších intervalech, než jeden den. Pokud je k dispozici vybavení k monitorování koncentrací oxipurinolu v plasmě, musí být dávka upravena tak, aby byly plasmatické hladiny oxipurinolu udržovány pod 100 umol/l (15,2 mg/l). Alopurinol a jeho metabolity se odstraňují renální dialýzou. Pokud je dialýza potřebná dva- až třikrát týdně, je nutno zvážit alternativní dávkovací schéma 300 až 400 mg alopurinolu ihned po každé dialýze, přičemž mezi dialýzami se nepodává žádná dávka. Dávkování při poruše funkce jater: u pacientů s poruchou funkce jater je nutno použít snížené dávky. Pacienti s poruchami funkce ledvin nebo jater by měli být během časné fáze léčby APO- ALLOPURINOLem pečlivě sledováni a při dalším zhoršení těchto funkcí by léčba měla být přerušena. U všech pacientů léčených APO-ALLOPURINOLem by měly být prováděny periodické kontroly jaterních testů a to zejména v raných fázích léčby Kontraindikace APO-ALLOPURINOL nesmí být podáván pacientům s přecitlivělostí na alopurinol nebo na kteroukoli pomocnou látku tohoto přípravku Zvláštní upozornění a opatření pro použití APO-ALLOPURINOL je relativně kontraindikován v těhotenství, během kojení a při poruchách funkce jater nebo ledvin. APO-ALLOPURINOL by měl být okamžitě vysazen při výskytu kožní vyrážky, která může být v některých případech následována závažnějšími projevy hypersenzitivity. Pacienti léčení pro hypertenzi nebo srdeční nedostatečnost např. diuretiky nebo ACE inhibitory mohou mít průvodní poruchu funkce ledvin a alopurinol by měl být u této skupiny použit s opatrností. Asymptomatická hyperurikémie se obecně nepovažuje za indikaci k použití alopurinolu. Tekutiny a úprava stravy s vyšetřením příčiny by měly nález upravit. Při zahájení léčby APO-ALLOPURINOLem u nových pacientů se mohou vyskytnout akutní dnavé záchvaty, které mohou pokračovat i poté, kdy hladina kyseliny močové v séru začne klesat. Vhodné je po dobu prvních 3-6 měsíců podávání profylaktických dávek kolchicinu anebo nesteroidních protizánětlivých látek u pacientů, kteří nemohou být kolchicinem léčeni, a to zvláště u nových pacientů a u pacientů, u nichž se dnavé záchvaty vyskytovaly často. Dále se doporučuje zahajovat 3/9
4 léčbu nízkými dávkami APO-ALLOPURINOLu 100 mg (100 až 200 mg denně) a dávku postupně zvyšovat do dosažení sérové hladiny kyseliny močové 357 µmol/l nebo méně (viz Dávkování a způsob podání). APO-ALLOPURINOL by neměl být podáván dětem a mladistvým s výjimkou dětí a adolescentů se sekundární hyperurikémií u neoplastických onemocnění nebo s Lesch-Nyhanovým syndromem, protože u jiných stavů nebyla u této věkové kategorie bezpečnost a účinnost alopurinolu stanovena Interakce s jinými léčivými přípravky a jiné formy interakce 6 -merkaptopurin a azathioprin: azathioprin se metabolizuje na 6-merkaptopurin, který se inaktivuje působením xanthinoxidázy. Pokud se 6-merkaptopurin či azathioprin podávají současně s alopurinolem, musí se podávat pouze čtvrtina obvyklé dávky 6-merkaptopurinu či azathioprinu, protože inhibice xanthinoxidázy prodlužuje jejich aktivitu. Vidarabin (adeninarabinosid): důkazy naznačují, že plasmatický poločas vidarabinu se za přítomnosti alopurinolu prodlužuje. Pokud se tyto přípravky používají současně, je nezbytná zvýšená opatrnost, aby se zjistilo zesílení toxických účinků. Salicyláty a urikosurika: oxipurinol, což je hlavní metabolit alopurinolu, který je sám terapeuticky aktivní, se vylučuje ledvinami podobným způsobem jako urát. Proto léčiva s urikosurickou aktivitou, jako je probenecid nebo vysoké dávky salicylátů, mohou zrychlit vylučování alopurinolu. To může oslabit terapeutickou účinnost alopurinolu, nicméně v každém případě je nutno vyhodnotit význam tohoto jevu. Chlorpropamid: pokud se alopurinol podává současně s chlorpropamidem při slabé funkci ledvin, může být zvýšeno riziko prodloužení hypoglykemické aktivity, protože alopurinol a chlorpropamid mohou soutěžit při vylučování v renálním tubulu. Kumarinová antikoagulancia: Existují vzácná hlášení zvýšeného účinku warfarinu a jiných kumarinových antikoagulancií, pokud se podávají současně s alopurinolem, a proto musí být všichni pacienti léčení antikoagulancii pečlivě sledováni. Fenytoin: alopurinol může inhibovat oxidaci fenytoinu v játrech, nicméně klinický význam nebyl prokázán. Theofylin: byla hlášena inhibice metabolismu theofylinu. Tento mechanismus lze vysvětlit tím, že se u člověka xanthinoxidáza účastní biotransformace theofylinu. U pacientů, kteří zahajují léčbu alopurinolem nebo zvyšují jeho dávku, je nutno sledovat hladiny theofylinu. Ampicilin/amoxicilin: u pacientů léčených ampicilinem nebo amoxicilinem současně s alopurinolem byla ve srovnání s pacienty, kteří nejsou oběma typy léčiv léčeni současně, hlášena zvýšená četnost kožní vyrážky. Příčina hlášené souvislosti nebyla zjištěna. Nicméně se doporučuje, aby se tam, kde to bude možné, u pacientů léčených alopurinolem používala alternativa k ampicilinu či amoxicilinu. Cyklofosfamid, doxorubicin, bleomycin, prokarbazin,mechloroethamin: u pacientů s neopláziemi (jinými než leukémie) byl za přítomnosti alopurinolu hlášen zvýšený útlum kostní dřeně navozený cyklofosfamidem a dalšími cytotoxickými látkami. Nicméně v dobře kontrolovaných studiích na pacientech léčených cyklofosfamidem, doxorubicinem, bleomycinem, prokarbazinem a/nebo mechlorethaminem (hydrochloridem chlormethinu) alopurinol toxické účinky těchto cytotoxických látek nezvyšoval. Cyklosporin: hlášení naznačují, že plasmatické koncentrace cyklosporinu mohou být při současné léčbě alopurinolem zvýšeny. Pokud se tato léčiva podávají současně, je nutno mít na paměti zesílenou toxicitu cyklosporinu. Didanosin: u zdravých dobrovolníků a pacientů s HIV léčených didanosinem byly při současné léčbě alopurinolem (300 mg denně) hodnoty didanosinu C max a AUC v plasmě přibližně zdvojnásobeny, 4/9
5 aniž by byl ovlivněn terminální poločas. Současné podávání těchto 2 léčiv se obecně nedoporučuje. Pokud se mu nelze vyhnout, může být potřebné snížení dávky didanosinu a pacienti musí být pečlivě sledováni Těhotenství a kojení APO-ALLOPURINOL by měl být podáván těhotným ženám a ženám v reprodukčním věku pouze tehdy, jestliže potenciální přínos pro ženu převažuje nad potenciálním rizikem pro plod. Alopurinol a jeho metabolit oxipurinol přestupují do mateřského mléka, avšak údaje týkající se účinku alopurinolu nebo jeho metabolitu na kojené dítě jsou nedostatečné. Proto by APO- ALLOPURINOL neměl být podáván kojícím ženám Účinky na schopnost řídit a obsluhovat stroje Jelikož APO-ALLOPURINOL může příležitostně vyvolat ospalost, může negativně ovlivnit činnosti vyžadující zvýšenou pozornost, koordinaci pohybů a rychlé rozhodování, jako jsou řízení motorových vozidel a obsluha strojů Nežádoucí účinky U tohoto přípravku není dostupná moderní klinická dokumentace, která by se dala použít k podpoře stanovení četnosti nežádoucích účinků. Nežádoucí účinky se mohou lišit v incidenci v závislosti na podávané dávce a také pokud se podávají v kombinaci s jinými léčivy. Kategorie četnosti přiřazené dále uvedeným nežádoucím účinkům jsou založeny na odhadech: u většiny nežádoucích účinků data pro výpočet incidence nejsou k dispozici. Nežádoucí účinky léčiv zjištěné při poregistračních studiích se považují za vzácné nebo velmi vzácné. Nežádoucí účinky podle třídy orgánových systémů, frekvence jsou definovány podle užívané konvence následovně: Velmi časté ( 1/10) Časté ( 1/100 až <1/10) Méně časté ( 1/1000 až <1/100) Vzácné ( 1/10000 až < 1/1000) Velmi vzácné (<1/10000), není známo (z dostupných údajů nelze určit) Infekce a infestace: furunkulóza Poruchy krve a lymfatického systému: agranulocytóza, aplastická anémie, trombocytopenie Velmi vzácně byly hlášeny případy trombocytopénie, agranulocytózy a aplastické anémie, zvláště u pacientů s postižením ledvinných a/nebo jaterních funkcí, což zvyšuje potřebu zvláštní péče o tuto skupinu pacientů. Poruchy imunitního systému Méně časté: hypersenzitivní reakce angioimunoblastická lymfadenopatie Závažné hypersenzitivní reakce, včetně kožních reakcí spojených s exfoliací, horečkou, lymfadenopatií, artralgií a/nebo eosinofilí, včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy se vyskytují vzácně (viz Poruchy kůže a podkožní tkáně).související vaskulitida a tkáňová odpověď se mohou projevit různými způsoby, včetně hepatitidy, poruchy funkce 5/9
6 ledvin a velmi vzácně záchvaty křečí. Velmi vzácně byl hlášen akutní anafylaktický šok. Pokud se takové reakce objeví, což může být kdykoli během léčby, musí se alopurinol ihned a trvale vysadit. Při překonávání hypersenzitivních kožních reakcí mohou být užitečné kortikosteroidy. Pokud se objeví generalizované hypersenzitivní reakce, byla při fatálních důsledcích obvykle přítomna porucha ledvin a/nebo jater. Angioimunoblastická lymfadenopatie byla popsána velmi vzácně po biopsii při generalizované lymfadenopatii. Zdá se, že je po vysazení alopurinolu reverzibilní. Poruchy metabolismu a výživy diabetes mellitus, hyperlipidémie Psychiatrické poruchy deprese Poruchy nervového systému kóma, paralýza, ataxie, neuropatie, parestézie, ospalost, bolesti hlavy, poruchy vnímání chutí Poruchy oka katarakta, poruchy vidění, změny na sítnici Poruchy ucha a labyrintu vertigo Srdeční poruchy angina, bradykardie Cévní poruchy hypertenze Gastrointestinální poruchy Méně časté: zvracení, nauzea, opakované zvracení krve, steatorhea, stomatitida, změny v návycích chození na stolici V dříve provedených klinických studiích byly hlášeny stavy nauzey a zvracení. Další sledování však naznačilo, že tyto účinky nejsou významných problémem a může se jim zabránit užíváním alopurinolu po jídle. Poruchy jater a žlučových cest Méně časté: Vzácné: asymptomatické zvýšení hodnot jaterních testů hepatitida (včetně nekrózy jater a granulomatózní hepatitidy) Porucha funkce jater byla hlášena bez zjevných známek více generalizované hypersenzitivity. Poruchy kůže a podkožní tkáně Časté: vyrážka 6/9
7 Vzácné: Stevens-Johnsonův syndrom/toxická epidermální nekrolýza angioedém, pevná léková vyrážka, alopecie, odbarvení vlasů Kožní reakce jsou nejběžnějšími reakcemi a mohou se vyskytnout kdykoli během léčby. Mohou být svědivé, makulopapulární, někdy šupinatící, někdy červené a vzácně exfoliativní, jako Stevens- Johnsonův syndrom a toxická epidermální nekrolýza (SJS/TEN).. Pokud se takové reakce objeví, musí se alopurinol vysadit ihned. Po uzdravení z mírných reakcí může být alopurinol, pokud je to třeba, nasazen znovu v nízké dávce (např. 50 mg/den) a dávku lze postupně zvyšovat. Pokud se znovu objeví vyrážka, musí být alopurinol vysazen trvale, protože se může objevit závažnější hypersenzitivita (viz Poruchy imunitního systému). Z klinické diagnózy SJS/TEN se vychází při dalším rozhodování. Pokud se taková reakce vyskytne kdykoliv během léčby, alopurinol by měl být okamžitě a trvale vysazen. Byl hlášen výskyt angioedému s projevy a symptomy generalizovanější hypersenzitivní reakce nebo bez nich. Poruchy ledvin a močových cest hematurie, urémie Poruchy reprodukčního systému a prsu mužská neplodnost, erektilní dysfunkce, gynekomastie Celkové poruchy a reakce v místě aplikace otok, celkový pocit nepohody, asténie, horečka Výskyt horečky byl hlášen s projevy a symptomy generalizovanější hypersenzitivní reakce na alopurinol nebo bez nich (viz Poruchy imunitního systému) Předávkování Předávkování alopurinolu se obvykle projeví nauzeou a zvracením. Pokud je přívod léčiva zastaven a je zajištěna přiměřená hydratace k urychlení exkrece alopurinolu, není obvykle zapotřebí žádná léčba. Jestliže se však vyskytnou další akutní obtíže, měl by být zvážen výplach žaludku; jinak je léčba symptomatická. V případě potřeby lze použít hemodialýzu. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: léčiva potlačující tvorbu kyseliny močové. ATC kód: M04AA01 Allopurinol je antiuratikum, inhibitor xanthinoxidázy. Alopurinol je kompetitivním inhibitorem tohoto enzymu a jeho metabolit aloxanthin inhibuje xanthinoxidázu nekompetitivně. Při léčení APO- ALLOPURINOLem se snižuje koncentrace kyseliny močové v plazmě i v moči. Snížení koncentrace urátů v tělesných tekutinách usnadňuje mobilizaci urátových depozit ve tkáních. Těmito mechanizmy se APO-ALLOPURINOL příznivě uplatňuje v léčbě primární i sekundární hyperurikémie a dny v období mimo záchvaty Farmakokinetické vlastnosti 7/9
8 Po perorálním podání se z trávicího ústrojí vstřebává přibližně 80% podané dávky APO- ALLOPURINOLu. Maximální sérové koncentrace jsou dosaženy asi za 2-6 hodin. Po podání dávky 500 mg jsou průměrné maximální koncentrace léčiva v krvi 3,3 mg/l. Alopurinol se prakticky neváže na plazmatické proteiny. S výjimkou mozkové tkáně se alopurinol distribuuje rovnoměrně do všech tkání. Hlavním metabolitem je farmakologicky aktivní oxipurinol, který s alopurinolem přestupuje do mateřského mléka. Močí se vyloučí přibližně 76% podané dávky, převážně ve formě volného oxipurinolu. Eliminační poločas alopurinolu je 1-2 hodiny a oxipurinolu hodin. Při snížené funkci ledvin se může kumulovat alopurinol i jeho metabolit Předklinické údaje vztahující se k bezpečnosti Mutagenita Cytogenetické studie ukazují, že alopurinol in vitro nevyvolává při koncentracích do 100 µg/ml a in vivo při dávkách do 60 mg/den po průměrnou dobu podávání 40 měsíců v lidských krvinkách chromozomální aberace. Alopurinol nevede in vitro k tvorbě nitrosloučenin ani neovlivňuje lymfocytární transformaci. Výsledky biochemických a jiných cytologických vyšetření s vysokou spolehlivostí napovídají, že alopurinol nemá negativní vliv na DNA v jakémkoliv stadiu buněčného cyklu a není mutagenní. Kancerogenita U myší a potkanů, jimž byl pod dobu až 2 let podáván alopurinol, nebyla zjištěna kancerogenita této látky. Teratogenita V jedné studii, v níž byly myším 10. nebo 13. den březosti intraperitoneálně podány dávky 50 nebo 100 mg/kg těl. hmotnosti, byl zjištěn abnormální vývoj plodů, avšak v podobné studii u potkanů, kterým byla podána dávka 120 mg/kg těl. hmotnosti 12. den březosti, nebyly žádné abnormality pozorovány. Rozsáhlé studie podávání vysokých perorálních dávek alopurinolu (u myší až do výše 100 mg/kg/den, u potkanů v dávkách až 200 mg/kg/den a u králíků až do výše 150 mg/kg/den) podávaných den březosti neprokázaly žádný teratogenní účinek alopurinolu. Jedna in vitro studie používající ke zjištění embryotoxicity slinné žlázy myšího plodu v kulturách ukázala, že u alopurinolu nelze očekávat žádnou embryotoxicitu bez současného vyvolání toxicity u matky. 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Sodná sůl kroskarmelosy, magnesium-stearát, koloidní bezvodný oxid křemičitý Inkompatibility Neuplatňuje se Doba použitelnosti 2 roky Zvláštní podmínky pro uchovávání Uchovávejte při teplotě do 25 C v dobře uzavřeném obalu Druh obalu a velikost balení Bílá HDPE lahvička, krycí hliníková fólie, modrý PP šroubovací uzávěr, LDPE pěnová výplň šroubovacího uzávěru, příbalová informace součástí etikety. Velikost balení: 50 a 100 tablet. 8/9
9 6.6. Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Žádné zvláštní požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Apotex Europe BV, Leiden, Nizozemsko 8. REGISTRAČNÍ ČÍSLO 29/170/92-C 9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE / O. DATUM REVIZE TEXTU /9
sp.zn.sukls213204/2014
 sp.zn.sukls213204/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-ALLOPURINOL tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje allopurinolum 100 mg. Úplný seznam pomocných látek
sp.zn.sukls213204/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-ALLOPURINOL tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje allopurinolum 100 mg. Úplný seznam pomocných látek
Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012
 Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Purinol 100 mg Purinol 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Purinol 100 mg Purinol 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Popis přípravku Purinol 100 mg Kulaté, bílé, bikonvexní tablety o průměru 9 mm s půlicí rýhou na jedné straně. Tabletu lze rozdělit na stejné dávky.
 sp. zn. sukls115037/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Purinol 100 mg Purinol 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje allopurinolum 100 mg nebo 300 mg.
sp. zn. sukls115037/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Purinol 100 mg Purinol 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje allopurinolum 100 mg nebo 300 mg.
Jedna tableta Allopurinol Teva obsahuje allopurinolum 100 mg, 200 mg nebo 300 mg.
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls161562-64/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Allopurinol Teva 100 mg Allopurinol Teva 200 mg Allopurinol Teva 300 mg tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls161562-64/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Allopurinol Teva 100 mg Allopurinol Teva 200 mg Allopurinol Teva 300 mg tablety 2. KVALITATIVNÍ
Profylaxe a prevence urátové litiázy a kalcium-oxalátové litiázy spojené s hyperurikosurií.
 sp.zn. sukls31984/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné tabletě. Allopurinolum
sp.zn. sukls31984/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné tabletě. Allopurinolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls19939/2015, sukls19941/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alopurinol Glenmark 100 mg, tablety Alopurinol Glenmark 300 mg, tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
Sp.zn.sukls19939/2015, sukls19941/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alopurinol Glenmark 100 mg, tablety Alopurinol Glenmark 300 mg, tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls245759/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alopurinol Sandoz 100 mg Alopurinol Sandoz 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Alopurinol Sandoz 100 mg Jedna tableta
Sp.zn.sukls245759/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alopurinol Sandoz 100 mg Alopurinol Sandoz 300 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Alopurinol Sandoz 100 mg Jedna tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls107451/2015 a sukls107472/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné
sp. zn. sukls107451/2015 a sukls107472/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné
Příbalová informace: informace pro pacienta. Milurit 100 Milurit 300 tablety allopurinolum
 sp. zn. sukls107451/2015 a sukls107472/2015 Příbalová informace: informace pro pacienta Milurit 100 Milurit 300 tablety allopurinolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp. zn. sukls107451/2015 a sukls107472/2015 Příbalová informace: informace pro pacienta Milurit 100 Milurit 300 tablety allopurinolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls78017/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné tabletě. Allopurinolum
sp. zn. sukls78017/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Milurit 100 Milurit 300 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Allopurinolum 100 mg v jedné tabletě. Allopurinolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls108322/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTISTAX 360 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje: Vitis viniferae folii extractum
sp.zn. sukls108322/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTISTAX 360 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje: Vitis viniferae folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
3 LÉKOVÁ FORMA Tableta s prodlouženým uvolňováním. Růžové, kulaté bikonvexní tablety s vyraženým '35' na jedné straně, na druhé straně hladké.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls243280/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dorsiflex 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mephenoxalonum 200 mg. Úplný seznam pomocných
sp.zn. sukls243280/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dorsiflex 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mephenoxalonum 200 mg. Úplný seznam pomocných
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn.sukls15506/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. k rozhodnutí o převodu registrace sp.zn.sukls5506/00 SOUHRN ÚDAJŮ O PŘÍPRAVKU. NÁZEV PŘÍPRAVKU PETINIMID měkké tobolky. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ethosuximidum 50 mg v měkké tobolce
Příloha č. k rozhodnutí o převodu registrace sp.zn.sukls5506/00 SOUHRN ÚDAJŮ O PŘÍPRAVKU. NÁZEV PŘÍPRAVKU PETINIMID měkké tobolky. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ethosuximidum 50 mg v měkké tobolce
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Souhrn údajů o přípravku
 sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
Příbalová informace: informace pro uživatele. APO-ALLOPURINOL tablety allopurinolum
 sp.zn. sukls164399/2011 Příbalová informace: informace pro uživatele APO-ALLOPURINOL tablety allopurinolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
sp.zn. sukls164399/2011 Příbalová informace: informace pro uživatele APO-ALLOPURINOL tablety allopurinolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014
 sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls107100/2012 a sukls107107/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
sp.zn.sukls51712/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bromhexin-EGIS 2 mg/ml Perorální roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp.zn.sukls51712/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bromhexin-EGIS 2 mg/ml Perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bromhexini hydrochloridum 120 mg v 60 ml
sp.zn.sukls51712/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bromhexin-EGIS 2 mg/ml Perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bromhexini hydrochloridum 120 mg v 60 ml
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
sp.zn.sukls188553/2014
 sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls19177/2006 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls19177/2006 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls19177/2006 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. APO-ALLOPURINOL tablety (allopurinolum)
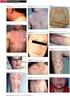 sp.zn. sukls211413/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
sp.zn. sukls211413/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Úplný seznam pomocných látek viz bod 6.1. Čirý žluto-hnědý sirup s charakteristickou příchutí medu a citronu.
 Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls219426/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls219426/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls219426/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg
 Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka
Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 krozhodnutí o změně registrace sp. zn. sukls239605/2009 a příloha k sp. zn. sukls137296/2009, sukls161897/2009, sukls161901/2009, sukls137266/2009, sukls33946/2010 1. NÁZEV PŘÍPRAVKU Bayflex
Příloha č. 3 krozhodnutí o změně registrace sp. zn. sukls239605/2009 a příloha k sp. zn. sukls137296/2009, sukls161897/2009, sukls161901/2009, sukls137266/2009, sukls33946/2010 1. NÁZEV PŘÍPRAVKU Bayflex
Příbalová informace: informace pro pacienta. PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum)
 sp.zn.sukls26034/2015 Příbalová informace: informace pro pacienta PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls26034/2015 Příbalová informace: informace pro pacienta PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 15 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 15 mg. Pomocné látky se
sp.zn.sukls40230/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AMBROSAN 15 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje ambroxoli hydrochloridum 15 mg. Pomocné látky se
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 1 mg žvýkací tablety pro psy Metacam 2,5 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
Krátkodobá léčba glaukomu (s otevřeným úhlem i sekundárního), předoperační příprava u glaukomu s uzavřeným úhlem.
 sp.zn.sukls185718/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DILURAN tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje acetazolamidum 250 mg. Pomocné látky se známým účinkem:
sp.zn.sukls185718/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DILURAN tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje acetazolamidum 250 mg. Pomocné látky se známým účinkem:
Příbalová informace: informace pro pacienta. PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum)
 sp. zn. sukls115037/2016 Příbalová informace: informace pro pacienta PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls115037/2016 Příbalová informace: informace pro pacienta PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum 2 mg).
 sp. zn. sukls298106/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dithiaden 2 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum
sp. zn. sukls298106/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dithiaden 2 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje bisulepini hydrochloridum 2,25 mg (bisulepinum
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls50856/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls50856/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COXTRAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nimesulidum 100 mg v 1 tabletě
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls50856/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU COXTRAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nimesulidum 100 mg v 1 tabletě
sp.zn.sukls133259/2014
 sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls82079/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls82079/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č.1 k rozhodnutí o změně registrace sp.zn.sukls82079/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-ALLOPURINOL tablety (allopurinolum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
Betahistin je indikován k léčbě Ménièrova syndromu, charakterizovaného následujícími příznaky: vertigo, tinnitus, ztráta sluchu a nauzea.
 Sp.zn.sukls74923/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERTIBETIS 16 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka/pomocné
Sp.zn.sukls74923/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERTIBETIS 16 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka/pomocné
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambex 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Účinná látka: Ambroxoli hydrochloridum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambex 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Účinná látka: Ambroxoli hydrochloridum
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls225294/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka Jedna potahovaná
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls225294/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
