PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Štefan Mašek
- před 8 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV PŘÍPRAVKU Abseamed IU/0,5 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje IU epoetinum alfa*, což odpovídá 16,8 mikrogramům/ml 1 předplněná injekční stříkačka s obsahem 0,5 ml obsahuje mezinárodních jednotek (IU), což odpovídá 8,4 mikrogramům epoetinum alfa. * Připraveno v buněčné linii CHO technologií rekombinantní DNA Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v předplněné injekční stříkačce (injekce) Čirý bezbarvý roztok 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Léčba symptomatické anémie spojené s chronickým renálním selháním (CRF) u dospělých a pediatrických pacientů: - Léčba anémie spojené s chronickým renálním selháním u pediatrických i dospělých hemodialyzovaných pacientů a dospělých pacientů dialyzovaných peritoneálně (viz bod 4.4). - Léčba těžké anémie ledvinového původu doprovázené klinickými příznaky u dospělých pacientů s renální insuficiencí, kteří dosud dialyzováni nejsou (viz bod 4.4). Léčba anémie a snížení počtu transfuzí u dospělých pacientů absolvujících chemoterapii pro onemocnění solidními tumory, maligním lymfomem nebo mnohočetným myelomem, pokud je u nich transfuze vzhledem k celkovému zdravotnímu stavu riziková (například při onemocnění srdce nebo při anémii již před počátkem chemoterapie). Abseamed lze použít ke zvýšení přínosu u pacientů, kteří si připravují vlastní (autologní) dávky krve. Jeho použití k této indikaci se musí zvážit s ohledem na hlášené riziko tromboembolických příhod. Léčbu je třeba omezit na pacienty se středně závažnou anémií (hemoglobin (Hb) g/dl (6,2-8,1 mmol/l), bez deficitu železa), nejsou-li k dispozici procedury šetřící krev nebo jsou-li tyto procedury nedostatečné, pokud velká naplánovaná ortopedická operace vyžaduje velké množství krve (4 nebo více jednotek krve u žen nebo 5 nebo více jednotek krve u mužů). Pokud při transfuzi hrozí vysoké riziko komplikací, lze Abseamed použít k omezení expozice alogenním krevním transfuzím u dospělých pacientů, kteří netrpí deficitem železa a jsou již zařazeni do programu velké naplánované ortopedické operace. Použití je třeba omezit na pacienty se středně závažnou anémií (např. Hb g/dl nebo 6,2-8,1 mmol/l), kteří neměli možnost připravit si vlastní (autologní) krevní dávky předem a u nichž se očekává středně závažná ztráta krve ml. Při použití v perioperačním období je zapotřebí vždy dodržovat zásady správného postupu zacházení s krví a krevními deriváty. 4.2 Dávkování a způsob podání Léčba Abseamedem se musí zahájit pod dohledem lékařů, kteří mají zkušenosti s léčbou pacientů se shora uvedenými indikacemi. 2
3 Dávkování Léčba symptomatické anémie u dospělých a pediatrických pacientů s chronickým renálním selháním U pacientů s chronickým renálním selháním se přípravek musí podávat intravenózně (viz bod 4.4). Symptomy a následky anémie se liší podle věku, pohlaví a současně probíhajících onemocnění; léčbu a stav jednotlivých pacientů musí vyhodnotit lékař. Abseamed má být podáván tak, aby se hemoglobin zvýšil nejvýše na hladinu 12 g/dl (7,5 mmol/l). Je třeba se vyhýbat tomu, aby došlo ke většímu zvýšení hemoglobinu než o 2 g/dl (1,25 mmol/l) za období čtyř týdnů. Jestliže k němu dojde, je třeba vhodným způsobem upravit dávku. Vzhledem k intraindividuální variabilitě je možné pozorovat, že občas jsou individuální hodnoty hemoglobinu u pacienta vyšší nebo nižší než požadovaná hladina. Variabilitu hladiny hemoglobinu je vhodné řešit úpravami dávkování, s ohledem na cílový rozsah hemoglobinu 10 g/dl (6,2 mmol/l) až 12 g/dl (7,5 mmol/l). U pediatrických pacientů je doporučený cílový rozsah hemoglobinu 9,5 až 11 g/dl (5,9-6,8 mmol/l). Je třeba se vyhýbat trvalému zvýšení hladiny hemoglobinu na hodnoty vyšší než 12 g/dl (7,5 mmol/l). Jestliže hemoglobin stoupá o více než 2 g/dl (1,25 mmol/l) za měsíc nebo jestliže trvalá hladina hemoglobinu přesáhne 12 g/dl (7,5 mmol/l), snižte dávku epoetinu alfa o 25 %. Jestliže hladina hemoglobinu přesáhne 13 g/dl (8,1 mmol/l), přerušte terapii, dokud neklesne pod 12 g/dl (7,5 mmol/l) a poté terapii epoetinem alfa obnovte při dávce o 25 % nižší než předchozí úroveň. Pacienty je třeba pečlivě sledovat, aby byla zajištěna adekvátní kontrola symptomů anémie při použití nejnižší vyzkoušené dávky epoetinu alfa. Před léčbou a během ní je třeba kontrolovat hladinu železa a v případě potřeby podávat suplementaci železa. Mimoto je třeba před zahájením terapie epoetinem alfa vyloučit jiné možné příčiny anémie, například deficit vitaminu B 12 nebo kyseliny listové. Nedostaví-li se žádaná odpověď na terapii epoetinem alfa, může to mít různé příčiny: deficit železa, kyseliny listové nebo vitaminu B 12 ; intoxikace hliníkem; interkurentní infekce; záněty anebo poranění; okultní krvácení; hemolýza, fibróza kostní dřeně různého původu. Dospělí hemodialyzovaní pacienti: Léčba je rozdělena na dvě fáze: Korekční fáze: 50 IU/kg 3x týdně intravenózně. Pokud je nutná úprava dávky, je třeba ji provádět po stupních trvajících vždy alespoň čtyři týdny. Při každém stupni se dávka zvyšuje nebo snižuje o 25 IU/kg 3x týdně. Udržovací fáze: Úprava dávkování k udržení hemoglobinových hodnot na požadované hladině: Hb mezi 10 a 12 g/dl (6,2-7,5 mmol/l). Doporučená celková týdenní dávka je mezi 75 a 300 IU/kg intravenózní cestou. Dostupné klinické údaje naznačují, že pacienti s velmi nízkými úvodními hodnotami hemoglobinu (< 6 g/dl čili < 3,75 mmol/l) mohou vyžadovat vyšší udržovací dávky než pacienti, jejichž počáteční anémie je méně těžká (Hb > 8 g/dl čili > 5 mmol/l). Pediatričtí pacienti na hemodialýze: Léčba je rozdělena na dvě fáze: Korekční fáze: 50 IU/kg 3x týdně, intravenózně. Pokud je nutná úprava dávky, je třeba ji provádět po stupních 25 IU/kg 3x týdně, s minimálním intervalem mezi jednotlivými stupni vždy alespoň čtyři týdny, dokud není dosaženo požadovaných hodnot. 3
4 Udržovací fáze: Úprava dávkování k udržení hodnot hemoglobinu na požadované úrovni: Hb mezi 9,5 a 11 g/dl (5,9-6,8 mmol/l). Děti s hmotností pod 30 kg většinou vyžadují vyšší udržovací dávky než děti s hmotností nad 30 kg a než dospělí. V klinických studiích byly po 6 měsících léčby zjištěny tyto udržovací dávky: Dávka (IU/kg podáváno 3x týdně) Hmotnost (kg) Střední dávka Obvyklá udržovací dávka < > Dostupné klinické údaje naznačují, že pediatričtí pacienti s velmi nízkými výchozími hodnotami hemoglobinu (< 6,8 g/dl čili < 4,25 mmol/l) mohou vyžadovat vyšší udržovací dávky než pacienti, jejichž počáteční hodnota hemoglobinu je vyšší (> 6,8 g/dl či > 4,25 mmol/l). Dospělí pacienti dialyzovaní peritoneálně Léčba je rozdělena na dvě fáze: Korekční fáze: Počáteční dávka je 50 IU/kg 2x týdně intravenózně. Udržovací fáze: Úprava dávkování k udržení hodnot hemoglobinu na požadované úrovni: Hb mezi 10 a 12 g/dl (6,2-7,5 mmol/l). Udržovací dávka je mezi 25 a 50 IU/kg 2x týdně, rozdělena do 2 stejně velkých injekčních dávek. Dospělí pacienti s renální insuficiencí, ale dosud bez dialýzy: Léčba se dělí do dvou fází: Korekční fáze: Počáteční dávka je 50 IU/kg 3x týdně intravenózní cestou, v případě potřeby se dávkování zvyšuje po 25 IU/kg (3x týdně), dokud není dosaženo požadovaných hodnot (intervaly mezi jednotlivými stupni mají být alespoň čtyři týdny). Udržovací fáze: Je nutná vhodná úprava dávkování k udržení hodnot hemoglobinu na požadované úrovni: Hb mezi 10 a 12 g/dl (6,2-7,5 mmol/l). Prodloužení intervalů mezi dávkami může vyžadovat zvýšení dávky. Maximální dávkování nemá přesáhnout 150 IU/kg 3x týdně. Pacienti s anémií vyvolanou chemoterapií: Epoetin alfa se musí pacientům s anémií (např. koncentrace hemoglobinu 10 g/dl (6,2 mmol/l)) podávat subkutánně. Symptomy a následky anémie se liší podle věku, pohlaví a celkových obtíží způsobených onemocněním; léčbu a stav jednotlivých pacientů musí vyhodnotit lékař. Vzhledem k intraindividuální variabilitě je možné pozorovat, že občas jsou individuální hodnoty hemoglobinu u pacienta vyšší nebo nižší než požadované. Na variabilitu hladiny hemoglobinu je třeba reagovat úpravou dávek, přičemž cílový rozsah hemoglobinu by měl být mezi 10 g/dl (6,2 mmol/l) a 12 g/dl (7,5 mmol/l). Je třeba se vyhnout tomu, aby hladina hemoglobinu byla trvale vyšší než 12 g/dl (7,5 mmol/l); pokyny k příslušné úpravě dávek pro případ, kdy hodnoty hemoglobinu převyšují 12 g/dl (7,5 mmol/l), jsou uvedeny níže. Léčba epoetinem alfa musí pokračovat ještě měsíc po ukončení chemoterapie. Počáteční dávka je 150 IU/kg 3x týdně, podávaná subkutánně. Alternativně lze epoetin alfa podávat v počáteční dávce 450 IU/kg subkutánně, a to jednou týdně. 4
5 - Pokud se po čtyřtýdenní léčbě koncentrace hemoglobinu zvýšily alespoň o 1 g/dl (0,62 mmol/l) anebo pokud počet retikulocytů stoupl o buněk/µl nad počáteční hodnoty, je třeba dávku udržovat na 150 IU/kg 3x týdně nebo 450 IU/kg jednou týdně. - Pokud se koncentrace hemoglobinu zvýšily o < 1 g/dl (< 0,62 mmol/l) anebo počet retikulocytů stoupl o < buněk/µl nad počáteční hodnoty, dávka se zvýší na 300 IU/kg 3x týdně. Pokud po dalších 4 týdnech léčby dávkami 300 IU/kg 3x týdně koncentrace hemoglobinu stoupne o 1 g/dl ( 0,62 mmol/l) anebo počet retikulocytů stoupne o buněk/µl, dávkování se udržuje na 300 IU/kg 3x týdně. Pokud se však hodnoty hemoglobinu zvýšily o <1 g/dl (< 0,62 mmol/l) anebo počet retikulocytů stoupl o < buněk/µl nad počáteční hodnoty, odpověď na terapii epoetinem alfa je nepravděpodobná, a proto je třeba léčbu přerušit. Doporučený dávkovací režim je popsán v následujícím diagramu: 150 IU/kg 3x/týden nebo 450 IU/kg jednou týdně po 4 týdny Zvýšení počtu retikulocytů o /µl nebo zvýšení koncentrace Hb o 1 g/dl Zvýšení počtu retikulocytů o < /µl a zvýšení koncentrace Hb o < 1 g/dl Cílová hladina Hb 300 IU/kg ( 12 g/dl) 3x/týden po 4 týdny Zvýšení počtu retikulocytů o /µl nebo zvýšení koncentrace Hb o 1 g/dl Zvýšení počtu retikulocytů o < /µl a zvýšení koncentrace Hb o < 1 g/dl Přerušte terapii Pacienty je třeba pečlivě sledovat, aby se zajistilo, že je podávána nejnižší účinná dávka epoetinu alfa pro adekvátní kontrolu příznaků anémie. Úprava dávkování k udržení koncentrace hemoglobinu mezi hodnotami 10 g/dl-12 g/dl (6,2-7,5 mmol/l): Jestliže hladina hemoglobinu vzroste o více než 2 g/dl (1,25 mmol/l) za měsíc, nebo pokud hladina hemoglobinu překročí 12 g/dl (7,5 mmol/l), snižte dávku epoetinu alfa o přibližně %. Jestliže hladina hemoglobinu přesáhne 13 g/dl (8,1 mmol/l), přerušte terapii, dokud hladina neklesne pod 12 g/dl (7,5 mmol/l), a potom podávejte epoetin alfa dále v dávce o 25 % nižší než předchozí dávka. 5
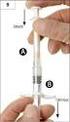
6 Dospělí chirurgičtí pacienti, kteří si připravují vlastní (autologní) dávky krve: Abseamed se podává intravenózní cestou. V případě dárcovství krve se přípravek Abseamed musí podat po ukončení procedury darování krve. Středně anemičtí pacienti (hematokrit %) vyžadující předzásobení krví ve výši 4 jednotky by měli být léčeni přípravkem Abseamed v dávce 600 IU/kg tělesné hmotnosti 2x týdně po dobu 3 týdnů před operací. Při použití tohoto režimu bylo možno odebrat 4 jednotky krve od 81 % pacientů léčených epoetinem alfa ve srovnání s 37 % u pacientů, kteří obdrželi placebo. Léčba epoetinem alfa snížila riziko expozice homologní krvi o 50 % ve srovnání s pacienty, kteří nebyli léčeni epoetinem alfa. Všem pacientům léčeným přípravkem Abseamed je nutno zajistit přiměřenou suplementaci železem (např. perorálně podávané přípravky železa v dávkách 200 mg elementárního železa denně) během celé léčby. Podávání železa je třeba zahájit co nejdříve, i několik týdnů před předzásobením vlastní krví, aby se před zahájením léčby přípravkem Abseamed vytvořila velká zásoba železa. Dospělí pacienti před velkou plánovanou ortopedickou operací: Přípravek je třeba podávat subkutánně. Doporučený dávkovací režim je 600 IU epoetinu alfa na kg a podává se týdně po tři týdny (21., 14. a 7. den) před výkonem, a v den výkonu (0. den). V případech, kde je z lékařského hlediska nutno zkrátit čas do operace na méně než tři týdny, podává se 300 IU/kg epoetinu alfa denně po 10 po sobě jdoucích dní před výkonem, v den operace a po čtyři dny po ní. Pokud při hematologickém hodnocení v předoperačním období hladina hemoglobinu dosáhne 15 g/dl (9,38 mmol/l) nebo více, podávání epoetinu alfa je třeba zastavit a další dávku již nepodávat. Je důležité se ujistit, že pacient při zahájení léčby netrpí deficitem železa. Všem pacientům léčeným epoetinem alfa je nutno zajistit přiměřenou suplementaci železem (tj. perorálně podávané přípravky železa v dávkách 200 mg Fe 2+ denně) během celé léčby epoetinem alfa. Podávání železa je třeba zahájit dle možností ještě před terapií epoetinem alfa, aby se vytvořila přiměřená zásoba železa. Způsob podání Jako u všech přípravků podávaných injekčně je třeba před aplikací vždy zkontrolovat kvalitu injekčního roztoku, zda neobsahuje částice nebo zda nedošlo ke změně barvy. Abseamed je sterilní výrobek neobsahující konzervační látky, určený pouze k jednorázovému použití. Podávejte požadované množství. Nepodávejte intravenózní infuzí ani ve směsi s jinými léčivými přípravky (další informace jsou uvedeny v bodě 6.6). Intravenózní injekce: aplikují se po dobu nejméně jedné až pěti minut, v závislosti na celkové dávce. U hemodialyzovaných pacientů je možné podat během dialýzy bolus do vhodného žilního vstupu dialyzační linky. Alternativně lze injekci podat při ukončení dialýzy, hadičkou zavedené dialyzační jehly, a pak hadičku propláchnout 10 ml fyziologického roztoku pro zajištění uspokojivého vpravení přípravku do oběhu. Pomalejší injekce je vhodnější u pacientů, kteří na léčbu reagují chřipkovitými příznaky. Subkutánní injekce: obecně se nemá překročit objem 1 ml na jedno místo vpichu. Větší objem je třeba rozdělit na aplikace do několika míst. Injekce se podávají do končetin nebo do přední břišní stěny. V případech, kdy lékař rozhodne, že je možné, aby pacient nebo jeho pečovatel bezpečně a účinně aplikoval subkutánní injekci přípravku Abseamed, je nutné pacientovi nebo pečovateli poskytnout přesné instrukce týkající se správné dávky a způsobu podání přípravku. 6
7 Pokyny, jak samostatně podávat injekci přípravku jsou k dispozici na konci příbalové informace. 4.3 Kontraindikace - Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě Pacientům, u kterých se po léčbě jakýmkoli erytropoetinem vyvine čistá aplazie červené krevní řady (pure red cell aplasia, PRCA), se Abseamed ani jiný erytropoetin nesmí podávat (viz bod 4.4 Čistá aplazie červené krevní řady). - Nekontrolovaná hypertenze. - Chirurgičtí pacienti, u kterých z jakéhokoli důvodu nelze zajistit přiměřenou antitrombotickou profylaxi. - U pacientů suplementovaných epoetinem alfa musí být respektovány všechny kontraindikace spojené s programem předoperačního autologního odběru. U pacientů před velkou plánovanou ortopedickou operací, kteří neměli možnost připravit si vlastní (autologní) dávky krve, je použití epoetinu alfa kontraindikováno, pokud pacient trpí závažným onemocněním věnčitých a periferních tepen, karotid či mozkových cév, včetně nedávno prodělaného infarktu myokardu anebo mozkové cévní příhody. 4.4 Zvláštní upozornění a opatření pro použití Celkové poruchy U všech pacientů užívajících epoetin alfa je třeba pečlivě monitorovat krevní tlak, a podle potřeby jej regulovat. Epoetin alfa je nutno používat se zvýšenou opatrností u neléčené, nedostatečně léčené či špatně kontrolovatelné hypertenze. Může být nutné zavést či zintenzívnit léčbu antihypertenzivy. Pokud krevní tlak nelze udržet pod kontrolou, je třeba léčbu epoetinem alfa přerušit. Opatrnosti je také třeba při podávání epoetinu alfa při epilepsii a při chronickém selhání jater. U pacientů s karcinomem a chronickým renálním selháváním je třeba hladiny hemoglobinu systematicky sledovat, dokud není dosaženo stabilních hodnot, a v pravidelných intervalech pokračovat i potom. U všech pacientů je třeba pečlivě monitorovat hladiny hemoglobinu vzhledem k potencionálně zvýšenému riziku tromboembolických příhod a fatálních případů, když jsou pacienti léčeni s hladinou hemoglobinu nad cílovou hladinou stanovenou pro indikaci použití. Během léčby epoetinem alfa se může vyvinout mírné a podané dávce úměrné zmnožení trombocytů, které však zůstává v rozsahu normálních hodnot. V dalším průběhu terapie toto zmnožení opět odezní. Kromě toho byly hlášeny i případy trombocytemie nad normálními hodnotami. Doporučuje se počty trombocytů pravidelně monitorovat během prvních 8 týdnů terapie. Před nasazením epoetinu alfa je třeba uvážit a případně léčit všechny ostatní příčiny anémie (nedostatek železa, hemolýzu, ztrátu krve, deficit vitaminu B 12 nebo kyseliny listové). Ve většině případů hodnoty feritinu v séru klesají současně se zvýšením hodnot hematokritu. K zajištění optimální odezvy na epoetin alfa by měly být zajištěny přiměřené zásoby železa: - suplementace železem v dávkách mg Fe 2+ /den perorálně ( mg Fe 2+ /den u dětí) se doporučuje u pacientů s chronickým renálním selháním a sérovou hladinou feritinu pod 100 ng/ml - podání perorálních dávek železa mg Fe 2+ /den se doporučuje u všech pacientů s nádorovým onemocněním a saturací transferinem pod 20 %. Výše uvedené dodatečné faktory anémie je třeba pečlivě zvážit také při rozhodování o zvýšení dávky epoetinu alfa u pacientů s nádorovým onemocněním. 7
8 U pacientů léčených epoetinem alfa byl velmi vzácně pozorován vývoj nebo exacerbace porfyrie. Epoetin alfa by měl být podáván s opatrností pacientům s porfyrií. Za účelem zdokonalení sledovanosti přípravků stimulujících tvorbu erytrocytů (ESA), by se měly názvy podaných přípravků ESA zřetelně zaznamenávat (nebo uvádět) do dokumentace pacienta. Pacienti mají být převedeni z léčby jedním typem ESA na jiný pouze pod náležitým dohledem. Čistá aplazie červené krevní řady (PRCA) Protilátkami zprostředkovaná PRCA byla pozorována po několika měsících až letech subkutánního podávání erytropoetinu zejména u pacientů s chronickým selháním ledvin. Případy byly také hlášeny u pacientů s hepatitidou C léčených interferonem a ribavirinem, když byly epoetiny užívány současně. Abseamed není schválen k léčbě anémie související s hepatitidou C. U pacientů, u nichž se vyvine náhlá ztráta účinnosti charakterizovaná poklesem hemoglobinu (1 až 2 g/dl nebo 0,62 až 1,25 mmol/l na měsíc) a zvýšenou potřebou transfuzí, je třeba zjistit počet retikulocytů a přešetřit typické příčiny špatné odpovědi na léčbu (deficit železa, kyseliny listové či vitaminu B 12, intoxikaci hliníkem, infekci či zánět, ztrátu krve a hemolýzu). Paradoxní pokles hemoglobinu a rozvoj závažné anémie související s nízkým počtem retikulocytů musí být podnětem k ukončení léčby přípravkem Abseamed a k provedení testu na anti-erytropoetinové protilátky. Při diagnóze PRCA by mělo být zváženo vyšetření kostní dřeně. Pacienti by neměli být převáděni na jinou léčbu ESA vzhledem ke zkřížené reakci. Léčba symptomatické anémie u dospělých a pediatrických pacientů s chronickým renálním selháním Údaje o imunogenicitě subkutánního podání Abseamedu u pacientů s rizikem protilátkami zprostředkovanou PRCA, tj. pacientů s renální anémií, nejsou dostačující. Proto se u pacientů s renální anémií musí tento léčivý přípravek podávat intravenózně. U pacientů s chronickým renálním selháním se má hodnota hemoglobinu zvyšovat přibližně o 1 g/dl (0,62 mmol/l) měsíčně; přírůstek by však neměl přesáhnout 2 g/dl (1,25 mmol/l) měsíčně, aby se minimalizovalo riziko zvýšení hypertenze. Koncentrace hemoglobinu U pacientů s chronickým renálním selháním by neměla udržovací koncentrace hemoglobinu překročit horní mez cílové koncentrace hemoglobinu, která je doporučena v bodě 4.2. V klinických studiích bylo pozorováno zvýšení rizika úmrtí, závažných kardiovaskulárních příhod nebo cerebrovaskulárních příhod včetně cévní mozkové příhody při podávání ESA k zajištění cílové hladiny hemoglobinu vyšší než 12 g/dl (7,5 mmol/l). Kontrolované klinické zkoušky neprokázaly výrazné přínosy odpovídající podávání epoetinů, pokud byla koncentrace hemoglobinu vyšší než hladina potřebná ke kontrole symptomů anémie a k tomu, aby nebylo potřeba transfuze krve. Někteří pacienti s delšími dávkovacími intervaly podávání epoetinu alfa (delšími než jeden týden) si nemusí udržet adekvátní hladiny hemoglobinu (viz bod 5.1) a mohou potřebovat zvýšení dávky epoetinu alfa. Hladiny hemoglobinu musí být pravidelně sledovány. U hemodialyzovaných pacientů se objevila trombóza arteriovenózní spojky, zejména u pacientů s tendencí k hypotenzi nebo s komplikacemi na arteriovenózních shuntech (například stenózy, výdutě atd.). U těchto pacientů je doporučena časná revize shuntu a prevence trombózy například podáváním kyseliny acetylsalicylové. V ojedinělých případech byla zjištěna hyperkalémie, ačkoli příčinná souvislost nebyla zjištěna. U pacientů s chronickým renálním selháním je třeba monitorovat hladiny sérových elektrolytů. Pokud 8
9 bude zjištěna zvýšená či stoupající sérová hladina draslíku, je třeba zvážit vysazení epoetinu alfa až do korekce sérových hodnot draslíku a kromě toho zvolit příslušnou léčbu hyperkalémie. Zvýšené hodnoty hematokritu v průběhu terapie epoetinem alfa často přinutí zvýšit dávky heparinu během hemodialýzy. Jestliže heparinizace není optimální, dialyzační systém se může ucpat. Dosud dostupné informace naznačují, že korekce anémie epoetinem alfa neurychluje progresi renální nedostatečnosti u dospělých pacientů s renální nedostatečností, kteří dosud dialyzováni nebyli. Léčba pacientů s anémií v důsledku chemoterapie Erytropoetiny jsou růstové faktory, které primárně stimulují tvorbu erytrocytů. Erytropoetinové receptory mohou být exprimovány na povrchu různých nádorových buněk. Stejně jako u všech ostatních růstových faktorů i zde existují obavy, že by epoetiny mohly stimulovat růst některého typu tumorů. V několika kontrolovaných studiích nebylo prokázáno, že by epoetiny zlepšily celkovou dobu přežití, nebo že by snižovaly riziko nádorové progrese u pacientů s anémií související s rakovinou. V kontrolovaných klinických studiích s užíváním epoetinu alfa a dalších přípravků ESA bylo prokázáno: - že se u pacientů s rakovinou hlavy nebo krku v pokročilém stádiu léčených radiační terapií při podávání těchto přípravků na cílové koncentrace hemoglobinu vyšší než 14 g/dl (8,7 mmol/l) snížila lokoregionální kontrola, - že se u pacientů s metastatickou rakovinou prsu léčených chemoterapií při podávání těchto přípravků na cílové koncentrace hemoglobinu g/dl (7,5-8,7 mmol/l) zkrátila celková doba přežití a zvýšil se počet úmrtí přičítaných progresi onemocnění během 4 měsíců, - že se u pacientů s aktivním maligním onemocněním, kteří nebyli léčeni ani chemoterapií ani radiační terapií, při podávání těchto přípravků na cílové koncentrace hemoglobinu 12 g/dl (7,5 mmol/l), zvýšilo riziko úmrtí. ESA nejsou indikovány pro použití u této populace pacientů. Vzhledem k výše uvedenému by v některých klinických situacích měla být upřednostňovanou léčbou při zvládání anémie u pacientů s rakovinou krevní transfuze. Rozhodnutí o podání rekombinantních erytropoetinů musí být provedeno po vyhodnocení přínosů a rizik se zapojením konkrétního pacienta, a při zvážení konkrétního klinického kontextu. Při takovémto vyhodnocení musí být zvažovány faktory, jako je typ nádoru a jeho stádium; stupeň anémie; pravděpodobnost přežití; prostředí, ve kterém je pacient léčen a pacientovy preference (viz bod 5.1). U pacientů s nádorovým onemocněním léčených chemoterapií je třeba při posuzování vhodnosti terapie epoetinem alfa (pacienti, u nichž transfuze představuje riziko) počítat se 2 3 týdenním zpožděním po podání léku, než se objeví erytropoetinem indukované erytrocyty. Vzhledem ke zvýšenému výskytu trombotických cévních příhod (TVE) u pacientů s nádorovým onemocněním užívajících přípravky stimulující tvorbu erytrocytů (viz bod 4.8) je třeba pečlivě zvážit rizika a přínos léčby (epoetinem alfa), zejména u pacientů s nádorovým onemocněním a zvýšeným rizikem cévní trombózy, například při obezitě, a u pacientů s anamnézou TVE (například s hlubokou žilní trombózou nebo plicní embolií). Byla navržena investigativní studie (studie BEST) u žen s metastatickou rakovinou prsu, aby se zjistilo, zda léčba přípravkem epoetin alfa, která pokračuje i po úpravě anémie, může zlepšit výsledky léčby. V této studii byl výskyt fatálních tromboembolických příhod vyšší u pacientů užívajících epoetin alfa než u pacientů užívajících placebo (viz bod 5.1). Chirurgičtí pacienti v programu předoperačního autologního odběru Musí se respektovat všechna zvláštní upozornění a opatření spojená s programem autologní krve, zejména běžná náhrada objemu. 9
10 Pacienti před velkou naplánovanou ortopedickou operací U těchto pacientů je třeba zjistit příčinu anémie a pokud možno zajistit vhodnou léčbu ještě před zahájením léčby epoetinem alfa. Trombotické příhody mohou u této populace znamenat riziko, a tuto možnost je třeba pečlivě zvážit ve srovnání s očekávaným přínosem léčby u této skupiny pacientů. Pacientům zařazeným do programu velkých plánovaných ortopedických operací je třeba zajistit přiměřenou antitrombotickou profylaxi u operovaných pacientů se mohou vyvinout trombotické a cévní příhody, zejména pokud trpí základním kardiovaskulárním onemocněním. Mimoto je třeba zvláštní opatrnosti u pacientů s predispozicí k rozvoji hluboké žilní trombózy (DVT, deep vein thrombosis). U pacientů s počáteční hodnotou hemoglobinu > 13 g/dl (> 8,1 mmol/l) také nelze vyloučit možnost, že léčba epoetinem alfa bude spojena se zvýšeným rizikem pooperačních trombotických a cévních příhod. Epoetin alfa se proto nepodává pacientům s počáteční koncentrací hemoglobinu > 13 g/dl (> 8,1 mmol/l). Pomocné látky Tento přípravek obsahuje méně než 1 mmol sodíku (23 mg) na 1 předplněnou injekční stříkačku, tj. v podstatě je bez sodíku. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nejsou žádné důkazy, že by léčba epoetinem alfa ovlivňovala metabolismus jiných léčivých přípravků. Protože se však cyklosporin váže na červené krvinky, existuje možnost vzájemné interakce. Pokud se epoetin alfa podává současně s cyklosporinem, je třeba monitorovat hladinu cyklosporinu v krvi a upravit dávky tohoto cytostatika, jakmile se hodnoty hematokritu zvýší. Neexistují důkazy pro interakci mezi epoetinem alfa a granulocytární kolonie stimulujícím faktorem (G-CSF) či faktorem stimulujícím granulocytární a makrofágové kolonie (GM-CSF), která by měla vliv na hematologickou diferenciaci anebo proliferaci nádorových buněk bioptických vzorků tumorů in vitro. Paediatrická populace Studie interakcí byly provedeny pouze u dospělých. 4.6 Fertilita, těhotenství a kojení Těhotenství Údaje o podávání epoetinu alfa těhotným ženám jsou omezené nebo nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Proto: - U pacientek s chronickým renálním selháním se Abseamed v těhotenství použije pouze tehdy, pokud potenciální přínos převáží potenciální rizika pro plod. - U těhotných nebo kojících chirurgických pacientek účastnících se programu přípravy autologní krve se použití epoetinu alfa nedoporučuje. Kojení Není známo, zda se epoetin alfa vylučuje do lidského mateřského mléka. Epoetin alfa by měl být užíván s opatrností u kojících žen. Rozhodnutí, zda pokračovat či ukončit kojení nebo pokračovat či ukončit léčbu epoetinem alfa, by mělo být učiněno s ohledem na posouzení prospěchu kojení pro dítě a přínosu léčby epoetinem alfa u ženy. U kojících chirurgických pacientek účastnících se programu přípravy autologní krve se použití epoetinu alfa nedoporučuje. 10
11 Fertilita Údaje o fertilitě nejsou k dispozici. 4.7 Účinky na schopnost řídit a obsluhovat stroje Abseamed nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. 4.8 Nežádoucí účinky Souhrn bezpečnostního profilu Nejčastější nežádoucí účinek u pacientů s nádorovým onemocněním a u pacientů s chronickým renálním selháním léčených epoetinem alfa je zvýšení krevního tlaku či zhoršení stávající hypertenze úměrné podané dávce. Musí se provádět monitorování krevního tlaku, především na počátku terapie (viz bod 4.4). Další obvyklé nežádoucí účinky, které se objevily v klinických studiích s epoetinem alfa, jsou hluboká žilní trombóza, plicní embolie, záchvaty, průjem, nauzea, bolest hlavy, příznaky podobné chřipce, pyrexie, vyrážka a zvracení. Příznaky podobné chřipce, například bolesti hlavy, kloubů, svalů a pyrexie se mohou vyskytnout zvláště na počátku léčby. Četnost jejich výskytu se liší v závislosti na indikaci (viz tabulka níže). Ve studiích s delším intervalem dávkování u dospělých pacientů s renální insuficiencí, kteří dosud nepodstoupili dialýzu, byly hlášeny kogesce respiračního traktu, která zahrnuje příhody kongesce horních cest dýchacích, nosní kongesci a nasofaryngitidu. Byly hlášeny závažné nežádoucí účinky zahrnující žilní a arteriální trombózu a embolii (včetně několika fatálních případů), například hluboká žilní trombóza, plicní embolie, arteriální trombóza (včetně infarktu myokardu a ischemie myokardu), retinální trombóza a trombóza arteriovenózní spojky (včetně dialyzačního vybavení). V klinických zkouškách s epoetinem alfa byl dále hlášen výskyt cévních mozkových příhod (včetně mozkového infarktu a mozkového krvácení) a tranzitorní ischemické ataky. Hlášen byl výskyt aneurysmat. Byly hlášeny hypersenzitivní reakce, včetně vyrážky, kopřivky, anafylaktické reakce a angioedému. U pacientů s normálním nebo nízkým krevním tlakem léčených epoetinem alfa se objevily také tyto reakce: hypertenzní krize s encefalopatií a záchvaty, vyžadující okamžitý zásah lékaře a intenzivní lékařskou péči. Zvláštní pozornost je třeba věnovat náhlým bodavým migrenózním bolestem hlavy jako možnému varovnému signálu. Protilátkami zprostředkovaná čistá aplazie červené krevní řady byla hlášena velmi vzácně (u < 1/ případů na pacienta za rok) po několika měsících až letech léčby epoetinem alfa (viz bod 4.4). Celkový bezpečnostní profil přípravku epoetin alfa byl zkoumán u 142 pacientů s chronickým renálním selháním a u 765 pacientů s nádorovým onemocněním, kteří se účastnili dvou dvojitě zaslepených placebem kontrolovaných klinických registračních studií. Nežádoucí účinky související s lékem hlášené u 0,2 % subjektů léčených epoetinem z těchto klinických studií, dalších klinických studií a post-marketingových zkušeností jsou uvedeny níže. Jsou klasifikovány podle tříd orgánových systémů a seřazeny podle četnosti výskytu. Tabulkově uspořádaný seznam nežádoucích účinků Četnost je definována následujícím způsobem: velmi časté (> 1/10), časté (> 1/100 až < 1/10), méně časté (> 1/1 000 až <1 /100), vzácné (> 1/ až < 1/1 000), velmi vzácné (< 1/10 000), není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. 11
12 Třídy orgánových systémů Četnost Nežádoucí účinek Poruchy krve a lymfatického systému Méně časté Trombocytemie (pacienti s nádorovým onemocněním) Četnost neznámá Erytropoetinovými protilátkami zprostředkovaná čistá aplazie červené krevní řady 1 Trombocytemie (pacienti s chronickým renálním selháním) Poruchy imunitního systému Četnost neznámá Anafylaktická reakce Hypersenzitivita Poruchy nervového systému Velmi časté Bolest hlavy (pacienti s nádorovým onemocněním) Časté Záchvaty (pacienti s chronickým renálním selháním) Bolest hlavy (pacienti s chronickým renálním selháním) Cévní mozková příhoda Méně časté Mozkové krvácení 2 Záchvaty (pacienti s nádorovým onemocněním) Četnost neznámá Cerebrovaskulární příhoda 2 Hypertenzní encefalopatie Tranzitorní ischemické ataky Poruchy oka Četnost neznámá Retinální trombóza Srdeční poruchy Četnost neznámá Infarkt myokardu Cévní poruchy Časté Hluboká žilní trombóza 2 (pacienti s nádorovým onemocněním) Hypertenze Četnost neznámá Hluboká žilní trombóza 2 (pacienti s chronickým renálním selháním) Arteriální trombóza Respirační, hrudní a mediastinální poruchy Časté Četnost neznámá Gastrointestinální poruchy Velmi časté Nauzea Časté Poruchy kůže a podkožní tkáně Poruchy svalové soustavy a pojivové tkáně Méně časté Časté Četnost neznámá Velmi časté Časté Méně časté Četnost neznámá Vrozené, familiální a Četnost neznámá Porfyrie 12 Hypertenzní krize Plicní embolie 2 (pacienti s nádorovým onemocněním) Plicní embolie 2 (pacienti s chronickým renálním selháním) Průjem (pacienti s nádorovým onemocněním) Zvracení Průjem (pacienti s chronickým renálním selháním) Vyrážka Angioedém Kopřivka Artralgie (pacienti s chronickým renálním selháním) Artralgie (pacienti s nádorovým onemocněním) Myalgie (pacienti s nádorovým onemocněním) Myalgie (pacienti s chronickým renálním selháním)
13 Poranění, otravy a procedurální komplikace Časté 1 Četnost nelze z klinických studií určit 2 Včetně případů s fatálním následkem. Popis vybraných nežádoucích účinků Pacienti s chronickým renálním selháním Třídy orgánových systémů Četnost Nežádoucí účinek genetické vady Celkové poruchy a reakce v místě aplikace Velmi časté Pyrexie (pacienti s nádorovým onemocněním) Příznaky podobné chřipce (pacienti s chronickým renálním selháním) Časté Příznaky podobné chřipce (pacienti s nádorovým onemocněním) Četnost neznámá Neúčinnost léčivých látek Periferní edém Pyrexie (pacienti s chronickým renálním selháním) Reakce v místě vpichu injekce Vyšetření Četnost neznámá Pozitivita na antierytropoetinovou protilátku 1 Trombóza arteriovenózní spojky, včetně dialýzy (pacienti s chronickým renálním selháním) U pacientů s chronickým renálním selháním může hladina hemoglobinu vyšší než 12 g/dl (7,5 mmol/l) souviset se zvýšeným rizikem kardiovaskulárních příhod, včetně úmrtí (viz bod 4.4). Může dojít k trombóze arteriovenózní spojky, zejména u pacientů s tendencí k hypotenzi nebo s komplikacemi na arteriovenózních shuntech (například stenózy, výdutě atd.), (viz bod 4.4). Pacienti s nádorovým onemocněním U pacientů s nádorovým onemocněním užívajících přípravky ESA, včetně pacientů užívajících epoetin alfa, byl hlášen vyšší výskyt tromboembolických příhod (viz bod 4.4). Pacienti před operací U pacientů před velkou plánovanou ortopedickou operací, kteří měli počáteční hodnotu hemoglobinu g/dl (6,2-8,1 mmol/l), byl výskyt trombotických/cévních příhod (většinou hluboké žilní trombózy) v celkové populaci pacientů zapojené do klinických studií podobný, a to u více skupin pacientů s různými dávkami epoetinu alfa i u placebové skupiny; klinické zkušenosti jsou však omezené. U pacientů s počáteční hodnotou hemoglobinu > 13 g/dl (8,1 mmol/l) mimoto nelze vyloučit možnost, že léčba epoetinem alfa může být spojena se zvýšeným rizikem pooperačních trombotických a cévních příhod. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. 13
14 4.9 Předávkování Terapeutické rozmezí epoetinu alfa je široké. Předávkování epoetinem alfa může vyvolat zesílené farmakologické účinky tohoto hormonu. Dosáhne-li hemoglobin nebo hematokrit příliš vysokých hodnot, je možné provést flebotomii. Další podpůrnou péči je třeba zajistit podle potřeby. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: jiné antianemické přípravky, ATC kód: B03XA01 Abseamed je tzv. podobným biologickým léčivým přípravkem ( biosimilar ). Podrobné informace jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky Mechanismus účinku Erytropoetin je glykoprotein, který jako mitotický stimulační faktor a diferenciační hormon stimuluje tvorbu erytrocytů z prekurzorů kompartmentu kmenových buněk. Zdánlivá molekulární hmotnost erytropoetinu je daltonů. Bílkovinná frakce tvoří asi 58 % molekuly a skládá se ze 165 aminokyselin. Čtyři cukerné řetězce jsou k bílkovině připojeny prostřednictvím tří N-glykosidických vazeb a jedné O-glykosidické vazby. Epoetin alfa získaný genovou technologií je glykosylován a je aminokyselinovým a sacharidovým složením identický s endogenním lidským erytropoetinem, který byl izolován z moči anemických pacientů. Abseamed má nejvyšší možnou čistotu dosažitelnou současnou technologií. Je důležité, že při koncentracích léčivé látky používané u lidí nejsou zjistitelná žádná rezidua buněčné linie, používané k produkci látky. Farmakodynamické účinky Biologická účinnost epoetinu alfa byla prokázána na různých modelech u pokusných zvířat in vivo (normální a anemické krysy, polycytemické myši). Po podání epoetinu alfa stoupají počty erytrocytů, hodnoty Hb a počty retikulocytů, i rychlost inkorporace izotopu 59 Fe. U erythroidních jaderných buněk sleziny byla po inkubaci s epoetinem alfa in vitro (kultura myších slezinných buněk) zjištěna zvýšená inkorporace 3 H-thymidinu. Klinická účinnost a bezpečnost V kulturách lidských buněk kostní dřeně se podařilo dokázat, že epoetin alfa stimuluje specificky tvorbu erytrocytů a neovlivní leukopoezu. Cytotoxické účinky epoetinu alfa na kostní dřeň nebyly zjištěny. 721 pacientů s nádorovým onemocněním léčených neplatinovými chemoterapeutiky bylo zařazeno do tří placebem kontrolovaných studií, z toho 389 pacientů s hematologickými malignitami (221 pacientů s mnohočetným myelomem, 144 s nehodgkinským lymfomem a 24 pacientů s jinými hematologickými malignitami) a 332 pacientů se solidními tumory (172 pacientů s karcinomem prsu, 64 s gynekologickými nádory, 23 s nádory plic, 22 s nádory prostaty, 21s nádory zažívacího ústrojí a 30 s jinými typy tumorů). Do dvou velkých otevřených studií bylo zařazeno 2697 pacientů s nádorovým onemocněním absolvujících chemoterapii neplatinovými preparáty, z toho 1895 pacientů se solidními tumory (683 s tumory prsu, 260 s tumory plic, 174 s gynekologickými tumory, 300 s tumory zažívacího ústrojí a 478 s jinými typy tumorů) a 802 pacientů s hematologickými malignitami. 14
15 V prospektivní, randomizované, dvojitě zaslepené a placebem kontrolované klinické studii, které se účastnilo 375 anemických pacientů s různými nemyeloidními malignitami, absolvujícími chemoterapii neplatinovými přípravky, se významně snížily následky anémie (např. únava, úbytek energie a omezení aktivity), a to podle měření za použití těchto dotazníků a hodnotících škál: funkční hodnocení protinádorové terapie-anémie (FACT-An) (a to jak na všeobecné hodnotící škále, tak i škále únavy) a nádorová lineární analogová škála (CLAS). Dvě jiné menší, randomizované a placebem kontrolované studie nevykázaly významné zlepšení u parametrů kvality života na škále EORTC-QLQ-C30 resp. CLAS. Erytropoetin je růstový faktor, který primárně stimuluje tvorbu erytrocytů. Erytropoetinové receptory mohou být exprimovány na povrchu různých nádorových buněk. Přežití a doba progrese byla zkoumána v pěti velkých kontrolovaných studiích zahrnujících celkem pacientů, čtyři studie byly dvojitě zaslepené, kontrolované placebem a jedna studie byla otevřená. Studie zahrnovaly buď pacienty, kteří byli léčeni chemoterapií (dvě studie) nebo populaci pacientů, pro kterou nejsou indikovány přípravky stimulující tvorbu erytrocytů: anémie u pacientů s rakovinou, kteří nejsou léčeni chemoterapií, a pacienti s rakovinou hlavy a krku léčených radioterapií. Cílové koncentrace hemoglobinu byly ve dvou studiích > 13 g/dl (8,1 mmol/l); ve zbývajících studiích g/dl (7,5-8,7 mmol/l). V otevřené studii nebyl prokázán žádný rozdíl v celkové době přežití mezi pacienty léčenými rekombinantním lidským erytropoetinem a kontrolami. Ve čtyřech studiích kontrolovaných placebem se pohybovala míra rizika celkového přežití mezi 1,25 a 2,47 ve prospěch kontrol. Tyto studie ukázaly konzistentní nevysvětlitelné, statisticky významné zvýšení mortality u pacientů s anémií spojenou s různými typy obvyklých nádorových onemocnění, kterým se podával rekombinantní lidský erytropoetin v porovnání s kontrolními skupinami. Výsledné celkové přežití v těchto zkouškách není možné dostatečně vysvětlit rozdíly ve výskytu trombózy a příbuzných komplikací mezi pacienty, kteří dostávali rekombinantní lidský erytropoetin a těmi z kontrolní skupiny. Byla rovněž provedena analýza údajů z 53 kontrolovaných klinických studií s několika epoetiny u více než pacientů s rakovinou (chemoterapie, radioterapie, chemoradioterapie nebo neléčení). Meta-analýza údajů celkového přežití vygenerovala odhad míry rizika přežití na 1,06 ve prospěch kontrolních skupin (95 % CI: 1,00, 1,12; 53 zkoušek a pacientů) a pro pacienty s rakovinou léčené chemoterapií byla míra celkové doby přežití 1,04 (95 % CI: 0,97, 1,11; 38 zkoušek a pacientů). Meta-analýzy rovněž ukázaly konzistentní a významné zvýšení relativního rizika tromboembolických příhod u pacientů s rakovinou léčených rekombinantním lidským erytropoetinem (viz bod 4.4). V randomizované, dvojitě zaslepené, placebem kontrolované studii se zařazenými pacienty s chronickým renálním selháním, kteří nebyli dialyzováni, s diabetem typu 2 a hladinou hemoglobinu 11 g/dl, dostávali pacienti buď darbepoetin alfa k dosažení cílové hladiny hemoglobinu 13 g/dl nebo placebo (viz bod 4.4). Studie neprokázala snížení rizika všech případů úmrtnosti, kardiovaskulární úmrtnosti ani konečné fáze renálního onemocnění (ESRD). Analýza jednotlivých případů ukázala následující HR (95 % CI): úmrtí 1,05 (0,92, 1,21), cévní mozková příhoda 1,92 (1,38, 2,68), městnavé srdeční selhání (CHF) 0,89 (0,74, 1,08), infarkt myokardu (MI) 0,96 (0,75, 1,23), hospitalizaci kvůli ischémii myokardu 0,84 (0,55, 1,27), ESRD 1,02 (0,87, 1,18). 5.2 Farmakokinetické vlastnosti Absorpce Biologická dostupnost subkutánně podaného epoetinu alfa je mnohem nižší než po intravenózním podání přibližně 20 %. 15
16 Eliminace Intravenózní podání Měření hladin epoetinu alfa po opakované intravenózně podané dávce ukázalo poločas eliminace přibližně 4 hodiny u zdravých dobrovolníků a mírně prodloužené poločasy u pacientů s renálním selháním přibližně 5 hodin. Poločas přibližně 6 hodin byl hlášen u dětí. Subkutánní podání Sérové hladiny epoetinu alfa jsou po subkutánní injekci mnohem nižší než po injekci intravenózní. Hladina stoupá pomalu a dosahuje maxima 12 až 18 hodin po podání. Dosažené maximum je vždy zřetelně nižší než po intravenózním podání (přibližně 20x). Kumulace nevzniká hladiny jsou stejné při stanovení za 24 hodin po první injekci nebo za 24 hodin po injekci poslední. Poločas eliminace je u subkutánního podání obtížné určit; odhaduje se na 24 hodiny. 5.3 Předklinické údaje vztahující se k bezpečnosti V některých předklinických toxikologických studiích u psů a potkanů, ne však u opic, byla terapie epoetinem alfa spojena se subklinickou fibrózou kostní dřeně (fibróza kostní dřeně je známou komplikací chronického renálního selhání u lidí a může souviset se sekundárním hyperparatyroidismem anebo s neznámými faktory. Výskyt této fibrózy se v jiné studii nezvýšil u dialyzovaných pacientů, kteří byli léčeni epoetinem alfa po 3 roky v porovnání s kontrolní skupinou dialyzovaných pacientů, kteří epoetinem alfa léčeni nebyli). Ve studiích na zvířatech epoetin alfa při podávání v týdenních dávkách přibližně 20x vyšších než odpovídá doporučeným týdenním dávkám u člověka, průkazně snižoval tělesnou hmotnost, opožďoval osifikaci a zvyšoval mortalitu plodu. Tyto změny byly vyhodnoceny jako sekundární, závislé na zpomalení přírůstku hmotnosti matky. Epoetin alfa nevyvolal změny v testech mutagenity na kulturách bakteriálních a savčích buněk ani v mikronukleárním testu u myší in vivo. Dlouhodobé studie karcinogenity provedeny nebyly. V literatuře existují protichůdné názory o tom, zda erytropoetin může hrát významnou roli při proliferaci tumoru. Informace o tom vycházejí z nálezů, získaných in vitro ze vzorků lidské tumorové tkáně, jejich význam pro klinickou situaci je však nejasný. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnanu sodného Chlorid sodný Glycin Polysorbát 80 Voda na injekci Kyselina chlorovodíková (k úpravě ph) Hydroxid sodný (k úpravě ph) 6.2 Inkompatibility Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky. 16
17 6.3 Doba použitelnosti 2 roky 6.4 Zvláštní opatření pro uchovávání Uchovávejte a převážejte chlazené (2 C-8 C). Chraňte před mrazem. Uchovávejte v původním obalu, aby byl přípravek chráněn před světlem. Pro účely ambulantního použití mohou pacienti Abseamed vyjmout z chladničky a uchovávat do 25 C po jednorázové období až 3 dní. 6.5 Druh obalu a obsah balení 0,5 ml roztoku v předplněné injekční stříkačce (sklo I. typu), s bezpečnostním krytem jehly anebo bez něho, se zátkou s pístem (pryž potažená teflonem), uzavřené v blistru. Balení po 1 nebo 6 kusech. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Abseamed by neměl být použit a měl by být zlikvidován: - pokud je tekutina zabarvena či v ní jsou plovoucí viditelné částice, - je-li poškozená pečeť, - pokud víte nebo se domníváte, že roztok byl nedopatřením zmražen nebo - při poruše chladničky. Předplněné injekční stříkačky jsou připraveny k použití (viz bod 4.2). Předplněnou injekční stříkačku neprotřepávejte. Injekční stříkačky mají výstupky s prstenci stupnice, aby bylo možné částečné použití v případě potřeby. Jeden prstenec stupnice odpovídá objemu 0,1 ml. Tento přípravek je určen pouze k jednorázovému použití. Aplikujte pouze jednu dávku přípravku Abseamed z jedné injekční stříkačky, z které byl před aplikací injekce odstraněn nepotřebný roztok. Použití předplněné injekční stříkačky s bezpečnostním krytem jehly Bezpečnostní kryt jehly překrývá jehlu po injekci, aby zabránil zranění píchnutím jehlou. Tím nijak neruší normální zacházení se stříkačkou.tlačte na píst pomalu až do té doby, kdy je podána celá dávka a kdy se píst již nedá dále stlačit. Zatímco udržujete tlak na píst, vytáhněte stříkačku s jehlou z pacientova těla. Bezpečnostní kryt zakryje jehlu, jakmile povolíte tlak na píst. Použití předplněné injekční stříkačky bez ochranného krytu jehly Podejte dávku standardním způsobem. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Medice Arzneimittel Pütter GmbH & Co KG Kuhloweg 37 D Iserlohn Německo 17
18 8. REGISTRAČNÍ ČÍSLO(A) EU/1/07/412/001 EU/1/07/412/002 EU/1/07/412/027 EU/1/07/412/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 28. srpna 2007 Datum posledního prodloužení registrace: 15. června DATUM REVIZE TEXTU Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky 18
19 1. NÁZEV PŘÍPRAVKU Abseamed IU/1 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje IU epoetinum alfa*, což odpovídá 16,8 mikrogramům/ml 1 předplněná injekční stříkačka s obsahem 1 ml obsahuje mezinárodních jednotek (IU), což odpovídá 16,8 mikrogramům epoetinum alfa. * Připraveno v buněčné linii CHO technologií rekombinantní DNA Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v předplněné injekční stříkačce (injekce) Čirý bezbarvý roztok 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Léčba symptomatické anémie spojené s chronickým renálním selháním (CRF) u dospělých a pediatrických pacientů: - Léčba anémie spojené s chronickým renálním selháním u pediatrických i dospělých hemodialyzovaných pacientů a dospělých pacientů dialyzovaných peritoneálně (viz bod 4.4). - Léčba těžké anémie ledvinového původu doprovázené klinickými příznaky u dospělých pacientů s renální insuficiencí, kteří dosud dialyzováni nejsou (viz bod 4.4). Léčba anémie a snížení počtu transfuzí u dospělých pacientů absolvujících chemoterapii pro onemocnění solidními tumory, maligním lymfomem nebo mnohočetným myelomem, pokud je u nich transfuze vzhledem k celkovému zdravotnímu stavu riziková (například při onemocnění srdce nebo při anémii již před počátkem chemoterapie). Abseamed lze použít ke zvýšení přínosu u pacientů, kteří si připravují vlastní (autologní) dávky krve. Jeho použití k této indikaci se musí zvážit s ohledem na hlášené riziko tromboembolických příhod. Léčbu je třeba omezit na pacienty se středně závažnou anémií (hemoglobin (Hb) g/dl (6,2-8,1 mmol/l), bez deficitu železa), nejsou-li k dispozici procedury šetřící krev nebo jsou-li tyto procedury nedostatečné, pokud velká naplánovaná ortopedická operace vyžaduje velké množství krve (4 nebo více jednotek krve u žen nebo 5 nebo více jednotek krve u mužů). Pokud při transfuzi hrozí vysoké riziko komplikací, lze Abseamed použít k omezení expozice alogenním krevním transfuzím u dospělých pacientů, kteří netrpí deficitem železa a jsou již zařazeni do programu velké naplánované ortopedické operace. Použití je třeba omezit na pacienty se středně závažnou anémií (např. Hb g/dl nebo 6,2-8,1 mmol/l), kteří neměli možnost připravit si vlastní (autologní) krevní dávky předem a u nichž se očekává středně závažná ztráta krve ml. Při použití v perioperačním období je zapotřebí vždy dodržovat zásady správného postupu zacházení s krví a krevními deriváty. 19
20 4.2 Dávkování a způsob podání Léčba Abseamedem se musí zahájit pod dohledem lékařů, kteří mají zkušenosti s léčbou pacientů se shora uvedenými indikacemi. Dávkování Léčba symptomatické anémie u dospělých a pediatrických pacientů s chronickým renálním selháním U pacientů s chronickým renálním selháním se přípravek musí podávat intravenózně (viz bod 4.4). Symptomy a následky anémie se liší podle věku, pohlaví a současně probíhajících onemocnění; léčbu a stav jednotlivých pacientů musí vyhodnotit lékař. Abseamed má být podáván tak, aby se hemoglobin zvýšil nejvýše na hladinu 12 g/dl (7,5 mmol/l). Je třeba se vyhýbat tomu, aby došlo ke většímu zvýšení hemoglobinu než o 2 g/dl (1,25 mmol/l) za období čtyř týdnů. Jestliže k němu dojde, je třeba vhodným způsobem upravit dávku. Vzhledem k intraindividuální variabilitě je možné pozorovat, že občas jsou individuální hodnoty hemoglobinu u pacienta vyšší nebo nižší než požadovaná hladina. Variabilitu hladiny hemoglobinu je vhodné řešit úpravami dávkování, s ohledem na cílový rozsah hemoglobinu 10 g/dl (6,2 mmol/l) až 12 g/dl (7,5 mmol/l). U pediatrických pacientů je doporučený cílový rozsah hemoglobinu 9,5 až 11 g/dl (5,9-6,8 mmol/l). Je třeba se vyhýbat trvalému zvýšení hladiny hemoglobinu na hodnoty vyšší než 12 g/dl (7,5 mmol/l). Jestliže hemoglobin stoupá o více než 2 g/dl (1,25 mmol/l) za měsíc nebo jestliže trvalá hladina hemoglobinu přesáhne 12 g/dl (7,5 mmol/l), snižte dávku epoetinu alfa o 25 %. Jestliže hladina hemoglobinu přesáhne 13 g/dl (8,1 mmol/l), přerušte terapii, dokud neklesne pod 12 g/dl (7,5 mmol/l) a poté terapii epoetinem alfa obnovte při dávce o 25 % nižší než předchozí úroveň. Pacienty je třeba pečlivě sledovat, aby byla zajištěna adekvátní kontrola symptomů anémie při použití nejnižší vyzkoušené dávky epoetinu alfa. Před léčbou a během ní je třeba kontrolovat hladinu železa a v případě potřeby podávat suplementaci železa. Mimoto je třeba před zahájením terapie epoetinem alfa vyloučit jiné možné příčiny anémie, například deficit vitaminu B 12 nebo kyseliny listové. Nedostaví-li se žádaná odpověď na terapii epoetinem alfa, může to mít různé příčiny: deficit železa, kyseliny listové nebo vitaminu B 12 ; intoxikace hliníkem; interkurentní infekce; záněty anebo poranění; okultní krvácení; hemolýza, fibróza kostní dřeně různého původu. Dospělí hemodialyzovaní pacienti: Léčba je rozdělena na dvě fáze: Korekční fáze: 50 IU/kg 3x týdně intravenózně. Pokud je nutná úprava dávky, je třeba ji provádět po stupních trvajících vždy alespoň čtyři týdny. Při každém stupni se dávka zvyšuje nebo snižuje o 25 IU/kg 3x týdně. Udržovací fáze: Úprava dávkování k udržení hemoglobinových hodnot na požadované hladině: Hb mezi 10 a 12 g/dl (6,2-7,5 mmol/l). Doporučená celková týdenní dávka je mezi 75 a 300 IU/kg intravenózní cestou. Dostupné klinické údaje naznačují, že pacienti s velmi nízkými úvodními hodnotami hemoglobinu (< 6 g/dl čili < 3,75 mmol/l) mohou vyžadovat vyšší udržovací dávky než pacienti, jejichž počáteční anémie je méně těžká (Hb > 8 g/dl čili > 5 mmol/l). Pediatričtí pacienti na hemodialýze: Léčba je rozdělena na dvě fáze: 20
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Předplněné injekční stříkačky o objemu 0,5 ml obsahují 20 000 IU (168,0 mikrogramů) epoetinu alfa
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1 ml) * produkovaný v ovariálních
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1 ml) * produkovaný v ovariálních
PŘÍLOHA SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Binocrit 1000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 2000 IU epoetinum
PŘÍLOHA SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Binocrit 1000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 2000 IU epoetinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Binocrit 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Binocrit 2 000 IU/1 ml injekční roztok v předplněné injekční stříkačce Binocrit
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Binocrit 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Binocrit 2 000 IU/1 ml injekční roztok v předplněné injekční stříkačce Binocrit
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls160392/2008, sukls160393/2008, sukls160394/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls160392/2008, sukls160393/2008, sukls160394/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 200 IU/0,1 ml, injekční roztok EPREX 400
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls160392/2008, sukls160393/2008, sukls160394/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 200 IU/0,1 ml, injekční roztok EPREX 400
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. produkovaný v ovariálních buňkách křečíka čínského (Chinese Hamster Ovary, CHO) s použitím technologie rekombinantní DNA.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce Retacrit 3
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce Retacrit 3
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Retacrit 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce Retacrit 2 000 IU/0,6 ml injekční roztok v předplněné injekční stříkačce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls244574/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls244574/2009 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.: sukls244574/2009 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Silapo 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 předplněná injekční stříkačka s
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Silapo 1 000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 předplněná injekční stříkačka s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Přípavek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Dynepo 1 000 IU/0,5 ml injekčního roztoku v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Dynepo 1 000 IU/0,5 ml injekčního roztoku v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU MIRCERA 50 mikrogramů/0,3 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU MIRCERA 50 mikrogramů/0,3 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 2 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Biopoin 1 000 IU/0,5 ml injekční roztok v předplněné injekční stříkačce Biopoin 2 000 IU/0.5 ml injekční roztok v předplněné injekční stříkačce Biopoin
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Jedna předplněná injekční stříkačka obsahuje 20 mikrogramů darbepoetinu alfa (darbepoetin alfa)
 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 20 mikrogramů injekční roztok v
1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 20 mikrogramů injekční roztok v
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Souhrn údajů o přípravku
 sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 500
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 500
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. EPREX 200 IU/0,1 ml, EPREX 400 IU/0,1 ml, EPREX IU/0,1 ml Injekční roztok (epoetinum alfa)
 Sp.zn.sukls56940/2013; sukls56941/2013; sukls56942/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE EPREX 200 IU/0,1 ml, EPREX 400 IU/0,1 ml, EPREX 1 000 IU/0,1 ml Injekční roztok (epoetinum alfa) Přečtěte
Sp.zn.sukls56940/2013; sukls56941/2013; sukls56942/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE EPREX 200 IU/0,1 ml, EPREX 400 IU/0,1 ml, EPREX 1 000 IU/0,1 ml Injekční roztok (epoetinum alfa) Přečtěte
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Souhrn údajů o přípravku
 Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
3. LÉKOVÁ FORMA Injekční suspenze vpředplněné injekční stříkačce; bezbarvá průhledná tekutina, v jednodávkových inj. stříkačkách (sklo, typu I).
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
záření gama s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele EPREX 200 IU/0,1 ml, EPREX 400 IU/0,1 ml, EPREX 1 000 IU/0,1 ml, EPREX 40 000 IU/ml (epoetinum alfa) injekční roztok Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele EPREX 200 IU/0,1 ml, EPREX 400 IU/0,1 ml, EPREX 1 000 IU/0,1 ml, EPREX 40 000 IU/ml (epoetinum alfa) injekční roztok Přečtěte si pozorně celou příbalovou informaci
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon vícedávkový 50 000 IU prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon vícedávkový 50 000 IU prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon vícedávkový 50 000 IU lyofilizát pro přípravu injekčního roztoku s rozpouštědlem (5000 IU/ml) 2. KVALITATIVNÍ A KVANTITIATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NeoRecormon vícedávkový 50 000 IU lyofilizát pro přípravu injekčního roztoku s rozpouštědlem (5000 IU/ml) 2. KVALITATIVNÍ A KVANTITIATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje hexylis aminolevulinas
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje hexylis aminolevulinas
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
Mast také obsahuje 36 mg propylenglykolu a 140 mg lanolinu v 1 gramu rektální masti.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
Jedna předplněná injekční stříkačka obsahuje immunoglobulinum humanum anti-d 1500 IU (300 mikrogramů).
 sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum humanum normale 160 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IGAMPLIA 160 mg/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IGAMPLIA 160 mg/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale Jeden ml injekčního roztoku obsahuje Immunoglobulinum
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
Pediatrická populace 1/5. sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU
 sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1. NÁZEV PŘÍPRAVKU. Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen DHA 2 PPi/LR Lyofilizát pro přípravu injekční suspenze s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen DHA 2 PPi/LR Lyofilizát pro přípravu injekční suspenze s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky:
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
