Příprava artworků pro obaly a PIL v registračním řízení
|
|
|
- Erik Mašek
- před 4 lety
- Počet zobrazení:
Transkript
1 Příprava artworků pro obaly a PIL v registračním řízení MUDr. Jana Doksanská, MCO Regulatory Affairs Head CZ&SK, sanofi-aventis, s.r.o., Praha 1 Agenda Legislativní rámec a lokální požadavky Terminologie, lingvistika, správnost uvádění informací Ochranné prvky v rámci regulatory 2 1
2 Legislativa a lokální požadavky Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů (dále jen zákon o léčivech ) Vyhláška č. 228/2008 Sb., o registraci léčivých přípravků, ve znění pozdějších předpisů (dále jen registrační vyhláška ) Směrnice 2001/83/ES, o kodexu Společenství týkajícím se humánních léčivých přípravků (dále jen Směrnice 2001/83/ES ) Guideline on the readability of the labelling and package leaflet of medicinal products for human use (ENTR/F/2/SF/jr (2009)D/869) REG-96 verze1 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tabulka X: Standardní názvy lékových forem, způsobu podání a obalů 2019 ( aktualizace REG-29 ver 4 Metodika k posuzování přijatelnosti názvů léčivých přípravků pro účely registračního řízení 3 Legislativa a lokální požadavky Nařízení Komise v přenesené pravomoci (EU) 2016/161, kterým se doplňuje směrnice Evropského parlamentu a Rady 2001/83/ES stanovením podrobných pravidel pro ochranné prvky uvedené na obalu humánních léčivých přípravků (dále jen nařízení Komise 2016/161 ) Směrnice 2001/83/ES, o kodexu Společenství týkajícím se humánních léčivých přípravků (dále jen Směrnice 2001/83/ES ) Informace k ochranným prvkům SÚKL: Guideline on the packaging information of medicinal products for human use authorised by the Union (dále jen Guideline on the packaging ) CMDh pokyn Blue Box requirements (CMDh/258/2012) 4 2
3 Označení na obalu léčivého přípravku(lp) a příbalová informace (PIL) ZoL 37: Údaje na vnějším a vnitřním obalu a v PIL musí být v souladu se schváleným SPC. Musí být uveden kód přidělený podle 32 odst. 5 k jednoznačné identifikaci každé varianty LP (pro účely evidence a příp. k identifikace při stanovování cen a úhrad z veřejného zdravotního pojištění). Nejsou přípustné jakékoli prvky reklamního charakteru. Název humánního LP musí být uveden na vnějším obalu Braillovým písmem, není-li stanoveno rozhodnutím o registraci jinak. 5 Označení na obalu LP a PIL PIL srozumitelná pro pacienta (na základě výsledků konzultace pacientů, pro které je LP určen) Údaje v ČJ, pokud více jazyků obsah musí být shodný Homeopatický přípravek musí být označen slovy homeopatický léčivý přípravek Na vnějším obalu nebo na vnitřním obalu, pokud vnější obal neexistuje, musí být uvedeny ochranné prvky dle odstavce 7 a 8 ZoL 6 3
4 QRD šablona Požadavky na obsah a členění textů humánních přípravků jsou blíže specifikovány v pravidelně aktualizovaných šablonách na webových stránkách EMA Verze 10, 02/ QRD šablona Appendix III Způsob podmínek uchovávání: OZNAČENÍ NA OBALU 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ PŘÍBALOVÁ INFORMACE 5. UCHOVÁVÁNÍ PŘÍPRAVKU X 8 4
5 QRD šablona Appendix IV Termíny a zkratky na obalu pro číslo šarže a expiraci Lot Č.š. Č.šarže EXP Použitelné do 9 PIL Název LP je vždy následován vyjádřením síly a lékové formy v pořadí: <název><síla><léková forma> (plné označení léčivého přípravku = full product name) Tyto údaje se uvádí v jednom řádku, bez oddělení síly a lékové formy čárkami a bez oddělení pomocí formátování např. odsazením lékové formy na druhý řádek Oclusin 500 mg tablety Oclusin 100 mg/ml perorální kapky, roztok REG-29 ver 4 Metodika k posuzování přijatelnosti názvů léčivých přípravků pro účely registračního řízení ( )
6 PIL Název léčivé látky INN názvosloví TABULKA X: STANDARDNÍ NÁZVY LÉKOVÝCH FOREM, ZPŮSOBŮ PODÁNÍ A OBALŮ Pomocné látky povinně uváděné na obalech a odpovídající text v příbalové informaci (Guideline on Excipients in the labelling and package leaflet of medicinal products for human use) na stránkách EMA zveřejněno ne/ 2009/09/WC pdf verze v českém jazyce zveřejněna na stránkách SÚKL Pomocné látky s vlivem na organismus sorbitol - Limity pro parentální i perorální podání Perorální parenterální (jiné než i.v.) 5 mg/kg/den Sorbitol je zdrojem fruktózy. Pokud Vám lékař sdělil, že nesnášíte (nebo Vaše dítě nesnáší) některé cukry nebo pokud máte diagnostikovanou vrozenou nesnášenlivost fruktózy, což je vzácné genetické onemocnění, při kterém pacienti nejsou schopni rozložit fruktózu, informujte svého lékaře, než <užijete><je Vám podán> (nebo je Vašemu dítěti podán) tento léčivý přípravek. Perorální 140 mg/kg/den Sorbitol může způsobit zažívací obtíže a mít mírný projímavý účinek. 13 6
7 PIL QR kód 14 PIL Předkládání národních překladů textů (CMDh pokyn CMDh Best Practice Guide on the submission of high quality national translations) - nová registrace, prodloužení, změny typu II do 7 kalendářních dnů po EoP MRP/DCP Product Information v národních jazykových mutacích - MS Word format 15 7
8 Grafické návrhy obalů LP Definice mock-upu Mock-up je plnobarevný návrh designu vnějšího a vnitřního obalu, ze kterého je patrná trojrozměrná prezentace textů na obalech. Předkládání mock-upu Národní procedura: české mock-upy jsou součástí předložené reg. dokumentace (modul 1.3.2). Akceptovatelné je i předložení závazku, že mock-upy budou předloženy v průběhu hodnotící fáze procedury, ve které probíhá jejich posouzení 16 Grafické návrhy obalů LP MRP/DCP procedura: společné (common) mock-upy jsou součástí předložené reg. dokumentace (modul 1.3.2). Akceptovatelné je i předložení závazku, že společné (common) mock-upy budou předloženy v průběhu hodnotící fáze procedury. mock-upy pro český trh odpovídající příslušným překladům textů obalu mají být předloženy nejpozději 5 dnů po ukončení evropské fáze procedury (tzv. End of Procedure) společně s českými překlady informací o LP pokud nejsou k dispozici české mock-upy v národní fázi procedury, budou za předložené mock-upy považovány společné (common) mock-upy mock-upy pro český trh je třeba zaslat na ovou adresu mock-upy@sukl.cz nejpozději 3 měsíce před uvedením na trh. 17 8
9 Grafické návrhy obalů LP Změna designu mock-upů: žádost o změnu v registraci je vyžadováno vždy při změně designu obalu oproti předchozí schválené verzi (např. změna barvy, velikosti písma, přidání/odebrání symbolů a piktogramů, přeskupení textu apod.). Změna se předkládá prostřednictvím národní změny v označení na obalu nebo příbalové informaci, která nesouvisí s SmPC, tzv. změna typu P (formulář žádosti REG-90 (i pro přípravky registrované cestou MR/DC procedury zvlášť pro každé registrační číslo. Při převodu registrace mock-upy jsou součástí modulu Pokud nejsou předloženy, je nutné je předložit 3 měsíce před uvedením na trh ( při zachování grafiky nebo změna typu P) 18 Grafické návrhy obalů LP Mock-upy jsou standardně předkládány ve formátu.pdf Akceptovatelné jsou i jiné formáty např.:.jpg;.doc. Z předloženého návrhu mock-upu je zřejmá reálná velikost výsledného obalu a použitých fontů písma (součástí návrhu event. i měřítko nebo údaje o rozměrech, velikost použitých fontů). Mock-up je předkládán pro každé registrační číslo LP, a to pro nejmenší velikost balení, která bude obchodována. V případě následného uvádění menší velikosti balení na trh, než pro jakou byl mock-up schválen, předložit žádost o změnu typu P pouze v případě ovlivnění čitelnosti textových údajů na obalu. Mock-upy jsou předkládány pro každý schválený typ a druh obalu, který bude obchodován (tzn. vnější obal včetně vícečetných balení (multipack) a všechny druhy vnitřního obalu). 19 9
10 Grafické návrhy obalů LP Plné označení LP (název + síla s jednotkami + léková forma) Název LP v dostatečné velikosti, výrazněji než ostatní údaje, pohromadě v jednom zorném poli, plné označení LP nemusí být uvedeno na jednom řádku Název LP by měl být na mock-upu uveden celý velkými písmeny (MEDICIN) nebo s velkým písmenem jen na začátku (Medicin). Plné označení LP na vnějším obalu, by mělo být, pokud je to možné, alespoň na třech neprotilehlých stranách krabičky. Lze uvádět symboly pro ochranné známky a TM. Uvedení těchto symbolů je plně v kompetenci a odpovědnosti žadatele/držitele. V textech obalů se tyto údaje neuvádí 20 Grafické návrhy obalů LP Léčivá látka pokud je název přípravku smyšlený, je léčivá látka uvedena přímo za plným označením LP minimálně jednou, a to na přední straně mock-upu. Pokud je název LP běžný (tzn. INN + MAH), může být léčivá látka uvedena na libovolném místě mock-upu Celkový obsah balení - síla je vyjádřena jako 10 mg/ml a velikosti balení jsou 5 ml, 10 ml Zásadní bezpečnostní varování/informace Odlišení přípravku s novým složením pomocných látek s vlivem na organismus - zvýraznění po dobu možného souběhu LP s původním a novým složením Písmo musí být vždy dostatečně čitelné a kontrastní oproti pozadí (velikosti minimálně 7 bodů, nebo takové, kde má písmeno x výšku alespoň 1,4 mm) V případě, že je zaregistrováno více sil, je třeba mock-upy jednotlivých sil od sebe dostatečně zřetelně rozlišit, (snížení rizika záměny), nejlépe použitím různých barev či uvedením síly výrazně větším fontem
11 Grafické návrhy obalů LP Grafické prvky, symboly a piktogramy Mohou být na obalu uvedeny za následujících podmínek: musí být v souladu s SmPC nesmí být reklamního charakteru nesmí být zavádějící, nesrozumitelné, klamavé nesmí narušit viditelnost a čitelnost povinně uváděných údajů 22 Grafické návrhy obalů LP Vyobrazení lékové formy/aplikačních pomůcek apod. Návody pro správné a bezpečné používání přípravku Ilustrace indikace/místa podání Příchuť léčivého přípravku Symboly pro dobu podání Recyklační symboly ne postava s odpadkovým košem Logo MAH/logo lokálního zástupce držitele Nekonkrétní grafické prvky (designové k odlišení LP navzájem např. barevné pruhy, pole, geometrické útvary, ornamenty, vzory apod.) 23 11
12 Grafické návrhy obalů LP Povinné: SÚKL kód (dle 37 odst. 1 zákona o léčivech a Přílohy č. 5 písm. A odst. 7 registrační vyhlášky). Na vnějším obalu LP musí být uveden kód přidělený SÚKL. Pro snazší identifikaci se doporučuje před číselný kód uvést uvozovací výraz SÚKL kód. SÚKL kód ani uvozovací výraz se neuvádí do textu obalu QRD šablony. Mezinárodně uznávaný identifikační standard (dle 37 odst. 1 zákona o léčivech) kterému odpovídá např. EAN, 2D kód stačí zobrazení umístění název v Braillově písmu, pokud není v rozhodnutí o registraci uvedeno jinak. Uvozovací výrazy pro dobu použitelnosti a číslo šarže Příloha č. IV QRD šablony 24 Grafické návrhy obalů LP Vícejazyčné a cizojazyčné obaly Údaje ve všech jazycích musí být shodné mimo údaje uváděné v blue-boxu (jsou stanoveny CMDh pokynem blue-box requirements ). V případě zavádění vícejazyčných obalů po zaregistrování LP je nutné předložit národní žádost o změnu typu P. Zároveň musí MAH předložit prohlášení, že obsah údajů je ve všech jazycích shodný. Žádost o změnu typu P je vyžadována při změně počtu jazyků, ve kterých jsou uvedené údaje na obalu. Při změně jazyka na již schváleném vícejazyčném obalu postačuje zaslat tuto informaci na ovou adresu mock-upy@sukl.cz (např. z CZ/SK na CZ/PL)
13 Ochranné prvky v rámci regulatory Vychází ze směrnice EU 2011/62 / EU tzv. směrnice o padělaných LP ( Falsified Medicines Directive či FMD ) Přímo účinný prováděcí předpis: nařízení komise (EU) 2016/161 (delegované akty) - stanovení podrobných pravidel pro ochranné prvky uvedené na obalu LP Zákon č. 378/2007 Sb., o léčivech novela nabyla účinnost (z pohledu adaptace nařízení 2016/161) 27 Ochranné prvky v rámci regulatory Ochranné prvky (OP) (UI + ATD) musí mít: Všechny léčivé přípravky vydávané na lékařský předpis, pokud nejsou uvedeny v příloze I nařízení (White list homeopatika, radionuklidové generátory, kity, radionuklidové prekursory, medicinální plyny, roztoky pro parenterální výživu, aditiva k intravenózním roztokům, kontrastní látky) LP vydávané bez lékařského předpisu, které jsou uvedeny v příloze II nařízení (Black list - omeprazol) White list a Black list zveřejňován na stránkách SÚKL Všechny OTC nesmí mít OP 28 13
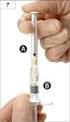
14 Ochranné prvky Jedinečný identifikátor (UI) identifikuje jednotlivá balení a slouží k ověření jejich pravosti. Obsahuje informace: kód přípravku sériové číslo balení číslo šarže datum expirace nosičem je dvojrozměrný čárový kód Prostředek k ověření manipulace s obalem (ATD) slouží k ověření, že s balením nebylo manipulováno nařízení nestanovuje specifikaci ATD ATD je umístěn na sekundárním obalu LP Má-li LP pouze primární obal, ATD je umístěn na něm 29 Ochranné prvky ČR novela ZoL 36 odst. 8 Technické řešení zajišťující celistvost LP, kterým MAH opatří vnější obal, jehož výdej není vázán na lékařský předpis a není uveden v příloze II nařízení o OP, se nepovažuje za OP podle nařízení o OP výrobce MŮŽE dle vlastního uvážení umístit vnější ochranný prvek (ATD) i na LP vydávané bez lékařského předpisu
15 Ochranné prvky Není nutné zachovávat pořadí uvedené v nařízení 2016/161 Zkratky PC, SN, Lot, EXP nemusí být uvedeny přímo před konkrétním číslem, avšak jejich uvedení musí umožňovat jednoznačnou identifikaci dat 31 QRD 17. JEDINEČNÝ IDENTIFIKÁTOR 2D ČÁROVÝ KÓD <2D čárový kód s jedinečným identifikátorem.> <Neuplatňuje se.> 18. JEDINEČNÝ IDENTIFIKÁTOR DATA ČITELNÁ OKEM <PC: {číslo} [kód přípravku] SN: {číslo} [sériové číslo] NN: {číslo} [vnitrostátní úhradové číslo nebo jiné vnitrostátní číslo identifikující léčivý přípravek]> <Neuplatňuje se.> 32 15
16 Ochranné prvky Zkratky dle QRD šablony PC kód přípravku GTIN SN sériové číslo Použitelnost a číslo šarže dle bodu 8 a 13 Kód přípravku (PC) a sériové číslo (SN) jako datové prvky jedinečného identifikátoru musí být na obalu vytištěny i ve formátu čitelném okem (možnost ověřit pravost jedinečného identifikátoru a provést jeho vyřazení v případě, že by 2D kód byl nečitelný). PC SN EXP Lot 33 Ochranné prvky Datové prvky PC a SN nemusejí být na obalu ve formátu čitelném okem, pokud se součet dvou nejdelších rozměrů obalu rovná nebo je menší než 10 cm. Není legislativně dáno, kde se má na obalu 2D kód vyskytovat Je zakázáno na obalu uvádět více 2D kódů určených k identifikaci a ověření pravosti LP. Nedoporučuje se na obal LP uvádět ani více 2D kódů, které k identifikaci neslouží, pokud lze sdružit do jednoho kódu Po je možné na obalu dále uvádět i EAN, pokud není negativně ovlivněna čitelnost (SÚKL doporučuje souběh kódů omezit) 34 16
17 Ochranné prvky Mock-up se předkládá pouze v případě, že dojde k ovlivnění čitelnosti (změna velikosti písma, velké přesuny textu) Je možné předložit mock-up, kde bude pouze vyznačeno prázdnémísto pro UI 35 Ochranné prvky z pohledu registrace 36 17
18 Ochranné prvky z pohledu registrace Všechny LP propuštěné do z výroby nemusí mít ochranné prvky a mohu být distribuovány a vydávány do konce doby použitelnosti. Všechny LP s výdejem na lékařský předpis, neuvedené na White listu, propuštěné z výroby (po , musí mít na obalu oba ochranné prvky ochranne.prvky@sukl.cz 37 Ochranné prvky z pohledu registrace Právní povinnosti a sankce - nesplnění požadavků nařízení Komise představuje porušení právních předpisů EU. Porušení se postihuje sankcemi podle právních předpisů členských států. MZ v souladu s ustanovením 11 písm. r) ZoL může povolit distribuci a výdej LP, které nesplňují požadavky nařízení o ochranných prvcích v ČR SÚKL zveřejňuje seznam takto dočasně schválených LP 38 18
19 Shrnutí MAH nese odpovědnost, že LP uváděné na trh v EU obsahují od 9. února 2019 ochranné prvky (jedinečný identifikátor a prostředek k ověření manipulace s obalem). Informace o ochranných prvcích musí být obsaženy v žádosti o registraci. 39 Zkratky ZoL Zákon o léku LP Léčivý přípravek SPC - Souhrn údajů o přípravku PIL Příbalová informace MAH Držitel rozhodnutí o registraci NOOL - Národní organizace pro ověřování pravosti léčiv 40 19
20 41 20
NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ
 1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ
 1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 POKYN REG-96 PRO PŘEDKLÁDÁNÍ MOCK-UPŮ V PRAXI PharmDr. František Pavlík Oddělení koordinace registračních procedur 3 Obsah 1) REG-96 obecně 2) Důvody pro vydání pokynu 3) Právní předpisy 4) Kdy předkládat
2 POKYN REG-96 PRO PŘEDKLÁDÁNÍ MOCK-UPŮ V PRAXI PharmDr. František Pavlík Oddělení koordinace registračních procedur 3 Obsah 1) REG-96 obecně 2) Důvody pro vydání pokynu 3) Právní předpisy 4) Kdy předkládat
Pokyn k předkládání mock-upů platí pro všechny léčivé přípravky registrované národní a MR/DC procedurou, a to bez ohledu na způsob výdeje.
 REG-96 verze 1 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
REG-96 verze 1 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
Pokyn k předkládání mock-upů platí pro všechny léčivé přípravky registrované národní a MR/DC procedurou, a to bez ohledu na způsob výdeje.
 REG-96 verze 0 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
REG-96 verze 0 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
REG XX verze 1. Požadavky na předkládání grafických návrhů obalů (mock-upů) léčivých přípravků
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 REG XX verze 1 Požadavky na předkládání grafických návrhů
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 REG XX verze 1 Požadavky na předkládání grafických návrhů
Ochranné prvky z pohledu registrace a časté dotazy
 1 Ochranné prvky z pohledu registrace a časté dotazy Ing. Marcela Beková 2 Obsah Legislativa kde jsme nyní Pro jaké LP jsou ochranné prvky (UI/ATD) povinné Implementace UI Implementace ATD Obal přípravku
1 Ochranné prvky z pohledu registrace a časté dotazy Ing. Marcela Beková 2 Obsah Legislativa kde jsme nyní Pro jaké LP jsou ochranné prvky (UI/ATD) povinné Implementace UI Implementace ATD Obal přípravku
STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY
 1 STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY Ing. Anna Ondruchová Sekce registrací Struktura názvů LP dle REG-29 verze 4 a její praktické dopady 2 Obsah: REG-29 verze 4 Nové registrace
1 STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY Ing. Anna Ondruchová Sekce registrací Struktura názvů LP dle REG-29 verze 4 a její praktické dopady 2 Obsah: REG-29 verze 4 Nové registrace
Obaly léčivých přípravků a co na nich SÚKL posuzuje
 1 Obaly léčivých přípravků a co na nich SÚKL posuzuje PharmDr. František Pavlík 2 Právní předpisy Zákon č. 378/2007 Sb., zákon o léčivech Vyhláška č. 228/2008 Sb., registrační vyhláška Pokyny Evropské
1 Obaly léčivých přípravků a co na nich SÚKL posuzuje PharmDr. František Pavlík 2 Právní předpisy Zákon č. 378/2007 Sb., zákon o léčivech Vyhláška č. 228/2008 Sb., registrační vyhláška Pokyny Evropské
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Padělky léčivých přípravků Kde jsme a kam směřujeme MUDr. Jana Mladá Sekce registrací 3 Obsah: Základní informace Padělková směrnice (Falsified Medicines Directive) Časový průběh Cíle a rozsah Ochranné
2 Padělky léčivých přípravků Kde jsme a kam směřujeme MUDr. Jana Mladá Sekce registrací 3 Obsah: Základní informace Padělková směrnice (Falsified Medicines Directive) Časový průběh Cíle a rozsah Ochranné
2015 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 16.6./
 1 Změny v označení na obalu a v PIL, které nesouvisí s SmPC (oznámení dle čl. 61(3) Směrnice) 2 ZMĚNY V OZNAČENÍ NA OBALU A V PIL, KTERÉ NESOUVISEJÍ S SmPC (OZNÁMENÍ DLE ČL. 61(3) SMĚRNICE) Bc. Tereza
1 Změny v označení na obalu a v PIL, které nesouvisí s SmPC (oznámení dle čl. 61(3) Směrnice) 2 ZMĚNY V OZNAČENÍ NA OBALU A V PIL, KTERÉ NESOUVISEJÍ S SmPC (OZNÁMENÍ DLE ČL. 61(3) SMĚRNICE) Bc. Tereza
Datum předložení návrhu skupině odborníků z GS1 ČR, SÚKL Červen a srpen 2017
 Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Texty SmPC a PIL jak s nimi po novu
 Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU
 Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU Praha, 26.dubna 2017 MUDr. Jaroslava Rezková 1 Obsah Legislativní rámec v ČR a EU Implementace povinností ze zákona Pozice,
Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU Praha, 26.dubna 2017 MUDr. Jaroslava Rezková 1 Obsah Legislativní rámec v ČR a EU Implementace povinností ze zákona Pozice,
Datum předložení návrhu skupině odborníků z GS1 ČR, SÚKL Červen a srpen 2017 verze 1 Listopad 2017 verze 2
 Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Obsah prezentace. Padělky léčiv a související legislativa. Výskyt padělků Legislativní rámec EU FMD novela zákona o léčivech Aktuální otázky
 Martin Mátl Padělky léčiv a související legislativa 1 Obsah prezentace Výskyt padělků Legislativní rámec EU FMD novela zákona o léčivech Aktuální otázky 2 1 Obsah prezentace Výskyt padělků Legislativní
Martin Mátl Padělky léčiv a související legislativa 1 Obsah prezentace Výskyt padělků Legislativní rámec EU FMD novela zákona o léčivech Aktuální otázky 2 1 Obsah prezentace Výskyt padělků Legislativní
Registrační dokumentace
 Registrační dokumentace Ing. Alena Pýchová 1 Úvod registrační dokumentace se předkládá ve formátu CTD povinný pro všechny typy procedur v rámci EU CTD určuje formát, v jakém májí být předložená data, ale
Registrační dokumentace Ing. Alena Pýchová 1 Úvod registrační dokumentace se předkládá ve formátu CTD povinný pro všechny typy procedur v rámci EU CTD určuje formát, v jakém májí být předložená data, ale
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 QR KÓDY Ing. Marcela Poláková Oddělení koordinace registrací CMDh POSITION PAPER ON THE USE OF QR CODES TO PROVIDE INFORMATION ABOUT THE MEDICINAL PRODUCT (CMDh/313/2014, Rev0) minimální požadavky (možnosti
QR KÓDY Ing. Marcela Poláková Oddělení koordinace registrací CMDh POSITION PAPER ON THE USE OF QR CODES TO PROVIDE INFORMATION ABOUT THE MEDICINAL PRODUCT (CMDh/313/2014, Rev0) minimální požadavky (možnosti
Ochranné prvky na obalech léčivých přípravků
 Ochranné prvky na obalech léčivých přípravků Ing. Markéta Kepková Regulatory Expert, GlaxoSmithKline s.r.o. 28.11.2017 Obsah Legislativa Systém ověřování léčiv European stakeholder model Úložiště EMVO
Ochranné prvky na obalech léčivých přípravků Ing. Markéta Kepková Regulatory Expert, GlaxoSmithKline s.r.o. 28.11.2017 Obsah Legislativa Systém ověřování léčiv European stakeholder model Úložiště EMVO
Změny v porovnání s předchozí verzí Doplněn bod 5.7 Revidována odpověď bodu 3.4 a 4.5
 Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
Obsahuje monohydrát laktózy. Pro více informací čtěte příbalovou informaci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička GLYMEXAN 1 mg 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje glimepiridum1 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje monohydrát laktózy. Pro více informací
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička GLYMEXAN 1 mg 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje glimepiridum1 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje monohydrát laktózy. Pro více informací
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM A VNITŘNÍM OBALU VNĚJŠÍ OBAL - KRABIČKA NA BLISTRY/NA LAHVIČKU VNITŘNÍ OBAL ŠTÍTEK NA LAHVIČKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU EFECTIN ER 37,5 mg 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM A VNITŘNÍM OBALU VNĚJŠÍ OBAL - KRABIČKA NA BLISTRY/NA LAHVIČKU VNITŘNÍ OBAL ŠTÍTEK NA LAHVIČKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU EFECTIN ER 37,5 mg 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 12./
 1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
2018 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 2 Hlášení závad v jakosti léčivých přípravků u distributorů Mgr. Eva Komrsková SÚKL 3 OBSAH I. Hlášení závad v jakosti léčivých přípravků u distributorů Závada v jakosti Legislativa Jak nahlásit závadu
1 2 Hlášení závad v jakosti léčivých přípravků u distributorů Mgr. Eva Komrsková SÚKL 3 OBSAH I. Hlášení závad v jakosti léčivých přípravků u distributorů Závada v jakosti Legislativa Jak nahlásit závadu
Jedna tableta s prodlouženým uvolňováním obsahuje quetiapinum 50 mg (ve formě quetiapini fumaras).
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Implementace ochranných prvků MUDr. Jitka Vokrouhlická Sekce registrací 3 Ochranné prvky Ochranné prvky (OP) = safety features (SF) Jedinečný identifikátor = unique identifier (UI) Prostředek k ověření
2 Implementace ochranných prvků MUDr. Jitka Vokrouhlická Sekce registrací 3 Ochranné prvky Ochranné prvky (OP) = safety features (SF) Jedinečný identifikátor = unique identifier (UI) Prostředek k ověření
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
Ochranné prvky OCHRANNÉ PRVKY. Mgr. Apolena Jonášová STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 3.2.2015 2 Směrnice Evropského Parlamentu a Rady 2011/62/EC ze dne 8. června 2011, která mění směrnici 2001/83/EC o kodexu Společenství týkajícím se humánních léčivých
1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 3.2.2015 2 Směrnice Evropského Parlamentu a Rady 2011/62/EC ze dne 8. června 2011, která mění směrnici 2001/83/EC o kodexu Společenství týkajícím se humánních léčivých
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 3.12.2013/5.12.2013 Žádosti o změny v registraci podané po 4. 8. 2013 u národně registrovaných léčivých přípravků 2 JAK PŘIPRAVIT KVALITNÍ TEXTY PRO PŘEDKLÁDANOU ŽÁDOST
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 3.12.2013/5.12.2013 Žádosti o změny v registraci podané po 4. 8. 2013 u národně registrovaných léčivých přípravků 2 JAK PŘIPRAVIT KVALITNÍ TEXTY PRO PŘEDKLÁDANOU ŽÁDOST
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 16.6./
 1 2 INFORMACE O VÝVOJI NOVÉHO NASTAVENÍ V POSUZOVÁNÍ NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ A SOUČASNÁ PRAXE Mgr. Martina Wagenknechtová, Ing. Anna Ondruchová Oddělení koordinace registrací Kontaktní adresa: nazvy@sukl.cz
1 2 INFORMACE O VÝVOJI NOVÉHO NASTAVENÍ V POSUZOVÁNÍ NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ A SOUČASNÁ PRAXE Mgr. Martina Wagenknechtová, Ing. Anna Ondruchová Oddělení koordinace registrací Kontaktní adresa: nazvy@sukl.cz
Jak vyhledávat v databázi léků.
 Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
 ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
Padělky léčivých přípravků v legální síti
 Mgr. Apolena Jonášová 2 Padělaným léčivým přípravkem se rozumí jakýkoli humánní léčivý přípravek Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění
Mgr. Apolena Jonášová 2 Padělaným léčivým přípravkem se rozumí jakýkoli humánní léčivý přípravek Zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění
Přímo aplikovatelné prováděcí nařízení podle čl. 54a směrnice ze dne , použitelné od
 Legislativní problematika ochranných prvků na obalech humánních léčivých přípravků Filip Vrubel Květen 2017 Kterým se doplňuje směrnice Evropského parlamentu a Rady 2001/83/ES stanovením podrobných pravidel
Legislativní problematika ochranných prvků na obalech humánních léčivých přípravků Filip Vrubel Květen 2017 Kterým se doplňuje směrnice Evropského parlamentu a Rady 2001/83/ES stanovením podrobných pravidel
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
OCHRANNÉ PRVKY. Mgr. Apolena Jonášová STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 2 Ochranné prvky přehled právních předpisů Směrnice 2011/62/EU: Směrnice Evropského Parlamentu a Rady 2011/62/EU ze dne 8. 6. 2011, která změnila směrnici 2001/83/ES
1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 2 Ochranné prvky přehled právních předpisů Směrnice 2011/62/EU: Směrnice Evropského Parlamentu a Rady 2011/62/EU ze dne 8. 6. 2011, která změnila směrnici 2001/83/ES
Nemocniční výjimka pokyn UST-37
 1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ
 1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace
 Státní ústav pro kontrolu léčiv [ 1 ] Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace Jitka Vokrouhlická Obsah [ 2 ] Referral procedura Referraly podle článku 107i,
Státní ústav pro kontrolu léčiv [ 1 ] Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace Jitka Vokrouhlická Obsah [ 2 ] Referral procedura Referraly podle článku 107i,
Požadavky na farmaceutickou dokumentaci
 1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE
 Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE 5. 12. 2017 Zákon o léčivech - Práva a povinnosti držitele rozhodnutí o registraci - 33 (3) Držitel rozhodnutí o registraci
Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE 5. 12. 2017 Zákon o léčivech - Práva a povinnosti držitele rozhodnutí o registraci - 33 (3) Držitel rozhodnutí o registraci
ACC LONG šumivá tableta acetylcysteinum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (PRO TUBU) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá látka: 600 mg v jedné šumivé tabletě. 3. SEZNAM POMOCNÝCH LÁTEK Pomocné látky:
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (PRO TUBU) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá látka: 600 mg v jedné šumivé tabletě. 3. SEZNAM POMOCNÝCH LÁTEK Pomocné látky:
Jak vyhledávat v databázi léků. www.olecich.cz
 Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ
 1 IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ Ing. Irena Lukáčová Oddělení administrativní podpory 2 Obsah Implementace jednotného hodnocení PSUR Základní pojmy Legislativa
1 IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ Ing. Irena Lukáčová Oddělení administrativní podpory 2 Obsah Implementace jednotného hodnocení PSUR Základní pojmy Legislativa
OCHRANNÉ PRVKY. Mgr. Apolena Jonášová STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 2 Ochranné prvky přehled právních předpisů Směrnice 2011/62/EU: Směrnice Evropského Parlamentu a Rady 2011/62/EU ze dne 8. 6. 2011, která změnila směrnici 2001/83/ES
1 OCHRANNÉ PRVKY Mgr. Apolena Jonášová 2 Ochranné prvky přehled právních předpisů Směrnice 2011/62/EU: Směrnice Evropského Parlamentu a Rady 2011/62/EU ze dne 8. 6. 2011, která změnila směrnici 2001/83/ES
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv
![[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv [ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv](/thumbs/92/109768502.jpg) [ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
[ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
FV systémy a jejich QM Základní dokument FV systému
 Státní ústav pro kontrolu léčiv [ 1 ] FV systémy a jejich QM Základní dokument FV systému Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? Stručné představení modulů
Státní ústav pro kontrolu léčiv [ 1 ] FV systémy a jejich QM Základní dokument FV systému Oddělení farmakovigilance Státní ústav pro kontrolu léčiv [ 2 ] Co v dnešní prezentaci? Stručné představení modulů
Jedna potahovaná tableta obsahuje atorvastatinum 40 mg (jako atorvastatinum calcicum trihydricum).
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na obal na tablety 2. OBSAH LÉČIVÉ LÁTKY Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg (jako calcicum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na obal na tablety 2. OBSAH LÉČIVÉ LÁTKY Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg (jako calcicum
[ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv
![[ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv [ 1 ] MUDr.Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav kontrolu léčiv](/thumbs/104/162117622.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Několik slov úvodem MUDr. Jana Mladá Oddělení farmakovigilance [ 3 ] O čem dnes? Změna legislativy Jak jsem na tom s českým zákonem? Co se bude dít po 21.7.2012?
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Několik slov úvodem MUDr. Jana Mladá Oddělení farmakovigilance [ 3 ] O čem dnes? Změna legislativy Jak jsem na tom s českým zákonem? Co se bude dít po 21.7.2012?
Parlament se usnesl na tomto zákoně České republiky:
 Strana 418 Sbírka zákonů č. 44 / 2019 44 ZÁKON ze dne 30. ledna 2019, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších
Strana 418 Sbírka zákonů č. 44 / 2019 44 ZÁKON ze dne 30. ledna 2019, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších
[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv
![[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv [ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv](/thumbs/93/112264798.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky
 PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky Platnost od: 3.7.2014 Pokyn blíže vymezuje pojmy, definuje obsah a upravuje podmínky poskytování informací
PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky Platnost od: 3.7.2014 Pokyn blíže vymezuje pojmy, definuje obsah a upravuje podmínky poskytování informací
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTON 50 x 50 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Voda na injekci Viaflo 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Aqua pro injectione 100% w/v 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTON 50 x 50 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Voda na injekci Viaflo 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Aqua pro injectione 100% w/v 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum 1,2 I.U a. proteasum 0,24 I.U)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU IRUXOL Mono mast Collagenasum 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU IRUXOL Mono mast Collagenasum 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum
REGISTRAČNÍ AKTUALITY
 1 REGISTRAČNÍ AKTUALITY PRODLOUŽENÍ, DUPLIKÁTY, DCP SLOTY, SUNSET CLAUSE, DOPRODEJ PO ZMĚNĚ REGISTRACE Ing. Irena Lukáčová 2 Obsah Nové postupy pro prodloužení platnosti registrace Termín předložení Případy
1 REGISTRAČNÍ AKTUALITY PRODLOUŽENÍ, DUPLIKÁTY, DCP SLOTY, SUNSET CLAUSE, DOPRODEJ PO ZMĚNĚ REGISTRACE Ing. Irena Lukáčová 2 Obsah Nové postupy pro prodloužení platnosti registrace Termín předložení Případy
Falsified Medicine Directive - ESM. Re-exporty - Srovnání limitací v rámci CEE
 Falsified Medicine Directive - ESM Re-exporty - Srovnání limitací v rámci CEE Mgr. Jakub Dvořáček, MHA Asociace inovativního farmaceutického průmyslu Re-exporty Srovnání legislativních limitací v rámci
Falsified Medicine Directive - ESM Re-exporty - Srovnání limitací v rámci CEE Mgr. Jakub Dvořáček, MHA Asociace inovativního farmaceutického průmyslu Re-exporty Srovnání legislativních limitací v rámci
2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 NEJČASTĚJŠÍ PORUŠENÍ ZÁKONA O REGULACI REKLAMY Mgr. Jana Hesounová Velký sál SÚKL 3 Přehled porušení ZoRR za roky 2012-2016 (přip. rekl. odborníci) 2% 3% 3% 2% 5% 6% 1% 1% 1% 1% 22% (nesoulad s SPC)
2 NEJČASTĚJŠÍ PORUŠENÍ ZÁKONA O REGULACI REKLAMY Mgr. Jana Hesounová Velký sál SÚKL 3 Přehled porušení ZoRR za roky 2012-2016 (přip. rekl. odborníci) 2% 3% 3% 2% 5% 6% 1% 1% 1% 1% 22% (nesoulad s SPC)
[ 1 ] MUDr. Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav pro kontrolu léčiv
![[ 1 ] MUDr. Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav pro kontrolu léčiv [ 1 ] MUDr. Jana Mladá Seminář oddělení farmakovigilance červen Státní ústav pro kontrolu léčiv](/thumbs/60/44115926.jpg) [ 1 ] [ 2 ] Shrnutí důležitých informací Registrační poznámky Jana Mladá Oddělení farmakovigilance [ 3 ] Co nyní? FV k registraci Standardní texty SPC Prodloužení registrace [ 4 ] Farmakovigilance k registraci
[ 1 ] [ 2 ] Shrnutí důležitých informací Registrační poznámky Jana Mladá Oddělení farmakovigilance [ 3 ] Co nyní? FV k registraci Standardní texty SPC Prodloužení registrace [ 4 ] Farmakovigilance k registraci
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 9.6.2016 KONZULTACE POSKYTOVANÉ SEKCÍ REGISTRACÍ MUDr. Radka Montoniová Sekce registrací 3 Obsah: Odborné konzultace vs. Clarification meeting Odborné konzultace Jak
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 9.6.2016 KONZULTACE POSKYTOVANÉ SEKCÍ REGISTRACÍ MUDr. Radka Montoniová Sekce registrací 3 Obsah: Odborné konzultace vs. Clarification meeting Odborné konzultace Jak
Návrh II. VYHLÁŠKA ze dne ,
 Návrh II. VYHLÁŠKA ze dne...........2018, kterou se mění vyhláška č. 84/2008 Sb., o správné lékárenské praxi, bližších podmínkách zacházení s léčivy v lékárnách, zdravotnických zařízeních a u dalších provozovatelů
Návrh II. VYHLÁŠKA ze dne...........2018, kterou se mění vyhláška č. 84/2008 Sb., o správné lékárenské praxi, bližších podmínkách zacházení s léčivy v lékárnách, zdravotnických zařízeních a u dalších provozovatelů
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 12.6./
 1 Brexit 2 BREXIT MUDr. Tomáš Boráň Ředitel sekce registrací Brexit 3 Obsah Brexit vývoj situace Lex Brexit Připravenost SÚKL Otázky a odpovědi k Brexitu Informace k Brexitu Výhled do budoucna Brexit 4
1 Brexit 2 BREXIT MUDr. Tomáš Boráň Ředitel sekce registrací Brexit 3 Obsah Brexit vývoj situace Lex Brexit Připravenost SÚKL Otázky a odpovědi k Brexitu Informace k Brexitu Výhled do budoucna Brexit 4
S kým spolupracujeme Implementace FMD a role standardu GS1. Mezi naše největší obchodní partnery patří:
 Implementace FMD a role standardu GS1 Pavla Cihlářová, ředitelka GS1 Czech Republic S kým spolupracujeme Mezi naše největší obchodní partnery patří: a máme i řadu dalších na lokální úrovni 2 1 Instituce,
Implementace FMD a role standardu GS1 Pavla Cihlářová, ředitelka GS1 Czech Republic S kým spolupracujeme Mezi naše největší obchodní partnery patří: a máme i řadu dalších na lokální úrovni 2 1 Instituce,
Uchovávejte při teplotě do 25 C v dobře uzavřené lahvičce, lahvičku uchovávejte v krabičce, aby byl přípravek chráněn před světlem a vlhkostí.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička (lahvička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibalgin 400 potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Ibuprofenum 400 mg v 1 potahované tabletě.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička (lahvička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibalgin 400 potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Ibuprofenum 400 mg v 1 potahované tabletě.
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Papírová krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 enterosolventmí tableta obsahuje: pancreatinum trypsinum chymotrypsinum bromelaina papainum amylasum lipasum rutosidum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Papírová krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 enterosolventmí tableta obsahuje: pancreatinum trypsinum chymotrypsinum bromelaina papainum amylasum lipasum rutosidum
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 potahovaná tableta obsahuje: bromelaina 90 mg (odp.: 450 F.I.P.-j.) trypsinum 48 mg (odp.: 24 µkat) rutosidum trihydricum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 potahovaná tableta obsahuje: bromelaina 90 mg (odp.: 450 F.I.P.-j.) trypsinum 48 mg (odp.: 24 µkat) rutosidum trihydricum
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 GROUPING ZMĚN WORKSHARING ZMĚN Ing. Pavla Rakušanová Oddělení koordinace registrací 3 OSNOVA: Grouping změn IA (IA IN ) Grouping změn IB, II Grouping změn IB, II - pro více LP Worksharing Grouping vs.
2 GROUPING ZMĚN WORKSHARING ZMĚN Ing. Pavla Rakušanová Oddělení koordinace registrací 3 OSNOVA: Grouping změn IA (IA IN ) Grouping změn IB, II Grouping změn IB, II - pro více LP Worksharing Grouping vs.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. BALENÍ 30 mg/ 5 ml
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
Periodicky aktualizované zprávy o bezpečnosti (PSUR)
 Státní ústav pro kontrolu léčiv [ 1 ] Periodicky aktualizované zprávy o bezpečnosti (PSUR) Petra Kaftanová [ 2 ] Legislativní rámec Nařízení Evropského parlamentu a Rady č. 726/2004 Směrnice Evropského
Státní ústav pro kontrolu léčiv [ 1 ] Periodicky aktualizované zprávy o bezpečnosti (PSUR) Petra Kaftanová [ 2 ] Legislativní rámec Nařízení Evropského parlamentu a Rady č. 726/2004 Směrnice Evropského
FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ
 1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
12/5/2017. Novinky v legislativě týkající se distribuce. Dopady právních úprav v distribuci léčivých přípravků Prosinec Novela zákona o léčivech
 Dopady právních úprav v distribuci léčivých přípravků Prosinec 2017 Novinky v legislativě týkající se distribuce Novela zákona o léčivech Nařízení Komise 2016/161, kterým se doplňuje směrnice Evropského
Dopady právních úprav v distribuci léčivých přípravků Prosinec 2017 Novinky v legislativě týkající se distribuce Novela zákona o léčivech Nařízení Komise 2016/161, kterým se doplňuje směrnice Evropského
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠNÍM OBALU A VNITŘNÍM OBALU Obal na tablety 15, 30, 40, 60 a 90 tablet 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna žvýkací tableta obsahuje: Calcium 1000 mg (jako calcii carbonas) Vitamin
ÚDAJE UVÁDĚNÉ NA VNĚJŠNÍM OBALU A VNITŘNÍM OBALU Obal na tablety 15, 30, 40, 60 a 90 tablet 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna žvýkací tableta obsahuje: Calcium 1000 mg (jako calcii carbonas) Vitamin
Aktualizovaný pokyn KLH-12
 Státní ústav pro kontrolu léčiv [ 1 ] Aktualizovaný pokyn KLH-12 Požadavky na doklady GMP pro klinická hodnocení PharmDr. et Mgr. Kateřina Buršíková RNDr. Petr Stránský [ 2 ] Zkratky IMP hodnocený léčivý
Státní ústav pro kontrolu léčiv [ 1 ] Aktualizovaný pokyn KLH-12 Požadavky na doklady GMP pro klinická hodnocení PharmDr. et Mgr. Kateřina Buršíková RNDr. Petr Stránský [ 2 ] Zkratky IMP hodnocený léčivý
Jak vyhledávat v databázi léků
 Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Obr. 1 Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní
Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Obr. 1 Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB.
 LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB. Mgr. Karel Ulrych Sekce registrací Zákon č. 66/2017 Sb. ze dne 31. 1. 2017 Změna zákona o léčivech, obsahující zejména úpravu zákona v reakci na nové nařízení
LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB. Mgr. Karel Ulrych Sekce registrací Zákon č. 66/2017 Sb. ze dne 31. 1. 2017 Změna zákona o léčivech, obsahující zejména úpravu zákona v reakci na nové nařízení
Edukační materiály DHPC
 Edukační materiály/dhpc Edukační materiály DHPC STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Seminář oddělení farmakovigilance červen 2014 Lucie Skálová MVDr. Edukační materiály -úvod 2 EDUKAČNÍ MATERIÁLY Požadavky
Edukační materiály/dhpc Edukační materiály DHPC STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Seminář oddělení farmakovigilance červen 2014 Lucie Skálová MVDr. Edukační materiály -úvod 2 EDUKAČNÍ MATERIÁLY Požadavky
Změny v systému elektronické výměny hlášení se SÚKL nový pokyn PHV4
 Státní ústav pro kontrolu léčiv [ 1 ] Změny v systému elektronické výměny hlášení se SÚKL nový pokyn PHV4 Ing.Kristína Vavrušková Oddělení farmakovigilance [ 2 ] Obsah prezentace Nová CZ FV legislativa
Státní ústav pro kontrolu léčiv [ 1 ] Změny v systému elektronické výměny hlášení se SÚKL nový pokyn PHV4 Ing.Kristína Vavrušková Oddělení farmakovigilance [ 2 ] Obsah prezentace Nová CZ FV legislativa
Požadavky na značení léčivých přípravků. Lenka Martínková, GS1 Czech Republic
 Požadavky na značení léčivých přípravků Lenka Martínková, GS1 Czech Republic Agenda Kdo je GS1 Pozice GS1 ve zdravotnickém sektoru Identifikační struktury, datové nosiče a jejich význam pro verifikaci
Požadavky na značení léčivých přípravků Lenka Martínková, GS1 Czech Republic Agenda Kdo je GS1 Pozice GS1 ve zdravotnickém sektoru Identifikační struktury, datové nosiče a jejich význam pro verifikaci
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Kartonová krabice (skleněné/polyethylenové lahve) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTONOVÁ KRABICE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna transdermální náplast 5 cm 2 o obsahu rivastigminum 9 mg, ze které se uvolní 4,6
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTONOVÁ KRABICE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna transdermální náplast 5 cm 2 o obsahu rivastigminum 9 mg, ze které se uvolní 4,6
Požadavky státního dozoru na uživatele in vitro diagnostik
 Požadavky státního dozoru na uživatele in vitro diagnostik STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 Ing. Hýbler Jaroslav - Odd. kontroly ZP 14. 2. 2006 - seminář 1 Osnova Legislativní
Požadavky státního dozoru na uživatele in vitro diagnostik STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 Ing. Hýbler Jaroslav - Odd. kontroly ZP 14. 2. 2006 - seminář 1 Osnova Legislativní
Seminář sekce registrací
 Státní ústav pro kontrolu léčiv [ 1 ] Seminář sekce registrací Jana Mladá [ 2 ] O čem dnes? Několik slov úvodem Sekce registrací Nová legislativa Co se změnilo Farmakovigilanční balíček Registrační drobnosti
Státní ústav pro kontrolu léčiv [ 1 ] Seminář sekce registrací Jana Mladá [ 2 ] O čem dnes? Několik slov úvodem Sekce registrací Nová legislativa Co se změnilo Farmakovigilanční balíček Registrační drobnosti
Farmaceutická dokumentace - základy
 Farmaceutická dokumentace - základy Ing. Tereza Stefflová SÚKL, Praha 2 Co vše posuzujeme/čteme? Průvodní dopis Formulář žádosti Dotazník SÚKL / srovnávací tabulky Vlastní farmaceutickou dokumentaci IMPD,
Farmaceutická dokumentace - základy Ing. Tereza Stefflová SÚKL, Praha 2 Co vše posuzujeme/čteme? Průvodní dopis Formulář žádosti Dotazník SÚKL / srovnávací tabulky Vlastní farmaceutickou dokumentaci IMPD,
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
Státní ústav pro kontrolu léčiv
 [ 1 ] [ 2 ] Změna zákona o léčivech Eva Niklíčková Odd. SVP [ 3 ] Směrnice 2011/62/EU ze dne 8. června 2011, kterou se mění směrnice 2001/83/ES o kodexu Společenství týkajícím se humánních léčivých přípravků,
[ 1 ] [ 2 ] Změna zákona o léčivech Eva Niklíčková Odd. SVP [ 3 ] Směrnice 2011/62/EU ze dne 8. června 2011, kterou se mění směrnice 2001/83/ES o kodexu Společenství týkajícím se humánních léčivých přípravků,
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 erecept Jaký je aktuální stav? Mgr. Irena Storová, pověřená vedením SÚKL 4. dubna 2018, Zlín 3 erecept erecept je lékařský předpis vystavený v elektronické podobě, uložený do CÚeR 1. 1. 2018 vznikla povinnost
erecept Jaký je aktuální stav? Mgr. Irena Storová, pověřená vedením SÚKL 4. dubna 2018, Zlín 3 erecept erecept je lékařský předpis vystavený v elektronické podobě, uložený do CÚeR 1. 1. 2018 vznikla povinnost
Ochranné prvky Mgr. Apolena Jonášová Ředitelka sekce dozoru
 Ochranné prvky Mgr. Apolena Jonášová Ředitelka sekce dozoru Ochranné prvky Základní informační zdroje Směrnice 2001/62/EU Nařízení 2016/161/EU https://ec.europa.eu/health/humanuse/falsified_medicines_en
Ochranné prvky Mgr. Apolena Jonášová Ředitelka sekce dozoru Ochranné prvky Základní informační zdroje Směrnice 2001/62/EU Nařízení 2016/161/EU https://ec.europa.eu/health/humanuse/falsified_medicines_en
5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
[ 1 ] Ing. František Chuchma, CSc. Seminář SVP/SDP, Státní ústav kontrolu léčiv
![[ 1 ] Ing. František Chuchma, CSc. Seminář SVP/SDP, Státní ústav kontrolu léčiv [ 1 ] Ing. František Chuchma, CSc. Seminář SVP/SDP, Státní ústav kontrolu léčiv](/thumbs/93/113400850.jpg) [ 1 ] VYR-32 verze 3, kapitola 4 Dokumentace [ 2 ] Překlad The Rules Governing Medicinal Products in EU, EU Guidelines to GMP, Chapter 4 Platnost od 30.6.2011 Právní základ: čl.47 Směrnice Evropského parlamentu
[ 1 ] VYR-32 verze 3, kapitola 4 Dokumentace [ 2 ] Překlad The Rules Governing Medicinal Products in EU, EU Guidelines to GMP, Chapter 4 Platnost od 30.6.2011 Právní základ: čl.47 Směrnice Evropského parlamentu
