Příbalová informace: informace pro uživatele. CEPROTIN 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem. Proteinum C humanum
|
|
|
- Magdalena Moravcová
- před 8 lety
- Počet zobrazení:
Transkript
1 Příbalová informace: informace pro uživatele CEPROTIN 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem. Proteinum C humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. - Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka. - Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy. - Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci 1. Co je CEPROTIN a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete CEPROTIN používat 3. Jak se CEPROTIN používá 4. Možné nežádoucí účinky 5. Jak CEPROTIN uchovávat 6. Obsah balení a další informace 1. Co je CEPROTIN a k čemu se používá CEPROTIN patří do skupiny léčiv nazývané antitrombotika. Tento léčivý přípravek obsahuje Protein C, přírodní protein který je produkován v játrech a je přítomný ve Vaší krvi. Protein C hraje důležitou roli v prevenci nadměrné tvorby sraženin, slouží tedy k prevenci a léčbě intravaskulární trombózy. CEPROTIN se používá při léčbě a prevenci trombotických a krvácivých kožních lézí (nazývaných purpura fulminans) u pacientů s těžkým vrozeným nedostatkem proteinu C. Dále může být CEPROTIN použit k léčbě vzácné komplikace léčby přípravky zřeďujícími krev (antikoagulační léky nazývané kumariny), která může vyvolat těžké poškození kůže (nekrózu). Kromě toho je CEPROTIN indikován k prevenci trombózy u pacientů s těžkým vrozeným nedostatkem proteinu C, platí-li jedna či více z níže uvedených podmínek: hrozí chirurgická či invazivní léčba během zahájení léčby kumarinovými deriváty (antikoagulační léčba, ředění krve) samotná léčba kumarinovými deriváty není dostatečná léčba kumarinovými deriváty není proveditelná 2. Čemu musíte věnovat pozornost, než začnete CEPROTIN používat Nepoužívejte CEPROTIN, - jestliže jste alergický(á) na lidský Protein C nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6), včetně myšího proteinu nebo heparinu Při život ohrožujících trombotických komplikacích se však může Váš lékař rozhodnout pokračovat v léčbě CEPROTINEM. 1
2 Upozornění a opatření Před použitím CEPROTINU se poraďte se svým lékařem nebo lékárníkem. Zvláštní opatrnosti při použití CEPROTINU je zapotřebí, objeví-li se příznaky alergie. K alergickým příznakům patří vyrážka, kopřivka, dýchací obtíže, nízký krevní tlak, svírání na hrudi a šok. Pokud se během léčby CEPROTINEM objeví tyto příznaky, má být injekce zastavena. Tyto příznaky mohou souviset s alergickou reakcí na některou ze složek přípravku, na myší bílkovinu nebo heparin. Přípravek může obsahovat stopová množství heparinu nebo myšího proteinu jako výsledek výrobního procesu. Objeví-li se taková reakce, rozhodne Váš lékař o odpovídající léčbě. Při výrobě léčivých přípravků z lidské krve nebo plazmy je dodržována řada opatření zabraňujících přenosu infekce na pacienty. Patří sem pečlivý výběr dárců krve a plazmy, který vylučuje možné přenašeče infekčních onemocnění, a testování každého vzorku plazmy na přítomnost virů a infekcí. Do procesu zpracování krve a plazmy zahrnují výrobci kroky, při nichž jsou deaktivovány nebo odstraněny viry. Přes všechna tato opatření při přípravě léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné infekce. Přijatá opatření jsou považována za účinná u obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C, a u neobaleného viru hepatitidy A. Přijatá opatření mohou mít omezenou účinnost proti neobaleným virům jako je parvovirus B19. Infekce parvovirem B19 může být závažná u těhotných žen (infekce plodu) a u pacientů se sníženou obranyschopností nebo těch, kteří trpí některými typy chudokrevnosti (např. srpkovitou nebo hemolytickou anémií). Pokud užíváte plazmatické přípravky proteinu C pravidelně/opakovaně, může Váš lékař doporučit, abyste zvážil vakcinaci proti hepatitidě A a B. Další léčivé přípravky a CEPROTIN V současnosti nejsou známy interakce s jinými léčivými přípravky. Přesto prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu. V případě přechodu na léčbu perorálními antikoagulancii musí léčba CEPROTINEM pokračovat až do dosažení stabilního perorálního antikoagulačního účinku. CEPROTIN s jídlem a pitím Neuplatňuje se. Těhotenství a kojení Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Váš lékař rozhodne, zda může být CEPROTIN použit během těhotenství a kojení. Řízení dopravních prostředků a obsluha strojů CEPROTIN nemá vliv na Vaši schopnost řídit nebo obsluhovat stroje. Důležité informace o některých složkách CEPROTINU Protože množství sodíku obsažené v nejvyšší denní dávce může přesáhnout 200 mg, může představovat riziko pro osoby na dietě s nízkým obsahem sodíku. 2
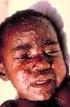
3 3. Jak se CEPROTIN používá CEPROTIN je určen k intravenóznímu podání (infuzí do žíly). Bude Vám podán pod dohledem lékaře se zkušenostmi se substituční léčbou koagulačními faktory/inhibitory tam, kde je uskutečnitelné monitorování aktivity proteinu C. Dávkování se může lišit v závislosti na vašem stavu a hmotnosti. Dávkování Dávkování, četnost podání a délka trvání léčby závisí na stupni závažnosti nedostatku proteinu C, na Vašem klinickém stavu a na hladině proteinu C ve Vaší plazmě. Dávky by měly být upraveny na základě klinického účinku a laboratorního vyšetření. Na počátku léčby by měla být dosažena 100% aktivita proteinu C a během léčby by měla být udržována aktivita vyšší než 25%. Měla by být podána úvodní dávka IU/kg. Váš lékař provede postupně několik odběrů krve ke stanovení délky setrvání proteinu C ve Vašem těle. Ke stanovení plazmatických hladin proteinu C se před zahájením a během léčby CEPROTINEM doporučuje měření aktivity proteinu C s použitím chromogenních substrátů. Dávkování by mělo být stanoveno na základě laboratorního měření aktivity proteinu C. V případě akutní trombotické události by mělo být měření prováděno každých 6 hodin až do stabilizace Vašeho stavu, poté dvakrát denně a pokaždé bezprostředně před podáním další injekce. Je nutné si uvědomit, že biologický poločas proteinu C může být výrazně zkrácen při takových klinických stavech, jako jsou akutní trombóza s purpura fulminans a kožní nekróza. Trpíte-li onemocněním ledvin nebo jater, informujte prosím svého lékaře, aby mohl v případě potřeby upravit Vaši léčbu. Při převádění na trvalou profylaxi perorálními antikoagulancii má být substituce proteinu C ukončena až po dosažení stabilního antikoagulačního účinku (viz Důležité informace o některých složkách přípravku Ceprotin ). U pacientů profylakticky léčených proteinem C lze připustit vyšší hladiny v situacích zvýšeného rizika trombózy (např. infekce, trauma nebo chirurgický výkon). Trpíte-li APC resistencí, což je rizikový faktor vzniku trombózy až v 5% evropské populace, může Váš lékař léčbu dle potřeby upravit. Podání CEPROTIN Vám bude podán intravenózní injekcí po rozpuštění prášku pro přípravu injekčního roztoku ve sterilizované vodě na injekci. Při každé aplikaci přípravku CEPROTIN doporučujeme zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně dohledat číslo použité šarže. Rozpusťte lyofilizovaný prášek CEPROTIN dodávaným rozpouštědlem (sterilizovaná voda na injekci) s použitím přiložené sterilní převodní jehly. Lahvičkou zlehka otáčejte až do úplného rozpuštění přípravku. Po rozpuštění se roztok natáhne sterilní filtrační jehlou do jednorázové injekční stříkačky. K natažení obsahu každé lahvičky rozpuštěného přípravku CEPROTIN musí být použita nová, nepoužitá filtrační jehla. Pokud jsou v roztoku viditelné částice, musí být zlikvidován. Rekonstituovaný roztok se ihned aplikuje intravenózní injekcí. 3
4 CEPROTIN má být podáván maximální injekční rychlostí 2 ml za minutu. U dětí s tělesnou hmotností méně než 10 kg by rychlost injekce neměla překročit 0,2 ml/kg/min. Veškerý nepoužitý roztok, prázdné lahvičky a použité jehly a stříkačky musí být patřičným způsobem zlikvidovány. Četnost a délka trvání léčby závisí na závažnosti nedostatku proteinu C, na stanovení hladin proteinu C ve Vaší plazmě a na místě a rozsahu trombózy. V případě akutní trombózy Vám může být CEPROTIN podáván každých 6 hodin. Jakmile sklon k trombóze začne klesat, může být četnost podání snížena. Jestliže jste použil(a) více CEPROTINU, než jste měl(a) Doporučujeme Vám, abyste dodržoval/a dávkování a četnost podání doporučené lékařem. V případě, podání více CEPROTINU, než se doporučuje, informujte prosím co nejdříve Vašeho lékaře. Jestliže jste zapomněl(a) použít CEPROTIN Neuplatňuje se. Jestliže jste přestal(a) používat CEPROTIN Nepřerušujte užívání CEPROTINU bez konzultace s Vaším lékařem. Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka. 4. Možné nežádoucí účinky Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Po podání CEPROTINU se mohou objevit následující nežádoucí účinky: Stejně jako u jiných přípravků podávaných infuzí do žíly jsou možné alergické reakce zahrnující závažné až život ohrožující reakce (anafylaxe), tyto reakce s CEPROTINEM však nebyly pozorovány. Přesto byste si měl(a) být vědom(a) časných známek alergických reakcí jako jsou pálení a píchání v místě vpichu, zimnice, zrudnutí, vyrážka, dýchací obtíže, nevolnost, bolest hlavy, apatie, nízký krevní tlak a svíravý pocit na hrudi. Během klinických studií byly velmi vzácně pozorovány následující nežádoucí účinky (méně než v 1 případě z podání pacientům): horečka (pyrexie), zvýšení C-reaktivního proteinu, kopřivka (urticaria), svědění (pruritus), vyrážka a malátnost. V rámci postmarketingové zkušenosti byly hlášeny neklid, krvácení do hrudníku, zvýšené pocení, bolest a erytém v místě injekce, zvýšená tělesná teplota a zvýšená potřeba katecholaminů (léky ke zvýšení krevního tlaku) během léčby. Pokud je přípravek podáván pacientům s těžkým vrozeným nedostatkem proteinu C, mohou se vytvořit protilátky inhibující protein C, které mohou snížit účinek přípravku. Toto však nebylo dosud v klinických studiích pozorováno. 4
5 Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku. 5. Jak CEPROTIN uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí. Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte v chladničce (2 C 8 C). Chraňte před mrazem. Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem. Rekonstituovaný roztok ihned použijte. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí. 6. Obsah balení a další informace Co CEPROTIN obsahuje Prášek: - Léčivou látkou je Proteinum C humanum. - Dalšími složkami jsou lidský albumin, chlorid sodný a dihydrát citronanu sodného. Jako rozpouštědlo se používá sterilizovaná voda na injekci. Jak CEPROTIN vypadá a co obsahuje toto balení CEPROTIN je dodáván jako bílý nebo smetanově zabarvený prášek nebo drobivá tuhá hmota pro přípravu injekčího roztoku s rozpouštědlem. Po rekonstituci je roztok bezbarvý nebo světle žlutý a čirý až mírně opalescentní, bez přítomnosti viditelných částic. Každé balení obsahuje také jednu převodní jehlu a jednu filtrační jehlu. Držitel rozhodnutí o registraci a výrobce Baxter AG Industriestrasse 67 A-1221 Vídeň, Rakousko 5
6 Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci: België/Belgique/Belgien Baxalta Belgium SPRL Tél./Tel.: БЪЛГАРИЯ Бакстер България ЕООД тел.: Česká republika BAXTER CZECH spol.s r.o. Tel Danmark Baxalta Denmark A/S Tlf.: Deutschland Baxalta Deutschland GmbH Tel.: Eesti OÜ Baxter Estonia Tel.: Ελλάδα Baxter Hellas ΕΠΕ Τηλ.: España Baxalta Spain S.L. Tel.: France Baxalta France SAS Tél.: Hrvatska Baxter d.o.o. Tel.: Ireland Baxalta UK Limited Tel.: Ísland Icepharma hf. Sími: Italia Baxalta Italy S.r.l. Tel.: Lietuva UAB Baxter Lithuania Tel.: Luxembourg/Luxemburg Baxalta Belgium SPRL Tél./Tel.: Magyarország Baxter Hungary Kft Tel.: Malta Baxalta UK Limited Tel.: Nederland Baxalta Netherlands B.V. Tel.: Norge SHELFCO - Baxalta Norway AS Tlf.: Österreich Baxalta Österreich GmbH Tel.: +43 (0) Polska Baxter Polska Sp. z o.o. Tel.: Portugal Baxalta Portugal, Unipessoal, Lda. Tel.: România FARMACEUTICA REMEDIA SA Tel.: Slovenija Baxter d.o.o. Tel.: Slovenská republika Baxter Slovakia, s.r.o. Tel.: Suomi/Finland SHELFCO - Baxalta Finland Oy Puh/Tel.:
7 Κύπρος Baxter Hellas ΕΠΕ Τηλ.: Latvija SIA Baxter Latvia Tel.: Sverige Baxalta Sweden AB Tel.: United Kingdom Baxalta UK Limited Tel.: Tato příbalová informace byla naposledy revidována Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: 7
8 Příbalová informace: informace pro uživatele CEPROTIN 1000 IU prášek pro přípravu injekčního roztoku s rozpouštědlem. Proteinum C humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. - Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka. - Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy. - Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci 1. Co je CEPROTIN a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete CEPROTIN používat 3. Jak se CEPROTIN používá 4. Možné nežádoucí účinky 5. Jak CEPROTIN uchovávat 6. Obsah balení a další informace 1. Co je CEPROTIN a k čemu se používá CEPROTIN patří do skupiny léčiv nazývané antitrombotika. Tento léčivý přípravek obsahuje Protein C produkovaný v játrech, který je přítomný ve Vaší krvi. Protein C hraje důležitou roli v prevenci nadměrné tvorby sraženin, slouží tedy k prevenci a léčbě intravaskulární trombózy. CEPROTIN se používá při léčbě a prevenci trombotických a krvácivých kožních lézí (nazývaných purpura fulminans) u pacientů s těžkým vrozeným nedostatkem proteinu C. Dále může být CEPROTIN použit k léčbě vzácné komplikace léčby přípravky zřeďujícími krev (antikoagulační léky nazývané kumariny), která může vyvolat těžké poškození kůže (nekrózu). Kromě toho je CEPROTIN indikován k prevenci trombózy u pacientů s těžkým vrozeným nedostatkem proteinu C, platí-li jedna či více z níže uvedených podmínek: hrozí chirurgická či invazivní léčba během zahájení léčby kumarinovými deriváty (antikoagulační léčba, ředění krve) samotná léčba kumarinovými deriváty není dostatečná léčba kumarinovými deriváty není proveditelná 2. Čemu musíte věnovat pozornost, než začnete CEPROTIN používat Nepoužívejte CEPROTIN, - jestliže jste alergický(á) na lidský Protein C nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6), včetně myšího proteinu nebo heparinu Při život ohrožujících trombotických komplikacích se však může Váš lékař rozhodnout pokračovat v léčbě CEPROTINEM. 8
9 Upozornění a opatření Před použitím CEPROTINU se poraďte se svým lékařem nebo lékárníkem. Zvláštní opatrnosti při použití CEPROTINU je zapotřebí, objeví-li se příznaky alergie. K alergickým příznakům patří vyrážka, kopřivka, dýchací obtíže, nízký krevní tlak, svírání na hrudi a šok. Pokud se během léčby CEPROTINEM objeví tyto příznaky, má být injekce zastavena. Tyto příznaky mohou souviset s alergickou reakcí na některou ze složek přípravku, na myší bílkovinu nebo heparin. Přípravek může obsahovat stopová množství heparinu nebo myšího proteinu jako výsledek výrobního procesu. Objeví-li se taková reakce, rozhodne Váš lékař o odpovídající léčbě. Při výrobě léčivých přípravků z lidské krve nebo plazmy je dodržována řada opatření zabraňujících přenosu infekce na pacienty. Patří sem pečlivý výběr dárců krve a plazmy, který vylučuje možné přenašeče infekčních onemocnění, a testování každého vzorku plazmy na přítomnost virů a infekcí. Do procesu zpracování krve a plazmy zahrnují výrobci kroky, při nichž jsou deaktivovány nebo odstraněny viry. Přes všechna tato opatření při přípravě léků vyráběných z lidské krve nebo plazmy nelze možnost přenosu infekce zcela vyloučit. To platí i pro jakékoli neznámé nebo vznikající viry či jiné infekce. Přijatá opatření jsou považována za účinná u obalených virů, jako je virus lidské imunodeficience (HIV), virus hepatitidy B a virus hepatitidy C, a u neobaleného viru hepatitidy A. Přijatá opatření mohou mít omezenou účinnost proti neobaleným virům jako je parvovirus B19. Infekce parvovirem B19 může být závažná u těhotných žen (infekce plodu) a u pacientů se sníženou obranyschopností nebo těch, kteří trpí některými typy chudokrevnosti (např. srpkovitou nebo hemolytickou anémií). Pokud užíváte plazmatické přípravky proteinu C pravidelně/opakovaně, může Váš lékař doporučit, abyste zvážil vakcinaci proti hepatitidě A a B. Další léčivé přípravky a CEPROTIN V současnosti nejsou známy interakce s jinými léčivými přípravky. Přesto prosím, informujte svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste v nedávné době užíval(a), a to i o lécích, které jsou dostupné bez lékařského předpisu. V případě přechodu na léčbu perorálními antikoagulancii musí léčba CEPROTINEM pokračovat až do dosažení stabilního perorálního antikoagulačního účinku. CEPROTIN s jídlem a pitím Neuplatňuje se. Těhotenství a kojení Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem nebo lékárníkem dříve, než začnete tento přípravek užívat. Váš lékař rozhodne, zda může být CEPROTIN použit během těhotenství a kojení. Řízení dopravních prostředků a obsluha strojů CEPROTIN nemá vliv na Vaši schopnost řídit nebo obsluhovat stroje. Důležité informace o některých složkách CEPROTINU Protože množství sodíku obsažené v nejvyšší denní dávce může přesáhnout 200 mg, může představovat riziko pro osoby na dietě s nízkým obsahem sodíku. 9
10 3. Jak se CEPROTIN používá CEPROTIN je určen k intravenóznímu podání (infuzí do žíly). Bude vám podán pod dohledem lékaře se zkušenostmi se substituční léčbou koagulačními faktory/inhibitory tam, kde je uskutečnitelné monitorování aktivity proteinu C. Dávkování se může lišit v závislosti na Vašem stavu a hmotnosti. Dávkování Dávkování, četnost podání a délka trvání léčby závisí na stupni závažnosti nedostatku proteinu C, na Vašem klinickém stavu a na hladině proteinu C ve Vaší plazmě. Dávky by měly být upraveny na základě klinického účinku a laboratorního vyšetření. Na počátku léčby by měla být dosažena 100% aktivita proteinu C a během léčby by měla být udržována aktivita vyšší než 25%. Měla by být podána úvodní dávka IU/kg. Váš lékař provede postupně několik odběrů krve ke stanovení délky setrvání proteinu C ve Vašem těle. Ke stanovení plazmatických hladin proteinu C se před zahájením a během léčby CEPROTINEM doporučuje měření aktivity proteinu C s použitím chromogenních substrátů. Dávkování by mělo být stanoveno na základě laboratorního měření aktivity proteinu C. V případě akutní trombotické události by mělo být měření prováděno každých 6 hodin až do stabilizace Vašeho stavu, poté dvakrát denně a pokaždé bezprostředně před podáním další injekce. Je nutné si uvědomit, že biologický poločas proteinu C může být výrazně zkrácen při takových klinických stavech, jako jsou akutní trombóza s purpura fulminans a kožní nekróza. Trpíte-li onemocněním ledvin nebo jater, informujte prosím svého lékaře, aby mohl v případě potřeby upravit Vaši léčbu. Při převádění na trvalou profylaxi perorálními antikoagulancii má být substituce proteinu C ukončena až po dosažení stabilního antikoagulačního účinku (viz Důležité informace o některých složkách přípravku Ceprotin ). U pacientů profylakticky léčených proteinem C lze připustit vyšší hladiny v situacích zvýšeného rizika trombózy (např. infekce, trauma nebo chirurgický výkon). Trpíte-li APC resistencí, což je rizikový faktor vzniku trombózy až v 5% evropské populace, může Váš lékař léčbu dle potřeby upravit. Podání CEPROTIN Vám bude podán intravenózní injekcí po rozpuštění prášku pro přípravu injekčního roztoku ve sterilizované vodě na injekci. Při každé aplikaci přípravku CEPROTIN doporučujeme zaznamenat název a číslo šarže přípravku, aby bylo možné zpětně dohledat číslo použité šarže. Rozpusťte lyofilizovaný prášek CEPROTIN dodávaným rozpouštědlem (sterilizovaná voda na injekci) s použitím přiložené sterilní převodní jehly. Lahvičkou zlehka otáčejte až do úplného rozpuštění přípravku. Po rozpuštění se roztok natáhne sterilní filtrační jehlou do jednorázové injekční stříkačky. K natažení obsahu každé lahvičky rozpuštěného přípravku CEPROTIN musí být použita nová, nepoužitá filtrační jehla. Pokud jsou v roztoku viditelné částice, musí být zlikvidován. Rekonstituovaný roztok se ihned aplikuje intravenózní injekcí. 10
11 CEPROTIN má být podáván maximální injekční rychlostí 2 ml za minutu. U dětí s tělesnou hmotností méně než 10 kg by rychlost injekce neměla překročit 0,2 ml/kg/min. Veškerý nepoužitý roztok, prázdné lahvičky a použité jehly a stříkačky musí být patřičným způsobem zlikvidovány. Četnost a délka trvání léčby závisí na závažnosti nedostatku proteinu C, na stanovení hladin proteinu C ve Vaší plazmě a na místě a rozsahu trombózy. V případě akutní trombózy Vám může být CEPROTIN podáván každých 6 hodin. Jakmile sklon k trombóze začne klesat, může být četnost podání snížena. Jestliže jste použil(a) více CEPROTINU, než jste měl(a) Doporučujeme Vám, abyste dodržoval/a dávkování a četnost podání doporučené lékařem. V případě podání více CEPROTINU, než se doporučuje, informujte prosím co nejdříve Vašeho lékaře. Jestliže jste zapomněl(a) použít CEPROTIN Neuplatňuje se. Jestliže jste přestal(a) používat CEPROTIN Nepřerušujte užívání CEPROTINU bez konzultace s Vaším lékařem. Máte-li jakékoli další otázky týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka. 4. Možné nežádoucí účinky Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Po podání CEPROTINU se mohou objevit následující nežádoucí účinky: Stejně jako u jiných přípravků podávaných infuzí do žíly jsou možné alergické reakce zahrnující závažné až život ohrožující reakce (anafylaxe), tyto reakce s CEPROTINEM však nebyly pozorovány. Přesto byste si měl(a) být vědom(a) časných známek alergických reakcí jako jsou pálení a píchání v místě vpichu, zimnice, zrudnutí, vyrážka, dýchací obtíže, nevolnost, bolest hlavy, apatie, nízký krevní tlak a svíravý pocit na hrudi. Během klinických studií byly velmi vzácně pozorovány následující nežádoucí účinky (méně než v 1 případě z podání pacientům): horečka (pyrexie), zvýšení C-reaktivního proteinu, kopřivka (urticaria), svědění (pruritus), vyrážka a malátnost. V rámci postmarketingové zkušenosti byly hlášeny neklid, krvácení do hrudníku, zvýšené pocení, bolest a erytém v místě injekce, zvýšená tělesná teplota a zvýšená potřeba katecholaminů (léky ke zvýšení krevního tlaku) během léčby. Pokud je přípravek podáván pacientům s těžkým vrozeným nedostatkem proteinu C, mohou se vytvořit protilátky inhibující protein C, které mohou snížit účinek přípravku. Toto však nebylo dosud v klinických studiích pozorováno. 11
12 Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři nebo lékárníkovi. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku. 5. Jak CEPROTIN uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí. Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na štítku za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte v chladničce (2 C 8 C). Chraňte před mrazem. Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem. Rekonstituovaný roztok ihned použijte. Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí. 6. Obsah balení a další informace Co CEPROTIN obsahuje Prášek: - Léčivou látkou je Proteinum C humanum - Dalšími složkami jsou lidský albumin, chlorid sodný a dihydrát citronanu sodného. Jako rozpouštědlo se používá sterilizovaná voda na injekci. Jak CEPROTIN vypadá a co obsahuje toto balení CEPROTIN je dodáván jako bílý nebo smetanově zabarvený prášek nebo drobivá tuhá hmota pro přípravu injekčího roztoku s rozpouštědlem. Po rekonstituci je roztok bezbarvý nebo světle žlutý a čirý až mírně opalescentní, bez přítomnosti viditelných částic. Každé balení obsahuje také jednu převodní jehlu a jednu filtrační jehlu. Držitel rozhodnutí o registraci a výrobce Baxter AG Industriestrasse 67 A-1221 Vídeň, Rakousko 12
13 Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci: België/Belgique/Belgien Baxalta Belgium SPRL Tél./Tel.: БЪЛГАРИЯ Бакстер България ЕООД тел.: Česká republika BAXTER CZECH spol.s r.o. Tel Danmark Baxalta Denmark A/S Tlf.: Deutschland Baxalta Deutschland GmbH Tel.: Eesti OÜ Baxter Estonia Tel.: Ελλάδα Baxter Hellas ΕΠΕ Τηλ.: España Baxalta Spain S.L. Tel.: France Baxalta France SAS Tél.: Hrvatska Baxter d.o.o. Tel.: Ireland Baxalta UK Limited Tel.: Ísland Icepharma hf. Sími: Italia Baxalta Italy S.r.l. Tel.: Lietuva UAB Baxter Lithuania Tel.: Luxembourg/Luxemburg Baxalta Belgium SPRL Tél./Tel.: Magyarország Baxter Hungary Kft Tel.: Malta Baxalta UK Limited Tel.: Nederland Baxalta Netherlands B.V. Tel.: Norge SHELFCO - Baxalta Norway AS Tlf.: Österreich Baxalta Österreich GmbH Tel.: +43 (0) Polska Baxter Polska Sp. z o.o. Tel.: Portugal Baxalta Portugal, Unipessoal, Lda. Tel.: România FARMACEUTICA REMEDIA SA Tel.: Slovenija Baxter d.o.o. Tel.: Slovenská republika Baxter Slovakia, s.r.o. Tel.: Suomi/Finland SHELFCO - Baxalta Finland Oy Puh/Tel.:
14 Κύπρος Baxter Hellas ΕΠΕ Τηλ.: Latvija SIA Baxter Latvia Tel.: Sverige Baxalta Sweden AB Tel.: United Kingdom Baxalta UK Limited Tel.: Tato příbalová informace byla naposledy revidována Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky: 14
Příbalová informace: Informace pro pacienta. Neoclarityn 5 mg perorální lyofilizát desloratadinum
 Příbalová informace: Informace pro pacienta Neoclarityn 5 mg perorální lyofilizát desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: Informace pro pacienta Neoclarityn 5 mg perorální lyofilizát desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Aerius 0,5 mg/ml perorální roztok desloratadinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele. PAMBA tablety (acidum aminomethylbenzoicum)
 sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele. FINEX 5 mg potahované tablety (finasteridum)
 sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele. EMEND 40 mg tvrdé tobolky aprepitantum
 Příbalová informace: informace pro uživatele EMEND 40 mg tvrdé tobolky aprepitantum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité
Příbalová informace: informace pro uživatele EMEND 40 mg tvrdé tobolky aprepitantum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás důležité
ANALERGIN NEO Potahované tablety 20 x 5 mg
 ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum
 Příbalová informace: informace pro uživatele Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna)
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než necháte Vaše dítě
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než necháte Vaše dítě
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Silgard, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Silgard, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Trachisan 8 mg proti bolesti v krku, pastilky. Lidocaini hydrochloridum monohydricum
 Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. FLECTOR EP GEL gel (diclofenacum epolaminum)
 sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: Informace pro uživatele. Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná)
 Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Prostamol UNO 320 mg, měkké tobolky Serenoae extractum (serenoový extrakt)
 sp.zn. sukls94320/2010 Příbalová informace: informace pro pacienta Prostamol UNO 320 mg, měkké tobolky Serenoae extractum (serenoový extrakt) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn. sukls94320/2010 Příbalová informace: informace pro pacienta Prostamol UNO 320 mg, měkké tobolky Serenoae extractum (serenoový extrakt) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Očkovací látka proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Očkovací látka proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum
 Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Clotrimazol AL 200 vaginální tablety clotrimazolum
 sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
K použití od 18 let. Léčivá látka ciklopirox zabraňuje růstu hub a ničí je. Díky tomu se zlepší stav Vašich nehtů.
 sp. zn. sukls91894/2013 Příbalová informace: Informace pro uživatele Polinail 80 mg/g léčivý lak na nehty ciclopiroxum K použití od 18 let Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls91894/2013 Příbalová informace: Informace pro uživatele Polinail 80 mg/g léčivý lak na nehty ciclopiroxum K použití od 18 let Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum
 Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro pacienta. Integrilin 0,75 mg/ml infuzní roztok eptifibatidum
 Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu)
 sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE. Aminoplasmal Hepa - 10% infuzní roztok
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
Příbalová informace: informace pro uživatele OFTAQUIX 5 mg/ml OČNÍ KAPKY, ROZTOK Levofloxacinum
 sp.zn.sukls33932/2012 Příbalová informace: informace pro uživatele OFTAQUIX 5 mg/ml OČNÍ KAPKY, ROZTOK Levofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.sukls33932/2012 Příbalová informace: informace pro uživatele OFTAQUIX 5 mg/ml OČNÍ KAPKY, ROZTOK Levofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Angizidine 35 mg tablety s řízeným uvolňováním trimetazidini dihydrochloridum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Angizidine 35 mg tablety s řízeným uvolňováním trimetazidini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Angizidine 35 mg tablety s řízeným uvolňováním trimetazidini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
P íbalová informace: informace pro uživatele
 P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 20 Příbalová informace: informace pro uživatele Zavesca 100 mg tvrdé tobolky Miglustatum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
B. PŘÍBALOVÁ INFORMACE 20 Příbalová informace: informace pro uživatele Zavesca 100 mg tvrdé tobolky Miglustatum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele. Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa)
 Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum
 sp.zn.sukls55165/2015 sukls229256/2015, sukls223777/2015 Příbalová informace: informace pro uživatele Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum Přečtěte si pozorně tuto příbalovou
sp.zn.sukls55165/2015 sukls229256/2015, sukls223777/2015 Příbalová informace: informace pro uživatele Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum Přečtěte si pozorně tuto příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Privigen 100 mg/ml (10%) infuzní roztok Normální lidský imunoglobulin (Immunoglobulinum humanum normale) (IVIg) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Privigen 100 mg/ml (10%) infuzní roztok Normální lidský imunoglobulin (Immunoglobulinum humanum normale) (IVIg) Přečtěte si pozorně celou příbalovou informaci
Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y
 Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. Tracleer 125 mg potahované tablety Bosentan
 Příbalová informace: informace pro uživatele Tracleer 125 mg potahované tablety Bosentan Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás
Příbalová informace: informace pro uživatele Tracleer 125 mg potahované tablety Bosentan Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro Vás
Příbalová informace: informace pro uživatele. APO-FINAS potahované tablety (finasteridum)
 Příbalová informace: informace pro uživatele APO-FINAS potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele APO-FINAS potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele. Vzduch medicinální syntetický Linde, medicinální plyn, stlačený Oxygenum 21,0-22,4 % V/V
 sp.zn. sukls273922/2012 Příbalová informace: informace pro uživatele Vzduch medicinální syntetický Linde, medicinální plyn, stlačený Oxygenum 21,0-22,4 % V/V Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls273922/2012 Příbalová informace: informace pro uživatele Vzduch medicinální syntetický Linde, medicinální plyn, stlačený Oxygenum 21,0-22,4 % V/V Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta. Lutinus 100 mg vaginální tablety Progesteronum
 Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta. Azomyr 0,5 mg/ml perorální roztok desloratadinum
 Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
sp.zn.sukls73280/2013
 sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Clotrimazol AL 1% krém (clotrimazolum)
 sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Thelin 100 mg potahované tablety sitaxentan sodný
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Thelin 100 mg potahované tablety sitaxentan sodný Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Thelin 100 mg potahované tablety sitaxentan sodný Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Ponechte si příbalovou
Příbalová informace: informace pro uživatele. PANCREOLAN FORTE enterosolventní tablety pancreatinum
 sp.zn. sukls215371/2015 Příbalová informace: informace pro uživatele PANCREOLAN FORTE enterosolventní tablety pancreatinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls215371/2015 Příbalová informace: informace pro uživatele PANCREOLAN FORTE enterosolventní tablety pancreatinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Kreon 10 000 tobolky pancreatinum
 sp. zn. sukls4248/2015 a sp.zn.sukls136237/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kreon 10 000 tobolky pancreatinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls4248/2015 a sp.zn.sukls136237/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kreon 10 000 tobolky pancreatinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls82959/2013
 sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE. Canespor 1x denně sada na nehty mast bifonazolum
 sp.zn.: sukls219557/2011 a sp.zn.: sukls46172/2014 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE Canespor 1x denně sada na nehty mast bifonazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než
sp.zn.: sukls219557/2011 a sp.zn.: sukls46172/2014 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE Canespor 1x denně sada na nehty mast bifonazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Amizolmet 500 mg/ml injekční roztok. Metamizolum natricum monohydricum
 Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn.sukls20687/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Persen obalené tablety Persen forte tvrdé tobolky Valerianae extractum siccum, Melissae folii extractum siccum a Menthae piperitae folii
sp.zn.sukls20687/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Persen obalené tablety Persen forte tvrdé tobolky Valerianae extractum siccum, Melissae folii extractum siccum a Menthae piperitae folii
Příbalová informace: informace pro pacienta. Betnovate 1 mg/g krém betamethasonum
 sp.zn.: sukls57199/2013 a sp.zn.: sukls121553/2015 Příbalová informace: informace pro pacienta Betnovate 1 mg/g krém betamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls57199/2013 a sp.zn.: sukls121553/2015 Příbalová informace: informace pro pacienta Betnovate 1 mg/g krém betamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bonviva 3 mg injekční roztok Acidum ibandronicum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bonviva 3 mg injekční roztok Acidum ibandronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bonviva 3 mg injekční roztok Acidum ibandronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje.
 PANCREOLAN FORTE (Pancreatinum) enterosolventní tablety Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek je dostupný bez lékařského předpisu. Přesto
PANCREOLAN FORTE (Pancreatinum) enterosolventní tablety Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek je dostupný bez lékařského předpisu. Přesto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 1. Co je přípravek Biodroxil a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete přípravek Biodroxil užívat 3. Jak se přípravek Biodroxil užívá 4. Možné nežádoucí účinky 5. Jak přípravek
1. Co je přípravek Biodroxil a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete přípravek Biodroxil užívat 3. Jak se přípravek Biodroxil užívá 4. Možné nežádoucí účinky 5. Jak přípravek
Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum
 Příbalová informace: informace pro uživatele Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta. Zurampic 200 mg potahované tablety lesinuradum
 Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Montelukast Abbott 10 mg potahované tablety Montelukastum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Montelukast Abbott 10 mg potahované tablety Montelukastum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Montelukast Abbott 10 mg potahované tablety Montelukastum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. APO-LETROZOL 2,5 mg Potahované tablety Letrozolum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls193293/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-LETROZOL 2,5 mg Potahované tablety Letrozolum Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls193293/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-LETROZOL 2,5 mg Potahované tablety Letrozolum Přečtěte si pozorně celou příbalovou
Souhrn údajů o přípravku
 Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Medicinální kapalný kyslík MPRC Medicinální plyn, kryogenní Oxygenum (O 2 ) 100 % (V/V)
 sp.zn. sukls156485/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Medicinální kapalný kyslík MPRC Medicinální plyn, kryogenní Oxygenum (O 2 ) 100 % (V/V) Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls156485/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Medicinální kapalný kyslík MPRC Medicinální plyn, kryogenní Oxygenum (O 2 ) 100 % (V/V) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.sukls102844/2012, sukls102840/2012, sukls102838/2012, sukls102833/2012, sukls102826/2012, sukls102821/2012 sp.zn.
 sp.zn.sukls102844/2012, sukls102840/2012, sukls102838/2012, sukls102833/2012, sukls102826/2012, sukls102821/2012 sp.zn.sukls197034/2013 Příbalová informace: informace pro uživatele Sorvasta 5 mg Sorvasta
sp.zn.sukls102844/2012, sukls102840/2012, sukls102838/2012, sukls102833/2012, sukls102826/2012, sukls102821/2012 sp.zn.sukls197034/2013 Příbalová informace: informace pro uživatele Sorvasta 5 mg Sorvasta
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety calcium, colecalciferolum
 sp.zn. sukls79311/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety calcium, colecalciferolum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls79311/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Calcium Cholecalciferol Béres 600 mg/400 IU potahované tablety calcium, colecalciferolum Přečtěte si pozorně celou příbalovou informaci
sp.zn.sukls18558/2015
 sp.zn.sukls18558/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN flurbiprofenum pastilky Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje. Tento přípravek
sp.zn.sukls18558/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN flurbiprofenum pastilky Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje. Tento přípravek
PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum)
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE. Tygacil 50 mg prášek pro přípravu infuzního roztoku tigecyclinum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Tygacil 50 mg prášek pro přípravu infuzního roztoku tigecyclinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Tygacil 50 mg prášek pro přípravu infuzního roztoku tigecyclinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Adepend 50 mg potahované tablety. naltrexoni hydrochloridum
 Sp. zn. sukls78119/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Adepend 50 mg potahované tablety naltrexoni hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls78119/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Adepend 50 mg potahované tablety naltrexoni hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Tamsulosin HCl 0,4 Prolong 1A Pharma
 Příloha č. 2 k rozhodnutí o registraci sp.zn.sukls102435/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Tamsulosin HCl 0,4 Prolong 1A Pharma potahované tablety s prodlouženým uvolňováním (tamsulosini
Příloha č. 2 k rozhodnutí o registraci sp.zn.sukls102435/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Tamsulosin HCl 0,4 Prolong 1A Pharma potahované tablety s prodlouženým uvolňováním (tamsulosini
1. CO JE EFDEGE A K ČEMU SE POUŽÍVÁ
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE EFDEGE 1 GBq/ml, injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE EFDEGE 1 GBq/ml, injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 Sp.zn. sukls213713/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Steripet 250 MBq/ml injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento
Sp.zn. sukls213713/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Steripet 250 MBq/ml injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento
EU/1/97/029/001-002 EU/1/97/029/006-010
 Příbalová informace - Rp. Informace pro použití, čtěte pozorně! J07BC20 TWINRIX PAEDIATRIC injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě
Příbalová informace - Rp. Informace pro použití, čtěte pozorně! J07BC20 TWINRIX PAEDIATRIC injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. Alendronate - Teva 70 mg Tablety Acidum alendronicum
 Sp.zn.sukls83569/2014 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Alendronate - Teva 70 mg Tablety Acidum alendronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls83569/2014 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Alendronate - Teva 70 mg Tablety Acidum alendronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls105157/2012
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls105157/2012 Příbalová inormace: informace pro pacienta GLANUTA 150 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls105157/2012 Příbalová inormace: informace pro pacienta GLANUTA 150 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci
Merck Santé, 2, rue du Pressoir Vert, 45400 Semoy, Francie Merck, SL, Poligono Merck, 08100 Mollet Del Valles (Barcelona), Španělsko Složení
 U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Monkasta 10 mg potahované tablety pro dospělé a dospívající od 15 let věku montelukastum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Monkasta 10 mg potahované tablety pro dospělé a dospívající od 15 let věku montelukastum
Příbalová informace: informace pro uživatele. OMNIPAQUE 300 300 mg I/ml, injekční roztok. OMNIPAQUE 350 350 mg I/ml, injekční roztok
 sp.zn.sukls55325/2015 Příbalová informace: informace pro uživatele OMNIPAQUE 300 300 mg I/ml, injekční roztok OMNIPAQUE 350 350 mg I/ml, injekční roztok Iohexolum Přečtěte si pozorně celou příbalovou informaci
sp.zn.sukls55325/2015 Příbalová informace: informace pro uživatele OMNIPAQUE 300 300 mg I/ml, injekční roztok OMNIPAQUE 350 350 mg I/ml, injekční roztok Iohexolum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta. Daleron proti chřipce a nachlazení potahované tablety
 sp. zn. sukls65664/2015 Příbalová informace: informace pro pacienta Daleron proti chřipce a nachlazení potahované tablety paracetamolum, pseudoephedrini hydrochloridum, dextromethorphani hydrobromidum
sp. zn. sukls65664/2015 Příbalová informace: informace pro pacienta Daleron proti chřipce a nachlazení potahované tablety paracetamolum, pseudoephedrini hydrochloridum, dextromethorphani hydrobromidum
GLANUTA 50 mg Potahované tablety Bicalutamidum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLANUTA 50 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLANUTA 50 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele Valsacor 320 mg potahované tablety Valsartanum
 Sp.zn. sukls175670/2012 Příbalová informace: informace pro uživatele Valsacor 320 mg potahované tablety Valsartanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Sp.zn. sukls175670/2012 Příbalová informace: informace pro uživatele Valsacor 320 mg potahované tablety Valsartanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE. Galvus 50 mg tablety Vildagliptinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta. TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum
 Příbalová informace: informace pro pacienta TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Příbalová informace: informace pro pacienta TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls105381/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Manoass 100 mg enterosolventní tablety acidum acetylsalicylicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls105381/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Manoass 100 mg enterosolventní tablety acidum acetylsalicylicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. Baraclude 0,05 mg/ml perorální roztok entecavirum
 Příbalová informace: informace pro uživatele Baraclude 0,05 mg/ml perorální roztok entecavirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele Baraclude 0,05 mg/ml perorální roztok entecavirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace. GlaxoSmithKline Biologicals S.A., Rue de l Institut 89, 1330 Rixensart, Belgie
 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU. IMMUNINE BAXTER 1200 IU, prášek a rozpouštědlo pro injekční nebo infuzní roztok
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMMUNINE BAXTER 1200 IU, prášek a rozpouštědlo pro injekční nebo infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: factor IX coagulationis
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMMUNINE BAXTER 1200 IU, prášek a rozpouštědlo pro injekční nebo infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: factor IX coagulationis
Psi: Snížení mortality a klinických příznaků parvovirózy (enterické formy) psů od 1 měsíce věku.
 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
Léčivé látky: Fibrinogenum humanum, thrombinum humanum, aprotininum, calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Roztoky pro tkáňové lepidlo, zmrazené, zvolna tuhnoucí Léčivé látky: Fibrinogenum humanum, thrombinum humanum, aprotininum,
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Roztoky pro tkáňové lepidlo, zmrazené, zvolna tuhnoucí Léčivé látky: Fibrinogenum humanum, thrombinum humanum, aprotininum,
Co byste měl(a) vědět o léčivém přípravku
 Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), pak
Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), pak
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta DHC Continus 60 mg DHC Continus 90 mg DHC Continus 120 mg tablety s řízeným uvolňováním dihydrocodeini tartras Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta DHC Continus 60 mg DHC Continus 90 mg DHC Continus 120 mg tablety s řízeným uvolňováním dihydrocodeini tartras Přečtěte si pozorně celou příbalovou informaci
MACE: INFORMACE PRO UŽIVATELE. Cervarix Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)
![MACE: INFORMACE PRO UŽIVATELE. Cervarix Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) MACE: INFORMACE PRO UŽIVATELE. Cervarix Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)](/thumbs/33/16328816.jpg) MACE: INFORMACE PRO UŽIVATELE Cervarix Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) dostanete tuto vakcínu. - vou informaci. - Máte-. -. - V : 1. Co je Cervarix
MACE: INFORMACE PRO UŽIVATELE Cervarix Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) dostanete tuto vakcínu. - vou informaci. - Máte-. -. - V : 1. Co je Cervarix
Co byste měli vědět o přípravku
 Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Příbalová informace: informace pro uživatele. Ferriprox 500 mg potahované tablety Deferipronum
 Příbalová informace: informace pro uživatele Ferriprox 500 mg potahované tablety Deferipronum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele Ferriprox 500 mg potahované tablety Deferipronum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože obsahuje
Levonorgestrel Zentiva 1,5 mg tableta levonorgestrelum
 Sp. zn. sukls56218/2014 Příbalová informace: informace pro uživatele Levonorgestrel Zentiva 1,5 mg tableta levonorgestrelum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls56218/2014 Příbalová informace: informace pro uživatele Levonorgestrel Zentiva 1,5 mg tableta levonorgestrelum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls112148/2013
 Sp.zn.sukls112148/2013 Příbalová informace: Informace pro uživatele Maratia 37,5 mg/325 mg tablety tramadoli hydrochloridum/paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls112148/2013 Příbalová informace: Informace pro uživatele Maratia 37,5 mg/325 mg tablety tramadoli hydrochloridum/paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. Velmetia 50 mg/1000 mg potahované tablety sitagliptinum/metformini hydrochloridum
 Příbalová informace: informace pro uživatele Velmetia 50 mg/1000 mg potahované tablety sitagliptinum/metformini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Velmetia 50 mg/1000 mg potahované tablety sitagliptinum/metformini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK GLANUTA 150 MG UŽÍVAT
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLANUTA 150 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE GLANUTA 150 mg Potahované tablety Bicalutamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele. CEPROTIN 500 IU prášek a rozpouštědlo pro injekční roztok. Proteinum C (humanum)
 Příbalová informace: informace pro uživatele CEPROTIN 500 IU prášek a rozpouštědlo pro injekční roztok. Proteinum C (humanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele CEPROTIN 500 IU prášek a rozpouštědlo pro injekční roztok. Proteinum C (humanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
