CZ.1.07/1.1.14/ Inovace výuky v Písku a okolí Výukový materiál. Spolupráce se základními školami. Přírodovědná oblast
|
|
|
- Ondřej Černý
- před 8 lety
- Počet zobrazení:
Transkript
1 Výukový materiál Spolupráce se základními školami Přírodovědná oblast Chemie kolem nás Chemii, podobně jako například biologii nebo fyziku, řadíme k tzv. přírodním vědám, neboť objektem zkoumání jsou určité části a vlastnosti přírody. Chemie je především tzv. užitná věda. To znamená, že jejím hlavním úkolem není pouze informace zjišťovat a shromažďovat, ale zejména snaha tyto získané informace prakticky využít v běžném životě. Hlavním cílem chemie je najít odpovědi na otázky, - jak můžeme znalosti o vlastnostech a přeměnách chemických látek využít ku svému prospěchu (k prospěchu celého lidstva) - jak lze tyto látky získat - jak s těmito látkami zacházet, aby to bylo bezpečné nejen pro nás, ale i pro okolní přírodu Pomocí obrázků se nejprve vrátíme zpátky do daleké historie pak přejdeme k současnému životu: UHLÍ Vznik černého kvalitní uhlí se datuje do období prvohor karbonu. Vzniklo z přesliček a kapradin, které napadaly do močálů a tam za nepřístupu kyslíku zuhelnatěly. Uhlí je jedna z forem prvku uhlíku. Podle kvality rozlišujeme antracit, černé uhlí, hnědé uhlí a lignit. Uhlí se využívá jako palivo v domácnostech i průmyslu a také k výrobě elektřiny v uhelných elektrárnách. Při hoření uhlí vzniká nejenom teplo, ale i spousta škodlivin, které se uvolňují do ovzduší. Zejména oxid siřičitý, oxid uhelnatý a oxid uhličitý. Záleží na tom, zda je spalování dokonalé či nedokonalé. SPŠ a VOŠ Písek, Karla Čapka 402, Písek 1
2 OHEŇ Historie užívání ohně sahá již do pravěku, kdy se člověk oheň naučil využívat ke svému prospěchu. Ať již k tepelné úpravě potravin či k výrobě kovů doba bronzová, železná. Oheň je forma hoření, je to exotermická oxidace hořlavých plynů (reakce s kyslíkem, při níž se uvolňuje teplo). Aby začalo hoření, musíme k předmětu, který má hořet, přiložit např. hořící zápalku. Ani zápalka se však nezažehne sama, musíme ji zapálit o krabičku. Je to proto, že chemická reakce, tj. hoření, potřebuje ke svému vzniku teplo. Hoření dřeva, uhlí, benzínu atd. je reakce, při které se tyto látky slučují se vzdušným kyslíkem. Tato reakce začíná na povrchu látek, a pokud neshoří povrchová vrstva, nemůže hořet další. Tím se vysvětluje relativně pomalý průběh hoření. O pravdivosti tohoto tvrzení se lze snadno přesvědčit: všichni víme, že když naštípáme dříví na třísky, hoří mnohem rychleji. Při spalování organického materiálu oheň vytváří různé produkty - kouř, saze, popel, dehet, dřevěné uhlí atd.. ALCHYMIE Alchymie je považována za předchůdkyni dnešní chemie. Cíle alchymie nebyly vždy pouze vědecké. Alchymisté zaměřili svá bádání zejména na: - zhotovení kamene mudrců, sloužícího k přeměně (transmutaci) obyčejných kovů ve zlato - přípravu tekutého zlata energetického léku dodávajícího tělu odolnost vůči všem nemocem - získání elixíru života látky způsobující omlazení organismu a prodloužení života - stvoření homunkuluse uměle vytvořená živá bytost Bylo nepsaným pravidlem, že každý alchymista pracoval utajeně a výsledky své práce neposkytoval nikomu, pouze je konzultoval s jiným alchymistou. Aby jejich tajemství zůstalo utajeno, používali různé symboly a značky, kterým rozuměli jen oni sami. Alchymie nahromadila velké množství chemicko-technologických zkušeností. Alchymisté vypracovali dodnes běžně užívané metody izolace látek - sublimace, destilace, krystalizace aj., různé způsoby žíhání a rozpuštění, vytvořili velké množství chemického nádobí - třecí miska, baňky, nálevky, kádinky a další. Již kolem roku 1200 n. l. znali řadu prvků - zlato, měď, železo, cín, rtuť, stříbro, síru apod., uměli připravit kyselinu sírovou, dusičnou, chlorovodíkovou, znali výrobu sody, louhů, ledku nebo alkoholu. V 16. století začala být alchymie postupně nahrazována vědeckým přístupem ke studiu látek a jejich vzájemných přeměn. Rájem středověkých alchymistů byl pražský dvůr císaře Rudolfa II. ( ), který byl proto zván "knížetem alchymistů". Možná si mnozí vzpomenete na film Císařův pekař a Pekařův císař, kde byl císařovým dvorním alchymistou magistr Edward Kelly, skutečná historická postava. Kelly byl známý anglický podvodník, který zneužíval pohostinnosti svých zaměstnavatelů. Kromě císaře Rudolfa II., byl příznivcem alchymistů i jihočeský šlechtic SPŠ a VOŠ Písek, Karla Čapka 402, Písek 2
3 Vilém z Rožmberka ( ), který v Českém Krumlově a Třeboni zřídil laboratoře. Vystřídalo se zde několik domácích i cizích alchymistů, kteří postupně rozpouštěli Vilémovo jmění. S přibývajícími léty Vilém snil čím dál více o elixíru mládí, kterého se však nikdy nedočkal. DÝCHÁNÍ Dýchání je proces výměny plynů, zejména kyslíku (O 2 ) a oxidu uhličitého (CO 2 ), mezi organismem a jeho vnějším prostředím. Projevem tohoto procesu navenek je dech. Přeměna plynů u člověka se uskutečňuje prostřednictvím dýchací soustavy, jejíž důležitou součástí jsou plíce. Tady je do krve předáván kyslík a naopak odebírán oxid uhličitý, který vydechujeme. Kromě oxidu uhličitého vydechujeme i vodní páru, což pozorujeme nejlépe v zimě, kdy nám od pusy stoupá oblak páry. Jak je vidět na obrázku, vydechnutý vzduch je těžší než běžný vzduch, neboť balónky naplněné vzduchem z plic padají k zemi. Je to díky obsahu oxidu uhličitého ve vydechnutém vzduchu, neboť CO 2 je těžší než vzduch. Na obrázku vidíme i balónek, který stoupá vzhůru k oblakům. Tento balónek musí být naplněn nějakým lehčím plynem, například heliem či výbušným vodíkem. Opakem dýchání je fotosyntéza, která probíhá v zelených částech rostlin. FOTOSYNTÉZA Fotosyntéza je chemická reakce, která je opakem dýchání. Uskutečňuje se v zelených částech rostlin, tedy v těch částech, které obsahují chloroplasty a v nich zelené barvivo chlorofyl. K fotosyntéze je navíc potřeba teplo a světlo. Reakce tedy probíhá pouze ve dne. V noci, když je tma, se rostliny chovají jako živočichové a naopak kyslík spotřebovávají. V ložnici bychom proto neměli mít příliš mnoho rostlin, aby nám neodebíraly důležitý kyslík. Největším producentem kyslíku jsou lesy, ne nadarmo se říká, že lesy jsou plíce Země. Ne vždy si to lidé uvědomují a k přírodě se nechovají tak, jak by si vzhledem ke své důležitosti zasloužila. Rovnice fotosyntézy: 6 CO H 2 O C 6 H 12 O O 2 oxid uhličitý voda cukr kyslík glukóza ZNEČIŠŤOVÁNÍ OVZDUŠÍ Zdroje znečišťování ovzduší lze rozdělit na mobilní - automobily, letadla, lesnické či zemědělské stroje a stacionární průmyslové továrny, tepelné elektrárny, spalovny odpadů či domácnosti topící tuhými palivy. SPŠ a VOŠ Písek, Karla Čapka 402, Písek 3
4 Součástí nových automobilů jsou katalyzátor y, které snižují únik škodlivin do ovzduší, zároveň při každé technické prohlídce musí automobil projít zkouškou na emise. Rovněž spalovny a průmyslové podniky jsou kontrolovány a musí splňovat zákonem stanovené normy. Do svých zařízení montují odlučovače, které zachycují škodliviny. Problém zvláště v zimním období představují domácnosti topící nejenom pevnými palivy, ale mnohdy i odpadem obsahujícím vše možné včetně plastů. Díky smogu se pak v těchto oblastech špatně dýchá nejen zdravému člověku, ale zejména lidem nemocným astmatikům a alergikům. Známé jsou případy z dřívějších let, kdy zejména v oblasti Krušných hor došlo kvůli vysoké koncentraci škodlivých oxidů ke vzniku kyselých dešťů a následně k úhynu velkých ploch lesních porostů. Škodlivé oxidy jsou zejména oxidy síry, dusíku a oxid uhelnatý. Jakmile se tyto plyny rozptýlí do atmosféry, začnou reagovat s vodou za tvorby sirných a dusíkatých kyselin, které padají na zem ve formě deště. Do ovzduší se při spalování dostává i jemný prach - popílek, který je součástí smogu. Zvláště při inverzním počasí se v některých oblastech našeho území díky smogu nedá venku pobývat. Jednou z reakcí vedoucí ke tvorbě kyselého deště je: S + O 2 SO 2 2 SO 2 + O 2 2 SO 3 SO 3 + H 2 O H 2 SO 4 OPALOVÁNÍ Kdo by neměl rád se v parném létě na koupališti vystavit sluníčku. Slunce je pro nás zdrojem energie, tepla. Díky slunečnímu záření si náš organismus vytváří i tolik potřebný vitamín D. Nic se však nemá přehánět. Zvláště v posledních letech, kdy ubývá ozónová vrstva, se nadměrné opalování stává spíše nebezpečné. Ozónová vrstva je ochranná vrstva nacházející se asi 25 km nad zemským povrchem, složená z molekul ozónu O 3. Molekuly ozónu pohlcují (zachycují) zdraví škodlivé UV záření. Pokud je vrstva oslabena, záření jí snadno proniká a může způsobit negativní změny na pokožce vznik rakoviny kůže. Před zářením můžeme naši pokožku ochránit pomocí krémů s UV faktorem. Čím je UV faktor větší, tím déle můžeme být vystaveni záření aniž by došlo k poškození pokožky. A co způsobuje ubývání ozónu? Jsou to především freony, tedy organické látky patřící do skupiny halogenderivátů uhlovodíků, které obsahují zejména fluor a chlor. Běžně využívané freony jsou plyny nebo nízkovroucí kapaliny. Jsou bezbarvé, bez zápachu, nehořlavé a při vdechování nejsou toxické. Jsou to výborné izolanty a rozpouštědla. Dříve se freony ve velkém měřítku používaly v chladicích zařízeních, jako hasicí prostředky nebo hnací médium ve sprejích. V dnešní SPŠ a VOŠ Písek, Karla Čapka 402, Písek 4
5 době se od jejich používání upouští právě kvůli negativnímu vlivu na ozónovou vrstvu zemské atmosféry. HYGIENA Hygiena patří mezi činnosti, které by každý z nás měl pravidelně provádět, aby jeho tělo zůstalo zdravé. Dobrá hygiena pomáhá nejenom zdraví, ale i kráse, pohodlí i sociálnímu styku. Přímo podporuje prevenci a izolování nemocí. Mytí je nejčastější příklad hygienického chování a obvykle se provádí vodou a mýdlem nebo saponátem pomáhajícím odstranit mastnotu a narušit nečistotu, aby mohla být umyta. Mýdlo se vyrábí procesem zvaným zmýdelňování z přírodních nebo chemicky upravených tuků působením koncentrovaných roztoků hydroxidů alkalických kovů, např. hydroxidu sodného NaOH nebo draselného KOH (tzv. louhů). Čištění zubů pastou, ve které je obsažen flour, napomáhá prevenci vzniku zubního kazu. Různé hygienické přípravky mohou být uměle parfémované, ty mohou na citlivější pokožce způsobit různé vyrážky a alergické reakce. UKLÍZENÍ Udržovat v čistotě potřebujeme nejen své tělo, ale i prostředí, ve kterém žijeme. K tomu, abychom zničili bakterie, které nás obklopují, používáme různé chemické prostředky obsahující látky pro hubení těchto škodlivých zárodků. Tyto prostředky mohou obsahovat například chlor, který je velice dobře identifikovatelný díky svému zápachu. Určitě všichni znáte zápach přechlorovaného plaveckého bazénu nebo čistícího prostředku s názvem Savo. Mnohé čistící prostředky jsou zdraví škodlivé, a proto by se s nimi mělo zacházet pouze v ochranných rukavicích. To, že je látka nebezpečná, poznáme pomocí symbolů uvedených na obalu prostředku: VODA SPŠ a VOŠ Písek, Karla Čapka 402, Písek 5
6 Voda, sumárním vzorcem H 2 O, je chemická sloučenina vodíku a kyslíku. Spolu se vzduchem, tvoří základní podmínky pro existenci života na Zemi. Za normální teploty a tlaku je to bezbarvá, čirá kapalina bez zápachu, v silnější vrstvě namodralá. Voda je nejčastějším rozpouštědlem. Většina reakcí v lidském těle probíhá ve vodném prostředí. V přírodě se vyskytuje ve třech skupenstvích: v pevném led a sníh, v kapalném voda a v plynném vodní pára. Voda tvoří 71% zemského povrchu. Podle tvrdosti rozlišujeme vodu: - měkká obsahuje málo minerálních látek - tvrdá z podzemních pramenů, obsahuje více minerálních látek Podle obsahu škodlivých mikroorganismů rozlišujeme vodu: - pitná voda je vhodná ke každodennímu použití, je zbavená nečistot, obsahuje vyvážené množství minerálních látek tak, aby neškodily zdraví, např. minerální voda (obsahuje mnoho minerálních látek), může to být i balená voda - užitková voda v průmyslových závodech a v potravinářství vyžadujeme dezinfikovanou vodu (chlórování, ozonizace, ozařování ultrafialovým zářením), např. voda určená k napájení zvířat /má odlišné parametry než voda pitná/ - odpadní voda, např. splašková voda POTRAVINY V našem těle při běžném životě probíhá mnoho pochodů, které vyžadují přísun energie. Každý pohyb, trávení, vylučování, ale i myšlení vyžaduje přísun potravin nesoucích s sebou vhodnou formu energie. Vědci stanovují množství, které se může uvolnit spalováním z příslušné potraviny. Počítá se v joulech a jistě všichni znáte různé tabulky ukazující, kolik energie dostaneme, když sníme tu či onu potravinu, a kolik by měl sníst dospělí muž či žena podle svého pracovního zařazení. Není jedno, ze které potraviny se energie uvolňuje. Jaké máme možné zdroje? Mohou jimi být bílkoviny, tuky nebo cukry. Nejrychlejším zdrojem energie jsou cukry. S nimi se běžně setkáváme v cukrárnách a máme je v cukřenkách. Do určité míry sem patří i med a ovocný cukr. Nejčastěji užívaný cukr je sacharóza, tzv. bílý cukr. Určitě si vzpomenete i na glukózu vznikající při fotosyntéze. Cukry se díky své jednoduché stavbě molekul velice rychle vstřebávají přímo do krve. Tím dojde k okamžitému zvýšení jejich obsahu v krvi a nastává stav, který se nazývá hyperglykémii - nadbytek cukru v krvi. Protože to není pro organismus nijak zvlášť příznivé, snaží se to kompenzovat vyplavením hormonu zvaného inzulín, který má za úkol metabolizovat sacharidy a dopravit je tam, kde jsou v organismu potřeba. Pokud se tak děje často, může dojít k zatížení slinivky břišní, které může vyústit v diabetes SPŠ a VOŠ Písek, Karla Čapka 402, Písek 6
7 mellitus - cukrovku. Tuk přicházející do našeho těla je nezbytný pro mnoho základních funkcí celého organismu. Je složen z jednotlivých částí, které se nazývají mastné kyseliny. Je jich několik druhů a každá má jiný význam pro tělo a jeho zdravý vývoj. Nasycené mastné kyseliny nejsou pro naše tělo nezbytné, protože si je dovede samo vytvořit. Slouží jako zdroj energie a ten mohou zcela nahradit polysacharidy. Nenasycené mastné kyseliny si tělo neumí vyrobit a je nutné přijímat je potravou. Při konzumaci potravin bychom měli dát přednost nenasyceným mastným kyselinám obsaženým v rybách a rostlinném oleji před nasycenými obsaženými v červeném mase či živočišných tucích. Bílkoviny jsou základními stavebními kameny našeho těla a na nich záleží, jaká bude konstrukce. Navíc hrají i důležitou úlohu ve funkcích složitého systému našeho těla. Proto je nezbytné, aby bílkoviny, které přivádíme do našeho těla, byly kvalitní a byl jich dostatek. O struktuře cukrů, tuků a bílkovin se dozvíte více při hodinách organické chemie. Pro dlouhodobé uchovávání potravin a pro zvýraznění chuti se používají různé stabilizátory, emulgátory a dochucovadla, nám známá jako éčka. Ta jsou mnohdy velice škodlivá. Měli bychom vždy dbát na správné složení potravin a vybírat si spíše ty bez umělých konzervantů a barviv. HNOJENÍ Hnojiva jsou směsi anorganických či organických látek používané pro zlepšení růstu rostlin. Obvykle jsou aplikována přes půdu (pro příjem kořeny) nebo hnojením listů (pro příjem listy). Hnojiva obvykle poskytují v různých poměrech tři hlavní biogenní prvky: dusík, fosfor, draslík. Významné hnojivo nese název podle značek obsažených prvků NPK. Dalšími biogenními prvky jsou vápník, síra, hořčík a někdy také stopové prvky, které jsou obsaženy v malém množství např. mangan, železo, zinek, měď, atd. Hnojiva mohou být buď přírodní hnůj, močůvka, kompost, nebo průmyslově vyrobená. Hnojiva lze aplikovat v pevné formě granule, prášek nebo v kapalné formě močůvka, kejda. Do půdy se takto vrací živiny, které rostliny pro svůj růst z půdy vyčerpají. Mezi známá hnojiva patří rovněž dusičnany, tzv. ledky: ledek chilský NaNO 3,ledek draselný KNO 3 a ledek amonný NH 4 NO 3. Negativem hnojení je mnohdy vyšší obsah dusičnanů například v zelenině. PORCELÁN Porcelán je keramická hmota, která vzniká vypálením keramické hmoty tvořené směsí kaolínu s dalšími přísadami (např. sádrovec CaSO 4.2H 2 O, křemičitý písek SiO 2, živec). Porcelán má bílou barvu a je nasákavý, proto se pokrývá vrstvou glazury, která má zároveň dekorativní funkci. Glazura se podle oblastí specificky zdobila malbou vídeňský porcelán, míšeňský porcelán, SPŠ a VOŠ Písek, Karla Čapka 402, Písek 7
8 cibulák, atd. Používá se pro výrobu nádobí, sanitární keramiky, elektrických izolátorů, dlaždic, ozdobných předmětů, v dentální keramice a mnoha dalších předmětů. STAVEBNICTVÍ Ve stavebnictví se používají různé chemické látky či jejich směsi. Jednou z takových látek je vápno, které je tradičním stavebním i nátěrovým materiálem. Vápno najdeme i v maltových a omítkových směsích. Pálené vápno CaO se vyrábí z vápence CaCO 3, který se praží ve vápenkách. Reakce probíhá podle rovnice: CaCO 3 CaO + CO 2 Dříve se pálené vápno před použití muselo hasit, tj. přelít vodou. Vzniklo hašené vápno: CaO + H 2 O Ca(OH) 2 Velmi důležitý byl poměr vody pokud jí bylo málo, vápno se spálilo, pokud jí bylo moc, vápno se utopilo. Při reakci s vodou vzniká velké množství tepla, netřeba si chránit oči štítem či brýlemi. Takto připravené vápno muselo v sudu zrát až jeden rok.po zředění vodou vzniklo vápenné mléko, které se používalo k bílení. Bílení vápnem mělo své výhody. Jednak sloužilo jako desinfekce před plísněmi (vápno je zásada žíravina) a jednak stěny mohly dýchat a plísně tolik nevznikaly. Vápno se dnes již v domácích podmínkách nehasí. Koupíte si předem připravenou sypkou směs, tu smísíte s vodou a ihned použijete. Rovnice tvrdnutí malty, jejíž součástí pálené vápno je: Ca(OH) 2 + CO 2 CaCO 3 + H 2 O PLASTY Plasty, známé pod ne zcela přesným názvem umělé hmoty, označují řadu syntetických organických materiálů. Struktura plastů je tvořena dlouhými řetězci molekul, kterým říkáme makromolekuly nebo polymery, které jsou složeny z obrovského počtu jednoduchých stále se opakujících molekul. Jejich název je odvozen z faktu, že mnohé jsou tvarovatelné - plastické. Často obsahují ještě další příměsi ke zlepšení užitných vlastností, např. odolnosti proti stárnutí, zvýšení houževnatosti, pružnosti, tepelné odolnosti, tvrdosti, pružnosti apod. Mezi jejich výhody patří nízká hustota, chemická odolnost, jednotnost složení a struktury a dobrá zpracovatelnost energeticky málo náročnými technologiemi. Díky tomu nalezly použití téměř ve všech průmyslových odvětvích i v domácnostech. Mezi nejběžnější plasty patří: polyethylen (PE), polypropylen (PP), polyvinylchlorid (PVC), polystyren (PS), polyethylentereftalát (PET), Teflon LÉKAŘSTVÍ SPŠ a VOŠ Písek, Karla Čapka 402, Písek 8
9 Obor lékařství by se v současné době bez poznatků z oblasti chemie jen těžko obešel. Nedovedeme si představit, že bychom šli k lékaři na aplikaci injekce a lékař by nám okolí vpichu nevydezinfikoval. Co je to za vodičku, kterou je místo potíráno? Někomu možná voní, někomu naopak zapáchá, to je čistě subjektivní. V každém případě je to roztok jodu v alkoholu. Možná vám maminka, když jste si jako malí rozbili koleno, potřela ránu štiplavou vodičkou. Dnes už asi víte, že to byl 3% roztok peroxidu vodíku (H 2 O 2 ), který lze krom jiného použít třeba k odbarvení vlasů. Odtud název peroxidová blondýna. Pokud nás přepadne například angína, lékař nám předepíše antibiotika např. penicilin, což je organická kyselina, kterou objevil Alexander Fleming v roce 1928, kdy si všiml, že v Petriho misce s bakteriemi roste plíseň, která zabíjí okolní bakterie. Antibiotika jako léčiva nemocí nám velmi pomáhají, ale mohou i škodit. A to zejména v případě, kdy jejich užívání bude neuvážené, nesprávné, případně kombinované s nevhodnými potravinami, jako je káva nebo alkohol. Mnohdy se náš organismus při nedostatku některých důležitých vitamínu či minerálů neobejde bez doplňků stravy. Vždy bychom měli chybějící látky prvotně vyhledávat spíše v potravinách, než užívat uměle vyrobené chemické přípravky. KOROZE Je to redoxní reakce, kdy vzdušný kyslík oxiduje povrch kovů, při čemž se sám redukuje. Ke korozi přispívají také další chemikálie (voda, soli, kyseliny,...) a agresivita prostředí (střídání teplot, intenzita slunečního záření atd.) Koroze železa probíhá podle rovnice: 4Fe + 3O 2 + 6H 2 O 4Fe(OH) 3 (rez) a na rozdíl od jiných kovů má destrukční účinky - postupně zničí kov v celém jeho objemu = koroze hloubková. Před korozí lze železo chránit například pomocí pokovování, nátěrů, nanesením plastu, pasivací (rychlé ponoření do kyseliny dusičné HNO 3 ). Koroze mědi probíhá pouze na povrchu = koroze povrchová. Měď se potáhne vrstvou hydratovaných oxidů zelené barvy (měděnka), které měď chrání před další korozí. Hliník, zinek, olovo, cín podléhají pouze povrchové korozi za vzniku oxidů, které kov chrání před další korozí pasivace kovů. Koroze železa způsobuje ročně mnohamilionové škody, ochrana před korozí je proto důležitá. Ještě důležitější je hledat cestu, jak nahrazovat kovy jinými materiály, například plasty. KLENOTNICTVÍ Lidé se od nepaměti zdobili různými šperky, které byly a jsou vyrobeny například z drahých kovů a kamenů. Nejčastějšími kovy k výrobě šperků jsou zlato a stříbro. Vzhledem k menší odolnosti SPŠ a VOŠ Písek, Karla Čapka 402, Písek 9
10 (zlato je příliš měkké) se tato kovy nepoužívají čisté, ale ve formě slitin se stříbrem, mědí, zinkem, palladiem či niklem. Příměsi palladia a niklu navíc zbarvují vzniklou slitinu vzniká tak v současné době dosti moderní bílé zlato. Výroba a dovoz šperků a výrobků ze zlata podléhá puncovnímu zákonu. Šperky a produkty, jak nové, tak i staré určené k prodeji jsou opatřené puncem. Punc je rozdílný pro každou ryzost zvlášť. Čisté zlato se nazývá ryzí a má 24 karátů. V obchodech můžeme najít zlato 18-ti, 14-ti či 8-mi karátové. Rovněž stříbrné šperky jsou vyrobeny ze slitin a v některých případech potaženy rhodiem pro větší odolnost a uchování stálého lesku. Kovové pásky hodinek jsou taktéž vyráběny ze slitin. Někdy je přímo uváděno, že slitiny neobsahují nikl, což je důležitá informace, neboť někteří lidé jsou na nikl alergičtí. Z drahých kamenů jsou asi nejznámější diamanty. Diamant je krystalická forma uhlíku, je to nejtvrdší přírodní látka (stupeň 10). Je průhledný, ale může mít i různá zbarvení, nevede elektrický proud a při správném výbrusu odráží světlo krásně se leskne. Dalšími známými drahými kameny jsou rubín červený, safír modrý, smaragd zelený. SPŠ a VOŠ Písek, Karla Čapka 402, Písek 10
Kyslík a vodík. Bezbarvý plyn, bez chuti a zápachu, asi 14krát lehčí než vzduch. Běžně tvoří molekuly H2. hydridy (např.
 1 Kyslík a vodík Kyslík Vlastnosti Bezbarvý reaktivní plyn, bez zápachu, nejčastěji tvoří molekuly O2. Kapalný kyslík je modrý. S jinými prvky tvoří sloučeniny oxidy (např. CO, CO2, SO2...) Výskyt Nejrozšířenější
1 Kyslík a vodík Kyslík Vlastnosti Bezbarvý reaktivní plyn, bez zápachu, nejčastěji tvoří molekuly O2. Kapalný kyslík je modrý. S jinými prvky tvoří sloučeniny oxidy (např. CO, CO2, SO2...) Výskyt Nejrozšířenější
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
Ch - Hydroxidy VARIACE
 Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
Ch - Hydroxidy Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně vytvořen,
PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ OVZDUŠÍ
 PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ OVZDUŠÍ 2010 Ing. Andrea Sikorová, Ph.D. 1 Problémy životního prostředí - ovzduší V této kapitole se dozvíte: Co je to ovzduší. Jaké plyny jsou v atmosféře. Jaké složky znečišťují
PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ OVZDUŠÍ 2010 Ing. Andrea Sikorová, Ph.D. 1 Problémy životního prostředí - ovzduší V této kapitole se dozvíte: Co je to ovzduší. Jaké plyny jsou v atmosféře. Jaké složky znečišťují
K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra
 K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra Kyslík Je složkou vzduchu Umožňuje dýchání živočichů V malém množství je také rozpuštěn ve vodě, což umožňuje život vodních živočichů Je nezbytnou
K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra Kyslík Je složkou vzduchu Umožňuje dýchání živočichů V malém množství je také rozpuštěn ve vodě, což umožňuje život vodních živočichů Je nezbytnou
VESMÍR. za počátek vesmíru považujeme velký třesk před 13,7 miliardami let. dochází k obrovskému uvolnění energie, která se rozpíná
 VESMÍR za počátek vesmíru považujeme velký třesk před 13,7 miliardami let dochází k obrovskému uvolnění energie, která se rozpíná vznikají první atomy, jako první se tvoří atomy vodíku HVĚZDY první hvězdy
VESMÍR za počátek vesmíru považujeme velký třesk před 13,7 miliardami let dochází k obrovskému uvolnění energie, která se rozpíná vznikají první atomy, jako první se tvoří atomy vodíku HVĚZDY první hvězdy
Speciální ZŠ a MŠ Adresa. U Červeného kostela 110, 415 01 TEPLICE. Název op. programu
 Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. TEST ŠKOLNÍHO KOLA kategorie D. ZADÁNÍ: 70 BODŮ časová náročnost: 120 minut
 Ústřední komise Chemické olympiády 53. ročník 016/017 TEST ŠKOLNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 10 minut Zadání testu školního kola ChO kat. D 016/017. Úloha 1 Výroba pigmentů 5
Ústřední komise Chemické olympiády 53. ročník 016/017 TEST ŠKOLNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 10 minut Zadání testu školního kola ChO kat. D 016/017. Úloha 1 Výroba pigmentů 5
1. Chemický turnaj. kategorie mladší žáci 30.11. 2012. Zadání úloh
 1. Chemický turnaj kategorie mladší žáci 30.11. 2012 Zadání úloh Vytvořeno v rámci projektu OPVK CZ.1.07/1.1.26/01.0034,,Zkvalitňování výuky chemie a biologie na GJO spolufinancovaného Evropským sociálním
1. Chemický turnaj kategorie mladší žáci 30.11. 2012 Zadání úloh Vytvořeno v rámci projektu OPVK CZ.1.07/1.1.26/01.0034,,Zkvalitňování výuky chemie a biologie na GJO spolufinancovaného Evropským sociálním
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
FAKTORY VNITŘNÍHO PROSTŘEDÍ STAVEB
 FAKTORY VNITŘNÍHO PROSTŘEDÍ STAVEB Vysoká škola technická a ekonomická v Českých Budějovicích Institute of Technology And Business In České Budějovice Tento učební materiál vznikl v rámci projektu "Integrace
FAKTORY VNITŘNÍHO PROSTŘEDÍ STAVEB Vysoká škola technická a ekonomická v Českých Budějovicích Institute of Technology And Business In České Budějovice Tento učební materiál vznikl v rámci projektu "Integrace
Co je chemie a proč se ji máme učit?
 ÚVOD Co je chemie a proč se ji máme učit? ➊ Spoj některé následující vynálezy s místem, kde byly objeveny. Dále zakroužkuj látky, které se snažili vyrobit dávní alchymisté. střelný prach papír oheň papyrus
ÚVOD Co je chemie a proč se ji máme učit? ➊ Spoj některé následující vynálezy s místem, kde byly objeveny. Dále zakroužkuj látky, které se snažili vyrobit dávní alchymisté. střelný prach papír oheň papyrus
Pracovní list: Opakování učiva 8. ročníku
 Pracovní list: Opakování učiva 8. ročníku Komentář ke hře: 1. Třída se rozdělí do čtyř skupin. Vždy spolu soupeří dvě skupiny a vítězné skupiny se pak utkají ve finále. 2. Každé z čísel skrývá otázku.
Pracovní list: Opakování učiva 8. ročníku Komentář ke hře: 1. Třída se rozdělí do čtyř skupin. Vždy spolu soupeří dvě skupiny a vítězné skupiny se pak utkají ve finále. 2. Každé z čísel skrývá otázku.
Chemie 8. ročník Vzdělávací obsah
 Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že
 Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že jsou poživatelné. Jiné jsou tak silné, že poleptají
Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že jsou poživatelné. Jiné jsou tak silné, že poleptají
NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663
 EU - PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
EU - PENÍZE ŠKOLÁM NÁZEV PROJEKTU : MÁME RÁDI TECHNIKU REGISTRAČNÍ ČÍSLO PROJEKTU :CZ.1.07/1.4.00/21.0663 Speciální základní škola a Praktická škola Trmice Fűgnerova 22 400 04 1 Identifikátor materiálu:
Ročník VIII. Chemie. Období Učivo téma Metody a formy práce- kurzívou. Kompetence Očekávané výstupy. Průřezová témata. Mezipřed.
 Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
O X I D Y. Ing. Lubor Hajduch ZŠ Újezd Kyjov
 O X I D Y Ing. Lubor Hajduch ZŠ Újezd Kyjov CO TO JSOU OXIDY? Oxidy (starší název kysličníky) jsou dvouprvkové sloučeniny kyslíku a dalšího prvku, kromě vodíku. Mezi oxidy patří mnoho nerostů, průmyslových
O X I D Y Ing. Lubor Hajduch ZŠ Újezd Kyjov CO TO JSOU OXIDY? Oxidy (starší název kysličníky) jsou dvouprvkové sloučeniny kyslíku a dalšího prvku, kromě vodíku. Mezi oxidy patří mnoho nerostů, průmyslových
Předmět: Chemie Ročník: 9.
 Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
Předmět: Chemie Ročník: 9. Očekávané výstupy Školní výstupy Učivo Průřezová témata 1. ANORGANICKÉ SLOUČENINY Uvede příklady uplatňování Popíše princip neutralizace Neutralizace neutralizace v praxi Vysvětlí
PERIODICKÁ TABULKA. Všechny prvky v tabulce můžeme rozdělit na kovy, nekovy a polokovy.
 PERIODICKÁ TABULKA Je známo více než 100 prvků 90 je přirozených (jsou v přírodě) 11 plynů 2 kapaliny (brom, rtuť) Ostatní byly připraveny uměle. Dmitrij Ivanovič Mendělejev uspořádal 63 tehdy známých
PERIODICKÁ TABULKA Je známo více než 100 prvků 90 je přirozených (jsou v přírodě) 11 plynů 2 kapaliny (brom, rtuť) Ostatní byly připraveny uměle. Dmitrij Ivanovič Mendělejev uspořádal 63 tehdy známých
Odborná škola výroby a služeb, Plzeň, Vejprnická 56, Plzeň. Číslo materiálu 19. Bc. Lenka Radová. Vytvořeno dne
 Název školy Název projektu Číslo projektu Číslo šablony Odborná škola výroby a služeb, Plzeň, Vejprnická 56, 318 00 Plzeň Digitalizace výuky CZ.1.07/1.5.00/34.0977 VY_32_inovace_ZZV19 Číslo materiálu 19
Název školy Název projektu Číslo projektu Číslo šablony Odborná škola výroby a služeb, Plzeň, Vejprnická 56, 318 00 Plzeň Digitalizace výuky CZ.1.07/1.5.00/34.0977 VY_32_inovace_ZZV19 Číslo materiálu 19
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 OKRESNÍ KOLO. Kategorie D. Teoretická část Řešení
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
Ústřední komise Chemické olympiády 55. ročník 2018/2019 OKRESNÍ KOLO Kategorie D Teoretická část Řešení Úloha 1 Bezpečnostní předpisy MarsCity II 16 bodů 1) Vybrané činnosti: a) Zvracení na mramorovou
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Látky jako uhlík, dusík, kyslík a. z vnějšku a opět z něj vystupuje.
 KOLOBĚH LÁTEK A TOK ENERGIE Látky jako uhlík, dusík, kyslík a voda v ekosystémech kolují. Energii se do ekosystémů dostává z vnějšku a opět z něj vystupuje. Základní podmínky pro život na Zemi. Světlo
KOLOBĚH LÁTEK A TOK ENERGIE Látky jako uhlík, dusík, kyslík a voda v ekosystémech kolují. Energii se do ekosystémů dostává z vnějšku a opět z něj vystupuje. Základní podmínky pro život na Zemi. Světlo
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Neživé přírodniny. Hmotné předměty. výrobky- vytvořil je člověk přírodniny- jsou součástí přírody
 Neživé přírodniny Hmotné předměty výrobky- vytvořil je člověk přírodniny- jsou součástí přírody Neživé vzduch voda minerály horniny půda Živé rostliny živočichové ( člověk ) houby bakterie VZDUCH Vzduch
Neživé přírodniny Hmotné předměty výrobky- vytvořil je člověk přírodniny- jsou součástí přírody Neživé vzduch voda minerály horniny půda Živé rostliny živočichové ( člověk ) houby bakterie VZDUCH Vzduch
NEŽIVÁ PŘÍRODA. Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky se složkami neživé přírody a jejich tříděním.
 NEŽIVÁ PŘÍRODA Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky se složkami neživé přírody a jejich tříděním. Neživá příroda mezi neživou přírodu patří voda, vzduch, nerosty, horniny,
NEŽIVÁ PŘÍRODA Anotace: Materiál je určen k výuce věd ve 3. ročníku ZŠ. Seznamuje žáky se složkami neživé přírody a jejich tříděním. Neživá příroda mezi neživou přírodu patří voda, vzduch, nerosty, horniny,
Chemie - 1. ročník. očekávané výstupy ŠVP. Žák:
 očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
očekávané výstupy RVP témata / učivo Chemie - 1. ročník Žák: očekávané výstupy ŠVP přesahy, vazby, mezipředmětové vztahy průřezová témata 1.1., 1.2., 1.3., 7.3. 1. Chemie a její význam charakteristika
*Základní škola praktická Halenkov * * *VY_32_INOVACE_03_01_03 * *Voda
 Základní škola praktická Halenkov VY_32_INOVACE_03_01_03 Voda Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Chemie
Základní škola praktická Halenkov VY_32_INOVACE_03_01_03 Voda Číslo projektu CZ.1.07/1.4.00/21.3185 Klíčová aktivita III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Zařazení učiva v rámci ŠVP Chemie
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
Vzdělávací oblast: Člověk a příroda. Vyučovací předmět: Chemie. Třída: kvarta. Očekávané výstupy. Poznámky. Přesahy. Průřezová témata.
 Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Vzdělávací oblast: Člověk a příroda Vyučovací předmět: Chemie Třída: kvarta Očekávané výstupy Vysvětlí pojmy oxidace, redukce, oxidační činidlo, redukční činidlo Rozliší redoxní rovnice od neredoxních
Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np:
 PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
PRVKY PÁTÉ SKUPINY Do této skupiny patří dusík, fosfor, arsen, antimon a bismut. Společnou vlastností těchto prvků je pět valenčních elektronů v orbitalech ns a np: Obecná konfigurace: ns np Nejvyšší kladné
Datum: 14. 2. 2013 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.
 Datum: 14. 2. 2013 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_467A Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
Datum: 14. 2. 2013 Projekt: Využití ICT techniky především v uměleckém vzdělávání Registrační číslo: CZ.1.07/1.5.00/34.1013 Číslo DUM: VY_32_INOVACE_467A Škola: Akademie - VOŠ, Gymn. a SOŠUP Světlá nad
POKYNY FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ
 POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
POKYNY Prostuduj si teoretický úvod a následně vypracuj postupně všechny zadané úkoly zkontroluj si správné řešení úkolů podle řešení FAKTORY OVLIVŇUJÍCÍ RYCHLOST REAKCÍ 1) Vliv koncentrace reaktantů čím
Charakteristika vyučovacího předmětu Chemie
 Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Vzdělávací obsah vyučovacího předmětu Chemie 9. ročník Zpracovala: Mgr. Michaela Krůtová ANORGANICKÉ SLOUČENINY KYSELINY porovná vlastnosti a použití vybraných prakticky významných kyselin orientuje se
Do baňky s několika mililitry 15% kyseliny chlorovodíkové vložíme hořící třísku. Pozorujeme, že tříska v baňce hoří. Hořící třísku z baňky vyndáme a
 Do baňky s několika mililitry 15% kyseliny chlorovodíkové vložíme hořící třísku. Pozorujeme, že tříska v baňce hoří. Hořící třísku z baňky vyndáme a vložíme kousek minerálu vápence Do baňky s několika
Do baňky s několika mililitry 15% kyseliny chlorovodíkové vložíme hořící třísku. Pozorujeme, že tříska v baňce hoří. Hořící třísku z baňky vyndáme a vložíme kousek minerálu vápence Do baňky s několika
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie 8.ročník. Rozpracované očekávané výstupy žáka Učivo Přesuny, OV a PT. Pozorování, pokus a bezpečnost práce předmět chemie,význam
 Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
Chemie 8.ročník Zařadí chemii mezi přírodní vědy. Pozorování, pokus a bezpečnost práce předmět chemie,význam Popisuje vlastnosti látek na základě pozorování, měření a pokusů. těleso,látka (vlastnosti látek)
Speciální ZŠ a MŠ Adresa. U Červeného kostela 110, TEPLICE Číslo op. programu CZ Název op. programu
 Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Základní škola, Ostrava Poruba, Bulharská 1532, příspěvková organizace
 Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Chemie - 8. ročník pozorování, pokus a bezpečnost práce Určí společné a rozdílné vlastnosti látek vlastnosti látek hustota, rozpustnost, tepelná a elektrická vodivost, vliv atmosféry na vlastnosti a stav
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto
 Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Gymnázium Vysoké Mýto nám. Vaňorného 163, 566 01 Vysoké Mýto Oxidace a redukce jsou chemické reakce spojené s výměnou elektronů. Při oxidaci látka elektrony uvolňuje a její oxidační číslo se zvyšuje.
Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější.
 Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Paliva. nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování
 Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Paliva Paliva nejběžnějším zdrojem tepla musí splňovat tyto podmínky: co nejmenší náklady na těžbu a výrobu snadno uskutečnitelné spalování Dělení paliv podle skupenství pevná uhlí, dřevo kapalná benzín,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Složky potravy a vitamíny
 Složky potravy a vitamíny Potrava musí být pestrá a vyvážená. Měla by obsahovat: základní živiny cukry (60%), tuky (25%) a bílkoviny (15%) vodu, minerální látky, vitaminy. Metabolismus: souhrn chemických
Složky potravy a vitamíny Potrava musí být pestrá a vyvážená. Měla by obsahovat: základní živiny cukry (60%), tuky (25%) a bílkoviny (15%) vodu, minerální látky, vitaminy. Metabolismus: souhrn chemických
PŘECHODNÉ PRVKY - II
 PŘECHODNÉ PRVKY - II Měď 11. skupina (I.B), 4. perioda nejstabilnější oxidační číslo II, často I ryzí v přírodě vzácná, sloučeniny kuprit Cu 2 O, chalkopyrit CuFeS 2 měkký, houževnatý, načervenalý kov,
PŘECHODNÉ PRVKY - II Měď 11. skupina (I.B), 4. perioda nejstabilnější oxidační číslo II, často I ryzí v přírodě vzácná, sloučeniny kuprit Cu 2 O, chalkopyrit CuFeS 2 měkký, houževnatý, načervenalý kov,
Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby
 Předmět: CHEMIE Ročník: 8. Časová dotace: 2 hodiny týdně Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby Konkretizované tematické okruhy realizovaného průřezového tématu září orientuje se
Předmět: CHEMIE Ročník: 8. Časová dotace: 2 hodiny týdně Očekávané výstupy podle RVP ZV Učivo předmětu Přesahy a vazby Konkretizované tematické okruhy realizovaného průřezového tématu září orientuje se
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Je tříatomová molekula kyslíku. Jeho vliv se liší podle toho, v jaké výšce se vyskytuje. Přízemní ozon je škodlivý, má účinky jako jedovatá látka,
 Ozon Je tříatomová molekula kyslíku. Jeho vliv se liší podle toho, v jaké výšce se vyskytuje. Přízemní ozon je škodlivý, má účinky jako jedovatá látka, ničí automobily, umělé hmoty a pryž. Vzniká při vzájemném
Ozon Je tříatomová molekula kyslíku. Jeho vliv se liší podle toho, v jaké výšce se vyskytuje. Přízemní ozon je škodlivý, má účinky jako jedovatá látka, ničí automobily, umělé hmoty a pryž. Vzniká při vzájemném
Speciální ZŠ a MŠ Adresa. U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu
 Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Subjekt Speciální ZŠ a MŠ Adresa U Červeného kostela 110, 415 01 TEPLICE Číslo op. programu CZ. 1. 07 Název op. programu OP Vzdělávání pro konkurenceschopnost Číslo výzvy 21 Název výzvy Žádost o fin. podporu
Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0
 Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
Otázka: Prvky V. A skupiny Předmět: Chemie Přidal(a): kevina.h Prvek Značka Z - protonové číslo Elektronegativita Dusík N 7 3,0 Fosfor P 15 2,2 Arsen As 33 2,1 Antimon Sb 51 2,0 Bismut Bi 83 2,0 valenční
SOLI. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 12. 4. 2013. Ročník: osmý
 SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
SOLI Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 4. 2013 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Anorganické sloučeniny 1 Anotace: Žáci se seznámí s vlastnostmi solí,
VÝZNAMNÉ OXIDY. Základní škola Kladno, Vašatova 1438 Autorem materiálu a všech jeho částí, není-li uvedeno jinak, je Jiřina Borovičková
 VY_32_INOVACE_CHE_278 VÝZNAMNÉ OXIDY Autor: Jiřina Borovičková Ing. Použití: 8. ročník Datum vypracování: 15.3.2013 Datum pilotáže: 21. 3. 2013 Metodika: : seznámit žáky s důležitými oxidy, vysvětlit jejich
VY_32_INOVACE_CHE_278 VÝZNAMNÉ OXIDY Autor: Jiřina Borovičková Ing. Použití: 8. ročník Datum vypracování: 15.3.2013 Datum pilotáže: 21. 3. 2013 Metodika: : seznámit žáky s důležitými oxidy, vysvětlit jejich
Učební osnovy vyučovacího předmětu chemie se doplňují: 2. stupeň Ročník: devátý. Přesahy, vazby, rozšiřující učivo, poznámky
 - zná pojmy oxidace, redukce, redoxní reakce - pozná redoxní reakci - určí oxidační číslo prvku ve sloučenině - popíše princip výroby surového železa a oceli - vysvětlí princip koroze a způsob ochrany
- zná pojmy oxidace, redukce, redoxní reakce - pozná redoxní reakci - určí oxidační číslo prvku ve sloučenině - popíše princip výroby surového železa a oceli - vysvětlí princip koroze a způsob ochrany
Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2
 Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2 Obsah tématu: 1) Vzdušný obal země 2) Složení vzduchu 3) Tlak vzduchu 4) Vítr 5) Voda 1) VZDUŠNÝ OBAL ZEMĚ Vzdušný obal Země.. je směs
Pracovní list č. 3 téma: Povětrnostní a klimatičtí činitelé část 2 Obsah tématu: 1) Vzdušný obal země 2) Složení vzduchu 3) Tlak vzduchu 4) Vítr 5) Voda 1) VZDUŠNÝ OBAL ZEMĚ Vzdušný obal Země.. je směs
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D. ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut Úloha 1 Je přítomen lignin? 19 bodů Při zpracování dřeva pro
Ústřední komise Chemické olympiády 53. ročník 2016/2017 TEORETICKÁ ČÁST OKRESNÍHO KOLA kategorie D ZADÁNÍ: 70 BODŮ časová náročnost: 90 minut Úloha 1 Je přítomen lignin? 19 bodů Při zpracování dřeva pro
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ PŮDA
 PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ PŮDA 2010 Ing. Andrea Sikorová, Ph.D. 1 Problémy životního prostředí - půda V této kapitole se dozvíte: Jak vznikla půda. Nejvýznamnější škodliviny znečištění půd. Co je to
PROBLÉMY ŽIVOTNÍHO PROSTŘEDÍ PŮDA 2010 Ing. Andrea Sikorová, Ph.D. 1 Problémy životního prostředí - půda V této kapitole se dozvíte: Jak vznikla půda. Nejvýznamnější škodliviny znečištění půd. Co je to
Projekt realizovaný na SPŠ Nové Město nad Metují. s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje
 Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty 1 2 chemického složení
Projekt realizovaný na SPŠ Nové Město nad Metují s finanční podporou v Operačním programu Vzdělávání pro konkurenceschopnost Královéhradeckého kraje Modul 02 Přírodovědné předměty 1 2 chemického složení
HRA Mícháme si Najdi Sumární Otázky Bezpečnost Příroda směsi
 RISKUJ HRA Mícháme si Najdi Sumární Otázky Bezpečnost Příroda směsi mě vzorce praxe 1000 1000 1000 1000 1000 1000 2000 2000 2000 2000 2000 2000 3000 3000 3000 3000 3000 3000 4000 4000 4000 4000 4000 4000
RISKUJ HRA Mícháme si Najdi Sumární Otázky Bezpečnost Příroda směsi mě vzorce praxe 1000 1000 1000 1000 1000 1000 2000 2000 2000 2000 2000 2000 3000 3000 3000 3000 3000 3000 4000 4000 4000 4000 4000 4000
Ch - Rozlišování látek
 Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Kovy, nekovy opakování Smart Board
 Kovy, nekovy opakování Smart Board VY_52_Inovace_218 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Kovy, nekovy opakování Smart Board VY_52_Inovace_218 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8 Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009
 Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Plasty Plasty, známé také pod názvem plastické hmoty nebo pod ne zcela přesným (obecnějším) názvem umělé hmoty,
Projekt: Inovace oboru Mechatronik pro Zlínský kraj Registrační číslo: CZ.1.07/1.1.08/03.0009 Plasty Plasty, známé také pod názvem plastické hmoty nebo pod ne zcela přesným (obecnějším) názvem umělé hmoty,
DUM č. 4 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 4 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
Prvky V.A a VI.A skupiny
 Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Prvky V.A a VI.A skupiny Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Duben 2010 Mgr. Alena Jirčáková Prvky V.A skupiny - vlastnosti - Prvky s pěti
Sada Životní prostředí UW400 Kat. číslo Stanovení obsahu kyslíku, nasycení kyslíkem a hodnoty BSK5
 Sada Životní prostředí UW400 Kat. číslo 100.3720 Stanovení obsahu kyslíku, nasycení kyslíkem a hodnoty BSK5 Teorie a hodnocení Obsah kyslíku ve vodě má pro přežití organismů nesmírný význam. Podle něho
Sada Životní prostředí UW400 Kat. číslo 100.3720 Stanovení obsahu kyslíku, nasycení kyslíkem a hodnoty BSK5 Teorie a hodnocení Obsah kyslíku ve vodě má pro přežití organismů nesmírný význam. Podle něho
 - Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
- Máte před sebou studijní materiál na téma KOVY ALKALICKÝCH ZEMIN, který obsahuje nejdůležitější fakta z této oblasti. - Doporučuji také prostudovat příslušnou kapitolu v učebnici PŘEHLED STŘEDOŠKOLSKÉ
Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR
 Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Celkový dusík Základní informace Ohlašovací prahy pro úniky a přenosy pro ohlašování do IRZ/E-PRTR Základní charakteristika Použití Zdroje úniků Dopady na životní prostředí Dopady na zdraví člověka, rizika
Obchodní akademie a Jazyková škola s právem státní jazykové zkoušky Písek
 Obchodní akademie a Jazyková škola s právem státní jazykové zkoušky Písek Pracovní list DUMu v rámci projektu Evropské peníze pro Obchodní akademii Písek", reg. č. CZ.1.07/1.5.00/34.0301, Číslo a název
Obchodní akademie a Jazyková škola s právem státní jazykové zkoušky Písek Pracovní list DUMu v rámci projektu Evropské peníze pro Obchodní akademii Písek", reg. č. CZ.1.07/1.5.00/34.0301, Číslo a název
Hydroxidy se vyznačují louhovitou" chutí. Ochutnávat je však nesmíte nikdy, protože mají stejné leptavé účinky jako kyseliny.
 Hydroxidy se vyznačují louhovitou" chutí. Ochutnávat je však nesmíte nikdy, protože mají stejné leptavé účinky jako kyseliny. K nejvýznamnějším z nich patří hydroxid sodný, hydroxid draselný a hydroxid
Hydroxidy se vyznačují louhovitou" chutí. Ochutnávat je však nesmíte nikdy, protože mají stejné leptavé účinky jako kyseliny. K nejvýznamnějším z nich patří hydroxid sodný, hydroxid draselný a hydroxid
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9.
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV:VY_32_INOVACE_102_Soli AUTOR: Igor Dubovan ROČNÍK, DATUM: 9., 15. 9. 2011 VZDĚL. OBOR, TÉMA: Chemie, Soli ČÍSLO PROJEKTU: OPVK
Střední škola obchodu, řemesel a služeb Žamberk. Výukový materiál zpracovaný v rámci projektu EU Peníze SŠ
 Střední škola obchodu, řemesel a služeb Žamberk Výukový materiál zpracovaný v rámci projektu EU Peníze SŠ Registrační číslo projektu: CZ.1.07/1.5.00/34.0130 Šablona: III/2 Ověřeno ve výuce dne: 7.6.2013
Střední škola obchodu, řemesel a služeb Žamberk Výukový materiál zpracovaný v rámci projektu EU Peníze SŠ Registrační číslo projektu: CZ.1.07/1.5.00/34.0130 Šablona: III/2 Ověřeno ve výuce dne: 7.6.2013
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 8. ročník Zpracovala: Mgr. Michaela Krůtová POZOROVÁNÍ, POKUS, BEZPEČNOST PRÁCE určí společné a rozdílné vlastnosti látek orientuje se v chemické laboratoři
Vzdělávací obsah vyučovacího předmětu Chemie 8. ročník Zpracovala: Mgr. Michaela Krůtová POZOROVÁNÍ, POKUS, BEZPEČNOST PRÁCE určí společné a rozdílné vlastnosti látek orientuje se v chemické laboratoři
2.10 Pomědění hřebíků. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.10 Pomědění hřebíků. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
2. Vlastnosti látek a chemické reakce 2.10 Pomědění hřebíků. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
DUM č. 2 v sadě. 24. Ch-2 Anorganická chemie
 projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
projekt GML Brno Docens DUM č. 2 v sadě 24. Ch-2 Anorganická chemie Autor: Aleš Mareček Datum: 26.09.2014 Ročník: 2A Anotace DUMu: Materiál je určen pro druhý ročník čtyřletého a šestý ročník víceletého
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Masarykova střední škola zemědělská a Vyšší odborná škola, Opava, příspěvková organizace
 Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_355_S-prvky a jejich sloučeniny Masarykova střední škola zemědělská a Vyšší odborná
Číslo projektu Číslo materiálu Název školy Autor Průřezové téma Tematický celek CZ.1.07/1.5.00/34.0565 VY_32_INOVACE_355_S-prvky a jejich sloučeniny Masarykova střední škola zemědělská a Vyšší odborná
VYPRACOVAT DO 22. 10. 2015
 Máte před sebou PRACOVNÍ LIST Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky: - pracovní list
Máte před sebou PRACOVNÍ LIST Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky: - pracovní list
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost.
 Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Tento materiál byl vytvořen v rámci projektu Operačního programu Vzdělávání pro konkurenceschopnost. Projekt MŠMT ČR Číslo projektu Název projektu školy Klíčová aktivita III/2 EU PENÍZE ŠKOLÁM CZ.1.07/1.4.00/21.2146
Přírodní zdroje uhlovodíků
 Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Alena Jirčáková Zemní plyn - vznik: Výskyt často spolu s ropou (naftový zemní plyn) nebo
Prvky 14. Skupiny (Tetrely)
 Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
Prvky 14. Skupiny (Tetrely) 19.1.2011 p 2 prvky C nekov Si, Ge polokov Sn, Pb kov ns 2 np 2 Na vytvoření kovalentních vazeb ve sloučeninách poskytují 2, nebo 4 elektrony Všechny prvky jsou pevné látky
CHEMIE SLOUŽÍ I OHROŽUJE
 CHEMIE SLOUŽÍ I OHROŽUJE autoři: Hana a Radovan Sloupovi 1. Ze tří cisteren unikly tři plyny - helium, amoniak a chlor. Napiš do obláčků správné značky nebo vzorce. Pomůže ti výstražné značení nebezpečnosti
CHEMIE SLOUŽÍ I OHROŽUJE autoři: Hana a Radovan Sloupovi 1. Ze tří cisteren unikly tři plyny - helium, amoniak a chlor. Napiš do obláčků správné značky nebo vzorce. Pomůže ti výstražné značení nebezpečnosti
VYPRACOVAT DO 23. 10. 2015
 Máte před sebou PRACOVNÍ LIST č. 1 Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky: - pracovní
Máte před sebou PRACOVNÍ LIST č. 1 Jestliže ho zpracujete, máte možnost získat známku, která má nejvyšší hodnotu v elektronické žákovské knížce. Ovšem je nezbytné splnit následující podmínky: - pracovní
Obsah Chemická reakce... 2 PL:
 Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
Obsah Chemická reakce... 2 PL: Vyčíslení chemické rovnice - řešení... 3 Tepelný průběh chemické reakce... 4 Rychlost chemických reakcí... 4 Rozdělení chemických reakcí... 4 1 Chemická reakce děj, při němž
III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT Inovace výuky na GSN prostřednictvím ICT
 Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: Datum: 23. 9. 2013 Cílová skupina: Klíčová slova: Anotace: III/2 - Inovace
Škola: Gymnázium, Brno, Slovanské náměstí 7 Šablona: Název projektu: Číslo projektu: Autor: Tematická oblast: Název DUMu: Kód: Datum: 23. 9. 2013 Cílová skupina: Klíčová slova: Anotace: III/2 - Inovace
rostlin a přesliček metrové sloje potřeba až třicetimetrová vrstva rašelin a přesliček vázaný uhlík, vodík, dusík a síru.
 VZNIK UHLÍ Uhlí vzniklo z pravěkých rostlin a přesliček v údolích, deltách řek a jiných nízko položených územích. Po odumření těchto rostlin klesaly až na dno bažin a za nepřístupu vzduchu jim nebylo umožněno
VZNIK UHLÍ Uhlí vzniklo z pravěkých rostlin a přesliček v údolích, deltách řek a jiných nízko položených územích. Po odumření těchto rostlin klesaly až na dno bažin a za nepřístupu vzduchu jim nebylo umožněno
Chemické děje a rovnice procvičování Smart Board
 Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
Chemické děje a rovnice procvičování Smart Board VY_52_INOVACE_216 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 9. Projekt EU peníze školám Operačního programu Vzdělávání pro konkurenceschopnost
9. ročník LMP NSP. 8. ročník LMP NSP. 10. ročník LMP SP. 7. ročník LMP NSP. Pozorování, pokus a bezpečnost práce. práce. práce
 Charakteristika vyučovacího předmětu Chemie ŠVP LMP Obsahové, časové a organizační vymezení vyučovacího předmětu Chemie Vyučovací předmět Chemie je tvořen z obsahu vzdělávacího oboru ze vzdělávací oblasti
Charakteristika vyučovacího předmětu Chemie ŠVP LMP Obsahové, časové a organizační vymezení vyučovacího předmětu Chemie Vyučovací předmět Chemie je tvořen z obsahu vzdělávacího oboru ze vzdělávací oblasti
TEORETICKÁ ČÁST (70 BODŮ)
 TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Válka mezi živly 7 bodů 1. Doplňte text: Sloučeniny obsahující kation draslíku (draselný) zbarvují plamen fialově. Dusičnan tohoto kationtu má vzorec KNO 3 a chemický
TEORETICKÁ ČÁST (70 BODŮ) Úloha 1 Válka mezi živly 7 bodů 1. Doplňte text: Sloučeniny obsahující kation draslíku (draselný) zbarvují plamen fialově. Dusičnan tohoto kationtu má vzorec KNO 3 a chemický
Vzduch II. znečištění vzduchu
 1 Vzduch II. znečištění vzduchu Kromě základních složek obsahuje vzduch i další látky, které způsobují např. jeho rozdílnou vůni nebo pach v různých místech Některé z těchto látek jsou příjemné (voňavý
1 Vzduch II. znečištění vzduchu Kromě základních složek obsahuje vzduch i další látky, které způsobují např. jeho rozdílnou vůni nebo pach v různých místech Některé z těchto látek jsou příjemné (voňavý
Digitální učební materiály III/ 2- Inovace a zkvalitnění výuky prostřednictvím ICT. VY_32_INOVACE_129_Sloučeniny Na+Ca_ prac_ list
 Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
Název školy Číslo projektu STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28. října 2707, příspěvková organizace CZ.1.07/1.5.00/34.0880 Název projektu Klíčová aktivita Digitální učební materiály
PRŮMYSLOVÁ HNOJIVA PESTICIDY
 PRŮMYSLOVÁ HNOJIVA PESTICIDY Rostliny potřebují ke svému růstu a vývoji řadu prvků Nezbytné prvky jsou: C N P K Ca Mg S Fe Stopové prvky, součástí rostlinných enzymů: B Zn Cu Co Mn Mo Hnojiva Směsi pro
PRŮMYSLOVÁ HNOJIVA PESTICIDY Rostliny potřebují ke svému růstu a vývoji řadu prvků Nezbytné prvky jsou: C N P K Ca Mg S Fe Stopové prvky, součástí rostlinných enzymů: B Zn Cu Co Mn Mo Hnojiva Směsi pro
OPAKOVÁNÍ VĚDNÍ OBORY, NEŽIVÁ PŘÍRODA
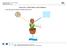 1. POPIŠ OBRÁZEK ZNÁZORŇUJÍCÍ PRŮBĚH FOTOSYNTÉZY. OPAKOVÁNÍ VĚDNÍ OBORY, NEŽIVÁ PŘÍRODA 1 2. POPIŠ SLOŽENÍ SOUČASNÉ ATMOSFÉRY (uveď, který z plynů v současné atmosféře je znázorněn modrou, žlutou a černou
1. POPIŠ OBRÁZEK ZNÁZORŇUJÍCÍ PRŮBĚH FOTOSYNTÉZY. OPAKOVÁNÍ VĚDNÍ OBORY, NEŽIVÁ PŘÍRODA 1 2. POPIŠ SLOŽENÍ SOUČASNÉ ATMOSFÉRY (uveď, který z plynů v současné atmosféře je znázorněn modrou, žlutou a černou
www.zlinskedumy.cz Inovace výuky prostřednictvím šablon pro SŠ
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Tematický okruh Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Stupeň a typ vzdělávání Vzdělávací oblast Vzdělávací obor Tematický okruh Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748
CZ.1.07/1.5.00/ Digitální učební materiály III/ 2- Inovace a zkvalitnění výuky prostřednictvím ICT
 Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28.
Název školy: Číslo a název projektu: Číslo a název šablony klíčové aktivity: Označení materiálu: Typ materiálu: Předmět, ročník, obor: STŘEDNÍ ODBORNÁ ŠKOLA a STŘEDNÍ ODBORNÉ UČILIŠTĚ, Česká Lípa, 28.
