*Vyrobeno rekombinantní technologií DNA v buněčné řadě vaječníku čínského křečka.
|
|
|
- Jan Dvořák
- před 7 lety
- Počet zobrazení:
Transkript
1 1. NÁZEV PŘÍPRAVKU Silapo 1000 IU/0,3 ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 předplněná injekční stříkačka s 0,3 ml injekčního roztoku obsahuje 1000 mezinárodních jednotek (International Units, IU) epoetinum zeta* (rekombinantního lidského erytropoetinu). Roztok obsahuje 3333 IU epoetinu zeta v 1 ml. *Vyrobeno rekombinantní technologií DNA v buněčné řadě vaječníku čínského křečka. Pomocná látka: Jedna předplněná injekční stříkačka obsahuje 0,15 mg fenylalaninu. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injekční roztok v předplněné injekční stříkačce. Čirý, bezbarvý roztok. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Léčba symptomatické anémie spojené s chronickým renálním selháním (CHRS) u dospělých a dětských pacientů: o Léčba anémie spojené s chronickým renálním selháním u dospělých a dětských pacientů na hemodialýze a dospělých pacientů na peritoneální dialýze (viz bod 4.4). o Léčba závažné anémie ledvinového původu doprovázené klinickými příznaky u dospělých pacientů s ledvinovou nedostatečností, kteří ještě nedocházejí na dialýzu (viz bod 4.4). Léčba anémie a snížení nutnosti transfúze u dospělých pacientů podstupujících chemoterapii pro solidní nádory, maligní lymfom nebo mnohočetný myelom, a s rizikem nutnosti podání transfúze z důvodu posouzení celkového zdravotního stavu pacienta (např. kardiovaskulární stav, chudokrevnost existující již před začátkem chemoterapie). Silapo lze použít ke zvýšení dostupnosti autologní krve u pacientů v dárcovském programu. Jeho použití v této indikaci musí být v rovnováze s rizikem tromboembolických příhod. Léčba by se měla podávat pouze pacientům s mírnou anémií (bez nedostatku železa), pokud postupy pro konzervování krve nejsou dostupné nebo účinné nebo pokud plánovaný zvolený velký chirurgický zákrok vyžaduje velký objem krve (4 a více jednotek pro ženy nebo 5 a více jednotek pro muže). 4.2 Dávkování a způsob podání Léčbu přípravkem Silapo je třeba zahájit pod dohledem lékaře, který má zkušenosti s vedením pacientů s výše uvedenými indikacemi. Dávkování - Léčba symptomatické anémie u dospělých a dětských pacientů s chronickým renálním selháním: 2
2 Silapo by měl být podáván buď subkutánně nebo intravenózně. Cílová koncentrace hemoglobinu je 10 až 12 g/dl (6,2-7,5 mmol/l), s výjimkou pediatrických pacientů, u nichž by koncentrace hemoglobinu měla být 9,5 až 11 g/dl (5,9-6,8 mmol/l). Horní mez cílové koncentrace hemoglobinu by neměla být překročena. Příznaky anémie a důsledky se mohou lišit v závislosti na věku, pohlaví a celkové zátěži chorobou. Lékařovo hodnocení individuálního klinického průběhu a stavu pacienta je nezbytné. Přípravek Silapo by měl být podáván buď subkutánně nebo intravenózně za účelem zvýšení hladiny hemoglobinu ne více, než na 12 g/dl (7,5 mmol/l). Vzhledem k variabilitě u pacienta je možné občas pozorovat jednotlivé hladiny hemoglobinu vyšší a nižší, než je požadovaná hladina hemoglobinu. Variabilita hemoglobinu by měla být řízena dávkou s ohledem na cílové rozmezí hemoglobinu 10 g/dl (6,2 mmol/l) až 12 g/dl (7,5 mmol/l). Je třeba se vyhnout dlouhodobé hladině hemoglobinu vyšší než 12 g/dl. Postup, pro vhodnou úpravu dávky pro případ, když je pozorována hladina hemoglobinu vyšší než 12 g/dl (7,5 mmol/l), je popsán níže. Je třeba zabránit zvýšení hladiny hemoglobinu více než 2 g/dl (1,25 mmol/l) v průběhu čtyř týdnů. Pokud k tomu dojde, je třeba provést odpovídající úpravu dávky tak, jak je popsáno. Pacienti by měli být důkladně monitorováni, aby se zajistilo, že nejnižší schválená dávka připravku Silapo je použita pro zajištění adekvátní kontroly příznaků anémie. U pacientů s chronickým renálním selháním a klinicky prokázanou ischemickou chorobou srdeční nebo městnavým srdečním selháním by při udržování koncentrace hemoglobinu neměl být překročen horní limit cílové koncentrace hemoglobinu. Dospělí pacienti na hemodialýze Silapo by měl být podáván buď subkutánně nebo intravenózně. Léčba je rozdělena do dvou etap: 1. Korekční fáze: 50 IU/kg 3krát týdně. Je-li nutné dávku upravit, měla by se tato úprava provádět postupně po dobu alespoň čtyř týdnů. V jednotlivých krocích této úpravy by se dávka měla zvyšovat nebo snižovat o 25 IU/kg 3krát týdně. 2. Udržovací fáze: Úprava dávky za účelem udržení hodnot hemoglobinu (Hb) na požadované úrovni: Hb od 10 do 12 g/dl (6,2-7,5 mmol/l). Celková doporučená týdenní dávka je 75 až 300 IU/kg. Podle dostupných klinických údajů může být u pacientů s velice nízkou počáteční hodnotou hemoglobinu (< 6 g/dl nebo < 3,75 mmol/l) nutné použít vyšších udržovacích dávek než u pacientů, jejichž počáteční anémie je méně závažná (Hb > 8 g/dl nebo > 5 mmol/l). Dětští pacienti na hemodialýze Léčba je rozdělena do dvou etap: 1. Korekční fáze: 50 IU/kg 3krát týdně intravenózně. Je-li nutné dávku upravit, měla by se tato úprava provádět postupně v krocích o 25 IU/kg 3krát týdně v intervalech alespoň 4 týdnů, dokud nebude dosaženo požadovaného cíle. 2. Udržovací fáze: Úprava dávky za účelem udržení hodnot hemoglobinu (Hb) na požadované úrovni: Hb od 9,5 do 11 g/dl (5,9-6,8 mmol/l). Děti s tělesnou váhou do 30 kg vyžadují obvykle vyšší údržovací dávky než děti s tělesnou váhou vyšší než 30 kg a dospělí. Následující udržovací dávky byly například zaznamenány v klinických studiích po 6 měsících léčby. 3
3 Dávka (IU/kg 3krát týdně) Hmotnost (kg) Střední hodnota Obvyklá udržovací dávka < > Podle dostupných klinických údajů může být u pacientů s velice nízkou počáteční hodnotou hemoglobinu (< 6,8 g/dl nebo < 4,25 mmol/l) nutné použít vyšších udržovacích dávek než u pacientů, jejichž počáteční hodnota hemoglobinu je vyšší (Hb > 6,8 g/dl nebo > 4,25 mmol/l). Dospělí pacienti na peritoneální dialýze Silapoby měl být podáván buď subkutánně nebo intravenózně. Léčba je rozdělena do dvou etap: 1. Korekční fáze: Počáteční dávka 50 IU/kg 2krát týdně. 2. Udržovací fáze: Úprava dávky za účelem udržení hodnot hemoglobinu (Hb) na požadované úrovni: (Hb od 10 do 12 g/dl (6,2-7,5 mmol/l).udržovací dávka od 25 do 50 IU/kg 2krát týdně ve 2 stejných dávkách. Dospělí pacienti s renální insuficiencí, ale dosud bez dialýzy Silapo by měl být podáván buď subkutánně nebo intravenózně. Léčba je rozdělena do dvou etap: 1. Korekční fáze: Počáteční dávka 50 IU/k 3krát týdně; poté v případě potřeby zvýšení dávky po o 25 IU/kg (3krát týdně), dokud nebude dosaženo požadovaného cíle (nutno provádět postupně po dobu alespoň čtyř týdnů). 2. Udržovací fáze: Úprava dávky za účelem udržení hodnot hemoglobinu (Hb) na požadované úrovni: Hb od 10 do 12 g/dl (6,2-7,5 mmol/l). Udržovací dávka od 17 do 33 IU/kg 3krát týdně. Maximální dávka by neměla překročit 200 IU/kg 3krát týdně. Léčba pacientů s anémií indukovanou chemoterapií Přípravek Silapo by se měl podávat subkutánně pacientům s anémií (např. koncentrace hemoglovinu 10 g/dl (6,2 mmol/l). Příznaky anémie a důsledky se mohou lišit v závislosti na věku, pohláví a celkové zátěži chorobou. Lékařovo hodnocení individuálního klinického průběhu pacienta a stavu je nezbytné. Vzhledem k variabilitě u pacienta je možné občas pozorovat jednotlivé hladiny hemoglobinu vyšší a nižší, než je požadovaná hladina hemoglobinu Variabilita hemoglobinu by měla být řízena dávkou s ohledem na cílové rozmezí hemoglobinu 10 g/dl (6,2 mmol/l) až 12 g/dl (7,5 mmol/l). Je třeba se vyhnout dlouhodobé hladině hemoglobinu vyšší než 12 g/dl (7,5 mmol/l). Postup, pro vhodnou úpravu dávky pro případ, když je pozorována hladina hemoglobinu vyšší než 12 g/dl (7,5 mmol/l), je popsán níže. Pacienti by měli být důkladně monitorováni, aby se zajistilo, že nejnižší schválená dávka připravku Silapo je použita pro zajištění adekvátní kontroly příznaků anémie. 4
4 Léčba přípravkem Silapo by měla pokračovat až do uplynutí jednoho měsíce po skončení chemoterapie. Počáteční dávka je 150 IU/kg podávaná subkutánně 3krát týdně. Alternativně lze přípravek Silapo podávat s počáteční dávkou 450 IU/kg subkutánně jednou týdně. Zvýšil-li se hemoglobin alespoň o 1 g/dl (0,62 mmol/l) nebo se počet retikulocytů zvýšil o buněk/µl nad referenční hodnotu po 4 týdnech léčby, měla by dávka zůstat na 150 IU/kg 3krát týdně nebo 450 IU/kg jednou týdně. Zvýšil-li se hemoglobin alespoň o <1 g/dl (0,62 mmol/l) a počet retikulocytů se zvýšil o < buněk/µl nad referenční hodnotu, zvyšte dávku na 300 IU/kg 3krát týdně. Pokud se po dalších 4 týdnech léčby dávkou 300 IU/kg 3krát týdně zvýšil hemoglobin o 1 g/dl (0,62 mmol/l) nebo se počet retikulocytů zvýšil o buněk/µl, měla by dávka zůstat na úrovni 300 IU/kg 3krát týdně. Pokud se ale hemoglobin zvýšil o <1 g/dl (0,62 mmol/l) a počet retikulocytů se zvýšil o < buněk/µl nad referenční hodnotu, je reakce nepravděpodobná a léčba by se měla přerušit. Doporučený režim dávkování je popsán v následujícím diagramu: 150 IU/kg 3x/týden Nebo 450 IU/kg jednou týdně po 4 týdny Zvýšení počtu retikulocytů o /μl nebo zvýšení koncentrace Hb o 1 g/d Zvýšení počtu retikulocytů o < /μl a zvýšení koncentrace Hb o < 1 g/dl Cílová koncentrace Hb (10-12 g/dl) 300 IU/kg 3x/týden Po 4 týdny Zvýšení počtu retikulocytů o /μl nebo zvýšení koncentrace Hb o 1 g/dl Zvýšení počtu retikulocytů o < /μl a zvýšení koncentrace Hb o < 1 g/dl Přerušte terapii Jakmile bylo dosaženo terapeutického cíle pro jednotlivého pacienta, dávka by měla být snížena o 25 až 50%, aby byla tato hladina hemoglobinu udržena. Příslušné titrování dávky je třeba zvážit. 5
5 Úprava dávky Je-li rychlost nárůstu hemoglobinu > 2 g/dl (> 1,25 mmol/l) za měsíc, měla by se dávka přípravku Silapo snížit o 25-50%. Překročí-li hladina hemoglobinu překročí 12 g/dl (7,5 mmol/l), přerušte léčbu, dokud hladina neklesne na 12 g/dl (7,5 mmol/l) nebo nižší a poté léčbu přípravkem Silapo opět obnovte s dávkou o 25% nižší, než byla předchozí dávka. Dospělí pacienti podstupující chirurgický zákrok v programu autologního dárcovství Přípravek Silapo by se měl podávat intravenózně. Během celého období, kdy se daruje krev, by se měl přípravek Silapo podat vždy po skončení procedury darování krve. Mírně anemičtí pacienti (hematokrit 33-39%), u kterých je nutné předzásobení 4 jednotkami krve, by měli být léčeni přípravkem Silapo podávaným v dávce 600 IU/kg tělesné hmotnosti 2krát týdně po dobu 3 týdnů před chirurgickým zákrokem. Všem pacientům léčeným přípravkem Silapo by se mělo podávat odpovídající množství doplňkového železa (např. 200 mg elementárního železa perorálně jednou denně) po celou dobu léčby. Doplňování železa by mělo začít co nejdříve, i několik týdnů před zahájením autologního předzásobení, aby se před zahájením léčby přípravkem Silapo dosáhlo vysoké hladiny železa. Způsob podání Pro instrukce o zacházení s léčivým přípravkem před podáním, viz bod 6.6. a) Intravenózní injekce Dávka by se měla podávat alespoň po dobu 1-5 minut, v závislosti na celkové dávce. U pacientů na hemodialýze lze podat bolusovou injekci během samotné dialýzy přes vhodný žilní vstup vedení pro dialýzu. Alternativně lze injekci podat na konci samotné dialýzy přes trubičku s jehlou zavedenou do píštěle; poté by mělo následovat 10 ml injekčního roztoku chloridu sodného 9 mg/ml (0,9%) k vypláchnutí trubičky a zajištění uspokojivého zavedení léčivého přípravku do krevního oběhu. U pacientů, kteří reagují na léčbu chřipce podobnými příznaky, je lepší provádět aplikaci pomaleji. Přípravek Silapo by se neměl podávat intravenózní infuzí. Přípravek Silapo nesmí být mísen s žádnými dalšími léčivými přípravky (viz bod 6.2). b) Subkutánní injekce Obecně by se v jednom místě vpichu neměl překročit maximální objem 1 ml. V případě větších objemů by se pro injekci mělo zvolit více než jedno místo. Injekce se podávají do končetin nebo přední břišní stěny. 4.3 Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Pacientům, u nichž se po léčbě jakýmkoli erytropoetinem rozvine čistá aplázie červené krevní řady (PRCA), se Silapo ani žádný jiný erytropoetin nesmí podávat (viz bod 4.4). Nekontrolovaná hypertenze U indikace zvýšení dostupnosti autologní krve : infarkt myokardu nebo mrtvice v průběhu měsíce, který předchází léčbu, nestabilní angína pectoris, zvýšené riziko vzniku hluboké žilní trombózy, jako např. žilní tromboembolická choroba v anamnéze. Pacienti, kterým není možno z jakéhokoli důvodu podávat adekvátní antitrombotickou profylaxi. 4.4 Zvláštní upozornění a opatření pro použití 6
6 Obecné informace Při léčbě přípravkem Silapo může stejně jako u všech pacientů užívajících erytropoetin dojít ke zvýšení krevního tlaku. Krevní tlak je třeba bedlivě sledovat a odpovídajícím způsobem upravovat u všech pacientů, kteří ještě nemají zkušenosti s léčbou epoetinem, a to před zahájením léčby přípravkem Silapo, na jejím začátku i v jejím průběhu. Může vzniknout potřeba zintenzívnit či posílit léčbu zvýšeného krevního tlaku. Nelze-li krevní tlak dostat pod kontrolu, měla by se léčba přípravkem Silapo přerušit. Přípravek Silapo by se měl používat s opatrností také v případě epilepsie nebo chronického jaterního selhání. Během léčby erytropoetinem může dojít k mírnému nárůstu počtu krevních destiček v běžném rozsahu, který bude závislý na podané dávce. V průběhu kontinuální léčby se počet krevních destiček opět vrátí do normálu. Během prvních 8 týdnů léčby se doporučuje počet krevních destiček pravidelně sledovat. Před zahájením léčby přípravkem Silapo a v jejím průběhu je třeba vzít v úvahu také veškeré další příčiny anémie (nedostatek železa, hemolýzu, ztrátu krve, nedostatek vitamínu B 12 nebo folátů) a léčit je. Ve většině případů poklesnou hodnoty feritinu v séru souběžně s nárůstem objemu červených krvinek oddělených od plazmy. Aby byla zajištěna optimální odpověď na erytropoetin, je třeba zajistit adekvátně vysokou hladinu železa: u pacientů s chronickým renálním selháním, jejichž hladina feritinu v séru je nižší než 100 ng/ml, se doporučuje doplňování železa, např mg/denně perorálně ( mg/denně u dětských pacientů); u všech pacientů trpících rakovinou, jejichž saturace transferinu je nižší než 20%, se doporučuje perorální substituce železa mg/denně. Všechny tyto doplňkové faktory anémie by se měly pečlivě zvážit také při rozhodování o zvýšení dávky erytropoetinu u pacientů trpících rakovinou. Paradoxní snížení hemoglobinu a vznik závažné anémie doprovázený nízkým počtem retikulocytů by mělo být důvodem k okamžitému přerušení léčby erytropoetinem a provedení testů na přítomnost erytropoetinových protilátek. Tyto případy byly hlášeny u pacientů s hepatitidou C při současném užívání epoetinů s interferonem a ribavirinem. Epoetiny nejsou schváleny v léčbě anémie doprovázené žloutenkou typu C. Aby se zvýšila vystopovatelnost přípravků stimulujících tvorbu epoetinů (ESA), mělo by být jméno předepsaného přípravku stimulujícího tvorbu epoetinu (ESA) zřetelně zaznamenáno (uvedeno) v pacientově složce. Během přípravy pacienta před samotným chirurgickým zákrokem by se měla vždy dodržovat správná praxe nakládání s krví. Tento léčivý přípravek obsahuje fenylalanin, který může být škodlivý pro osoby s fenylketonurií. Tento léčebný přípravek obsahuje méně než 1 mmol sodíku (23 mg) na dávku, tzn. že je v podstatě bez sodíku. Pacienti s chronickým renálním selháním Koncentrace hemoglobinu U pacientů s chronickým renálním selháním by neměla udržovací koncentrace hemoglobinu překročit horní mez cílové koncentrace hemoglobinu, která je doporučena v bodě 4.2. V klinických studiích bylo pozorováno zvýšení rizika úmrtí, závažných kardiovaskulárních příhod nebo cerebrovaskulárních příhod včetně mrtvice při podávání ESA pro zajištění cílové hladiny hemoglobinu vyšší než 12 g/dl (7,5 mmol/l). 7
7 Kontrolované klinické studie neprokázaly významnější přínos, který by souvisel s podáváním erytropoetinů, pokud je koncentrace hemoglobinu zvýšena nad hladinu, která je nutná pro kontrolu příznaků anémie a pro předejítí krevní tranfúze. Hladina hemoglobinu by se měla pravidelně měřit, dokud nebude dosaženo stabilní úrovně, a v pravidelných intervalech i poté. Rychlost nárůstu hemoglobinu by měla být přibližně 1 g/dl (0,62 mmol/l) za měsíc a neměla by překročit 2 g/dl (1,25 mmol/l) za měsíc,, aby se minimalizovalo riziko vzniku či zhoršení hypertenze. Pacienti s chronickám selháním ledvin léčení přípravkem Silapo podávaným subkutánně by měli být pravidelně sledování, aby se zjistil pokles účinnosti, který se projeví jako chybějící nebo snížená odpověď na léčbu Silapem u pacientů, kteří dříve na tuto terapii reagovali. Toto je charakterizováno trvalým poklesem hemoglobinu i přes zvýšení dávky Silapa. Žádná odpověď na léčbu erytropoetinem by měla vést k urychlenému hledání příčinných faktorů. Jedná se např. o nedostatek železa, folátů nebo vitamínu B 12, intoxikaci hliníkem, přidružené infekce, zánětlivé nebo traumatické příhody, skrytou ztrátu krve, hemolýzu a fibrózu kostní dřeně jakéhokoli původu. Případy PRCA způsobené neutralizujícími protilátkami byly u pacientů trpících chronickým renálním selháním, kterým byl erytropoetin podáván subkutánně, hlášeny velice zřídka. U pacientů s náhlým vznikem nedostatečné účinnosti, která se definuje jako pokles hemoglobinu (1-2 g/dl za měsíc) se zvýšenou nutností transfúze, je třeba stanovit počet retikulocytů a zjistit charakteristické příčiny takové nedostatečné odpovědi (např. nedostatek železa, folátu, vitaminu B 12, intoxikace hliníkem, infekce nebo zánět, ztráta krve a hemolýza). Nepodaří-li se identifikovat žádnou příčinu, je třeba pro potřeby diagnózy PRCA zvážit vyšetření kostní dřeně. V případě diagnózy PRCA je třeba léčbu přípravkem Silapo okamžitě přerušit a zvážit provedení testů na protilátky proti erytropoetinu. Pacienti by neměli přecházet na jiný léčivý přípravek, protože protilátky proti erytropoetinu reagují zkříženě s jiným erytropoetiny. Je třeba vyloučit další příčiny čisté aplázie červené krevní řady a nasadit odpovídající léčbu. Doporučuje se pravidelně sledovat počet retikulocytů za účelem zjištění možného výskytu nedostatečné účinnosti u pacientů s chronickým renálním selháním. V ojedinělých případech byly pozorována hyperkalémie. U pacientů s chronickým renálním selháním může korekce anémie vést ke zvýšené chuti k jídlu a příjmu draslíku a proteinů. Je možné, že bude nutné pravidelně upravovat předepsanou dialýzu, aby se močovina, kreatinin a draslík udržely v požadovaném rozsahu. U pacientů s chronickým renálním selháním by se měly sledovat elektrolyty v séru. V případě zjištění zvýšené (nebo zvyšující se) hladiny draslíku v séru je třeba zvážit ukončení podávání erytropoetinu, dokud nedojde k nápravě hyperkalémie. V průběhu léčby erytropoetinem je během hemodialýzy často nutné zvýšit v důsledku nárůstu objemu červených krvinek oddělených od plazmy dávku heparinu. Není-li heparinizace optimální, je možná okluze dialyzačního systému. Na základě aktuálně dostupných informací nezvyšuje korekce anémie pomocí erytropoetinu u dospělých pacientů s renální nedostatečností, kteří ještě nedocházejí na dialýzu, rychlost progrese renální nedostatečnosti. Dospělí pacienti trpící rakovinou a symptomatickou anémií, kteří podstupují chemoterapii U pacientů trpících rakovinou, kteří podstupují chemoterapii, by se při posuzování vhodnosti léčby přípravkem Silapo (pacient je vystaven riziku nutnosti podání transfúze) mělo vzít v potaz 2-3 týdenní prodlení mezi podáním erytropoetinu a výskytem červených krvinek vyvolaných erytropoetinem. 8
8 Hladina hemoglobinu by se měla bedlivě sledovat, dokud nebude dosaženo stabilní úrovně, a v pravidelných intervalech i poté. Překročí-li rychlost nárůstu hemoglobinu 2 g/dl (1,25 mmol/l) za měsíc nebo pokud hladina hemoglobinu překročí 12 g/dl (7,5 mmol/l), je třeba pečlivě upravit dávku popsanou v bodu 4.2, aby se minimalizovalo riziko trombotických příhod (viz bod 4.2). Jelikož byl u pacientů trpících rakovinou, kterým se podávají erytropoetické přípravky (viz bod 4.8), pozorován zvýšený výskyt trombotických cévních příhod, je třeba toto riziko pečlivě zvážit v porovnání s prospěchem, který může léčba (pomocí přípravku Silapo) přinést, zvláště u pacientů trpících rakovinou se zvýšeným rizikem trombotických cévních příhod, jako např. obezitou, a u pacientů s trombotickými cévními příhodami v anamnéze (např. hlubokou žilní trombózou nebo plicní embolií). Dospělí pacienti podstupující chirurgický zákrok, kteří se účastní autologního dárcovského programu Je třeba dodržovat veškerá zvláštní varování a upozornění související s autologním dárcovským programem, zvláště rutinní náhradou objemu. Potenciál pro růst nádoru Erytropoetiny jsou růstové faktory, které stimulují hlavně produkci červených krvinek. Receptory pro erytropoetin byly také nalezeny na povrchu některých nádorových buněk. Podobně jako u jiných růstových faktorů existuje obava, že by erytropoetiny mohly stimulovat růst jakéhokoliv typu malignity. Několik kontrolovaných studiích neprokázalo, že by erytropoetiny zvyšovaly celkové přežití nebo snižovaly riziko progrese nádoru u pacientů s anémií související s rakovinou. Několik kontrolovaných klinických studií, ve kterých byly erytropoetiny podávány pacientům trpícím různými druhy běžně se vyskytujících nádorů, včetně dlaždicobuněčného karcinomu hlavy a krku, karcinomu plic a karcinomu prsu, prokázaly nevysvětlitelnou nadměrnou mortalitu. V kontrolovaných klinických studiích ukázalo použití Epoetinu alfa a jiných látek stimulujících erytropoézu (ESA) toto: zkrácení času do progrese tumoru u pacientů s pokročilým karcinomem hlavy a krku, kteří podstupovali radioterapii, když byly podávány pro dosažení hladiny hemoglobinu vyšší než 14 g/dl (8,7 mmol/l), zkrácení celkového přežití a zvýšení mortality související s progresí choroby ve 4. měsíci u pacientů s metastatickým karcinomem prsu, kteří dostávali chemoterapii, pokud byly podávány pro dosažení hladiny hemoglobinu g/dl (7,5-8,7 mmol/l), zvýšení rizika úmrtí při podávání k dosažení hladiny hemoglobinu 12 g/dl (7,5 mmol/l) u pacientů s aktivní malignitou bez chemoterapie nebo radioterapie. ESA nejsou indikovány pro použití u této populace pacientů. Vzhledem k výše uvedenému by měla být krevní transfúze v určitých klinických situacích preferovanou léčbu pro anémii u pacientů s rakovinou. Rozhodnutí o podání rekombinantních erytropoetinů by mělo vycházet ze zhodnocení poměru přínosu a rizika s účastí jednotlivého pacienta, které by mělo vzít v úvahu specifický klinický kontext. Faktory, které by měly být při tomto hodnocení zváženy, by měly zahrnovat typ nádoru a jeho stádium, stupeň anémie, očekávanou délku života, prostředí, v němž je pacient léčen a preference pacienta (viz bod 5.1). 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Neexistují žádné důkazy o tom, že by léčba erytropoetinem měnila metabolismus jiných léčivých přípravků. 9
9 Jelikož ale červené krvinky váží cyklosporin, existuje potenciál pro interakce s jinými léčivými přípravky. V případě současného podávání erytropoetinu s cyklosporinem je třeba sledovat hladinu cyklosporinu v krvi a v případě, že dojde k nárůstu hematokritu, je třeba dávku cyklosporinu upravit. Nejsou známy žádné důkazy, že dochází k interakci mezi epoetinem alfa a G-CSF nebo GM-CSF pokud jde o hematologickou diferenciaci nebo proliferaci bioptického vzorku nádoru in vitro. 4.6 Fertilita, těhotenství a kojení Nebyly provedeny adekvátní a dostatečně kontrolované studie u těhotných žen. Studie na zvířatech ukázaly reprodukční toxicitu (viz bod 5.3). Proto by se erytropoetin měl v těhotenství a během kojení obecně používat pouze v případě, kdy jeho potenciální prospěch převáží potenciální riziko, které hrozí plodu. 4.7 Účinky na schopnost řídit a obsluhovat stroje Silapo nemá žádný nebo zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. 4.8 Nežádoucí účinky Silapo je biologický léčivý přípravek. Údaje z klinických studií přípravku Silapo jsou v souladu s bezpečnostním profilem jiných registrovaných erytropoetinů. Na základě výsledků klinických studií s jinými registrovanými erytropoetiny se přibližně u 8% pacientů léčených erytropoetinem projeví nejspíše nežádoucí účinky. Nežádoucí účinky během léčby erytropoetinem byly zaznamenány hlavně u pacientů s chronickým renálním selháním nebo malignitami, přičemž se nejčastěji jedná o bolest hlavy a zvýšení krevního tlaku v závislosti na dávce. Může se vyvinout hypertenzní krize s příznaky podobnými encefalopatii. Je třeba sledovat vznik náhlé a bodavé migrenózní bolesti hlavy jako možného varovného signálu. U pacientů užívajících přípravky podporující erytropoezu, byly hlášeny trombotické a cévní příhody, například ischemie myokardu, infarkt myokardu, mozkové krvácení a mozkový infarkt, přechodná ischemická ataka, hluboká žilní trombóza, arteriální trombóza, plicní embolie, aneurysma, trombóza sítnice a srážení krve v umělé ledvině. Protilátkami zprostředkovaná erytroblastopenie (PRCA) byla hlášena po léčbě epoetinem alfa prováděné po dobu několika měsíců až let. U většiny z těchto pacientů byly zjištěny protilátky proti erythropoetinu (viz body 4.3 a 4.4). V tomto bodě je frekvence výskytu nežádoucích účinků definována následovně: Velmi časté (>1/10); časté (>1/100 až <1/10); méně časté (>1/1,000 až <1/100); vzácné (>1/10,000 až <1/1,000); velmi vzácné (<1/10,000), není známo (četnost výskytu nelze z dostupných dat určit). Třída orgánových systémů Poruchy krve a lymfatického systému Frekvence Nežádoucí účinek Velmi vzácné Thrombocytóza (viz bod 4.4) Četnost není známa Erythroblastopenie způsobená protilátkou (PRCA) Poruchy imunitního systému vzácné Velmi vzácné Hypersenzitivní reakce Anafylaktické reakce 10
10 Závratě (pacienti s chonickým Velmi časté selháním ledvin) Bolest hlavy (pacienti s karcinomem) Poruchy nervového sytému Závratě (pacienti s karcinomem) časté Bolest hlavy (pacienti s chonickým selháním ledvin) mrtvice Méně časté Ccerebrální krvácení cerebrální infarkt Četnost není známa Přechodné ischemické záchvaty Hypertenzní encefalopatie Poruchy oka Četnost není známa Sítnicová thrombóza Srdeční poruchy Četnost není známa Infarkt myokardu Ischemie myokardu Cévní poruchy Respirační, hrudní a mediastinální poruchy Poruchy kůže a podkožní tkáně Poruchy svalové a kosterní soustavy a pojivové tkáně Celkové poruchy a reakce v místě aplikace Poranění, otravy a procedurální komplikace časté Četnost není známa časté Četnost není známa časté Velmi vzácné Četnost není známa Velmi časté časté Velmi časté časté časté Hluboká žilní tromboza (pacienti s karcinomem) Zvýšení krevního tlaku Aneuryzma Arteriální trombóza Hluboká žilní tromboza (pacienti s chronickým selháním ledvin) Hypertenzní krize Plicní embolie (pacienti s karcinomem) Plicní embolie (pacienti s chronickým selháním ledvin) Nespecifikované kožní vyrážky angioedem svědění Bolest kloubů (pacienti s chronickým selháním ledvin) Bolest kloubů (pacienti s karcinomem) Příznaky podobné chřipce (pacienti s chronickým selháním ledvin) Pocit slabosti (pacienti s chronickým selháním ledvin) Únava (pacienti s chronickým selháním ledvin) Příznaky podobné chřipce (pacienti s karcinomem) Pocit slabosti (patienti s karcinomem) únava (patienti s karcinomem) Ucpávání umělé ledviny 11
11 Hemodialyzovaní dospělí a pediatričtí pacienti, peritoneálně dialyzovaní dospělí, a dosud nedialyzovaní dospělí pacienti s renální insuficiencí: Nejčastější nežádoucí reakce při léčbě epoetinem alfa je zvýšení krevního tlaku či zhoršení stávající hypertenze úměrné podané dávce. Toto zvýšení krevního tlaku lze léčit jinými léčivými přípravky. Mimoto se doporučuje monitorování krevního tlaku především na počátku terapie. V ojedinělých případech se u pacientů s normálním nebo nízkým krevním tlakem objevily také tyto reakce: hypertenzní krize s příznaky podobnými encefalopatii (například bolestmi hlavy a zmateností) a generalizované tonickoklonické křeče, vyžadující okamžitý zásah lékaře a intenzivní lékařskou péči. Zvláštní pozornost je třeba věnovat náhlým bodavým migrenózním bolestem hlavy jako možnému varovnému signálu. Může dojít k trombóze arteriovenózní spojky, zejména u pacientů s tendencí k hypotenzi nebo s komplikacemi na arteriovenózních shuntech (například stenózy, výdutě atd.). U těchto pacientů doporučujeme časnou revizi shuntu a jako prevenci trombózy například podávání kyseliny acetylsalicylové. Dospělí pacienti s nádorovým onemocněním a symptomatickou anémií léčení chemoterapií U pacientů léčených epoetinem alfa se může vyvinout hypertenze. Proto je třeba pečlivě monitorovat koncentraci hemoglobinu a krevní tlak. U pacientů, kteří užívali přípravky podporující erytropoezu, byl zjištěn zvýšený výskyt trombotických cévních příhod (viz bod 4.4 a bod 4.8 Celkové poruchy). Pacienti podstupující chirurgický zákrok v programech autologního dárcovství Bez ohledu na léčbu erytropoetinem může u pacientů podstupujících chirurgický zákrok, kteří v důsledku opakované flebotomie trpí některým z kardiovaskulárních onemocnění, dojít k trombotickým a vaskulárním příhodám. Proto by se u takových pacientů měla provádě t rutinní náhrada objemu. 4.9 Předávkování Terapeutická rezerva erytropoetinu je velice široká. Předávkování erytropoetinem může vyvolat účinky, které budou nástavbou farmakologických účinků hormonu. Bude-li hladina hemoglobinu příliš vysoká, je možné provést flebotomii. V případě potřeby je nutné poskytnout dodatečnou podpůrnou péči. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: antianemické přípravky, erytropoetin ATC kód: B03XA01 Silapo je bilogicky podobný přípravek. Detailní informace jsou dostupné na stránkách Evropské lékové agentury Erytropoetin je glykoprotein, který stimuluje, jako mitotický stimulační faktor a diferenciační hormon, tvorbu erytrocytů z prekurzorů v prostoru kmenových buněk. Zdánlivá molekulová hmotnost erytropoetinu je daltonů. Bílkovinná část molekuly přispívá asi z 58% k celkové molekulární hmotnosti a skládá se ze 165 aminokyselin. Čtyři 12
12 uhlohydrátové řetězce jsou s bílkovinou spojeny třemi N-glykosidickými vazbami a jednou O-glykosidickou vazbou. Aminokyselinová sekvence a uhlohydrátové složení epoetinu zeta je identické jako u endogenního lidského erytropoetinu, který byl izolován z moči anemických pacientů. Biologická účinnost erytropoetinu byly prokázána na několika zvířecích modelech in vivo (normální a anemičtí potkani, polycytemické myši). Po podání erytropoetinu se počet erytrocytů, hodnoty Hb a počet retikulocytů zvýší, a stejně tak poroste i rychlost inkorporace 59 Fe. Zvýšená rychlost inkorporace 3 H thymidinu do erytroidních nukleotidních buněk sleziny byla zjištěna in vitro (buněčná kultura myší sleziny) po inkubaci s erytropoetinem. Pomocí buněčných kultur buněk lidské kostní dřeně by bylo možné ukázat, že erytropoetin stimuluje specificky erytropoézu a neovlivňuje leukopoézu. Cytotoxické působení erytropoetinu na buňky kostní dřeně se nepodařilo zjistit. Stejně jako u jiných hematopoetických růstových faktorů prokázal erytropoetin stimulační vlastnosti in vitro na endoteliálních lidských buňkách. 721 pacientů trpících rakovinou a podstupujících ne-platinovou chemoterapii byly zařazeno do tří studií kontrolovaných placebem, 389 pacientů s hematologickými malignitami (221 s mnohočetným myelomem, 144 s ne-hodgkinovým lymfomem a 24 s dalšími hematologickými malignitami) a 332 se solidními nádory (172 s nádorem prsu, 64 s gynekologickým nádorem, 23 s nádorem plic, 22 s nádorem prostaty, 21 s gastrointestinálním nádorem a 30 s jinými typy nádoru). Do dvou velkých otevřených studií bylo zařazeno 2697 pacientů trpících rakovinou a podstupujících ne-platinovou chemoterapii, 1895 se solidními nádory (683 s nádorem prsu, 260 s nádorem plic, 174 s gynekologickým nádorem, 300 s gastrointestinálním nádorem a 478 s jinými typy nádoru) a 802 s hematologickými malignitami. Prospektivní, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie prováděná s 375 anemickými pacienty s různými nemyeloidními malignitami a podstupujícími ne-platinovou chemoterapii ukázala výrazné snížení následků souvisejících s anemií (např. únava, menší energie, snížení aktivity), měřeno s použitím následujících nástrojů a stupnic: všeobecná stupnice funkčního hodnocení léčby rakoviny-anemie (Functional Assessment of Cancer Therapy-Anaemia - FACT-An), stupnice únavy FACT-An a lineární analogová stupnice rakoviny (Cancer Linear Analogue Scale - CLAS). Dvě menší randomizované, placebem kontrolované studie neukázaly výrazné zlepšení parametrů kvality života na stupnici EORTC-QLQ-C30 ani na stupnici CLAS. Erytropoetin je růstový faktor, který primárně stimuluje produkci červených krvinek. Receptory erytropoetinu se mohou objevit na povrchu různých nádorových buněk. Přežití a progrese nádoru byly zkoumány v pěti velkých kontrolovaných studiích, které zahrnovaly celkem 2833 pacientů, z nichž čtyři byly dvojitě zaslepené placebem kontrolované studie a jedna byla otevřená studie. Studie nabíraly buď pacienty, kteří byli léčeni chemoterapií (dvě studie) nebo používaly populace pacientů, u nichž nebyly indikovány látky stimulující erytropoézu: anémie u pacientů s karcinomem bez chemoterapie a pacientů s karcinomem hlavy a krku, kteří dostávali chemoterapii. Cílová koncentrace hemoglobinu ve dvou studiích byla > 13 g/dl. Ve zbývajících třech studiích byla g/dl. V otevřené; studii nebyl rozdíl v celkovém přežití mezi pacienty, kteří byli léčeni rekombinantním lidským erytropoetinem a kontrolami. Ve čtyřech studiích kontrolovaných placebem se pohyboval poměr rizika pro celkové přežití mezi 1,25 a 2,47 ve prospěch kontrol. Tyto studie ukázaly konzistentní nevysvětlený statisticky významný nárůst mortality u pacientů, kteří měli anémii spojenou s různými běžnými typy rakoviny, kteří dostávali rekombinantní lidský erytropoetin, ve srovnání s kontrolami. Celkové přežití ve studiích nebylo možné uspokojivě vysvětlit rozdílem v incidenci trombózy a souvisejících komplikací u těch, kteří dostávali rekombinantní lidský erytropoetin a těch v kontrolní skupině. 13
13 Byla provedena také systematická analýza zahrnující více než 9000 pacientů s karcinomem účastnících se na 57 klinických studiích. Metaanalýza údajů o celkovém přežití poskytla bodový odhad poměru rizika 1,08 ve prospěch kontrol (95 % interval spolehlivosti: 0,99, 1,18; 42 studií a 8167 pacientů). Zvýšené relativní riziko trombembolické příhody (RR 1,67, 95% interval spolehlivosti: 1,35, 2,06, 35 studií a 6769 pacientů) bylo pozorováno u pacientů léčených rekombinantním lidským erytropoetinem. Existuje zvýšené riziko trombembolické příhody u pacientů s karcinomem léčených rekombinantním lidským erytropoetinem a negativní vliv na celkové přežití není možné vyloučit. Rozsah v jakém by tyto výsledky mohly platit pro podávání rekombinantního lidského erytropoetinu pacientům s karcinomem, kteří jsou léčeni chemoterapií, pro dosažení koncentrací hemoglobinu menších než 13 g/dl, je nejasný, protože do analyzovaných dat bylo zařazeno pouze málo pacientů s těmito charakteristikami. Analýzy dat byly provedeny na více než pacientech léčených na rakovinu (chemo-, radio-, chemoradio- nebo bez terapie), kteří se účastnili 53 kontrolovaných studií zahrnujících různé epoetiny. Metaanalýza údajů o celkovém přežití poskytla bodový odhad poměru rizika 1,06 ve prospěch kontrol (95% interval spolehlivosti: 1,00; 1,12; 53 studií a pacientů), u pacientů léčených chemoterapií byl tento celkový poměr rizika přežití 1,04 (95% CI: 0,97; 1,11; 38 studií a pacientů). Metaanalýzy také indikovaly konzistentně a významně zvýšení relativního rizika případů tromboembolie u pacientů s rakovinou užívajících rekombinantní lidský erytropoetin (viz bod.4.4). V randomizované, dvojitě zaslepené, placebem kontrolované studii se zařazenými pacienty, kteří nebyli dialyzováni s diabetem typu 2 a hladinou hemoglobinu 11 g/dl, pacienty kteří byli léčeni buď darbepoetinem alfa k dosažení cílové hladiny hemoglobinu 13 g/dl nebo placebem /viz bod 4.4). Studie neprokázala snížení rizika všech případů úmrtnosti, kardiovaskulární úmrtnosti nebo konečné fáze renálního onemocnění (ESRD). Analýza jednotlivých případů ukázala následující HR (95% CI): úmrtí 1,05 (0,92, 1,21), mrtvice 1,92 (1,38, 2,68), městnavé srdeční selhání (CHF) 0,89 (0,74, 1,08), infarkt myokardu (MI) 0,96 (0,75, 1,23), hospitalizaci kvůli ischémii myokardu 0,84 (0,55, 1,27), ESRD 1,02 (0,87, 1,18). 5.2 Farmakokinetické vlastnosti Intravenózní podání Měřením erytropoetinu po intravenózním podání několikanásobné dávky odhalilo poločas rozpadu přibližně 4 hodin u zdravých jedinců a o něco delší poločas rozpadu (přibližně 5 hodin) u pacientů s renálním selháním. U dětí byl zaznamenán poločas rozpadu přibližně 6 hodin. Subkutánní podání Po subkutánní injekci jsou hladiny erytropoetinu v séru mnohem nižší než hladiny, kterých se dosáhne po intravenózní injekci. Tyto hladiny se zvyšují pomalu a nejvyšší úrovně dosáhnou mezi 12 a 18 hodinami po podání dávky. Nejvyšší úroveň je vždy výrazně pod úrovní, které se dosáhne při intravenózním podání (přibližně 1/20 hodnoty). Nedochází k žádné akumulaci: hladiny zůstávají stejné, ať se měří 24 hodin po první injekci nebo 24 hodin po poslední injekci. V případě podkožního podání se poločas rozpadu obtížně stanovuje, ale odhaduje se na 24 hodin. Biodostupnost erytropoetinu podávaného subkutánní injekcí je mnohem nižší než u intravenózně podávaného léčivého přípravku: přibližně 20%. 5.3 Předklinické údaje vztahující se k bezpečnosti přípravku V některých předklinických toxikologických studiích na psech a potkanech, ne však na opicích, byla léčba erytropoetinem spojována se subklinickou fibrózou kostní dřeně (fibróza kostní dřeně je známá komplikace chronického renálního selhání u lidí a může mít souvislost se sekundárním 14
14 hyperparatyroidismem nebo neznámými faktory. Výskyt fibrózy kostní dřeně ve studii pacientů na hemodialýze, kteří byli léčeni erytropoetinem po dobu 3 let, nebyl ve srovnání s odpovídající kontrolní skupinou pacientů na dialýze, kteří nebyli léčeni erytropoetinem, zvýšený). Studie na zvířatech ukázaly, že erytropoetin snižuje tělesnou hmotnost plodu, zpožďuje osifikaci a zvyšuje úmrtnost plodu, je-li podáván v týdenních dávkách přibližně 20 krát vyšších, než je doporučená týdenní dávka pro člověka. Tyto změny se ale ve srovnání s poklesem tělesné hmotnosti matky považují za vedlejší. Erytropoetin nevykázal žádné změny ve zkouškách mutagenity buněčných kultur bakterií a savců ani u in vivo zkoušek na mikrojádra u myší. Dlouhodobé studie kancerogenity nebyly provedeny. V odborné literatuře lze nalézt rozporuplná tvrzení ohledně skutečnosti, zda může erytropoetin hrát významnější roli při podpoře nádorového bujení. Tato tvrzení jsou založena na zjištěních in vitro ze vzorků lidských nádorů, ale jejich důležitost v klinické praxi je nejistá. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Dihydrát dihydrogenfosforečnanu sodného Dihydrát hydrogenfosforečnan sodného Chlorid sodný Chlorid vápenatý dihydrát Polysorbát 20 Glycin Leucin Izoleucin Treonin Kyselina glutamová Fenylalanin Voda na injekce Hydroxid sodný (k úpravě ph) Kyselina chlorovodíková (k úpravě ph) 6.2 Inkompatibility Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky. 6.3 Doba použitelnosti 30 měsíců 6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 C 8 C). Chraňte před mrazem. Předplněnou injekční stříkačku uchovávejte ve vnějším obalu, aby byl přípravek chráněn před světlem. Pro usnadnění ambulantního použití může pacient vyjmout přípravek z chladničky a uchovávat jej jednorázově po dobu maximálně 3 dnů při pokojové teplotě (maximálně do 25 C). 6.5 Druh obalu a velikost balení Předplněná injekční stříkačka (sklo typu I) s připevněnou ocelovou injekční jehlou a pryžovým uzávěrem potaženým polytetrafluoretylenem (PTFE). 15
15 Jedna předplněná injekční stříkačka obsahuje 0,3 ml injekčního roztoku. Jedno balení obsahuje 1 nebo 6 předplněných injekčních stříkaček. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Návod k zacházení s přípravkem Silapo: 1. Vyjměte jednu injekční stříkačku z blistru a zkontrolujte, zda je v ní obsažený roztok čirý, bezbarvý, a nejsou v něm prakticky žádné viditelné částice. 2. Odstraňte z jehly injekční stříkačky ochranné víčko, podržte injekční stříkačku ve svislé poloze a zlehka stiskněte píst směrem nahoru, čímž z injekční stříkačky a jehly vytlačíte vzduch. 3. Injekční stříkačka je nyní připravená k použití. Přípravku Silapo se nesmí použít v případě, že přebal blistru je porušen nebo je blistr jakkoli poškozen; tekutina je zabarvená nebo jsou v ní vidět vznášející se částice; z předplněné injekční stříkačky došlo k úniku jakéhokoli množství tekutiny nebo je uvnitř uzavřeného blistru patrná kondenzace; mohlo dojít k jeho náhodnému zmrznutí. Tento léčivý přípravek je pouze pro jednorázové použití. Přípravkem netřepat. Všechen nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI STADA Arzneimittel AG Stadastrasse 2-18 D Bad Vilbel Německo 8. REGISTRAČNÍ ČÍSLO(A) EU/1/07/432/001 EU/1/07/432/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE 18/12/ DATUM REVIZE TEXTU 16
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku
 Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Předplněné injekční stříkačky o objemu 0,5 ml obsahují 20 000 IU (168,0 mikrogramů) epoetinu alfa
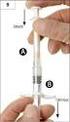 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1 ml) * produkovaný v ovariálních
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EPREX 40 000 IU/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Epoetinum alfa *..40 000 IU (336,0 mikrogramů v 1 ml) * produkovaný v ovariálních
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml
 Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
Příbalová informace. GlaxoSmithKline Biologicals S.A., Rue de l Institut 89, 1330 Rixensart, Belgie
 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující adjuvans MF59C.1 (Sezóna 2013/2014)
 sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
S O UH R N Ú D AJ Ů O P ŘÍPR AVK U
 sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aranesp 10 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp 15 mikrogramů injekční roztok v předplněné injekční stříkačce. Aranesp
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
www.printo.it/pediatric-rheumatology/cz/intro
 www.printo.it/pediatric-rheumatology/cz/intro Behcetova nemoc Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se BN diagnostikuje? Diagnóza se stanovuje hlavně na základě klinických projevů, její potvrzení splněním
www.printo.it/pediatric-rheumatology/cz/intro Behcetova nemoc Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se BN diagnostikuje? Diagnóza se stanovuje hlavně na základě klinických projevů, její potvrzení splněním
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 0,5 mg/ml perorální suspenze pro kočky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
HYPERTENZE VYSOKÝ KREVNÍ TLAK
 HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)
![Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)](/thumbs/33/16328748.jpg) 1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
Psi: Snížení mortality a klinických příznaků parvovirózy (enterické formy) psů od 1 měsíce věku.
 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
3. LÉKOVÁ FORMA Prášek pro perorální roztok MOVICOL je sypký bílý prášek s charakteristickou limetkovou a citronovou příchutí.
 sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Použití homeopatického léčivého přípravku v uvedených terapeutických indikacích je založeno výhradně na homeopatických zkušenostech.
 sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy
 PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
Co byste měli vědět o přípravku
 Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE. Aminoplasmal Hepa - 10% infuzní roztok
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Amizolmet 500 mg/ml injekční roztok. Metamizolum natricum monohydricum
 Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Žvýkací tableta Bílé, kulaté, bikonvexní nepotahované tablety o průměru 16 mm, které mohou mít malé skvrny.
 Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011
 Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
Merck Santé, 2, rue du Pressoir Vert, 45400 Semoy, Francie Merck, SL, Poligono Merck, 08100 Mollet Del Valles (Barcelona), Španělsko Složení
 U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
SOUHRN ÚDAJŮ O PŘĺPRAVKU
 sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
9 METODICKÉ POKYNY AD HOC MODUL 2010: Sladění pracovního a rodinného života
 9 METODICKÉ POKYNY AD HOC MODUL 2010: Sladění pracovního a rodinného života Ad hoc modul 2010 bude šetřen na 1. vlně (resp. podle čtvrtletí zařazení sčítacího obvodu) v domácnosti ve všech čtvrtletích
9 METODICKÉ POKYNY AD HOC MODUL 2010: Sladění pracovního a rodinného života Ad hoc modul 2010 bude šetřen na 1. vlně (resp. podle čtvrtletí zařazení sčítacího obvodu) v domácnosti ve všech čtvrtletích
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Trachisan 8 mg proti bolesti v krku, pastilky. Lidocaini hydrochloridum monohydricum
 Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
Zadávací dokumentace k veřejné zakázce dle zákona č. 137/2006 Sb., o veřejných zakázkách (dále jen zákon )
 FAKULTNÍ NEMOCNICE BRNO Jihlavská 20, 625 00 Brno tel: 532 231 111 ŘEDITELSTVÍ ředitel FN Brno: MUDr. Roman Kraus, MBA tel.: 532 232 000, fax: 543 211 185 e-mail: rkraus@fnbrno.cz IČO: 652 697 05, DIČ:
FAKULTNÍ NEMOCNICE BRNO Jihlavská 20, 625 00 Brno tel: 532 231 111 ŘEDITELSTVÍ ředitel FN Brno: MUDr. Roman Kraus, MBA tel.: 532 232 000, fax: 543 211 185 e-mail: rkraus@fnbrno.cz IČO: 652 697 05, DIČ:
Zkušenosti z klinického hodnocení účinnosti s použitím desloratadinu u mladistvých ve věku 12 až 17 let jsou omezené (viz.bod 4.8 a 5.1).
 1. NÁZEV PŘÍPRAVKU Azomyr 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA
1. NÁZEV PŘÍPRAVKU Azomyr 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. FLECTOR EP GEL gel (diclofenacum epolaminum)
 sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLABRILUX 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jeden ml přípravku Glabrilux 0,3
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLABRILUX 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jeden ml přípravku Glabrilux 0,3
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls187311/2014 a sp.zn.sukls124014/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gelaspan 4%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: Gelatina succinata
Sp.zn.sukls187311/2014 a sp.zn.sukls124014/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gelaspan 4%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: Gelatina succinata
sp.zn. sukls106749/2014
 sp.zn. sukls106749/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Thioctacid 600 HR Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná tableta obsahuje: acidum thiocticum (kyselina
sp.zn. sukls106749/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Thioctacid 600 HR Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná tableta obsahuje: acidum thiocticum (kyselina
SOUHRN ÚDAJU O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
Příloha č. 1 ke sdělení sp. zn. sukls37758/2013, sukls37776/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 ke sdělení sp. zn. sukls37758/2013, sukls37776/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Ebrantil i.v. 25 Ebrantil i.v. 50 Injekční roztok 2. Kvalitativní a kvantitativní složení Ebrantil
Příloha č. 1 ke sdělení sp. zn. sukls37758/2013, sukls37776/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Ebrantil i.v. 25 Ebrantil i.v. 50 Injekční roztok 2. Kvalitativní a kvantitativní složení Ebrantil
DIABETES MELLITUS. Diabetes dělíme na diabetes mellitus 1. typu a 2. typu, pro každý typ je charakteristická jiná příčina vzniku a jiná léčba.
 DIABETES MELLITUS Diabetes mellitus je dnes jedním z nejzávažnějších onemocnění hromadného výskytu. Diabetiků v celém světě významně přibývá. Dnes dosahuje výskyt diabetu v České republice kolem 7 %, pravděpodobně
DIABETES MELLITUS Diabetes mellitus je dnes jedním z nejzávažnějších onemocnění hromadného výskytu. Diabetiků v celém světě významně přibývá. Dnes dosahuje výskyt diabetu v České republice kolem 7 %, pravděpodobně
Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg.
 1. NÁZEV PŘÍPRAVKU Aerius 5 mg perorální lyofilizát 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg. Úplný seznam pomocných látek
1. NÁZEV PŘÍPRAVKU Aerius 5 mg perorální lyofilizát 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg. Úplný seznam pomocných látek
Příbalová informace: informace pro uživatele. Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa)
 Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Akutní stavy Ztráty vody a iont byly hrazeny infúzemi glukózy nebo pitím vody. Vznikající hypoosmolalita ECT vedla k p esunu ásti vody z ECT do ICT.
 Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls1508897/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin Krka 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5
sp.zn.sukls1508897/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin Krka 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
Tento léčivý přípravek obsahuje méně než 1 mmol sodíku (23 mg) na injekci, je tedy v podstatě bezsodíkový.
 1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
EVROPSKÝ PARLAMENT 2014-2019. Výbor pro životní prostředí, veřejné zdraví a bezpečnost potravin NÁVRH STANOVISKA
 EVROPSKÝ PARLAMENT 2014-2019 Výbor pro životní prostředí, veřejné zdraví a bezpečnost potravin 4. 3. 2015 2014/0255(COD) NÁVRH STANOVISKA Výboru pro životní prostředí, veřejné zdraví a bezpečnost potravin
EVROPSKÝ PARLAMENT 2014-2019 Výbor pro životní prostředí, veřejné zdraví a bezpečnost potravin 4. 3. 2015 2014/0255(COD) NÁVRH STANOVISKA Výboru pro životní prostředí, veřejné zdraví a bezpečnost potravin
Žvýkací tablety Bílé, kulaté, bikonvexní nepotažené žvýkací tablety, které mohou mít světle žluté skvrny.
 sp.zn.sukls55165/2015; sukls229256/2015, sukls223777/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D3 500 mg/ 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
sp.zn.sukls55165/2015; sukls229256/2015, sukls223777/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D3 500 mg/ 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
Příbalová informace: informace pro uživatele. PAMBA tablety (acidum aminomethylbenzoicum)
 sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Clotrimazol AL 200 vaginální tablety clotrimazolum
 sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Tab. 1. Výskyt rizikových faktorů TEN ve sledovaném souboru.
 Úprava algoritmu prevence žilního tromboembolizmu. Úpravu algoritmu prevence žilního tromboembolizmu (TEN) jsme provedli na základě klinických zkušeností a nových dat z literatury. Prospektivně jsme sledovali
Úprava algoritmu prevence žilního tromboembolizmu. Úpravu algoritmu prevence žilního tromboembolizmu (TEN) jsme provedli na základě klinických zkušeností a nových dat z literatury. Prospektivně jsme sledovali
Návrh. VYHLÁŠKA ze dne...2006 o zdravotnické dokumentaci. Rozsah údajů zaznamenávaných do zdravotnické dokumentace
 Návrh VYHLÁŠKA ze dne...2006 o zdravotnické dokumentaci Ministerstvo zdravotnictví stanoví podle 117 odst. 5 zákona č..../2006 Sb., o zdravotní péči: Rozsah údajů zaznamenávaných do zdravotnické dokumentace
Návrh VYHLÁŠKA ze dne...2006 o zdravotnické dokumentaci Ministerstvo zdravotnictví stanoví podle 117 odst. 5 zákona č..../2006 Sb., o zdravotní péči: Rozsah údajů zaznamenávaných do zdravotnické dokumentace
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 tableta s řízeným uvolňováním obsahuje ferrosi sulfas sesquihydricus 256,3 mg (což odpovídá 80 mg železa).
 sp.zn. sukls224193/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TARDYFERON Tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta s řízeným uvolňováním obsahuje ferrosi sulfas
sp.zn. sukls224193/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TARDYFERON Tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta s řízeným uvolňováním obsahuje ferrosi sulfas
PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI
 PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 41 PŘIPRAVOVANÉ ZMĚNY, KTERÉ BUDOU DOPLNĚNY DO PŘÍSLUŠNÝCH ČÁSTÍ SOUHRNU ÚDAJŮ O PŘÍPRAVKU PRO PŘÍPRAVKY OBSAHUJÍCÍ KABERGOLIN 4.2
PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 41 PŘIPRAVOVANÉ ZMĚNY, KTERÉ BUDOU DOPLNĚNY DO PŘÍSLUŠNÝCH ČÁSTÍ SOUHRNU ÚDAJŮ O PŘÍPRAVKU PRO PŘÍPRAVKY OBSAHUJÍCÍ KABERGOLIN 4.2
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 Pregnyl 5 000 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného prášku pro přípravu injekčního roztoku a rozpouštědla
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 Pregnyl 5 000 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného prášku pro přípravu injekčního roztoku a rozpouštědla
Karcinom prsu (zhoubný nádor prsu)
 Karcinom prsu (zhoubný nádor prsu) Autor: Lenka Gallusová, Školitel: MUDr. Karel Ćwiertka, Ph.D. Onkologická klinika LF UP a FNOL Výskyt Karcinom prsu je po karcinomech kůže druhým nejčastějším zhoubným
Karcinom prsu (zhoubný nádor prsu) Autor: Lenka Gallusová, Školitel: MUDr. Karel Ćwiertka, Ph.D. Onkologická klinika LF UP a FNOL Výskyt Karcinom prsu je po karcinomech kůže druhým nejčastějším zhoubným
Příloha č. 3 VÝKONOVÉ UKAZATELE
 Příloha č. 3 VÝKONOVÉ UKAZATELE OBSAH 0. ÚVODNÍ USTANOVENÍ... 3 0.1. Vymezení obsahu přílohy... 3 0.2. Způsob vedení evidencí... 3 0.3. Hodnocené období... 4 1. VÝKONOVÉ UKAZATELE ODPADNÍ VODA... 5 1.1.
Příloha č. 3 VÝKONOVÉ UKAZATELE OBSAH 0. ÚVODNÍ USTANOVENÍ... 3 0.1. Vymezení obsahu přílohy... 3 0.2. Způsob vedení evidencí... 3 0.3. Hodnocené období... 4 1. VÝKONOVÉ UKAZATELE ODPADNÍ VODA... 5 1.1.
TĚHOTENSKÉ TESTY. gynekologické vyšetření (hmatatelné změny v pochvě i děloze) imunologické těhotenské testy (provedené s pomocí moči či krve)
 TĚHOTENSKÉ TESTY Téma těhotenských testů vysvětluje princip stanovení gravidity v domácím prostředí. Podává informace k jednotlivým druhům těhotenských testů, jejich citlivosti, včetně popisu návodu pro
TĚHOTENSKÉ TESTY Téma těhotenských testů vysvětluje princip stanovení gravidity v domácím prostředí. Podává informace k jednotlivým druhům těhotenských testů, jejich citlivosti, včetně popisu návodu pro
Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná).
 1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
Revmatická horečka a post-streptokoková reaktivní artritida
 www.printo.it/pediatric-rheumatology/cz/intro Revmatická horečka a post-streptokoková reaktivní artritida Verze č 2016 2. DIAGNOSA A TERAPIE 2.1 Jak se revmatická horečka diagnostikuje? Žádný konkrétní
www.printo.it/pediatric-rheumatology/cz/intro Revmatická horečka a post-streptokoková reaktivní artritida Verze č 2016 2. DIAGNOSA A TERAPIE 2.1 Jak se revmatická horečka diagnostikuje? Žádný konkrétní
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humatrope 18IU (6 mg), prášek pro přípravu injekčního roztoku s rozpouštědlem Humatrope 36IU (12 mg), prášek pro přípravu injekčního roztoku s rozpouštědlem
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Humatrope 18IU (6 mg), prášek pro přípravu injekčního roztoku s rozpouštědlem Humatrope 36IU (12 mg), prášek pro přípravu injekčního roztoku s rozpouštědlem
Zadávací dokumentace k veřejné zakázce dle zákona č. 137/2006 Sb., o veřejných zakázkách (dále jen zákon )
 FAKULTNÍ NEMOCNICE BRNO Jihlavská 20, 625 00 Brno tel: 532 231 111 ŘEDITELSTVÍ ředitel FN Brno: MUDr. Roman Kraus, MBA tel.: 532 232 000, fax: 543 211 185 e-mail: rkraus@fnbrno.cz IČO: 652 697 05, DIČ:
FAKULTNÍ NEMOCNICE BRNO Jihlavská 20, 625 00 Brno tel: 532 231 111 ŘEDITELSTVÍ ředitel FN Brno: MUDr. Roman Kraus, MBA tel.: 532 232 000, fax: 543 211 185 e-mail: rkraus@fnbrno.cz IČO: 652 697 05, DIČ:
Obsah. 1. Nastartujte svůj den 11. 2. Polévky a předkrmy 21. 3. Lehké svačiny a obědy 33. 4. Hlavní chod 47. 5. Přílohy 91. 6. Moučníky a dezerty 101
 ÚVOD 3 Obsah Úvod 4 1. Nastartujte svůj den 11 2. Polévky a předkrmy 21 3. Lehké svačiny a obědy 33 4. Hlavní chod 47 5. Přílohy 91 6. Moučníky a dezerty 101 7. Domácí pečivo 113 Seznam receptů a jejich
ÚVOD 3 Obsah Úvod 4 1. Nastartujte svůj den 11 2. Polévky a předkrmy 21 3. Lehké svačiny a obědy 33 4. Hlavní chod 47 5. Přílohy 91 6. Moučníky a dezerty 101 7. Domácí pečivo 113 Seznam receptů a jejich
A/California/7/2009 (H1N1)pdm09, použitá varianta A/Brisbane/10/2010, divoký typ
 1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Návazné opatření týkající se aplikačního nástroje pro sternální implantát ZipFix : Změny v návodu k chirurgické technice
 UPOZORNĚNÍ pro: vedoucího operačního sálu 20. června 2014 Naléhavé: Bezpečnostní upozornění pro terén FSN20149997 Návazné opatření týkající se aplikačního nástroje pro sternální implantát ZipFix : Změny
UPOZORNĚNÍ pro: vedoucího operačního sálu 20. června 2014 Naléhavé: Bezpečnostní upozornění pro terén FSN20149997 Návazné opatření týkající se aplikačního nástroje pro sternální implantát ZipFix : Změny
sp. zn. sukls82959/2013
 sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
Vojenská nemocnice Olomouc Sušilovo nám. 5, 779 00 Olomouc Tel.: 973 201 111, fax: 585 222 486, e mail: vnol@vnol.cz. Spirometrie
 Spirometrie Spirometrie je funkční vyšetření plic, které má důležitou úlohu v diferenciální diagnostice plicních onemocnění. Spirometrie je indikována především u přetrvávajícího kašle, dušnosti nebo u
Spirometrie Spirometrie je funkční vyšetření plic, které má důležitou úlohu v diferenciální diagnostice plicních onemocnění. Spirometrie je indikována především u přetrvávajícího kašle, dušnosti nebo u
Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum
 sp.zn.sukls55165/2015 sukls229256/2015, sukls223777/2015 Příbalová informace: informace pro uživatele Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum Přečtěte si pozorně tuto příbalovou
sp.zn.sukls55165/2015 sukls229256/2015, sukls223777/2015 Příbalová informace: informace pro uživatele Calcichew D3 500 mg/ 200 IU žvýkací tablety calcium, colecalciferolum Přečtěte si pozorně tuto příbalovou
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková
 Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Krevní plazma organické a anorganické součásti, význam minerálů a bílkovin krevní plazmy. Somatologie Mgr. Naděžda Procházková Krevní plazma definice: Tekutá složka krve Nažloutlá, vazká tekutina Složení
Návod k použití pro Hydraulický zvedák
 Návod k použití pro Hydraulický zvedák Katalogové číslo: 229062 Přístroj Vysoce kvalitní hydraulický válec, velká nožní deska ze speciální litiny pro větší stabilitu, volně pohyblivá sklopná zdvihací páka,
Návod k použití pro Hydraulický zvedák Katalogové číslo: 229062 Přístroj Vysoce kvalitní hydraulický válec, velká nožní deska ze speciální litiny pro větší stabilitu, volně pohyblivá sklopná zdvihací páka,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
OK Omega-3 Complete. o A 90 % DDD o D 3 100% DDD o E 40% DDD o Q10 má 60 mg
 OK Omega-3 Complete posiluje činnost srdce - kardiovaskulární systém, je více zaměřená na srdce než Gama a Omega snižuje hladinu cholesterolu i když dokáže plně nahradit léky, nemá vedlejší účinky a nevzniká
OK Omega-3 Complete posiluje činnost srdce - kardiovaskulární systém, je více zaměřená na srdce než Gama a Omega snižuje hladinu cholesterolu i když dokáže plně nahradit léky, nemá vedlejší účinky a nevzniká
Oxid uhelnatý: základní informace
 Oxid uhelnatý: základní informace LIFEPAK 15, jehož uvedení na trh Physio-Control připravuje, bude mimo jiné umožňovat neinvazivní diagnostiku SpCO. Čím může být významná dostupnost rychlé, neinvazivní
Oxid uhelnatý: základní informace LIFEPAK 15, jehož uvedení na trh Physio-Control připravuje, bude mimo jiné umožňovat neinvazivní diagnostiku SpCO. Čím může být významná dostupnost rychlé, neinvazivní
Příbalová informace: informace pro uživatele. Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum
 Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls73280/2013
 sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Faktory ovlivňující zdravotní stav Anamnéza, anebo problémy s možným dopadem na zdravotní péči
 Svazek 1 Tabelární seznam nemocí KAPITOLA XXI Faktory ovlivňující zdravotní stav a kontakt se zdravotnickými službami (Z00 Z99) Faktory ovlivňující zdravotní stav Anamnéza, anebo problémy s možným dopadem
Svazek 1 Tabelární seznam nemocí KAPITOLA XXI Faktory ovlivňující zdravotní stav a kontakt se zdravotnickými službami (Z00 Z99) Faktory ovlivňující zdravotní stav Anamnéza, anebo problémy s možným dopadem
Databáze invazivních vstupů jako zdroj dat pro účinnou kontrolu infekcí
 NÁZEV PROJEKTU: Databáze invazivních vstupů jako zdroj dat pro účinnou kontrolu infekcí Projekt do soutěže Bezpečná nemocnice na téma: Co můžeme udělat (děláme) pro zdravotníky, aby mohli poskytovat bezpečnou
NÁZEV PROJEKTU: Databáze invazivních vstupů jako zdroj dat pro účinnou kontrolu infekcí Projekt do soutěže Bezpečná nemocnice na téma: Co můžeme udělat (děláme) pro zdravotníky, aby mohli poskytovat bezpečnou
VÝZVA K PODÁNÍ NABÍDKY
 VÝZVA K PODÁNÍ NABÍDKY Výzva k podání nabídky a prokázání kvalifikace pro veřejnou zakázku: KOUTEX 2014 (recyklace textilního odpadu) - zadávanou jako zakázku malého rozsahu nespadající pod aplikaci zákona
VÝZVA K PODÁNÍ NABÍDKY Výzva k podání nabídky a prokázání kvalifikace pro veřejnou zakázku: KOUTEX 2014 (recyklace textilního odpadu) - zadávanou jako zakázku malého rozsahu nespadající pod aplikaci zákona
VYR-32 POKYNY PRO SPRÁVNOU VÝROBNÍ PRAXI - DOPLNĚK 6
 VYR-32 POKYNY PRO SPRÁVNOU VÝROBNÍ PRAXI - DOPLNĚK 6 Platnost od 1.1.2004 VÝROBA PLYNŮ PRO MEDICINÁLNÍ ÚČELY VYDÁNÍ PROSINEC 2003 1. Zásady Tento doplněk se zabývá průmyslovou výrobou medicinálních plynů,
VYR-32 POKYNY PRO SPRÁVNOU VÝROBNÍ PRAXI - DOPLNĚK 6 Platnost od 1.1.2004 VÝROBA PLYNŮ PRO MEDICINÁLNÍ ÚČELY VYDÁNÍ PROSINEC 2003 1. Zásady Tento doplněk se zabývá průmyslovou výrobou medicinálních plynů,
Clotrimazol AL 1% krém (clotrimazolum)
 sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 sp.zn. sukls90531/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Sandoz 60 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje orlistatum 60 mg. Úplný seznam
sp.zn. sukls90531/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Sandoz 60 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje orlistatum 60 mg. Úplný seznam
PŘÍBALOVÝ LETÁK. ZAP TM Troponin I Test
 PŘÍBALOVÝ LETÁK ZAP TM Troponin I Test Výrobek č. 8002 Jen pro In-vitro diagnostiku ZAMÝŠLENÉ VYUŽITÍ Test ZAP TM Troponin I je imunochromatografický test využívaný ke kvalitativní detekci lidského srdečního
PŘÍBALOVÝ LETÁK ZAP TM Troponin I Test Výrobek č. 8002 Jen pro In-vitro diagnostiku ZAMÝŠLENÉ VYUŽITÍ Test ZAP TM Troponin I je imunochromatografický test využívaný ke kvalitativní detekci lidského srdečního
Příloha I. Seznam názvů, lékové formy, sil léčivých přípravků, cesty podání a žadatele v členských státech
 Příloha I Seznam názvů, lékové formy, sil léčivých přípravků, cesty a žadatele v členských státech Členský stát EU/EEA Rakousko Rakousko Žadatel (Smyšlený) název Generics 20mg Pulver und Lösungsmittel
Příloha I Seznam názvů, lékové formy, sil léčivých přípravků, cesty a žadatele v členských státech Členský stát EU/EEA Rakousko Rakousko Žadatel (Smyšlený) název Generics 20mg Pulver und Lösungsmittel
Pravidla poskytování pečovatelské služby (PS) (pro zájemce a uživatele PS)
 Město Šenov Radniční náměstí 300, 739 34 Šenov pečovatelská služba I. Kontakty: Pravidla poskytování pečovatelské služby (PS) (pro zájemce a uživatele PS) MěÚ Šenov, správní odbor, Radniční náměstí 300,
Město Šenov Radniční náměstí 300, 739 34 Šenov pečovatelská služba I. Kontakty: Pravidla poskytování pečovatelské služby (PS) (pro zájemce a uživatele PS) MěÚ Šenov, správní odbor, Radniční náměstí 300,
Bezpečnost a účinnost bimatoprostu u dětí ve věku 0 až 18 let zatím nebyla stanovena.
 Sp. zn. Sukls202727/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimatoprost STADA 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg.
Sp. zn. Sukls202727/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimatoprost STADA 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg.
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK X UŽÍVAT
 VZOROVÁ PŘÍBALOVÁ INFORMACE PRO PŘÍPRAVKY HORMONÁLNÍ SUBSTITUČNÍ LÉČBY (založená na CORE SPC HRT revize 3, prosinec 2009) Ref. č. dokumentu: CMDh/240/2011, Rev0 červenec 2011 Obecné poznámky: Příbalový
VZOROVÁ PŘÍBALOVÁ INFORMACE PRO PŘÍPRAVKY HORMONÁLNÍ SUBSTITUČNÍ LÉČBY (založená na CORE SPC HRT revize 3, prosinec 2009) Ref. č. dokumentu: CMDh/240/2011, Rev0 červenec 2011 Obecné poznámky: Příbalový
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls240936/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram obsahuje diclofenacum natricum 10 mg. Pomocné látky: propylenglykol,
sp.zn. sukls240936/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram obsahuje diclofenacum natricum 10 mg. Pomocné látky: propylenglykol,
5.6.6.3. Metody hodnocení rizik
 5.6.6.3. Metody hodnocení rizik http://www.guard7.cz/lexikon/lexikon-bozp/identifikace-nebezpeci-ahodnoceni-rizik/metody-hodnoceni-rizik Pro hodnocení a analýzu rizik se používají různé metody. Výběr metody
5.6.6.3. Metody hodnocení rizik http://www.guard7.cz/lexikon/lexikon-bozp/identifikace-nebezpeci-ahodnoceni-rizik/metody-hodnoceni-rizik Pro hodnocení a analýzu rizik se používají různé metody. Výběr metody
Čl. 3 Poskytnutí finančních prostředků vyčleněných na rozvojový program Čl. 4 Předkládání žádostí, poskytování dotací, časové určení programu
 Vyhlášení rozvojového programu na podporu navýšení kapacit ve školských poradenských zařízeních v roce 2016 čj.: MSMT-10938/2016 ze dne 29. března 2016 Ministerstvo školství, mládeže a tělovýchovy (dále
Vyhlášení rozvojového programu na podporu navýšení kapacit ve školských poradenských zařízeních v roce 2016 čj.: MSMT-10938/2016 ze dne 29. března 2016 Ministerstvo školství, mládeže a tělovýchovy (dále
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/25 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Previcox 57 mg žvýkací tablety pro psy Previcox 227 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/25 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Previcox 57 mg žvýkací tablety pro psy Previcox 227 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SMLOUVA O POSKYTOVÁNÍ SOCIÁLNÍ SLUŽBY č.../2013
 SMLOUVA O POSKYTOVÁNÍ SOCIÁLNÍ SLUŽBY č.../2013 Poskytovatelem sociální služby: Adresa: Sídlo: DOMOV PRO SENIORY JAVORNÍK, p. o., Školní 104, 790 70 J a v o r n í k J A V O R N Í K IČO: 75004101 Zapsán:
SMLOUVA O POSKYTOVÁNÍ SOCIÁLNÍ SLUŽBY č.../2013 Poskytovatelem sociální služby: Adresa: Sídlo: DOMOV PRO SENIORY JAVORNÍK, p. o., Školní 104, 790 70 J a v o r n í k J A V O R N Í K IČO: 75004101 Zapsán:
