15. ZHOUBNÉ NÁDORY KŮŽE (C43, C44)
|
|
|
- Matyáš Štěpánek
- před 7 lety
- Počet zobrazení:
Transkript
1 15. ZHOUBNÉ NÁDORY KŮŽE (C43, C44) 15.1 Zhoubný melanom kůže (C43) Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této léčby, patrný až na základě četných meta-analýz a nezanedbatelnou toxicitu. Vzhledem k omezené účinnosti adjuvantní léčby interferonem alfa je dnes proto nejvhodnějším postupem u nemocných po radikální operaci zařazení do klinické studie s novými léky. Ve stádiu IIB-III lze podávat interferon alfa ve středních dávkách (2B). Prodloužení celkového přežití při použití středních dávek interferonu alfa lze očekávat u pacientů stádia IIB s ulcerací primárního nádoru, u stádia III s ulcerací primárního nádoru a mikroskopickým postižením spádových uzlin (subanalýza studie EORTC 18952). dávka opakování cyklu interferon alfa 9 (10) MIU s.c. 5 týdně po dobu 4 týdnů následně 9 (10) MIU s.c. 3 týdně po dobu 48 týdnů Ve stádiu III je možno pro vysoce rizikovou skupinu pacientů využít vysokodávkovaný interferon alfa-2b (2B). dávka opakování cyklu interferon alfa-2b 20 MIU/m 2 i.v. 5 týdně po dobu 4 týdnů následně 10 MIU/m 2 s.c. 3 týdně 11 měsíců U pacientů klinického stádia IIB-III je možno také zvážit kombinaci dakarbazin + multiferon (start multiferonu za 3 týdny po DTIC) (2B). dávka opakování cyklu DTIC 850 mg/m 2 à 3 týdny 2 cykly *Multiferon 3 MIU s.c. 3 týdně po dobu 6 měsíců * Indikační omezení úhrady Multiferonu dle SÚKL: léčba vysoce rizikových pacientů se stádiem IIB-III kožního melanomu po dvou počátečních cyklech dakarbazinem, u kterých není použití vysokodávkovaného rekombinantního interferonu vhodné Neoadjuvantní léčba Neoadjuvantní chemo či imunoterapie u melanomu není indikována Paliativní léčba Standardem léčby metastatického maligního melanomu se stává cílená léčba (vemurafenib, dabrafenib a trametinib u nemocných s mutací BRAF V600) a moderní imunoterapie (ipilimumab). Na rozdíl od cytotoxické chemoterapie bylo v randomizovaných klinických studiích u těchto léků prokázáno prodloužení přežití, a to v první i dalších liniích léčby. Vemurafenib, dabrafenib a trametinib v monoterapii je registrován pro 1. a další linii systémové léčby. Vemurafenib je dle SÚKL hrazen z prostředků veřejného zdravotního pojištění za těchto podmínek: Vemurafenib je indikován v monoterapii k léčbě pacientů starších 18 let s neresekovatelným nebo metastazujícím melanomem s pozitivní mutací V600 genu BRAF, potvrzenou validním testem, kteří nebyli v minulosti léčeni paliativní chemo(imuno)terapií. Terapie je hrazena pouze za předpokladu kumulativního splnění následujících podmínek: a) pacient má výkonnostní stav 0-1 dle ECOG; b) pacientova předpokládaná doba života 108 MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
2 v době zahájení terapie je alespoň 3 měsíce; c) pacient nevykazuje přítomnost symptomatických mozkových metastáz; d) pacient má normální krevní, jaterní a ledvinové funkce. Terapie je hrazena do progrese onemocnění. Dabrafenib a trametinib zatím nemají stanovenou úhradu ze zdravotního pojištění. Ipilimumab má registraci pro 1. a další linii léčby. Úhrada ze zdravotního pojištění pro první linii léčby nebyla zatím stanovena. Ipilimumab je dle SÚKL hrazen z prostředků veřejného zdravotního pojištění za těchto podmínek: Ipilimumab je v monoterapii indikován k léčbě pokročilého melanomu (neresekovatelného stádia III nebo metastatického stádia IV) u pacientů, kteří dostávali jedno nebo více léčiv ze skupiny chemoterapeutik či cytokinů předchozí volby (dakarbazin, interleukin 2, fotemustin, karboplatina nebo temozolomid) za kumulativního splnění následujících podmínek: a) pacient má výkonnostní stav 0-1 dle ECOG; b) pacientova předpokládaná doba života je delší než 4 měsíce; c) pacient nevykazuje přítomnost aktivních mozkových metastáz, primárního okulárního melanomu nebo primárního melanomu CNS; d) pacient není dlouhodobě léčen kortikosteroidy nebo dalšími imunosupresivy; e) pacient má normální krevní, jaterní a ledvinové funkce; f) pacient nemá diagnostikované autoimunitní onemocněním. Z prostředků veřejného zdravotního pojištění je hrazeno podání maximálně čtyř samostatných dávek ipilimumabu 3 mg/kg hmotnosti pacienta, opakovaný (reindukční) režim není ze zdravotního pojištění hrazen. U pacientů, kteří nesplní indikační omezení úhrady pro vemurafenib nebo ipilimumab (viz. výše) je nadále indikována paliativní chemoterapie. Na rozdíl od předchozích preparátů jsou všechny režimy cytotoxické chemoterapie účinné jen omezeně a nebyl zde prokázán benefit v prodloužení celkového přežití. ČOS: Stupně evidence a doporučeni Stupeň 1 Založeno na vysokém stupni důkazů, jednotné doporučeni ČOS, že léčba je vhodná. Stupeň 2A Založeno na nižším stupni důkazů, jednotné doporučeni ČOS, že léčba je vhodná. Stupeň 2B Založeno na nižším stupni důkazů, doporučeni ČOS, že léčba je vhodná. Stupeň 3 Založeno na jakémkoliv stupni důkazů, v rámci ČOS není shoda o vhodnosti léčby. Léčebné algoritmy u pokročilého maligního melanomu 1. linie léčby pokročilého maligního melanomu (inoperabilní stádium III a IV) Mutace BRAF V600 WT BRAF V600 Vemurafenib (1) *Dabrafenib (1) *Trametinib (1) **Ipilimumab (1) **Ipilimumab (1) MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
3 2. linie léčby pokročilého maligního melanomu (inoperabilní stádium III a IV) Mutace BRAF V600 WT BRAF V600 Předchozí léčba BRAF nebo MEK inhibitorem Předchozí léčba ipilimumabem Předchozí léčba chemoterapií Předchozí léčba ipilimumabem Předchozí léčba chemoterapií **Ipilimumab (3) **Vemurafenib (2B) *Dabrafenib (2B) *Trametinib (2B) **Vemurafenib (1) *Dabrafenib (1) *Trametinib (1) Ipilimumab (1) Ipilimumab (1) * O úhradě přípravku ze zdravotního pojištění nebylo k rozhodnuto. ** O úhradě přípravku ze zdravotního pojištění nebylo pro danou indikaci k rozhodnuto (indikační omezení úhrady dle SÚKL). Příklady léčebných paliativních schémat dávka mg/m 2 den aplikace opakování cyklu ipilimumab ipilimumab 3 mg/kg i.v. inf. 1. à 3 týdny, 4 vemurafenib vemurafenib 960 mg p.o. 2 denně denně do progrese *dabrafenib dabrafenib 150 mg p.o. 2 denně denně do progrese *trametinib trametinib 2 mg p. o. 1 denně denně do progrese Vysokodávkovaný dakarbazin (HD DTIC) DTIC à 4 týdny nebo DTIC à 3 týdny CVD DDP VBL 1, DTIC à 3 týdny 110 MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
4 dávka mg/m 2 den aplikace opakování cyklu kombinace BOLD BLM 15 mg/den 1., 4. VCR 1,5 mg/den (max. 2 mg) 1., 5. CCNU DTIC à 4 týdny fotemustin fotemustin , 8., týdnů interval bez terapie s následnou udržovací fází den 1., Vybrané informace k ipilimumabu Ipilimumab je indikován k léčbě pokročilého (neresekovatelného nebo metastazujícího) melanomu u dospělých. Přecitlivělost na složky přípravku. Nebyly provedeny žádné studie. Podávání přípravku je spojeno se zánětlivými nežádoucími účinky, které jsou důsledkem zvýšené nebo nadměrné imunitní aktivity. Imunitně podmíněné nežádoucí účinky, které mohou být závažné nebo život ohrožující, se mohou týkat gastrointestinálního traktu, jater, kůže, nervové, endokrinní nebo jiné orgánové soustavy. Většina z nich, včetně těžkých reakcí, ustoupila po zahájení odpovídající imunosupresivní léčby nebo vysazení přípravku. Nejčastějšími nežádoucími účinky u pacientů, kterým byl podáván přípravek v monoterapii v dávce 3 mg/kg t.hm., byly průjem, vyrážka, pruritus, únava, nevolnost, zvracení, snížená chuť k jídlu nebo bolesti břicha. Doporučený indukční režim: 3 mg/kg t.hm., i.v. infuzí po dobu 90 minut, každé 3 týdny, celkem 4 dávky. Pacienti by měli dostat celý indukční režim (4 dávky) dle tolerance, bez ohledu na vzhled nových lézí nebo růst existujících lézí. Hodnocení odpovědi nádoru by se mělo provést pouze po dokončení indukční terapie. Podrobné pokyny pro přerušení léčby nebo vynechání dávek jsou uvedeny v SPC Vybrané informace k vemurafenibu Vemurafenib je indikován v monoterapii k léčbě dospělých pacientů s neresekovatelným nebo metastazujícím melanomem s pozitivní mutací V600 genu BRAF. Přecitlivělost na složky přípravku. MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
5 Vliv vemurafenibu na jiné léčivé přípravky: vemurafenib může zvýšit plazmatickou expozici léčivých přípravků predominantně metabolizovaných CYP1A2 a snížit plazmatickou expozici léků metabolizovaných predominantně CYP3A4, včetně perorální antikoncepce. Před zahájením společného podávání s vemurafenibem má být na základě terapeutického rozpětí zvážena úprava dávky léčivých přípravků, které jsou predominantně metabolizovány CYP1A2 nebo CYP3A4. Pokud je vemurafenib používán souběžně s warfarinem, je třeba zvýšit opatrnost a zvážit doplňující pravidelné sledování INR. Vliv jiných léčivých přípravků na vemurafenib: farmakokinetika vemurafenibu může být ovlivněna léčivy, které inhibují nebo ovlivňují P-gp (např. verapamil, klaritromycin, cyklosporin, ritonavir, chinidin, dronedaron, amiodaron, itrakonazol, ranolazin). Současné podání silných induktorů P-gp, glukuronidace, CYP3A4 (např. rifampicin, rifabutin, karbamazepin, fenytoin nebo třezalka tečkovaná [hypericin]) má být pokud možno vyloučeno. Pro zachování účinnosti vemurafenibu má být zvážena alternativní léčba s nižším indukčním potenciálem. Nejčastější nežádoucí účinky (> 30%) hlášené v souvislosti s vemurafenibem zahrnují artralgii, únavu, vyrážku, fotosenzitivní reakci, nauzeu, alopecii a pruritus. Velmi často (20%) byl hlášen kožní spinocelulární karcinom. Doporučená dávka vemurafenibu je 960 mg (4 tablety po 240 mg) dvakrát denně (odpovídá celkové denní dávce 1920 mg). První dávka se užívá ráno a druhá dávka přibližně o 12 hodin později večer. Každá dávka ráno / večer má být užita vždy stejným způsobem, tedy buď s jídlem, nebo bez jídla. V léčbě vemurafenibem se má pokračovat až do progrese onemocnění nebo do rozvoje nepřijatelné toxicity. Podrobné pokyny pro úpravu dávek nebo přerušení léčby jsou uvedeny v SPC Vybrané informace k dabrafenibu Dabrafenib je indikován v monoterapii k léčbě dospělých pacientů s neresekovatelným nebo metastatickým melanomem s mutací V600 genu BRAF. Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Dabrafenib je induktor enzymů a zvyšuje syntézu enzymů, které metabolizují léky včetně CYP3A4, CYP2C a CYP2B6 a může zvyšovat syntézu transportérů. Očekává se velký počet ovlivněných léčivých přípravků, i když rozsah interakcí se bude různit. Nejčastější nežádoucí účinky (s četností 15 % a více) hlášené v souvislosti s léčbou dabrafenibem byly hyperkeratóza, bolest hlavy, pyrexie, artralgie, únava, nauzea, papilom, alopecie, vyrážka a zvracení. Doporučená dávka dabrafenibu je 150 mg (dvě 75mg tobolky) dvakrát denně (což odpovídá celkové denní dávce 300 mg). Dabrafenib je třeba užít nejméně 1 hodinu před jídlem nebo alespoň 2 hodiny po jídle a mezi jednotlivými dávkami je třeba ponechat interval přibližně 12 hodin. Pokud dojde k vynechání dávky, nemá se tato dávka užívat, pokud do další dávky zbývá méně než 6 hodin. 112 MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
6 V léčbě se pokračuje dokud z ní má pacient prospěch nebo dokud se neobjeví nepřijatelná toxicita. Podrobné pokyny pro úpravu dávek nebo přerušení léčby jsou uvedeny v SPC. *O úhradě přípravku ze zdravotního pojištění nebylo k rozhodnuto Vybrané informace k trametinibu Trametinib je indikován k léčbě dospělých pacientů s neresekovatelným nebo metastatickým melanomem s mutací V600 genu BRAF. Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Vzhledem k tomu, že trametinib je metabolizován především deacetylací za pomoci hydrolytických enzymů, je nepravděpodobné, že by jeho farmakokinetika byla ovlivněna jinými látkami přes metabolické interakce. Nejčastější nežádoucí účinky trametinibu ( 20 %) zahrnovaly vyrážku, průjem, únavu, periferní edém, nauseu a dermatitis acneiform. Doporučená dávka trametinibu je 2 mg jednou denně. V léčbě trametinibem je doporučeno pokračovat, dokud z ní má pacient prospěch, nebo dokud se neobjeví nepřijatelná toxicita. Pacienti by měli užívat trametinib alespoň jednu hodinu před jídlem nebo dvě hodiny po jídle, vzhledem k vlivu jídla na absorpci trametinibu. *O úhradě přípravku ze zdravotního pojištění nebylo k rozhodnuto. Vybrané klinické studie u pokročilého maligního melanomu preparát Název studie fáze linie léčby počet pacientů design RR (%) PFS (měsíce) OS (měsíce) citace vemurafenib BRIM-2 II 2. a další 132 jednoramenná studie 53 6,8 15,9 6 vemurafenib BRIM-3 III vem vs DTIC 48 6,9 13,6 7, 8 dabrafenib BREAK-2 II 2. a další 76 (V600E) + 16 (V600K) jednoramenná studie ,3 4,5 13,1 12,9 9 dabrafenib BREAK-3 III dabra vs DTIC 59 6,9 18,2 10 trametinib METRIC III 1. a tram vs DTIC nebo paclitaxel 22 4,8 NS 11 ipilimumab 10 mg/kg III IPI + DTIC vs DTIC 15,2 NS 11,2 12 ipilimumab 3 mg/kg MDX III 2. a další 676 ipilimumab vs ipilimumab + gp 100 vs gp ,9 2,86 10,1 13 MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
7 Literatura: 1. Kirkwood JM, Strawderman MH, Ernstoff MS, et al. Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST J Clin Oncol 1996;14: Eggermont AM, Suciu S, Testori A, et al. Ulceration of primary melanoma and responsiveness to adjuvant interferon therapy: Analysis of the adjuvant trials EORTC and EORTC in 2,644 patients. J Clin Oncol 2009;27(Suppl 15): Serrone L, Zeuli M, Sega FM, Cognetti F. Dacarbazine-based chemotherapy for metastatic melanoma: thirty-year experience overview. J Exp Clin Cancer Res 2000;19: Ives NJ, Stowe RL, Lorigan P, Wheatley K. Chemotherapy compared with biochemotherapy for the treatment of metastatic melanoma: a meta-analysis of 18 trials involving 2,621 patients. J Clin Oncol 2007; 25(34): Atkins MB, Hsu J, Lee S, et al. Phase III trial comparing concurrent biochemotherapy with cisplatin, vinblastine, dacarbazine, interleukin-2, and interferon alfa-2b with cisplatin, vinblastine, and dacarbazine alone in patients with metastatic malignant melanoma (E3695): a trial coordinated by the eastern cooperative oncology group. J Clin Oncol 2008 Dec 10; 26(35): Sosman JA, Kim KB, Schuchter L, et al. Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib. N Engl J Med 2012,366: Chapman PB, Hauschild A, Robert C, et al. Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation. New England Journal of Medicine 2011;364: McArthur GA, Chapman PB, Robert C et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014;15(3): Ascierto PA, Minor D, Ribas A, et al. Phase II trial (BREAK-2) of the BRAF inhibitor dabrafenib (GSK ) in patients with metastatic melanoma. J Clin Oncol Sep 10;31(26): Hauschild A, Grob JJ, Demidov LV et al. Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet Jul 28;380(9839): Flaherty KT, Robert C, Hersey P, et al. METRIC Study Group. Improved survival with MEK inhibition in BRAF-mutated melanoma. N Engl J Med. 2012;367(2): Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011;364(26): Hodi FS, O Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363: Souhrn údajů o přípravku (SPC) Yervoy, Zelboraf, Tafinlar a Mekinist Pokročilý bazocelulární karcinom (C44) Lokálně pokročilý bazocelulární karcinom Lokálně pokročilý bazocelulární karcinom představují kožní léze, které nejsou vhodné k chirurgické léčbě (inoperabilní, opakovaně rekurentní, kde kurativní resekce není pravděpodobná nebo kde by chirurgické řešení vedlo k významné deformitě nebo morbiditě) a kde nebyla úspěšná radioterapie, nebo kde je tato léčba kontraindikovaná nebo nevhodná Metastatický bazocelulární karcinom Metastatický bazocelulární karcinom je bazocelulární karcinom, který se rozšířil z kůže dále do jiných částí těla, včetně lymfatických uzlin, plic, kostí a/nebo vnitřních orgánů Vybrané informace k vismodegibu Přípravek Erivedge (vismodegib) je indikován k léčbě dospělých pacientů s: symptomatickým metastazujícím bazocelulárním karcinomem, lokálně pokročilým bazocelulárním karcinomem, který není vhodný k chirurgické léčbě nebo radioterapii. Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku. Těhotné nebo kojící ženy. Ženy ve fertilním věku, které nesplňují požadavky Programu prevence početí (Erivedge Pregnancy Prevention Programme). Léčivé přípravky, které ovlivňují ph horní části gastrointestinálního traktu (např. inhibitory protonové pumpy, antagonisty H2-receptorů a antacida), mohou ovlivňovat rozpustnost vismodegibu a snižovat jeho bio- 114 MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
8 logickou dostupnost. Žádné formální klinické studie hodnotící vliv přípravků ovlivňujících žaludeční ph na systémovou expozici vismodegibu však zatím nebyly provedeny. Studie in vitro naznačují, že vismodegib je substrátem efluxního transportéru pro P-glykoprotein a enzymů CYP2C9 a CYP3A4, které metabolizují lék. Pokud se vismodegib podává společně s léčivými přípravky, které inhibují P-glykoprotein (např. klaritromycin, erytromycin, azitromycin, verapamil, cyklosporin), CYP2C9 (amiodaron, flukonazol, mikonazol nebo oxandrolon) nebo CYP3A4 (boceprevir, klaritromycin, konivaptan, indinavir, itrakonazol, ketokonazol, lopinavir/ritonavir, mibefradil, nefazodon, nelfinavir, posakonazol, ritonavir, sachinavir, telaprevir, telitromycin nebo vorikonazol) může dojít ke zvýšení systémové expozice vismodegibu a častějšímu výskytu nežádoucích příhod. Podobně, pokud je vismodegib podáván společně s induktory CYP (avasimib, rifampin, karbamazepin, fenytoin, třezalka tečkovaná (St. John s wort), může být expozice vismodegibu snížena. Nejčastější nežádoucí účinky, které se objevily u 30 % pacientů, byly svalové spasmy, alopecie, dysgeuzie, pokles tělesné hmotnosti, únava a nauzea. Doporučená dávka je jedna 150 mg tobolka jednou denně. Léčba do progrese onemocnění nebo výskytu nepřijatelné toxicity. *O úhradě přípravku ze zdravotního pojištění nebylo k rozhodnuto. Literatura 1. Sekulic A, Migden MR, Oro AE, et al. Efficacy and safety of vismodegib in advanced basal-cell carcinoma. N Engl J Med 2012;366: Souhrn údajů o přípravku (SPC) Erivedge. MODRÁ KNIHA ČESKÉ ONKOLOGICKÉ SPOLEČNOSTI 19. aktualizace, platná od
15. ZHOUBNÉ NÁDORY KŮŽE (C43, C44)
 15. ZHOUBNÉ NÁDORY KŮŽE (C43, C44) 15.1 Zhoubný melanom kůže (C43) 15.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
15. ZHOUBNÉ NÁDORY KŮŽE (C43, C44) 15.1 Zhoubný melanom kůže (C43) 15.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44)
 11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44)
 11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44)
 11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44) 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu se stále používá interferon alfa. Je nutné připustit hraniční benefit této
11. ZHOUBNÉ NOVOTVARY KŮŽE (C43-44)
 11. 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu je standardem cílená léčba s kombinací BRAF a MEK inhibitoru a imunoterapie s checkpoint inhibitory. Z
11. 11.1 Zhoubný melanom kůže (C43) 11.1.1 Adjuvantní léčba V adjuvantní léčbě maligního melanomu je standardem cílená léčba s kombinací BRAF a MEK inhibitoru a imunoterapie s checkpoint inhibitory. Z
Standard. 4. Stanovení odpovědné osoby za diagnosticko léčebný plán (ošetřující lékař či lékař s kompetencí) doc. MUDr. Vuk Fait, CSc.
 1/15 1. Epidemiologie: je nádor postihující především kůži. Jeho výskyt v civilizovaných zemích stále stoupá a v současné době patří k nádorům s nejrychlejším růstem incidence. V naší republice bylo v
1/15 1. Epidemiologie: je nádor postihující především kůži. Jeho výskyt v civilizovaných zemích stále stoupá a v současné době patří k nádorům s nejrychlejším růstem incidence. V naší republice bylo v
Novinky v léčbě pacientů s pokročilým maligním melanomem
 Novinky v léčbě pacientů s pokročilým maligním melanomem MUDr. Radek Lakomý, Ph.D.; MUDr. Alexandr Poprach; prof. MUDr. Rostislav Vyzula, CSc. LF MU a Masarykův onkologický ústav, Klinika komplexní onkologické
Novinky v léčbě pacientů s pokročilým maligním melanomem MUDr. Radek Lakomý, Ph.D.; MUDr. Alexandr Poprach; prof. MUDr. Rostislav Vyzula, CSc. LF MU a Masarykův onkologický ústav, Klinika komplexní onkologické
3.3 KARCINOM SLINIVKY BŘIŠNÍ
 3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
3.3 KARCINOM SLINIVKY BŘIŠNÍ Epidemiologie Zhoubné nádory pankreatu se vyskytují převážně ve vyšším věku po 60. roce života, převážně u mužů. Zhoubné nádory pankreatu Incidence a mortalita v České republice
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
TAFINLAR (DABRAFENIB) SCHVÁLEN PRO LÉČBU POKROČILÉHO MELANOMU
 MALIGNÍ MELANOM A OSTATNÍ NÁDORY KŮŽE 83 TAFINLAR (DABRAFENIB) SCHVÁLEN PRO LÉČBU POKROČILÉHO MELANOMU Nosek M. CZ/BRF/0003/13 Úvod Melanom patří k zákeřným onkologickým onemocněním a jeho incidence celosvětově
MALIGNÍ MELANOM A OSTATNÍ NÁDORY KŮŽE 83 TAFINLAR (DABRAFENIB) SCHVÁLEN PRO LÉČBU POKROČILÉHO MELANOMU Nosek M. CZ/BRF/0003/13 Úvod Melanom patří k zákeřným onkologickým onemocněním a jeho incidence celosvětově
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tarceva 25 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 25 mg erlotinibum (ve formě erlotinibi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tarceva 25 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 25 mg erlotinibum (ve formě erlotinibi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Klinické studie v ČR & monoklonální gamapatie: přehled a plán pro rok 2013-2014
 Eva Jarošová Klinické studie v ČR & monoklonální gamapatie: přehled a plán pro rok 2013-2014 Brno, 29. 11. 2013 Mnohočetný myelom Nová diagnóza Aktivní klinické studie - MM Studie EMN02 AKADEMICKÁ Studie
Eva Jarošová Klinické studie v ČR & monoklonální gamapatie: přehled a plán pro rok 2013-2014 Brno, 29. 11. 2013 Mnohočetný myelom Nová diagnóza Aktivní klinické studie - MM Studie EMN02 AKADEMICKÁ Studie
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Mapování epidemiologické situace zhoubného melanomu a obraz léčebné péče v ČR s důrazem na léčbu pokročilého melanomu v letech 2007 2014
 Mapování epidemiologické situace zhoubného melanomu a obraz léčebné péče v ČR s důrazem na léčbu pokročilého melanomu v letech 2007 2014 prof. MUDr. Bohuslav Melichar, Ph.D. 1, Mgr. Michal Burger 2, MUDr.
Mapování epidemiologické situace zhoubného melanomu a obraz léčebné péče v ČR s důrazem na léčbu pokročilého melanomu v letech 2007 2014 prof. MUDr. Bohuslav Melichar, Ph.D. 1, Mgr. Michal Burger 2, MUDr.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
Udržovací léčba MabTherou u nemocných s folikulárním lymfomem možnosti léčby v roce 2010
 Udržovací léčba MabTherou u nemocných s folikulárním lymfomem možnosti léčby v roce 2010 David Belada, II.interní klinika, OKH FN a LF v Hradci Králové Lymfomové fórum 2010 Grand Hotel Bellevue, Vysoké
Udržovací léčba MabTherou u nemocných s folikulárním lymfomem možnosti léčby v roce 2010 David Belada, II.interní klinika, OKH FN a LF v Hradci Králové Lymfomové fórum 2010 Grand Hotel Bellevue, Vysoké
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls106502/2011, sukls106531/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls106502/2011, sukls106531/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TORVACARD 10 TORVACARD 20 Potahované tablety Atorvastatinum
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls106502/2011, sukls106531/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TORVACARD 10 TORVACARD 20 Potahované tablety Atorvastatinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls106353/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRVKU Lopacut 2 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAXEGIS 20 mg koncentrát a rozpouštědlo pro přípravu infuzního roztoku TAXEGIS 80 mg koncentrát
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls137130/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAXEGIS 20 mg koncentrát a rozpouštědlo pro přípravu infuzního roztoku TAXEGIS 80 mg koncentrát
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro přípravu infúzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Docetaxel Accord 20 mg/1 ml koncentrát pro přípravu infúzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje 20 mg
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ellaone 30 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 30 mg ulipristali acetas. Pomocné látky se známým účinkem:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ellaone 30 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 30 mg ulipristali acetas. Pomocné látky se známým účinkem:
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOTILIUM 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Domperidonum 10 mg v jedné potahované
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls18786/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOTILIUM 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Domperidonum 10 mg v jedné potahované
Strategie léčby metastatického karcinomu ledviny. Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc
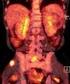 Strategie léčby metastatického karcinomu ledviny Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Strategické úvahy Režim první linie? Režim druhé linie? Kolik linií? Kombinace s lokálním metodami
Strategie léčby metastatického karcinomu ledviny Bohuslav Melichar Onkologická klinika LF UP a FN Olomouc Strategické úvahy Režim první linie? Režim druhé linie? Kolik linií? Kombinace s lokálním metodami
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls103020/2010 a příloha ke sp.zn sukls178695-98/2009
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls103020/2010 a příloha ke sp.zn sukls178695-98/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Simvastatin Orion 10 mg Simvastatin Orion 20 mg
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls103020/2010 a příloha ke sp.zn sukls178695-98/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Simvastatin Orion 10 mg Simvastatin Orion 20 mg
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Emselex 7,5 mg, tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 7,5 mg darifenacinum (jako hydrobromid)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
STÁTNÍ ÚSTAV Šrobárova 48 Telefon: PRO KONTROLU LÉČIV Praha 10 Fax: Web:
 STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS213040/2014 Vyřizuje/linka Datum: 22. 5. 2015
STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS213040/2014 Vyřizuje/linka Datum: 22. 5. 2015
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. TORVACARD 10 TORVACARD 20 TORVACARD 40 potahované tablety Atorvastatinum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls96605/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TORVACARD 10 TORVACARD 20 TORVACARD 40 potahované tablety Atorvastatinum Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls96605/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TORVACARD 10 TORVACARD 20 TORVACARD 40 potahované tablety Atorvastatinum Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocné látky se známým účinkem: Jedna tableta obsahuje 28 mg laktosy a 5 mg glyceromakrogol-hydroxystearátu.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PLENDIL ER 5 mg PLENDIL ER 10 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje felodipinum 5,0 mg. Pomocné látky se známým účinkem: Jedna tableta
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infúzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU TAXOTERE 20 mg/0,5 ml koncentrát a rozpouštědlo pro infúzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna jednodávková injekční lahvička TAXOTERE
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls114374/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LOPERON cps 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Loperamidi hydrochloridum 2 mg v jedné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34)
 2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom 1. linie: 2.1.1 Nádory klinického stadia IIA a IIB pokud jsou kontraindikace chirurgické léčby. U těchto nemocných se chemoterapie kombinuje
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom 1. linie: 2.1.1 Nádory klinického stadia IIA a IIB pokud jsou kontraindikace chirurgické léčby. U těchto nemocných se chemoterapie kombinuje
STIVARGA (REGORAFENIB)
 NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
NÁDORY TLUSTÉHO STŘEVA A REKTA 31 STIVARGA (REGORAFENIB) Kolektiv autorů Úvod Regorafenib (Stivarga ) je nový perorální multikinázový inhibitor, který byl v roce 2013 registrován pro léčbu dospělých pacientů
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Imunoterapie metastazujícího melanomu
 183 Imunoterapie metastazujícího melanomu Ivana Krajsová Dermatovenerologická klinika VFN v Praze Aktivace imunitního systému je velmi důležitým krokem v léčebné strategii metastazujícího melanomu a větší
183 Imunoterapie metastazujícího melanomu Ivana Krajsová Dermatovenerologická klinika VFN v Praze Aktivace imunitního systému je velmi důležitým krokem v léčebné strategii metastazujícího melanomu a větší
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Larus 10 mg Larus 20 mg Larus 40 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá potahovaná tableta obsahuje: atorvastatinum 10 mg, 20 mg
1. NÁZEV PŘÍPRAVKU Larus 10 mg Larus 20 mg Larus 40 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá potahovaná tableta obsahuje: atorvastatinum 10 mg, 20 mg
2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum. Pomocné látky viz bod 6.1.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mirtawin 15 mg Mirtawin 30 mg Mirtawin 45 mg 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 15 mg nebo 30 mg nebo 45 mg mirtazapinum.
Jedna potahovaná tableta obsahuje atazanavirum 300 mg (jako atazanaviri sulfas) a cobicistatum 150 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Ipilimumab v léčbě melanomu
 MUDr. Monika Arenbergerová, Ph.D.; MUDr. Alena Fialová; prof. MUDr. Petr Arenberger, DrSc., MBA Dermatovenerologická klinika 3. LF UK a FNKV, Praha Souhrn Arenbergerová M, Fialová A, Arenberger P.. Remedia
MUDr. Monika Arenbergerová, Ph.D.; MUDr. Alena Fialová; prof. MUDr. Petr Arenberger, DrSc., MBA Dermatovenerologická klinika 3. LF UK a FNKV, Praha Souhrn Arenbergerová M, Fialová A, Arenberger P.. Remedia
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
KOMBINAČNÍ LÉČBA DIABETU, ANEB TERAPIE ŠITÁ NA MÍRU. MUDr. Jitka Kuchařová Skymed s.r.o. 1.6.2016
 KOMBINAČNÍ LÉČBA DIABETU, ANEB TERAPIE ŠITÁ NA MÍRU MUDr. Jitka Kuchařová Skymed s.r.o. 1.6.2016 PATOGENEZE DIABETU 2.TYPU mnoho let - inzulinová rezistence a poruchy inzulinové sekrece dnes - až osm poruch
KOMBINAČNÍ LÉČBA DIABETU, ANEB TERAPIE ŠITÁ NA MÍRU MUDr. Jitka Kuchařová Skymed s.r.o. 1.6.2016 PATOGENEZE DIABETU 2.TYPU mnoho let - inzulinová rezistence a poruchy inzulinové sekrece dnes - až osm poruch
Příbalová informace: informace pro uživatele. CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum)
 sp.zn.sukls30566/2015 Příbalová informace: informace pro uživatele CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls30566/2015 Příbalová informace: informace pro uživatele CORSIM 10 CORSIM 20 CORSIM 40 potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Souhrn údajů o přípravku
 sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009. PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum
 Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Belsanor 5 mg potahované tablety Belsanor 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Belsanor 5 mg potahované tablety: Jedna tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Belsanor 5 mg potahované tablety Belsanor 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Belsanor 5 mg potahované tablety: Jedna tableta obsahuje
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Vyvěšeno dne: 12. 4. 2012 Rozhodnutí nabylo právní moci dne: 17. 4. 2012 V Praze dne 12. 4. 2012 č. j.: MZDR74106/2011 sp. zn. FAR: L269/2011 k sp. zn.: SUKLS170408/2010
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Vyvěšeno dne: 12. 4. 2012 Rozhodnutí nabylo právní moci dne: 17. 4. 2012 V Praze dne 12. 4. 2012 č. j.: MZDR74106/2011 sp. zn. FAR: L269/2011 k sp. zn.: SUKLS170408/2010
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
Specifika posuzování onkologických léčiv v České republice. Hambálek J. ČFES Bratislava
 Specifika posuzování onkologických léčiv v České republice Hambálek J. ČFES Bratislava 23.11.2016 Trochu legislativy na začátek 39b odst. 2 ZoVZP: Při stanovení výše a podmínek úhrady se u léčivého přípravku
Specifika posuzování onkologických léčiv v České republice Hambálek J. ČFES Bratislava 23.11.2016 Trochu legislativy na začátek 39b odst. 2 ZoVZP: Při stanovení výše a podmínek úhrady se u léčivého přípravku
31. 3. 1. 4. 2016. kinosál ředitelství FN Motol, V Úvalu 84, Praha 5 PROGRAM
 31. 3. 1. 4. 2016 kinosál ředitelství FN Motol, V Úvalu 84, Praha 5 PROGRAM GIST? Glivec! Zkrácená informace Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
31. 3. 1. 4. 2016 kinosál ředitelství FN Motol, V Úvalu 84, Praha 5 PROGRAM GIST? Glivec! Zkrácená informace Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34)
 2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom Podání chemoterapie s radikálním léčebným záměrem (průkazné prodloužení života) 2.1.1 Nádory klinického stádia IIA a IIB pokud jsou
2. ZHOUBNÝ NOVOTVAR BRONCHU A PLÍCE (C34) 2.1 Nemalobuněčný karcinom Podání chemoterapie s radikálním léčebným záměrem (průkazné prodloužení života) 2.1.1 Nádory klinického stádia IIA a IIB pokud jsou
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57)
 9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
9. ZHOUBNÝ NOVOTVAR OVARIÍ A TUBY (C56-57) 9.1 Epiteliální 9.1.1 Chemoterapie jako součást primární léčby Po chirurgické léčbě epiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní.
Červené potahované tablety oválného tvaru s vyraženým nápisem Pfizer na jedné straně a 1 XNB na druhé straně.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU INTELENCE 25 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje um 25 mg. Pomocná látka se známým účinkem: Jedna tableta obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU INTELENCE 25 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje um 25 mg. Pomocná látka se známým účinkem: Jedna tableta obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 75 mg (ve formě dabigatrani
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 75 mg (ve formě dabigatrani
Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT)
 Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT) Důležité bezpečnostní informace pro lékaře týkající se sledování
Bezpečnostní průvodce použití přípravku REVOLADE (eltrombopag) při léčbě chronické trombocytopenie asociované s hepatitidou typu C (HCVaT) Důležité bezpečnostní informace pro lékaře týkající se sledování
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička pro PVC-Al blistry a HDPE lahvičky 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. Pregabalin Archie Samuel 150 mg tvrdé tobolky
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje silodosinum 4 mg. Úplný seznam pomocných látek viz
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009
 Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
sp.zn.sukls133259/2014
 sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
sp.zn.sukls133259/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VERMOX tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mebendazolum 100 mg. Pomocné látky se známým účinkem: oranžová
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Bazocelulární karcinom. Zaostřeno na
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli podezření na nežádoucí účinky na www.sukl.cz/nahlasit-nezadouci-ucinek
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli podezření na nežádoucí účinky na www.sukl.cz/nahlasit-nezadouci-ucinek
Prevence cévních mozkových příhod a systémové embolie u dospělých pacientů s NVFS s jedním nebo více rizikovými faktory (SPAF)
 1. NÁZEV PŘÍPRAVKU Pradaxa 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 150 mg (ve formě dabigatrani etexilati mesilas). Pomocné látky
1. NÁZEV PŘÍPRAVKU Pradaxa 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje dabigatranum etexilatum 150 mg (ve formě dabigatrani etexilati mesilas). Pomocné látky
V příbalové informaci naleznete:
 Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls131001/2011 PŘÍBALOVÁ INFORMACE SIMGAL 10 mg potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls131001/2011 PŘÍBALOVÁ INFORMACE SIMGAL 10 mg potahované tablety (simvastatinum) Přečtěte si pozorně celou příbalovou informaci dříve,
Vesicare 5 mg potahované tablety
 Sp. zn. sukls74933/2013 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg, potahované tablety: Jedna tableta obsahuje 5 mg
Sp. zn. sukls74933/2013 SOUHR ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vesicare 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Vesicare 5 mg, potahované tablety: Jedna tableta obsahuje 5 mg
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. MYGREF 250 MG tvrdá tobolka. mofetilis mycophenolas
 Sp.zn. sukls82417/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Sp.zn. sukls82417/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE MYGREF 250 MG tvrdá tobolka mofetilis mycophenolas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty
 Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Možnosti léčby kastračně rezistentního metastatického karcinomu prostaty Iveta Kolářová Oddělení klinické a radiační onkologie Pardubice Multiscan s.r.o. Pardubická krajská nemocnice, a.s. Pardubice 19.9.2012
Injekce 25 mg jednou denně ode dne získání zralého vajíčka, obvykle do 12 týdnů potvrzeného těhotenství.
 sp.zn.sukls101164/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU NÁZEV PŘÍPRAVKU Prolutex 25 mg injekční roztok 1. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička (1,119 ml) obsahuje progesteronum 22,35 mg/ml).
sp.zn.sukls101164/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU NÁZEV PŘÍPRAVKU Prolutex 25 mg injekční roztok 1. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička (1,119 ml) obsahuje progesteronum 22,35 mg/ml).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XATRAL UNO tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Alfuzosini hydrochloridum 10 mg v jedné tabletě. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXESTEA 25 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Exemestanum Jedna potahovaná tableta obsahuje exemestanum 25 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXESTEA 25 mg Potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Exemestanum Jedna potahovaná tableta obsahuje exemestanum 25 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Ethanol: 100 mg/tobolka. Sandimmun Neoral měkké tobolky obsahuje 11,8 % v/v ethanolu (9,4 %
 sp. zn. sukls61688/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Sandimmun Neoral 25 mg Sandimmun Neoral 50 mg Sandimmun Neoral 100 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka
sp. zn. sukls61688/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Sandimmun Neoral 25 mg Sandimmun Neoral 50 mg Sandimmun Neoral 100 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka
DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY
 1 DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY Vítková E., Krajíčková D. Komplexní cerebrovaskulární centrum Neurologická klinika LF UK a FN Hradec Králové 2 Atriální fibrilace riziko CMP AF výskyt u 0,5%
1 DABIGATRAN PREVENCE CÉVNÍ MOZKOVÉ PŘÍHODY Vítková E., Krajíčková D. Komplexní cerebrovaskulární centrum Neurologická klinika LF UK a FN Hradec Králové 2 Atriální fibrilace riziko CMP AF výskyt u 0,5%
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls90149/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUTTALAX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje Natrii picosulfas 5 mg Pomocná látka se známým účinkem: monohydrát
sp.zn.sukls90149/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUTTALAX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje Natrii picosulfas 5 mg Pomocná látka se známým účinkem: monohydrát
Jedna potahovaná tableta obsahuje 35,8 mg laktózy (ve formě monohydrátu), viz bod 4.4. Úplný seznam pomocných látek viz bod 6.1.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
AMLODIPIN HBF 10 mg AMLODIPIN HBF 5 mg
 AMLODIPIN HBF 10 mg 83/584/08-C DR: O RP: 83/871/92-C D: HERBACOS-BOFARMA S.R.O., PARDUBICE, Česká republika S: Amlodipini besilas 13.87 mg (odp. Amlodipinum 10 mg) PP: Bílé, kulaté, bikonvexní tablety
AMLODIPIN HBF 10 mg 83/584/08-C DR: O RP: 83/871/92-C D: HERBACOS-BOFARMA S.R.O., PARDUBICE, Česká republika S: Amlodipini besilas 13.87 mg (odp. Amlodipinum 10 mg) PP: Bílé, kulaté, bikonvexní tablety
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE PRO: Fungiconazol 200 mg tablety pro psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD
B. PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE PRO: Fungiconazol 200 mg tablety pro psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD
Příbalová informace: Informace pro uživatele. ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum
 Příbalová informace: Informace pro uživatele ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: Informace pro uživatele ZOCOR 10 mg ZOCOR 20 mg ZOCOR FORTE 40 mg Potahované tablety Simvastatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
