PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Antonín Čech
- před 7 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy jeden cm 2 náplasti obsahuje 640 mikrogramů capsaicinum. Pomocná látka se známým účinkem Jedna 50 g tuba čisticího gelu pro přípravek Qutenza obsahuje 0,2 mg/g butylhydroxyanisolu (E320). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Kožní náplast. Jedna náplast má rozměry 14 cm x 20 cm (280 cm 2 ) a skládá se z adhezivní strany obsahující léčivou látku a z vnější povrchové vrstvy. Adhezivní strana je pokryta odstranitelnou, průhlednou, nepotištěnou, diagonálně přestřiženou ochrannou folií. Na vnější povrchové vrstvě je vytištěn nápis capsaicin 8%. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Přípravek Qutenza je indikován k léčbě periferní neuropatické bolesti u dospělých, a to buď samostatně, nebo v kombinaci s dalšími léčivými přípravky pro léčbu bolesti. 4.2 Dávkování a způsob podání Kožní náplast Qutenza má aplikovat lékař nebo zdravotnický pracovník pod dohledem lékaře. Dávkování Přípravek Qutenza by měl být aplikován na nejbolestivější oblast pokožky (za použití maximálně 4 náplastí). Bolestivou oblast určí lékař a vyznačí ji na pokožce. Přípravek Qutenza se musí aplikovat na neporušenou, nepodrážděnou, suchou pokožku a nechat působit na nohou (např. u neuropatie spojené s HIV, bolestivá diabetická periferní neuropatie) po dobu 30 minut a na jiných částech těla (např. u postherpetické neuralgie) po dobu 60 minut. Pokud bolest přetrvává nebo se vrací, lze léčbu přípravkem Qutenza opakovat každých 90 dní. Před aplikací přípravku Qutenza může být léčená oblast ošetřena topickým anestetikem nebo může být pacientovi perorálně podáno analgetikum, aby se snížila možná bolest spojená s aplikací. Topické anestetikum by mělo být aplikováno na celou oblast léčenou přípravkem Qutenza s vnějším přesahem od 1 do 2 cm. Topické anestetikum nebo perorální analgetikum by mělo být použito v souladu s pokyny pro užívání daného léčivého přípravku. V klinických studiích byli pacienti ošetřeni topickým 4% lidokainem, lidokainem (2,5%) v kombinaci s prilokainem (2,5%) nebo jim bylo podáno 50 mg tramadolu. Anestetický krém musí být odstraněn před aplikací náplasti Qutenza a kůže musí být důkladně omyta a osušena. Porucha funkce ledvin a/nebo jater 2
3 U pacientů s poruchou funkce jater nebo ledvin není nutné dávkování upravovat. Pediatrická populace Bezpečnost a účinnost přípravku Qutenza u dětí od narození do 18 let nebyla stanovena. Údaje nejsou k dispozici. Způsob podání Pouze pro kožní podání. Opatření, která je nutno učinit před zacházením s léčivým přípravkem nebo před jeho podáním Po celou dobu manipulace s přípravkem Qutenza a při čištění léčených oblastí je nutné používat nitrilové rukavice. Latexové rukavice NELZE použít, protože neposkytují dostatečnou ochranu. Je doporučeno použití masky a ochranných brýlí, zvláště při aplikaci a odstraňování náplasti. Tato opatření mají být přijata, aby se zabránilo nechtěnému kontaktu s náplastmi nebo jiným materiálem, který byl v kontaktu s léčenou oblastí. Toto může vést k přechodnému erytému a pocitu pálení (zvláště sliznice mohou být citlivé), bolesti oka, podráždění očí a hrdla a kašli. Náplasti nesmějí být přidržovány v blízkosti očí nebo sliznic. Pokud je to nutné, ostříhejte ochlupení v postižené oblasti pro lepší přilnavost náplasti (neholte je). Léčenou oblast citlivě omyjte mýdlem a vodou. Po odstranění chlupů a omytí pokožku důkladně osušte. Návod k použití Přípravek Qutenza je náplast na jedno použití, kterou je možné zastřihnout do velikosti a tvaru léčené oblasti. Náplast Qutenza stříhejte před odstraněním ochranné folie. Ochranná folie NESMÍ být odstraněna dříve, než těsně před aplikací. Ochranná folie je kvůli snadnějšímu odstranění diagonálně přestřižena. Odtrhněte a přehněte část ochranné folie a přiložte adhezivní část potištěné náplasti na léčenou oblast. Přidržte náplast na místě. Jednou rukou pomalu a opatrně odlupujte ochrannou folii a zárověň druhou rukou náplast uhlazujte a přitlačujte na pokožku, aby bylo zaručeno úplné přilnutí náplasti na kůži, bez výskytu vzduchových bublin a vlhkosti. Při léčbě nohou mohou být náplasti Qutenza ovinuty okolo dorzální, laterální a plantární strany každé nohy, aby byla léčená oblast úplně zakryta. Aby přípravek Qutenza na léčené oblasti po celou dobu dobře držel, lze použít stahovací ponožky nebo obinadlo. Při odstraňování rolujte náplast Qutenza jemně a pomalu směrem dovnitř, aby riziko aerosolizace kapsaicinu bylo co nejmenší. Po odstranění přípravku Qutenza naneste na léčenou oblast dostatečné množství čisticího gelu a nechte jej působit po dobu alespoň jedné minuty. Čisticí gel setřete suchou gázou, aby byly veškeré zbytky kapsaicinu z pokožky odstraněny. Po setření čisticího gelu jemně omyjte léčenou oblast mýdlem a vodou. Akutní bolest v průběhu aplikace a po jejím skončení se léčí lokálním chlazením (jako je studený obklad) a perorálními analgetiky (např. krátkodobě působící opioidy). Opatření pro zacházení s léčebným materiálem a jeho likvidaci viz bod Kontraindikace 3
4 Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě Zvláštní upozornění a opatření pro použití Zdravotnický personál by měl při manipulaci s náplastmi a při čištění léčených oblastí používat nitrilové rukavice (viz bod 4.2). Je vhodné aplikovat náplast Qutenza v dobře větraných ošetřovnách. Zhodnocení stavu pokožky Přípravek Qutenza se používá pouze na suchou, neporušenou (zdravou) pokožku a nikoli na obličej, nad vlasovou linií hlavy a/nebo v blízkosti sliznic. U pacientů s bolestivou periferní neuropatií má být před každou aplikací náplasti Qutenza, a poté při každé další návštěvě, provedena vizuální kontrola nohou k detekci kožních lézí vztahujících se ke stávající neuropatii a cévní nedostatečnosti. Smyslové vnímání Při podávání náplastí Qutenza bylo hlášeno omezení smyslového vnímání. Snížení smyslového vnímání je obecně malé a dočasné (včetně stimulací teplem a ostrými předměty), nicméně v klinických studiích bolestivé diabetické neuropatie byl hlášen jeden případ přetrvávající hypoestezie. V tomto případě nemůže být vyloučena souvislost s náplastí Qutenza. U pacientů se sníženou citlovostí v nohách a dále u těch, u kterých je zvýšené riziko pro takové změny smyslového vnímání, musí být zvýšená opatrnost. Všichni pacienti s předchozím deficitem smyslového vnímání mají být před každou aplikací náplasti Qutenza klinicky vyšetřeni na příznaky ztráty smyslového vnímání. Pokud je ztráta smyslového vnímání detekována nebo došlo ke zhoršení, musí být vhodnost léčby náplastí Qutenza znovu zvážena. Sledování a péče při výskytu nežádoucích účinků v místě aplikace Nežádoucí účinky v místě aplikace, jako je přechodné lokální pálení v místě aplikace, bolest, erytém a pruritus, jsou časté nebo velmi časté. Dále byly u pacientů léčených kapsaicinovými náplastmi hlášeny případy popálenin, včetně popálenin druhého stupně. Viz bod 4.8. U pacientů se silnou bolestí musí být náplast odstraněna a kůže zkontrolována, zda nedošlo k chemickému popálení. Nezamýšlená expozice Pokud přípravek Qutenza přijde do kontaktu s pokožkou, která nemá být léčena, naneste čisticí gel, nechte jej působit po dobu jedné minuty a gel poté setřete suchou gázou, aby byly veškeré zbytky kapsaicinu z pokožky odstraněny. Po setření čisticího gelu omyjte danou oblast mýdlem a vodou. Pokud dojde k pálení očí, pokožky nebo dýchacích cest, odveďte postiženou osobu mimo dosah přípravku Qutenza. Oči nebo sliznice vypláchněte nebo omyjte proudem vody. Objeví-li se dušnost, poskytněte odpovídající lékařskou péči. Zvýšení krevního tlaku V důsledku toho, že léčba přípravkem Qutenza může být spojena se zvýšením intenzity bolesti, může během léčby a krátce po ní dojít k přechodnému zvýšení krevního tlaku (v průměru < 8,0 mm Hg). Krevní tlak je třeba v průběhu léčebného postupu sledovat. U pacientů s nestabilní nebo nedostatečně upravenou hypertenzí nebo s anamnézou kardiovaskulárního onemocnění by se před zahájením léčby přípravkem Qutenza mělo zvážit riziko nežádoucích kardiovaskulárních účinků způsobených stresem, který může být s tímto léčebným postupem spojen. Zvláštní péče by měla být věnována diabetickým pacientům se současným onemocněním koronárních tepen, hypertenzí a kardiovaskulární autonomní neuropatií. Dyskomfort spojený s léčbou 4
5 Pacientům, kteří pociťují bolest během a po aplikaci náplasti, je třeba poskytnout podpůrnou léčbu, jako je lokální chlazení nebo perorální analgetika (např. krátkodobě působící opioidy). Pacienti užívající vysoké dávky opioidů nemusejí odpovídat na perorální opioidy, podávané k léčbě akutní bolesti v průběhu a po skončení této léčebné procedury. U pacientů, u kterých je podezření na vysokou toleranci opioidů, je třeba před zahájením léčby přípravkem Qutenza pečlivě odebrat anamnézu a mít v záloze alternativní strategii mírnění bolesti. Čistící gel Čisticí gel pro přípravek Qutenza obsahuje butylhydroxyanisol, který může vyvolat topické kožní reakce (např. kontaktní dermatitidu) nebo podráždění očí a sliznic. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Žádné formální studie interakcí s jinými léčivými přípravky nebyly provedeny, neboť bylo prokázáno, že při podávání přípravku Qutenza se vyskytují pouze přechodné nízké hodnoty systémové absorpce. 4.6 Fertilita, těhotenství a kojení Těhotenství O podávání kapsaicinu těhotným ženám nejsou k dispozici žádné nebo pouze omezené údaje. Jak vyplývá z farmakokinetiky u lidí, která dokládá přechodnou nízkou systémovou expozici kapsaicinu, je pravděpodobnost, že přípravek Qutenza zvyšuje riziko vývojových abnormalit při podávání těhotným ženám, velmi nízká. Přesto je při předepisování těhotným ženám nutno postupovat opatrně. Kojení Není známo, zda se kapsaicin/metabolity vylučují do lidského mateřského mléka. Dostupné farmakologické/toxikologické údaje na zvířatech prokázaly vylučování kapsaicinu/metabolitů do mateřského mléka (viz bod 5.3). Riziko pro novorozence/kojence nelze vyloučit. Kojení by mělo být během léčby přípravkem Qutenza přerušeno. Fertilita Nejsou k dispozici údaje týkající se fertility u lidí. Studie reprodukční toxicity provedená u potkanů prokázala snížení počtu a procenta pohyblivých spermií a počtu těhotenství (viz bod 5.3). 4.7 Účinky na schopnost řídit a obsluhovat stroje Přípravek Qutenza nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. 4.8 Nežádoucí účinky Souhrn bezpečnostního profilu Z počtu 1826 pacientů léčených přípravkem Qutenza v randomizovaných kontrolovaných studiích jich 1089 (59,6 %) hlásilo nežádoucí účinky, které zkoušející posoudil jako související s léčivým přípravkem. Nejčastěji hlášenými nežádoucími účinky bylo přechodné pálení v místě aplikace, bolest, erytém a svědění. Nežádoucí účinky byly přechodné, spontánně odeznívající a obvykle mírné až 5
6 střední intenzity. Ve všech kontrolovaných hodnoceních přerušilo léčbu z důvodu nežádoucích účinků 2,0 % pacientů, kterým byl podáván přípravek Qutenza, a 0,9 % pacientů v kontrolní skupině. Tabulkový přehled nežádoucích účinků V tabulce 1 uvedené níže jsou všechny nežádoucí účinky, které se vyskytly v kontrolovaných klinických studiích u pacientů s postherpetickou neuralgií (PHN), bolestivou neuropatií spojenou s HIV (Human Immunodeficiency Virus - Associated Neuropathy HIV-AN) a bolestivou diabetickou periferní neuropatií, s incidencí větší než v kontrolní skupině a u více než jednoho pacienta, seřazeny podle tříd orgánových systémů a četnosti výskytu: velmi časté ( 1/10), časté ( 1/100 až < 1/10), méně časté ( 1/1 000 až < 1/100) a není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Tabulka 1: Tabulkový přehled nežádoucích účinků Třídy orgánových systémů a četnost výskytu Infekce a infestace Poruchy nervového systému Časté Poruchy oka Srdeční poruchy Cévní poruchy Respirační, hrudní a mediastinální poruchy Gastrointestinální poruchy Poruchy kůže a podkožní tkáně Poruchy svalové a kosterní soustavy a pojivové tkáně Časté Celkové poruchy a reakce v místě aplikace Velmi časté Časté Vyšetření Poranění, otravy,a procedurální komplikace Není známo Nežádoucí účinek Herpes zoster Pocit pálení Poruchy chuti, snížená citlivost Podráždění očí Atrio-ventrikulární (AV) blok prvního stupně, tachykardie, palpitace Hypertenze Kašel, dráždění v krku Nauzea Pruritus Bolest končetiny Svalové křeče Bolest v místě aplikace, erytém v místě aplikace Svědění v místě aplikace, papuly v místě aplikace, vezikuly v místě aplikace, edém v místě aplikace, otok v místě aplikace, suchost v místě aplikace Kopřivka v místě aplikace, parestézie v místě aplikace, dermatitida v místě aplikace, hyperestézie v místě aplikace, zánět v místě aplikace, reakce v místě aplikace, podráždění v místě aplikace, tvorba modřin v místě aplikace, periferní edém Zvýšený krevní tlak Popáleniny druhého stupně, náhodná expozice (včetně bolesti oka, podráždění oka a hrdla a kašle) Popis vybraných nežádoucích účinků 6
7 V klinických hodnoceních u zdravých dobrovolníků byly pozorovány dočasné, menší změny v detekci tepla (1 C až 2 C) a bodavé pocity v místě aplikace přípravku Qutenza. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. 4.9 Předávkování Nebyl hlášen žádný případ předávkování. Přípravek Qutenza musí být podáván lékařem nebo pod dohledem lékaře. Předávkování je tudíž nepravděpodobné. Předávkování může být spojeno s těžkými reakcemi v místě aplikace, např. bolestí, erytémem a svěděním v místě aplikace. V případě podezření na předávkování je třeba náplasti jemně odstranit, nanést čisticí gel, nechat jej působit po dobu jedné minuty a poté jej setřít suchou gázou a postiženou oblast jemně omýt mýdlem a vodou. Je-li to klinicky nutné, je třeba zahájit podpůrná opatření. Proti kapsaicinu neexistuje žádné antidotum. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Anestetika, ostatní topická anestetika, ATC kód: N01BX04 Mechanismus účinku Kapsaicin nebo 6-nonenamid, N-[(4-hydroxy-3-methoxyfenyl) methyl]-8-methyl-, (6E), je vysoce selektivní agonista vaniloidního receptoru TRPV1. Počátečním účinkem kapsaicinu je aktivace kožních nociceptorů exprimujících TRPV1, což vede k palčivosti a erytému v důsledku uvolnění vazoaktivních neuropeptidů. Farmakodynamické účinky Po expozici kapsaicinu se kožní nociceptory stávají méně citlivými na různé podněty. Tyto následné účinky kapsaicinu jsou často označovány jako desenzitizace a předpokládá se, že na jejich základě dochází k úlevě od bolesti. Předpokládá se, že vzruchy vedené kožními nervy, které neexprimují TRPV1, zůstávají nezměněny, včetně schopnosti detekovat mechanické a vibrační podněty. Kapsaicinem vyvolané změny v kožních nociceptorech jsou reverzibilní a u zdravých dobrovolníků bylo hlášeno a pozorováno, že normální funkce (detekce bolestivých vzruchů) se navrací během několika týdnů. Klinická účinnost a bezpečnost V kontrolovaných klinických studiích prováděných u pacientů s bolestivou neuropatií spojenou s Human Immunodeficiency Virus - Associated Neuropathy (HIV-AN) a bolestivou diabetickou periferní neuropatií byla prokázána účinnost jedné 30 minutové aplikace přípravku Qutenza na nohy. V kontrolovaných klinických studiích prováděných u pacientů s postherpetickou neuralgií (PHN) byla prokázána účinnost jedné 60 minutové dávky přípravku Qutenza na jiná místa než nohy. Zmírnění bolesti bylo pozorováno v 1. týdnu při PHN, v 2. týdnu při HIV-AN a ve 3. týdnu při bolestivé diabetické periferní neuropatii. U všech tří etiologií přetrvala účinnost po celou dobu trvání 12týdenní studie. U bolestivé diabetické periferní neuropatie byla prokázána stálá a opakovatelná účinnost při opakovaných léčbách během 52týdenní periody. 7
8 Bezpečnostní profil náplasti Qutenza u diabetických pacientů byl srovnatelný s populací bez diabetu. Bylo prokázáno, že přípravek Qutenza je při samostatném použití nebo při použití v kombinaci se systémovými léčivými přípravky pro léčbu neuropatické bolesti účinný. 5.2 Farmakokinetické vlastnosti Kapsaicin obsažený v přípravku Qutenza je určen pro kožní podání. Údaje z testů in vitro (rozpouštění léčivé látky a testy průniku kůží) ukázaly, že míra uvolňování kapsaicinu z přípravku Qutenza má během doby aplikace lineární charakter. Na základě studií in vitro se odhaduje, že do epidermálních a dermálních vrstev kůže se během jednohodinových aplikací absorbuje přibližně 1 % kapsaicinu. Jelikož je množství kapsaicinu uvolněného z náplasti za hodinu přímo úměrné velikosti plochy aplikace, odhaduje se, že celkové maximální možné dávce přibližně 7 mg odpovídá aplikační plocha o velikosti 1000 cm 2. Za předpokladu, že se z náplasti o ploše 1000 cm 2 aplikované pacientovi o hmotnosti 60 kg uvolní a vstřebá přibližně 1 % kapsaicinu obsaženého v náplasti, je maximální možná expozice kapsaicinu přibližně 0,12 mg/kg jednou za 3 měsíce. Podle Vědeckého výboru EK pro potraviny je v Evropě průměrný perorální příjem kapsaicinu 1,5 mg/den (0,025 mg/kg/den pro osobu o hmotnosti 60 kg) a nejvyšší potravinová expozice je 25 až 200 mg/den (až 3,3 mg/kg/den pro osobu o hmotnosti 60 kg). Z farmakokinetických údajů u člověka vyplývá, že po 60 minutové aplikaci přípravku Qutenza dochází k přechodné, nízké (< 5 ng/ml) systémové expozici kapsaicinu přibližně u jedné třetiny pacientů s postherpetickou neuralgií (PHN), u 3 % pacientů s bolestivou diabetickou periferní neuropatií a u žádného pacienta s neuropatií spojenou s HIV (HIV-AN). Pro 30 minutovou aplikaci nejsou k dispozici žádné údaje. Počet pacientů s PHN se systémovou expozicí kapsaicinu obecně rostl s větší plochou aplikace a s delší dobou léčby. Nejvyšší hodnota koncentrace kapsaicinu zjištěná u pacientů léčených po dobu 60 minut činila 4,6 ng/ml, jenž byla naměřena okamžitě po odstranění přípravku Qutenza. Nejměřitelnější hodnoty byly pozorovány v okamžiku odstranění přípravku Qutenza s jasnou tendencí k jejich poklesu do 3 až 6 hodin po odstranění přípravku. U žádného z pacientů nebyly pozorovány zjistitelné hladiny metabolitů. Populační farmakokinetická analýza pacientů léčených po dobu 60 a 90 minut ukázala, že hladiny kapsaicinu v plazmě dosahovaly nejvyšších hodnot přibližně po 20 minutách po odstranění přípravku Qutenza a klesaly velmi rychle se středním poločasem eliminace kolem 130 minut. 5.3 Předklinické údaje vztahující se k bezpečnosti Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po jedné dávce a toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka. Studie genotoxicity provedené s kapsaicinem prokazují slabou mutagenní reakci v testu myšího lymfomu a negativní odpovědi v Amesově testu, v mikronukleovém testu u myší a v testu chromozomální aberace u lidských lymfocytů z periferní krve. Studie kancerogenity provedená u myší naznačuje, že kapsaicin není kancerogenní. Studie reprodukční toxicity provedená u potkanů prokázala statisticky významné snížení počtu a procenta pohyblivých spermií u potkanů léčených 3 hodiny denně od 28. dne před kohabitací, během kohabitace a až do dne před utracením. Index plodnosti a počet těhotenství na počet potkanů v kohabitaci byl u všech skupin léčených kapsaicinem nižší, i když nešlo o statisticky významné hodnoty ani o hodnoty závislé na dávce. Teratologická studie provedená na králících neprokázala žádné embryofetální toxické účinky. Opožděné osifikace kostí (menší počet osifikovaných metatarsů) se v teratologické studii na potkanech vyskytly při dávkách vyšších, než jsou terapeutické dávky u lidí; význam tohoto zjištění 8
9 pro člověka není znám. Perinatální a postnatální toxikologické studie provedené na potkanech neprokázaly reprodukční toxicitu. U laktujících potkanů vystavených přípravku Qutenza denně po dobu 3 hodin se prokázaly měřitelné hodnoty kapsaicinu v mateřském mléce. Ve studii kožní senzibilizace u morčat byla pozorována mírná senzibilizace. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Náplast Matrice: adhezivní dimetikon diethylenglykol-monoethylether dimetikon ethylcelulóza N50 (E462) Krycí folie: polyesterová krycí fólie inkoust obsahující oxid titaničitý Snímatelný ochranný film: snímatelná polyesterová fólie Čisticí gel makrogol 300 karbomer čištěná voda hydroxid sodný (E524) dihydrát dinatrium-edetátu butylhydroxyanisol (E320) 6.2 Inkompatibility Neuplatňuje se. 6.3 Doba použitelnosti 4 roky Po otevření sáčku: použijte přípravek Qutenza do 2 hodin 6.4 Zvláštní opatření pro uchovávání Qutenza kožní náplast: Uchovávejte ve vodorovné poloze v původním sáčku a papírové skládačce (krabičce). Uchovávejte při teplotě do 25 C. Čisticí gel: Uchovávejte při teplotě do 25 C. 6.5 Druh obalu a obsah balení Náplast Qutenza je uchovávána v sáčku z hliníkové folie potažené papírem s tepelně zatavenou vrstvou z kopolymeru akrylonitrilu a kyseliny akrylové. 9
10 Přípravek Qutenza je dostupný v sadě obsahující jednu nebo dvě samostatně zabalené náplasti a 50 g tubu čisticího gelu. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Zdravotnický personál by měl při manipulaci s náplastmi a při čištění léčených oblastí použít nitrilové rukavice. Je doporučeno použití masky a ochranných brýlí, viz bod 4.2. Použité a nepoužité náplasti a veškerý další materiál, který byl v kontaktu s léčenou oblastí, uzavřete do polyethylenového sáčku na zdravotnický odpad a uložte jej ihned po použití do příslušné nádoby pro zdravotnický odpad. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Astellas Pharma Europe B.V. Sylviusweg BE Leiden Nizozemsko 8. REGISTRAČNÍ ČÍSLO(A) EU/1/09/524/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 15. května 2009 Datum posledního prodloužení registrace: 15. května DATUM REVIZE TEXTU 8/2015 Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky 10
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
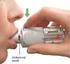
APLIKACE PŘÍPRAVKU QUTENZA
 APLIKACE PŘÍPRAVKU QUTENZA KARIM Centrum pro léčbu bolesti, FN PLZEŇ Mgr. Zapletalová V., Bc. Boušová V., Bc. Weinerová J., Andělová I., MUDr.Lejčko, MUDr. Machart LÉKOVÁ FORMA A SLOŽENÍ kožní náplast
APLIKACE PŘÍPRAVKU QUTENZA KARIM Centrum pro léčbu bolesti, FN PLZEŇ Mgr. Zapletalová V., Bc. Boušová V., Bc. Weinerová J., Andělová I., MUDr.Lejčko, MUDr. Machart LÉKOVÁ FORMA A SLOŽENÍ kožní náplast
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
Informace k předepisování a použití přípravku Qutenza TM (kapsaicin) (Verze 4.1.; Duben 2015)
 EDUKAČNÍ MATERIÁL Qutenza (kapsaicin) 8% náplast Informace k předepisování a použití přípravku Qutenza TM (kapsaicin) (Verze 4.1.; Duben 2015) Materiál pro minimalizaci rizik týkající se 8% náplasti Qutenza
EDUKAČNÍ MATERIÁL Qutenza (kapsaicin) 8% náplast Informace k předepisování a použití přípravku Qutenza TM (kapsaicin) (Verze 4.1.; Duben 2015) Materiál pro minimalizaci rizik týkající se 8% náplasti Qutenza
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls105115/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imazol krémpasta 10 mg/g Kožní pasta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram pasty obsahuje clotrimazolum 10 mg. Pomocné
sp.zn.: sukls105115/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Imazol krémpasta 10 mg/g Kožní pasta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram pasty obsahuje clotrimazolum 10 mg. Pomocné
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
4.2 Dávkování a způsob podání Dospělí a děti Fucidin H krém se aplikuje na postižená místa na kůži 3 krát denně po dobu maximálně 2 týdnů.
 sp.zn. sukls65852/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin H krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 20,35 mg/g (odpovídá acidum fusidicum 20 mg/g), hydrocortisoni
sp.zn. sukls65852/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin H krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 20,35 mg/g (odpovídá acidum fusidicum 20 mg/g), hydrocortisoni
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje celkem 179 mg capsaicinum, tedy
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. APIGUARD gel (25% Thymolum) pro podání ve včelím úlu
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka se známým účinkem: 1 g masti obsahuje 2 mg kyseliny sorbové.
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls51148/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls51148/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls45024/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Wartec cream 1,5 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje podophyllotoxinum 1,5 mg. Pomocná látka se
sp.zn. sukls45024/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Wartec cream 1,5 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje podophyllotoxinum 1,5 mg. Pomocná látka se
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
BEPANTHEN 50 mg/g Krém
 sp.zn. sukls12978/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BEPANTHEN 50 mg/g Krém 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje: Dexpanthenolum 50 mg Pomocné látky se známým
sp.zn. sukls12978/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BEPANTHEN 50 mg/g Krém 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje: Dexpanthenolum 50 mg Pomocné látky se známým
3. LÉKOVÁ FORMA mast Bílá homogenní emulze(voda/olej) s charakteristickým zápachem po tuku z ovčí vlny.
 sp.zn. sukls228214/2012 a sp.zn. sukls102376/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BEPANTHEN 50 mg/g mast 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje: Dexpanthenolum 50
sp.zn. sukls228214/2012 a sp.zn. sukls102376/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BEPANTHEN 50 mg/g mast 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje: Dexpanthenolum 50
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje capsaicinum 179 mg (což odpovídá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Qutenza 179 mg kožní náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna náplast o velikosti 280 cm 2 obsahuje capsaicinum 179 mg (což odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls179582/2010 a sp.zn. sukls251297/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocné látky
sp.zn. sukls179582/2010 a sp.zn. sukls251297/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
sp.zn.: sukls49677/2013
 sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
Příloha č.2 ke sdělení sp.zn.sukls7045/2013
 Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Picato, 150 mikrogramů/g gel 2. KVALITATIVNÍ A KVANITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje ingenoli mebutas 150 μg. Jedna tuba obsahuje ingenoli
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Picato, 150 mikrogramů/g gel 2. KVALITATIVNÍ A KVANITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje ingenoli mebutas 150 μg. Jedna tuba obsahuje ingenoli
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls103137/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole Grindeks 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
sp.zn. sukls103137/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole Grindeks 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls108322/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTISTAX 360 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje: Vitis viniferae folii extractum
sp.zn. sukls108322/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTISTAX 360 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje: Vitis viniferae folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls86344/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta Venorutonu Forte obsahuje 500 mg oxerutinum (O-beta-hydroxyethyl-rutosid).
sp.zn. sukls86344/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta Venorutonu Forte obsahuje 500 mg oxerutinum (O-beta-hydroxyethyl-rutosid).
sp.zn. sukls91035/2010
 sp.zn. sukls91035/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole MD-Pharm 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
sp.zn. sukls91035/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole MD-Pharm 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Světle modré, kulaté, bikonvexní obalené tablety, průměr přibližně 12,4 mm, výška přibližně 7,5 mm.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
4.3. Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
 sp.zn. sukls52904/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 7,5 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocná látka se známým účinkem:
sp.zn. sukls52904/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 7,5 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocná látka se známým účinkem:
sp.zn.: sukls76674/2014
 sp.zn.: sukls76674/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX 125 mikrogramů/dávka, nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml roztoku.
sp.zn.: sukls76674/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX 125 mikrogramů/dávka, nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml roztoku.
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/15 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Pruban 0,1 % krém pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Resocortoli butyras 3. LÉKOVÁ FORMA
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/15 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Pruban 0,1 % krém pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Resocortoli butyras 3. LÉKOVÁ FORMA
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Qutenza 179 mg kožní náplast capsaicinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Qutenza 179 mg kožní náplast capsaicinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Qutenza 179 mg kožní náplast capsaicinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou
3. LÉKOVÁ FORMA Léková forma: gel Popis přípravku: bezbarvý, čirý až mírně opalizující homogenní gel charakteristického zápachu po isopropylalkoholu
 Příloha č. 3 ke sdělení sp.zn. sukls65242/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOLMINA GEL 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný seznam
Příloha č. 3 ke sdělení sp.zn. sukls65242/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOLMINA GEL 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný seznam
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele Qutenza 179 mg kožní náplast capsaicinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele Qutenza 179 mg kožní náplast capsaicinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Úplný seznam pomocných látek viz bod 6.1. Čirý žluto-hnědý sirup s charakteristickou příchutí medu a citronu.
 Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pevaryl 10 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje econazoli nitras 1,0 g Pomocné látky se známým účinkem: butylhydroxyanisol,
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pevaryl 10 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje econazoli nitras 1,0 g Pomocné látky se známým účinkem: butylhydroxyanisol,
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls18536/2013, sp.zn.sukls149913/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON 300 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka přípravku VENORUTON 300 obsahuje
sp.zn.sukls18536/2013, sp.zn.sukls149913/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON 300 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka přípravku VENORUTON 300 obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls4008/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN nosní sprej, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 2.1. Obecný popis sterilní
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls4008/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN nosní sprej, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 2.1. Obecný popis sterilní
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls56216/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septabene 1,5 mg/ml + 5,0 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje, roztoku obsahuje
Sp. zn. sukls56216/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septabene 1,5 mg/ml + 5,0 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje, roztoku obsahuje
Přípravek Neo-angin třešeň je určen pro dospělé, dospívající a děti od 6 let.
 sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls243280/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dorsiflex 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mephenoxalonum 200 mg. Úplný seznam pomocných
sp.zn. sukls243280/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dorsiflex 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje mephenoxalonum 200 mg. Úplný seznam pomocných
Kvasinkové infekce kůže, zvláště způsobené rodem Candida (např. Candida albicans).
 sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
Dospělí Postižené oblasti by měly být před aplikací krému nejprve důkladně omyty vodou a mýdlem a vysušeny.
 sp.zn. sukls77451/2011 a sp.zn. sukls27901/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU WARTEC CREAM Krém 2. SLOŽENÍ KVALITATIVNÍ I KVANTITATIVNÍ Léčivá látka: podophyllotoxinum 1,5 mg/g krému. Úplný
sp.zn. sukls77451/2011 a sp.zn. sukls27901/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU WARTEC CREAM Krém 2. SLOŽENÍ KVALITATIVNÍ I KVANTITATIVNÍ Léčivá látka: podophyllotoxinum 1,5 mg/g krému. Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls76878/2017 1. NÁZEV PŘÍPRAVKU SMECTA 3 g prášek pro perorální suspenzi SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje diosmectitum 3 g. Pomocné látky
sp. zn. sukls76878/2017 1. NÁZEV PŘÍPRAVKU SMECTA 3 g prášek pro perorální suspenzi SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje diosmectitum 3 g. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil DermGel Gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 mg terbinafini
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil DermGel Gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 mg terbinafini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls204068/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej Kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini hydrochloridum
sp.zn.sukls204068/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej Kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
SOUHRN ÚDAJU O PŘÍPRAVKU. 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá 0,436 mg epinastinum)
 Příloha č. 1. NÁZEV PŘÍPRAVKU PURIVIST 0,5 mg/ml oční kapky, roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá
Příloha č. 1. NÁZEV PŘÍPRAVKU PURIVIST 0,5 mg/ml oční kapky, roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá
