2.11 Vlastnosti látek. (Skupenství, rozpustnost, hoření, rozklad) Projekt Trojlístek
|
|
|
- Pavla Silvie Vacková
- před 7 lety
- Počet zobrazení:
Transkript
1 2. Vlastnosti látek a chemické reakce 2.11 Vlastnosti látek. (Skupenství, rozpustnost, hoření, rozklad) Projekt úroveň 1 2 3
2 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ (8. a 9. třída) a nižší ročníky osmiletých gymnázií (tercie a kvarta). 2. stupeň ZŠ (8. a 9. třída) Osmiletá gymnázia (tercie a kvarta) 3. Abstrakt Předvedení rozmanitých vlastností chemických sloučenin, látek a materiálů, jejichž znalost je nezbytná pro práci s nimi. Poznáváme různé vlastnosti látek. 4. Startovní znalosti žáků Předpokládáme znalosti načerpané v 1. a 2. stupni ZŠ v předmětech Prvouka, Vlastivěda, Přírodopis, Fyzika, Chemie a rovněž obecné znalosti jevů každodenního života z oblasti člověk a příroda (individuální látky, jejich směsi, látky anorganické a organické, rozpustnost, barva a chuť, hořlavost, hoření a hašení aj.). Co mají žáci znát: látky a jejich směsi; rozpustnost; barva a chuť; hoření a hašení. 5. Cílové znalosti žáků, nabyté vědomosti, přínos Provedení jednoduchých ukázek a experimentů doplní teoretickou přípravu k předmětu i k laboratorní technice a položí základy správné laboratorní praxe, bezpečnosti práce a požární ochrany. Seznámí žáky s nutností dodržovat pravidla bezpečné práce a používat osobní ochranné pracovní prostředky (brýle, plásť, rukavice apod.). Znalost povahy a vlastností látek je nezbytná pro práci a nakládání s nimi. Získané znalosti a zkušenosti jsou přenositelné do běžného každodenního života, neboť chemické látky a přípravky se dnes vyskytují v takřka každé domácnosti, kde se skladují, pracuje se s nimi a jejich odpady a obaly se likvidují. Mnoho domácích nehod či úrazů spojených s prací s chemikáliemi často pramení z nevědomosti a neznalosti povahy používaných látek. Těm je možno předcházet například již pouhým přečtením etikety a přizpůsobením práce uvedeným doporučením. Co se žáci dozví: Co je chemická látka. Typy skupenství. Volba rozpouštědla. Rozpustnost. Rozpouštění a rozklad. Hořlavost. Hoření a hašení. Skladování. Likvidace odpadů a obalů. Používání osobních ochranných pracovních pomůcek. Pravidla bezpečné práce. 2
3 6. Chemikálie, pomůcky a vybavení 6.1 Použité chemikálie Benzín technický Aceton CH 3 COCH 3 Ethanol CH 3 CH 2 OH Toluen C 6 H 5 CH 3 Jod I 2 Síran měďnatý pentahydrát CuSO 4.5H 2 O Kyselina sírová H 2 SO 4 Voda H 2 O(l) Led H 2 O(s) DŮLEŽITÉ: Co budu potřebovat, co si mám nachystat, připravit, nakoupit! Na co nesmím zapomenout! 6.2 Pomůcky a laboratorní vybavení Laboratorní kahan (nebo propan-butanový kahan + kartuše) Zápalky Elektrický vařič Laboratorní špachtle Pinzeta (nebo laboratorní kleště) Kádinka 400 ml Kádinka 100 ml Hodinové sklo Pipeta Pipetovací balónek Zkumavka Držák na zkumavky Skleněná tyčinka Dělicí nálevka 250 ml se zátkou Laboratorní stojan Kruh Svorka křížová Bavlněná textilie Syntetická textilie (polyamidová tkanina, polyesterová tkanice) Cukr kostkový a cukr krystal Sůl kamenná (kuchyňská) Cigaretový popel Svíčka Hasicí přístroj práškový (CO 2 ) Plastové pohárky 50 ml 6.3 Přístrojové vybavení Provedení experimentu nevyžaduje použití laboratorních měřicích přístrojů. 3
4 7. Časový harmonogram 7.1 Příprava experimentu Do doby přípravy experimentu je nutno zahrnout shromáždění výše uvedených chemikálií, pomůcek a nádobí. Časy: Shromáždění pomůcek, nádobí a chemikálií odhadujeme na maximálně 15 minut. 7.2 Realizace experimentu Doba realizace ukázek a pokusů je odvislá od počtu experimentů vybraných z níže uvedené nabídky (kap. 8). Časy: Realizaci pokusů zaměřených na výklad a demonstraci rozmanitých vlastností látek a jejich směsí doporučujeme věnovat celou vyučovací hodinu (45 minut). ČASY: 15 minut 45 minut 8. Laboratorní postup 8.1 Skupenství Učitel seznámí žáky s příklady běžných látek rozdílných skupenství, znalosti rozšíří o skupenství prvků periodické tabulky (může ukázat dostupné příklady): plynné látky (vzduch, vodní pára, zemní plyn, propan-butan, acetylen, vodík, dusík, kyslík, fluor, chlor, vzácné plyny), kapalné látky (voda, ethanol, aceton, toluen, benzín, jediné dva kapalné prvky brom a rtuť), tuhé látky (led, grafit, železo, měď, hliník, cín, další nekovy a kovy). Výklad učitel doplní o teplotní změny (teplota tání, varu) a tepelné požadavky skupenských změn (skupenské teplo tání, výparné teplo apod.). Tání ledu, var vody a kondenzace páry Do kádinky o objemu 400 ml vneseme několik kostek ledu, pozorujeme změnu skupenství (tání). Následně kádinku umístíme na elektrický vařič a vodu zahříváme, pozorujeme změnu skupenství (var). Kádinku zakryjeme hodinovým sklem a pozorujeme změnu skupenství (kondenzace). 4
5 8.2 Barevnost Učitel připraví ukázku bezbarvých a barevných látek, zdůrazní možnost vizuálního posouzení identity nebo kvality látek. Výklad doplní o důvody barevnosti látek (pohlcování viditelného záření). Bezbarvá sacharóza a modrá modrá skalice Pozorujeme barevnost cukru (bezbarvý) a síranu měďnatého (modré zbarvení). 8.3 Chuť V kuchyni pracujeme obvykle s látkami určenými ke konzumaci. Pokud vizuální posouzení selhává, můžeme k rozlišení použít jiný ze smyslů, tedy chuť. Cukr a sůl Následující pokus situujeme do učebny, neprovádíme jej v laboratoři. Zrakem se pokusíme rozlišit krystalový cukr a kuchyňskou sůl umístěné v 50 ml plastových pohárcích. Posléze ochutnáme několik krystalků každé z obou látek a porovnáme s výsledky vizuálního zkoumání. 8.4 Vůně a zápach Vůně či zápach jsou silně individuální čichové vjemy. Čich je možno rovněž použít k hrubému posouzení známých látek. Učitel seznámí žáky se správným postupem čichového testování. Různé vůně Otevřenou láhev s neznámou látkou držíme v ruce ve výši prsou asi 50 cm od obličeje. Lehkým mávnutím volné ruky od hrdla láhve směrem k obličeji přineseme malé množství výparů od láhve k nosu. Opatrně, nikoli zhluboka, vdechneme malé množství takto zředěných výparů. Tímto způsobem můžeme posoudit některé běžně používané látky, jako jsou voda, ethanol, aceton, benzín, toluen apod. 8.5 Látka anorganická vs. organická Pro jednoduché odlišení anorganické látky od látky organické můžeme použít zkoušku v plameni. Zkouška v plameni Malé množství chloridu sodného (kuchyňské soli) nabereme na laboratorní špachtli a přiblížíme k plameni laboratorního kahanu. Pozorujeme změny krystalů na špachtli. Stejný pokus provedeme také se sacharózou (např. cukr krystal). 5
6 8.6 Hoření a požár Hoření je chemická reakce, jejíž podstatou je oxidace organické látky nebo organického materiálu kyslíkem (na vzduchu). Při hoření se uvolňuje velké množství tepla a vznikají zplodiny hoření. Neopatrnou manipulací s hořlavinou v blízkosti plamene nebo zdroje tepla může dojít k požáru. Učitel seznámí žáky se základními hořlavinami používanými v laboratoři (ethanol, aceton, diethylether, benzín, toluen, kyselina octová aj.) a se zásadami práce při jejich skladování a při manipulaci s nimi. Hoření tkanin Do pinzety nebo laboratorních kleští uchopíme malý proužek tkaniny (5 2 cm proužek látky, 5 cm tkaničky apod.) a umístíme k plameni kahanu. Otestujeme přírodní tkaninu (bavlna) a syntetickou tkaninu (polyester, polyamid, polypropylen aj.). Pozorujeme rozdíly v hoření, barvu plamene, zplodiny hoření a zbytky hoření (popel apod.). Zplodiny hoření Pokus realizujeme na volném otevřeném prostranství (školní dvůr apod.) nebo event. v laboratorní digestoři. Na nehořlavou nesavou podložku (betonová dlažba ev. obkladačka laboratorního stolu v digestoři) vylijeme asi 5 až 10 ml hořlavé kapaliny (ethanol, aceton, benzín, toluen aj.) a s nejvyšší opatrností podpálíme zápalkou. Necháme volně dohořet. Pozorujeme způsob a rychlost hoření, barvu plamene a množství uvolňovaných sazí. Zapálíme svíčku. Do plamene vložíme na několik sekund skleněnou tyčinku a po vyjmutí pozorujeme množství sazí. Postupně vkládáme tyčinku do různých míst v plameni. Hoří kostka cukru? Na hodinové sklo umístíme kostku cukru a zápalkou se ji snažíme zapálit. Poté kostku obalíme v cigaretovém popelu a opět ji na hodinovém skle zapálíme. 8.7 Hašení Učitel seznámí žáky s povinnostmi osob při vzniku požáru a se způsoby hašení drobných požárů v laboratoři. Hašení požáru Na nehořlavou nesavou podložku (betonová dlažba ev. obkladačka laboratorního stolu v digestoři) vylijeme asi 2 až 5 ml ethanolu a s nejvyšší opatrností podpálíme zápalkou. Uhasíme vlhkým hadrem. 6
7 Podobně vylijeme 5 až 10 ml ethanolu, podpálíme a opatrně uhasíme práškovým hasicím přístrojem. Do zkumavky odměříme asi 1 až 2 ml ethanolu, zkumavku umístíme do držáku zkumavek a opatrně za míchání zahříváme nad kahanem. Neprodleně po vzplanutí uvolňovaných par ethanolu hoření zastavíme sfouknutím plamene nebo zakrytím hrdla zkumavky hodinovým sklem či vlhkým hadrem. 8.8 Rozpustnost a polarita Do 250 ml dělicí nálevky vneseme laboratorní špachtlí malé množství síranu měďnatého CuSO 4 a jodu I 2. Přidáme 50 ml vody a 10 ml benzínu, protřepeme a děličku zavěsíme do kruhu na stojan. Po rozdělení kapalin vyhodnotíme rozpustnost obou rozpouštěných látek. 8.9 Rozklad Do 100 ml kádinky umístíme kostku cukru a pipetou přidáme 1 ml koncentrované kyseliny sírové. Pozorujeme chování směsi. 9. Princip experimentu Barevnost Barevnost látek způsobuje jejich interakce s elektromagnetickým zářením, konkrétně viditelným světlem. Některé látky pohlcují část viditelného světla a část odrážejí a lidskému oku se tak jeví jako barevné. Látka anorganická vs. organická Tuhé organické látky obvykle tají (nebo ev. podléhajií rozkladu) při teplotách zhruba do 300 až 350 C (t. t. vitamínu C je 192 C, sacharózy 186 C, naftalenu 80 C, kyseliny acetylsalicylové 135 C). Naopak velká většina tuhých anorganických látek podléhá tání při vysokých teplotách (t. t. železa 1535 C, uhličitanu vápenatého 1282 C, chloridu sodného 800 C). Přiblížením krystalů organické látky k plameni kahanu dojde k tání této látky (nebo ev. k rozkladu, zuhelnatění), naopak většina anorganických tuhých látek tát nebude. Takto můžeme s určitou pravděpodobností určit, zda se jedná o látku organickou nebo anorganickou. Hoření Organické látky se jsou tvořeny atomy uhlíku, vodíku a dalšími heteroatomy, kterými jsou často kyslík, síra, dusík, fosfor aj. Hořením organické látky vzniká vždy oxid uhličitý CO 2 a voda H 2 O. Při nedokonalém spalování vzniká vedle oxidu uhličitého 7
8 CO 2 i oxid uhelnatý CO a uhlík C. Vznikající uhlík pozorujeme ve formě sazí. Při hoření vzniká tím větší množství sazí, čím větší množství uhlíku na úkor dalších prvků je v hořící látce. Například molekulu toluenu C 6 H 5 CH 3 tvoří atomy uhlíku C a vodíku H v hmotnostních poměrech 91,3 % C a 8,7 % H. V molekule ethanolu C 2 H 5 OH jsou atomy C, H a O přítomné v hmotnostních poměrech 52,2 % C, 13,0 % H a 34,8 % O. Hořením toluenu tedy vzniká větší množství sazí. Sacharóza (řepný cukr) hoří poměrně nesnadno, je málo hořlavá. Hoření kostky cukru velmi usnadní její obalení v cigaretovém popelu. Přítomná stopová množství kovů pocházející z popela katalyzují oxidativní proces. Rozpustnost a polarita Empirická poučka praví, že podobné se rozpouští v podobném. Podobností se rozumí polarita rozpouštědla a rozpouštěné látky. Rozpouštědlem s nejvyšší polaritou je voda, mezi polární rozpouštědla dále řadíme alkoholy, kyseliny nebo estery, slabě polární jsou například ethery a nepolární jsou uhlovodíky jako hexan, heptan, cyklohexan aj. Z použitých látek se síran měďnatý CuSO 4 jako snadno disociovatelná sůl dobře rozpouští ve vodě a nepolární jod I 2 se naopak dobře rozpouští v nepolárním benzínu, který je směsí uhlovodíků. Rozklad Organický materiál (organická sloučenina nebo směs, rostlinná nebo živočišná tkáň) se působením silných minerálních kyselin rozkládá, mineralizuje. Průvodním jevem procesu je zuhelnatění rozkládaného materiálu. 10. Bezpečnost práce Kromě dodržování zásad bezpečné práce a hygieny práce je nutné seznámit se s povahou použitých chemických látek, se způsoby jejich likvidace a také s nutnými úkony, které je třeba provést v případě poškození zdraví. Pracujeme v dobře větrané místnosti, v některých případech i v otevřeném závětrném prostranství. Výčet všech výstražných symbolů nebezpečnosti, standardních vět o nebezpečnosti (H věty) a pokynů pro bezpečné zacházení (P věty) přesahuje rámec tohoto dokumentu. Věnujte proto zvýšenou pozornost bezpečnostním opatřením uvedeným na obalech použitých chemikálií a přizpůsobte jim způsob práce. Používejte rovněž nezbytné osobní ochranné pracovní pomůcky. Seznamte se s bezpečnostními listy a mějte je k dispozici. 8
9 V případě poškození zdraví postiženého ošetřete dle zásad první pomoci, postupujte rovněž podle pokynů uvedených v bezpečnostních listech. Použité chemikálie shromažďujte v uzavřených tmavých obalech a na dobře větraném místě a společně s vyprázdněnými obaly je předejte k likvidaci (sběrný dvůr, periodický svoz nebezpečného odpadu v místě bydliště, likvidační firma apod.). 11. Poznámky ke strategii výuky Souhrn předkládaných pokusů k ilustrování základních vlastností chemických látek doporučujeme předvádět žákům jako sled demonstrací. Většina z nich se nehodí k individuálnímu nebo skupinovému provádění žáky. V průběhu přípravy a realizace pokusů je vhodné činnosti doprovázet výkladem principů jednotlivých jevů a dále výkladem zásad bezpečné práce a požární ochrany. Pokusy doporučujeme provádět v otevřeném závětrném prostranství a v dostatečné vzdálenosti od hořlavých předmětů. Jen některé z pokusů můžeme provádět v laboratoři. 12. Přínos Žáci se seznámí s některými důležitými vlastnostmi chemických látek, jejichž znalost je nezbytná pro práci v chemické laboratoři a znalost některých z nich dokonce i v běžném každodenním životě. Naučí se jednoduše a s pomocí smyslových orgánů, jako jsou zrak, čich a ve výjimečných případech i chuť, rozeznávat nebo identifikovat chemické látky. Na základě vlastností látek se žáci naučí odhadnout jejich schopnost rozpouštět nebo se rozpouštět. Naučí se posoudit dle chemické struktury látek jejich hořlavost a způsob jejich hoření a také jejich hašení. Seznámí se se způsoby hašení dle typu hořícího materiálu a rovněž dle jeho množství. 13. Fotografie Počáteční a finální stav experimentu můžeme dokumentovat pořízením fotografií. Průběh krátkých pokusů můžeme natočit videokamerou nebo fotoaparátem. 9
2.03 Endotermní/exotermní děje. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.03 Endotermní/exotermní děje. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina
2. Vlastnosti látek a chemické reakce 2.03 Endotermní/exotermní děje. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina
5.06 Teichmanovy krystaly (důkaz krve). Projekt Trojlístek
 5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
5. Forenzní chemie (chemie v kriminalistice) 5.06 Teichmanovy krystaly (důkaz krve). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
5.03 Hoření. Projekt Trojlístek
 5. Forenzní chemie (chemie v kriminalistice) 5.03 Hoření. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
5. Forenzní chemie (chemie v kriminalistice) 5.03 Hoření. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
2. Vlastnosti látek a chemické reakce 2.01 Aerobní/anaerobní reakce aneb kvasinky v akci. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
1.03 Důkaz tuků ve stravě. Projekt Trojlístek
 1. Chemie a společnost 1.03 Důkaz tuků ve stravě. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena
1. Chemie a společnost 1.03 Důkaz tuků ve stravě. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena
3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt Trojlístek
 3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
3. Separační metody 3.02 Dělení směsí, aneb i separace může být legrace (filtrace). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2.
2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
2. Vlastnosti látek a chemické reakce 2.12 Vyvíjení CO 2 bublinky kolem nás. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
1.08 Tvrdost vody. Projekt Trojlístek
 1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
1. Chemie a společnost 1.08. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky 2. stupně ZŠ
2.10 Pomědění hřebíků. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.10 Pomědění hřebíků. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
2. Vlastnosti látek a chemické reakce 2.10 Pomědění hřebíků. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
3.04 Extrakce lipidů. Projekt Trojlístek
 3. Separační metody 3.04 Extrakce lipidů. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
3. Separační metody 3.04 Extrakce lipidů. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu
 Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
Téma : Uhlovodíky Areny Toluen a naftalen Název : Vlastnosti toluenu a naftalenu Typ pokusu : demonstrační Princip : Areny starším názvem aromatické uhlovodíky, vzaly tento svůj název podle své typické
2.09 Oxidačně-redukční vlastnosti glukózy. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.09 Oxidačně-redukční vlastnosti glukózy. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
2. Vlastnosti látek a chemické reakce 2.09 Oxidačně-redukční vlastnosti glukózy. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová
2.07 Krystalizace. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.07 Krystalizace. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
2. Vlastnosti látek a chemické reakce 2.07 Krystalizace. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je
1.05 Chladicí směsi. Projekt Trojlístek
 1. Chemie a společnost 1.05 Chladicí směsi. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
1. Chemie a společnost 1.05 Chladicí směsi. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
5.02 Hledání stop ninhydrinem (otisky prstů). Projekt Trojlístek
 5. Forenzní chemie (chemie v kriminalistice) 5.02 Hledání stop ninhydrinem (otisky prstů). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
5. Forenzní chemie (chemie v kriminalistice) 5.02 Hledání stop ninhydrinem (otisky prstů). Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY
 LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
LABORATORNÍ PRÁCE Č. 6 PRÁCE S PLYNY Mezi nejrozšířenější práce s plyny v laboratoři patří příprava a důkazy oxidu uhličitého CO 2, kyslíku O 2, vodíku H 2, oxidu siřičitého SO 2 a amoniaku NH 3. Reakcí
Zjišťování vlastností různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce)
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Zjišťování í různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce) Označení: EU-Inovace-Ch-8-01 Předmět:
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.128/02.0055 Zjišťování í různorodých látek pomocí žákovské soupravy pro chemii (laboratorní práce) Označení: EU-Inovace-Ch-8-01 Předmět:
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. KRAJSKÉ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 KRAJSKÉ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (60 bodů) Úloha 1 Vlastnosti prvků 26
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Chemie ukázka chemického skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce práce s dostupnými a běžně používanými látkami (směsmi). Na základě piktogramů žák posoudí nebezpečnost
Vlastnosti kyseliny sírové
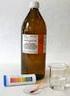 Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
Vlastnosti kyseliny sírové Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - kyselina sírová - voda - kostka cukru b)
7) Uveď příklad chemické reakce, při níž se sloučí dva prvky za vzniku sloučeniny. (3) hoření vodíku s kyslíkem a vzniká voda
 Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
Chemické reakce a děje Chemické reakce 1) Jak se chemické reakce odlišují od fyzikálních dějů? (2) změna vlastností látek, změna vazeb mezi atomy 2) Co označujeme v chemických reakcích jako reaktanty a
4.01 Barevné reakce manganistanu draselného. Projekt Trojlístek
 4. Přírodní látky: zdroje, vlastnosti a důkazy 4.01 Barevné reakce manganistanu draselného. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
4. Přírodní látky: zdroje, vlastnosti a důkazy 4.01 Barevné reakce manganistanu draselného. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
Návod k laboratornímu cvičení. Efektní pokusy
 Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
Návod k laboratornímu cvičení Efektní pokusy Úkol č. 1: Chemikova zahrádka Pomůcky: skleněná vana, lžička na chemikálie. Chemikálie: vodní sklo, síran zinečnatý ZnSO 4 (X i ), síran železnatý FeSO 4, chlorid
KARBOXYLOVÉ KYSELINY
 LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
LABORATORNÍ PRÁCE Č. 28 KARBOXYLOVÉ KYSELINY PRINCIP Karboxylové kyseliny jsou látky, které ve své molekule obsahují jednu nebo více karboxylových skupin. Odvozují se od nich dva typy derivátů, substituční
3.07 Sublimace kofeinu. Projekt Trojlístek
 3. Separační metody 3.07 Sublimace kofeinu. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
3. Separační metody 3.07 Sublimace kofeinu. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro žáky
HYDROXYDERIVÁTY - ALKOHOLY
 LABORATORNÍ PRÁCE Č. 26 HYDROXYDERIVÁTY - ALKOHOLY PRINCIP Hydroxyderiváty jsou kyslíkaté deriváty uhlovodíků, které vznikají náhradou jednoho nebo více atomů vodíku v molekule uhlovodíku hydroxylovou
LABORATORNÍ PRÁCE Č. 26 HYDROXYDERIVÁTY - ALKOHOLY PRINCIP Hydroxyderiváty jsou kyslíkaté deriváty uhlovodíků, které vznikají náhradou jednoho nebo více atomů vodíku v molekule uhlovodíku hydroxylovou
Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr. Veronika Prchlíková III/2 Inovace a zkvalitnění výuky prostřednictvím ITC
 Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Název projektu Číslo projektu Název školy Autor Název šablony Název DUMu Inovace výuky prostřednictvím šablon pro SŠ CZ.1.07/1.5.00/34.0748 Gymnázium Jana Pivečky a Střední odborná škola Slavičín Mgr.
Ch - Rozlišování látek
 Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
1.06 Jak tuhne malta. Projekt Trojlístek
 1. Chemie a společnost 1.06 Jak tuhne malta. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro
1. Chemie a společnost 1.06 Jak tuhne malta. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena pro
Návod k laboratornímu cvičení. Oddělování složek směsí I
 Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Návod k laboratornímu cvičení Oddělování složek směsí I Úkol č. 1: Usazování Pomůcky: dělící nálevka, držák, svorka, stojan, kádinka Chemikálie: voda, potravinářské barvivo, olej 1. Dělící nálevku upevníme
Název: Barvy chromu. Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
Název: Barvy chromu Autor: Mgr. Jiří Vozka, Ph.D. Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, biologie Ročník: 3. Tématický celek: Systematická anorganická
Příprava vápenné vody
 Příprava vápenné vody Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - oxid vápenatý - voda b) potřeby - kádinka 2 ks
Příprava vápenné vody Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - oxid vápenatý - voda b) potřeby - kádinka 2 ks
EU peníze středním školám digitální učební materiál
 EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
EU peníze středním školám digitální učební materiál Číslo projektu: Číslo a název šablony klíčové aktivity: Tematická oblast, název DUMu: Autor: CZ.1.07/1.5.00/34.0515 III/2 Inovace a zkvalitnění výuky
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ
 SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
SHRNUTÍ A ZÁKLADNÍ POJMY chemie 8.ročník ZŠ 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu - látka
Nasycený roztok. Metodický list pro učitele. Časový harmonogram. a) doba na přípravu - 10 minut b) doba na provedení - 10 minut.
 Nasycený roztok Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - modrá skalice (pentahydrát síranu měďnatého) - voda
Nasycený roztok Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Pomůcky a) chemikálie - modrá skalice (pentahydrát síranu měďnatého) - voda
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 9 Lipidy Pro potřeby projektu
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY
 1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
1. PROCES A PODMÍNKY HOŘENÍ, HOŘLAVÉ LÁTKY V této kapitole se dozvíte: Jak lze definovat hoření? Jak lze vysvětlit proces hoření? Jaké jsou základní podmínky pro hoření? Co jsou hořlavé látky (hořlaviny)
Ročník VIII. Chemie. Období Učivo téma Metody a formy práce- kurzívou. Kompetence Očekávané výstupy. Průřezová témata. Mezipřed.
 Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Úvod IX. -ukázka chem.skla přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády. 46. ročník 2009/2010. OKRESNÍ KOLO kategorie D
 Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (55 bodů) Úloha 1 Závislost rozpustnosti
Ministerstvo školství, mládeže a tělovýchovy Ústřední komise Chemické olympiády 46. ročník 2009/2010 OKRESNÍ KOLO kategorie D ŘEŠENÍ SOUTĚŽNÍCH ÚLOH TEORETICKÁ ČÁST (55 bodů) Úloha 1 Závislost rozpustnosti
DUM VY_52_INOVACE_12CH36
 Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH36 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Základní škola Kaplice, Školní 226 DUM VY_52_INOVACE_12CH36 autor: Kristýna Anna Rolníková období vytvoření: říjen 2011 duben 2012 ročník, pro který je vytvořen: 8. a 9. vzdělávací oblast: vzdělávací obor:
Sešit pro laboratorní práci z chemie
 Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Sešit pro laboratorní práci z chemie téma: Důkaz C, H, N a halogenů v organických sloučeninách autor: ing. Alena Dvořáková vytvořeno při realizaci projektu: Inovace školního vzdělávacího programu biologie
Vzdělávací obsah vyučovacího předmětu
 Vzdělávací obsah vyučovacího předmětu Chemie 8. ročník Zpracovala: Mgr. Michaela Krůtová POZOROVÁNÍ, POKUS, BEZPEČNOST PRÁCE určí společné a rozdílné vlastnosti látek orientuje se v chemické laboratoři
Vzdělávací obsah vyučovacího předmětu Chemie 8. ročník Zpracovala: Mgr. Michaela Krůtová POZOROVÁNÍ, POKUS, BEZPEČNOST PRÁCE určí společné a rozdílné vlastnosti látek orientuje se v chemické laboratoři
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny
 ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
ORGANICKÁ CHEMIE Laboratorní práce č. 4 Téma: Karbonylové sloučeniny, karboxylové kyseliny Úkol 1: Připravte acetaldehyd. Karbonylová skupina aldehydů podléhá velmi snadno oxidaci až na skupinu karboxylovou.
Látky, jejich vlastnosti, skupenství, rozpustnost
 - zná zásady bezpečné práce v laboratoři, poskytne první pomoc a přivolá pomoc při úrazech - dokáže poznat a pojmenovat chemické nádobí - pozná skupenství a jejich přeměny - porovná společné a rozdílné
- zná zásady bezpečné práce v laboratoři, poskytne první pomoc a přivolá pomoc při úrazech - dokáže poznat a pojmenovat chemické nádobí - pozná skupenství a jejich přeměny - porovná společné a rozdílné
VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE
 VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice Kontaktní
VÝROBA KYSELINY SÍROVÉ TEXT PRO UČITELE Mgr. Jana Prášilová prof. RNDr. Jiří Kameníček, CSc. Olomouc, 2013 Obsah 1. Téma v učebnicích používaných na gymnáziích 2. Teoretické poznatky k problematice Kontaktní
9. ročník LMP NSP. 8. ročník LMP NSP. 10. ročník LMP SP. 7. ročník LMP NSP. Pozorování, pokus a bezpečnost práce. práce. práce
 Charakteristika vyučovacího předmětu Chemie ŠVP LMP Obsahové, časové a organizační vymezení vyučovacího předmětu Chemie Vyučovací předmět Chemie je tvořen z obsahu vzdělávacího oboru ze vzdělávací oblasti
Charakteristika vyučovacího předmětu Chemie ŠVP LMP Obsahové, časové a organizační vymezení vyučovacího předmětu Chemie Vyučovací předmět Chemie je tvořen z obsahu vzdělávacího oboru ze vzdělávací oblasti
ZŠ ÚnO, Bratří Čapků 1332
 Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
Úvodní obrazovka Menu (vlevo nahoře) Návrat na hlavní stránku Obsah Výsledky Poznámky Záložky edunet Konec Chemie 1 (pro 12-16 let) LangMaster Obsah (střední část) výběr tématu - dvojklikem v seznamu témat
LP č. 5 - SACHARIDY. Autor: Mgr. Stanislava Bubíková. Datum (období) tvorby: 28. 2. 2013. Ročník: devátý
 LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
LP č. 5 - SACHARIDY Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 28. 2. 2013 Ročník: devátý Vzdělávací oblast: Člověk a příroda / Chemie / Organické sloučeniny 1 Anotace: Žáci si prakticky vyzkouší
Chemie 8. ročník Vzdělávací obsah
 Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
Chemie 8. ročník Časový Září Téma Učivo Ročníkové výstupy žák podle svých schopností: Poznámka Pozorování, pokus a bezpečnost práce Úvod do chemie Vlastnosti látek (hustota, rozpustnost, kujnost, tepelná
téma: Úvodní praktikum - Práce v laboratoři autor: Ing. Dagmar Kučerová
 téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
téma: Úvodní praktikum - Práce v laboratoři cíl praktika: Žáci budou seznámeni s laboratorním řádem a poučeni o bezpečnosti práce. pomůcky: laboratorní řád popis aktivit: Žáci se seznámí se všemi body
1.07 Přírodní indikátor ph. Projekt Trojlístek
 1. Chemie a společnost 1.07 Přírodní indikátor ph. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena
1. Chemie a společnost 1.07 Přírodní indikátor ph. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika je určena
Název: Krystalizace. Výukové materiály. Téma: Krystalizace. Úroveň: 2. stupeň ZŠ. Tematický celek: Vidět a poznat neviditelné. Předmět (obor): chemie
 Název: Krystalizace Výukové materiály Téma: Krystalizace Úroveň: 2. stupeň ZŠ Tematický celek: Vidět a poznat neviditelné Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba trvání: 2 vyučovací
Název: Krystalizace Výukové materiály Téma: Krystalizace Úroveň: 2. stupeň ZŠ Tematický celek: Vidět a poznat neviditelné Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba trvání: 2 vyučovací
Název: Fyzikální a chemický děj Výukové materiály
 Název: Fyzikální a chemický děj Výukové materiály Téma: Fyzikální a chemický děj Úroveň: 2. stupeň ZŠ Tematický celek: Materiály a jejich přeměny Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba
Název: Fyzikální a chemický děj Výukové materiály Téma: Fyzikální a chemický děj Úroveň: 2. stupeň ZŠ Tematický celek: Materiály a jejich přeměny Předmět (obor): chemie Doporučený věk žáků: 13 14 let Doba
Předmět: CHEMIE Ročník: 8. ŠVP Základní škola Brno, Hroznová 1. Výstupy předmětu
 Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
Chemie -ukázka chem. skla Chemie přírodní věda, poznat chemické sklo a pomůcky, zásady bezpečné práce-práce s dostupnými a běžně používanými látkami, hodnocení jejich rizikovosti, posoudí bezpečnost vybraných
ANORGANICKÁ ORGANICKÁ
 EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
EMIE ANORGANIKÁ ORGANIKÁ 1 EMIE ANORGANIKÁ Anorganické látky Oxidy: O, O 2.. V neživé přírodě.. alogenidy: Nal.. ydroxidy: NaO Uhličitany: ao 3... Kyseliny: l. ydrogenuhličitany: NaO 3. 2 EMIE ORGANIKÁ
Směsi a čisté látky, metody dělení
 Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
Směsi a čisté látky, metody dělení LÁTKY Chemicky čisté látky Sloučeniny Chemické prvky Homogenní Roztoky pevné kapalné plynné Směsi Heterogenní Suspenze Emulze Pěna Aerosol Chemicky čisté látky: prvky
téma: Halogeny-úvod autor: Ing. František Krejčí, CSc. cíl praktika: žáci si osvojí znalosti z chemie halogenů doba trvání: 2 h
 téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
téma: Halogeny-úvod cíl praktika: žáci si osvojí znalosti z chemie halogenů pomůcky: psací potřeby popis aktivit: Žáci si osvojí problematiku halogenů, popíší jejich elektronovou konfiguraci a z ní vyvodí
5. Nekovy sı ra. 1) Obecná charakteristika nekovů. 2) Síra a její vlastnosti
 5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
5. Nekovy sı ra 1) Obecná charakteristika nekovů 2) Síra a její vlastnosti 1) Obecná charakteristika nekovů Jedna ze tří chemických skupin prvků. Nekovy mají vysokou elektronegativitu. Jsou to prvky uspořádané
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
Charakteristika vyučovacího předmětu Chemie
 Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Charakteristika vyučovacího předmětu Chemie Obsahové, časové a organizační vymezení předmětu Chemie Obsah předmětu Chemie je zaměřen na praktické využití poznatků o chemických látkách, na znalost a dodržování
Co je chemie a proč se ji máme učit?
 ÚVOD Co je chemie a proč se ji máme učit? ➊ Spoj některé následující vynálezy s místem, kde byly objeveny. Dále zakroužkuj látky, které se snažili vyrobit dávní alchymisté. střelný prach papír oheň papyrus
ÚVOD Co je chemie a proč se ji máme učit? ➊ Spoj některé následující vynálezy s místem, kde byly objeveny. Dále zakroužkuj látky, které se snažili vyrobit dávní alchymisté. střelný prach papír oheň papyrus
UHLOVODÍKY A HALOGENDERIVÁTY
 LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
LABORATORNÍ PRÁCE Č. 25 UHLOVODÍKY A HALOGENDERIVÁTY PRINCIP Uhlovodíky jsou nejjednodušší organické sloučeniny, jejichž molekuly jsou tvořeny pouze uhlíkem a vodíkem. Uhlovodíky klasifikujeme z několika
Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy
 Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Název: xidy dusíku Autor: Mgr. Štěpán Mička Název školy: Gymnázium Jana Nerudy, škola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzika, Ročník: 3. Tématický celek: Systematická anorganická
Vyučovací hodiny mohou probíhat v multimediální učebně, odborné učebně chemie a fyziky, ve venkovních prostorách školy a formou exkurzí.
 7.6.2 Charakteristika předmětu 2. stupně Chemie je zařazena do vzdělávací oblasti Člověk a příroda. Vyučovací předmět má časovou dotaci v a 9. ročníku 2 hodiny týdně. V ročníku byla použita jedna disponibilní
7.6.2 Charakteristika předmětu 2. stupně Chemie je zařazena do vzdělávací oblasti Člověk a příroda. Vyučovací předmět má časovou dotaci v a 9. ročníku 2 hodiny týdně. V ročníku byla použita jedna disponibilní
Oborový workshop pro ZŠ CHEMIE
 PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
PRAKTICKÁ VÝUKA PŘÍRODOVĚDNÝCH PŘEDMĚTŮ NA ZŠ A SŠ CZ.1.07/1.1.30/02.0024 Tento projekt je spolufinancován Evropským sociálním fondem a státním rozpočtem České republiky. Oborový workshop pro ZŠ CHEMIE
Sublimace jodu. Metodický list pro učitele. Časový harmonogram. a) doba na přípravu - 10 minut b) doba na provedení - 20 minut.
 Sublimace jodu Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 20 minut Pomůcky a) chemikálie - jod znečištěný pískem b) potřeby - kádinka - hodinové
Sublimace jodu Metodický list pro učitele Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 20 minut Pomůcky a) chemikálie - jod znečištěný pískem b) potřeby - kádinka - hodinové
Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že
 Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že jsou poživatelné. Jiné jsou tak silné, že poleptají
Jako kyseliny jsou označovány všechny látky, jejichž molekuly se ve vodě rozkládají a uvolňují vodíkové kationty. Některé kyseliny jsou tak slabé, že jsou poživatelné. Jiné jsou tak silné, že poleptají
ORGANICKÁ CHEMIE Laboratorní práce č. 3
 Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
Téma: Hydroxyderiváty uhlovodíků ORGANICKÁ CHEMIE Laboratorní práce č. 3 Úkol 1: Dokažte přítomnost ethanolu ve víně. Ethanol bezbarvá kapalina, která je základní součástí alkoholických nápojů. Ethanol
5.10 CHEMIE Charakteristika předmětu
 5.10 5.10.1 Charakteristika předmětu A. Obsahové vymezení Vyučovací předmět chemie je součástí vzdělávací oblasti Člověk a příroda, která žákovi umožňuje poznávání přírody jako systému, chápání důležitosti
5.10 5.10.1 Charakteristika předmětu A. Obsahové vymezení Vyučovací předmět chemie je součástí vzdělávací oblasti Člověk a příroda, která žákovi umožňuje poznávání přírody jako systému, chápání důležitosti
OKRUH 7 Karboxylové kyseliny
 OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
OKRUH 7 Karboxylové kyseliny Pro karboxylové kyseliny je charakteristická přítomnost jedné nebo více karboxylových skupin Monokarboxylové kyseliny Příprava kyseliny mravenčí z chloroformu a její důkaz
Návod k laboratornímu cvičení. Bílkoviny
 Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
Úkol č. 1: Důkazy bílkovin ve vaječném bílku a) natvrdo uvařené vejce s kyselinou dusičnou Pomůcky: Petriho miska, pipeta, nůž. Návod k laboratornímu cvičení Bílkoviny Chemikálie: koncentrovaná kyselina
Důkaz uhličitanu ve vodním kameni
 Důkaz uhličitanu ve vodním kameni Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Metodický list pro učitele Pomůcky a) chemikálie - ocet b) potřeby - varná konvice zanesená
Důkaz uhličitanu ve vodním kameni Časový harmonogram a) doba na přípravu - 10 minut b) doba na provedení - 10 minut Metodický list pro učitele Pomůcky a) chemikálie - ocet b) potřeby - varná konvice zanesená
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Chemie (CHE) Obecná chemie, anorganická chemie Tercie 2 hodiny týdně Školní tabule, interaktivní tabule, Apple TV, tablety, tyčinkové a kalotové modely molekul,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace
 Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Sada 7 Název souboru Ročník Předmět Formát Název výukového materiálu Anotace VY_52_INOVACE_737 8. Chemie notebook Směsi Materiál slouží k vyvození a objasnění pojmů (klíčová slova - chemická látka, směs,
Návod k laboratornímu cvičení. Alkoholy
 Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Úkol č. 1: Ověřování fyzikálních vlastností alkoholů Návod k laboratornímu cvičení Alkoholy Pomůcky: 3 velké zkumavky - A,B,C, hodinové sklíčko, kapátko nebo skleněná tyčinka Chemikálie: etanol (F), etan-1,2-
Laboratorní cvičení z kinetiky chemických reakcí
 Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Laboratorní cvičení z kinetiky chemických reakcí LABORATORNÍ CVIČENÍ 1. Téma: Ovlivňování průběhu reakce změnou koncentrace látek. podmínek průběhu reakce. Jednou z nich je změna koncentrace výchozích
Vodík, kyslík a jejich sloučeniny
 I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
I N V E S T I C E D O R O Z V O J E V Z D Ě L Á V Á N Í TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY Laboratorní práce č. 8 Vodík, kyslík a jejich sloučeniny
2.05 Chemická zahrádka. Projekt Trojlístek
 2. Vlastnosti látek a chemické reakce 2.05 Chemická zahrádka. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
2. Vlastnosti látek a chemické reakce 2.05 Chemická zahrádka. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie 2. Cílová skupina Metodika
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1
 SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
SHRNUTÍ A ZÁKLADNÍ POJMY UČEBNICE ZÁKLADY CHEMIE 1 1. ČÍM SE ZABÝVÁ CHEMIE VLASTNOSTI LÁTEK, POKUSY - chemie přírodní věda, která studuje vlastnosti a přeměny látek pomocí pozorování, měření a pokusu -
K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra
 K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra Kyslík Je složkou vzduchu Umožňuje dýchání živočichů V malém množství je také rozpuštěn ve vodě, což umožňuje život vodních živočichů Je nezbytnou
K nejvýznamějším nekovům patří: kyslík dusík vodík uhlík síra Kyslík Je složkou vzduchu Umožňuje dýchání živočichů V malém množství je také rozpuštěn ve vodě, což umožňuje život vodních živočichů Je nezbytnou
RUŠENÁ KRYSTALIZACE A SUBLIMACE
 LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
LABORATORNÍ PRÁCE Č. 5 RUŠENÁ KRYSTALIZACE A SUBLIMACE KRYSTALIZACE PRINCIP Krystalizace je důležitý postup při získávání čistých tuhých látek z jejich roztoků. Tuhá látka se rozpustí ve vhodném rozpouštědle.
Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější.
 Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Nejjednodušší prvek. Na Zemi tvoří vodík asi 15 % atomů všech prvků. Chemické slučování je děj, při kterém z látek jednodušších vznikají látky složitější. Vodík tvoří dvouatomové molekuly, je lehčí než
Návod k laboratornímu cvičení. Fenoly
 Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Návod k laboratornímu cvičení Fenoly Úkol č. 1: Příprava fenolátu sodného Pomůcky: váhy, kádinka, zkumavky Chemikálie: 10% roztok hydroxidu sodného NaOH (C), 5%roztok kyseliny chlorovodíkové HCl (C, X
Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH. atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na +
 OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
OPAKOVÁNÍ Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag Cl - NaOH atomy: Cu Ag molekuly: Cl 2 CO H 2 SO 4 NaOH kationty: Fe 2+ Na + Vyberte z těchto částic Cu Cl 2 Fe 2+ Na + CO H 2 SO 4 Ag
LP č.2 SUBLIMACE, CHROMATOGRAFIE
 LP č.2 SUBLIMACE, CHROMATOGRAFIE Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 6. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci navrhnou postupy a
LP č.2 SUBLIMACE, CHROMATOGRAFIE Autor: Mgr. Stanislava Bubíková Datum (období) tvorby: 12. 6. 2012 Ročník: osmý Vzdělávací oblast: Člověk a příroda / Chemie / Směsi 1 Anotace: Žáci navrhnou postupy a
Prvky,směsi -pracovní list
 Prvky,směsi -pracovní list VY_52_INOVACE_194 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8,9 Prvky,směsi -pracovní list 1) Co platí pro železo a sodík? (ke každému tvrzení napište
Prvky,směsi -pracovní list VY_52_INOVACE_194 Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Chemie Ročník: 8,9 Prvky,směsi -pracovní list 1) Co platí pro železo a sodík? (ke každému tvrzení napište
Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii
 Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
Zvyšování kvality výuky v přírodních a technických oblastech CZ.1.07/1.1.28/02.0055 Sacharidy - důkaz organických látek v přírodních materiálech pomocí žákovské soupravy pro chemii (laboratorní práce)
2. Chemický turnaj. kategorie starší žáci Teoretická část. Řešení úloh
 2. Chemický turnaj kategorie starší žáci 31. 5. 2013 Teoretická část Řešení úloh Téma: Oxidy celkem 29 bodů 1. Příprava oxidů Rovnice:...S + O 2 SO 2... Název oxidu:...siřičitý... rovnice 2 b. Rovnice:
2. Chemický turnaj kategorie starší žáci 31. 5. 2013 Teoretická část Řešení úloh Téma: Oxidy celkem 29 bodů 1. Příprava oxidů Rovnice:...S + O 2 SO 2... Název oxidu:...siřičitý... rovnice 2 b. Rovnice:
ZÁSADY BEZPEČNOSTI PŘI PRÁCI
 ZÁSADY BEZPEČNOSTI PŘI PRÁCI Soustřeďte se na práci, kterou vykonáváte, nerozptylujte se záležitostmi, které s danou prací nesouvisí. Chemikálie neberte do rukou a neochutnávejte je, vždy je třeba počítat
ZÁSADY BEZPEČNOSTI PŘI PRÁCI Soustřeďte se na práci, kterou vykonáváte, nerozptylujte se záležitostmi, které s danou prací nesouvisí. Chemikálie neberte do rukou a neochutnávejte je, vždy je třeba počítat
Ústřední komise Chemické olympiády. 53. ročník 2016/2017. KRAJSKÉ KOLO kategorie C. ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut
 Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
Ústřední komise Chemické olympiády 53. ročník 2016/2017 KRAJSKÉ KOLO kategorie C ZADÁNÍ PRAKTICKÉ ČÁSTI (40 BODŮ) časová náročnost: 120 minut Zadání praktické části krajského kola ChO kat. C 2016/2017
4.02 Důkaz bílkovin biuretovou reakcí. Projekt Trojlístek
 4. Přírodní látky: zdroje, vlastnosti a důkazy 4.02 Důkaz bílkovin biuretovou reakcí. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
4. Přírodní látky: zdroje, vlastnosti a důkazy 4.02 Důkaz bílkovin biuretovou reakcí. Projekt úroveň 1 2 3 1. Předmět výuky Metodika je určena pro vzdělávací obsah vzdělávacího předmětu Chemie. Chemie
DOCELA OBYČEJNÁ VODA
 Skupina č. Pracovali: Téma : DOCELA OBYČEJNÁ VODA Úloha č.1 Příprava destilované vody. Sestavte destilační aparaturu, do baňky nalijte vodu (s trochou modré skalice) a zahřívejte. Popište získaný destilát.
Skupina č. Pracovali: Téma : DOCELA OBYČEJNÁ VODA Úloha č.1 Příprava destilované vody. Sestavte destilační aparaturu, do baňky nalijte vodu (s trochou modré skalice) a zahřívejte. Popište získaný destilát.
Termochemie. Úkol: A. Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli
 1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
1. Termochemie Úkol: Určete změnu teploty při rozpouštění hydroxidu sodného B. Určete reakční teplo reakce zinku s roztokem měďnaté soli Pomůcky : a) kádinky, teploměr, odměrný válec, váženka, váhy, kalorimetr,
Ústřední komise Chemické olympiády. 42. ročník. KRAJSKÉ KOLO Kategorie D. SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut
 Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Ústřední komise Chemické olympiády 42. ročník 2005 2006 KRAJSKÉ KOLO Kategorie D SOUTĚŽNÍ ÚLOHY TEORETICKÉ ČÁSTI Časová náročnost: 60 minut Institut dětí a mládeže Ministerstva školství, mládeže a tělovýchovy
Autor: Tomáš Galbička Téma: Alkany a cykloalkany Ročník: 2.
 Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Alkany uhlovodíky s otevřeným řetězcem a pouze jednoduchými vazbami vazby sigma, největší výskyt elektronů na spojnici jader v názvu mají koncovku an Cykloalkany uhlovodíky s uzavřeným řetězcem a pouze
Praktické ukázky analytických metod ve vinařství
 Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Praktické ukázky analytických metod ve vinařství Ing. Mojmír Baroň Stanovení v moštu Stanovení ph a veškerých titrovatelných kyselin Stanovení ph Princip: Hodnota ph je záporný dekadický logaritmus aktivity
Reakce kyselin a zásad
 seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
seminář 6. 1. 2011 Chemie Reakce kyselin a zásad Známe několik teorií, které charakterizují definují kyseliny a zásady. Nejstarší je Arrheniova teorie, která je platná pro vodné prostředí, podle které
Korespondenční seminář Chemie, 8.kolo
 Korespondenční seminář Chemie, 8.kolo Milí žáci kvarty a 9. ročníku ZŠ, na následujících stránkách najdete 8. kolo korespondenčního semináře, ve kterém opět můžete změřit své síly v oboru chemie se svými
Korespondenční seminář Chemie, 8.kolo Milí žáci kvarty a 9. ročníku ZŠ, na následujících stránkách najdete 8. kolo korespondenčního semináře, ve kterém opět můžete změřit své síly v oboru chemie se svými
Voda polární rozpouštědlo
 VY_32_INVACE_30_BEN05.notebook Voda polární rozpouštědlo Temacká oblast : Chemie anorganická chemie Datum vytvoření: 2. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
VY_32_INVACE_30_BEN05.notebook Voda polární rozpouštědlo Temacká oblast : Chemie anorganická chemie Datum vytvoření: 2. 8. 2012 Ročník: 2. ročník čtyřletého gymnázia (sexta osmiletého gymnázia) Stručný
