Pokyny pro podávání přípravku a sledování pacienta
|
|
|
- Dominik Pospíšil
- před 7 lety
- Počet zobrazení:
Transkript
1 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011
2 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický návod k bezpečnému užívání a podávání mikafunginu, antimykotika ze skupiny echinokandinů. Tato brožurka také poukazuje na způsoby, jak minimalizovat možná rizika spojená s užíváním mikafunginu.
3 O mikafunginu 3 Mikafungin je echinokandinové antimykotikum. Je účinné proti mnoha druhům plísní, včetně klinicky nejvýznamnějších druhů z rodů Candida a Aspergillus. Údaje ze zkoušek in vitro ukazují, že mikafungin účinkuje rovněž proti flukonazol-rezistentním kmenům rodu Candida. Mikafungin se používá k léčbě kandidémie a invazivní kandidózy u dospělých i dětí. Používá se také v terapii ezofageální kandidózy, pokud je pro pacienta i.v. terapie vhodná. Přípravek je také vhodný pro profylaktické podávání imunosuprimovaným pacientům. Při rozhodování, zda použít přípravek Mycamine, by se mělo brát v úvahu riziko možného vzniku nádorů jater. Mycamine by tedy měl být užíván, pokud nejsou vhodná jiná antimykotika. Léčbu mikafunginem by měl zahájit lékař, který má zkušenosti s léčbou systémových mykotických infekcí. Pozornost by měl věnovat platným doporučením týkajícím se vhodného použití příslušných antimykotik. Nežádoucí účinky Nejčastěji uváděnými nežádoucími účinky v klinických studiích byla nauzea (2,8 %), zvýšená hladina alkalické fosfatázy v krvi (2,7 %), flebitida (2,5 %, především u pacientů s HIV infekcí s periferními katetry), zvracení (2,5 %) a zvýšená hladina aspartát aminotransferázy (2,3 %). Při analýze údajů o bezpečnosti nebyly pozorovány žádné klinicky významné rozdíly mezi pohlavími nebo rasami. Podání mikafunginu je spojeno s rizikem vzniku nádorů jater. Podrobné informace o hlavních rizicích (anafylaktická/anafylaktoidní reakce, exfoliativní kožní reakce, hepatotoxicita, hemolýza a renální toxicita) a také speciální doporučení pro sledování pacientů během lečby mikafunginem naleznete v bodech 4.4 a 4.8 SPC a v části Sledování pacienta v této příručce (str. 6). Zahájení léčby Mikafungin by měl být užíván pouze v případě, když nejsou vhodná jiná antimykotika a v souladu s SPC. Základní prvky léčebného postupu jsou uvedeny v kontrolním dotazníku pro předepisujícího lékaře. Kontrolní dotazník by měl být vyplněn před podáním mikafunginu novému pacientovi. Vyplněný dotazník by měl být uchováván v dokumentaci pacienta.
4 4 Podávání 1 2 Zkontrolujte hmotnost pacienta a vypočítejte odpovídající dávku podle dávkovací tabulky. Vezměte odpovídající množství lahviček mikafunginu, sterilním postupem odstraňte plastový uzávěr lahvičky a vydezinfikujte zátku alkoholem. 3 4 Jemně pohybujte lahvičkou krouživými pohyby, dokud se prášek zcela nerozpustí. NETŘEPEJTE. 5 6 Natáhněte 5 ml roztoku chloridu sodného 9 mg/ml (0,9 %) pro infuzi nebo roztoku glukózy 50 mg/ml (5 %) pro infuzi (ze 100 ml láhve/vaku) a toto množství injikujte pomalu asepticky do každé lahvičky podél vnitřní stěny. Koncentrát bude pěnit, snažte se množství vytvořené pěny co nejvíc omezit. Natáhněte všechen rekonstituovaný koncentrát z každé lahvičky a vraťte do infuzní láhve/vaku, ze kterého byl odebrán. Jemně otočte infuzní láhev/vak dnem vzhůru, aby se zředěný roztok promíchal. NETŘEPEJTE. Nepoužívejte roztok, pokud je zakalený nebo obsahuje sraženinu. 1 hod CHRAŇTE INFUZNÍ VAK PŘED SVĚTLEM. Podejte roztok v intravenózní infuzi trvající přibližně 1 hodinu. Pacienta sledujte kvůli možnému výskytu alergických reakcí. Rekonstituované a naředěné roztoky použijte okamžitě po přípravě. Nespotřebovaný přípravek nebo odpadní materiál zlikvidujte v souladu s místními požadavky. Nemíchejte ani nepodávejte mikafungin v infuzi současně s jinými léčivými přípravky s výjimkou výše uvedených.
5 Dávkovací tabulka pro dospělé a děti (včetně novorozenců) 5 Indikace Tělesná hmotnost > 40 kg Tělesná hmotnost 40 kg Léčba kandidémie nebo invazivní kandidózy 100 mg/den* 2 mg/kg/den* Léčba ezofageální kandidózy (pouze dospělí) 150 mg/den 3 mg/kg/den Profylaxe kandidových infekcí 50 mg/den 1 mg/kg/den * Jestliže není odpověď pacienta dostatečná, např. přetrvávají-li pozitivní kultivace nebo nelepší-li se klinický stav, lze dávku zvýšit na 200 mg/den u pacientů s tělesnou hmotností > 40 kg resp. na 4 mg/kg/den u pacientů s tělesnou hmotností 40 kg. Není nutná úprava dávky u selhání ledvin nebo jater, u starších pacientů, nebo s ohledem na pohlaví nebo rasu. Příprava roztoku pro infuzi Dávka (mg) Vhodná velikost lahvičky přípravku Mycamine (mg/lahvička) Objem chloridu sodného (0,9 %) nebo glukózy (5 %), pro přidání do lahvičky Objem (koncentrace) rekonstituovaného prášku Standardní infuze (doplněná do 100 ml) Konečná koncentrace 50 1x50 5ml cca. 5 ml (10 mg/ml) 0,5 mg/ml x 100 5ml cca. 5 ml (20 mg/ml) 1,0 mg/ml x x 50 5ml cca. 10 ml 1,5 mg/ml x 100 5ml cca. 10 ml 2,0 mg/ml
6 6 Doporučené trvání léčby Kandidémie nebo invazivní kandidóza: Léčba kandidové infekce by měla trvat minimálně 14 dní. V antimykotické léčbě by se mělo pokračovat ještě nejméně jeden týden poté, co byly dvě po sobě následující hemokultury negativní, a po odeznění klinických příznaků a symptomů infekce. Ezofageální kandidóza: Pro léčbu ezofageální kandidózy by měl být mikafungin podáván ještě nejméně jeden týden po odeznění klinických příznaků a symptomů. Profylaxe kandidových infekcí: Pro profylaxi kandidových infekcí by měl být Mycamine podáván ještě nejméně jeden týden po dosažení normálních hodnot počtu neutrofilů. Zkušenosti s použitím mikafunginu u pacientů mladších než 2 roky jsou omezené. Sledování pacienta Pacienti, kteří podstupují léčbu mikafunginem, jsou pravděpodobně kriticky nemocní, se širokou škálou komplikovaných stavů vyžadujících podávání většího počtu léčivých přípravků včetně antineoplastické chemoterapie, silných systémových imunosupresiv a širokospektrých antibiotik. Proto je pravděpodobné, že jsou již intenzivně monitorováni. Podávání je kontraindikováno u pacientů se známou přecitlivělostí na mikafungin, jiné echinokandiny nebo monohydrát laktózy. Během léčby mikafunginem sledujte u pacientů především tyto projevy: Anafylaktické/anafylaktoidní reakce, včetně šoku pokud se taková reakce objeví, zastavte infuzi přípravku a podejte vhodnou léčbu. Exfoliativní kožní reakce, jako je Stevens-Johnsův syndrom a toxická epidermální nekrolýza. Pokud se u pacientů objeví vyrážka, je třeba je pečlivě sledovat a pokud se léze zhoršují, podávání mikafunginu ukončit. Zhoršení jaterních funkcí pokud dojde k významnému a přetrvávajícímu zvýšení hladin ALT/AST, doporučuje se okamžité přerušení terapie, aby bylo minimalizováno riziko jaterních abnormalit a možného následného vzniku jaterního tumoru. Klinické nebo laboratorní známky hemolýzy, včetně akutní intravaskulární hemolýzy nebo hemolytické anémie jestliže jsou přítomny příznaky hemolýzy, sledujte podrobně známky zhoršování a zhodnoťte poměr přínosu a rizika pokračování terapie mikafunginem. Zhoršení renálních funkcí mikafungin může způsobit problémy s ledvinami, selhání ledvin a abnormální výskledky renálních funkčních testů. Ostatní nežádoucí účinky nejčastěji hlášenými nežádoucími účinky během klinických studií s mikafunginem byly nauzea, zvýšená hladina alkalické fosfatázy v krvi, flebitida (primárně u HIV infikovaných pacientů s periferními katetry), zvracení a zvýšení AST v krvi. Klinický a mikrobiologický ústup infekce Souběžná léčba monitorujte hladiny sirolimusu, nifedipinu a itrakonazolu z důvodu toxicity a snižte dávky, pokud je třeba. Rovněž je nutno pečlivě sledovat toxicitu amfotericinu B deoxycholátu.
7 Užitečné kontakty Další informaci o mikafunginu naleznete v Souhrnu informací o přípravku nebo, prosím, kontaktujte: 7 Astellas Pharma s.r.o. Sokolovská 100/ Praha 8 Tel.: Fax: pharmacovigilance_cz_sk@cz.astellas.com
8 Tato publikace podléhá copyrightu podle Bernské konvence a Všeobecné autorské konvence. Všechna práva vyhrazena. Žádná část této publikace nesmí být reprodukována v jakékoli formě, včetně elektronické, fotokopií, mikrofilmů a nahrávání, bez písemného souhlasu držitele copyrightu, přičemž žádosti o tento souhlas by měly být adresovány nakladateli. Toto písemné povolení musí být vždy získáno dříve, než bude kterákoli část této publikace uložena v publikačním systému jakékoli povahy.
Příbalová informace: informace pro uživatele. Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum
 Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum (ve formě micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mycamine 50 mg Jedna injekční
Příbalová informace: informace pro uživatele. Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum
 Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele Mycamine 50 mg prášek pro infuzní roztok Mycamine 100 mg prášek pro infuzní roztok Micafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Mycamine 50 mg prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 50 mg micafunginum
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PERFALGAN 10 mg/ml, infuzní roztok paracetamolum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
2. CO MUSÍTE VĚDĚT NEŽ ZAČNETE FLUCONAZOL ARDEZ UŽÍVAT
 Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum
 sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Příbalová informace: informace pro uživatele. Erbitux 5 mg/ml infuzní roztok Cetuximabum
 Příbalová informace: informace pro uživatele Erbitux 5 mg/ml infuzní roztok Cetuximabum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro
Příbalová informace: informace pro uživatele Erbitux 5 mg/ml infuzní roztok Cetuximabum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu infuzního roztoku
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
2. Čemu musíte věnovat pozornost, než začnete přípravek Vancomycin CNP Pharma používat
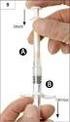 sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
. konference dětských hematologů a onkologů České a Slovenské republiky
 XX. konference dětských hematologů a onkologů České a Slovenské republiky 8. 10. října 2010 Praha, hotel Pyramida II. oznámení 2 Vážené kolegyně a kolegové, velmi si vážíme cti pořádat jubilejní XX. konferenci
XX. konference dětských hematologů a onkologů České a Slovenské republiky 8. 10. října 2010 Praha, hotel Pyramida II. oznámení 2 Vážené kolegyně a kolegové, velmi si vážíme cti pořádat jubilejní XX. konferenci
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg prášek pro injekční roztok. (Ampicilinum/sulbactamum)
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls207005/2010 a příloha k sp.zn. sukls122247/2012 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls207005/2010 a příloha k sp.zn. sukls122247/2012 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg
Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání
 Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp. zn. sukls145609/2011 a ke sdělení sp. zn. sukls145619/2011 1. NÁZEV PŘÍPRAVKU AMPHOCIL 50 mg AMPHOCIL 100 mg prášek pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2.
Příloha č. 3 ke sdělení sp. zn. sukls145609/2011 a ke sdělení sp. zn. sukls145619/2011 1. NÁZEV PŘÍPRAVKU AMPHOCIL 50 mg AMPHOCIL 100 mg prášek pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2.
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013
 STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013 STUDIJNÍ OBOR: ZDRAVOTNICKÝ ASISTENT OBSAH 1.Úvod...3 2. Historický vývoj
STŘEDNÍ ZDRAVONICKÁ ŠKOLA KROMĚŘÍŽ SPECIÁLNÍ FARMAKOLOGIE KLINICKÁ PROPEDEUTIKA ANTIMYKOTIKA ROČNÍK: 3. ŠKOLNÍ ROK: 2012 / 2013 STUDIJNÍ OBOR: ZDRAVOTNICKÝ ASISTENT OBSAH 1.Úvod...3 2. Historický vývoj
Průvodce použitím přípravku YERVOY (ipilimumab)
 Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
PŘÍBALOVÁ INFORMACE 2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE STOPTUSSIN SIRUP UŽÍVAT
 PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Tento přípravek je dostupný bez lékařského předpisu. Přesto však Stoptussin sirup musíte užívat
PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Tento přípravek je dostupný bez lékařského předpisu. Přesto však Stoptussin sirup musíte užívat
Příbalová informace: Informace pro uživatele. Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum)
 sp.zn. sukls273948/2016 Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls273948/2016 Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Simdax Příbalová informace
 Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku
 Příloha č. 1a k rozhodnutí o změně registrace sp.zn. sukls116762/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku (Cefuroximum) Přečtěte si
Příloha č. 1a k rozhodnutí o změně registrace sp.zn. sukls116762/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku (Cefuroximum) Přečtěte si
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta. Sulperazon 2 g IM/IV Prášek pro injekční roztok. Cefoperazonum/sulbactamum
 Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Cefoperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Cefoperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienty. Chloramphenicol VUAB 1 g. prášek pro injekční roztok chloramphenicolum
 sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Trihydrát octanu sodného Kyselina octová Chlorid sodný Hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu ph Voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012
 Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeanutrisol G 5 Ardeanutrisol G 10 Ardeanutrisol G 20 Ardeanutrisol
Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeanutrisol G 5 Ardeanutrisol G 10 Ardeanutrisol G 20 Ardeanutrisol
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp. zn. sukls34348/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ampicillin/Sulbactam Mylan 1 g/0,5 g prášek pro injekční / infuzní roztok léčivé látky: sulbactamum 0,5 g a ampicillinum 1 g Přečtěte
Sp. zn. sukls34348/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ampicillin/Sulbactam Mylan 1 g/0,5 g prášek pro injekční / infuzní roztok léčivé látky: sulbactamum 0,5 g a ampicillinum 1 g Přečtěte
Příbalová informace: informace pro pacienta. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok
 sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
Příloha č. 1 k rozhodnutí o převodu registrace sp. zn. sukls143194/2012 a příloha ke sp. zn. sukls183998/2012
 Příloha č. 1 k rozhodnutí o převodu registrace sp. zn. sukls143194/2012 a příloha ke sp. zn. sukls183998/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyrdanax 20 mg/ml prášek pro infuzní roztok Dexrazoxanum
Příloha č. 1 k rozhodnutí o převodu registrace sp. zn. sukls143194/2012 a příloha ke sp. zn. sukls183998/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyrdanax 20 mg/ml prášek pro infuzní roztok Dexrazoxanum
Příbalová informace Informace pro použití, čtěte pozorně!
 Příloha č. 2 ke sdělení sp. zn. sukls145609/2011 a ke sdělení sp. zn. sukls145619/2011 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku AMPHOCIL 50 mg AMPHOCIL 100 mg prášek pro
Příloha č. 2 ke sdělení sp. zn. sukls145609/2011 a ke sdělení sp. zn. sukls145619/2011 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku AMPHOCIL 50 mg AMPHOCIL 100 mg prášek pro
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok. Sulperazonum/sulbactamum
 Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum
 Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ECALTA 100 mg prášek pro přípravu infuzního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje anidulafunginum 100 mg.
Příbalová informace: informace pro uživatele
 sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Fungitraxx 10 mg/ml perorální roztok pro okrasné ptactvo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Fungitraxx 10 mg/ml perorální roztok pro okrasné ptactvo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Granisetron Sandoz 1mg/1ml, koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetronum
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls20915/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Granisetron Sandoz 1mg/1ml, koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetronum
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls20915/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Granisetron Sandoz 1mg/1ml, koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetronum
Příprava a podání injekce
 Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PERFALGAN 10 mg/ml, infuzní roztok paracetamolum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls39459/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls39459/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele
 sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
Celkové shrnutí vědeckého hodnocení přípravku Diflucan a souvisejících názvů (viz příloha I)
 PŘÍLOHA II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace předkládané Evropskou agenturou pro léčivé přípravky 31 Vědecké závěry Celkové
PŘÍLOHA II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace předkládané Evropskou agenturou pro léčivé přípravky 31 Vědecké závěry Celkové
Anidulafungin Accord 100 mg prášek pro koncentrát pro infuzní roztok. anidulafunginum
 Sp.zn. sukls57203/2017 Příbalová informace: informace pro pacienta 100 mg prášek pro koncentrát pro infuzní roztok anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls57203/2017 Příbalová informace: informace pro pacienta 100 mg prášek pro koncentrát pro infuzní roztok anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g, prášek pro přípravu injekčního roztoku Ceftazidim
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g, prášek pro přípravu injekčního roztoku Ceftazidim
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Příbalová informace: informace pro pacienta. Vyxeos 44 mg/100 mg prášek pro koncentrát pro infuzní roztok. daunorubicinum a cytarabinum
 Příbalová informace: informace pro pacienta Vyxeos 44 mg/100 mg prášek pro koncentrát pro infuzní roztok. daunorubicinum a cytarabinum Přečtěte si pozorně celou příbalovou informaci dříve, než je Vám podán
Příbalová informace: informace pro pacienta Vyxeos 44 mg/100 mg prášek pro koncentrát pro infuzní roztok. daunorubicinum a cytarabinum Přečtěte si pozorně celou příbalovou informaci dříve, než je Vám podán
Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
Příbalová informace: informace pro pacienta. BLINCYTO 38,5 mikrogramu prášek pro koncentrát a roztok pro infuzní roztok blinatumomabum
 Příbalová informace: informace pro pacienta BLINCYTO 38,5 mikrogramu prášek pro koncentrát a roztok pro infuzní roztok blinatumomabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání
Příbalová informace: informace pro pacienta BLINCYTO 38,5 mikrogramu prášek pro koncentrát a roztok pro infuzní roztok blinatumomabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání
Příbalová informace: informace pro uživatele. ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III
 Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta. Atosiban PharmIdea 37,5 mg/5 ml koncentrát pro infuzní roztok. atosibanum
 sp.zn.sukls246791/2016 Příbalová informace: informace pro pacienta Atosiban PharmIdea 37,5 mg/5 ml koncentrát pro infuzní roztok atosibanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls246791/2016 Příbalová informace: informace pro pacienta Atosiban PharmIdea 37,5 mg/5 ml koncentrát pro infuzní roztok atosibanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
