Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls120529/2011, sukls120534/2011, sukls120548/2011 a sukls120565/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Zdeňka Dušková
- před 8 lety
- Počet zobrazení:
Transkript
1 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls120529/2011, sukls120534/2011, sukls120548/2011 a sukls120565/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU: SANDIMMUN NEORAL 25 mg SANDIMMUN NEORAL 50 mg SANDIMMUN NEORAL 100 mg SANDIMMUN NEORAL 100 mg/ml 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Měkká tobolka: Léčivá látka: ciclosporinum, 25, 50 nebo 100 mg v jedné měkké želatinové tobolce. Perorální roztok: Léčivá látka: ciclosporinum 100 mg v 1 ml. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Měkká tobolka Perorální roztok Popis přípravku: Sandimmun Neoral 25 mg: měkké želatinové tobolky o velikosti 10 mm, modrošedé, oválné, označené NVR a 25 mg, obsahující nažloutlý až hnědožlutý čirý roztok, Sandimmun Neoral 50 mg: měkké želatinové tobolky o velikosti 20 mm, nažloutlé, podlouhlé, označené NVR a 50 mg, obsahující nažloutlý až hnědožlutý čirý roztok Sandimmun Neoral 100 mg: měkké želatinové tobolky o velikosti 25 mm, modrošedé, podlouhlé, označené NVR a 100 mg, obsahující nažloutlý až hnědožlutý čirý roztok Sandimmun Neoral 100 mg/ml: nažloutlý až hnědožlutý čirý roztok Sandimmun Neoral je nová léková forma s léčivou látkou cyklosporinem. Její podstatou je mikroemulze, díky níž je snížena variabilita farmakokinetických parametrů a je dosaženo lineárního vztahu mezi dávkou a expozicí cyklosporinu a stabilnějšího absorpčního profilu, který je méně ovlivňován příjmem potravy. Lékovou formou je prekoncentrát mikroemulze, u něhož byla ve farmakokinetických a klinických studiích prokázána mnohem těsnější korelace mezi minimální koncentrací v ustáleném stavu a expozicí cyklosporinu, byl-li cyklosporin podáván v přípravku Sandimmun Neoral, než tomu bylo u klasického Sandimmunu. Mikroemulze vzniká v přítomnosti vody, ať už ve formě nápoje nebo žaludeční šťávy. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Transplantace Transplantace parenchymatózních orgánů Prevence odmítnutí transplantátů ledvin, jater, srdce, kombinace srdce a plic, plic nebo alogenních transplantátů pankreatu. Léčba odmítnutí transplantátu u nemocných léčených dříve jinými imunosupresivy. Transplantace kostní dřeně Prevence odmítnutí transplantátů po transplantaci kostní dřeně. Prevence nebo léčba choroby z reakce mezi transplantátem a příjemcem (GVHD). 1/18
2 Jiné indikace než transplantace Endogenní uveitida Aktivní ohrožení zraku způsobené střední nebo zadní uveitidou neinfekční etiologie, když konvenční léčba nestačí nebo má nepřijatelné nežádoucí účinky. Behçetova uveitida s opakovanými zánětlivými atakami postihujícími sítnici. Nefrotický syndrom Steroid-dependentní a steroid-rezistentní nefrotický syndrom u dospělých a u dětí vzniklý v důsledku poškození glomerulů nefropatií s minimálními změnami, ložiskovou a segmentální glomerulosklerózou nebo membranózní glomerulonefritidou. Sandimmun Neoral lze použít k navození a udržení remise a také k udržení remise dosažené steroidy, což dovoluje i jejich vysazení. Revmatoidní artritida Sandimmun Neoral je indikován k léčbě těžké aktivní revmatoidní artritidy. Psoriáza Sandimmun Neoral je indikován u nemocných s těžkou psoriázou, u nichž je konvenční léčba neúčinná nebo nevhodná. Atopická dermatitida Sandimmun Neoral je indikován k léčbě pacientů s těžkou atopickou dermatitidou, kteří vyžadují systémovou terapii. 4.2 Dávkování a způsob podání Denní dávka Sandimmun Neoralu (perorální roztok a měkké tobolky) by měla být vždy rozdělena do dvou dílčích dávek podávaných 2x denně. Transplantace Transplantace parenchymatózních orgánů Léčba Sandimmun Neoralem musí být zahájena nejpozději 12 hodin před operací dávkou mg/kg/den rozdělenou do dvou dávek. Tato dávka se podává denně po dobu 1-2 týdnů po operaci rozdělená do dvou dávek. Dále se dávka, podle hladin cyklosporinu v krvi, postupně snižuje až na udržovací dávku 2 až 6 mg/kg/den, podává se opět rozdělená do 2 dílčích dávek. Pokud je Sandimmun Neoral podáván s jinými imunosupresivy (např. kortikosteroidy nebo jako součást trojnebo čtyřkombinace), mohou být použity pro zahájení terapie nižší dávky (např. 3 až 6 mg/kg/den podávané opět rozdělené do 2 dávek). Je-li použit Sandimmun koncentrát pro přípravu infuzního roztoku, je doporučená dávka přibližně jedna třetina dávky Sandimmun Neoral a doporučuje se, aby pacienti byli převedeni na perorální léčbu, jakmile je to možné. Transplantace kostní dřeně Počáteční dávka se podává den před transplantací. Ve většině případů se dává přednost intravenózní infuzi; doporučovaná dávka je 3 5 mg/kg za den. V této dávce se pokračuje formou infuzí během bezprostředního období po transplantaci, po dobu až dvou týdnů, než se přejde na perorální udržovací léčbu v denní dávce asi 12,5 mg/kg rozdělené do dvou dávek.v udržovací léčbě se pokračuje po dobu alespoň 3 měsíců (raději 6 měsíců), než se dávka postupně sníží během jednoho roku po transplantaci na nulu. Jestliže se k zahájení terapie použije Sandimmun Neoral, doporučuje se den před transplantací podat dávku 12,5 až 15 mg/den rozdělenou do dvou dávek. Při gastrointestinálních poruchách, které mohou snížit vstřebávání, může být nutné podávat vyšší perorální dávky nebo použít intravenózní léčbu. 2/18
3 U některých nemocných dojde po vynechání léčby Sandimmunem k reakci mezi transplantátem a příjemcem (GVHD), ale odpověď na opětovné zavedení léčby je obvykle příznivá. K léčbě mírné chronické GVHD je možné podávat nízké dávky Sandimmun Neoralu. Dávkování u jiných indikací než transplantací Endogenní uveitida: K navození remise se doporučuje podávat perorálně dávku 5 mg/kg za den rozdělenou do dvou dávek, a to až do dosažení remise aktivního uveálního zánětu a zlepšení ostrosti zraku. U refrakterních případů může být dávka po omezenou dobu zvýšena až na 7 mg/kg za den. Jestliže se onemocnění nepodařilo zvládnout dostatečně samotným Sandimmun Neoralem, lze k dosažení remise nebo k překonání zánětlivých očních příhod přidat systémovou léčbu kortikosteroidy v denních dávkách 0,2 0,6 mg/kg prednisonu nebo jeho ekvivalentu. Při udržovací léčbě musejí být dávky postupně sníženy na nejnižší účinné množství, které v období remise nesmí přesáhnout 5 mg/kg za den. Nefrotický syndrom: Jsou-li, s výjimkou proteinurie, renální funkce v normě, doporučuje se k navození remise u dospělých zahájit léčbu dávkou 5 mg/kg za den a u dětí dávkou 6 mg/kg za den, rozdělenou do dvou dávek. U nemocných se zhoršenou renální funkcí nesmí počáteční dávka přesáhnout 2,5 mg/kg za den. U nemocných, u kterých je účinek samotného Sandimmun Neoralu nedostatečný, zejména u steroidrezistentních pacientů, se doporučuje kombinace Sandimmun Neoralu s nízkými perorálními dávkami kortikosteroidů. Není-li po 3 měsících léčby dosaženo uspokojivého terapeutického efektu, musí být léčba Sandimmun Neoralem ukončena. Dávkování je nutné individuálně upravit dle účinnosti (proteinurie) a bezpečnosti (především podle sérového kreatininu). Dávky by však neměly u dospělých překročit 5 mg/kg za den, u dětí 6 mg/kg za den. Pro udržovací léčbu musí být dávka pozvolna snižována až na nejnižší účinné množství. Revmatoidní artritida: Po dobu prvních 6 týdnů léčby se doporučuje dávka 3 mg/kg za den rozdělená do dvou dílčích dávek. Pokud není během této doby účinek léčby dostatečný, je možné denní dávku postupně zvyšovat podle individuální tolerance nemocného, nesmí však přesáhnout 5 mg/kg. K dosažení plné účinnosti může léčba Sandimmun Neoralem vyžadovat až 12 týdnů. Pro udržovací léčbu musí být dávka individuálně titrována podle snášenlivosti. Sandimmun Neoral lze podávat v kombinaci s nízkou dávkou kortikosteroidů a/nebo nesteroidních antirevmatik. Sandimmun Neoral je možné podávat v kombinaci s nízkou týdenní dávkou methotrexátu pacientům, jejichž terapeutická odpověď na samotný methotrexát není dostatečná. V takových případech se podává počáteční dávka Sandimmun Neoralu 2,5 mg/kg za den, rozdělená do dvou dávek. Toto množství lze podle snášenlivosti zvýšit. Psoriáza: Léčba musí být přísně individuální, odpovídající variabilitě onemocnění. K navození remise se doporučuje počáteční dávka 2,5 mg/kg za den rozdělená do dvou dílčích dávek. Nedojde-li po jednom měsíci léčby ke zlepšení, je možné denní dávku postupně zvyšovat, ale neměla by překročit 5 mg/kg/den. U nemocných, u nichž nemohlo být v průběhu 6 týdnů dosaženo uspokojivého zlepšení psoriatických lézí při dávce 5 mg/kg za den, nebo u těch pacientů, u kterých není účinná dávka v souladu s bezpečnostními doporučeními, musí být léčba Sandimmun Neoralem přerušena. U nemocných, jejichž stav vyžaduje rychlé zlepšení, je oprávněno podávat počáteční dávky 5 mg/kg za den. Jakmile je dosaženo uspokojivého léčebného efektu, je možné léčbu Sandimmun Neoralem přerušit a v případě následného relapsu je možné léčbu Sandimmun Neoralem znovu zahájit dříve účinnou dávkou. U některých pacientů je však nezbytná kontinuální udržovací terapie. Pro udržovací léčbu je nutné dávky individuálně titrovat na nejnižší účinnou dávku. Dávky nesmí přesáhnout 5 mg/kg za den. 3/18
4 Atopická dermatitida: Léčba musí být přísně individuální, odpovídající variabilitě onemocnění. Doporučované denní dávky se pohybují v rozmezí mezi 2,5 mg až 5,0 mg/kg/den a podávají se rozdělené do dvou dílčích dávek. Pokud není počáteční dávkou 2,5 mg/kg/den dosaženo během dvou týdnů uspokojivého léčebného efektu, je možné dávku rychle zvýšit na maximální dávku 5,0 mg/kg/den. U zvlášť závažných případů je možné dosáhnout rychlého terapeutického účinku, pokud je terapie zahájena hned dávkou 5,0 mg/kg/den. Po dosažení odpovídajícího terapeutického účinku by měla být dávka postupně snižována a pokud to stav onemocnění dovoluje, měl by být Sandimmun Neoral úplně vysazen. Případný replaps je možné zvládnout další léčebnou kúrou Sandimmun Neoralem. Pro dosažení uspokojivého terapeutického účinku stačí někdy léčba po dobu 8 týdnů, ale pro dosažení léčebného výsledku byla dobře tolerována i léčba trvající jeden rok. Přechod z klasického Sandimmunu na Sandimmun Neoral Dostupná data ukazují, že po převedení pacienta z klasického Sandimmunu na Sandimmun Neoral v poměru 1:1 jsou minimální koncentrace cyklosporinu v ustáleném stavu v plné krvi srovnatelné. Přesto se mohou u mnoha pacientů vyskytnout vyšší vrcholové koncentrace (c max ) i zvýšená expozice léku (AUC). U malého procenta pacientů mohou být tyto rozdíly výraznější a mohou mít klinický význam. Jejich velikost závisí převážně na individuálních rozdílech v absorpci cyklosporinu z klasického Sandimmunu, u kterého je známa velká variabilita v biologické dostupnosti. Pacienti s variabilními minimálními koncentracemi při rovnovážném stavu nebo při velmi vysokých dávkách Sandimmunu mohou špatně nebo nestejnoměrně absorbovat cyklosporin (např. pacienti s cystickou fibrózou, pacienti po transplantaci jater s cholestázou nebo špatnou sekrecí žluče, děti nebo někteří příjemci transplantované ledviny), ale mohou po převedení na Sandimmun Neoral začít cyklosporin dobře absorbovat. Proto může být v této populaci pacientů po převedení z klasického Sandimmunu na Sandimmun Neoral v poměru 1 : 1 zvýšení biologické dostupnosti cyklosporinu vyšší, než se očekávalo. Dávku Sandimmun Neoralu je proto nutné titrovat individuálně směrem dolů podle minimální koncentrace v ustáleném stavu. Je třeba zdůraznit, že ve srovnání s klasickým Sandimmunem absorpce cyklosporinu ze Sandimmun Neoralu je méně variabilní a korelace mezi lékovou hladinou v krvi a expozicí (vyjádřeno v AUC) je mnohem větší. Toto činí minimální koncentrace cyklosporinu v ustáleném stavu mnohem hodnotnějším a spolehlivějším parametrem pro monitorování léčby. Protože přechod z klasického Sandimmunu na Sandimmun Neoral může vyvolat zvýšenou expozici léku, měla by být dodržována následující pravidla: U pacientů po transplantaci by měla být počáteční dávka Sandimmun Neoralu stejná, jako byla dávka klasického Sandimmunu. Minimální hladiny koncentrací cyklosporinu v plné krvi by měly být monitorovány během 4-7 dnů od převedení na Sandimmun Neoral. Navíc by v prvních 2 měsících po převedení na Sandimmun Neoral měly být sledovány bezpečnostní parametry léčby (sérový kreatinin a krevní tlak). Jestliže jsou minimální koncentrace cyklosporinu v ustáleném stavu v krvi mimo terapeutické rozmezí a/nebo se zhorší klinické bezpečnostní ukazatelé léčby, je nutné odpovídajícím způsobem upravit dávku. U pacientů léčených pro jiné indikace než jsou transplantace by měla být počáteční dávka Sandimmun Neoralu také stejná, jako byla dávka klasického Sandimmunu. Druhý, čtvrtý a osmý týden po převedení na Sandimmun Neoral by měl být měřen sérový kreatinin a krevní tlak. Jestliže hladiny kreatininu nebo krevní tlak výrazně překračují hodnoty před konverzí nebo jestliže sérový kreatinin stoupne o více než 30 % nad hodnoty před zahájením léčby Sandimmunem (při opakovaném měření), by dávka měla být snížena. V případě neočekávané toxicity léčivého přípravku nebo neúčinné léčby musejí být hladiny cyklosporinu v krvi také monitorovány. Podávání Dávky uvedené pro perorální podání jsou pouze doporučením. Doporučené dávkování Sandimmun koncentrátu pro infuzní roztok je přibližně třetina příslušné perorální dávky. Je nutné pravidelně monitorovat hladiny cyklosporinu v krvi, např. použitím RIA metody založené na monoklonálních protilátkách. Získané výsledky slouží jako návod pro stanovení optimálního aktuálního dávkování tak, aby u jednotlivých pacientů bylo dosaženo požadované výsledné koncentrace. 4/18
5 Převod z jedné perorální formy cyklosporinu na druhou by měl být proveden s opatrností a za dohledu lékaře. Při zavádění nové lékové formy je nutné monitorovat hladiny cyklosporinu v krvi, aby bylo zajištěno dosažení hodnot před převodem. Perorální podání Denní dávka Sandimmun Neoralu by měla vždy být podávána rozděleně ve dvou dílčích dávkách (ráno a večer). Tobolky se polykají celé, nerozkousané. Perorální roztok Sandimmun Neoral perorální roztok se doporučuje přednostně ředit v pomerančové nebo jablečné šťávě. Podle individuální chuti pacienta lze také použít i jiné nealkoholické nápoje. Těsně před vypitím musí být perorální roztok dobře promíchán. Vzhledem k možné interferenci s enzymatickým systémem P450 nesmí být k ředění používána grapefruitová šťáva. Pipeta nesmí přijít do styku s ředicím nápojem. Při čištění se pipeta nesmí vyplachovat, ale pouze zvenku otřít suchou látkou (viz bod 6.6 Návod k použití přípravku, zacházení s ním (a k jeho likvidaci)). Starší pacienti: U starších pacientů je s léčbou Sandimmun Neoralem méně zkušeností, ale při dodržení doporučeného dávkování se nevyskytly zvláštní problémy. V klinických studiích u revmatoidní artritidy s cyklosporinem bylo 17,5 % pacientů ve věku 65 let nebo starších. U těchto pacientů byla větší pravděpodobnost, že se během léčby objeví systolická hypertenze, a po 3 až 4 měsících léčby bylo častěji pozorováno zvýšení sérového kreatininu o 50 % proti výchozí hodnotě. Klinické studie se Sandimmun Neoralem u pacientů po transplantaci a s psoriasou nezahrnovaly dostatečné množství pacientů ve věku 65 let a starších, aby bylo možné stanovit, zda na léčbu odpovídají jinak než mladší pacienti. Z ostatních hlášených klinických zkušeností nebyly identifikovatelné rozdíly v odpovědích na léčbu mezi staršími a mladými pacienty. Obecně by dávka pro starší pacienty měla být stanovena opatrně, obvyklá počáteční dávka by měla být na spodní hranici dávkového rozmezí, reflektující větší frekvenci snížení jaterních, renálních nebo srdečních funkcí a také souběžná další onemocnění nebo podávání i jiných léků. Děti: Zkušenosti s léčbou dětí Sandimmun Neoralem jsou stále ještě omezené. Avšak děti starší 1 roku snášely léčbu Sandimmun Neoralem ve standardním dávkování bez větších problémů. V několika studiích vyžadovala léčba dětí vyšší dávky na kg tělesné hmotnosti, než se používají u dospělých. Toto množství bylo přesto dobře tolerováno. 4.3 Kontraindikace Hypersenzitivita na cyklosporin nebo kteroukoli pomocnou látku obsaženou v přípravku Sandimmun Neoral. 4.4 Zvláštní upozornění a opatření pro použití Sandimmun Neoral smějí předepisovat pouze lékaři se zkušeností s imunosupresivní léčbou, kteří mohou náležitě sledovat nemocného, včetně pravidelného celkového fyzikálního vyšetření, měření krevního tlaku a kontroly laboratorních bezpečnostních parametrů. Nemocní po transplantaci mají být léčeni v zařízeních s náležitým laboratorním vybavením a dalším pomocným zdravotnickým vybavením. Lékař odpovědný za udržovací léčbu musí dostat úplné informace potřebné pro sledování nemocného. Podobně jako jiná imunosupresiva cyklosporin zvyšuje riziko vzniku lymfomů a jiných malignit, postihujících zejména kůži. Zdá se, že zvýšené riziko souvisí spíše s mírou a délkou imunosuprese než s určitým použitým přípravkem. Z tohoto důvodu je nutné opatrně používat léčebný režim s kombinací více imunosupresiv (včetně cyklosporinu), protože může vést ke vzniku lymfoproliferativních onemocnění nebo nádorových onemocnění solidních orgánů, z nichž některé, jak bylo zaznamenáno, skončily fatálně. 5/18
6 S ohledem na potenciální riziko malignit kůže by pacienti léčení Sandimmunem Neoral, zejména léčení pro psoriázu nebo atopickou dermatitidu, měli být upozorněni, že se nemají vystavovat přímému slunečnímu záření a neměli by být současně léčeni UVB ozařováním nebo PUVA fotochemoterapií. Podobně jako u jiných imunosupresiv predisponuje léčba cyklosporinem pacienty k rozvoji různých bakteriálních, mykotických, parazitárních a virových infekcí, často oportunními patogeny. U pacientů užívajících cyklosporin byla zjištěna aktivace latentních polyomavirových infekcí, které mohou vést k polyomavirové nefropatii (PVAN), zejména BK virus nefropatii (BKVN) nebo JC virové progresivní multifokální leukoencefalopatii (PML). Tyto stavy jsou často spojené s vysokou celkovou imunosupresivní zátěží a měly by být brány v potaz při diferenciální diagnostice imunosuprimovaných pacientů se zhoršenou funkcí ledvin nebo neurologickými příznaky. Byly hlášené vážné a/nebo fatální následky. Proto musí být, zejména u nemocných dlouhodobě užívajících kombinovanou imunosupresivní léčbu, učiněna efektivní preventivní a léčebná opatření. Jako častá a potenciálně závažná komplikace se může během několika prvních týdnů léčby Sandimmunem Neoral vyskytnout zvýšení sérového kreatininu a močoviny. Tyto funkční změny jsou závislé na dávce, jsou reverzibilní a reagují obvykle na snížení dávky. Během dlouhodobé léčby mohou u některých nemocných nastat strukturální změny ledvin (např. intersticiální fibróza), které musejí být u nemocných po transplantaci ledvin odlišeny od změn vzniklých v důsledku vleklých rejekčních reakcí. Sandimmun Neoral může také, v závislosti na dávce, způsobit reverzibilní zvýšení sérového bilirubinu a někdy i jaterních enzymů (viz bod 4.8 Nežádoucí účinky) U pacientů léčených cyklosporinem došlo v období po registraci k vyžádaným a spontánním hlášením hepatotoxicity a poškození jater, které zahrnovaly cholestázu, žloutenku, hepatitidu a selhání ledvin. Nejvíce případů bylo u pacientů s významnými komorbiditami, základními onemocněními a dalšími ovlivňujícími faktory včetně komplikací infekcemi a současné léčby léky s hepatotoxickým potenciálem. V některých případech, především u transplantovaných pacientů, byly hlášeny fatální následky (viz bod 4.8 Nežádoucí účinky). Je třeba pečlivě sledovat hodnoty vyšetření funkčních testů. Při abnormálním zvýšení těchto hodnot je nutná úprava dávkování. U starších pacientů je nutno zvláště pečlivě monitorovat funkci ledvin. K monitorování hladin cyklosporinu v plné krvi se dává přednost metodám používajícím specifických monoklonálních protilátek (měření hladin původního léku), ačkoli lze ke stejným účelům použít i metody HPLC. Při použití plazmy nebo séra je třeba dodržovat standardní protokol separace (čas a teplotu). Počáteční monitorování pacientů po transplantaci jater je možné provádět buď specifickými monoklonálními protilátkami, nebo současným hodnocením jak specifickými, tak i nespecifickými monoklonálními protilátkami, aby bylo stanoveno dávkování zajišťující adekvátní imunosupresi. Koncentrace cyklosporinu v krvi, plazmě a séru je pouze jedním z mnoha faktorů určujících klinický stav nemocného, a proto jsou tyto výsledky v souvislosti s jinými klinickými a laboratorními parametry pouze vodítkem při úpravě dávkování. Při léčbě Sandimmun Neoralem je nutné pravidelné sledování krevního tlaku, pokud se vyvine hypertenze, musí být zahájena vhodná antihypertenzní léčba. Vzhledem k tomu, že v ojedinělých případech bylo popsáno, že Sandimmun Neoral působí nepatrné reverzibilní zvýšení krevních lipidů, doporučuje se před léčbou a po prvním měsíci léčby stanovit hladinu lipidů v krvi. Dojde-li k jejich zvýšení, je třeba zvážit možnost zahájení diety s omezením tuků. Cyklosporin zvyšuje riziko hyperkalemie, zejména u nemocných s poruchou funkce ledvin. Zvýšená opatrnost je nutná při současném podávání cyklosporinu a kalium šetřících léčivých přípravků (např. kalium šetřících diuretik, inhibitorů ACE, blokátorů receptorů angiotenzinu II), léků obsahujících kalium, jakož i u pacientů, kteří jsou na dietě s vysokým obsahem kalia. V těchto případech se doporučuje kontrolovat kalemii. Cyklosporin zvyšuje vylučování hořčíku. To může vést k symptomatické hypomagnezemii, zejména v období kolem transplantace. Doporučuje se proto v peritransplantačním období kontrolovat sérové hladiny hořčíku, zejména u nemocných s přítomností neurologických symptomů. Je-li to považováno za nutné, měl by být podán hořčík jako doplňková léčba. Zvýšená opatrnost je vyžadována při léčbě nemocných s hyperurikemií. Během léčby cyklosporinem může být vakcinace méně účinná; je nutné se vyvarovat očkování živou atenuovanou vakcínou. 6/18
7 Pozornost je třeba věnovat současnému podávání lerkandipinu a cyklosporinu (viz bod 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce). Cyklosporin může zvýšit krevní hladiny souběžně podávaných léčivých přípravků, které jsou substrátypglykoproteinu (Pgp), jako je aliskiren (viz bod 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce). Sandimmun Neoral obsahuje ricinomakrogol, který může způsobit žaludeční problémy a průjem. Pacienti se vzácnými dědičnými problémy s intolerancí fruktózy by neměli užívat tobolky přípravku Sandimmun Neoral, protože obsahují sorbitol. Upozornění pro jiné indikace než transplantace Pacienti s poruchou renálních funkcí (vyjma nefrotického syndromu s přijatelným stupněm renální poruchy), nekontrolovanou hypertenzí, nekontrolovanými infekcemi nebo jakýmikoli zhoubnými nádory nesmějí dostávat cyklosporin. Upozornění při léčbě endogenní uveitidy Vzhledem k tomu, že Sandimmun Neoral může zhoršit renální funkce, je třeba tyto funkce často kontrolovat. Zůstává-li při více než jednom měření kreatinin zvýšen o více než 30% nad výchozí hodnoty, musí se dávka Sandimmun Neoralu o 25-50% snížit. Tato doporučení platí i tehdy, když jsou hodnoty kreatininu ještě v normálním laboratorním rozmezí. S použitím Sandimmun Neoralu u dětí s endogenní uveitidou jsou pouze omezené zkušenosti. Upozornění při léčbě nefrotického syndromu Vzhledem k tomu, že Sandimmun Neoral může zhoršit renální funkce, je třeba tyto funkce často kontrolovat. Zůstává-li při více než jednom měření kreatinin zvýšen o více než 30% nad výchozí stav, musí se dávka Sandimmun Neoralu o 25-50% snížit. U pacientů s abnormálními hodnotami renálních funkcí již před zahájením léčby by měla být léčba zahájena dávkou 2,5 mg/kg za den. Tito pacienti musejí být velmi pečlivě monitorováni. U některých pacientů může být obtížné odlišit renální dysfunkci vyvolanou Sandimmun Neoralem od změn souvisejících se samotným nefrotickým syndromem. To vysvětluje, proč byly ve vzácných případech popsány při léčbě Sandimmun Neoralem strukturální změny u ledvin, při nichž nedošlo ke zvýšení sérového kreatininu. U pacientů se steroid-dependentní nefropatií s minimálními změnami, kteří užívají Sandimmun Neoral více jak jeden rok, je nutné zvážit biopsii ledvin. U pacientů s nefrotickým syndromem léčených imunosupresivy (včetně cyklosporinu) byl ojediněle popsán výskyt malignit (včetně Hodgkinova lymfomu). Upozornění při léčbě revmatoidní artritidy Vzhledem k tomu, že Sandimmun Neoral může zhoršit renální funkce, měla by být před zahájením léčby stanovena počáteční hladina sérového kreatininu pomocí alespoň dvou měření. Sérový kreatinin by měl být v průběhu prvních 3 měsíců terapie monitorován ve dvoutýdenních intervalech, poté jednou měsíčně. Po 6 měsících léčby je třeba měřit sérový kreatinin v intervalu 4 8 týdnů, v závislosti na stabilitě choroby, dalších souběžných onemocněních a souběžně užívaných lécích. Častější kontroly jsou nezbytné, pokud se zvýší dávka Sandimmun Neoralu nebo při zahájení podávání nesteroidních antirevmatik či zvýšení jejich dávky. Zůstává-li při více než jednom měření hodnota sérového kreatininu zvýšena o více než 30% nad výchozí hodnoty, musí se dávka Sandimmun Neoralu snížit. Je-li sérový kreatinin zvýšen o více než 50% nad výchozí stav, musí být dávka Sandimmun Neoralu snížena o 50 %. Tato doporučení platí i tehdy, když jsou hodnoty ještě stále v normálním laboratorním rozmezí. Není-li snížení dávky do 1 měsíce úspěšné, musí být léčba Sandimmun Neoralem přerušena. Přerušení léčby je nezbytné i tehdy, pokud nelze hypertenzi vzniklou během léčby Sandimmun Neoralem upravit vhodnou antihypertenzní léčbou. 7/18
8 Stejně jako při dlouhodobé léčbě jinými imunosupresivy (včetně cyklosporinu) je nutno mít na paměti zvýšené riziko lymfoproliferativních chorob. Zvýšenou opatrnost je třeba dodržovat při kombinované léčbě Sandimmun Neoralem s methotrexatem. Upozornění při léčbě psoriázy Vzhledem k tomu, že Sandimmun Neoral může zhoršit renální funkce, měla by být před zahájením léčby stanovena počáteční hladina sérového kreatininu pomocí alespoň dvou měření. Sérový kreatinin by měl být v průběhu prvních 3 měsíců terapie monitorován ve dvoutýdenních intervalech, poté jednou měsíčně. Zůstává-li při více než jednom měření hodnota sérového kreatininu zvýšena o více než 30 % nad výchozí stav, musí se dávka Sandimmun Neoralu o 25-50% snížit. Tato doporučení platí i tehdy, když jsou hodnoty ještě stále v normálním laboratorním rozmezí. Není-li snížení dávky do 1 měsíce úspěšné, musí být léčba Sandimmun Neoralem přerušena. Přerušení léčby je nezbytné i tehdy, pokud nelze hypertenzi vzniklou během léčby Sandimmun Neoralem upravit vhodnou antihypertenzní léčbou. Starší pacienti by měli být léčeni pouze při invalidizující psoriáze a renální funkce by u nich měly být kontrolovány zvlášť pečlivě. S použitím Sandimmun Neoralu u dětí s psoriázou jsou pouze omezené zkušenosti. Při léčbě cyklosporinem, stejně jako při konvenční léčbě imunosupresivy, byl u nemocných s psoriázou popsán výskyt malignit (zejména kožních). Při kožních lézích netypických pro lupenku nebo při podezření na malignitu nebo premalignitu je nezbytné před zahájením léčby Sandimmun Neoralem provést jejich bioptické vyšetření. Nemocní s maligními nebo premaligními změnami kůže se smějí léčit Sandimmun Neoralem pouze po odpovídající léčbě těchto lézí a pokud pro úspěšnou léčbu psoriázy neexistuje jiná možnost. U několika nemocných s psoriázou léčených Sandimmunem se vyskytly lymfoproliferativní choroby. Reagovaly však příznivě na okamžité přerušení léčby. Pacienti užívající Sandimmun Neoral by neměli být současně léčeni UVB ozařováním nebo PUVA fotochemoterapií. Upozornění při léčbě atopické dermatitidy Vzhledem k tomu, že Sandimmun Neoral může zhoršit renální funkce, měla by být před zahájením léčby spolehlivě stanovena počáteční hladina sérového kreatininu pomocí alespoň dvou měření. Sérový kreatinin by měl být v průběhu prvních 3 měsíců terapie monitorován ve dvoutýdenních intervalech, poté jednou měsíčně, pokud zůstávají hodnoty kreatininu stabilní. Je-li při více než jednom měření kreatinin zvýšen o více než 30% nad výchozí stav, musí se dávka Sandimmun Neoralu o 25-50% snížit. Tato doporučení platí i tehdy, když jsou hodnoty ještě stále v normálním laboratorním rozmezí. Není-li snížení dávky do 1 měsíce úspěšné, musí být léčba Sandimmun Neoralem přerušena. Přerušení léčby je nezbytné i tehdy, pokud nelze hypertenzi vzniklou během léčby Sandimmun Neoralem upravit vhodnou antihypertenzní léčbou. Zkušenosti s použitím Sandimmun Neoralu u dětí s atopickou dermatitidou jsou stále omezené. Starší pacienti by měli být léčeni pouze při invalidizující atopické dermatitidě a renální funkce by u nich měly být kontrolovány zvlášť pečlivě. Výskyt benigní lymfadenopatie je běžně doprovázen vzplanutími atopické dermatitidy, která vždy vymizí spontánně nebo při celkovém zlepšení onemocnění. Lymfadenopatie zjištěná při léčbě cyklosporinem by měla být pravidelně kontrolována. Lymfadenopatie perzistující i při ústupu aktivity onemocnění by měla být preventivně biopticky vyšetřena, aby bylo možné vyloučit lymfom. Aktivní infekci Herpes simplex je vhodné nechat před zahájením léčby Sandimmun Neoralem odeznít. Objeví-li se během podávání Sandimmun Neoralu a pokud nejde o infekci se závažným průběhem, není to nezbytný důvod k přerušení léčby. Kožní infekce kmenem Staphylococcus aureus není absolutní kontraindikací pro léčbu Sandimmun Neoralem, ale měla by být kontrolována vhodným antibakteriálním lékem. Perorální podávání erytromycinu není vhodné, protože může vyvolat zvýšení koncentrace cyklosporinu v krvi (viz bod 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce) nebo pokud není jiná alternativa léčby, doporučuje se pečlivě monitorovat hladinu cyklosporinu v krvi, renální funkce a nežádoucí účinky cyklosporinu. 8/18
9 Pacienti užívající Sandimmun Neoral by neměli být současně léčeni UVB ozařováním nebo PUVA fotochemoterapií. Pediatrické užití při jiných indikacích než transplantačních Odpovídající zkušenosti s použitím přípravku Sandimmun Neoral nejsou s výjimkou léčby nefrotického syndromu dostupné; proto jeho použití u dětí mladších 16 let pro netranspantační indikace s výjimkou nefrotického syndromu nelze doporučit. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Potravinové interakce Při současném užívání grapefruitové šťávy bylo zaznamenáno zvýšení biologické dostupnosti cyklosporinu. Při souběžném příjmu potravy bohaté na tuky bylo hlášené zvýšení biologické dostupnosti perorálních forem Sandimmunu. Lékové interakce Z množství léků se zaznamenanou interakcí s cyklosporinem, jsou v následujícím výčtu uvedeny ty léky, u nichž je interakce řádně doložena a má klinický význam. U mnoha přípravků je známo, že zvyšují nebo snižují hladinu cyklosporinu v plazmě nebo krvi, obvykle na podkladě inhibice nebo indukce enzymů zapojených do metabolismu cyklosporinu, zejména CYP3A4. Cyklosporin je také inhibitor CYP3A4 a efluxního transportního systému P-glykoproteinu mnoha léků a může zvýšit plazmatické hladiny současně podávaných látek, které jsou substráty tohoto enzymu a/nebo transportéru. Léky snižující hladinu cyklosporinu: Barbituráty, karbamazepin, oxkarbazepin, fenytoin; nafcilin, sulfadimidin i.v.; rifampicin; oktreotid; probukol; orlistat; Hypericum perforatum (třezalka tečkovaná); tiklopidin, sulfinpyrazon, terbinafin, bosentan. Léky zvyšující hladinu cyklosporinu: Makrolidová antibiotika (např. erytromycin, azitromycin a klaritromycin); ketokonazol, flukonazol, itrakonazol, vorikonazol; diltiazem, nikardipin, verapamil; metoklopramid; perorální kontraceptiva; danazol; metylprednisolon (ve vysokých dávkách); alopurinol; amiodaron; kyselina cholová a její deriváty, inhibitory proteázy, imatinib; kolchicin, nefazodon. Jiné lékové interakce Při užívání cyklosporinu s jinými léky je třeba věnovat zvýšenou pozornost lékům, které mají nefrotoxický synergistický účinek: např. aminoglykosidy (např. gentamicin, tobramycin), amfotericin B, ciprofloxacin, vankomycin, trimetoprim (+ sulfametoxazol); nesteroidní antirevmatika (např. diklofenak, naproxen, sulindak); melfalan, antagonisté H 2 receptorů (např. cimetidin, ranitidin); methotrexát (viz bod 4.4. Zvláštní upozornění a opatření pro použití). Je nutné se vyvarovat souběžnému podávání takrolimu z důvodu možného zvýšení nefrotoxicity. Při současném podávání nifedipinu s cyklosporinem může docházet ke zvýšení výskytu hyperplázie dásní, než když je užíván cyklosporin samotný. Při současném podávání lerkandipinu a cyklosporinu se AUC lerkandipinu zvýšila třikrát a AUC cyklosporinu se zvýšila o 21%. Proto se při současném podávání lerkandipinu a cyklosporinu doporučuje zvláštní opatrnost (viz bod 4.4. Zvláštní upozornění a opatření pro použití). Cyklosporin je vysoce účinný inhibitor Pgp a může zvýšit krevní hladiny současně podávaných léků, které jsou substráty Pgp, jako je aliskiren. Po souběžném podání cyklosporinu a aliskirenu došlo ke zvýšení Cmax aliskirenu 2,5x a zvýšení AUC přibližně 5x. Nicméně farmakokinetický profil cyklosporinu nebyl významně pozměněn. Při souběžném podávání cyklosporinu a aliskirenu se doporučuje dbát zvýšené opatrnosti (viz bod 4.4 Zvláštní upozornění a opatření pro použití). Při současném podávání diklofenaku a cyklosporinu dochází ke zvýšení biologické dostupnosti diklofenaku, což může vést ke vzniku reverzibilní poruchy renálních funkcí. Zvýšení biologické dostupnosti diklofenaku 9/18
10 je nejspíše způsobeno snížením jeho vysoké biotransformace při prvém průchodu játry ( first-pass efektem). Při současném podávání cyklosporinu s nesteroidními antirevmatiky s nízkou biotransformací při prvém průchodu játry ( first-pass efektem), např. kyselina acetylsalicylová, lze očekávat, že jejich biologická dostupnost nebude zvýšena. Cyklosporin může snižovat clearance digoxinu, kolchicinu, prednisolonu a inhibitorů HMG-CoA reduktázy (statinů) a etoposidu. U několika pacientů, kteří užívali digoxin, byla během několika dnů po zahájení léčby cyklosporinem pozorována závažná digitalisová toxicita. Existují také zprávy o potenciálu cyklosporinu zvyšovat toxické účinky kolchicinu, jako je myopatie, neuropatie, a to především u pacientů s poruchou renálních funkcí. Pokud jsou digoxin nebo kolchicin podávány současně s cyklosporinem, je nezbytné pečlivé klinické sledování pacienta, aby bylo možné časné zaznamenání manifestace toxicity digoxinu nebo kolchicinu s následným snížením dávky nebo jeho vysazením. Po souběžné aplikaci cyklosporinu s lovastatinem, simvastatinem, atorvastatinem, pravastatinem, vzácně s fluvastatinem byly hlášeny literární nebo postmarketingové případy myotoxicity zahrnující svalovou slabost nebo bolestivost, myositidu a rhabdomyolýzu. Pokud jsou tyto statiny souběžně podávány s cyklosporinem, měla by být jejich dávka snížena podle doporučení. U pacientů s příznaky nebo projevy myopatie, zvýšených rizikových faktorů s predispozicí k závažnému poškození ledvin, včetně renálního selhání, sekundární rhabdomyolýzy, je nutné léčbu statiny dočasně vysadit nebo přerušit. Zvýšené hladiny kreatininu v séru byly pozorovány ve studiích, kdy byl užíván everolimus nebo sirolimus v kombinaci s plnou dávkou cyklosporinu pro mikroemulzi.při snížení dávky cyklosporinu je tento účinek často reverzibilní. Everolimus a sirolimus mají pouze minimální vliv na farmakokinetiku cyklosporinu. Souběžná aplikace cyklosporinu signifikantně zvyšuje hladiny everolimu a sirolimu v krvi. Opatrnost je nutná při současném podávání přípravků šetřících draslík (např. draslík šetřící diuretika, ACE inhibitory, antagonisté receptorů angiotensinu II nebo přípravky obsahující draslík, protože po jejich podání může dojít k významnému vzestupu hladin draslíku v séru (viz bod 4.4 Zvláštní upozornění a opatření pro použití). Cyklosporin může zvyšovat plazmatické koncentrace repaglinidu a tím zvyšovat riziko hypoglykemie. Doporučení Pokud se nelze vyhnout současnému podávání léků, u nichž je známa interakce s cyklosporinem, doporučují se následující základní opatření: Během současného podávání léků s možným synergistickým nefrotoxickým účinkem musí být prováděno pečlivé monitorování renálních funkcí (zejména sérového kreatininu). Při významném zhoršení renálních funkcí je nutné snížit dávku současně podávaného léku anebo zvážit alternativní způsob léčby. U pacientů po transplantaci byly hlášeny ojedinělé případy významného, ale reverzibilního zhoršení funkce ledvin (s odpovídajícím zvýšením kreatininu v séru) po následném podání derivátů kyseliny fibrové (např. bezafibrátu, fenofibrátu). U těchto pacientů musejí být proto pečlivě sledovány funkce ledvin. V případě významného zhoršení funkce ledvin musí být souběžné podávání léku ukončeno. Léky snižující nebo zvyšující biologickou dostupnost cyklosporinu: u transplantovaných pacientů se vyžaduje časté stanovování hladin cyklosporinu a v nezbytných případech úprava dávky cyklosporinu, zejména při zahájení nebo vysazení tohoto současně podávaného léku. U netransplantovaných pacientů je význam stanovování hladin cyklosporinu v krvi sporný, protože u těchto pacientů není vztah mezi hladinou cyklosporinu v krvi a klinickým účinkem jasně stanoven. U léků, které zvyšují hladinu cyklosporinu a jsou podávány současně, je vhodnější pečlivě sledovat funkce ledvin a možné nežádoucí účinky cyklosporinu, než monitorovat hladiny cyklosporinu v krvi. Pacientům, u nichž při užívání cyklosporinu dojde ke vzniku hypertrofie dásní, nesmí být podáván nifedipin. Nesteroidní antirevmatika, která podléhají výrazné metabolizaci při prvém průchodu játry first-pass metabolism (např. diklofenak), musejí být podávána v nižších dávkách, než se používají u pacientů, kteří neužívají cyklosporin. 10/18
11 Při současném užívání digoxinu, kolchicinu nebo inhibitorů HMG-CoA reduktázy (statinů) společně s cyklosporinem se vyžaduje pečlivé sledování klinického stavu, aby se včas odhalily toxické projevy léku, vyžadující snížení jeho dávky nebo jeho vysazení. 4.6 Těhotenství a kojení Těhotenství Ve studiích na zvířatech se ukázala reprodukční toxicita u potkanů a králíků. Zkušenosti se Sandimmun Neoralem u těhotných žen jsou omezené. U těhotných transplantovaných pacientek léčených imunosupresivy po transplantaci, včetně cyklosporinu a léčebných režimů s cyklosporinem, existuje zvýšené riziko předčasného porodu ( 37 týdnů). O dětech vystavených cyklosporinu in utero je omezený počet údajů, a to do věku cca 7 let. Renální funkce a krevní tlak u těchto dětí byly normální. Nicméně neexistují adekvátní kontrolované klinické studie u těhotných žen, proto se Sandimmun Neoral nesmí užívat v těhotenství, pokud potenciální přínos pro matku nezdůvodní potenciální riziko pro plod. Kojení Cyklosporin přechází do mateřského mléka, a proto matky léčené Sandimmun Neoralem nesmějí kojit. 4.7 Účinky na schopnost řídit a obsluhovat stroje Nejsou známy údaje o tom, že by Sandimmun Neoral ovlivňoval schopnost řídit nebo obsluhovat stroje Nežádoucí účinky Mnoho nežádoucí účinků spojených s podáváním cyklosporinu je závislých na dávce a reagují příznivě na její snížení. V různých indikacích je celkové spektrum nežádoucích účinků v podstatě stejné. Jsou zde však rozdíly v jejich incidenci a závažnosti. Důsledkem vyšších počátečních dávek a delší udržovací léčby u pacientů po transplantaci jsou nežádoucí účinky častější a obvykle závažnější než u pacientů léčených pro jiné indikace. Po i.v. podání byly pozorovány anafylaktoidní reakce (viz bod 4.4 Zvláštní upozornění a opatření pro použití). Infekční a parazitární onemocnění Pacienti s imunosupresivní léčbou, včetně cyklosporinu a léčebných režimů s cyklosporinem, mají zvýšené riziko infekcí (virových, bakteriálních, plísňových, parazitárních) (viz bod 4.4 Zvláštní upozornění a opatření pro použití). Vyskytují se infekce celkové i lokální. Mohou se zhoršit i již existující infekce a reaktivace polyomavirových infeckí může vést k polyomavirové nefropatii (PVAN) nebo k JC virové progresivní multifokální leukoencefalopatii (PML). Byly hlášeny i vážné a/nebo fatální případy. Nádory benigní, maligní a nespecifikované (včetně cyst a polypů) Pacienti s imunosupresivní léčbou, včetně cyklosporinu a léčebných režimů s cyklosporinem, mají zvýšené riziko rozvoje lymfonů nebo lymfomproliferativních onemocnění a dalších zhoubných nádorů, zvláště na kůži. Četnost malignit se zvyšuje s intenzitou a trváním léčby viz bod 4.4 Zvláštní upozornění a opatření pro použití). Některé malignity mohou být fatální. Nežádoucí účinky (Tabulka 1) jsou řazeny podle klesající závažnosti. Pro frekvenci výskytu nežádoucích účinků bylo použito následující hodnocení: velmi časté ( 1/10), časté ( 1/100 až <1/10), méně časté ( 1/1000 až <1/100), vzácné ( 1/10000 až <01/1000), velmi vzácné (<10000), není známo (z dostupných údajů nelze určit). Tabulka 1 Poruchy krve a lymfatického systému Méně časté: Vzácné: Poruchy metabolismu a výživy Anemie, trombocytopenie Mikroangiopatická hemolytická anemie, hemolyticko-uremický syndrom 11/18
12 Velmi časté: Časté: Vzácné: Poruchy nervového systému Velmi časté: Časté: Méně časté: Vzácné: Velmi vzácné: Cévní poruchy Velmi časté Gastrointestinální poruchy Časté: Vzácné: Poruchy jater a žlučových cest Časté: Hyperlipidemie Anorexie, hyperurikemie, hyperkalemie, hypomagnesemie (viz bod 4.4 Zvláštní upozornění a opatření pro použití) Hyperglykemie Třes, bolesti hlavy včetně migrény Parestezie Známky encefalopatie, např. křeče, zmatenost, dezorientace, snížená schopnost reakcí, agitovanost, nespavost, poruchy vidění, kortikální slepota, kóma, paréza, cerebelární ataxie Motorická polyneuropatie Edém oční čočky včetně papily zrakového nervu se zhoršením zraku a sekundární benigní intrakraniální hypertenzí Hypertenze Poruchy kůže a podkožní tkáně Časté: Hypertrichóza Méně časté: Alergická vyrážka Poruchy svalové a kosterní soustavy a pojivové tkáně Časté: Svalové křeče, myalgie Vzácné: Svalová slabost, myopatie Poruchy ledvin a močových cest Velmi časté: Nauzea, zvracení, bolesti břicha, průjem, hypertrofie dásní, Pankreatitida Neobvyklá funkce jater (viz bod 4.4 Zvláštní upozornění a opatření pro použití) Renální dysfunkce (viz bod 4.4 Zvláštní upozornění a opatření pro použití) Poruchy reprodukčního systému a prsu Vzácné: Poruchy menstruace, gynekomastie Celkové poruchy a rekce v místě aplikace Časté: Únava Méně časté: Edém, zvýšení tělesné hmotnosti Další nežádoucí lékové účinky hlášené po uvedení na trh U pacientů léčených cyklosporinem došlo v období po registraci k vyžádaným a spontánním hlášením hepatotoxicity a poškození jater, které zahrnovaly cholestázu, žloutenku, hepatitidu a selhání ledvin. Nejvíce případů bylo u pacientů s významnými komorbiditami, základními onemconěními a dalšími ovlivňujícími faktory včetně komplikací infekcemi a současné léčby léky s hepatotoxickým potenciálem. V některých případech, především u transplantovaných pacientů, byly hlášeny fatální následky (viz bod 4.4 Zvláštní upozornění a opatření pro použití) Předávkování Perorální LD 50 cyklosporinu je mg/kg u myší, mg/kg u potkanů a > mg/kg u králíků. Po i.v. podání je LD 50 cyklosporinu 148 mg/kg u myší, 104 mg/kg u potkanů a 46 mg/kg u králíků. Příznaky: S akutním předávkováním Sandimmunem je jen málo zkušeností. Po perorálním podávání byly dávky až do 10 g (přibližně 150 mg/kg) poměrně dobře snášeny, s relativně minimálními klinickými projevy, jako je zvracení, ospalost, bolesti hlavy, tachykardie a u několika pacientů se objevila středně závažná, reverzibilní porucha ledvinných funkcí. Avšak závažné případy intoxikace byly popsány u nezralých novorozenců po náhodném parenterálním předávkování. 12/18
13 Léčba U všech případů předávkování by měla být aplikována celková podpůrná a symptomatická léčba. Do několika hodin po perorálním požití může být účinný výplach žaludku a vyvolání zvracení. Cyklosporin není významnou měrou dialyzovatelný ani odstranitelný z těla hemoperfuzí s použitím aktivního uhlí. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: Imunosupresiva, inhibitory kalcineurinu; ATC kód: L04ADA01 Cyklosporin (známý také jako cyklosporin A) je cyklický polypeptid složený z 11 aminokyselin. Je to silné imunosupresivum prodlužující u zvířat přežívání alogenních transplantátů kůže, srdce, ledvin, pankreatu, kostní dřeně, tenkého střeva a plic. Studie ukazují, že cyklosporin tlumí reakce zprostředkované buňkami, včetně imunity vůči alotransplantátu, dále opožděnou kožní přecitlivělost, experimentální alergickou encefalomyelitidu, Freundovu adjuvantní artritidu, reakce mezi transplantátem a příjemcem (GVHD) a také tvorbu protilátek T lymfocyty. Na buněčné úrovni tlumí tvorbu a uvolňování lymfokinů včetně interleukinu- 2 (růstového faktoru T lymfocytů TCGF). Zdá se, že cyklosporin blokuje klidové lymfocyty ve fázi G 0 nebo G 1 buněčného cyklu a tlumí antigenem vyvolané uvolňování lymfokinů z aktivovaných T lymfocytů. Všechny dostupné důkazy naznačují, že cyklosporin působí na lymfocyty specificky a reverzibilně. Na rozdíl od cytostatik nesnižuje cyklosporin hemopoézu a neovlivňuje funkci fagocytů. Nemocní léčení Sandimmun Neoralem jsou méně náchylní k infekci, než nemocní užívající jinou imunosupresivní léčbu. U člověka byly provedeny úspěšné transplantace parenchymatózních orgánů a kostní dřeně s použitím cyklosporinu k prevenci a k léčbě odvržení štěpu a GVHD. Cyklosporin byl úspěšně použit u hepatitidy C (HCV) pozitivních a HCV negativních příjemců transplantátů jater. Léčebné účinky cyklosporinu byly prokázány také u různých stavů, o nichž se ví nebo předpokládá, že jsou autoimunního původu Farmakokinetické vlastnosti Po aplikaci Sandimmun Neoralu dojde ke zlepšení linearity vztahu dávky a expozice k cyklosporinu (AUC B ) a je více konzistentní profil absorpce, který je méně ovlivňován současným příjmem stravy a denním rytmem, než tomu bylo u klasické formy cyklosporinu Sandimmunu. Tyto vlastnosti přinášejí nižší variabilitu hladin jak u jednoho pacienta, tak i při srovnání několika pacientů, a také větší korelaci mezi trough minimální koncentrací cyklosporinu v ustáleném stavu (c min ) v krvi a celkovou expozicí (AUC B ). Důsledkem těchto přídatných výhodných vlastností je, že při podávání Sandimmun Neoralu již není nutné brát zřetel na současný příjem potravy. Navíc při udržovací terapii Sandimmun Neoral zabezpečuje mnohem stálejší expozici k cyklosporinu během dne, jakož i dlouhodobě. Sandimmun Neoral měkké želatinové tobolky a Sandimmun Neoral perorální roztok jsou bioekvivalentní. Dostupná data ukazují, že po konverzi z klasického Sandimmunu na Sandimmun Neoral v poměru 1:1 jsou minimální koncentrace v ustáleném stavu v plné krvi srovnatelné a zůstávají v požadovaném terapeutickém rozmezí. Sandimmun Neoral se rychleji vstřebává ve srovnání s perorální formou klasického Sandimmunu, který dosahuje maximálních koncentrací během 1 6 hodin. Výsledkem je o hodinu rychlejší dosažení t max a o 59% vyšší c max. Sandimmun Neoral vykazuje v průměru o 29% vyšší biologickou dostupnost než klasický Sandimmun. Cyklosporin se distribuuje hlavně mimo krevní objem. V krvi je 33-47% cyklosporinu obsaženo v plazmě, 4-9% v lymfocytech, 5-12% v granulocytech a 41-58% v erytrocytech. Přibližně 90% cyklosporinu se v plazmě váže na proteiny, především na lipoproteiny. Cyklosporin je poměrně rychle metabolizován na přibližně 15 metabolitů. Cyklosporin není metabolizován pouze jednou metabolickou cestou. Vylučován je přednostně žlučí, pouze 6% podané perorální dávky je vylučováno močí, a pouze 0,1% je vylučováno močí v nezměněné formě. Údaje o konečném poločase cyklosporinu se velmi liší, záleží na použité metodě stanovení a vzorku populace. Terminální poločas se pohybuje v rozmezí mezi 6,3 hodin u zdravých pacientů až 20,4 hodin u pacientů se závažným poškozením jater Předklinické údaje vztahující se k bezpečnosti Mutagenní nebo teratogenní účinky cyklosporinu nebyly potvrzeny v žádném ze standardních testovacích systémů při perorálním podání (potkani do 17 mg/kg a králíci do 30 mg/kg denně p.o.). Při toxických 13/18
14 perorálních dávkách (30 mg/kg u potkanů a 100 mg/kg u králíků denně p.o.) byl cyklosporin embryo- a fetotoxický, pro což svědčí zvýšená prenatální a postnatální mortalita, jakož i snížená hmotnost plodu spolu s opožděným vývojem kostry. Ve dvou publikovaných výzkumných studiích se u králíků vystavených cyklosporinu in utero (10 mg/kg/den subkutánně) vyskytoval snížený počet nefronů, renální hypertrofie, systémová hypertenze a progresivní renální insuficience až do 35 týdnů věku. Březí samice potkanů, které dostávaly 12 mg/kg/den cyklosporinu intravenózně (dvojnásobek doporučené lidské intravenózní dávky), měly plody se zvýšenou incidencí defektů komorové přepážky. Tyto nálezy se neprojevily u jiných druhů a jejich význam pro člověka není znám. Studie kancerogenity byly prováděny u samců i samic potkanů i myší. V 78týdenní studii na myších byl při dávkách 1, 4 a 16 mg/kg/den zaznamenán statisticky významný trend k lymfocytárním lymfomům u samic a incidence hepatocelulárního karcinomu při středních dávkách byla, v porovnání s kontrolami, významně zvýšená u samců. Ve 24měsíční studii na potkanech byl, v porovnání s kontrolami, při dávkách 0,5, 2 a 8 mg/kg/den zaznamenán významně zvýšený výskyt pankreatického adenomu při nízkých dávkách. Incidence hepatocelulárního karcinomu a pankreatického adenomu nebyla závislá na dávkách cyklosporinu. Ve studiích u samců ani samic potkanů nebyly zjištěny poruchy fertility. Cyklosporin nebyl v následujících testech nalezen jako mutagenní/genotoxický (Amesův test, v79-hgprt test, mikronukleární test u myší a čínských křečků, test získaných chromozomálních aberací v kostní dřeni čínských křečků, dominantně letální test u myší, DNA test na spermatu myší). V in vitro testu výměny sesterských chromatid (SCE) indukcí cyklosporinem na lidských lymfocytech byl při vysokých koncentracích v tomto systému náznak pozitivity (tzn. indukce výměny sesterských chromatid). Zvýšená incidence malignit je dobře známou komplikací imunosupresivní léčby u pacientů po transplantaci orgánů. Nejčastějšími nádory jsou non-hodgkinský lymfom a karcinomy kůže. Riziko malignit při léčbě cyklosporinem je vyšší než u normální, zdravé populace, ale podobné jako u pacientů léčených jinými imunosupresivy. Bylo popsáno, že při snížení nebo vysazení imunosuprese může dojít k regresi lézí. 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Měkké želatinové tobolky: Obsah tobolek: Tokoferol -alfa, bezvodý ethanol, propylenglykol, čištěný kukuřičný olej, ricinomakrogol Složení tobolky: černý oxid železitý (E172) (tobolky 25 a 100 mg), oxid titaničitý (E171), glycerol, propylenglykol, želatina, ethanol 90%. Potisk tobolky: karmín, chlorid hlinitý, hydroxid sodný, hydroxypropylmethylcelulosa Perorální roztok: Tokoferol -alfa, bezvodý ethanol, propylenglykol, čištěný kukuřičný olej, ricinomakrogol, dusík 6.2 Inkompatibility Pro tobolky a perorální roztok nejsou popsány. 6.3 Doba použitelnosti Perorální roztok: 3 roky Tobolky: 3 roky 6.4 Zvláštní opatření pro uchovávání Měkké tobolky: Uchovávejte při teplotě do 25 C v původním obalu, aby byl léčivý přípravek chráněn před vzdušnou vlhkostí Perorální roztok: Uchovávejte při teplotě do 25 C v původním obalu, aby byl léčivý přípravek chráněn před vzdušnou vlhkostí. Sandimmun Neoral musí být uchováván mimo dosah a dohled dětí. 14/18
15 6.4 Druh obalu a velikost balení Sandimmun Neoral, měkké želatinové tobolky: Al/Al blistr, krabička Sandimmun Neoral, perorální roztok: 50 ml šroubovací lékovka z hnědého skla s kovovým uzávěrem,, žlutozelený kryt z plastické hmoty, se šroubovacím uzávěrem, injekční stříkačka z plastické hmoty s kanylou v PE rource, černý PE kryt, tvarovaná folie, krabička. Velikost balení: 50 x 25 mg měkké tobolky 50 x 50 mg měkké tobolky 50 x 100 mg měkké tobolky 50 ml perorální roztok 6.5. Návod k použití přípravku, zacházení s ním (a k jeho likvidaci) K balení připravku Sandimmun Neoral, perorální roztok jsou přiloženy dvě stříkačky k odměření dávek. Stříkačka o objemu 1 ml je určena k odměření dávek do 1 ml (každý stupeň 0,05 ml odpovídá 5 mg cyklosporinu). Stříkačka o objemu 4 ml je určena k odměření dávek vyšších než 1 ml až do objemu 4 ml (každý stupeň 0,1 ml odpovídá 10 mg cyklosporinu). První použití Sandimmun Neoral perorálního roztoku 15/18
16 1. Odklopte kryt ve středu kovového uzávěru 2. Odstraňte kompletně celý kovový uzávěr 3. Odstraňte černou zátku a vyhoďte ji. 4. Zatlačte kanylu s bílým uzávěrem pevně do hrdla lahvičky. 16/18
17 5. Podle velikosti předepsaného objemu vyberte odpovídající stříkačku. Pro objem do 1 ml použijte stříkačku o objemu 1 ml, pro objem větší než 1 ml použijte stříkačku o objemu 4 ml. Na bílý uzávěr nasaďte ústí stříkačky. 6. Natáhněte předepsaný objem do stříkačky (poloha spodního kroužku pístu na stupnici souhlasí s předepsaným objemem). 7. Dříve, než sundáte stříkačku, odstraňte velké bubliny několikerým natažením a vytlačení obsahu stříkačky zpět. Přítomnost několika nepatrných bublinek není důležitá a neovlivní dávkování. 8. Obsah stříkačky vystříkněte do malé skleničky s trochou tekutiny, ale nikoli s grapefruitovým džusem. Přiložená stříkačka nesmí přijít do styku s tekutinou ve skleničce. Těsně před užitím může být lék smíchán. Obsah skleničky zamíchejte a okamžitě celý obsah vypijte. Prosím, užijte lék okamžitě po přípravě. Po vypití se sklenička naplní ještě jednou stejnou tekutinou a znovu se vypije. Tím je zajištěno, že byla podána celá dávka. 9. Po použití stříkačku nevyplachujte, osušte pouze zvenku stříkačku suchým hadříkem a vraťte ji do obalu. Bílý uzávěr s kanylou zůstávají v lahvičce. Lahvičku uzavřete přiloženým krytem. Následné použití Začněte od bodu DRŽITEL ROZHODNUTÍ O REGISTRACI Novartis s.r.o., Praha, Česká republika. 17/18
18 8. REGISTRAČNÍ ČÍSLO(A) Sandimmun Neoral 25 mg: 59/649/95 A/C Sandimmun Neoral 50 mg: 59/649/95 B/C Sandimmun Neoral 100 mg: 59/649/95 C/C Sandimmun Neoral 100mg/ml: 59/665/95 - C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE / DATUM REVIZE TEXTU /18
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Ethanol: 100 mg/tobolka. Sandimmun Neoral měkké tobolky obsahuje 11,8 % v/v ethanolu (9,4 %
 sp. zn. sukls61688/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Sandimmun Neoral 25 mg Sandimmun Neoral 50 mg Sandimmun Neoral 100 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka
sp. zn. sukls61688/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Sandimmun Neoral 25 mg Sandimmun Neoral 50 mg Sandimmun Neoral 100 mg měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls232350/2009, sukls232352/2009, sukls232353/2009, sukls232354/2009 a příloha k sp.zn.: sukls14030/2006, sukls14031/2006, sukls14032/2006, sukls14033/2006,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls232350/2009, sukls232352/2009, sukls232353/2009, sukls232354/2009 a příloha k sp.zn.: sukls14030/2006, sukls14031/2006, sukls14032/2006, sukls14033/2006,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SANDIMMUN koncentrát pro přípravu infuzního roztoku Ciclosporinum
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls120568/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SANDIMMUN koncentrát pro přípravu infuzního roztoku Ciclosporinum Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls120568/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SANDIMMUN koncentrát pro přípravu infuzního roztoku Ciclosporinum Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn.: sukls42222/2010, sukls42224/2010, sukls42228/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Equoral 25 mg Equoral 50 mg Equoral 100 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje
sp. zn.: sukls42222/2010, sukls42224/2010, sukls42228/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Equoral 25 mg Equoral 50 mg Equoral 100 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198662/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198662/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls198662/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum
PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
 PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE Poznámka: Tato verze souhrnu údajů o přípravku, údajů na obalech a příbalové informace je platná v době vydání rozhodnutí komise.
PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE Poznámka: Tato verze souhrnu údajů o přípravku, údajů na obalech a příbalové informace je platná v době vydání rozhodnutí komise.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls269493/2018, sukls270381/2018, sukls270421/2018 1. NÁZEV PŘÍPRAVKU Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum SOUHRN ÚDAJŮ O PŘÍPRAVKU
sp. zn. sukls269493/2018, sukls270381/2018, sukls270421/2018 1. NÁZEV PŘÍPRAVKU Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum SOUHRN ÚDAJŮ O PŘÍPRAVKU
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127978/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclaid 100 mg/ml, perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ciclosporinum 100
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127978/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclaid 100 mg/ml, perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ciclosporinum 100
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
sp.zn.: sukls76097/2009 a sp.zn.: sukls222992/2013
 sp.zn.: sukls76097/2009 a sp.zn.: sukls222992/2013 Příbalová informace: informace pro pacienta Sandimmun Neoral 100 mg/ml perorální roztok ciclosporinum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn.: sukls76097/2009 a sp.zn.: sukls222992/2013 Příbalová informace: informace pro pacienta Sandimmun Neoral 100 mg/ml perorální roztok ciclosporinum Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls153628/2010
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls153628/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SANDIMMUN NEORAL 100 mg/ml perorální roztok Ciclosporinum Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls153628/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SANDIMMUN NEORAL 100 mg/ml perorální roztok Ciclosporinum Přečtěte si pozorně celou příbalovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK CYCLAID UŽÍVAT
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls234832, sukls234833/2009, sukls234834/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyclaid 25 mg Cyclaid 50 mg Cyclaid 100 mg měkké tobolky
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls234832, sukls234833/2009, sukls234834/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyclaid 25 mg Cyclaid 50 mg Cyclaid 100 mg měkké tobolky
10. Jak léčím já. 17. října 2009 PROGRAM DERMATOLOGICKÉ SYMPOZIUM V ÚSTÍ NAD LABEM
 Česká dermatovenerologická společnost ČLS JEP Kožní sanatorium, spol. s r. o. za organizačního zajištění BOS. org s. r. o. pořádá 10. DERMATOLOGICKÉ SYMPOZIUM V ÚSTÍ NAD LABEM Jak léčím já 17. října 2009
Česká dermatovenerologická společnost ČLS JEP Kožní sanatorium, spol. s r. o. za organizačního zajištění BOS. org s. r. o. pořádá 10. DERMATOLOGICKÉ SYMPOZIUM V ÚSTÍ NAD LABEM Jak léčím já 17. října 2009
Příbalová informace: informace pro pacienta. Sandimmun 50 mg/ml koncentrát pro infuzní roztok Ciclosporinum
 sp. zn. sukls165150/2014 a k sp. zn. sukls172732/2014 Příbalová informace: informace pro pacienta Sandimmun 50 mg/ml koncentrát pro infuzní roztok Ciclosporinum Přečtěte si pozorně celou příbalovou informaci
sp. zn. sukls165150/2014 a k sp. zn. sukls172732/2014 Příbalová informace: informace pro pacienta Sandimmun 50 mg/ml koncentrát pro infuzní roztok Ciclosporinum Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum
 sp. zn. sukls242335/2015 a k sp. zn. sukls40569/2014 Příbalová informace: informace pro pacienta Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum Přečtěte
sp. zn. sukls242335/2015 a k sp. zn. sukls40569/2014 Příbalová informace: informace pro pacienta Ciclosporin Mylan 25 mg Ciclosporin Mylan 50 mg Ciclosporin Mylan 100 mg měkké tobolky ciclosporinum Přečtěte
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cyclaid 100 mg/ml perorální roztok ciclosporinum
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls127978/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyclaid 100 mg/ml perorální roztok ciclosporinum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls127978/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyclaid 100 mg/ml perorální roztok ciclosporinum Přečtěte si pozorně celou příbalovou informaci
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls179122/2011, sukls179170/2011 1. NÁZEV PŘÍPRAVKU Nitresan 10 mg Nitresan 20 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Příbalová informace: informace pro pacienta. EQUORAL 25 mg, měkká tobolka EQUORAL 50 mg, měkká tobolka EQUORAL 100 mg, měkká tobolka.
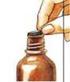 sp. zn. sukls21257/2014 Příbalová informace: informace pro pacienta EQUORAL 25 mg, měkká tobolka EQUORAL 50 mg, měkká tobolka EQUORAL 100 mg, měkká tobolka Ciclosporinum Přečtěte si pozorně celou příbalovou
sp. zn. sukls21257/2014 Příbalová informace: informace pro pacienta EQUORAL 25 mg, měkká tobolka EQUORAL 50 mg, měkká tobolka EQUORAL 100 mg, měkká tobolka Ciclosporinum Přečtěte si pozorně celou příbalovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls198662/2011 a příloha k sp.zn. sukls130174/2011, sukls22978/2012, sukls122740/2012
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls198662/2011 a příloha k sp.zn. sukls130174/2011, sukls22978/2012, sukls122740/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ciclosporin Mylan
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls198662/2011 a příloha k sp.zn. sukls130174/2011, sukls22978/2012, sukls122740/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ciclosporin Mylan
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009
 Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příloha č.3 k rozhodnutí o změně registrace sp.zn.sukls98466/2010 a příloha k sp.zn.sukls164928/2009, sukls164929/2009 1. NÁZEV PŘÍPRAVKU Kapidin 10 mg Kapidin 20 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU
Příbalová informace: informace pro pacienta. Equoral. perorální roztok. Ciclosporinum
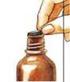 sp. zn.: sukls42220/2010 Příbalová informace: informace pro pacienta Equoral perorální roztok Ciclosporinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
sp. zn.: sukls42220/2010 Příbalová informace: informace pro pacienta Equoral perorální roztok Ciclosporinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Česká dermatovenerologická společnost ČLS JEP Kožní sanatorium, spol. s r. o. za organizační spolupráce BOS. org s. r. o., Ústí nad Labem.
 Česká dermatovenerologická společnost ČLS JEP Kožní sanatorium, spol. s r. o. za organizační spolupráce BOS. org s. r. o., Ústí nad Labem pořádá 9. DERMATOLOGICKÉ SYMPOZIUM V ÚSTÍ NAD LABEM Jak léčím já?
Česká dermatovenerologická společnost ČLS JEP Kožní sanatorium, spol. s r. o. za organizační spolupráce BOS. org s. r. o., Ústí nad Labem pořádá 9. DERMATOLOGICKÉ SYMPOZIUM V ÚSTÍ NAD LABEM Jak léčím já?
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
zpět na stránku produktu zpět na obdobná léčiva
 sp.zn.sukls43804/2012 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glyvenol 400 měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls43804/2012 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glyvenol 400 měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Muscoril cps. Jedna tvrdá tobolka obsahuje thiocolchicosidum 4 mg. Jedna ampule (2 ml) obsahuje thiocolchicosidum 4 mg.
 sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Oranžová tobolka č. 2 (tvrdá želatinová), která obsahuje bílé nebo nažloutlé granule.
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls151812/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAMIPRO 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 0,4 mg tamsulosini
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls151812/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TAMIPRO 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 0,4 mg tamsulosini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
3 LÉKOVÁ FORMA Tableta s prodlouženým uvolňováním. Růžové, kulaté bikonvexní tablety s vyraženým '35' na jedné straně, na druhé straně hladké.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Souhrn údajů o přípravku
 sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
Jedna tableta s prodlouženým uvolňováním obsahuje 0,4 mg tamsulosini hydrochloridum, což odpovídá 0,367 mg tamsulosinum.
 sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
 sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls197050/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RANISAN 75 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje ranitidini hydrochloridum
sp.zn. sukls197050/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RANISAN 75 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje ranitidini hydrochloridum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
