9. HETEROGENNÍ KATALÝZA
|
|
|
- Milada Kolářová
- před 7 lety
- Počet zobrazení:
Transkript
1 9. HETEROGENNÍ KATALÝZA Úloha 9-1 Kinetiá analýza enzymové reae... 2 Úloha 9-2 Kinetiá analýza enzymové reae... 2 Úloha 9-3 Kinetiá analýza enzymové reae... 3 Úloha 9-4 Kinetiá analýza enzymové reae... 3 Úloha 9-5 Kinetiá analýza enzymové reae... 3 Úloha 9-6 Výpočet stupně přeměny enzymové reae... 4 Úloha 9-7 Výpočet přeměny enzymové reae... 4 Úloha 9-8 Výpočet onentrae enzymu... 4 Úloha 9-9 Výpočet molární ativity enzymu z integrálníh dat... 4 Úloha 9-10 Výpočet molární ativity enzymu z integrálníh dat... 5 Úloha 9-11 Výpočet molární ativity enzymu z integrálníh dat... 5 Úloha 9-12 Kinetiá analýza enzymové reae integrální data... 5 Úloha 9-13 Kinetia enzymové reae... 6 Úloha 9-14 nhibie enzymovýh reaí - plně aompetitivní inhibie... 6 Úloha 9-15 nhibie enzymovýh reaí smíšená inhibie... 7 Úloha 9-16 nhibie enzymovýh reaí částečně ompetitivní inhibie... 8 Úloha 9-17 nhibie enzymovýh reaí plně ompetitivní inhibie... 9 Úloha 9-18 nhibie enzymovýh reaí plně neompetitivní inhibie Úloha 9-19 nhibie enzymovýh reaí částečně neompetitivní inhibie Úloha 9-20 Diagnostia inhibovanýh enzymovýh reaí Úloha 9-21 Diagnostia inhibovanýh enzymovýh reaí Úloha 9-22 Diagnostia inhibovanýh enzymovýh reaí Úloha 9-23 Diagnostia inhibovanýh enzymovýh reaí Úloha 9-24 Diagnostia inhibovanýh enzymovýh reaí Úloha 9-25 Diagnostia inhibovanýh enzymovýh reaí Enzymové reae 1
2 Úloha 9-1 Kinetiá analýza enzymové reae Hodnoty počáteční ryhlosti enzymatié reae 1 E + + E 2 P + E stanovené při různýh onentraíh substrátu, jsou uvedeny v následujíí tabule: υ υ 0 mol dm 3 mol dm 3 s 1 mol dm 3 mol dm 3 s 1 0,0003 0,822 0,012 12,6 0,0005 1,33 0,051 17,6 0,001 2,50 0,074 18,3 0,005 8,33 0,092 18,6 (a) tanovte onstanty rovnie Mihaelise a Mentenové. (b) Ja dlouho bude trvat, než zreaguje 25 % substrátu, jehož počáteční onentrae byla (i) 1, mol dm 3, (ii) 1,35 mol dm 3, (iii) 1, mol dm 3? Výslede: (a) K M = 7, mol dm 3, υ max = 2, mol dm 3 s 1 (b) (i) 2,8 h, (ii) 468,7 h, (iii) 3,2694 h Úloha 9-2 Kinetiá analýza enzymové reae Kinetiá studie syntézy vyházejíí z yseliny valerové a pentanolu, atalyzované PEG lipasou, prováděná za onstantní onentrae enzymu ( E0 = 0,45 mg m 3, M E = g mol 1 ) a onstantní onentrae pentanolu (0,75 mol dm 3 ), posytla tuto závislost počáteční ryhlosti υ 0 na onentrai yseliny valerové (substrátu ) 10 4 υ υ 0 mol dm 3 mol dm 3 min 1 mol dm 3 mol dm 3 min 1 0,042 1,80 0,370 6,30 0,083 2,95 0,550 7,11 0,126 3,73 0,760 7,65 0,167 4,50 1,000 7,92 0,238 5,36 1,300 8,06 (a) Nareslete saturační řivu (b) tanovte K M (mol dm 3 ), υ max (mol dm 3 s 1 ) a atalytiou ativitu lipasy (s 1 ). Výslede: (a) aturační řiva: závislost υ 0 na (b) K M = 0,17564 mol dm 3 υ max = 9, mol dm 3 min 1 = 1, mol dm 3 s 1 2 = 8,568 s υ ,2 0,4 0,6 0,8 1 1,2 1,4 9. Enzymové reae 2
3 Úloha 9-3 Kinetiá analýza enzymové reae Působení pepsinu na ethylester 1-arboxy-1-glutamyltyrosinu bylo sledováno při teplotě 38 C a ph = 4. Reae, terá představuje hydrolýzu peptidové vazby, byla provedena s omerčním pepsinem v onentrai 4,710 5 mol dm 3 (molární hmotnost g mol 1 ). Reae byla sledována titraí uvolněné yseliny. Hodnoty počáteční ryhlosti při různýh onentraíh substrátu jsou uvedeny v následujíí tabule. tanovte hodnoty Mihaelisovy onstanty K M a maximální ryhlosti υ max υ υ 0 mmol dm 3 mol dm 3 s 1 mmol dm 3 mol dm 3 s 1 0,30 2,40 4,00 10,5 0,77 4,88 6,15 11,6 1,52 7,24 8,00 12,1 2,46 8,94 10,34 12,6 Výslede: K M = 1, mol dm 3, υ max = 1, mol dm 3 s 1 Úloha 9-4 Kinetiá analýza enzymové reae Při stejnýh podmínáh jao v předházejíím příladu (38 C ph = 4) bylo sledováno působení pepsinu na 1-arboxy-1-glutamyltyrosin: 10 8 υ υ 0 mmol dm 3 mol dm 3 s 1 mmol dm 3 mol dm 3 s 1 0,25 1,16 4,5 6,64 0,62 2,43 8,0 7,55 1,60 4,42 12,4 8,06 2,70 5,60 15,6 8,27 (a) tanovte hodnoty inetiýh parametrů K M a υ max pro tento případ. (b) Vypočítejte, oli proent původně přítomného 1-arboxy-1-glutamyltyrosinu se přemění za 10 hodin, je-li jeho počáteční onentrae 0,8 mol dm 3. Výslede: (a) K M = 1, mol dm 3, υ max = 9, mol dm 3 s 1, (b) α = 4, Úloha 9-5 Kinetiá analýza enzymové reae Enzymatiá hydrolýza jisté optiy ativní láty (substrátu) byla sledována měřením počáteční ryhlosti při různýh onentraíh substrátu. Ryhlost byla měřena ryhlostí změny údaje polarimetru. Byla zísána tato data: 10 6 υ υ 0 mol dm 3 mol dm 3 s 1 mol dm 3 mol dm 3 s 1 0,0052 0,608 0,15 5,02 0,012 1,26 0,53 6,18 0,041 2,97 1,32 6,54 0,079 4,07 1,67 6,59 tanovte z těhto dat Mihaelisovu onstantu K M pro omplex enzym-substrát a hodnotu maximální ryhlosti υ max. Výslede: K M = 0,0529 mol dm 3, υ max = 6,810 6 mol dm 3 s 1 9. Enzymové reae 3
4 Úloha 9-6 Výpočet stupně přeměny enzymové reae Vypočítejte, jaého stupně přeměny dosáhnete po 2 hodináh od přidání enzymu roztou optiy ativní láty (viz předhozí úloha), provádíte-li reai (a) v oblasti nízýh onentraí, při 0 = 1,210 5 mol dm 3, (b) v oblasti vysoýh onentraí, při 0 = 1,5 mol dm 3. Výslede: (a) α = 0,6035, (b) α = 0,03265 Úloha 9-7 Výpočet přeměny enzymové reae Působení ribosafosfátisomerasy na D-ribosa-5-fosfát (substrát) bylo sledováno při teplotě 37 C a ph = 7,6. Mihaelisova onstanta má hodnotu K M = 2,710 3 mol dm 3, maximální ryhlost υ max = 3,610 7 mol dm 3 s 1. Koli substrátu se přemění za jednu hodinu, měla-li výhozí onentrae hodnotu 1,810 3 mol dm 3? Výslede: 4, mol dm 3 ; 26,275 % Úloha 9-8 Výpočet onentrae enzymu Při teplotě 0 C, dy je desativae trypsinu zanedbatelná, bylo sledováno trávení aseinu (substrát) trypsinem s roztoy aseinu o onentrai 1, mol dm 3, jejihž ph bylo pufrem yselina boritá-boritan sodný udržováno na hodnotě 7,6. Pro Mihaelisovu onstantu byla nalezena hodnota K M = mol dm 3. Při prvém pousu lesla onentrae aseinu po 35 minutáh na 80 % původní hodnoty, při druhém pousu se stejnou počáteční onentraí aseinu, avša s jinou onentraí enzymu, se za 24 minut po přidání enzymu do roztou aseinu přeměnilo 30 % aseinu. Jaý byl poměr onentraí enzymu při prvém a druhém pousu? Výslede: E0 (1)/ E0 (2) = 0,4333 Úloha 9-9 Výpočet molární ativity enzymu z integrálníh dat Pro Mihaelisovu onstantu ribonuleasy z hovězího panreasu byla při jejím působení na 3',5'thimidin (substrát) o počáteční onentrai 2 mol dm 3 při 25 C a ph = 7 zjištěna hodnota K M = 0,0014 mol dm 3. Byl sledován úbyte onentrae substrátu s časem při dvou různýh onentraíh enzymu:. E0 = 4,510 7 mol dm 3. E0 = 1,910 6 mol dm 3 τ / h α τ / min α 1 0, ,0685 2,5 0, , , , , ,586 Časová závislost stupně přeměny α je lineární. tanovte molární ativitu ribonuleasy. Výslede: 2 = 150 s 1 9. Enzymové reae 4
5 Úloha 9-10 Výpočet molární ativity enzymu z integrálníh dat Při studiu rozladu močoviny působením ureasy při teplotě 35 C CO(NH 2 ) H 2 O = (NH 4 ) 2 CO 3 byl sledován vliv onentrae enzymu. K 10 m 3 roztou, terý obsahoval 0,00165 molu močoviny, bylo přidáváno 1 až 5 m 3 roztou ureasy (podle pousu) a množství vody, potřebné doplnění vzoru na objem 15 m 3. V 1 m 3 roztou ureasy bylo obsaženo 3,6 mg ureasy (M = 480 g mol 1 ). Reae byla přerušována po vhodně volené době přidáním přebytu 0,1 M HCl. Tím se enzym zničil a množství HCl, zbylé po neutralizai uhličitanu amonného, vytvořeného rozladem močoviny, bylo stanoveno titraí 0,1 M hydroxidem. Byla zjištěna tato data: τ /min relativní množství enzymu rozložená močovina / % 80,0 1 51,2 40,0 2 52,0 26,6 3 52,6 20,0 4 53,2 16,0 5 53,3 Množství enzymu je uváděno relativně množství enzymu přidanému při prvém pousu. Jaá je molární ativita ureasy? Mihaelisova onstanta má hodnotu K M = 0,04 mol dm 3. Výslede: 2 = 36,458 s 1 Úloha 9-11 Výpočet molární ativity enzymu z integrálníh dat Pro enzymovou reai probíhajíí podle shematu 1 E + + E 2 E + P1 + P 2 1 byla z počátečníh reačníh ryhlostí vyhodnoena Mihaelisova onstanta K M = 214 mmol dm 3. Při sledování časové závislosti onentrae substrátu bylo zjištěno, že po 1 hodině lesla jeho onentrae z počáteční hodnoty 3 µg m 3 (M = 150 g mol 1 ) na 40 % původní hodnoty. Konentrae enzymu, terý uvažovanou reae atalyzuje, byla při tomto pousu 2, mol dm 3. Jaá je molární ativita tohoto enzymu? Výslede: 2 = 25,1 s 1 Úloha 9-12 Kinetiá analýza enzymové reae integrální data Při působení hymotrypsinu, zísaného z hovězího panreasu, na aetyl-l-tyrosinethylester (substrát ) byla při 25 C a ph = 7,8 zjištěna tato časová závislost oamžité onentrae substrátu: τ τ min mol dm 3 min mol dm 3 0 2, ,3 1, ,2 1, ,5 1, ,9 1, ,3 8, ,2 1,410 4 tanovte inetié parametry K M a υ max této enzymové reae. Výslede: K M = 7, mol dm 3, υ max = 1, mol dm 3 s 1 9. Enzymové reae 5
6 Úloha 9-13 Kinetia enzymové reae Karbonanhydrasa - enzym, podílejíí se na ustavování rovnováhy CO 2 + H 2 O = H 2 CO 3 se vyznačuje vysoou hodnotou molární ativity, 2 = µmol substrátu (CO 2 ) na µmol enzymu za seundu. Mihaelisova onstanta má hodnotu K M = 0,0084 mol dm 3. Jaé množství enzymu (M = g mol 1 ) je zapotřebí, aby za 100 s zreagovalo 30 % substrátu, jehož počáteční onentrae byla 13 mmol dm 3? Výslede: E0 = 3,448 µg dm 3 Úloha 9-14 nhibie enzymovýh reaí - plně aompetitivní inhibie Pro plně aompetitivní inhibii probíhajíí podle shematu 1+ 2 E + E 1 + E + P 5+ 5 navrhněte rovnii popisujíí závislost ryhlosti této inhibované reae na onentrai substrátu a inhibitoru a převeďte ryhlostní rovnii do nejčastěji používanýh linearizovanýh tvarů (Lineweavera a Bura, Hanese, Eadiea). Předpoládejte, že mezi substrátem, enzymem a inhibitorem se ryhle ustavuje rovnováha. Z hodnot počátečníh ryhlostí, naměřenýh pro plně aompetitivní inhibii při různýh onentraíh substrátu a inhibitoru, uvedenýh v následujíí tabule, zjistěte hodnotu disoiační onstanty omplexu E K, a hodnoty onstant K M a υ max v závislosti na onentrai inhibitoru. Nareslete Dixonův graf a graf podle Huntera a Downse. E υ i /(mol dm 3 s 1 ) mol dm 3 = 0 = 0,008 = 0,018 = 0,030 = 0,045 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,0008 5, , , , , ,0050 1, , , , , ,0125 2, , , , , ,0250 2, , , , , E0 K K Výslede: υi =, KM = KM, υmax = υmax K + K + KM K 1 1 K Lineweaver a Bure: M 1 K + KM 1 = + = + υi υmax υmax υmax K υ max úse směrnie K Hanes: M 1 KM K + = + = + υi υmax υmax υ max υmax K úse směrnie υ Eadie: i K K υi υi = υmax KM = υmax KM K + K + úse směrnie 9. Enzymové reae 6
7 Kinetié parametry (pro /(mol dm 3 )): 6 3 2,110 KM /(mol dm ) =, Dixonův graf: rovnoběžné přímy se stejnou směrnií: , υmax /(mol dm s ) = M 1 1 K = υ υ + + υ K i max max úse směrnie Graf Huntera a Downse: jedna hyperbola pro všehny onentrae inhibitoru: 6 υi K K M 2,110 = + K 3 = υ υ i Úloha 9-15 nhibie enzymovýh reaí smíšená inhibie Příladem typiy smíšené inhibie je případ, dy v systému dohází těmto dílčím reaím: E + 1+ E 2 1 P + E K = E + E + E E 3+ E 3+ E 3 K = K = K = Od plně neompetitivní inhibie se toto shema liší v tom, že platí K K = = α > 1 K K Najděte výraz pro ryhlost inhibované reae a pro níže uvedená experimentální data stanovte hodnoty všeh inetiýh onstant. Nareslete Dixonův graf a graf podle Huntera a Downse υ i / ( mol dm 3 s 1 ) mol dm 3 = 0 = 0,005 = 0,012 = 0,017 = 0,025 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,008 4,870 2,804 1,759 1,389 1,040 0,025 6,140 3,588 2,268 1,796 1,347 0,050 6,542 3,840 2,433 1,929 1,448 0,080 6,707 3,944 2,502 1,984 1, Výslede: K υi = 2E0, K + / α K + KM + K + / α K K υmax + = υmax K + /, KM = KM α K / + α υ max = mol dm 3 s 1, K M = 0,0035 mol dm 3, K = 0,006 mol dm 3, α = 1,2, K = 0,0072 mol dm 3, K = 0,0042 mol dm 3 9. Enzymové reae 7
8 ,04 10 υmax /(mol dm s ) = 3 7,2 10 +, K M /(mol dm ) 4, = 3 7, (pro / mol dm 3 ) 1 1 K Lineweaver a Bur: M 1 K + / α KM K + 1 = + = + υi υmax υmax υmax K υmax K úse směrnie Hanes: M M υi υmax υmax υmax K υmax K úse směrnie K 1 K K + K + / = + = + α υi K K + υi Eadie: υi = υmax KM = υmax KM K + / α K + / α úse směrnie Dixonův graf: svaze sbíhavýh příme 1 KM + 1 KM = υ i υmax + + υmax K α υmax K úse směrnie Graf podle Huntera a Downse - nelineární průběh: υi K ( KM + ) = υ υ K + / α i M Úloha 9-16 nhibie enzymovýh reaí částečně ompetitivní inhibie Odvoďte (a) výraz pro ryhlost plně ompetitivní reae, probíhajíí podle shematu 1+ 2 E E E + P 3+ 3 E (b) linearizované tvary ryhlostní rovnie podle (i) Hanese, (ii) Lineweavera a Bura, (iii) Eadiea, () Pro data uvedená v následujíí tabule vypočítejte inetié parametry υ max, K M a K uvažované inhibované reae υ i / ( mol dm 3 s 1 ) mol dm 3 = 0 = 0,005 = 0,012 = 0,032 = 0,084 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,014 1, , , , , ,038 3, , , , , ,124 7, , , , , ,340 1, , , , , (d) Zonstruujte Dixonův graf a graf podle Huntera a Downse. 9. Enzymové reae 8
9 2E0 Výslede: (a) υi =, KM 1+ + K (b) Linearizované tvary: 1 1 K Lineweaver a Bur: M 1 1 KM K + 1 = + = + υi υmax υmax υ max υmax K Hanes: úse směrnie K 1 K K 1 = + = + + υ υ υ υ K υ M M i max max max max úse směrnie υi K + υ Eadie: υi υmax KM i = = υ max KM K úse směrnie () υmax = υmax = 1, mol dm 3 s 1 K M = 0, mol dm 3, K = 0,1121 mol dm 3 K K + M = KM = 0, ,85694 K 1 1 M M (d) Dixonův graf - svaze sbíhavýh příme: 1 K K = υi υ + max + υmax K úse směrnie Graf podle Huntera a Downse - svaze sbíhavýh příme: υi K = K + υ υi KM úse směrnie Úloha 9-17 nhibie enzymovýh reaí plně ompetitivní inhibie Pro jistou enzymovou reai bylo navrženo shema 1+ 2 E + E E + P = E + E E + P 4 teré popisuje částečně ompetitivní inhibii. (a) Odvoďte vztah pro ryhlost této inhibované reae a porovnejte výrazy pro zdánlivé onstanty a υ s KM a υ max neinhibované reae K M max (b) Odvoďte linerizované výrazy (i) podle Lineweavera a Bura, (ii) podle Hanese, (iii) podle Eadiea. () Z hodnot počátečníh ryhlostí, naměřenýh při různýh onentraíh substrátu a inhibitoru, stanovte hodnoty onstant v ryhlostní rovnii. (d) estrojte graf (i) podle Dixona, (ii) podle Huntera a Downse. Ja rozlišíme plně ompetitivní inhibii od částečně ompetitivní? 9. Enzymové reae 9
10 10 5 υ i / (mol dm 3 s 1 ) mol dm 3 = 0 = 0,013 = 0,027 = 0,075 = 0,109 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,012 5,778 4,841 4,785 4,749 4,733 0,090 6,393 6,216 6,204 6,195 6,192 0,260 6,463 6,399 6,394 6,391 6,390 0,380 6,474 6,430 6,427 6,425 6,424 Výslede: 2 E0 (a) υi = K + KM + / + K α (b) Linearizae: (i) Lineweaver a Bur:, υmax = 2 E0 = υmax, K M M + K = K K + α 1 1 KM 1 1 KM K + 1 = + = + υi υmax υmax υ max υmax K + / α úse směrnie / K (ii) Hanes: M 1 KM K + 1 = + = + υi υmax υmax υmax K + / α υ max úse směrnie (iii) Eadie υi K + υ υi υmax KM i = = υ max KM K + / α úse směrnie () υ max = υ max = 6, mol dm 3 s 1, K M = 1, mol dm 3 K = 6, mol dm 3, α = 3,014 K = 2, mol dm 3 K = 4, mol dm 3 (K = K M ) K 4 3 6, M = 4, , (d) (i) Dixonův graf je nelineární- tím lze rozlišit částečně ompetitivní inhibii od inhibie plné, jejíž Dixonův graf je lineární (viz Úloha 9-16) 1 1 KM 1 K + = + υ υ υ K + / α i max max (ii) Graf podle Huntera a Downse - je lineární, svaze sbíhajííh se příme υi ( α K + ) ( α K + ) = + υ υi ( α 1) KM ( α 1) úse směrnie 9. Enzymové reae 10
11 Úloha 9-18 nhibie enzymovýh reaí plně neompetitivní inhibie Enzymová reae probíhá za přítomnosti inhibitoru podle následujíího shématu: 1+ 2 E + E E + P E + E 4 (a) Odvoďte vztah pro ryhlost inhibované reae. Ja ovlivňuje tato plně neompetitivní inhibie hodnoty parametrů K M a υ max v porovnání s neinhibovanou enzymatiou reaí? (b) Odvoďte linearizované tvary ryhlostní rovnie podle (i) Lineweavera a Bura, (ii) Hanese, (iii) Eadiea a vypočítejte hodnoty inetiýh parametrů K M, υ max, K M, υ max a K. () Pomoí závislostí podle (i) Dixona, (ii) Huntera a Downse uažte ja lze rozlišit plnou a částečnou ompetitivní inhibii. υ i / ( mol dm 3 s 1 ) = 0 = 0,01 = 0,02 = 0,03 = 0,04 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,026 4, , , , , ,108 1, , , , , ,340 2, , , , , ,570 3, , , , , Výslede: (a) υ i K 2E0 υ max K + = = K + K + M M K =, υmax = υmax K +, KM KM (b) Linearizae 1 1 K (i) Lineweavera a Bura: M 1 K + KM K + 1 = + = + υi υmax υmax υmax K υmax K úse směrnie K (ii) Hanese M 1 KM K + K + = + = + υi υmax υmax υmax K υmax K úse směrnie υ (iii) Eadiea i K υ υi υmax KM i = = υmax KM K + úse směrnie υ max = mol dm 3 s 1, K M = 0,262 mol dm 3, K = mol dm ,5 10 υmax /(mol dm s ) = KM 1 KM ()(i) Dixonův graf je lineární: = 1 1 υi υ + max + + υmax K úse směrnie υi (ii) Graf podle Huntera a Downse = K - jediná příma pro všehny onentrae υ υi inhibitoru. 9. Enzymové reae 11
12 Úloha 9-19 nhibie enzymovýh reaí částečně neompetitivní inhibie O jisté enzymové reai se předpoládá, že probíhá podle shématu 1+ 2 E + E E + P E + E E + P 4 teré popisuje částečně neompetitivní inhibii. Vyjádřete (a) ryhlost reae jao funi onentrae substrátu a inhibitoru, (b) nejčastěji používané linearizované tvary ryhlostní rovnie () Z dat uvedenýh v následujíí tabule vypočítejte inetié parametry inhibované i neinhibované reae υ i / ( mol dm 3 s 1 ) mol dm 3 = 0 = 0,0053 = 0,012 = 0,025 = 0,060 mol dm 3 mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,025 7, , , , , ,110 2, , , , , ,250 3, , , , , ,550 4, , , , , (d) estrojte grafy podle Dixona a podle Huntera a Downse. K + β 2 E0 Výslede: (a) υi = K + KM + (b) Linearizae podle 1 1 K (i) Lineweavera a Bura: M 1 1 K + KM K + 1 = + = + υi υmax υmax υmax K + β υmax K + β úse směrnie K (ii) Hanese M 1 KM K + 1 K + = + = + υi υmax υmax υmax K + β υmax K + β úse směrnie υ (iii) Eadiea i K + β υi υi = υmax KM = υmax KM K + úse směrnie () υ max = 6,810 5 mol dm 3 s 1, K M = 0,216 mol dm 3, K = 0,009 mol dm 3, β = 0, , ,0810 max = υ 1 ( KM + ) ( K + ) (d) (i) Dixonův graf je nelineární: = υ υ ( K + β ) i max υi K + β (ii) Graf podle Huntera a Downse = υ υ β i 1 - soustava rovnoběžnýh příme 9. Enzymové reae 12
13 Úloha 9-20 Diagnostia inhibovanýh enzymovýh reaí Při syntéze purinů byl sledován vliv azaserinu, terý má inhibiční účiny: 0,005 0,008 0,012 0,018 0,022 0,035 0,048 0, υ 1,000 1,429 1,875 2,368 2,620 3,182 3,530 3, υ i = 0,004 = 0,012 = 0,03 = 0,05 0,937 1,344 1,772 2,250 2,493 3,045 3,390 3,609 0,831 1,200 1,594 2,040 2,271 2,802 3,138 3,355 0,662 0,968 1,300 1,690 1,894 2,377 2,690 2,900 0,540 0,797 1,080 1,418 1,600 2,034 2,324 2,516 υ je počáteční ryhlost neinhibované enzymové reae (mol dm 3 s 1 ), υ i počáteční ryhlost enzymové reae za přítomnosti inhibitoru (mol dm 3 s 1 ), onentrae substrátu (mol dm 3 ), onentrae inhibitoru (mol dm 3 ). Posuďte harater inhibičního účinu azaserinu, najděte rovnii popisujíí závislost počáteční ryhlosti na onentrai substrátu a inhibitoru a stanovte hodnoty onstant. υmax K Výslede: míšená inhibie: υi = K + α K + KM + K + / α υ max = mol dm 3 s 1 ; K M = 0,02 mol dm 3 ; K = 0,051 mol dm 3, α = 3 Úloha 9-21 Diagnostia inhibovanýh enzymovýh reaí Působení enzymu arginasy na substrát argirin bylo při teplotě 37 C a ph 8,4 sledováno jedna za přítomnosti, jedna za nepřítomnosti norvalinu, terý má inhibiční účine. Výsledy byly vyjádřeny poměrem hodnot ryhlostí υ/υ i (v nepřítomnosti inhibitoru υ, za přítomnosti inhibitoru υ i ) pro různé onentrae inhibitoru a substrátu: (argirin) mol dm 3 0,0223 0,0667 0,0445 (norvalin) mol dm 3 0,0890 0,0445 0,0178 0,0334 0,0179 0,0083 0,0890 0,0445 0,0178 υ/υ i 3,67 2,34 1,53 2,03 1,54 1,25 3,74 2,36 1,54 Na záladě těhto dat posuďte, zda norvalin má plně ompetitivní nebo neompetitivní účine a stanovte inhibiční onstantu (onstanty). Výslede: Plně neompetitivní, υ = = K υ υ υ/υ i i i 1 = 0,033 mol dm 3 9. Enzymové reae 13
14 Úloha 9-22 Diagnostia inhibovanýh enzymovýh reaí nhibie působení arginasy na argirin, vyvolaná přítomností ornithinu byla sledována při teplotě 37 C a ph 8,4 měřením počátečníh reačníh ryhlostí při různýh onentraíh argirinu a inhibitoru. Poměr počáteční ryhlosti v nepřítomnosti inhibitoru (υ) a v přítomnosti inhibitoru (υ i ) je uveden ve třetím sloupi následujíí tabuly: (argirin) (ornithin) υ/υ i mol dm 3 mol dm 3 0,0223 0,0890 0,0445 0,0223 0,0111 9,1 5 2,9 1,89 (argirin) (ornithin) υ/υ i mol dm 3 mol dm 3 0,0667 0,0667 0,0334 0,0167 0, ,44 2,17 1,61 1,30 0,0297 0,0445 0,0297 0,0148 0,0074 0,0445 0,0223 0,0111 3,06 1,98 1,47 3,33 2,18 1,57 0,089 0,0890 0,0445 0,0223 0,0111 0, ,42 2,20 1,63 1,31 1,16 Rozhodněte, zda se jedná o plně ompetitivní nebo plně neompetitivní inhibii a stanovte hodnoty disoiačníh onstant pro systém arginasa-argirin (K M ) a arginasa-ornithin (K ). Výslede: Graf podle Dixona je přímový pro oba případy. Plně ompetitivní a plně neompetitivní je možno odlišit závislostí podle Huntera a Downse výraz υ i /( υ υ i ) je lineárně závislý na, inhibie je plně ompetitivní: υ K υ υ υ/υ K i = = K + i i 1 M (pro plně neompetitivní inhibii nezávisí na onentrai inhibitoru ani na onentrai substrátu) K = 3, mol dm 3 K M = 0,01009 mol dm 3 Úloha 9-23 Diagnostia inhibovanýh enzymovýh reaí Analýzou inetiýh dat zísanýh sledováním enzymatiého působení hexainasy (M = 380 g mol 1 ) na substrát při onentrai enzymu 4,75 mg dm 3 byla zjištěna pro Mihaelisovu onstantu hodnota K M = 0,0035 mol dm 3, pro moleulární ativitu enzymu hodnota 2 = 250 s 1. Z hodnot počátečníh reačníh ryhlostí naměřenýh za přítomnosti gluosa-6-fosfátu (viz tabula) určete povahu inhibičníh účinů gluosa-6-fosfátu, sestavte rovnii pro závislost ryhlosti inhibované reae na onentrai substrátu a inhibitoru a stanovte hodnoty onstant této rovnie. Porovnejte průběh saturační řivy neinhibované a inhibované reae. 9. Enzymové reae 14
15 10 6 υ i / (mol dm 3 s 1 ) mol dm 3 = 2,510 4 = 6,810 4 = = mol dm 3 mol dm 3 mol dm 3 mol dm 3 0,0003 0,0015 0,0027 0,0039 0,0043 0,0058 0,0090 0,0120 0,227 0,863 1,253 1,517 1,587 1,795 2,072 2,228 0,210 0,800 1,160 1,404 1,468 1,660 1,917 2,062 0,192 0,729 1,058 1,280 1,340 1,516 1,750 1,882 0,179 0,682 0,990 1,198 1,253 1,417 1,636 1,760 Výslede: Průběh saturačníh řive odpovídá buď neompetitivní inhibii (obr. 9.8a) nebo inhibii smíšené (obr. 9.10a). Dixonův graf má hyperboliý průběh inhibie je částečně neompetitivní. K = mol dm 3, β = 0,7 Úloha 9-24 Diagnostia inhibovanýh enzymovýh reaí Byl zoumán vliv různýh inhibitorů na enzymové působení dehydrogenasy na pyrohroznan. Pro neinhibovanou reai byly zjištěny onstanty K M = 0,01 mol dm 3 a υ max = 2,510 5 mol dm 3 s 1. Všehny tři testované inhibitory mají aompetitivní účiny. Při onentrai pyrohroznanu 0,02 mol dm 3 byly zísány tyto hodnoty počátečníh ryhlostí enzymové reae (v mol dm 3 s 1 ): 10 5 υ i mol dm 3 inhibitor A inhibitor B inhibitor C 0,003 0,010 0,022 0,035 0,060 1,515 1,250 0,961 0,769 0,556 1,375 1,053 0,839 0,739 0,652 1,626 1,538 1,400 1,290 1,111 Na záladě těhto dat rozhodněte, jde-li o inhibii plnou nebo částečnou a v případě plné inhibie stanovte hodnoty inhibičníh onstant K. Výslede: Dixonův graf je lineární v případě inhibitorů A a C, hyperboliý u inhibitoru B. 3 A: plná inhibie, K = 0,02 mol dm B: částečná inhibie, 3 C: plná inhibie, K = 0,08 mol dm 9. Enzymové reae 15
16 Úloha 9-25 Diagnostia inhibovanýh enzymovýh reaí Působení lysozymu (molární hmotnost g/mol, moleulární ativita 2 = 0,5 s 1 ) v onentrai 0,858 mg m 3 na substrát bez přítomnosti inhibitoru je haraterizováno Mihaelisovou onstantou K M = 0,085 mol dm 3. Pro tutéž enzymovou reai byly v přítomnosti inhibitoru naměřeny hodnoty počátečníh reačníh ryhlostí υ i [mol dm 3 s 1 ] při různýh onentraíh substrátu (v mol dm 3 ) a inhibitoru v (mol dm 3 ): 10 6 υ i 10 6 υ i 0,007 0,005 0,01 0,05 0,09 0,15 2,102 1,954 1,334 1,082 0,898 0,075 0,005 0,01 0,05 0,09 0,15 13,400 12,824 9,983 8,588 7,458 0,03 0,005 0,01 0,05 0,09 0,15 7,323 6,900 4,990 4,147 3,506 0,12 0,005 0,01 0,05 0,09 0,15 16,909 16,330 13,314 11,726 10,385 Zjistěte, jaý typ inhibie tento inhibitor vyvolává, navrhněte ryhlostní rovnii a stanovte hodnoty inhibičníh onstant. Výslede: částečně ompetitivní inhibie υmax υi = K + KM + K + / α K + KM = KM K + α /, υ max = υ max = mol dm 3 s 1 K = 0,042 mol dm 3, α = 5 /( mol dm 3 ) K M ) υ max /(mol dm 3 s 1 ) 0 0, , ,005 0, , ,01 0, , ,05 0, , ,09 0, , ,15 0, , Enzymové reae 16
c A = c A0 a k c ln c A A0
 řád n 2.řád.řád 0.řád. KINETIK JEDNODUCHÝCH REKCÍ 0 Ryhlost reae, ryhlosti přírůstu a úbytu jednotlivýh slože... 2 02 Ryhlost reae, ryhlosti přírůstu a úbytu jednotlivýh slože... 2 03 Ryhlost reae, ryhlosti
řád n 2.řád.řád 0.řád. KINETIK JEDNODUCHÝCH REKCÍ 0 Ryhlost reae, ryhlosti přírůstu a úbytu jednotlivýh slože... 2 02 Ryhlost reae, ryhlosti přírůstu a úbytu jednotlivýh slože... 2 03 Ryhlost reae, ryhlosti
8. HOMOGENNÍ KATALÝZA
 8. HOMOGENNÍ TLÝZ 8.1 MECHNISMUS HOMOGENNĚ TLYZOVNÝCH RECÍ... 8.1.1 omplex rrheniova typu... 8.1. omplex van t Hoffova typu...3 8. RECE TLYZOVNÉ YSELINMI...4 8..1 Obená yselá atalýza...4 8.. Speifiá yselá
8. HOMOGENNÍ TLÝZ 8.1 MECHNISMUS HOMOGENNĚ TLYZOVNÝCH RECÍ... 8.1.1 omplex rrheniova typu... 8.1. omplex van t Hoffova typu...3 8. RECE TLYZOVNÉ YSELINMI...4 8..1 Obená yselá atalýza...4 8.. Speifiá yselá
4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY
 4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY Úloha 4-1 Řešení reačních schémat... Úloha 4- Řešení reačních schémat... Úloha 4-3 Řešení reačních schémat... Úloha 4-4 Řešení reačních schémat... 3 Úloha 4-5 Řešení
4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY Úloha 4-1 Řešení reačních schémat... Úloha 4- Řešení reačních schémat... Úloha 4-3 Řešení reačních schémat... Úloha 4-4 Řešení reačních schémat... 3 Úloha 4-5 Řešení
Aplikované chemické procesy
 pliované hemié proesy Záladní pojmy, bilanování Rozdělení systému - podle výměny hmoty a energie Otevřený systém může se svým oolím vyměňovat hmotu a energii v průběhu časového období bilanování Uzavřený
pliované hemié proesy Záladní pojmy, bilanování Rozdělení systému - podle výměny hmoty a energie Otevřený systém může se svým oolím vyměňovat hmotu a energii v průběhu časového období bilanování Uzavřený
Inženýrství chemicko-farmaceutických výrob. » Využívají k přeměně chemických látek živých mikroorganismů» Příklady
 Inženýrství hemio-farmaeutiýh výrob io reatory ioreatory» Využívají přeměně hemiýh láte živýh miroorganismů» řílay» Chemiý průmysl» yselina mléčná, yselina otová, ethanol» otravinářsý průmysl» mléárensé
Inženýrství hemio-farmaeutiýh výrob io reatory ioreatory» Využívají přeměně hemiýh láte živýh miroorganismů» řílay» Chemiý průmysl» yselina mléčná, yselina otová, ethanol» otravinářsý průmysl» mléárensé
kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]
![kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ] kde k c(no 2) = 2, m 6 mol 2 s 1. Jaká je hodnota rychlostní konstanty v rychlostní rovnici ? V [k = 1, m 6 mol 2 s 1 ]](/thumbs/98/135866737.jpg) KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
KINETIKA JEDNODUCHÝCH REAKCÍ Různé vyjádření reakční rychlosti a rychlostní konstanty 1 Rychlost reakce, rychlosti přírůstku a úbytku jednotlivých složek Rozklad kyseliny dusité je popsán stechiometrickou
9. KINETIKA ENZYMATICKÝCH REAKCÍ
 9. KNETKA ENZYMATCKÝCH REAKCÍ 9. ENZYMOVÁ KATALÝZA...2 9.. Mechanismus enzymových reakcí...2 9..2 Vyhodnocení experimentálních dat...5 Příklad 9- Zpracování kinetických dat metodou počátečních reakčních
9. KNETKA ENZYMATCKÝCH REAKCÍ 9. ENZYMOVÁ KATALÝZA...2 9.. Mechanismus enzymových reakcí...2 9..2 Vyhodnocení experimentálních dat...5 Příklad 9- Zpracování kinetických dat metodou počátečních reakčních
Aplikované chemické procesy. Inženýrské myšlení. Průběh vývoje technologie. Základní pojmy, bilancování
 pliované hemié proesy Záladní pojmy, bilanování Inženýrsé myšlení Popis průmyslovýh aparátů + Popis hem. a fyz. dějů v proeseh Přesná formulae problému + návrh správného řešení Průběh vývoje tehnologie
pliované hemié proesy Záladní pojmy, bilanování Inženýrsé myšlení Popis průmyslovýh aparátů + Popis hem. a fyz. dějů v proeseh Přesná formulae problému + návrh správného řešení Průběh vývoje tehnologie
Nejprve je nutno převést hmotnostní koncentrace na molární (správný výsledek je 1,345M).
 11. vičení ph II. 1. Jaké je ph 8% ota, = 1,0097 g/m, = 60,05 g.mol -1, = 1,75. -5? Nejprve je nutno převést hmotnostní konentrae na molární (správný výsledek je 1,5). Poté použijeme jednu z následujííh
11. vičení ph II. 1. Jaké je ph 8% ota, = 1,0097 g/m, = 60,05 g.mol -1, = 1,75. -5? Nejprve je nutno převést hmotnostní konentrae na molární (správný výsledek je 1,5). Poté použijeme jednu z následujííh
Difuze v procesu hoření
 Difuze v procesu hoření Fyziální podmíny hoření Záladní podmínou nepřetržitého průběhu spalovací reace je přívod reagentů (paliva a vzduchu) do ohniště a zároveň odvod produtů hoření (spalin). Pro dosažení
Difuze v procesu hoření Fyziální podmíny hoření Záladní podmínou nepřetržitého průběhu spalovací reace je přívod reagentů (paliva a vzduchu) do ohniště a zároveň odvod produtů hoření (spalin). Pro dosažení
6.1 Klasifikace chemických reakcí
 6. CHEMICKÁ KINETIK Termodynamia studuje složení systému v jeho časově neproměnném (rovnovážném) stavu (tj. sleduje stav, jehož systém dosahuje po dostatečně dlouhé době), dovoluje poznat energetié podmíny,
6. CHEMICKÁ KINETIK Termodynamia studuje složení systému v jeho časově neproměnném (rovnovážném) stavu (tj. sleduje stav, jehož systém dosahuje po dostatečně dlouhé době), dovoluje poznat energetié podmíny,
4. Látkové bilance ve směsích
 4. Látové bilance ve směsích V této apitole se naučíme využívat bilanci při práci s roztoy a jinými směsmi láte. Zjednodušený princip bilance složy i v systému (napřílad v ádince, v níž připravujeme vodný
4. Látové bilance ve směsích V této apitole se naučíme využívat bilanci při práci s roztoy a jinými směsmi láte. Zjednodušený princip bilance složy i v systému (napřílad v ádince, v níž připravujeme vodný
18 Kinetika chemických reakcí
 18 Kinetika hemikýh reakí Všehny hemiké reake probíhají určitou ryhlostí, která závisí na podmínkáh, z nihž nejdůležitější jsou konentrae reagujííh látek, teplota a přítomnost katalyzátoru nebo inhibitoru.
18 Kinetika hemikýh reakí Všehny hemiké reake probíhají určitou ryhlostí, která závisí na podmínkáh, z nihž nejdůležitější jsou konentrae reagujííh látek, teplota a přítomnost katalyzátoru nebo inhibitoru.
Úloha 3-15 Protisměrné reakce, relaxační kinetika... 5. Úloha 3-18 Protisměrné reakce, relaxační kinetika... 6
 3. SIMULTÁNNÍ REAKCE Úloha 3-1 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 3-2 Protisměrné reakce oboustranně prvého řádu, výpočet času... 2 Úloha 3-3 Protisměrné reakce oboustranně
3. SIMULTÁNNÍ REAKCE Úloha 3-1 Protisměrné reakce oboustranně prvého řádu, výpočet přeměny... 2 Úloha 3-2 Protisměrné reakce oboustranně prvého řádu, výpočet času... 2 Úloha 3-3 Protisměrné reakce oboustranně
a) formulujte Weierstrassovo kritérium stejnoměrné konvergence b) pomocí tohoto kritéria ukažte, že funkční řada konverguje stejnoměrně na celé R
 ) ČÍSELNÉ A FUNKČNÍ ŘADY (5b) a) formulujte Leibnitzovo ritérium včetně absolutní onvergence b) apliujte toto ritérium na řadu a) formulujte podílové ritérium b) posuďte onvergenci řad c) oli členů této
) ČÍSELNÉ A FUNKČNÍ ŘADY (5b) a) formulujte Leibnitzovo ritérium včetně absolutní onvergence b) apliujte toto ritérium na řadu a) formulujte podílové ritérium b) posuďte onvergenci řad c) oli členů této
3.6.3 Prvky trojúhelníků
 3.6.3 Prvy trojúhelníů Předpolady: 030602 Př. 1: Narýsuj trojúhelní, je-li dáno: = 5m, β = 110, a = 6m. Změř veliosti vnitřníh úhlů a strany b. Zontroluj, zda platí vzore pro součet úhlů v trojúhelníu.
3.6.3 Prvy trojúhelníů Předpolady: 030602 Př. 1: Narýsuj trojúhelní, je-li dáno: = 5m, β = 110, a = 6m. Změř veliosti vnitřníh úhlů a strany b. Zontroluj, zda platí vzore pro součet úhlů v trojúhelníu.
Úloha 1-39 Teplotní závislost rychlostní konstanty, reakce druhého řádu... 11
 1. ZÁKLADNÍ POJMY Úloha 1-1 Různé vyjádření reakční rychlosti rychlosti přírůstku a úbytku jednotlivých složek... 2 Úloha 1-2 Různé vyjádření reakční rychlosti změna celkového látkového množství... 2 Úloha
1. ZÁKLADNÍ POJMY Úloha 1-1 Různé vyjádření reakční rychlosti rychlosti přírůstku a úbytku jednotlivých složek... 2 Úloha 1-2 Různé vyjádření reakční rychlosti změna celkového látkového množství... 2 Úloha
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ
 2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
2. KINETICKÁ ANALÝZA HOMOGENNÍCH REAKCÍ Úloha 2-1 Řád reakce a rychlostní konstanta integrální metodou stupeň přeměny... 2 Úloha 2-2 Řád reakce a rychlostní konstanta integrální metodou... 2 Úloha 2-3
4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY
 4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY 4.1 KINETICKÝ ROZBOR - ŘEŠENÍ KOMPLEXNÍHO MECHANISMU... 4.1.1 Záladní prinipy...3 Přílad 4-1 Řešení reačníh shemat aproximaí staionárního stavu...4 Přílad 4- Řešení
4. MECHANISMY A TEORIE CHEMICKÉ KINETIKY 4.1 KINETICKÝ ROZBOR - ŘEŠENÍ KOMPLEXNÍHO MECHANISMU... 4.1.1 Záladní prinipy...3 Přílad 4-1 Řešení reačníh shemat aproximaí staionárního stavu...4 Přílad 4- Řešení
Chemické výpočty II. Vladimíra Kvasnicová
 Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
Chemické výpočty II Vladimíra Kvasnicová Převod jednotek pmol/l nmol/l µmol/l mmol/l mol/l 10-12 10-9 10-6 10-3 mol/l µg mg g 10-6 10-3 g µl ml dl L 10-6 10-3 10-1 L Cvičení 12) cholesterol (MW=386,7g/mol):
MĚŘENÍ MOMENTU SETRVAČNOSTI Z DOBY KYVU
 Úloha č 5 MĚŘENÍ MOMENTU SETRVAČNOSTI Z DOBY KYVU ÚKOL MĚŘENÍ: Určete moment setrvačnosti ruhové a obdélníové desy vzhledem jednotlivým osám z doby yvu Vypočtěte moment setrvačnosti ruhové a obdélníové
Úloha č 5 MĚŘENÍ MOMENTU SETRVAČNOSTI Z DOBY KYVU ÚKOL MĚŘENÍ: Určete moment setrvačnosti ruhové a obdélníové desy vzhledem jednotlivým osám z doby yvu Vypočtěte moment setrvačnosti ruhové a obdélníové
Název: Chemická rovnováha II
 Název: Chemicá rovnováha II Autor: Mgr. Štěpán Miča Název šoly: Gymnázium Jana Nerudy, šola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzia Roční: 6. Tématicý cele: Chemicá rovnováha (fyziální
Název: Chemicá rovnováha II Autor: Mgr. Štěpán Miča Název šoly: Gymnázium Jana Nerudy, šola hl. města Prahy Předmět, mezipředmětové vztahy: chemie, fyzia Roční: 6. Tématicý cele: Chemicá rovnováha (fyziální
2) Připravte si 7 sad po pěti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
13. Kolik molů vodíku vznikne reakcí jednoho molu zinku s kyselinou chlorovodíkovou?
 Hmotnosti atomů a molekul, látkové množství - 1. ročník 1. Vypočítej skutečnou hmotnost jednoho atomu železa. 2. Vypočítej látkové množství a) S v 80 g síry, b) S 8 v 80 g síry, c) H 2 S v 70 g sulfanu.
Hmotnosti atomů a molekul, látkové množství - 1. ročník 1. Vypočítej skutečnou hmotnost jednoho atomu železa. 2. Vypočítej látkové množství a) S v 80 g síry, b) S 8 v 80 g síry, c) H 2 S v 70 g sulfanu.
Inovace bakalářského studijního oboru Aplikovaná chemie CZ.1.07/2.2.00/ Výpočty z chemických vzorců
 Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
Výpočty z chemických vzorců 1. Hmotnost kyslíku je 80 g. Vypočítejte : a) počet atomů kyslíku ( 3,011 10 atomů) b) počet molů kyslíku (2,5 mol) c) počet molekul kyslíku (1,505 10 24 molekul) d) objem (dm
REAKČNÍ KINETIKA 1. ZÁKLADNÍ POJMY. α, ß jsou dílčí reakční řády, α je dílčí reakční řád vzhledem ke složce A, ß vzhledem ke složce
 REKČNÍ KINETIK - zabývá se ryhlosí hemikýh reakí ZÁKLDNÍ POJMY Definie reakční ryhlosi v - pro reake probíhajíí za konsanního objemu v dξ di v V d ν d i [] moldm 3 s Ryhlosní rovnie obeně vyjadřuje vzah
REKČNÍ KINETIK - zabývá se ryhlosí hemikýh reakí ZÁKLDNÍ POJMY Definie reakční ryhlosi v - pro reake probíhajíí za konsanního objemu v dξ di v V d ν d i [] moldm 3 s Ryhlosní rovnie obeně vyjadřuje vzah
složky j v jednotkovém objemu reakční směsi V S s časem τ, tj. reakční rychlost složky j (rychlost vzniku či zániku složky), je definována jako
 22 Chemié reatory Egon Eert, Miloš Mare, Vladimír Mía V aždém tehnologiém proesu, de proíhá hemiá či iohemiá změna, e hemiý či iohemiý reator ednou z nevýznamněšíh součástí provozního zařízení. Při návrhu
22 Chemié reatory Egon Eert, Miloš Mare, Vladimír Mía V aždém tehnologiém proesu, de proíhá hemiá či iohemiá změna, e hemiý či iohemiý reator ednou z nevýznamněšíh součástí provozního zařízení. Při návrhu
11 Analytická geometrie v rovině
 Analytiá geometrie v rovině V této části se udeme zaývat pouze rovinou. Využijeme něterýh vlastností teré v prostoru neplatí.. Poznáma: Opaování u = (u u ) v = (v v ) u = (u + u ) u.v = u v + u v vetory
Analytiá geometrie v rovině V této části se udeme zaývat pouze rovinou. Využijeme něterýh vlastností teré v prostoru neplatí.. Poznáma: Opaování u = (u u ) v = (v v ) u = (u + u ) u.v = u v + u v vetory
Jana Fauknerová Matějčková
 Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
Jana Fauknerová Matějčková převody jednotek výpočet ph ph vodných roztoků ph silných kyselin a zásad ph slabých kyselin a zásad, disociační konstanta, pk ph pufrů koncentace 1000mg př. g/dl mg/l = = *10000
1) Napište názvy anorganických sloučenin: á 1 BOD OsO4
 BIOCHEMIE, 1a TEST Čas: 45 minut (povoleny jsou kalkulátory; tabulky a učebnice NE!!). Řešení úloh vpisujte do textu nebo za text úlohy. Za správné odpovědi můžete získat maximálně 40 bodů. 1) Napište
BIOCHEMIE, 1a TEST Čas: 45 minut (povoleny jsou kalkulátory; tabulky a učebnice NE!!). Řešení úloh vpisujte do textu nebo za text úlohy. Za správné odpovědi můžete získat maximálně 40 bodů. 1) Napište
Příklady: - počet členů dané domácnosti - počet zákazníků ve frontě - počet pokusů do padnutí čísla šest - životnost televizoru - věk člověka
 Náhodná veličina Náhodnou veličinou nazýváme veličinu, terá s určitými p-stmi nabývá reálných hodnot jednoznačně přiřazených výsledům příslušných náhodných pousů Náhodné veličiny obvyle dělíme na dva záladní
Náhodná veličina Náhodnou veličinou nazýváme veličinu, terá s určitými p-stmi nabývá reálných hodnot jednoznačně přiřazených výsledům příslušných náhodných pousů Náhodné veličiny obvyle dělíme na dva záladní
7.3.9 Směrnicový tvar rovnice přímky
 7.3.9 Směrnicový tvar rovnice přímy Předpolady: 7306 Pedagogicá poznáma: Stává se, že v hodině nestihneme poslední část s určováním vztahu mezi směrnicemi olmých příme. Vrátíme se obecné rovnici přímy:
7.3.9 Směrnicový tvar rovnice přímy Předpolady: 7306 Pedagogicá poznáma: Stává se, že v hodině nestihneme poslední část s určováním vztahu mezi směrnicemi olmých příme. Vrátíme se obecné rovnici přímy:
Chemická kinetika: Základní pojmy
 Chemicá inetia: Záladní pojmy Produty tepelného rozladu oxidu dusičného jsou oxid dusičitý a yslí. Tato reace probíhá v omezené míře i za laboratorní teploty a je příčinou žloutnutí až hnědnutí yseliny
Chemicá inetia: Záladní pojmy Produty tepelného rozladu oxidu dusičného jsou oxid dusičitý a yslí. Tato reace probíhá v omezené míře i za laboratorní teploty a je příčinou žloutnutí až hnědnutí yseliny
2) Připravte si 3 sady po šesti zkumavkách. Do všech zkumavek pipetujte 0.2 ml roztoku BAPNA o různé koncentraci podle tabulky.
 CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
CVIČENÍ Z ENZYMOLOGIE 1) Stanovení Michaelisovy konstanty trypsinu pomocí chromogenního substrátu. Aktivita trypsinu se určí změřením rychlosti hydrolýzy chromogenního substrátu BAPNA (Nα-benzoyl-L-arginin-p-nitroanilid)
Hydrochemie koncentrace látek (výpočty)
 1 Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) 1 mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve
1 Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) 1 mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve
MOMENT SETRVAČNOSTI. Obecná část Pomocí Newtonova pohybového zákona síly můžeme odvodit pohybovou rovnici pro rotační pohyb:
 MOMENT SETRVAČNOST Obecná část Pomocí Newtonova pohybového záona síly můžeme odvodit pohybovou rovnici pro rotační pohyb: dω M = = ε, (1) d t de M je moment vnější síly působící na těleso, ω úhlová rychlost,
MOMENT SETRVAČNOST Obecná část Pomocí Newtonova pohybového záona síly můžeme odvodit pohybovou rovnici pro rotační pohyb: dω M = = ε, (1) d t de M je moment vnější síly působící na těleso, ω úhlová rychlost,
7.3.9 Směrnicový tvar rovnice přímky
 739 Směrnicový tvar rovnice přímy Předpolady: 7306 Pedagogicá poznáma: Stává se, že v hodině nestihneme poslední část s určováním vztahu mezi směrnicemi olmých příme Vrátíme se obecné rovnici přímy: Obecná
739 Směrnicový tvar rovnice přímy Předpolady: 7306 Pedagogicá poznáma: Stává se, že v hodině nestihneme poslední část s určováním vztahu mezi směrnicemi olmých příme Vrátíme se obecné rovnici přímy: Obecná
Hmotnost. Výpočty z chemie. m(x) Ar(X) = Atomová relativní hmotnost: m(y) Mr(Y) = Molekulová relativní hmotnost: Mr(AB)= Ar(A)+Ar(B)
 Hmotnostní jednotka: Atomová relativní hmotnost: Molekulová relativní hmotnost: Molární hmotnost: Hmotnost u = 1,66057.10-27 kg X) Ar(X) = m u Y) Mr(Y) = m u Mr(AB)= Ar(A)+Ar(B) m M(Y) = ; [g/mol] n M(Y)
Hmotnostní jednotka: Atomová relativní hmotnost: Molekulová relativní hmotnost: Molární hmotnost: Hmotnost u = 1,66057.10-27 kg X) Ar(X) = m u Y) Mr(Y) = m u Mr(AB)= Ar(A)+Ar(B) m M(Y) = ; [g/mol] n M(Y)
ROVNOVÁŽNÉ NAPĚTÍ ČLÁNKU OVĚŘENÍ NERNSTOVY ROVNICE
 Verze 14.2.213 ROVNOVÁŽNÉ NAPĚTÍ ČLÁNKU OVĚŘENÍ NERNSTOVY ROVNICE 1. TEORETICKÝ ÚVOD 1.1 PRINCIP Nernstova rovnie, jedna ze základníh elektrohemikýh rovni, vyjadřuje závislost poteniálu elektrody, která
Verze 14.2.213 ROVNOVÁŽNÉ NAPĚTÍ ČLÁNKU OVĚŘENÍ NERNSTOVY ROVNICE 1. TEORETICKÝ ÚVOD 1.1 PRINCIP Nernstova rovnie, jedna ze základníh elektrohemikýh rovni, vyjadřuje závislost poteniálu elektrody, která
Laboratorní práce č. 4
 Jméno Body Laboratorní práce č. 4 Úloha 1: Chelatometrické stanovení celkové tvrdosti vody Uveďte spotřeby odměrného roztoku Chelatonu 3 a jejich aritmetický průměr. Titrace # 1 2 3 Průměr Spotřeba / ml
Jméno Body Laboratorní práce č. 4 Úloha 1: Chelatometrické stanovení celkové tvrdosti vody Uveďte spotřeby odměrného roztoku Chelatonu 3 a jejich aritmetický průměr. Titrace # 1 2 3 Průměr Spotřeba / ml
Acidobazické rovnováhy
 Aidobaziké rovnováhy při aidobazikýh rovnováháh (proteolytikýh) - přenos vodíkového kationtu mezi ionty (molekulami) zúčastněnými v rovnováze kyselina donor protonů zásada akeptor protonů YSELINA + zásada
Aidobaziké rovnováhy při aidobazikýh rovnováháh (proteolytikýh) - přenos vodíkového kationtu mezi ionty (molekulami) zúčastněnými v rovnováze kyselina donor protonů zásada akeptor protonů YSELINA + zásada
MOMENT SETRVAČNOSTI. Obecná část Pomocí Newtonova pohybového zákona síly můžeme odvodit pohybovou rovnici pro rotační pohyb:
 MOMENT SETRVAČNOST Obecná část Pomocí Newtonova pohybového záona síly můžeme odvodit pohybovou rovnici pro rotační pohyb: dω M = = ε, (1) d t de M je moment vnější síly působící na těleso, ω úhlová rychlost,
MOMENT SETRVAČNOST Obecná část Pomocí Newtonova pohybového záona síly můžeme odvodit pohybovou rovnici pro rotační pohyb: dω M = = ε, (1) d t de M je moment vnější síly působící na těleso, ω úhlová rychlost,
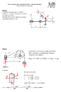
úloha 8. - inhibiční konstanta
 úloha 8. Kinetika enzymové reakce. Inhibice enzymové reakce. a) Stanovení počáteční rychlosti enzymové reakce, stanovení molekulární aktivity (čísla přeměny) enzymu b) Závislost rychlosti enzymové reakce
úloha 8. Kinetika enzymové reakce. Inhibice enzymové reakce. a) Stanovení počáteční rychlosti enzymové reakce, stanovení molekulární aktivity (čísla přeměny) enzymu b) Závislost rychlosti enzymové reakce
ENZYMY. Klasifikace enzymů
 ENZYMY Enzymy jsou bílkoviny, které katalyzují chemické reakce probíhající v živých organismech. Byly identifikovány tisíce enzymů, mnohé z nich byly izolovány čisté. Klasifikace enzymů Vzhledem k tomu,
ENZYMY Enzymy jsou bílkoviny, které katalyzují chemické reakce probíhající v živých organismech. Byly identifikovány tisíce enzymů, mnohé z nich byly izolovány čisté. Klasifikace enzymů Vzhledem k tomu,
N A = 6,023 10 23 mol -1
 Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
Pro vyjadřování množství látky se v chemii zavádí veličina látkové množství. Značí se n, jednotkou je 1 mol. Látkové množství je jednou ze základních veličin soustavy SI. Jeden mol je takové množství látky,
VNITŘNÍ ENERGIE, TEPLO A PRÁCE
 VNITŘNÍ ENERGIE, TEPLO A PRÁCE 1. Vnitřní energie (U) Vnitřní energie je energie uložená v těleseh. Je těžké určit absolutní hodnotu. Pro většinu dějů to není nezbytné, protože ji nejsme shopni uvolnit
VNITŘNÍ ENERGIE, TEPLO A PRÁCE 1. Vnitřní energie (U) Vnitřní energie je energie uložená v těleseh. Je těžké určit absolutní hodnotu. Pro většinu dějů to není nezbytné, protože ji nejsme shopni uvolnit
Předpokládáme ideální chování, neuvažujeme autoprotolýzu vody ve smyslu nutnosti číselného řešení simultánních rovnováh. CH3COO
 Pufr ze slabé kyseliny a její soli se silnou zásaou např CHCOOH + CHCOONa Násleujíí rozbor bue vyházet z počátečního stavu, ky konentrae obou látek jsou srovnatelné (největší pufrační kapaita je pro ekvimolární
Pufr ze slabé kyseliny a její soli se silnou zásaou např CHCOOH + CHCOONa Násleujíí rozbor bue vyházet z počátečního stavu, ky konentrae obou látek jsou srovnatelné (největší pufrační kapaita je pro ekvimolární
Opakování k maturitě matematika 4. roč. STR 2 <
 8.. Otáza číslo Mocniny a odmocniny. b.) Zjednodušte: b. b Opaování maturitě matematia. roč. STR :.) Zjednodušte:.) Vypočtěte: a. y : ( a. y ) =.) Umocněte: 7 7.. Otáza číslo Lineární a vadraticé rovnice.)
8.. Otáza číslo Mocniny a odmocniny. b.) Zjednodušte: b. b Opaování maturitě matematia. roč. STR :.) Zjednodušte:.) Vypočtěte: a. y : ( a. y ) =.) Umocněte: 7 7.. Otáza číslo Lineární a vadraticé rovnice.)
β 180 α úhel ve stupních β úhel v radiánech β = GONIOMETRIE = = 7π 6 5π 6 3 3π 2 π 11π 6 Velikost úhlu v obloukové a stupňové míře: Stupňová míra:
 GONIOMETRIE Veliost úhlu v oblouové a stupňové míře: Stupňová míra: Jednota (stupeň) 60 600 jeden stupeň 60 minut 600 vteřin Př. 5,4 5 4 0,4 0,4 60 4 Oblouová míra: Jednota radián radián je veliost taového
GONIOMETRIE Veliost úhlu v oblouové a stupňové míře: Stupňová míra: Jednota (stupeň) 60 600 jeden stupeň 60 minut 600 vteřin Př. 5,4 5 4 0,4 0,4 60 4 Oblouová míra: Jednota radián radián je veliost taového
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY
 ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
ZÁKLADNÍ CHEMICKÉ POJMY A ZÁKONY Klíčová slova: relativní atomová hmotnost (A r ), relativní molekulová hmotnost (M r ), Avogadrova konstanta (N A ), látkové množství (n, mol), molární hmotnost (M, g/mol),
6 5 = 0, = 0, = 0, = 0, 0032
 III. Opaované pousy, Bernoulliho nerovnost. Házíme pětrát hrací ostou a sledujeme výsyt šesty. Spočtěte pravděpodobnosti možných výsledů a určete, terý má největší pravděpodobnost. Řešení: Jedná se o serii
III. Opaované pousy, Bernoulliho nerovnost. Házíme pětrát hrací ostou a sledujeme výsyt šesty. Spočtěte pravděpodobnosti možných výsledů a určete, terý má největší pravděpodobnost. Řešení: Jedná se o serii
STANOVENÍ PROPUSTNOSTI OBALOVÝCH MATERIÁLŮ PRO VODNÍ PÁRU
 STANOVENÍ PROPUSTNOSTI OBALOVÝCH MATERIÁLŮ PRO VODNÍ PÁRU Úvod Obecná teorie propustnosti polymerních obalových materiálů je zmíněna v návodu pro stanovení propustnosti pro kyslík. Na tomto místě je třeba
STANOVENÍ PROPUSTNOSTI OBALOVÝCH MATERIÁLŮ PRO VODNÍ PÁRU Úvod Obecná teorie propustnosti polymerních obalových materiálů je zmíněna v návodu pro stanovení propustnosti pro kyslík. Na tomto místě je třeba
studentská kopie Předběžný odhad profilů: 1. Výpočet zatížení 1.1) Zatížení stálá Materiál: RD S10, LLD SB
 Zadání: Navrhněte a posuďte rozhodujíí nosné prvy (latě, rove, leštiny, vaznie, sloupy) a jejih spoje (vaznie leština, leština-roev, roev-vaznie, vaznie-sloupe) střešní onstrue obytné budovy z materiálů
Zadání: Navrhněte a posuďte rozhodujíí nosné prvy (latě, rove, leštiny, vaznie, sloupy) a jejih spoje (vaznie leština, leština-roev, roev-vaznie, vaznie-sloupe) střešní onstrue obytné budovy z materiálů
Reciprokou funkci znáte ze základní školy pod označením nepřímá úměra.
 @091 7. Reciproá funce Reciproou funci znáte ze záladní šoly pod označením nepřímá úměra. Definice: Reciproá funce je dána předpisem ( 0 je reálné číslo) f : y R \ {0} A) Definiční obor funce: Je třeba
@091 7. Reciproá funce Reciproou funci znáte ze záladní šoly pod označením nepřímá úměra. Definice: Reciproá funce je dána předpisem ( 0 je reálné číslo) f : y R \ {0} A) Definiční obor funce: Je třeba
Ú L O H Y. kde r je rychlost reakce vyjádřená úbytkem látkového množství kyslíku v molech v objemu 1 m
 Ú L O H Y 1. Různé vyjádření reakční rychlosti; Př. 9.1 Určete, jaké vztahy platí mezi rychlostmi vzniku a ubývání jednotlivých složek reakce 4 NH 3 (g) + 5 O (g) = 4 NO(g) + 6 H O(g). Různé vyjádření
Ú L O H Y 1. Různé vyjádření reakční rychlosti; Př. 9.1 Určete, jaké vztahy platí mezi rychlostmi vzniku a ubývání jednotlivých složek reakce 4 NH 3 (g) + 5 O (g) = 4 NO(g) + 6 H O(g). Různé vyjádření
Složení soustav (roztoky, koncentrace látkového množství)
 VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
VZOROVÉ PŘÍKLADY Z CHEMIE A DOPORUČENÁ LITERATURA pro přípravu k přijímací zkoušce studijnímu oboru Nanotechnologie na VŠB TU Ostrava Doporučená literatura z chemie: Prakticky jakákoliv celostátní učebnice
ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie C ŘEŠENÍ KONTROLNÍHO TESTU ŠKOLNÍHO KOLA KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) Úloha 1 Neznámý nerost 21 bodů 1. Barva plamene:
Měření indukčností cívek
 7..00 Ṫeorie eletromagneticého pole Měření indučností cíve.......... Petr Česá, studijní supina 05 Letní semestr 000/00 . Měření indučností cíve Měření vlastní a vzájemné indučnosti válcových cíve ZAÁNÍ
7..00 Ṫeorie eletromagneticého pole Měření indučností cíve.......... Petr Česá, studijní supina 05 Letní semestr 000/00 . Měření indučností cíve Měření vlastní a vzájemné indučnosti válcových cíve ZAÁNÍ
Kinetika enzymově katalysovaných reakcí
 Kinetika enzymově katalysovaných reakcí Rychlost reakce aa + bb + c C + d D +... dn A d [ A] d [ B ] d [C ] v= = = = av d τ ad τ bd τ cd τ Počáteční rychlost reakce aa + bb + konc. c C + d D +... d [ A]
Kinetika enzymově katalysovaných reakcí Rychlost reakce aa + bb + c C + d D +... dn A d [ A] d [ B ] d [C ] v= = = = av d τ ad τ bd τ cd τ Počáteční rychlost reakce aa + bb + konc. c C + d D +... d [ A]
. Najdi parametrické vyjádření přímky AB. Nakresli přímku AB do kartézské soustavy souřadnic a najdi její další vyjádření.
 735 Obená rovnie přímky I Předpoklady: 070304 Pedagogiká poznámka: Úvodní příklad se nesmí příliš prodlužovat Nemá enu ztráet čas tím, že si většina žáků nepamatuje lineární funke Raději ryhle napíši řešení
735 Obená rovnie přímky I Předpoklady: 070304 Pedagogiká poznámka: Úvodní příklad se nesmí příliš prodlužovat Nemá enu ztráet čas tím, že si většina žáků nepamatuje lineární funke Raději ryhle napíši řešení
Alternativní rozdělení. Alternativní rozdělení. Binomické rozdělení. Binomické rozdělení
 Alternativní rozdělení Alternativní rozdělení Alternativní rozdělení Alternativní rozdělení Náhodná veličina X má alternativní rozdělení s parametrem p, jestliže nabývá hodnot 0 a 1 s pravděpodobnostmi
Alternativní rozdělení Alternativní rozdělení Alternativní rozdělení Alternativní rozdělení Náhodná veličina X má alternativní rozdělení s parametrem p, jestliže nabývá hodnot 0 a 1 s pravděpodobnostmi
, kde J [mol.m -2.s -1 ] je difuzní tok, D [m 2.s -1 ] je celkový
![, kde J [mol.m -2.s -1 ] je difuzní tok, D [m 2.s -1 ] je celkový , kde J [mol.m -2.s -1 ] je difuzní tok, D [m 2.s -1 ] je celkový](/thumbs/62/46575607.jpg) FM / DIFUZE I. I. a II. FICKŮV ZÁKON Jméno: St. sk.: Datum: Autor vičení: Ing. Eva Novotná, Ph.D., 4enov@seznam.z Potřebné moudro : Cílem vičení je vytvořit reálný pohled na důležitost, mnohotvárnost a
FM / DIFUZE I. I. a II. FICKŮV ZÁKON Jméno: St. sk.: Datum: Autor vičení: Ing. Eva Novotná, Ph.D., 4enov@seznam.z Potřebné moudro : Cílem vičení je vytvořit reálný pohled na důležitost, mnohotvárnost a
Ac - +H 2 O HAc + OH -, naopak roztok soli silné kyseliny a slabé zásady (např. chlorid amonný NH 4 Cl) vykazuje kyselou reakci K A
 YDROLÝZ SOLÍ ydrolýze podléhjí soli, jejihž ktion přísluší slbé bázi /nebo nion slbé kyselině. ydrolýz soli je reke soli s vodou z vzniku neutrálníh molekul příslušného slbého elektrolytu. Důsledkem hydrolýzy
YDROLÝZ SOLÍ ydrolýze podléhjí soli, jejihž ktion přísluší slbé bázi /nebo nion slbé kyselině. ydrolýz soli je reke soli s vodou z vzniku neutrálníh molekul příslušného slbého elektrolytu. Důsledkem hydrolýzy
2. KINETICKÁ ANALÝZA JEDNODUCHÝCH HO- MOGENNÍCH REAKCÍ
 . KINETICKÁ ANALÝZA JEDNODUCHÝCH HO- MOGENNÍCH REAKCÍ.1 Kinetiká měření....1.1 Chemiké metody...3.1. Fyzikální metody...3. Stanovení řádu reake a ryhlostní konstanty...4.1.1 Integrální metoda...4 Příklad
. KINETICKÁ ANALÝZA JEDNODUCHÝCH HO- MOGENNÍCH REAKCÍ.1 Kinetiká měření....1.1 Chemiké metody...3.1. Fyzikální metody...3. Stanovení řádu reake a ryhlostní konstanty...4.1.1 Integrální metoda...4 Příklad
Určení počátku šikmého pole řetězovky
 2. Šikmé pole Určení počátku šikmého pole řetězovky d h A ϕ y A y x A x a Obr. 2.1. Souřadnie počátku šikmého pole Jestliže heme určit řetězovku, která je zavěšená v bodeh A a a je daná parametrem, je
2. Šikmé pole Určení počátku šikmého pole řetězovky d h A ϕ y A y x A x a Obr. 2.1. Souřadnie počátku šikmého pole Jestliže heme určit řetězovku, která je zavěšená v bodeh A a a je daná parametrem, je
Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku.
 Koncentrace roztoků Hmotnostní zlomek w Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku. w= m A m s m s...hmotnost celého roztoku, m A... hmotnost rozpuštěné látky Hmotnost roztoku
Koncentrace roztoků Hmotnostní zlomek w Vyjadřuje poměr hmotnosti rozpuštěné látky k hmotnosti celého roztoku. w= m A m s m s...hmotnost celého roztoku, m A... hmotnost rozpuštěné látky Hmotnost roztoku
Chemické veličiny, vztahy mezi nimi a chemické výpočty
 SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
SBÍRKA ŘEŠENÝCH PŘÍKLADŮ PRO PROJEKT PŘÍRODNÍ VĚDY AKTIVNĚ A INTERAKTIVNĚ CZ.1.07/1.1.24/01.0040 Chemické veličiny, vztahy mezi nimi a chemické výpočty Mgr. Jana Žůrková, 2013, 20 stran Obsah 1. Veličiny
Ch - Chemické reakce a jejich zápis
 Ch - Chemické reakce a jejich zápis Autor: Mgr. Jaromír Juřek Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl
Ch - Chemické reakce a jejich zápis Autor: Mgr. Jaromír Juřek Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE Tento dokument byl
ENZYMY. RNDr. Lucie Koláčná, Ph.D.
 ENZYMY RNDr. Lucie Koláčná, Ph.D. Enzymy: katalyzátory živé buňky jednoduché nebo složené proteiny Apoenzym: proteinová část Kofaktor: nízkomolekulová neaminokyselinová struktura nezbytně nutná pro funkci
ENZYMY RNDr. Lucie Koláčná, Ph.D. Enzymy: katalyzátory živé buňky jednoduché nebo složené proteiny Apoenzym: proteinová část Kofaktor: nízkomolekulová neaminokyselinová struktura nezbytně nutná pro funkci
f (k) (x 0 ) (x x 0 ) k, x (x 0 r, x 0 + r). k! f(x) = k=1 Řada se nazývá Taylorovou řadou funkce f v bodě x 0. Přehled některých Taylorových řad.
 8. Taylorova řada. V urzu matematiy jsme uázali, že je možné funci f, terá má v oolí bodu x derivace aproximovat polynomem, jehož derivace se shodují s derivacemi aproximované funce v bodě x. Poud má funce
8. Taylorova řada. V urzu matematiy jsme uázali, že je možné funci f, terá má v oolí bodu x derivace aproximovat polynomem, jehož derivace se shodují s derivacemi aproximované funce v bodě x. Poud má funce
Rovnice rovnováhy: ++ =0 x : =0 y : =0 =0,83
 Vypočítejte moment síly P = 4500 N k osám x, y, z, je-li a = 0,25 m, b = 0, 03 m, R = 0,06 m, β = 60. Nositelka síly P svírá s tečnou ke kružnici o poloměru R úhel α = 20.. α β P y Uvolnění: # y β! x Rovnice
Vypočítejte moment síly P = 4500 N k osám x, y, z, je-li a = 0,25 m, b = 0, 03 m, R = 0,06 m, β = 60. Nositelka síly P svírá s tečnou ke kružnici o poloměru R úhel α = 20.. α β P y Uvolnění: # y β! x Rovnice
Isaac Newton Jan Marcus Marci z Kronlandu
 Optié vlastnosti láte Isaa Newton 64 77 Jan Marus Mari z Kronlandu 595 677 Světlo je eletromagnetié vlnění James Cler Maxwell 83 879 Maxwellovy rovnie ρ E, B E B E, B μ j + μ t t Energie eletromagnetiýh
Optié vlastnosti láte Isaa Newton 64 77 Jan Marus Mari z Kronlandu 595 677 Světlo je eletromagnetié vlnění James Cler Maxwell 83 879 Maxwellovy rovnie ρ E, B E B E, B μ j + μ t t Energie eletromagnetiýh
Stanovení koncentrace složky v roztoku vodivostním měřením
 Laboratorní úloha B/2 Stanovení koncentrace složky v roztoku vodivostním měřením Úkol: A. Stanovte vodivostním měřením koncentraci HCl v dodaném vzorku roztoku. Zjistěte vodivostním měřením body konduktometrické
Laboratorní úloha B/2 Stanovení koncentrace složky v roztoku vodivostním měřením Úkol: A. Stanovte vodivostním měřením koncentraci HCl v dodaném vzorku roztoku. Zjistěte vodivostním měřením body konduktometrické
{ } Konstrukce trojúhelníků I. Předpoklady: 3404
 3.4.5 Konstrue trojúhelníů I Předolady: 3404 U onstručníh úloh rozeznáváme dva záladní tyy: olohové úlohy: jejih zadání většinou začíná slovy Je dána.. Tato věta znamená, že onstrui musíme začít rvem,
3.4.5 Konstrue trojúhelníů I Předolady: 3404 U onstručníh úloh rozeznáváme dva záladní tyy: olohové úlohy: jejih zadání většinou začíná slovy Je dána.. Tato věta znamená, že onstrui musíme začít rvem,
EKONOMETRIE 10. přednáška Modely zpožděných proměnných
 EKONOMERIE 10. přednáška Modely zpožděnýh proměnnýh Časové posuny mezi působením určitýh faktorů (vyvolány např. informačními, rozhodovaími, instituionálními a tehnologikými důvody). Setrvačnost ve vývoji
EKONOMERIE 10. přednáška Modely zpožděnýh proměnnýh Časové posuny mezi působením určitýh faktorů (vyvolány např. informačními, rozhodovaími, instituionálními a tehnologikými důvody). Setrvačnost ve vývoji
Cvičení z termomechaniky Cvičení 8.
 Příklad Vzduch o tlaku,5 [MPa] a teplotě 27 [ C] vytéká Lavalovou dýzou do prostředí o tlaku 0,7 [MPa]. Nejužší průřez dýzy má průměr 0,04 [m]. Za jakou dobu vyteče 250 [kg] vzduchu a jaká bude výtoková
Příklad Vzduch o tlaku,5 [MPa] a teplotě 27 [ C] vytéká Lavalovou dýzou do prostředí o tlaku 0,7 [MPa]. Nejužší průřez dýzy má průměr 0,04 [m]. Za jakou dobu vyteče 250 [kg] vzduchu a jaká bude výtoková
Kurz 1 Úvod k biochemickému praktiku
 Kurz 1 Úvod k biochemickému praktiku Pavla Balínová http://vyuka.lf3.cuni.cz/ Důležité informace Kroužkový asistent: RNDr. Pavla Balínová e-mailová adresa: pavla.balinova@lf3.cuni.cz místnost: 410 studijní
Kurz 1 Úvod k biochemickému praktiku Pavla Balínová http://vyuka.lf3.cuni.cz/ Důležité informace Kroužkový asistent: RNDr. Pavla Balínová e-mailová adresa: pavla.balinova@lf3.cuni.cz místnost: 410 studijní
Hydrochemie koncentrace látek (výpočty)
 Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve 2
Atomová hmotnostní konstanta/jednotka m u Relativní atomová hmotnost Relativní molekulová hmotnost Látkové množství (mol) mol je takové množství látky, které obsahuje tolik částic, kolik je atomů ve 2
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ)
 KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
KONTROLNÍ TEST ŠKOLNÍHO KOLA (70 BODŮ) Úloha 1 Ic), IIa), IIId), IVb) za každé správné přiřazení po 1 bodu; celkem Úloha 2 8 bodů 1. Sodík reaguje s vodou za vzniku hydroxidu sodného a dalšího produktu.
Odměrná analýza, volumetrie
 Odměrná analýza, volumetrie metoda založená na měření objemu metoda absolutní: stanovení analytu ze změřeného objemu roztoku činidla o přesně známé koncentraci, který je zapotřebí k úplné a stechiometricky
Odměrná analýza, volumetrie metoda založená na měření objemu metoda absolutní: stanovení analytu ze změřeného objemu roztoku činidla o přesně známé koncentraci, který je zapotřebí k úplné a stechiometricky
Ústřední komise Chemické olympiády. 55. ročník 2018/2019 NÁRODNÍ KOLO. Kategorie E. Řešení praktických částí
 Ústřední komise Chemické olympiády 55. ročník 2018/2019 NÁRODNÍ KOLO Kategorie E Řešení praktických částí PRAKTICKÁ ČÁST 50 BODŮ Úloha 1 Stanovení Ni 2+ a Ca 2+ ve směsi konduktometricky 20 bodů 1) Chemické
Ústřední komise Chemické olympiády 55. ročník 2018/2019 NÁRODNÍ KOLO Kategorie E Řešení praktických částí PRAKTICKÁ ČÁST 50 BODŮ Úloha 1 Stanovení Ni 2+ a Ca 2+ ve směsi konduktometricky 20 bodů 1) Chemické
9 Skonto, porovnání různých forem financování
 9 Sonto, porovnání různých forem financování Sonto je sráža (sleva) z ceny, terou posytuje prodávající upujícímu v případě, že upující zaplatí oamžitě (resp. během dohodnuté ráté lhůty). Výše sonta je
9 Sonto, porovnání různých forem financování Sonto je sráža (sleva) z ceny, terou posytuje prodávající upujícímu v případě, že upující zaplatí oamžitě (resp. během dohodnuté ráté lhůty). Výše sonta je
Značí se A r Určí se z periodické tabulky. Jednotkou je 1/12 hmotnosti atomu uhlíku. A r (H) = 1 A r (O) = 16
 CHEMICKÉ VÝPOČTY Značí se A r Určí se z periodické tabulky. Jednotkou je 1/12 hmotnosti atomu uhlíku. A r (H) = 1 A r (O) = 16 12 6 C Značí se M r Vypočítá se jako součet relativních atomových hmotností
CHEMICKÉ VÝPOČTY Značí se A r Určí se z periodické tabulky. Jednotkou je 1/12 hmotnosti atomu uhlíku. A r (H) = 1 A r (O) = 16 12 6 C Značí se M r Vypočítá se jako součet relativních atomových hmotností
E KONTROLNÍ TEST ŠKOLNÍHO KOLA
 Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie A a E KONTROLNÍ TEST ŠKOLNÍHO KOLA časová náročnost: 120 minut KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) ANORGANICKÁ CHEMIE 16
Ústřední komise Chemické olympiády 48. ročník 2011/2012 ŠKOLNÍ KOLO kategorie A a E KONTROLNÍ TEST ŠKOLNÍHO KOLA časová náročnost: 120 minut KONTROLNÍ TEST ŠKOLNÍHO KOLA (60 BODŮ) ANORGANICKÁ CHEMIE 16
Měření na 1-fázovém transformátoru. Schéma zapojení:
 Číslo úlohy: Jméno a příjmení: Třída/Supina: Měřeno dne: Název úlohy: / Měření na 1-fázovém transformátoru Spolupracovali ve supině.. Zadání úlohy: Na zadaném 1-fázovém transformátoru proveďte následující
Číslo úlohy: Jméno a příjmení: Třída/Supina: Měřeno dne: Název úlohy: / Měření na 1-fázovém transformátoru Spolupracovali ve supině.. Zadání úlohy: Na zadaném 1-fázovém transformátoru proveďte následující
1 Základní chemické výpočty. Koncentrace roztoků
 1 Záklní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N výpočtem Látkové množství n.. Hmotnost
1 Záklní chemické výpočty. Koncentrace roztoků Množství látky (Doplňte tabulku) Veličina Symbol Jednotka SI Jednotky v biochemii Veličina se zjišťuje Počet částic N výpočtem Látkové množství n.. Hmotnost
Autor: Tomáš Galbička www.nasprtej.cz Téma: Roztoky Ročník: 2.
 Roztoky směsi dvou a více látek jsou homogenní (= nepoznáte jednotlivé částečky roztoku - částice jsou menší než 10-9 m) nejčastěji se rozpouští pevná látka v kapalné látce jedna složka = rozpouštědlo
Roztoky směsi dvou a více látek jsou homogenní (= nepoznáte jednotlivé částečky roztoku - částice jsou menší než 10-9 m) nejčastěji se rozpouští pevná látka v kapalné látce jedna složka = rozpouštědlo
Fyzikální praktikum č.: 1
 Datum: 5.5.2005 Fyziální pratium č.: 1 ypracoval: Tomáš Henych Název: Studium činnosti fotonásobiče Úol: 1. Stanovte závislost oeficientu seundární emise na napětí mezi dynodami. yneste do grafu závislost
Datum: 5.5.2005 Fyziální pratium č.: 1 ypracoval: Tomáš Henych Název: Studium činnosti fotonásobiče Úol: 1. Stanovte závislost oeficientu seundární emise na napětí mezi dynodami. yneste do grafu závislost
VZÁJEMNÁ POLOHA DVOU PŘÍMEK V ROVINĚ
 VZÁJEMNÁ POLOHA DVOU PŘÍMEK V ROVINĚ Dvě přímky v rovině mohou být: různoběžné - mají jediný společný bod, rovnoběžné různé - nemají společný bod, totožné - mají nekonečně mnoho společných bodů. ŘEŠENÉ
VZÁJEMNÁ POLOHA DVOU PŘÍMEK V ROVINĚ Dvě přímky v rovině mohou být: různoběžné - mají jediný společný bod, rovnoběžné různé - nemají společný bod, totožné - mají nekonečně mnoho společných bodů. ŘEŠENÉ
Chemické výpočty I. Vladimíra Kvasnicová
 Chemické výpočty I Vladimíra Kvasnicová 1) Vyjadřování koncentrace molarita procentuální koncentrace převod jednotek 2) Osmotický tlak, osmolarita Základní pojmy koncentrace = množství rozpuštěné látky
Chemické výpočty I Vladimíra Kvasnicová 1) Vyjadřování koncentrace molarita procentuální koncentrace převod jednotek 2) Osmotický tlak, osmolarita Základní pojmy koncentrace = množství rozpuštěné látky
Aplikované chemické procesy. Heterogenní nekatalyzované reakce
 plikované hemiké proesy Heterogenní nekatalyzované reake Heterogenní nekatalytiké reake plyn nebo kapalina dostávají do styku s tuhou látkou a reagují s ní, přičemž se tato látka mění v produkt. a ( tekutina
plikované hemiké proesy Heterogenní nekatalyzované reake Heterogenní nekatalytiké reake plyn nebo kapalina dostávají do styku s tuhou látkou a reagují s ní, přičemž se tato látka mění v produkt. a ( tekutina
MATEMATIKA. O paradoxech spojených s losováním koulí
 MATEMATIKA O paradoxeh spojenýh s losováním oulí PAVEL TLUSTÝ IRENEUSZ KRECH Eonomiá faulta JU, Česé Budějovie Uniwersytet Pedagogizny, Kraów Matematia popisuje a zoumá různé situae reálného světa. Je
MATEMATIKA O paradoxeh spojenýh s losováním oulí PAVEL TLUSTÝ IRENEUSZ KRECH Eonomiá faulta JU, Česé Budějovie Uniwersytet Pedagogizny, Kraów Matematia popisuje a zoumá různé situae reálného světa. Je
Laboratorní práce č. 1: Přibližné určení průměru molekuly kyseliny olejové
 Přírodní vědy moderně a interaktivně FYZIKA 4. ročník šestiletého a 2. ročník čtyřletého studia Laboratorní práce č. 1: Přibližné určení průměru molekuly kyseliny olejové ymnázium Přírodní vědy moderně
Přírodní vědy moderně a interaktivně FYZIKA 4. ročník šestiletého a 2. ročník čtyřletého studia Laboratorní práce č. 1: Přibližné určení průměru molekuly kyseliny olejové ymnázium Přírodní vědy moderně
3. SIMULTÁNNÍ REAKCE
 3. IMULTÁNNÍ REKCE 3. Protsměrné (vratné) reae... 3.. Reae, obě ílčí reae prvého řáu... 3.. Reae D E, D, D E...4 3..3 Kneta & termoynama (vratné reae & hemá rovnováha)...4 Příla 3- Protsměrné reae...6
3. IMULTÁNNÍ REKCE 3. Protsměrné (vratné) reae... 3.. Reae, obě ílčí reae prvého řáu... 3.. Reae D E, D, D E...4 3..3 Kneta & termoynama (vratné reae & hemá rovnováha)...4 Příla 3- Protsměrné reae...6
EKONOMETRIE 2. přednáška Modely chování výrobce I.
 EKONOMETRIE. přednáška Modely hování výrobe I. analýza raionálního hování firmy při rozhodování o objemu výroby, vstupů a nákladů při maimalizai zisku základní prinip při rozhodování výrobů Produkční funke
EKONOMETRIE. přednáška Modely hování výrobe I. analýza raionálního hování firmy při rozhodování o objemu výroby, vstupů a nákladů při maimalizai zisku základní prinip při rozhodování výrobů Produkční funke
4. TEORIE REAKČNÍ RYCHLOSTI
 4. TEOIE EČÍ YCHLOSTI onečný íl: Vyjádření yhlostní onstanty elementání eae v ávislosti na vnějšíh podmínáh a stutuře eagujííh láte. HEIOV TEOIE Pan henius (889) vyšel empiiy jištěné ávislosti na T ln.
4. TEOIE EČÍ YCHLOSTI onečný íl: Vyjádření yhlostní onstanty elementání eae v ávislosti na vnějšíh podmínáh a stutuře eagujííh láte. HEIOV TEOIE Pan henius (889) vyšel empiiy jištěné ávislosti na T ln.
1 Gaussova kvadratura
 Cvičení - zadání a řešení úloh Zálady numericé matematiy - NMNM0 Verze z 7. prosince 08 Gaussova vadratura Fat, že pro něterá rovnoměrná rozložení uzlů dostáváme přesnost o stupeň vyšší napovídá, že pro
Cvičení - zadání a řešení úloh Zálady numericé matematiy - NMNM0 Verze z 7. prosince 08 Gaussova vadratura Fat, že pro něterá rovnoměrná rozložení uzlů dostáváme přesnost o stupeň vyšší napovídá, že pro
Buckinghamův Π-teorém (viz Barenblatt, Scaling, 2003)
 Bucinghamův Π-teorém (viz Barenblatt, Scaling, 2003) Formalizace rozměrové analýzy ( výsledné jednoty na obou stranách musí souhlasit ). Rozměr fyziální veličiny Mějme nějaou třídu jednote, napřílad [(g,
Bucinghamův Π-teorém (viz Barenblatt, Scaling, 2003) Formalizace rozměrové analýzy ( výsledné jednoty na obou stranách musí souhlasit ). Rozměr fyziální veličiny Mějme nějaou třídu jednote, napřílad [(g,
