Vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů
|
|
|
- Jiřina Konečná
- před 8 lety
- Počet zobrazení:
Transkript
1 ČESKÁ ZEMĚDĚLSKÁ UNIVERZITA V PRAZE Fakulta agrobiologie, potravinových a přírodních zdrojů Katedra veterinárních disciplín Vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů DISERTAČNÍ PRÁCE Autor. Ing. Hana Tichovská Školitel: prof. Mgr. Ing. Markéta Sedmíková, Ph.D. Školitel specialista: doc. Ing. Eva Chmelíková, Ph.D. Praha 2011
2 Prohlášení Prohlašuji, ţe jsem doktorskou práci na téma:,,vliv oxidu dusnatého na meiotickou kompetenci prasečích oocytů vypracovala samostatně a pouţila jen pramenů, které cituji a uvádím v přiloţené bibliografii. V Praze dne: Podpis autora práce:
3 Poděkování Ráda bych touto cestou poděkovala své školitelce prof. Mgr. Ing. Markétě Sedmíkové, Ph.D, za její cenné připomínky při laboratorní práci i publikování výsledků, které byly velmi inspirativní, za trpělivost a ochotu při vedení mé disertační práce. Dále děkuji za moţnost provádění experimentů v nových laboratořích a moţnost získávání nových poznatků na zahraničních stáţích. Dále bych ráda poděkovala doc. Ing. Evě Chmelíkové, Ph.D. za vedení mé práce v laboratoři a pomoc při zvládnutí náročné metodiky izolace a kultivace rostoucích oocytů i dalších metod a zpracování výsledků. Mé díky patří také všem pracovníkům KVD za vytvoření přátelského kolektivu a dobrého pracovního prostředí. Mnohokrát také děkuji celé mé rodině za podporu ve studiu.
4 Abstract Reproductive biotechnology such as in vitro fertilization, the creation of transgenic animals or cloning by nuclear transfer depends on the use of fully grown, meiotically competent oocytes capable of completing meiotic maturation by reaching the stage of metaphase II. However, there exists only a limited quantity of these oocytes in the ovaries of females. In view of their limited number, growing oocytes without meiotic competence represent a possible source. The mechanisms controlling the acquisition of meiotic competence, however, are still not completely clear. A gas with a short half-life, nitric oxide (NO) can fulfill a regulatory role in this period. NO is synthesized from L-arginine by the enzyme Nitric Oxide Synthase (NOS), which occurs in a wide range of mammalian cells in multiple isoforms. Three most frequent neuronal (nnos), inducible (inos) and endothelial NOS (enos) were detected in growing and fully-grown porcine oocytes. The objective of this study was to ascertain the role of NO in the growth phase of pig oocytes and its influence on the acquisition of meiotic competence with the help of NOS inhibitors, NO donors and their combinations. We demonstrated that the selective competitive inos inhibitor aminoguanidine and also the non-selective NOS inhibitor L-NAME block meiotic maturation of oocytes with partial or even full meiotic competence at the very beginning. NOS inhibitors influence even competent oocytes in the first stage of meiotic metaphase. However, blockage is less effective than at the beginning of meiotic maturation. The number of parthenogenetically activated competent oocytes greatly increased in a pure medium after inhibitor reversion. A large quantity of NO externally added to the in vitro cultivation environment disrupts the viability of oocytes. The effectiveness of the inhibitor can be reversed in oocytes by an NO donor in a very low concentration. However, the donor is not capable of pushing the oocytes farther than beyond the first stage of meiotic metaphase. The experiments confirmed the connection of NO with the growth period and the acquisition of meiotic competence. However, it is evident from the experiments that NO is not the only stimulus controlling the growth period. Key words: oocytes, nitric oxide, pig, meiotic competence
5 Abstrakt Reprodukční biotechnologie jako je in-vitro oplození, transgeneze nebo klonování jedinců závisí na dostupnosti plně vyvinutých meioticky kompetentních oocytů, které jsou schopny dosáhnout druhé meiotické metafáze. Těchto oocytů je ovšem ve vaječníku samice omezené mnoţství. Slibným zdrojem oocytů pro biotechnologie by proto mohly být rostoucí oocyty s omezenou meiotickou kompetencí, kterých je ve vaječníku velké mnoţství. Mechanismus kontrolující zisk meiotické kompetence však dosud není plně znám. Při růstu a zisku meiotické kompetence oocytů by mohla hrát regulační roli malá plynná molekula s krátkým poločasem rozpadu molekula oxidu dusnatého (NO). NO je syntetizován z L-Argininu pomocí enzymu syntázy oxidu dusnatého (NOS), která se vyskytuje v různých tkáních savců v několika izoformách. V rostoucích a také v plně kompetentních oocytech prasete byly nalezeny 3 izoformy NOS: nervová (nnos) endoteliální (enos) a indukovatelná (inos) NOS. Cílem této práce bylo zjistit úlohu NO během růstové fáze oocytů a jeho vliv na získání meiotické kompetence pomocí inhibitorů NOS a NO donoru. V této práci jsme ukázali, ţe selektivní inos inhibitor aminoguanidin a neselektivní NOS inhibitor L-NAME blokují meiotické zrání oocytů s částečnou i s plnou meiotickou kompetencí. Inhibitor NOS ovlivnil také přechod mezi první a druhou meiotickou metafází. Nicméně jeho působení bylo mnohem slabší, neţ na počátku meiotického zrání. Účinek inhibitoru byl reverzibilní, po přemístění oocytů do čistého média došlo ke zvýšení počtu partenogeneticky aktivovaných oocytů. Vysoké koncentrace NO dodaného do kultivačního média sníţily ţivotaschopnost oocytů. Efekt inhibitoru byl zvrácen pouţitím nízkých koncentrací donoru, nicméně donor nebyl schopen posunout oocyty do stadia metafáze II. Tyto experimenty potvrdily zapojení NO do zisku meiotické kompetence, je však jasné, ţe NO není jediným faktorem kontrolující růstovou periodu oocytů. Klíčová slova: oocyty, oxid dusnatý, prase, meiotická kompetence
6 Obsah Úvod 1 1 Literární přehled Oogeneze Fáze mnoţení zárodečných buněk Růst oocytů Zisk meiotické kompetence Meiotické zrání Regulace meiotického zrání Oxid dusnatý Stavba NO- syntázy Izoformy NO- syntázy Aktivita a regulace NO-syntáz Vlastnosti oxidu dusnatého Inhibitory NO- syntáz a donory NO Vliv NO- syntáz a NO na reprodukci samic Lokalizace NO-syntáz ve vaječníku samic Úloha NO v meiotickém zrání savčích oocytů Mechanizmy působení NO během meiotického zrání oocytů 34 2 Cíl práce: 38 3 Materiál a metody 39 4 Experimentální schéma 41 5 Výsledky 43 6 Diskuze 58 7 Závěr 65 8 Seznam použitých zkratek 66 Seznam použité literatury 69 Příloha 83
7
8 Úvod V chovu hospodářských zvířat se v posledních letech vyuţívá ve zvýšené míře reprodukčních biotechnologií jako je inseminace, in vitro oplození, transfer embryí, klonování a tvorba transgenních jedinců. U prasete tyto techniky stále naráţejí na některé problémy. U tohoto druhu je obtíţné mraţení inseminačních dávek a embryí a také klonování má velmi nízkou účinnost. Zvýšení efektivity těchto technik je důleţité zejména proto, ţe prase je nejen významným hospodářským zvířetem, ale je často vyuţíváno také jako modelový druh pro humánní medicínu a xenotransplantace. Většina biotechnologických metod je limitována počtem zralých samičích buněk ve vaječníku - oocytů. Ve vaječníku se ovšem kromě omezeného mnoţství zralých oocytů nachází také velké mnoţství vyvíjejících se rostoucích oocytů. Cestou k získání vyššího počtu zralých oocytů mohou být techniky zvýšující vývojovou schopnost rostoucích oocytů, nebo metody růstu oocytů in vitro. Pro zlepšení těchto metod je nutné objasnit signální kaskády řídící vývoj samičích pohlavních buněk. Růst a zrání oocytů ovlivňuje řada molekul, mezi něţ pravděpodobně patří také malá plynná molekula oxidu dusnatého. Oxid dusnatý je důleţitou signální molekulou, která je syntetizovaná v různých ţivočišnýchtkáních. Za objev vasodilatačního účinku NO v kardiovaskulárním systému byla v roce 1998 udělana Nobelova cena za fyziologii. Tento plyn s krátkým poločasem rozpadu se účastní také různorodých procesů v reprodukci. Řada studií prokázala, ţe je syntetizován v reprodukční soustavě samic laboratorních hlodavců a významě se podílí na regulaci vývoje samičích pohlavních buněk, oocytů. 1
9 1 Literární přehled 1.1 Oogeneze Oogeneze savců je proces, během něhoţ se z primordiálních zárodečných buněk (PGC, Primordial Germ Cells) vyvíjí zralá vajíčka (oocyty), která jsou oplození schopná. Během svého vývoje musí zárodečná buňka zredukovat svůj genetický materiál, coţ se děje v průběhu redukčního dělení - meiózy. Meióza je zahájena v embryonálním období samice, je však záhy pozastavena a nastupuje první meiotický blok. Oocyt je uvolněn z tohoto bloku teprve v době puberty samice. Meióza je znovuzahájena, ale během ovulace je opět pozastavena v takzvaném druhém meiotickém bloku. Druhý meiotický blok je fyziologicky prolomen aktivací spermií a poté můţe být meióza dokončena. Oogeneze probíhá ve třech fázích: mnoţení zárodečných buněk, jejich růst a zrání. Do fáze růstu vstupují skupiny oocytů postupně a není dán přesný okamţik počátku jejich růstu. (Wassarman, 1988). Obr. 1: Průběh oogeneze savců. PGC - primordiální zárodečné buňky, GVBD - rozpad zárodečného váčku. Podle: Wassarman, (1988), Picton et al. (1998) 2
10 1.1.1 Fáze množení zárodečných buněk Primordiální zárodečné buňky Samičí pohlavní buňky - oocyty pocházejí z malého počtu kmenových buněk (PGC - primordiální zárodečné buňky). Tyto buňky se vytváří ve splanchnopleuře a přilehlém entodermu ţloutkového váčku z nediferenciovaných buněk epiblastu jiţ během gastrulace embrya. Poté primordiální zárodečné buňky aktivně migrují do zadní části embrya, kde se nakonec usídlí v místě vznikající pohlavní lišty na mezonefros. Během migrace do pohlavní lišty se primordiální zárodečné buňky několikanásobně dělí mitózou (Byskov, 1982, Freeman, 2003). U prasete se tyto buňky nachází v pohlavní liště jiţ 24. den embryonálního vývoje (Bielanska - Osuchowska, 2006). Na přeměně buněk epiblastu v PGC se podílí řada faktorů, například transformační růstový faktor TGF β (Transforming Growth Factor) a morfogenické faktory BMP-4, BMP-8b, BMP-2 (Bone Morphogenetic Proteins) (Ying a Zhao., 2001). Migraci PGC do zárodečné rýhy ovlivňuje především c-kit ligand, který je produkován somatickými buňkami v místech, kudy migrují PGC. Na počátku utváření celé gonády se podílí také steroidogenní faktor SF-1, který pravděpodobně reguluje aromatázu a hydroxylázu ve vaječníku (Logan et al., 2003). Oogonie a oocyty Primordiální zárodečné buňky usídlené v zárodečné liště se kolem 40. dne fetálního vývoje prasete zanořují do kůry a přeměňují se tak na oogonie (Picton et al., 1998). Oogonie jsou buňky kulovitého tvaru obsahující hyaloplazmu s volnými polyribozomy a mitochondriemi, které jsou koncentrované blízko jádra. Mitochondrie oogonií jsou kulovité s úzkými kristami, jádro obsahuje nukleoplazmu s krátkými segmenty heterochromatinu. Oogonie se stále mitoticky dělí. Ve vaječníku se začnou oogonie shlukovat do skupin ve kterých jsou propojeny pomocí intracelulárních cytoplazmatických můstků. Kolem oogonií se shlukují buňky pocházející z mezonefros. Jakmile jsou oogonie obklopeny těmito buňkami, zahajují replikaci DNA a vstupují do meiózy. Během vstupu do meiózy se přeruší cytoplazmatické můstky a oogonie se dále označují jako oocyty (Wassarman, 1988, Bielanska - Osuchowska, 2006). 3
11 Během počáteční fáze meiózy (profáze) oocyty prochází fázemi leptotene, zygotene, pachytene a diplotene, kdy je jejich meióza pozastavena (Picton et al., 1998). Ve stádiu pachytene probíhá crossing-over a rekombinace genů. Ve stádiu diplotene jsou na chromozómech viditelná chiasmata, která jsou výsledkem crossing overu. Kolem doby porodu jsou oocyty u většiny savců ve stádiu rozptýlené diplotene a dictyate. Krátce po porodu se většina oocytů nachází ve stádiu dictyate ve kterém je meióza oocytu zastavena po dobu růstu oocytu, dokud nedojde k jejímu opětovnému zahájení. Stimulem pro znovuzahájení zrání oocytu je vzestup hladiny hypofyzárních hormonů během puberty samice (Wasserman, 1988). Během přeměny oogonie v oocyt se postupně mění ultrastruktura organel v cytoplazmě. Mitochondrie se začínají prodluţovat a hladké endoplazmatické retikulum vytváří malé mnoţství dlouhých cisteren. Celkově se zvyšuje počet mitochondrií, endoplazmatického retikula, membránových struktur a lyzozómů. Během těchto prvních stádií meiózy mnoho oocytů atreticky zaniká (Wasserman, 1988, Bielanska - Osuchowska, 2006). K regulaci procesu utváření oocytů z oogonií je dostupno pouze omezené mnoţství informací. Vaječníky ovce, skotu, králíka a morčete produkují v tuto dobu malé mnoţství estrogenů. Jakmile oogonie vstoupí do meiózy, klesá mnoţství syntetizovaných estrogenů (Garrett a Guthire, 1999). C-Kit ligand, který se účastnil vývoje PGC, je v tomto období přítomen v somatických buňkách povrchu ovaria. C-Kit ligand se společně s růstovým faktorem IGF-I (Insulin-like Growth Factor) účastní na zahájení meiózy u myší (McNatty et al., 2000). Do regulace velikosti oocytu je zapojen také transkripční faktor AhR (Aryl-Hydrocarbon Receptor) (Logan et al., 2003). Podle dříve obecně uznávaného dogmatu se zárodečné buňky mnoţí pouze v období prenatálního vývoje samice. Toto dogma ovšem vyvrátili Johnson et al. (2004), kteří potvrdili, ţe nejen vaječníky mladých, ale i dospělých samic myší obsahují mitoticky aktivní zárodečné buňky slouţící jako zásoba za oocyty, které podlehly atrézii. Ve své další práci tento tým ukázal, ţe zdrojem zárodečných buněk myši můţe být extragonadální tkáň jako je kostní dřeň či krevní buňky (Johnson et al., 2005). Také některé další vědecké týmy prokázaly, ţe zdrojem zárodečných buněk můţe být kůţe u prasete (Dyce et al., 2006; Dyce a Li, 2006) a buňky slinivky břišní u potkana (Danner et al., 2007). Zou et al. (2009) rovněţ potvrdili Johnsonovu teorii, kdyţ vytvořili zárodečnou linii z buněk dospělých myší. 4
12 1.1.2 Růst oocytů Během fáze růstu oocyt syntetizuje důleţité molekuly pro svůj další vývoj a zvětšuje svou velikost. Kolem oocytu se postupně shlukují somatické buňky tvořící obal - folikul, který hraje významnou roli ve vývoji vlastního oocytu (Motlík a Fulka, 1986). Během celé fáze růstu se u myší zvyšuje syntéza RNA aţ 200x oproti somatickým buňkám. Oocyt s dokončeným růstem obsahuje 60 65% rrna, 20-25% trna, 10 15% mrna a jiţ ve 2/3 růstu obsahuje oocyt téměř konečné mnoţství RNA. Plně meioticky kompetentní oocyt myší obsahuje také asi 50x více proteinů neţ somatická buňka. Mezi proteiny které rostoucí oocyt syntetizuje, patří: glykoproteiny vrstvy zona pellucida (5 10%), laktát dehydrogenáza (2 5 %), tubulin (1,5 2%), ribosomální proteiny (1,5%), mitochondriální proteiny (1-2%), aktin (1%), histony (0,3%), kalmodulin (0,3%), dále kreatin kináza důleţitá pro udrţování ATP a glukóza 6 fosfát dehydrogenáza potřebná pro produkci NADPH (Wassarman, 1988). Utváření primordiálního folikulu Po zastavení meiózy je oocyt obklopen jednou vrstvou somatických buněk, které se nyní nazývají pregranulózní buňky (Picton et al., 1998). Tyto buňky mohou mít dvojí původ. Vznikají buď z epitelových buněk povrchu vaječníku nebo z buněk pocházejících z mezonefros (Sawyer et al., 2002). Oocyt je spojen s okolními buňkami pomocí desmozómů a mezibuněčných spojů gap junctions. Spojení s ostatními buňkami je velmi důleţité pro transport malých molekul (< 1 kda). Endoplazmatické retikulum je jiţ pokryto na několika místech ribozomy a je spojeno s jadernou membránou. Mitochondrie mohou mít protáhlý i kulovitý tvar a jsou v kontaktu s endoplazmatickým retikulem. Blízko jádra jsou přítomná lipidová granula a mnoţství membránových váčků. Stále se zvětšuje velikost oocytu a zvyšuje se počet organel. V tomto stádiu byly v jádru sledovány 1-2 jadérka. Chromozómy se nachází ve stádiu diplotene, coţ umoţňuje transkripci RNA a translaci důleţitých proteinů (Wasserman, 1988, Bielanska - Osuchowska, 2006). Z původního počtu zárodečných buněk do této fáze u prasat dospěje pouze asi 40%. Při narození samice prasete je vyvinuto pouze oocytů (Guthrie a Garrett, 2001). Zahájení tvorby primordiálního folikulu je u myší řízeno faktorem Fig-α. (Soyal et al., 2000). 5
13 Utváření primárního folikulu Později se ploché pregranulózní buňky, které obklopují oocyt, mění v buňky kubického tvaru. Jádro oocytu je umístěno centrálně a blízko jaderné membrány můţeme pozorovat krátké kompaktní bivalenty chromozómů. Blízko jaderné membrány se nachází také denzní granula. Okolo jádra je jiţ jen málo endoplazmatických retikul s průměrem 0,3 μm, zatímco počet mitochondrií se stále zvyšuje (Bielanska - Osuchowska, 2006). Vývoj primárního folikulu je řízen rovnováhou mezi inhibičními a stimulačními faktory. V jadérku dochází k expresi proteinů retinoblastu a onkogenu myc, které stimulují produkci inhibičních faktorů bránících proliferaci granulózních buněk (Picton et al., 1998). Dalším faktorem se stejnou funkcí je Antimülerův hormon AMH z rodiny růstových faktorů (Durlinger et al., 2002). Do regulace vývoje primárního folikulu jsou zapojeny i další faktory z této rodiny: BMP (Bone Morfologic Factor) a růstový diferenciační faktor GDF-9 (Growth Differentiation Factor) (Van der Hurk et al., 2000). U skotu (Hulshof et al., 1997) a myší (Zhao et al., 2001) byl nalezen v oocytu a granulózních buňkách další faktor activin A, který pravděpodobně kontroluje zahájení vývoje primárního folikulu. U skotu (Wandji et al., 1996), kozy (Silva et al., 2004) a myši (Eppig a O Brien, 1996) byl nalezen epidermální růstový faktor (EGF), který podporuje utváření primárního folikulu. Pro růst raného folikulu jsou nezbytné i faktory WT-1 (Wilms Tumor Protein) a SF-1 (Steroidogenetic Factor) (Logan et al., 2003). SF-1 faktor je lokalizován v granulózních buňkách a pravděpodobně stimuluje expresi antimülerova hormonu AMH (Sadovski a Dorn, 2000). Vývoj primárního folikulu není přímo závislý na folikulostimulačním hormonu FSH (Meduri et al., 2002). Tvorba folikulu obklopeného více vrstvami Jakmile se kolem oocytu vytvoří dvě a více vrstev granulózních buněk, je utvořen sekundární čili preantrální folikul. V tomto období oocyt prochází intenzivním růstem, granulózní buňky proliferují a vrstvu granulózních buněk začínají obklopovat buňky thékální vrstvy (tvořící vrstvy theca foliculi externa a interna). Tyto folikuly dosahují u prasat velikosti 300 μm a oocyt prasete dosahuje 90 μm (Van den Hurk et al., 1997). Během růstu získávají oocyty postupně meiotickou kompetenci, coţ je schopnost znovuzahájit a plně dokončit meiózu. Probíhá syntéza nových proteinů, intenzivní mnoţení organel a přeorganizování organel jiţ vzniklých. Během této fáze se zvyšuje 6
14 počet ribozómů, mitochondrií a jiných organel. Akumulují se membránové váčky, granula glykogenu, proteinů, lipidů a multivesikulární tělíska (Bielanska - Osuchowska, 2006). Jednou z důleţitých změn během růstové fáze je vytvoření glykoproteinové vrstvy na povrchu oocytu, která se nazývá zona pellucida (ZP). Jiţ v počátcích růstu můţeme pozorovat základy vrstvy zona pellucida jako oblasti jemných filament mezi oocytem a kumulárními buňkami. Tato membrána se utváří jako ochrana oocytu ze tří druhů glykoproteinů ZP1, ZP2 a ZP3. Glykoprotein ZP3 hraje později roli jako primární vazebný receptor pro spermii a vazbou spermie na tento receptor je spuštěna akrozomální reakce. ZP2 funguje jako sekundární receptor spermie a ZP1 funguje jako propojovací článek ZP2 a ZP3 (Picton et al., 1998). Pro expresi těchto glykoprotinů je potřebný faktor FIG α. (Soyal et al., 2000). Během dalšího růstu folikulu začínají mezi vrstvami theca folliculi prorůstat krevní kapiláry, kterými jsou do folikulu transportovány endokrinní faktory. Mnoho experimentů ukázalo, ţe pro vývoj tohoto stádia oocytu jsou důleţité gonadotropiny. Receptory pro luteinizační hormon (LH) byly nalezeny u raných folikulů potkanů. Inzulin a luteinizační hormon přiváděný do kapilár théky má vliv na utváření androgenů v théce. Ty se poté dostávají do granulózních buněk, kde navozují vznik receptorů pro folikulostimulační hormon (FSH) (van den Hurk et al., 2000). Dalším endokrinním faktorem ovlivňujícím vývoj sekundárního folikulu je gonadotropní hormon (GH). Nervový růstový faktor NGF (Nerve Growth factor) a VIP (Vasoactive Intestinal Polypeptide) také stimulují vývoj raného folikulu. Sekundární folikul neprodukuje estrogeny, protoţe mu chybí enzym aromatáza, která přeměňuje androgeny na estrogeny, ale vývoj folikulu ovlivňují estrogeny z jiných zdrojů (Zhao et al., 2000). Na růstu sekundárního folikulu se podílí také mnoho jiných faktorů (Antimülerův hormon, růstový diferenciační faktor, Kit ligand). Antimülerův hormon produkovaný granulózními buňkami sekundárního folikulu modifikuje růst pomocí sniţování citlivosti k folikulostimulačnímu hormonu (Durlinger et al., 2002). Růstový faktor GDF-9 produkovaný taktéţ granulózními buňkami kontroluje biologickou aktivitu aktivinu a inhibinu (Dong et al., 1996). Oba dva faktory růstový faktor GDF-9 a protein BMP-15 kontrolují utváření kit ligandu KL v granulózních buňkách, růstový faktor GDF-9 působí jako inhibitor a protein BMP-15 jako aktivátor exprese kit ligandu KL (Otsuka a Shimasaki, 2002). 7
15 Mezi další faktory zasahující do vývoje sekundárního folikulu u domestikovaných zvířat patří růstové faktory epidermální růstový faktor EGF (Epidermal Growth Factor), transformační růstový faktor TGF (Transforming Growth Factor), IGF (Insulin Growth Factor), FGF-2, FGF-7 (Fibroblast Growth Factors) a aktivin. Při jejich nedostatku podléhá folikul apoptóze (van den Hurk et al., 2000). U prasete byla objevena EGF mrna i EGF peptid a také jejich receptory. mrna růstového faktoru TGFβ je exprimována u prasete v thékálních buňkách. Tento faktor inhibuje růst folikulu neboť je inhibitorem mitózy granulózních buněk u prasat (Singh et al., 1995). V případě IGF-I a aktivinu A byla popsán jejich stimulační efekt na proliferaci granulózních buněk. IGF-I zvyšuje pravděpodobnost přeţití thékálních buněk a aktivin-a iniciuje utváření antra. IGF-I je schopný stimulovat syntézu receptorů pro FSH. FGF-2 je lokalizován v thékálních buňkách člověka a granulózních buňkách skotu. U křečka má mitogenní efekt, ale nemá vliv na steroidogenezi. Je také moţným faktorem regulujícím vývoj krevních kapilár během folikulogeneze (Garrett a Guthire, 1999). Na vývoji sekundárního folikulu se podílí i některé faktory, které byly zapojeny i do dřívějšího vývoje folikulu. Patří mezi ně například SF-1 a WT-1. SF-1 je syntetizován v granulózních a thékálních buňkách a reguluje utváření AMH (Logan et al., 2003). WT-1 je exprimován hlavně v granulózních buňkách (Sadovski a Dorn, 2000). Utváření antrálního folikulu a výběr dominantních folikulů Vznik Graafova (antrálního) folikulu je závislý na působení hormonů a začíná při dosaţení puberty. Jak bylo popsáno výše, mezi thékálními buňkami postupně začnou prorůstat krevní kapiláry, které pronikají aţ do theca interna těsně u bazální membrány. Na buňkách theca interna se formují receptory pro LH a na granulózních buňkách se formují receptory pro FSH a estrogeny. V období hormonálního řízení jsou pod vlivm LH produkovány buňkami vrstvy theca interna androgeny. Androgeny difundují z theca interna do granulózních buněk. Pod vlivem FSH přeměňují granulózní buňky androgeny na estrogeny. Produkované estrogeny vyvolávají růst a dělení granulózních buněk a spolu s FSH stimulují granulózní buňky k tvorbě sekretů, které způsobí separaci granulózních buněk a vytváří se dutina nazývaná antrum (Wasserman, 1988). V antrálních folikulech můţeme rozdělit kumulární buňky na dvě skupiny: 1) Kumulární buňky, které obklopují oocyt a jsou s ním spojeny pomocí mezibuněčných spojů gap-junctions, tvoří vrstvu označovanou jako corona radiata. 2) Kumulární buňky 8
16 lemující folikulární stěnu se nazývají murální. Během zvětšování dutiny se oocyt dostává do excentrické pozice nachází se nyní na tzv. vejconosném hrbolku. Folikul se vlivem produkce folikulární tekutiny vyklenuje nad povrch vaječníku a vzniká tak velký Graafův folikul schopný ovulace, který představuje poslední stádium vývoje folikulu (Wasserman, 1988). U prasete se vyvíjí v cyklu více neţ 50 folikulů. U prepubertálních prasniček se na vaječníku nachází 70% primordiálních folikulů, 3% primarních, 30% sekundárních a velmi malé mnoţství terciálních folikulů a ţádná ţlutá tělíska. Během poklesu hladiny FSH nastává u prasete vývoj několika dominantních folikulů. Tyto velké folikuly produkují velká mnoţství estradiolu a inhibinu a jsou schopny ovulace. Ostatní folikuly většinou podléhají atrézii. Výběr folikulů určených k ovulaci je u prepubertálních prasniček závislý na hormonálním řízení. Během 2 týdnů před pubertou se zvyšuje hladina pulzů luteinizačního hormonu a estradiolu, zatímco hladina kortikosteroidů klesá na polovinu. U cyklujících prasnic má na výběr folikulů vliv především ţluté tělísko. Během estrálního cyklu se mění poměr atretických a zdravých oocytů. Například během dne estrálního cyklu prasete ja aţ 77 % velkých folikulů jiţ atretických. Zdá se, ţe sníţení genové transkripce a exprese aromatázy s následným sníţením hladiny estrogenu ve folikulu mohou být prvním krokem vedoucím k atrezii folikulů (Knox, 2005) Zisk meiotické kompetence Tímto pojmem označujeme schopnost oocytu znovuzahájit a dokončit meiotické zrání. Meiotická kompetence oocytu závisí na velikosti oocytu a jeho folikulu. Během fáze růstu dochází v oocytu k intenzivní transkripci, translaci a syntéze nových organel, které tvoří zásobu pro následující meiotické zrání a preimplantační vývoj embrya a tyto změny souvisí se ziskem meiotické kompetence. Oocyty na začátku svého růstu nejsou schopny zahájit zrání, jsou zcela meioticky nekompetentní. Později, v dalších fázích růstu jsou sice schopny zrání zahájit, nikoliv však jej zcela dokončit (jsou částečně meioticky kompetentní). Teprve oocyty s ukončeným růstem mají plně vyvinutou kompetenci a jsou schopny dosáhnout stádia metafáze II (Motlík et al, 1984). Známkou nabytí meiotické kompetence je u velké části savců vytvoření antra ve folikulu a kompetence oocytu je dána také jeho velikostí. Oocyty prasat o velikosti oocytu menším neţ 100 m z folikulů o velikosti 0,4 0,8 mm mají omezenou nebo nemají ţádnou meiotickou kompetenci. Oocyty prasete o velikosti 110 m z folikulů o průměru 1 1,5 mm po vyjmutí z folikulu vstupují do meiózy, procházejí rozpadem zárodečného váčku a většina z nich dosáhne 9
17 stádia metafáze I, kde je jejich vývoj pozastaven - mají tudíţ částečnou meiotickou kompetenci. Prasečí oocyty nabývají meiotickou kompetenci okolo 14 dní po utvoření antra ve folikulech větších neţ 3 mm (Motlík et al. 1984, Morbeck et al. 1992, Hunter, 2000). Plně dorostlé prasečí oocyty o velikosti 120 m jsou jiţ zcela meioticky kompetentní a po 48 hodinové kultivaci v in vitro podmínkách dosahují stádia metafáze II (Motlík et al., 1984, Petr et al., 1994). Dosaţení plné meiotické kompetence je na biochemické úrovni charakterizováno hromaděním neaktivního komplexu p34cdc2/cyklin B označovaného jako pre-mpf. Po vytvoření folikulárního antra se jiţ pre-mpf nehromadí, vyvíjí se schopnost tento komplex aktivovat (Kanayama et al., 2002). Podrobnější popis regulace meiotického zrání je popsán v samostatné kapitole této práce. Jakmile oocyt dosáhne své plné velikosti a meiotické kompetence, čeká na signál ve formě náhlého zvýšení hladiny luteinizačního hormonu (LH-peak). Dochází ke znovuzahájení meiózy a ovulaci (Wasserman, 1988). Vaječník savců obsahuje velké mnoţství oocytů bez nebo s částečnou meoitickou kompetencí. Jen malý počet oocytů dosáhne své finální velikosti a je ovulováno. Metody kultivace rostoucích oocytů (in vitro růst) jsou velmi důleţité pro studium regulace růstu oocytů. Oocyty dorostlé in vitro by mohly být nadějným zdrojem oocytů vyuţitelných pro reprodukční biotechnologie nebo výzkum v oblasti humánní reprodukce. Doposud bylo vyvinuto několik systémů pro in vitro růst oocytů. Tyto metody jsou zaloţeny především na kultivaci buď celých orgánů (Eppig a O Brien 1996), kultivací folikulů (Hirao et al., 1994), nebo kultivaci oocytů na gelu (Huanmin a Yong, 2000) a membránách (Shen et al. 2007). Menší pozornost byla v minulosti věnována kultivaci samostatných komplexů oocytů a kumulárních buněk. Tímto způsobem se jiţ podařilo zvýšit meiotickou kompetenci rostoucích oocytů prasete. Oocyty s částečnou meiotickou kompetencí kultivované s kalcium ionoforem dosáhly stádia MII a posléze byly partenogeneticky aktivovány, přičemţ více neţ polovina oocytů byla aktivována (Sedmíková et al., 2003). Meiotická kompetence rostoucích prasečích oocytů byla zvýšena také kultivací oocytů s inhibitorem kalcium dependentní ATPázy (Petr et al., 1999) a s inhibitorem histon deacetylázy (Petr et al., 2009). Studium dalších molekul zapojených do růstové periody by mohlo také pomoci zvýšit meiotickou kompetenci rostoucích oocytů. 10
18 1.1.4 Meiotické zrání Meiotické zrání je proces, při němţ oocyt prochází ze stádia diplotene I do stádia druhé meiotické metafáze (MII) (Wassarman,1988). V rostoucích a dominantních folikulech, zůstávají oocyty zastaveny ve stádiu diplotene první meiotické profáze, která je srovnatelná s G2 fází buněčného cyklu somatických buněk. Ve fyziologických podmínkách (in vivo) začíná fáze zrání během puberty samice (u prasat asi 48 hodin před ovulací). Fyziologickým stimulem pro znovuzahájení meiózy je zvýšená pulzační hladina luteinizačního hormonu (LH). Při znovuzahájení meiózy hraje nezbytnou roli komunikace oocytu s okolními somatickými buňkami. Jelikoţ oocyt sám o sobě nemá receptory pro gonadotropiny, hormonální signál působí přes granulózní buňky které mají na svém povrchu tyto receptory (Lawrence et al., 1980). Kontakt mezi oocytem a okolními buňkami je zajišťován mezibuněčnými spoji gap junctions. Přes tyto spoje mohou procházet malé signální molekuly. Krátce po zvýšení hladiny LH nastává narušení spojů mezi oocytem a kumulárními buňkami, které jsou dále drţeny poblíţ pomocí kyseliny hyaluronové. Tento jev se nazývá expanze kumulu (Wassarman,1988). Po prasknutí folikulu dochází k ovulaci. Meiotické zrání probíhá právě v době mezi LH vlnou a ovulací (Van der Hurk et al., 2000). U většiny savců jsou oocyty ovulovány ve stádiu metafáze II. Během sestupu vejcovodem je meióza v tomto stádiu opět pozastavena, jedná se o takzvaný druhý meiotický blok. Pokračování meiózy a její dokončení je moţné jen po tzv. aktivačním stimulu. Ten za normálních okolností zajistí oocytu průnik spermie při oplození, in vitro můţe být vyvolán partenogenetickou aktivací, například ionty vápníku. Pro meiotické zrání je důleţité nejen přeskupení chromozómů (jaderné zrání), ale také změny v cytoplazmě (cytoplazmatické zrání) (Hunter, 2000). Jaderné zrání Při kultivaci oocytů in vitro trvá jaderné zrání u prasete hodin a oocyt během něj prochází dvěma meiotickými děleními (M-fáze), mezi nimiţ se nereplikuje DNA (S fáze). Oocyt poté zůstává zastaven ve druhé meiotické metafázi (MII). Před znovuzahájením meiózy se jádro oocytu nachází ve stádiu zárodečného váčku (GV - Germinal Vesicle). Toto stádium je charakteristické kompaktní jadernou membránou a jadérkem obklopeným rozptýleným chromatinem. Chromatin v tomto stádiu utváří kruh nebo útvar podobný koňské podkově (Motlík a Fulka, 1976, Wassarman, 11
19 1988). U prasete ke znovuzahájení meiózy dochází hodin od počátku kultivace oocytů in vitro (Motlík a Fulka., 1976, Motlík a Fulka, 1986). Na počátku znovuzahájení meiózy I můţeme sledovat rozpad jaderné membrány (GVBD, Germinal Vesicle Breakdown). Proces GVBD začne nepatrným vlněním jaderné membrány, při kterém mizí jaderné póry. Během GVBD postupně mizí také jadérko. Na konci GVBD je jiţ jaderná membrána zcela rozptýlena (Wassarman, 1988). Během GVBD můţeme u prasete charakterizovat 4 stádia GV1 GV4 Ve stádiu GV1 můţeme pozorovat chromozomy uspořádané do tvaru koňské podkovy. Dále se ve stádiu GV 2 objevují na jaderné membráně shluky chromatinu. Ve stádiu GVIII je chromatin jiţ zkondenzovaný a v mikroskopu ho můţeme pozorovat jako síť filament rozprostřených po jádře. Ve stádiu GV4 se jiţ nedá rozeznat jadérko a jaderná membrána je rozptýlena. (Lucas et al., 2002). Na konci GVBD je kondenzovaný chromatin seskupen do shluku, a toto stádium se nazývá diakineze. Stádium diakineze trvá u prasete necelou hodinu (Wehrend a Mainecke, 2001). Stádium GVBD je dokončeno u prasete asi za 24 hodin. Oocyt poté prochází stádiem metafáze I, pro kterou je charakteristické utvoření bivalentů, a která u prasete probíhá mezi hodinou (Wehrend a Mainecke, 2001) od počátku kultivace in vitro. Chromozómy jsou přesunuty do ekvatoriální roviny a jsou spojeny metafázním vřeténkem (Kubišta, 1998). Poté oocyt vstupuje do stádia anafáze I, charakteristického prodluţováním a oddělením párových chromozómů k pólům. U prasete tato fáze in vitro probíhá mezi hodinou. Mezi hodinou kultivace in vitro poté oocyt vstoupí do telofáze I, kdy je dokončeno oddělení chromozómů a první meióza (Kanagawa et al., 1991). Mezi meiózou I a meiózou II probíhá jen krátká interfáze nazývaná interkineze. Během této periody neprobíhá syntéza DNA (Kishimoto, 2003). Po velmi krátké interfázi následuje profáze II, která je na rozdíl od profáze I rychlá a není tak komplikovaná. Obecně je profáze II podobná jako profáze u mitotického dělení. Posledním stádiem meiotického zrání je stádium druhé meiotické metafáze (MII). Toto stádium nastává u prasete mezi hodinou kultivace in vitro (Kanagawa et el., 1991) a vyznačuje se vyloučením poloviny genetické informace v podobě prvního pólového tělíska. V prvním pólovém tělísku je však zřídka nalezeno vřeténko a chromozómy pólového tělíska v pozdní telofázi degenerují (Wassarman, 1988). V metafázi II je meiotické dělení podruhé zastaveno (Kubišta, 1998). 12
20 Obr. 2: Znázornění stádií meiotického jaderného zrání podle Motlík a Fulka (1976) GV1-GV4 rozpad zárodečného váčku, DI- diakineze, MI- metafáze I, Ana- I anafáze I, Telo- telofáze I, MII- metafáze II. Cytoplazmatické zrání Pro následující oplození a další embryonální vývoj je nutné, aby také cytoplasma oocytu dostatečně vyzrála. Vývoj kvalitního zralého oocytu je závislý na redistribuci organel, cytoskeletu, transkripční aktivitě oocytu a obsahu takzvaných cytoplazmatických faktorů. Kumulární buňky oocytu produkují některé molekuly, které kontrolují nejen jaderné, ale také cytoplazmatické zrání (Cha a Chian, 1998). Mezi dobrě zjistitelné biologické markery cytoplazmatického zrání patří glutathionin a ATP, jejichţ koncentrace během meiotického zrání stoupá (Luciano et al., 2005). Dalšími markery cytoplasmatického zrání jsou enzymy kataláza, superoxid dismutáza a glutathion peroxidáza (Cetica et al., 2001) Z organel jsou důleţité zejména redistribuce mitochondrií a cytoskeletu (Stojkovic et al., 1999). Mitochondrie se v době GVBD seskupují kolem jádra, poté se při vydělení prvního pólového tělíska dočasně rozptýlí a následně se opět seskupí v druhé metafázi (MII) (Van Blerkom a Bell, 1986). Kolem zárodečného váčku (GV) se vytváří kruh Golgiho aparátu. Golgiho aparát je lokalizován také v blízkosti výběţků kumulárních buněk a poblíţ něho jsou lokalizována kortikální granula. Kortikální granula jsou specifické organely oocytu odvozené od Golgiho aparátu obsahující glykosaminoglykany, 13
21 proteiny a enzymy. Během zrání, asi kolem 18. hodiny kultivace, migrují k plazmatické membráně. Exocytóza kortikálních granul zabraňuje polyspermii při oplození (Moricard a Moricard, 1975). Redistribuce organel je důleţitá zejména pro proteosyntézu v oocytu. Po té co je znovuzahájena meióza neprobíhá jiţ téměř ţádná exprese genů. Nasyntetizovaná mrna je chráněna před degradací a velké mnoţství RNA je během zrání uskladněno jako deadenylované transkripty spojené s proteiny (Moor a Dai, 2001). Do aktivace takto inaktivní RNA jsou zapojeny různé mechanizmy jako fosforylace translačních faktorů, ribozómové podjednotky, defosforylace polymerázy a především polyadenylace mrna (Colgan et al., 1996) Regulace meiotického zrání Podobně jako je řízen buněčný cyklus somatických buněk, tak je také meióza řízena mnoha faktory. Meiózu savců řídí různé molekuly jako cykliny, na cyklinech závislé kinázy, fosfatázy a signální molekuly, které jsou většinou propojeny ve sloţité signální kaskády. Znovuzahájení meiózy a výstup z prvního meiotického bloku je závislý především na sníţení hladiny cyklického adenosin monofosfátu camp (Cho et al., 1974). Cyklické nukleotidy camp a cgmp Pro znovuzahájení meiózy je nutné, aby se sníţila hladina cyklického adenosin monofosfátu (camp) v oocytu. Cyklický AMP je syntetizován jak oocytem, tak i folikulárními buňkami a do oocytu se dostává především pomocí mezibuněčných spojů tzv. gap junctions (Cho et al., 1974). Po uvolnění oocytu z prostředí folikulu dojde k poklesu camp, který je produkován folikulárními buňkami, můţe tedy dojít k znovuzahájení meiózy. Cyklický AMP je syntetizován enzymem adenylát cyklázou (AC), která je aktivována G-proteiny. K poklesu hladiny camp můţe dojít například po vyřazení jednoho ze tří podjednotek tzv. trimerních G-proteinů, Gs proteinu (Mehlmann et al., 2002). Koncentraci camp můţe zvyšovat cyklický guanosinmonofosfát (cgmp), čímţ se inhibuje spontánní zrání (Ratner., 1976). cgmp vzniká pomocí enzymu rozpustné guanylát cyklázy (sgc), která katalyzuje přeměnu guanosin trifosfátu (GTP) na cgmp. cgmp můţe mít v buňkách různé cíle, jako jsou iontové kanály, proteinkináza G, nebo fosfodiesterázy. Koncentrace cgmp klesá průběţně se zráním oocytů a tím jim dovolí 14
22 zahájit meiózu. Bylo zjištěno, ţe cgmp udrţuje blok meiotického zastavení dvěma způsoby: 1) Aktivuje cgmp-dependentní kinázu v oocytu 2) Inhibuje oocytovou camp fosfodiesterázu v oocytu a tím udrţuje vysokou hladinu camp (Ratner et al., 1976, Hubbard et al., 1982, Tornell et al., 1990, Vaccari et al., 2009). Několik prací ovšem uvádí, ţe pro znovuzahájení meiózy je nutné naopak zvýšení hladiny cgmp (Tornell et al., 1984, Hubbard a Price., 1988). Pro znovuzahájení meiózy jsou nutné také fosfodiesterázy (PDE). Tyto enzymy hydrolyzují camp na AMP, čímţ klesá hladina camp a můţe dojít k zahájení meiózy (Bornslaeger et al., 1986). V oocytech savců je hlavní fosfodiesterázou PDE-3A, v granulózních buňkách je to pak PDE-4B (Masciarelli et al., 2004, Vaccari et al., 2009). V oocytech můţe být cílovou molekulou pro camp proteinkináza A (PKA), jejíţ aktivita je nutná k udrţení bloku meiózy. camp se naváţe na regulační podjednotku komplexu neaktivní proteinkinázy A a tím enzym aktivuje. Aktivní proteinkináza A poté fosforyluje proteiny nutné k udrţení prvního meiotického bloku (Bornslaeger et al., 1986) (obr. 3). P ATP proteiny neaktivní C C ATP aktivní adenylyl cykláza C GTP camp R 4 camp R C R R proteinkináza A neaktivní komplex fosfodiesteráza camp-pde camp camp camp camp AMP plasmatická membrána Obr. 3.: Model působení camp, podle Bornslaeger et al., (1986) Vápníkové ionty (Ca 2+ ) Vápníkové ionty jsou významné intracelulární signální molekuly. V prasečích oocytech bylo nejvíce iontů vápníků nalezeno v karyoplazmě, vakuolách, mitochondriích a na povrchu lipidových granul (Petr et al., 2001). Vápník se do cytosolu dostává především přes 2 signální kaskády dráhu vyuţívající inositol 1,4,5 trifosfátové (IP3) receptory (IP3R) a dráhu vyuţívající ryanodinové receptory - RyR (Petr et al., 2002). Vápníkové ionty jsou transportovány z cytoplazmy do lumenu zásobních organel pomocí ATPázových SERCA pump (Pozzan et al., 1994). Vápník byl nalezen jiţ v nezralých oocytech, jeho receptory jsou však méně citlivé ke stimulaci (Shiraishi et al., 1995). Vápenaté ionty hrají roli především v časné fázi výstupu z bloku v profázi I (Wassarmann, 1988). Rozinek et al. (2003) potvrdili význam vápníku pro znovuzahájení meiotického 15
23 zrání také pro oocyty prasete. Stimulace LH vlnou způsobí aktivaci fosfolipázy C (PLC) a tím krátký počáteční vzrůst hladiny vápníkových iontů, coţ vede k produkci inositoltrifosfátu. Podle Homova modelu modifikují vápníkové ionty například cykliny které jsou nezbytně nutné pro buněčný cyklus (Homa, 1995). Jedním z cílových proteinů vápníkových iontů, je kalmodulin dependentní protein kináza (CaMKII), jejíţ aktivita závisí na frekvenci oscilaci vápníkových iontů. Tato kináza u ţáby rodu Xenopus fosforyluje metaphase promoting factor - MPF (Lorca et al., 1993). Cyklin dependentní kinázy Buněčný cyklus jak somatických, tak i pohlavních buněk je řízen především cyklin dependentními kinázami (CDK) (Maller a Krebs, 1980, Wu a Gerhart 1980) Tyto kinázy katalyzují přenos fosfátové skupiny z adenozintrifosfátu (ATP) na postranní řetězec aminokyseliny v cílovém proteinu. Cyklin dependentní kinázy jsou v buňce přítomny po celý buněčný cyklus a jejich aktivita tedy musí být regulována jejich regulační podjednotkou cyklinem (Alberts et al., 1998). Cyklin reguluje rychlost reakce i substrátovou specifitu odpovídající kinázy (Hagting et al., 1999). Řízení meiózy je zaloţeno především na změnách koncentrace cyklinů, která je zajišťována degradací ubikvitin dependentní proteolýzou. Molekuly cyklinů obsahují na svém N-konci specifickou sekvenci tzv. destrukční box, na který jsou v případě nutnosti navázány molekuly ubikvitinu, které molekulu označí k následné degradaci v proteozómech. Roli v rozeznání cyklinu hraje ubikvitin ligáza APC (Anaphase-Promoting Complex) (Hagting et al., 1999). Metaphase promoting factor (MPF) Důleţitou molekulou regulující meiózu je MPF (Metaphase Promoting Factor). MPF je komplex skládající se ze dvou odlišných podjednotek: katalytické cyklin dependentní kinázy (CDK1, p34 cdc2) a regulační podjednotky - cyklinu B. MPF se účastní zahájení a řízení meiózy savců. Cílovými proteiny pro MPF jsou velké proteinové komplexy důleţité pro svinutí DNA během meiózy a proteiny jaderné membrány, které jsou-li fosforylovány, můţe dojít k rozpadu jaderné membrány. Katalytická podjednotka p34cdc2 (CDK1) například fosforyluje laminy jaderné membrány, čímţ navodí rozpad jaderné membrány (Jones, 2004). 16
24 Regulace MPF probíhá zejména pomocí degradace cyklinu B. Degradace cyklinu B umoţní, aby fosfatázy defosforylovaly své substráty, a tím dojde k dekondenzaci chromatinu, obnovení jaderné membrány a vezikulárních organel. Aktivita MPF je řízena také její fosforylací a defosforylací pomocí kináz. MPF je regulována pomocí Wee1/Myt1 kináz, které fosforylují p34 cdc2 (CDK1) a tím ji inhibují na Thr 14 a Tyr 15 a cdc25 fosfatázou, která defosforyluje p34 cdc2 (CDK1) na stejném místě. Pro aktivaci CDK v MPF je tudíţ nutná zvýšená aktivita cdc25 fosfatázy a sníţená aktivita Wee/Myt kináz (Jones, 2004). V nezralém meioticky nekompetentním oocytu je mnoţství podjednotek p34cdc2 (CDK1) a cyklinu B podobné jako u oocytu s ukončenou růstovou periodou. Rostoucí oocyt však obsahuje fosforylovanou p34 cdc2 (CDK1), která není schopna aktivovat MPF, dokud není růst dokončen (Kishimoto, 2003). Nutnou podmínkou pro znovuzahájení meiózy je zvýšení koncentrace p34 cdc2 (CDK1) a zejména syntéza cyklinu B. Aktivace p34 cdc2 (CDK1) probíhá defosforylací pomocí cdc25 fosfatázy, přičemţ cdc25 fosfatáza je regulována kinázou Plk (polo-like kinase). Aktivace MPF vyţaduje aktivní protein syntézu a fosforylaci některých proteinů, která předchází GVBD (Stojkovic et al., 1999). Aktivita MPF narůstá krátce před GVBD a kondenzací chromozómů, zatímco sníţení její aktivity umoţňuje přechod z metafáze do anafáze (Stojkovic et al., 1999). U oocytů zastavených v metafázi II se aktivita MPF zvyšuje a dosahuje nejvyšší hladiny. Inaktivace MPF a degradace cyklinu B souvisí s přechodem oocytu z metafáze II do anafáze II a telofáze II (Sun a Nagai, 2003). Průběh aktivity MPF během meiotického zrání znázorňuje obrázek. 5. Mitogeny-aktivované protein kinázy (MAPK) Tato skupina protein kináz hraje klíčovou roli v regulaci meiózy pomocí fosforylace proteinů na serinových nebo threoninových zbytcích. V savčích oocytech byly nalezeny dvě formy těchto extracelulárně regulovaných kináz: ERK1 (p44) a ERK2 (p42). Tyto dvě formy jsou v literatuře běţně popisovány jako klasické MAPK. Klasická MAPK (dále jen MAPK) je zapojena do tvorby a dynamiky mikrotubulů. Bylo zjištěno, ţe MAP kináza přenáší signál pro zahájení meiózy z cytoplazmy do jádra (Stojkovic et al., 1999). MAP kináza můţe fosforylovat různé cíle, které jsou často podobné s cíli MPF. MAP kináza také můţe fosforylovat inhibiční kinázy, které fosforylují části MPF (Inoue et al., 1995). 17
25 MAP kináza například fosforyluje proteiny které udrţují chromatin v kondenzovaném stavu, coţ je důleţité v době přechodu z první metafáze do druhé, kdy aktivita MAP kinázy na rozdíl od MPF neklesá a je tak zabráněno přechodu oocytu do interfáze (Dekel et al., 1995). MAP kináza také fosforyluje proteiny jaderné laminy a tím zabraňuje tvorbě jaderné membrány (Murray a Hunt, 1993). U myší bylo zjištěno, ţe jiţ na počátku růstové periody oocytu jsou přítomny dvě MAPK: ERK1 (p44) a ERK2 (p42). Během nabývání meiotické kompetence dochází v částečně kompetentním oocytu k fosforylaci těchto MAPK (Harrouk a Clarke, 1995). U prasat bylo také popsáno, ţe zralé oocyty s ukončeným růstem, získané z folikulů o velikosti mm jsou schopny aktivovat cdc2 a MAPK, kdeţto rostoucí oocyty získané z folikulů mm nebyly schopny aktivovat cdc2 kinázu a kaskádu MAPK1 ačkoliv mají nasyntetizovaný cyklin B1. Oocyty z folikulů o velikosti mm jiţ některé dokáţí aktivovat p34cdc2 (CDK1), ale nejsou schopnyplně aktivovat kaskádu vedoucí k aktivaci MEK. Během závěrečné fáze růstu oocyty získají schopnost aktivovat tuto p34cdc2 (CDK1) kinázu a tím získávají plnou meiotickou kompetenci (Kanayama et al., 2002). Během G2/M fáze se část MAP kináz přesouvá do zárodečného váčku (Meinecke a Krischek, 2003). MAP kináza je aktivována pomocí Mos (aktivní katalytický komponent cytostatického faktoru CSF) a Plk1 (polo-like kináza1), které jsou ovšem v nezralém oocytu neaktivní (Sun a Nagai, 2003). MAP kináza je aktivována v době, kdy probíhá rozpad zárodečného váčku (GVBD). U myši se MAP kináza aktivuje následně aţ po aktivaci MPF (Stojkovic et al., 1999). U prasete se názory na dobu aktivace MPF liší. Bylo popsáno, ţe dochází k současné aktivaci MPF a MAP kinázy (Motlik et al., 1998). V odlišné studii ovšem bylo popsáno, ţe dochází nejdříve k aktivaci MPF a poté k aktivaci MAPK (Inoue, 1995). Nejvíce autorů zastává názor, ţe nejdříve dochází k aktivaci MAPK a poté MPF (Wehrend a Maeinecke 2001, Sugiura et al., 2005). Výsledky studií jsou odlišné pravděpodobně z důvodu velké heterogenity prasečích oocytů a odlišným způsobům kultivace. U prasete mají MAP kináza a P90rsk důleţitou roli v zastavení meiózy II. Jestliţe byla aktivita MAP kinázy/ P90rsk inhibována, byl blok v meióze II uvolněn a oocyty vstoupily do interfáze (Stojkovic et al., 1999). MAPK zůstává vysoce aktivní v průběhu zrání savčích oocytů a její aktivita klesá aţ po aktivaci. Průběh aktivity MAPK a MPF během meiotického zrání je znázorněn na obrázku 4. 18
26 Společné zapojení faktorů do znovuzahájení meiotického zrání je znázorněno na obrázku 5. Obr. 4.: Aktivita MAPK a MPF během meiotického zrání savců (podle Fan a Sun., 2004) Obr. 5: Model zapojení molekul camp, MAPK (ERK1/2), MPF a do znovuzahájení zrání u savců. Podle tohoto modelu se na udrţení prvního meiotického bloku podílí cyklický adenosin monofosfát (camp). Ke sníţení hladiny camp můţe dojít po přerušení mezibuněčných spojů nebo pomocí proteindiesteráz PDE3. Pokud je v oocytu přítomna vysoká hledina camp, ten aktivuje proteinkinázu A (PKA) která posléze blokuje cyklindependentní kinázu cdc25b, která je nutná pro znovuzahájení zrání. Pro aktivaci MPF je tedy nutné sníţení aktivity PKA a aktivace cdc25b pomocí ERK1/2 a polo-like kinázami Plk/Akt. Schéma je znázorněno podle Liang et al., (2007). 19
27 Cytostatický faktor CSF Oocyty zastavené v druhé meiotické metafázi jsou zastaveny ve druhém meiotickém bloku pomocí skupiny molekul nazývané cytostatický faktor (CSF). Cytostatický faktor je přítomen v cytoplasmě ovulovaných oocytů, kde brání degradaci cyklinu B, který je nutný pro udrţení aktivity MPF. Důleţitým cytostatickým faktorem je Mos protein, který je potřebný pro stimulaci aktivity MAP kinázy a systém Mos/MAP kináza pravděpodobně slouţí k aktivaci a stabilizaci MPF (Stojkovic et al., 1999). K výstupu z druhého meiotického bloku můţe dojít aţ po sníţení aktivity MPF. Mos protein fosforyluje MEK1 kinázu a tím zvyšuje aktivitu MAPK. Mezi další molekuly CSF patří například SAC (Spindle Assembly Checkpoint) proteiny které jsou důleţité pro zastavení buněk v metafázi pomocí inhibice Anaphase Promoting komplexu (APC). Je-li tento komplex aktivován, dochází k degradaci cyklinu B a výstupu z druhého meiotického bloku (Sagata, 1997). 1.2 Oxid dusnatý V současné době jsou intenzivně studovány malé plynné molekuly (takzvané gasotransmittery) jako významné signální molekuly v buňkách. Gasotransmittery jsou syntetizovány v buňkách enzymy a jejich syntéza je přísně regulována. Snadno prostupují přes plasmatickou membránu a mohou mít mnoho autokrinních, endokrinních i parakrinních efektů (Wang, 2004). Mezi gasotransmittery patří také oxid dusnatý. Za objev vazodilatační funkce oxidu dusnatého v kardiovaskulárním systému byla v roce 1998 udělena Nobelova cena za fyziologii. Po tomto objevu se oxid dusnatý dostal do popředí výzkumů i v ostatních oblastech fyziologie a medicíny. Řada vědeckých týmů v současnosti zdůrazňuje důleţitou funkci oxidu dusnatého v oblasti reprodukce samic (Jablonka-Shariff a Olson, 1997, Sengoku et al., 2001; Bu et al., 2003). Oxid dusnatý je v buňkách syntetizován enzymem NO-syntázou (NOS, EC ) (Nathan a Xie, 1994). NOS katalyzuje přeměnu aminokyseliny L-agininu na L- citrullin, přičemţ vzniká také molekula oxidu dusnatého. K reakci je nutný jako substrát nikotinamidadenin-dinukleotid fosfát (NADPH) a kyslík. Schéma reakce vzniku oxidu dusnatého je znázorněna na obrázku 6 (Stuehr et al., 1999). 20
28 GTP BH 4 NO syntáza FAD FMN N Fe CaM N N N BH 4 + N H NH 2 2 NH + NH Vytvoření dimeru NOS H + NH 2 N H + + OH 0,5H + 0,5 NADP NH 0,5 NADPH O- O 2 H 2O - O O 2 H O - 2O + NH NH3 + O O O O NH NH 2 + NO L - Arginin N-Hydroxyarginin L - Citrullin + NO Obr. 6. Syntéza oxidu dusnatého (Stuehr et al., 1999) Stavba NO- syntázy NO-syntázy jsou homodimery obsahující vazebná místa pro NADPH (nikotinamidadenindinukleotid fosfát), FMN (flavinmononukleotid), FAD (flavinadenindinukleotid) a kalmodulin (CaM) (Hemmens a Mayer, 1998; Boggs et al., 2000). Součástí NOS jsou také pevně vázané kofaktory tetrahydrobiopterin (HB4 = 6R-5,6,7,8 tetrahydrobiopterin) a hemová skupina (protophorfirin IX). NOS monomeru se skládá z oxidační domény leţící na aminokonci a redukční domény leţící na karboxylovém konci. Na redukční doméně se nachází vazebná místa pro redukční kofaktory NADPH, FMN, FAD a kalmodulin. Oxidační doména pevně váţe tetrahydrobiopterin a thiolátovouhemovou skupinu, která je reakčním centrem pro oxidační reakce. Kalmodulin aktivuje funkce NOS a ovlivňuje průtok elektronů enzymem (Stuehr et al, 1999). Molekulová hmotnost monomeru se v závislosti na izoformě pohybuje se mezi 110 a 160 kda (Hemmens a Mayer, 1998). 21
29 Ca 2+ CaM Hem FMN FAD Obr. 7.: Model syntázy oxidu dusnatého.bh 4 - tetrahydrobiopterin, L-Arg L-arginin, CaM kalmodulin, FMN flavinmononukleotid, FAD - flavinadenindinukleotid, NADPH nikotinamidadenindinucleotid fosfatáza (Stuehr et al., 1999) Izoformy NO- syntázy Enzym NO- syntáza se v buňkách vyskytuje ve třech základních izoformách. Jednotlivé izoformy jsou produkty různých genů s různou lokalizací, regulací, katalytickými účinky a různou citlivostí k inhibitorům (Murad, 1999; Furchgott, 1999; Ignarro, 1999). 1) Nervová NO-syntáza (známá jako nnos, typ I, NOS-I a NOS-1), byla poprvé nalezena v nervové tkáni (Bredt et al., 1990). Později byl její výskyt prokázán také v kosterní svalovině, beta buňkách Langerhansových ostrůvků slinivky břišní, hypofýze, dřeni nadledvin a ledvinových nefronech, samčích pohlavních orgánech a dalších tkáních (Dixit a Parvizi, 2001). Gen pro nnos je u člověka uloţen na 12. chromosomu. Monomer proteinu má hmotnost 131 kda. Tato isoforma syntetizuje pouze malé mnoţství oxidu dusnatého. Je exprimována konstitutivně (jako konstitutivní jsou označovány enzymy, které jsou v buňce trvale přítomny ve víceméně stálé koncentraci) a je aktivována vzestupem hladiny vnitrobuněčného vápníku. Ion Ca 2+ se váţe na kalmodulin a komplex kalmodulin/ca 2+ aktivuje nnos (Janssens et al., 1992). 2) Endoteliální NO-syntáza (enos, typ III, NOS-III, NOS-3) byla poprvé objevena v endotelových buňkách cév (Bredt et al., 1990, Alderton, 2001). enos byla detekována taktéţ ve folikulech vaječníků savců (Jablonka - Shariff a Olson, 1997). U samců savců byla nalezena v Leydigových, Sertoliho a endoteliálních buňkách a také ve spermatidách (Ambrosino et al., 2003). Je závislá na zvýšení hladiny vápníku, stejně jako isoforma 22
30 nnos (je kalcium a kalmodulin dependentní). Endoteliální NO-syntáza také syntetizuje jen malé mnoţství oxidu dusnatého po krátkou dobu. enos je většinou spojena s endoteliálními buněčnými membránami. Tato isoforma je u člověka kódována genem umístěným na chromosomu 7. Protein má velikost 133 kda (Janssens et al., 1992). 3) Indukovatelná NO-syntáza (známá jako inos, typ II, NOS-II, NOS-2). Tato izoforma byla poprvé nalezena v myších makrofázích. Je ale exprimována celou řadou buněk včetně hepatocytů, buněk hladké svaloviny, fibroblastů, buněk Langerhansových ostrůvků slinivky břišní, epiteliálních buněk, neutrofilních granulocytů, chondrocytů, keratinocytů a buněk respiračního epitelu (Nathan a Xie, 1994). inos byla detekována také ve folikulu vaječníků savců. inos zajišťuje stálou produkci oxidu dusnatého po dlouhou dobu (Jablonka -Shariff a Olson, 1997). Na rozdíl od nnos a enos vţdy obsahuje pevně vázaný kalmodulin s vápníkem. Tato isoforma je tedy regulována na úrovni transkripce (Alderton, 2001). U člověka je inos produkována genem lokalizovaném na chromosomu 17. Protein má molekulovou hmotnost 133 kda (Dixit a Parvizi, 2001). Mimo tyto izoformy byly objeveny různé varianty sestřihů izoforem: nnos - se 160 kda, nnos- se 136 kda, nnos- se 125 kda a existují také inos vzniklé sestřihem (Alderon et al., 2001) Aktivita a regulace NO-syntáz Pro aktivaci všech tří izoforem je nezbytné utvoření funkčního enzymu dimerizací. Aktivita NOS je ovlivňována vápníkem/ kalmodulinem, fosforylací, interakcí s jinými proteiny, řízenou degradací NOS a zpětnou vazbou oxidem dusnatým. nnos a enos jsou konstitutivní enzymy, jeţ jsou buňkami produkovány stále, nezávisle na podmínkách prostředí. Produkují pouze malá mnoţství NO. inos je produkována v závislosti na stimulu, jeţ představují nejčastěji endotoxiny a proinflamační cytokiny. inos produkuje na rozdíl od konstitutivních izoforem větší mnoţství oxidu dusnatého (Ignarro, 1999; Hattori et al., 2000). Produkce oxidu dusnatého je u nnos a enos regulována vazbou proteinu kalmodulinu, který je aktivován zvýšením hladiny intracelulárního vápníku. inos je nezávislá na mnoţství vápníku a kalmodulinu (Bian a Murad, 2003). Na rozdíl od konstitutivních NOS obsahuje velice pevně navázaný kalmodulin, proto je inos aktivita 23
31 označována jako Ca 2+ independentní (Suschek et al., 1993). Kalmodulin mění svou konformaci po navázání vápníku, coţ mu umoţňuje navázat se na kalmodulindependentní izoformu NOS (Alberts et al., 1998). Fosforylovaný kalmodulin je pro aktivaci NOS neúčinný, proto musí být defosforylován (Greif et al., 2004). Vazba kalmodulinu zvyšuje rychlost transferu elektronů z NADPH do redukční domény (Alderton, 2001). Také fosforylace a defosforylace hrají roli v regulaci aktivity všech 3 enzymů NOS. Aktivaci enos ovlivňuje fosforylace na zbytcích Thr 495 and Ser Do fosforylace těchto zbytků jsou zapojeny proteinkinázy Akt, proteinkináza A (PKA), proteinkináza C (PKC), MAPK. Defosforylaci zajišťují dvě proteinfosfatázy PP1 a PP2A. Pokud je enos fosforylována na Ser 1177, enos je aktivována, kdeţto fosforylace Thr 495 sniţuje její aktivitu. Dále fosforylace na Ser 1117 pomocí CaM-dependentní kinázy (CaM-KII) vedla ke zvýšení aktivity enos (Fleming et al., 2001), zatímco fosforylace nnos na Serinu 847 pomocí (CaM-KII) vede ke sníţení aktivity NOS enzymu (Alderton, 2001). Také v další studii bylo zjištěno, ţe proteinkináza A fosforyluje Ser na enos a tím se stimuluje vyšší produkce NO. Fosforylace NOS proteinkinázou C na Thr 495 a proteinkinázou A významně sniţuje jejich aktivitu (Bredt et Snyder, 1992). Dále bylo zjištěno, ţe zvýšená fosforylace tyrozinů na enos sníţila aktivitu enos o 50%. (Cardena et al., 1996). Nejnovější výzkumy rakovinných buněk ukazují, ţe na fosforylaci inos by se mohla podílet Src kináza a mohla by tak regulovat její aktivitu pomocí stabilizace dimeru NOS (Tyryshkin et al., 2010). Vzniklý, nebo dodaný NO můţe sám o sobě inhibovat produkci NO přes narušení vazby proteinového komplexu NFk-B, který zajišťuje transkripci s promotorem na inos genu. NO můţe také interagovat s hemovým ţelezem v nnos a tato inhibice můţe být zvrácena pomocí tetrahydrobiopterinu (Griscavage et al. 1994). Reversibilní inhibici enos pomocí NO potvrdil také Ravichandran et al, (1995) a Vaziri a Wang, (1999). NOS interaguje s dalšími proteiny, které mohou ovlivnit jeho aktivitu. Součástí nnos je vazebné místo pro vazbu PIN (Protein Inhibitor of NOS). Úloha PIN v regulaci NOS ovšem není zcela jasná, pravděpodobně reguluje NOS v závislosti na koncentraci (Jaffrey a Snyder, 1996). Heat-shock protein 90 (Hsp90) pravděpodobně reguluje aktivitu NOS pomocí allosterického efektu (Chan et al., 2006). Regulace lokalizace enos je řízena především myristoylací a palmitoylací a také proteinem Caveolinem. Studie publikovaná Tianem et al., 2010 ukázala, ţe Caveolin-1 můţe stimulovat aktivitu enos 24
32 v odpověď na oxidativní stres. Důleţitým kontrolním bodem pro regulaci NOS je udrţení stability její mrna a regulace její degradace (Nathan a Xie, 1994). Na degradaci NOS izoforem se pravděpodobně podílí tři mechanizmy dráha zahrnující proteázu kalpain, systém ubikvitin - proteazóm a regulace hsp90 chaperony (Osawa et al., 2003) Vlastnosti oxidu dusnatého Oxid dusnatý je volný radikál, jehoţ biologický poločas rozpadu je jen několik sekund (~5 s) (Garthwaite, 1991). NO snadno proniká skrz biomembrány a je hydrofobní (Kupková a Beneš, 2004). Odstraněním nepárového elektronu z NO vzniká nitrosoniový ion NO + naopak redukcí NO vzniká nitroxylový ion NO - Z biologického hlediska jsou důleţité zejména reakce NO s kyslíkem a s ionty transitních kovů (Brune a Lapetina, 1995). Oxid dusnatý reaguje s O 2 za vzniku oxidu dusičitého NO 2, který můţe dimerizovat do formy N 2 O 4, který jiţ nemá charakter radikálu. Vyšší koncentrace NO 2 nebo jeho dimeru způsobují poškození epiteliálních buněk dýchacích cest (Kupková a Beneš, 2004). Reakcí N 2 O 4 s vodou se tvoří stabilní produkty nitrity (NO 2- ) a nitráty (NO 3- ) (Dixit a Parvizi, 2001). Nitráty a nitrity mohou v organismu reagovat například s oxyhemoglobinem. Reakcí NO 2 s oxidem dusnatým vzniká oxid dusitý, který můţe nitrosylovat proteiny. Nitrosylace je jednou z rozšířených modifikací bílkovin v organismu (Stamler et al., 1994). Nitroso-thioly také slouţí jako efektní nosiče oxidu dusnatého (Furchgott a Zawadski, 1980). Při rozkladu oxidu dusnatého vznikají dusitany, které se v přítomnosti hemoproteinů oxidují aţ na dusičnany (Kupková a Beneš, 2004). Těchto reakcí se vyuţívá při nepřímém stanovení NO, protoţe dusitany a dusičnany se na rozdíl od NO dají spektrofotometricky stanovit. Další reakcí je reakce NO se superoxidem (O 2 ), při níţ vzniká toxický peroxodusitan (OONO - ), který můţe oxidovat SH skupiny bílkovin. Peroxodusitan můţe způsobovat poškození DNA a apoptózu, čehoţ vyuţívají makrofágy při obraně organismu. Reakcí NO s kyslíkovými radikály se tvoří další toxické radikály, které způsobují poškození tkáně a účastní se tak chronického i akutního zánětu (Clementi et al., 1998). Nejdůleţitější biologické funkce NO jsou znázorněny na obrázku 8. 25
33 Obr. 8.: Základní dráhy působení radikálu oxidu dusnatého v biologických systémech. Podle Stamler et al. (1997). Reakce NO s rozpustnou guanylátcyklázou Častým cílovým proteinem pro oxid dusnatý je rozpustná guanylát cykláza (scg) (Ignarro et al., 1987; Murad, 1994). NO se v guanylát cykláze váţe na hemové ţelezo a cysteinový zbytek v blízkosti hemové skupiny. Interakce NO s hemovým ţelezem má za následek uvolnění transaxiálního ligandu histidinu, coţ vede k enzymové aktivaci guanylát cyklázy. Guanylát cykláza v buňkách například přeměňuje guanosintrifosfát (GTP) na cyklický guanosinmonofosfát (cgmp). cgmp sniţuje vnitrobuněčnou koncentraci Ca 2+. Sníţení koncentrace Ca 2+ má za následek například uvolnění hladkého svalstva. NO se pomocí aktivace cgmp účastní také přenosu nervového signálu. Působením glutamátu na NMDA receptor se zvyšuje koncentrace Ca 2+. Zvýšení koncentrace vápníkových iontů aktivuje nnos, a vzniklý NO způsobí vzestup hladiny cgmp a zpětnou difúzi oxidu dusnatého do presynaptického neuronu. Pomocí cgmp se tak NO pravděpodobně účastní tvorby paměťové stopy v centrální nervové soustavě (Eu et al., 2000). cgmp jako cílová molekula pro NO se účastní také na zvýšení hladiny camp, důleţitého faktoru v meiotickém zrání oocytů (Sun a Nagai, 2003). Reakce NO s dalšími hemoproteiny NO často reaguje také s dalšími hemoproteiny. Oxid dusnatý produkovaný stimulovanými makrofágy difunduje do okolních tkání, kde reaguje s Fe-S a hemovými centry enzymů. Nejvíce hemových skupin je dostupných uvnitř mitochondriální akonitasy 26
34 (Drapier a Hibbs, 1996). Vazbou na tyto hemové proteiny se sníţí tvorba NADH, který je nutný pro řízení oxidativní fosforylace. NO a peroxonitrit také inhibují komplexy dýchacího řetězce. NO také inhibuje ribonukleotid reduktásy, coţ vede k inhibici DNA syntézy (Clementi et al., 1998). S- Nitrosylace Nitrosylace je jednou z rozšířených modifikací proteinů. Sloučeniny NO jako N 2 O 3, N 2 O 4 a ONOO - mohou snadno reagovat s thioly v aminokyselinách, peptidech a proteinech a mohou je nitrosylovat. Nitrosylace modifikuje například iontové kanály, kinázy, proteolytické enzymy, transkripční faktory.(mc Donald a Moss, 1994, Stamler 1994). Přes kaskádu nitrosylace oxid dusantý reguluje například apoptózu a receptory spojené s G-proteiny (Kokkola et al., 2005) Inhibitory NO- syntáz a donory NO Při studiu funkcí oxidu dusnatého v organizmu se často pouţívá metod farmakologické inhibice enzymu NOS a kultivace buněk s donory NO. Inhibitory NOS Aktivita NOS můţe být regulována pomocí mnoha farmaceutických inhibitorů. První skupinou často pouţívaných inhibitorů ve výzkumu úlohy NO v ţivotních dějích jsou takzvané kompetitivní inhibitory. Tyto inhibitory inhibují reakci katalyzovanou NOS obsazením vazebného místo pro substrát NOS - L-arginin (Rees et al., 1989; 1990). Mezi pouţívané deriváty argininu patří NG-monometyl-L-arginin (L-NMMA), N-omega-nitro- L-arginin (L-NA) a N-omega-nitro-L-arginin metylester (L-NAME). Tyto inhibitory inhibují nespecificky všechny tři izoformy NOS. Jejich nespornou výhodou je existence neúčinných D-konformerů, které je moţno při experimentech vyuţít jako negativní kontrolu. Nevýhodou těchto inhibitorů je ţe obsahují alkoholové, aminové nebo karboxylové skupiny, které mohou nespecificky reagovat i s jinými hemovými proteiny v buňkách (Peterson et al., 1992). Druhým typem inhibitorů jsou akompetivní inhibitory, které inhibují základní mechanizmus vzniku NO a vyţadují NADPH a substrát. Inhibitor se naváţe na enzym a způsobí konformační změny nebo kovaletní změny enzymu. Do této skupiny patří inos 27
35 specifický inhibitor aminoguanidin (AG) společně s acetamidovými inhibitory (L-NIO, L-NIL, GW273629). Pro inaktivaci NOS aminoguanidinem (AG) je nutná současná přítomnost Ca 2+, kalmodulinu, NADPH, tetrahydrobiopterinu a kyslíku (Wolff a Lubeskie, 1995). Aminoguanidin je mnohem slabší inhibitor konstitutivních izoforem, pouţívá se zejména pro inhibici inos. Efekt aminoguanidinu lze zvrátit pouţitím NO donoru (Yamauchi et al., 1997). Donory NO Syntetické S-nitrosothioly patří mezi často pouţívané donory oxidu dusnatého. Ve studiích zaměřených na reprodukce samic je nejvíce pouţíván donor SNAP (S-nitroso-Nacetylpenicillamine) a SNP (sodium nitroprusside). SNAP uvolňuje NO ve fyziologických podmínkách (Nishio et al., 1996). SNAP je pouţíván jako vazodilatátor, neboť působí svou produkcí NO stimulačně na produkci cgmp. Na rozdíl od toho ovšem vyšší koncentrace SNAP (1 mm) indukují apoptózu buněk přes jinou neţ cgmp dráhu (Shen et al., 1998). Poločas rozpadu tohoto donoru je přibliţně 5 hodin při 37⁰ C (Iggnaro et al., 1981). SNP uvolňuje spontálně NO a NO - po rozpuštění ve vodě (Navaza et al., 1989). Nicméně při degradaci SNP vznikají i dva biologicky aktivní produkty, kyanidy a volné ionty ţeleza. Poločas rozpadu tohoto donoru jsou 2 minuty, ovšem metabolity se uvolňují ještě několik dní (Coppens et al., 2002). Oba tyto donory byly také vyuţity jako aktivační stimuly při studiu partenogenetické aktivace pomocí oxidu dusnatého V této studiizjištěno, ţe SNAP je mnohem efektivnější pro aktivaci oocytů neţ SNP (Petr et al., 2005). 28
36 1.3 Vliv NO- syntáz a NO na reprodukci samic Lokalizace NO-syntáz ve vaječníku samic enos enos byla detekována ve vaječníku potkana (Zackrisson et al., 1996, Tao et al., 1997, Jablonka-Shariff a Olson, 1997). Tato izoforma byla nalezena v buňkách théky, v ovariálním stroma a nástěnných granulózních buňkách časných antráních folikulů potkana a po ovulaci uvnitř buněk ţlutého tělíska (Jablonka- Shariff a Olson, 1997). Nejnovější studie ukazuje, ţe všechny tři izoformy NOS jsou ve vaječníku přítomny jiţ u právě narozených mláďat potkanů. U jednodenních mláďat se nacházejí především v oocytech a s postupným růstem folikulů se objevují také v granulózních a thékálních buňkách. Nejvyšší aktivita NOS a produkce NO byla zaznamenána den, kdy probíhá puberta potkanů (Zhang et al., 2011). enos byla nalezena také v myších oocytech (Mitchell et al., 2004, Jablonka- Shariff a Olson, 1997) a granulózních buňkách dospělých i prepubertálních myší (Mitchell et al., 2004). U skotu byla detekována enos v nezralých rostoucích oocytech, její mnoţství se během zrání oocytů sniţovalo (Tesfaye et al. 2006). enos byla těmito autory nalezena také v embryích skotu. Pires et al. (2009) detekovali enos v oocytech z primárních, sekundárních i terciálních folikulů skotu a v oocytech během zrání. enos byla nalezena především v cytoplazmě oocytů, granulózních a thékálních buňkách, kdeţto v oblasti jádra oocytů nebyl zaznamenán ţádný signál. Tito autoři v oocytech nalezli také mrna pro enos, mnoţství mrna se sniţovalo během zrání oocytů (Pires et al., 2009). U prasete byly nalezeny všechny tři izoformy NOS ve vaječníku a to i během vývoje folikulů. enos je exprimována uvnitř velkých folikulů (Takesue et al., 2003, Tao et al., 2004) o velikosti 7-10 mm. Tato izoforma byla nalezena v oocytech, endoteliálních buňkách, thékálních buňkách, kumulárních buňkách (Tao et al., 2004). Později byla nalezena také v oocytech a granulózních buňkách jiţ během utváření folikulu s jednou vrstvou kumulárních buněk (Kim et al., 2005). V oocytech z malých folikulů o velikosti 1-3 mm prokázal expresi enos a přítomnost enos mrna Hattori et al, (2000). Ve folikulech o průměru 7 mm bylo nalezeno větší mnoţství enos neţ ve folikulech s průměrem 2 mm. V této práci ovšem autoři nesledovali velikost oocytů, tudíţ ani vztah exprese k meiotické kompetenci oocytů (Takesue et al., 2003). Dále tito autoři prokázali, 29
37 ţe oocyty získané z folikulů o velikosti 3-6 mm produkují po 15 hodinách kultivace malá mnoţství NO. Vztah exprese NOS k meiotické kompetenci byl sledován v práci Chmelíkové et al V této práci bylo zjištěno, ţe jak mrna pro enos, tak vlastní enos přítomna ve všech sledovaných velikostních kategoriích rostoucích oocytů prasete a v kumulárních buňkách oocytů větších neţ 90 µm. V oocytech o velikosti 80 µm bylo znatelné, ţe v oblasti jádra se nachází více enos neţ v oblasti cytoplazmy. V částečně meioticky kompetentním oocytu pak byly nalezeny shluky enos v cytoplazmě. U prasete byla tato izoforma nalezena také v oocytech a kumulárních buňkách ve stádiích GV, MI a MII během meiotického zrání oocytů in vitro. Nejvyšší koncentrace enos byla nalezena u oocytů ve stádiu GV a s meiotickým zráním klesala (Chmelíková et al., 2010) inos Také inos byla nalezena ve vaječníku savců. Tato izoforma byla stejně jako enos nalezena ve vaječníku potkana (Zackrisson et al., 1996, Van Voohris et al, 1995, Tao et al., 1997, Jablonka-Shariff a Olson, 1997). Byla nalezena především v théce časných antrálních folikulů, ovariálním stroma a buňkách ţlutého tělíska (Jablonka- Shariff a Olson, 1997, Van Voohris et al, 1995). mrna pro inos byla nalezena v granulózních buňkách preantrálního folikulu potkana (Van Voohris et al, 1995). Mitchell et al. (2004) detekovali tuto izoformu v oocytech myší v théce a ooplazmě oocytů. V granulózních buňkách byla nalezena mrna pro inos ovšem signál proteinu inos v granulózních buňkách byl velmi slabý. Huo et al., 2005 zjistili, ţe lokalizace inos závisí na vývojovém stádiu oocytu. Ve stádiu GV byla inos nalezena převáţně v oblasti zárodečného váčku, ale krátce po GVBD byla inos lokalizována kolem kondenzovaných chromozómů. Kolem chromozómů byla inos lokalizována i během metafáze I a II. V anafázi byla inos nalezena v okolí dělícího vřeténka, poté byla v telofázi jiţ rozptýlena mezi chromozómy a dále byla tato izoforma nalezena v samčím a samičím prvojádru (Huo et al., 2005). U skotu byla inos nalezena rozptýleně v cytoplazmě nezralých oocytů, kdeţto u zralých oocytů se vyskytovala více ve shlucích. Tato izoforma byla nalezena také během embryonálního vývoje do stádia blastocysty (Tesfaye et al. 2006). Pires et al popisuje, ţe inos je lokalizována podobně jako enos, ve folikulu během vývoje folikulu skotu. V izolovaných oocytech nalezli inos v cytoplasmě a její distribuce se nelišila 30
38 během meiotického zrání. Tito autoři také nalezli mrna pro tuto izoformu v oocytech, přičemţ největší mnoţství bylo nalezeno v rostoucích oocytech (Pires et al. 2009). U prasete byla nalezena inos v granulózních buňkách časných antrálních folikulů menších neţ 3 mm (Grasselli et al., 2001). Tao et al., 2004 nalezl inos pouze v oocytech z velkých folikulů, zatímco Kim et al., (2005) nalezl inos izoformu v oocytech z malých folikulů s jednou vrstvou kumulárních buněk. V těchto folikulech ovšem nenalezli inos v granulózních buňkách. U oocytů s více vrsvami kumulárních buněk a antrálních oocytů tuto izoformu jiţ detekovali jak v cytoplasmě oocytu, tak v granulózních buňkách a théce. Přítomnost mrna pro inos a vlastní inos byla následně potvrzena v rostoucích oocytech od velikosti 80 µm také v jejich kumulárních buňkách. inos byla lokalizována v oocytech převáţně rozptýleně v cytoplazmě. Zajímavé bylo, ţe oocytů velikosti 80 µm se inos vyskytovala také v oblasti jadérka (Chmelíková et al., 2009). Tato izoforma byla dále nalezena při zrání prasečích oocytů in vitro. Podobně jako enos také inos se vyskytovala v nejvyšší koncentraci ve stádiu GV a poté její mnoţsví v oocytu klesalo. Zajímavé je, ţe se tato izofoma nevyskytovala v oblasti zárodečného váčku a kolem metafázního vřeténka (Chmelíková et al., 2010). nnos V ovariu potkana nebyla nnos zjištěna (Van Vohris et al., 1995). Abe et al., 1999 detekoval mrna pro nnos v myších oocytech (Abe et al., 1999). U skotu byla nalezena také pouze mrna pro nnos u nezralých oocytů, u zralých ovšem nalezna nebyla (Tesfaye et al., 2006). U prasete byla nnos detekována v oocytech malých folikulů s jednou vrsvou buněk, v oocytech, granulóze i théce větších folikulů a také v antrálních folikulech. V této práci oocyty nebyly rozlišeny podle své velikosti, tudíţ ani podle meiotické kompetence (Kim et al., 2005). Podrobnější studie (Chmelíková et al., 2009) ukázala, ţe mrna pro nnos a také vlastní protein nnos je přítomen ve všech námi sledovaných stádiích rostoucích oocytů prasete. Mnoţství proteinu nnos v oocytu stoupá s růstem oocytu, ovšem v kumulárních buňkách tento protein nalezen nebyl. Tato izoforma byla v oocytech lokalizována v cytoplasmě. U rostoucích oocytů o velikosti µm bylo více nnos nakumulováno v korové oblasti oocytu. U plně meioticky kompetentních oocytů se nnos mimo cytoplasmy nacházela také v jádru a jadérka. Také třetí izoforma nnos byla nalezena v oocytech a jejich kumulárních buňkách během meiotického zrání prasečích oocytů in vitro (Chmelíková et al., 2010). 31
39 Z těchto studií je zřetelné, ţe mrna pro NOS, a všechny tři izoformy NOS jsou syntetizovány během růstu prasečích oocytů jiţ od stádia velikosti oocytu 80 µm. Změny v distribuci jednotlivých izoforem NOS naznačují, ţe NOS pravděpodobně hraje úlohu při růstu oocytů a zisku meiotické kompetence prasete (Chmelíková et al., 2009) Úloha NO v meiotickém zrání savčích oocytů V organismu působí NO nejen jako neurotransmiter, vasodilatátor, inhibitor agregace krevních destiček a proliferace hladké svaloviny, ale také jako regulátor reprodukčních funkcí samic. NO hraje roli na kaţdé úrovni regulace reprodukce samic. Na úrovni hypotalamu reguluje uvolňování releasing hormonu LHRH který uvolní gonadotrpiny aktivací nnos v hypofýze. (Rosselli et al., 1994). Ve vaječníku NO indukuje ovulaci a luteolýzu (Yang et al., 2003), v reprodukčním traktu relaxuje svalovinu dělohy přes působení cgmp (Mc Cann et al., 2003). V mnoha pracech bylo prokázáno, ţe je NO nezbytný pro meiotické zrání oocytů savců. Úloha oxidu dusnatého v meiotickém zrání oocytů je často studována pomocí vyblokování genů pro NOS nebo pomocí specifických inhibitorů NOS nebo donorů NO. Mnoho studií pouţívá jako modelové organismy laboratorní hlodavce. Úlohu oxidu dusnatého v meióze prokázali experimenty pouţívající myši s vyblokovaným genem pro enos. Po vyblokování genu pro enos se myším rodilo méně mláďat a některá z nich měla sníţenou ţivotaschopnost. Tato zvířata měla také méně dozrálých oocytů ve stádiu MII, neboť velké mnoţství oocytů degenerovalo. Některé z abnormalit pozorovaných u enos deficitních myší se podobaly abnormalitám vyskytujícím se při nedostatku MPF (Jablonka - Shariff a Olson, 1998, Jablonka - Shariff a Olson, 2000). Při vyblokování genu pro enzym inos bylo u myší mnoţství ovulovaných oocytů sníţeno jen nepatrně a tento zásah neovlivnil počet mláďat ve vrhu a jejich ţivotaschopnost (Jablonka - Shariff a Olson, 1998). Pomocí nespecifického inhibitoru NOS (L-NAME) bylo prokázáno, ţe inhibice NOS narušuje rozpad zárodečného váčku a postup z první do druhé meiotické metafáze. Řada takto ošetřených oocytů vykazovala podobné degenerativní změny jako oocyty získané od myší s vyblokovaným genem pro enos. Výsledky těchto studií ukázaly, ţe NO je nezbytný pro normální zrání oocytů u myší (Jablonka - Shariff a Olson, 1998, 2000). 32
40 Také u skotu bylo prokázáno, ţe je NO nezbytný pro meiotické zrání oocytů. Oproti laboratorním hlodavcům, inhibovaly u skotu meiotické zrání aţ 10 x vyšší koncentrace inhibitoru (100 mm AG). Tyto koncentrace také narušily expanzi kumulárních buněk a zvýšily koncentraci NO 3- /NO 2- v oocytech skotu. Během zrání tyto vysoké koncentrace také inhibovaly migraci kortikálních granul. V této studii se snaţili zvrátit inhibiční efekt pomocí donoru NO SNP. Kombinace 100 mm AG 10 5 M SNP ovšem nezvrátila efekt inhibitoru, pouze zvýšila koncentraci NO 3- /NO 2- v oocytech (Matta et al., 2009). Vliv inhibitorů NOS na zrání oocytů a raný embryonální vývoj u skotu sledovali také Schwarz et al. (2010). Inhibitor L-NAME (10-7 M) sníţil počet oocytů, které dosáhly stádia druhé meiotické metafáze (Schwarz et al., 2010). V několika pracech bylo zjištěno, ţe NO můţe mít i jiné efekty. Mitsube et al., (1999) popisuje, ţe inhibitory NOS (L-NMMA a AG) neměly vliv na ovulaci vyvolanou LH u potkanů. V této studii kultivovali celá ovária s inhibitory. Také u králíků inhibice NOS inhibitorem (L-NAME) neměla vliv na počet oocytů ve stádiu GVBD (Yamauchi et al. 1997). Odlišné výsledky byly také publikovány ve studii pouţívající inhibice NOS u oocytů potkana (Nakamura et al., 2002). V této studii bylo popsáno, ţe inos inhibitor indukoval zrání oocytů. Autoři se domnívají, ţe NO přímo inhibuje meiotické zrání v oocytech bez kumulárních buněk. V této práci ovšem sledovali vliv pouze inos izoformy, pouţívali jiných inhibitorů a v kontrolních skupinách měli malé mnoţství zralých oocytů (Nakamura et al., 2002). Ovšem také v další práci bylo u potkanů zjištěno, ţe NO můţe inhibovat zrání oocytů navozené LH. Při LH-indukovaném zrání oocytů NO donor SNAP sníţil poměr oocytů které prošly GVBD a inhiboval expanzi kumulu. Naopak při inhibici NOS pomocí AG byl napodoben efekt LH na redukci mezibuněčných spojů při ovulaci. Také při in vivo experimentech bylo zjištěno, ţe injekce NO donorů zainhibovala ovulaci stimulovanou hcg (Sela-Abramovich et al., 2008). V dalších studiích bylo zjištěno, ţe NO můţe mít na zrání myších oocytů dvojí efekt. Oxid dusnatý můţe v malých koncentracích působit stimulačně, ovšem vyšší koncentrace mohou mít naopak inhibiční efekt na meiotické zrání. 24-hodinová inhibice NOS (inhibitorem NOS - L-NAME) narušila vyloučení prvního pólového tělíska oocytů (Sengoku et al., 2001, Bu et al., 2003). Sengoku et al., 2001 zjistili, ţe je kromě koncentrace NO významná také přítomnost kumulárních buněk kolem oocytů neboť NOS inhibitor (L-NAME) výrazně potlačil znovuzahájení meiózy pouze u oocytů obklopených kumulárními buňkami. Niţší koncentrace donoru SNP naopak stimulovaly 33
41 zrání oocytů obklopených kumulárními buňkami, ovšem neměly vliv na oocyty bez kumulárních buněk (Bu et al., 2003). Sengoku et al. (2001) ovšem zjistil, ţe pro stimulaci jsou nutné ještě niţší koncentrace donoru a naopak vysoké koncentrace (4 M SNP) způsobily vyšší procento atypických oocytů. Dvojí efekt NO byl prokázán také u skotu. Nízké koncentrace NO jsou nutné pro zrání oocytů (Matta et al., 2002), kdeţto vysoké koncentrace donoru SNP (10-3 M) blokovaly vývoj oocytů. Oocyty měly zpomalený průběh GVBD, většina oocytů byla zastavena v MI fázi a u těchto oocytů byla potlačená kumulární expanze. Tato inhibice vysokou koncentrací donoru byla nevratná. Inhibitor inos Aminoguanidin inhiboval GVBD v koncentracích 10 a 50 mm a naopak niţší koncentrace donoru NO SNP (0,01 μm) stimulovaly GVBD (Bilodeau-Goeseels., 2007). Také u prasečích oocytů hraje oxid dusnatý významnou roli během zrání. Pomocí experimentů, ve kterých byl pouţit inos inhibitor (AG) bylo prokázáno, ţe pro normální průběh GVBD je nutná funkční inos (Tao et al., 2004). Oocyty kultivované s nespecifickým inhibitorem L-NAME neměly blokován rozpad zárodečného váčku, ale většinou byly zastaveny před vyloučením prvního pólového tělíska. Naopak vyšší koncentrace NO donoru (0,3 mm SNP) inhibovaly utváření antra (Tao et al., 2004), a vysoké koncentrace NO donoru (SNP 1-10 mm) narušovaly meiotické zrání prasečích oocytů v době přechodu mezi první a druhou meiotickou metafází (Tao et al., 2005) Mechanizmy působení NO během meiotického zrání oocytů Vliv oxidu dusnatého na meiotické zrání savčího oocytu byl prokázán v mnoha pracech. Jeho přesné působení v oocytu, však zatím není detailně prostudováno. Objasnění signální kaskády je komplikované zejména vzhledem k odlišnému působení nízkých a vysokých koncentrací NO na meiotické zrání, proto je nutné odlišovat inhibiční a stimulační efekt oxidu dusnatého. V nízkých koncentracích oxid dusnatý přenáší signály a působí jako vnitrobuněčný posel, a tím také pomáhá regulovat meiózu. Ve vysokých koncentracích ovšem značně poškozuje oocyt svými deriváty. Přebytečný oxid dusnatý můţe v buňce reagovat s jinými volnými radikály (O 2- ) a produkovat tak více toxické radikály, například peroxynitrity ONOO - (Bu et al, 2003). 34
42 Stimulační vliv NO na meiotické zrání NO můţe být klíčovým regulátorem signální kaskády, která kontroluje postup mezi metafází I a metafází II u oocytů myší a potkanů (Jablonka-Shariff a Olson, 1998). NO je znám jako aktivátor guanátcyklázy a cyklických nukleotidů, regulátorů zpětného zahájení meiózy. Jablonka-Shariff a Olson (1998) uvádějí, ţe oxid dusnatý pravděpodobně reguluje hladinu camp buď zvýšením syntézy cgmp, a nebo stimulací camp-pde během přechodu z metafáze I do metafáze II (Jablonka-Shariff a Olson, 1998). V diskuzi svých výsledků vycházely z informace, ţe cgmp je lokalizována v granulózních buňkách potkaního vaječníku a v několika pracech bylo popsáno, ţe je zapojena do znovuzahájení meiózy u potkanů a křečků a ţe pro znovuzahájení meiózy je nutné zvýšení hladiny cgmp (Tornell et al., 1984, Hubbard a Price., 1988). V mnoha dalších pracech ovšem bylo naopak ukázáno, ţe pro výstup z meiotického bloku je nutné sníţení hladiny cgmp (Ratner et al., 1976, Hubbard a Terranova., 1982, Tornell et al., 1990, Vaccari et al., 2009). Inhibiční vliv NO na meiotické zrání Podle Sela-Abramovich et al., (2008), je pro znovuzahájení meiózy je nutný pokles NO v kumulárních buňkách. V této práci byl sledován vliv NO při kultivaci celých folikulů potkanů s LH. Úloha NO můţe být úzce spojena s produkcí NO v kumulárních buňkách odkud se NO můţe dostávat do oocytu a hrát tak roli při ovulaci a výstupu z prvního meiotického bloku. Bylo prokázáno, ţe NO inhibuje aktivaci MAPK v granulózních buňkách vyvolanou LH u potkanů. NO také brání přerušení mezibuněčných spojů při ovulaci (Sela-Abramovich et al., 2008). Dále bylo popsáno, ţe NO můţe působit na aktivitu MAPK pomocí adenylyl cyklázy (Tranguch et al., 2003) nebo přes utváření cgmp (Ingram et al., 2000). Sela-Abramovich et al. 2008, popisují, ţe NO můţe aktivovat sgc a zvyšovat produkci cgmp a je moţné, ţe pokles cgmp při ošetření LH umoţňuje aktivaci MAPK v granulósních buňkách. Ve své práci navrhli následující model působení NO po ošetření potkaních folikulů LH: Po stimulaci LH klesne hladina NO a sníţí se aktivita sgc a tím také hladina cgmp. To vede k aktivaci RAF1, MAP2K1 a MAPK a postupnému narušení mezibuněčných spojů. Přerušením mezibuněčných spojů se zabrání migraci molekul camp do oocytu. Sníţení koncentrace cgmp můţe vést také k odstranění inhibičního efektu cgmp na proteindiesterázy a tyto aktivní proteindiesterázy dále sniţují hladinu camp v oocytu (Sela-Abramovich et al., 35
43 2008). Kaskáda oxidu dusaného navrţená těmito autory je znázorněna na obrázku. Obr. 12.: Model kaskády oxidu dusnatého, podle Sela-Abramovich et al., (2008). Tento tým později navrhl další moţný mechanismus zapojení NO produkovaného inos v kumulárních buňkách do znovuzahájení zrání. Donor NO SNAP blokoval proteindiesterázu PDE3A a inhibice inos vedla naopak k aktivaci PDE3A u folikulů vystavených působení LH. Na tomto modelu bylo ukázáno, ţe sníţená hladina NO má vliv aţ po LH vlně a spolu s přechodným zvýšením hladiny camp v konečném důsledku sniţuje hladinu camp. Tito autoři tudíţ navrhují, ţe NO je nezbytný pro udrţení meiotického bloku. Navrhované schéma je znázorněno na obrázku 13 (Edry a Dekel, 2009). Tyto výsledky jsou podobné výsledkům Nakamury et al. (2002), který popisuje, ţe pro GVBD je nutné sníţení koncentrace NO produkovaného inos kumulárními buňkami po ošetření hcg. Obr. 13.: Model kaskády oxidu dusnatého podle Edry a Dekel (2009). Také u prasete bylo popsáno, ţe se hladina NO sniţuje po hormonálním ošetření gonadotropními hormony. U prasete byla ovšem sledována hladina NO produkovaného enos izoformou v oocytu na rozdíl od studie Sela-Abramovich et al. (2008), kde byla sledována koncentrace NO produkovaného inos v kumulárních buňkách oocytů potkanů. Produkce NO v oocytu prasete ovšem nebyla sníţena v přítomnosti LH, ale naopak byla 36
8 cyklinů (A, B, C, D, E, F, G a H) - v jednotlivých fázích buněčného cyklu jsou přítomny určité typy cyklinů
 Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
Buněč ěčné dělení BUNĚČ ĚČNÝ CYKLUS ŘÍZENÍ BUNĚČ ĚČNÉHO CYKLU cykliny a na cyklinech závislé proteinkinázy (Cyclin-Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího
Buněčné dělení ŘÍZENÍ BUNĚČNÉHO CYKLU
 BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
BUNĚČNÝ CYKLUS Buněčné dělení Cykliny a na cyklinech závislé proteinkinázy (Cyclin- Dependent Protein Kinases; Cdk-proteinkinázy) - proteiny, které jsou součástí řídícího systému buněčného cyklu 8 cyklinů
BUŇEČNÝ CYKLUS A JEHO KONTROLA
 BUŇEČNÝ CYKLUS A JEHO KONTROLA MITOSA - fáze: Profáze - kondensace chromosomů - 30 nm chromatine fibres vázané na matrix Rozpad Metafáze - párové ( sesterské ) chromatidy - vázané centromerou, seřazené
BUŇEČNÝ CYKLUS A JEHO KONTROLA MITOSA - fáze: Profáze - kondensace chromosomů - 30 nm chromatine fibres vázané na matrix Rozpad Metafáze - párové ( sesterské ) chromatidy - vázané centromerou, seřazené
Buňky, tkáně, orgány, soustavy
 Lidská buňka buněčné organely a struktury: Jádro Endoplazmatické retikulum Goldiho aparát Mitochondrie Lysozomy Centrioly Cytoskelet Cytoplazma Cytoplazmatická membrána Buněčné jádro Jadérko Karyoplazma
Lidská buňka buněčné organely a struktury: Jádro Endoplazmatické retikulum Goldiho aparát Mitochondrie Lysozomy Centrioly Cytoskelet Cytoplazma Cytoplazmatická membrána Buněčné jádro Jadérko Karyoplazma
Mechanismy hormonální regulace metabolismu. Vladimíra Kvasnicová
 Mechanismy hormonální regulace metabolismu Vladimíra Kvasnicová Osnova semináře 1. Obecný mechanismus působení hormonů (opakování) 2. Příklady mechanismů účinku vybraných hormonů na energetický metabolismus
Mechanismy hormonální regulace metabolismu Vladimíra Kvasnicová Osnova semináře 1. Obecný mechanismus působení hormonů (opakování) 2. Příklady mechanismů účinku vybraných hormonů na energetický metabolismus
44 somatických chromozomů pohlavní hormony (X,Y) 46 chromozomů
 Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
Buněčný cyklus MUDr.Kateřina Kapounková Inovace studijního oboru Regenerace a výţiva ve sportu (CZ.107/2.2.00/15.0209) 1 DNA,geny genom = soubor všech genů a všechna DNA buňky; kompletní genetický materiál
Buněčný cyklus. Replikace DNA a dělení buňky
 Buněčný cyklus Replikace DNA a dělení buňky 2 Regulace buněčného dělení buněčný cyklus: buněčné dělení buněčný růst kontrola kvality potomstva (dceřinných buněk) bránípřenosu nekompletně zreplikovaných
Buněčný cyklus Replikace DNA a dělení buňky 2 Regulace buněčného dělení buněčný cyklus: buněčné dělení buněčný růst kontrola kvality potomstva (dceřinných buněk) bránípřenosu nekompletně zreplikovaných
Struktura a funkce biomakromolekul
 Struktura a funkce biomakromolekul KBC/BPOL 10. Struktury signálních komplexů Ivo Frébort Typy hormonů Steroidní hormony deriváty cholesterolu, regulují metabolismus, osmotickou rovnováhu, sexuální funkce
Struktura a funkce biomakromolekul KBC/BPOL 10. Struktury signálních komplexů Ivo Frébort Typy hormonů Steroidní hormony deriváty cholesterolu, regulují metabolismus, osmotickou rovnováhu, sexuální funkce
INTRACELULÁRNÍ SIGNALIZACE II
 INTRACELULÁRNÍ SIGNALIZACE II 1 VÝZNAM INTRACELULÁRNÍ SIGNALIZACE V MEDICÍNĚ Příklad: Intracelulární signalizace: aktivace Ras proteinu (aktivace receptorové kinázy aktivace Ras aktivace kinázové kaskády
INTRACELULÁRNÍ SIGNALIZACE II 1 VÝZNAM INTRACELULÁRNÍ SIGNALIZACE V MEDICÍNĚ Příklad: Intracelulární signalizace: aktivace Ras proteinu (aktivace receptorové kinázy aktivace Ras aktivace kinázové kaskády
Nejmenší jednotka živého organismu schopná samostatné existence. Výměnu látek Růst Pohyb Rozmnožování Dědičnost
 BUŇKA Nejmenší jednotka živého organismu schopná samostatné existence Buňka je schopna uskutečňovat základní funkce organismu: obrázky použity z Nečas: BIOLOGIE LIDSKÉ TĚLO Alberts: ZÁKLADY BUNĚČNÉ BIOLOGIE
BUŇKA Nejmenší jednotka živého organismu schopná samostatné existence Buňka je schopna uskutečňovat základní funkce organismu: obrázky použity z Nečas: BIOLOGIE LIDSKÉ TĚLO Alberts: ZÁKLADY BUNĚČNÉ BIOLOGIE
Základy buněčné biologie
 Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Maturitní otázka č. 8 Základy buněčné biologie vypracovalo přírodozpytné sympózium LP, AM & DK na konferenci v Praze, 1. Máje 2014 Buňka (cellula) je nejmenší známý útvar, který je schopný všech životních
Ženský pohlavní systém
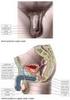 Ženský pohlavní systém 419 Ženský pohlavní systém Oogonia primordiální zárodečná buňka z epiblastu - ve stěně žloutkového váčku migrace do základu gonád mitotické dělení pod vlivem medulárního rete ovarii
Ženský pohlavní systém 419 Ženský pohlavní systém Oogonia primordiální zárodečná buňka z epiblastu - ve stěně žloutkového váčku migrace do základu gonád mitotické dělení pod vlivem medulárního rete ovarii
Bílkoviny a rostlinná buňka
 Bílkoviny a rostlinná buňka Bílkoviny Rostliny --- kontinuální diferenciace vytváření orgánů: - mitotická dělení -zvětšování buněk a tvorba buněčné stěny syntéza bílkovin --- fotosyntéza syntéza bílkovin
Bílkoviny a rostlinná buňka Bílkoviny Rostliny --- kontinuální diferenciace vytváření orgánů: - mitotická dělení -zvětšování buněk a tvorba buněčné stěny syntéza bílkovin --- fotosyntéza syntéza bílkovin
Exprese genetického kódu Centrální dogma molekulární biologie DNA RNA proteinu transkripce DNA mrna translace proteosyntéza
 Exprese genetického kódu Centrální dogma molekulární biologie - genetická informace v DNA -> RNA -> primárního řetězce proteinu 1) transkripce - přepis z DNA do mrna 2) translace - přeložení z kódu nukleových
Exprese genetického kódu Centrální dogma molekulární biologie - genetická informace v DNA -> RNA -> primárního řetězce proteinu 1) transkripce - přepis z DNA do mrna 2) translace - přeložení z kódu nukleových
Intracelulární Ca 2+ signalizace
 Intracelulární Ca 2+ signalizace Vytášek 2009 Ca 2+ je universální intracelulární signalizační molekula (secondary messenger), která kontroluje řadu buměčných metabolických a vývojových cest intracelulární
Intracelulární Ca 2+ signalizace Vytášek 2009 Ca 2+ je universální intracelulární signalizační molekula (secondary messenger), která kontroluje řadu buměčných metabolických a vývojových cest intracelulární
VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ
 FUNKCE PROTEINŮ 1 VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ Příklad: protein: dystrofin onemocnění: Duchenneova svalová dystrofie 2 3 4 FUNKCE PROTEINŮ: 1. Vztah struktury a funkce proteinů 2. Rodiny proteinů
FUNKCE PROTEINŮ 1 VÝZNAM FUNKCE PROTEINŮ V MEDICÍNĚ Příklad: protein: dystrofin onemocnění: Duchenneova svalová dystrofie 2 3 4 FUNKCE PROTEINŮ: 1. Vztah struktury a funkce proteinů 2. Rodiny proteinů
Inovace studia molekulární. a buněčné biologie
 Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Inovace studia molekulární I n v e s t i c e d o r o z v o j e v z d ě l á v á n í a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115
 Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: V/2 - inovace směřující k rozvoji odborných kompetencí Název materiálu: Buněčný cyklus
Gymnázium a Střední odborná škola, Rokycany, Mládežníků 1115 Číslo projektu: CZ.1.07/1.5.00/34.0410 Číslo šablony: V/2 - inovace směřující k rozvoji odborných kompetencí Název materiálu: Buněčný cyklus
Stavba dřeva. Základy cytologie. přednáška
 Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Základy cytologie přednáška Buňka definice, charakteristika strana 2 2 Buňky základní strukturální a funkční jednotky živých organismů Základní charakteristiky buněk rozmanitost (diverzita) - např. rostlinná
Regulace metabolických drah na úrovni buňky
 Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
Regulace metabolických drah na úrovni buňky EB Obsah přednášky Obecné principy regulace metabolických drah na úrovni buňky regulace zajištěná kompartmentací metabolických dějů změna absolutní koncentrace
2. Z následujících tvrzení, týkajících se prokaryotické buňky, vyberte správné:
 Výběrové otázky: 1. Součástí všech prokaryotických buněk je: a) DNA, plazmidy b) plazmidy, mitochondrie c) plazmidy, ribozomy d) mitochondrie, endoplazmatické retikulum 2. Z následujících tvrzení, týkajících
Výběrové otázky: 1. Součástí všech prokaryotických buněk je: a) DNA, plazmidy b) plazmidy, mitochondrie c) plazmidy, ribozomy d) mitochondrie, endoplazmatické retikulum 2. Z následujících tvrzení, týkajících
Eukaryotická buňka. Stavba. - hlavní rozdíly:
 Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
Eukaryotická buňka - hlavní rozdíly: rostlinná buňka živočišná buňka buňka hub buněčná stěna ano (celulóza) ne ano (chitin) vakuoly ano ne (prvoci ano) ano lysozomy ne ano ne zásobní látka škrob glykogen
PŘENOS SIGNÁLU V BUŇCE. Nela Pavlíková
 PŘENOS SIGNÁLU V BUŇCE Nela Pavlíková nela.pavlikova@lf3.cuni.cz Odpovědi na otázky Co za ligand aktivuje receptor spřažený s G-proteinem obsahující podjednotku α T? Opsin. Co prochází otevřenými CNGC
PŘENOS SIGNÁLU V BUŇCE Nela Pavlíková nela.pavlikova@lf3.cuni.cz Odpovědi na otázky Co za ligand aktivuje receptor spřažený s G-proteinem obsahující podjednotku α T? Opsin. Co prochází otevřenými CNGC
PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY
 PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY 1 VÝZNAM MEMBRÁNOVÝCH RECEPTORŮ V MEDICÍNĚ Příklad: Membránové receptory: adrenergní receptory (receptory pro adrenalin a noradrenalin) Funkce: zprostředkování
PŘENOS SIGNÁLU DO BUŇKY, MEMBRÁNOVÉ RECEPTORY 1 VÝZNAM MEMBRÁNOVÝCH RECEPTORŮ V MEDICÍNĚ Příklad: Membránové receptory: adrenergní receptory (receptory pro adrenalin a noradrenalin) Funkce: zprostředkování
David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3
 David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3 Klinika reprodukční medicíny a gynekologie Zlín 1 Imalab s.r.o. Zlín 2 Beckman Coulter ČR, a Imunoanalytická laboratoř,
David Rumpík1, Stanislav Los Chovanec1, Taťána Rumpíková1 Jaroslav Loucký2, Radek Kučera3 Klinika reprodukční medicíny a gynekologie Zlín 1 Imalab s.r.o. Zlín 2 Beckman Coulter ČR, a Imunoanalytická laboratoř,
BUNĚČNÉ JÁDRO FYZIOLOGIE BUŇKY JADÉRKO ENDOPLASMATICKÉ RETIKULUM (ER)
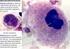 BUNĚČNÉ JÁDRO FYZIOLOGIE BUŇKY Buněčné jádro- v něm genetická informace Úkoly jádra-1) regulace dělení, zrání a funkce buňky; -2) přenos genetické informace do nové buňky; -3) syntéza informační RNA (messenger
BUNĚČNÉ JÁDRO FYZIOLOGIE BUŇKY Buněčné jádro- v něm genetická informace Úkoly jádra-1) regulace dělení, zrání a funkce buňky; -2) přenos genetické informace do nové buňky; -3) syntéza informační RNA (messenger
DUM č. 11 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 11 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 30.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Princip genové exprese, intenzita překladu
projekt GML Brno Docens DUM č. 11 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 30.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Princip genové exprese, intenzita překladu
http://www.accessexcellence.org/ab/gg/chromosome.html
 3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
3. cvičení Buněčný cyklus Mitóza Modifikace mitózy 1 DNA, chromosom genetická informace organismu chromosom = strukturní podoba DNA během dělení (mitózy) řetězec DNA (chromonema) histony další enzymatické
FYZIOLOGIE ROSTLIN. Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz
 FYZIOLOGIE ROSTLIN Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz Studijní literatura: Hejnák,V., Zámečníková,B., Zámečník, J., Hnilička, F.: Fyziologie rostlin.
FYZIOLOGIE ROSTLIN Přednášející: Doc. Ing. Václav Hejnák, Ph.D. Tel.: 224382514 E-mail: hejnak @af.czu.cz Studijní literatura: Hejnák,V., Zámečníková,B., Zámečník, J., Hnilička, F.: Fyziologie rostlin.
Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze
 Mendelova univerzita v Brně Agronomická fakulta Ústav chovu a šlechtění zvířat Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze Diplomová práce Vedoucí práce: Ing. Martin Hošek,
Mendelova univerzita v Brně Agronomická fakulta Ústav chovu a šlechtění zvířat Biochemické parametry zony pellucidy prasečích oocytů během folikulogeneze Diplomová práce Vedoucí práce: Ing. Martin Hošek,
MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE
 Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
Cvičení 6: BUNĚČNÝ CYKLUS, MITÓZA Jméno: Skupina: MITÓZA V BUŇKÁCH KOŘÍNKU CIBULE Trvalý preparát: kořínek cibule obarvený v acetorceinu V buňkách kořínku cibule jsou viditelné různé mitotické figury.
- význam: ochranná funkce, dodává buňce tvar. jádro = karyon, je vyplněné karyoplazmou ( polotekutá tekutina )
 Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Otázka: Buňka a dělení buněk Předmět: Biologie Přidal(a): Štěpán Buňka - cytologie = nauka o buňce - rostlinná a živočišná buňka jsou eukaryotické buňky Stavba rostlinné (eukaryotické) buňky: buněčná stěna
Buněčný cyklus a molekulární mechanismy onkogeneze
 Buněčný cyklus a molekulární mechanismy onkogeneze Imunofluorescence DAPI Přehled regulace buněčného cyklu Základní terminologie: Cycliny evolučně konzervované proteiny s homologními oblastmi; jejich
Buněčný cyklus a molekulární mechanismy onkogeneze Imunofluorescence DAPI Přehled regulace buněčného cyklu Základní terminologie: Cycliny evolučně konzervované proteiny s homologními oblastmi; jejich
VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ
 REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
REGULACE APOPTÓZY 1 VÝZNAM REGULACE APOPTÓZY V MEDICÍNĚ Příklad: Regulace apoptózy: protein p53 je klíčová molekula regulace buněčného cyklu a regulace apoptózy Onemocnění: více než polovina (70-75%) nádorů
Endocytóza o regulovaný transport látek v buňce
 . Endocytóza o regulovaný transport látek v buňce Exocytóza BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace
. Endocytóza o regulovaný transport látek v buňce Exocytóza BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace
DUM č. 1 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 1 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Charakteristika buněčného cyklu eukaryot
projekt GML Brno Docens DUM č. 1 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: Charakteristika buněčného cyklu eukaryot
MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK
 MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK PLASMATICKÁ MEMBRÁNA EUKARYOTICKÝCH BUNĚK Všechny buňky (prokaryotické a eukaryotické) jsou ohraničeny membránami zajišťujícími integritu a funkci buněk Ochrana
MEMBRÁNOVÉ STRUKTURY EUKARYONTNÍCH BUNĚK PLASMATICKÁ MEMBRÁNA EUKARYOTICKÝCH BUNĚK Všechny buňky (prokaryotické a eukaryotické) jsou ohraničeny membránami zajišťujícími integritu a funkci buněk Ochrana
Gametogenese a fertilizace. Vývoj 142
 Gametogenese a fertilizace Vývoj 142 Gamety pohlavní buňky Gametogenese diferenciace vysoce specializovaných pohlavních buněk schopných po fertilizaci vytvořit nového jedince Vajíčko (ovum) Spermie 1.
Gametogenese a fertilizace Vývoj 142 Gamety pohlavní buňky Gametogenese diferenciace vysoce specializovaných pohlavních buněk schopných po fertilizaci vytvořit nového jedince Vajíčko (ovum) Spermie 1.
MEIÓZA. 1. Které fáze z meiotické profáze I jsou znázorněny na obrázcích?
 Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
Cvičení 8: ROZMNOŽOVÁNÍ A VÝVOJ Jméno: Skupina: MEIÓZA Trvalý preparát: obarvené podélné řezy varlat brouka smrtníka obecného (Blaps mortisaga) Prohlédněte si několik řezů varlete a hledejte v semenotvorných
SOMATOLOGIE Vnitřní systémy
 SOMATOLOGIE Vnitřní systémy VY-32-INOVACE-56 AUTOR: Mgr. Ludmila Kainarová POHLAVNÍ SYSTÉM ŽENY FUNKCE 1. tvorba pohlavních buněk vajíček 2. tvorba pohlavních hormonů (estrogen,progesteron) 3. umožnění
SOMATOLOGIE Vnitřní systémy VY-32-INOVACE-56 AUTOR: Mgr. Ludmila Kainarová POHLAVNÍ SYSTÉM ŽENY FUNKCE 1. tvorba pohlavních buněk vajíček 2. tvorba pohlavních hormonů (estrogen,progesteron) 3. umožnění
Tyranovec královský Onychorhynchus coronatus SIGNALIZACE BUNĚČNÁ. B10, 2015/2016 Ivan Literák
 BUNĚČNÁ SIGNALIZACE Tyranovec královský Onychorhynchus coronatus B10, 2015/2016 Ivan Literák BUNĚČNÁ SIGNALIZACE BUNĚČNÁ SIGNALIZACE - reakce na podněty z okolí - komunikace s jinými buňkami - souhra buněk
BUNĚČNÁ SIGNALIZACE Tyranovec královský Onychorhynchus coronatus B10, 2015/2016 Ivan Literák BUNĚČNÁ SIGNALIZACE BUNĚČNÁ SIGNALIZACE - reakce na podněty z okolí - komunikace s jinými buňkami - souhra buněk
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ
 BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
BUŇKA ZÁKLADNÍ JEDNOTKA ORGANISMŮ SPOLEČNÉ ZNAKY ŽIVÉHO - schopnost získávat energii z živin pro své životní potřeby - síla aktivně odpovídat na změny prostředí - možnost růstu, diferenciace a reprodukce
1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu
 Test pro přijímací řízení magisterské studium Biochemie 2019 1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu U dalších otázek zakroužkujte správné tvrzení (pouze jedna správná
Test pro přijímací řízení magisterské studium Biochemie 2019 1. Napište strukturní vzorce aminokyselin D a Y a vzorce adenosinu a thyminu U dalších otázek zakroužkujte správné tvrzení (pouze jedna správná
Molekulární základy dědičnosti. Ústřední dogma molekulární biologie Struktura DNA a RNA
 Molekulární základy dědičnosti Ústřední dogma molekulární biologie Struktura DNA a RNA Ústřední dogma molekulární genetiky - vztah mezi nukleovými kyselinami a proteiny proteosyntéza replikace DNA RNA
Molekulární základy dědičnosti Ústřední dogma molekulární biologie Struktura DNA a RNA Ústřední dogma molekulární genetiky - vztah mezi nukleovými kyselinami a proteiny proteosyntéza replikace DNA RNA
Rozmnožování buněk Vertikální přenos GI. KBI / GENE Mgr. Zbyněk Houdek
 Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
Rozmnožování buněk Vertikální přenos GI KBI / GENE Mgr. Zbyněk Houdek Buněčný cyklus Buňky vznikají z bb. a jedinou možnou cestou, jak vytvořit více bb. je jejich dělením. Vertikální přenos GI: B. (mateřská)
Eva Benešová. Dýchací řetězec
 Eva Benešová Dýchací řetězec Dýchací řetězec Během oxidace látek vstupujících do různých metabolických cyklů (glykolýza, CC, beta-oxidace MK) vznikají NADH a FADH 2, které následně vstupují do DŘ. V DŘ
Eva Benešová Dýchací řetězec Dýchací řetězec Během oxidace látek vstupujících do různých metabolických cyklů (glykolýza, CC, beta-oxidace MK) vznikají NADH a FADH 2, které následně vstupují do DŘ. V DŘ
Prokaryota x Eukaryota. Vibrio cholerae
 Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Živočišná buňka Prokaryota x Eukaryota Vibrio cholerae Dělení živočišných buněk: buňky jednobuněčných organismů (volně žijící samostatné jednotky) buňky mnohobuněčných větší morfologické i funkční celky
Univerzita Karlova v Praze - 1. lékařská fakulta. Buňka. Ústav pro histologii a embryologii
 Univerzita Karlova v Praze - 1. lékařská fakulta Buňka. Stavba a funkce buněčné membrány. Transmembránový transport. Membránové organely, buněčné kompartmenty. Ústav pro histologii a embryologii Doc. MUDr.
Univerzita Karlova v Praze - 1. lékařská fakulta Buňka. Stavba a funkce buněčné membrány. Transmembránový transport. Membránové organely, buněčné kompartmenty. Ústav pro histologii a embryologii Doc. MUDr.
Tyranovec královský Onychorhynchus coronatus SIGNALIZACE BUNĚČNÁ. B11, 2016/2017 Ivan Literák
 BUNĚČNÁ SIGNALIZACE Tyranovec královský Onychorhynchus coronatus B11, 2016/2017 Ivan Literák BUNĚČNÁ SIGNALIZACE BUNĚČNÁ SIGNALIZACE - reakce na podněty z okolí - komunikace s jinými buňkami - souhra buněk
BUNĚČNÁ SIGNALIZACE Tyranovec královský Onychorhynchus coronatus B11, 2016/2017 Ivan Literák BUNĚČNÁ SIGNALIZACE BUNĚČNÁ SIGNALIZACE - reakce na podněty z okolí - komunikace s jinými buňkami - souhra buněk
Karyokineze. Amitóza. Mitóza. Meióza. Dělení jádra. Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky.
 Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
Karyokineze Dělení jádra Předchází dělení buňky Dochází k rozdělení genetické informace u mateřské buňky Druhy karyokineze Amitóza Mitóza Meióza Amitóza Přímé dělení jádra Genetická informace je rozdělena
DUM č. 3 v sadě. 37. Bi-2 Cytologie, molekulární biologie a genetika
 projekt GML Brno Docens DUM č. 3 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: chromatin - stavba, organizace a struktura
projekt GML Brno Docens DUM č. 3 v sadě 37. Bi-2 Cytologie, molekulární biologie a genetika Autor: Martin Krejčí Datum: 02.06.2014 Ročník: 6AF, 6BF Anotace DUMu: chromatin - stavba, organizace a struktura
Buňka. Buňka (cellula) základní stavební a funkční jednotka organismů, schopná samostatné existence. Cytologie nauka o buňkách
 Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
Buňka Historie 1655 - Robert Hooke (1635 1703) - použil jednoduchý mikroskop k popisu pórů v řezu korku. Nazval je, podle podoby k buňkám včelích plástů, buňky. 18. - 19. St. - vznik buněčné biologie jako
ŽENSKÝ REPRODUKČNÍ SYSTÉM
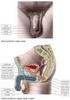 MUDr. Josef Jonáš ŽENSKÝ REPRODUKČNÍ SYSTÉM a jeho detoxikace 1 Vaječník - základní orgán ženské reprodukce Zdroj: P. Abrams, Lidské tělo 2 Hned při narození je ve vaječníku založeno mnoho folikulů, z
MUDr. Josef Jonáš ŽENSKÝ REPRODUKČNÍ SYSTÉM a jeho detoxikace 1 Vaječník - základní orgán ženské reprodukce Zdroj: P. Abrams, Lidské tělo 2 Hned při narození je ve vaječníku založeno mnoho folikulů, z
STRUKTURA EUKARYONTNÍCH BUNĚK
 STRUKTURA EUKARYONTNÍCH BUNĚK EUKARYOTICKÉ ORGANELY Jádro Ribozomy Endoplazmatické retikulum Golgiho aparát Lysozomy Endozomy Mitochondrie Plastidy Vakuola Cytoskelet Vznik eukaryotického jádra Jaderný
STRUKTURA EUKARYONTNÍCH BUNĚK EUKARYOTICKÉ ORGANELY Jádro Ribozomy Endoplazmatické retikulum Golgiho aparát Lysozomy Endozomy Mitochondrie Plastidy Vakuola Cytoskelet Vznik eukaryotického jádra Jaderný
FYZIOLOGIE BUŇKY BUŇKA 5.3.2015. Základní funkce buněk: PROKARYOTICKÁ BUŇKA. Funkce zajišťují základní životní projevy buněk: EUKARYOTICKÁ BUŇKA
 FYZIOLOGIE BUŇKY BUŇKA - nejmenší samostatná morfologická a funkční jednotka živého organismu, schopná nezávislé existence buňky tkáně orgány organismus - fyziologie orgánů a systémů založena na komplexní
FYZIOLOGIE BUŇKY BUŇKA - nejmenší samostatná morfologická a funkční jednotka živého organismu, schopná nezávislé existence buňky tkáně orgány organismus - fyziologie orgánů a systémů založena na komplexní
Rozdíly mezi prokaryotní a eukaryotní buňkou. methanobacterium, halococcus,...
 Dělení buňky Biologie člení živé organizmy do dvou hlavních kategorií: prokaryotní a eukaryotní organizmy. Na základě srovnání 16S rrna se zjistilo, že na naší planetě jsou 3 hlavní nadříše buněčných forem:
Dělení buňky Biologie člení živé organizmy do dvou hlavních kategorií: prokaryotní a eukaryotní organizmy. Na základě srovnání 16S rrna se zjistilo, že na naší planetě jsou 3 hlavní nadříše buněčných forem:
I. vývoj pohlavních buněkspermatogenese
 I. vývoj pohlavních buněkspermatogenese a oogenese určeno výhradně pro přípravu p pravu studentů 1.léka kařské fakulty Rešerše: Hamilton-Boyd-Mossman, Langman, Larsen, Lüllmann-Rauch, Moore-Persaud, edu,
I. vývoj pohlavních buněkspermatogenese a oogenese určeno výhradně pro přípravu p pravu studentů 1.léka kařské fakulty Rešerše: Hamilton-Boyd-Mossman, Langman, Larsen, Lüllmann-Rauch, Moore-Persaud, edu,
Gametogeneze, mitóza a meióza. Prof. MUDr. Pavel Trávník, DrSc.
 Gametogeneze, mitóza a meióza Prof. MUDr. Pavel Trávník, DrSc. Buněčný cyklus generační doba - trvání cyklu interfáze - období mezi dvěma následnými mitózami vlastní buněčné dělení - mitóza regulace buněčného
Gametogeneze, mitóza a meióza Prof. MUDr. Pavel Trávník, DrSc. Buněčný cyklus generační doba - trvání cyklu interfáze - období mezi dvěma následnými mitózami vlastní buněčné dělení - mitóza regulace buněčného
10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození
 10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození MEIÓZA meióza (redukční dělení/ meiotické dělení), je buněčné dělení, při kterém
10. oogeneze a spermiogeneze meióza, vznik spermií a vajíček ovulační a menstruační cyklus antikoncepční metody, oplození MEIÓZA meióza (redukční dělení/ meiotické dělení), je buněčné dělení, při kterém
VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY
 VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY ÚHIEM 1. LF UK v PRAZE Předmět: B02241 Obecná histologie a obecná embryologie Akademický rok 2013 2014 POUZE PRO OSOBNÍ
VÝVOJ POHLAVNÍCH BUNĚK OOGENESE A SPERMATOGENESE OPLOZENÍ, RÝHOVÁNÍ, VÝVOJ BLASTOCYSTY ÚHIEM 1. LF UK v PRAZE Předmět: B02241 Obecná histologie a obecná embryologie Akademický rok 2013 2014 POUZE PRO OSOBNÍ
Buněčný cyklus. When a cell arises, there must be a previous cell, just as animals can only arise from animals and plant from plants.
 Buněčný cyklus When a cell arises, there must be a previous cell, just as animals can only arise from animals and plant from plants. (Rudolf Wirchow, 1858) Buněčný cyklus cyklus buněčných procesů začínajících
Buněčný cyklus When a cell arises, there must be a previous cell, just as animals can only arise from animals and plant from plants. (Rudolf Wirchow, 1858) Buněčný cyklus cyklus buněčných procesů začínajících
Cytologie. Přednáška 2010
 Cytologie Přednáška 2010 Buňka 1.Velikost 6 200 µm, průměrná velikost 20um 2. JÁDRO a CYTOPLAZMA 3. ORGANELY (membránové) 4. CYTOPLAZMATICKÉ INKLUZE 5. CYTOSKELET 6. Funkční systémy eukaryotické buňky:
Cytologie Přednáška 2010 Buňka 1.Velikost 6 200 µm, průměrná velikost 20um 2. JÁDRO a CYTOPLAZMA 3. ORGANELY (membránové) 4. CYTOPLAZMATICKÉ INKLUZE 5. CYTOSKELET 6. Funkční systémy eukaryotické buňky:
Bunka a bunecné interakce v patogeneze tkánového poškození
 Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
Bunka a bunecné interakce v patogeneze tkánového poškození bunka - stejná genetická výbava - funkce (proliferace, produkce látek atd.) závisí na diferenciaci diferenciace tkán - specializovaná produkce
BUNĚČNÝ CYKLUS. OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky. Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí
 (1 BUNĚČNÝ CYKLUS BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace kontrolní body molekulární brzdy Jednobuněčné
(1 BUNĚČNÝ CYKLUS BUNĚČNÝ CYKLUS OMNIS CELLULA ET CELLULA - buňka vzniká jen z buňky Sled akcí, ve kterých buňka zdvojí svůj obsah a pak se rozdělí systém regulace kontrolní body molekulární brzdy Jednobuněčné
NUKLEOVÉ KYSELINY. Základ života
 NUKLEOVÉ KYSELINY Základ života HISTORIE 1. H. Braconnot (30. léta 19. století) - Strassburg vinné kvasinky izolace matiére animale. 2. J.F. Meischer - experimenty z hnisem štěpení trypsinem odstředěním
NUKLEOVÉ KYSELINY Základ života HISTORIE 1. H. Braconnot (30. léta 19. století) - Strassburg vinné kvasinky izolace matiére animale. 2. J.F. Meischer - experimenty z hnisem štěpení trypsinem odstředěním
STRUKTURA EUKARYONTNÍCH BUNĚK
 STRUKTURA EUKARYONTNÍCH BUNĚK EUKARYOTICKÉ ORGANELY Jádro Ribozomy Endoplazmatické retikulum Golgiho aparát Lysozomy Endozomy Mitochondrie Plastidy Vakuola Cytoskelet Vznik eukaryotického jádra Jaderný
STRUKTURA EUKARYONTNÍCH BUNĚK EUKARYOTICKÉ ORGANELY Jádro Ribozomy Endoplazmatické retikulum Golgiho aparát Lysozomy Endozomy Mitochondrie Plastidy Vakuola Cytoskelet Vznik eukaryotického jádra Jaderný
PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU
 PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU Podstata prezentace antigenu (MHC restrikce) byla objevena v roce 1974 V současnosti je zřejmé, že to je jeden z klíčových
PREZENTACE ANTIGENU A REGULACE NA ÚROVNI Th (A DALŠÍCH) LYMFOCYTŮ PREZENTACE ANTIGENU Podstata prezentace antigenu (MHC restrikce) byla objevena v roce 1974 V současnosti je zřejmé, že to je jeden z klíčových
MENSTRUAČNÍ A OVULAČNÍ CYKLUS. Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje
 MENSTRUAČNÍ A OVULAČNÍ CYKLUS Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Radka Benešová Ženské pohlavní ústrojí Vznik a cesta neoplozeného
MENSTRUAČNÍ A OVULAČNÍ CYKLUS Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje Říjen 2010 Mgr. Radka Benešová Ženské pohlavní ústrojí Vznik a cesta neoplozeného
Základy molekulární biologie KBC/MBIOZ
 Základy molekulární biologie KBC/MBIOZ Mária Čudejková 2. Transkripce genu a její regulace Transkripce genetické informace z DNA na RNA Transkripce dvou genů zachycená na snímku z elektronového mikroskopu.
Základy molekulární biologie KBC/MBIOZ Mária Čudejková 2. Transkripce genu a její regulace Transkripce genetické informace z DNA na RNA Transkripce dvou genů zachycená na snímku z elektronového mikroskopu.
pátek, 24. července 15 BUŇKA
 BUŇKA ŽIVOČIŠNÁ BUŇKA mitochondrie ribozom hrubé endoplazmatické retikulum cytoplazma plazmatická membrána mikrotubule lyzozom hladké endoplazmatické retikulum Golgiho aparát jádro jadérko chromatin volné
BUŇKA ŽIVOČIŠNÁ BUŇKA mitochondrie ribozom hrubé endoplazmatické retikulum cytoplazma plazmatická membrána mikrotubule lyzozom hladké endoplazmatické retikulum Golgiho aparát jádro jadérko chromatin volné
Variace Pohlavní soustava ženy
 Variace 1 Pohlavní soustava ženy 21.7.2014 16:03:50 Powered by EduBase BIOLOGIE ČLOVĚKA POHLAVNÍ SOUSTAVA POHLAVNÍ SOUSTAVA ŽENY Funkce pohlavního systému ženy 1. Zrání vajíček a jejich uvolňování z kůry
Variace 1 Pohlavní soustava ženy 21.7.2014 16:03:50 Powered by EduBase BIOLOGIE ČLOVĚKA POHLAVNÍ SOUSTAVA POHLAVNÍ SOUSTAVA ŽENY Funkce pohlavního systému ženy 1. Zrání vajíček a jejich uvolňování z kůry
Bp1252 Biochemie. #11 Biochemie svalů
 Bp1252 Biochemie #11 Biochemie svalů Úvod Charakteristickou funkční vlastností svalu je schopnost kontrakce a relaxace Kontrakce následuje po excitaci vzrušivé buněčné membrány je přímou přeměnou chemické
Bp1252 Biochemie #11 Biochemie svalů Úvod Charakteristickou funkční vlastností svalu je schopnost kontrakce a relaxace Kontrakce následuje po excitaci vzrušivé buněčné membrány je přímou přeměnou chemické
Apoptóza Onkogeny. Srbová Martina
 Apoptóza Onkogeny Srbová Martina Buněčný cyklus Regulace buněčného cyklu 1. Cyklin-dependentní kináza (Cdk) cyclin Regulace buněčného cyklu 2. Retinoblastomový protein (prb) E2F Regulace buněčného cyklu
Apoptóza Onkogeny Srbová Martina Buněčný cyklus Regulace buněčného cyklu 1. Cyklin-dependentní kináza (Cdk) cyclin Regulace buněčného cyklu 2. Retinoblastomový protein (prb) E2F Regulace buněčného cyklu
1.Biologie buňky. 1.1.Chemické složení buňky
 1.Biologie buňky 1.1.Chemické složení buňky 1. Stavbu molekuly DNA objasnil: a) J. B. Lamarck b) W. Harwey c) J.Watson a F.Crick d) A. van Leeuwenhoeck 2. Voda obsažená v buňkách je: a) vázaná na lipidy
1.Biologie buňky 1.1.Chemické složení buňky 1. Stavbu molekuly DNA objasnil: a) J. B. Lamarck b) W. Harwey c) J.Watson a F.Crick d) A. van Leeuwenhoeck 2. Voda obsažená v buňkách je: a) vázaná na lipidy
Intermediární metabolismus. Vladimíra Kvasnicová
 Intermediární metabolismus Vladimíra Kvasnicová Vztahy v intermediárním metabolismu (sacharidy, lipidy, proteiny) 1. po jídle (přísun energie z vnějšku) oxidace CO 2, H 2 O, urea + ATP tvorba zásob glykogen,
Intermediární metabolismus Vladimíra Kvasnicová Vztahy v intermediárním metabolismu (sacharidy, lipidy, proteiny) 1. po jídle (přísun energie z vnějšku) oxidace CO 2, H 2 O, urea + ATP tvorba zásob glykogen,
Kosterní svalstvo tlustých a tenkých filament
 Kosterní svalstvo Základní pojmy: Sarkoplazmatické retikulum zásobárna iontů vápníku - depolarizace membrány uvolnění vápníku v blízkosti kontraktilního aparátu vazba na proteiny zajišťující kontrakci
Kosterní svalstvo Základní pojmy: Sarkoplazmatické retikulum zásobárna iontů vápníku - depolarizace membrány uvolnění vápníku v blízkosti kontraktilního aparátu vazba na proteiny zajišťující kontrakci
růstu a buněčného dělění
 Buněčný cyklus - principy regulace buněčného Buněčný cyklus - principy regulace buněčného růstu a buněčného dělění Mitóza Průběh mitózy v buněčné kultuře fibroblastů Buněčný cyklus Kinázy závislé na cyklinech
Buněčný cyklus - principy regulace buněčného Buněčný cyklus - principy regulace buněčného růstu a buněčného dělění Mitóza Průběh mitózy v buněčné kultuře fibroblastů Buněčný cyklus Kinázy závislé na cyklinech
Současná formulace: Buňka je minimální jednotka, která vykazuje všechny znaky živých soustav
 Buněčná teorie: Počátky formování: 1840 a dále, Jan E. Purkyně myšlenka o analogie rostlinného a živočišného těla (buňky zrníčka) Schwann T. Virchow R. nové buňky vznikají pouze dělením buněk již existujících
Buněčná teorie: Počátky formování: 1840 a dále, Jan E. Purkyně myšlenka o analogie rostlinného a živočišného těla (buňky zrníčka) Schwann T. Virchow R. nové buňky vznikají pouze dělením buněk již existujících
Toxikologie PřF UK, ZS 2016/ Toxikodynamika I.
 Toxikodynamika toxikodynamika (řec. δίνευω = pohánět, točit) interakce xenobiotika s cílovým místem (buňkou, receptorem) biologická odpověď jak xenobiotikum působí na organismus toxický účinek nespecifický
Toxikodynamika toxikodynamika (řec. δίνευω = pohánět, točit) interakce xenobiotika s cílovým místem (buňkou, receptorem) biologická odpověď jak xenobiotikum působí na organismus toxický účinek nespecifický
STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno
 STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno STARÁ DOBRÁ KLASIKA Agonistický protokol, antagonistický protokol, flair up protokol. Různé studie, různé závěry ve smyslu toho,
STIMULAČNÍ PROTOKOLY A CO DÁL?! MUDr. Marcel Štelcl, Ph.D. ReproGenesis Brno STARÁ DOBRÁ KLASIKA Agonistický protokol, antagonistický protokol, flair up protokol. Různé studie, různé závěry ve smyslu toho,
Vytvořilo Oddělení lékařské genetiky FN Brno
 GONOSOMY GONOSOMY CHROMOSOMY X, Y Obr. 1 (Nussbaum, 2004) autosomy v chromosomovém páru homologní po celé délce chromosomů crossingover MEIÓZA Obr. 2 (Nussbaum, 2004) GONOSOMY CHROMOSOMY X, Y ODLIŠNOSTI
GONOSOMY GONOSOMY CHROMOSOMY X, Y Obr. 1 (Nussbaum, 2004) autosomy v chromosomovém páru homologní po celé délce chromosomů crossingover MEIÓZA Obr. 2 (Nussbaum, 2004) GONOSOMY CHROMOSOMY X, Y ODLIŠNOSTI
Chemie nukleotidů a nukleových kyselin. Centrální dogma molekulární biologie (existují vyjímky)
 Chemie nukleotidů a nukleových kyselin Centrální dogma molekulární biologie (existují vyjímky) NH 2 N N báze O N N -O P O - O H 2 C H H O H H cukr OH OH nukleosid nukleotid Nukleosidy vznikají buď syntézou
Chemie nukleotidů a nukleových kyselin Centrální dogma molekulární biologie (existují vyjímky) NH 2 N N báze O N N -O P O - O H 2 C H H O H H cukr OH OH nukleosid nukleotid Nukleosidy vznikají buď syntézou
Číslo a název projektu Číslo a název šablony
 Číslo a název projektu Číslo a název šablony DUM číslo a název CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT SSOS_ZE_1.05
Číslo a název projektu Číslo a název šablony DUM číslo a název CZ.1.07/1.5.00/34.0378 Zefektivnění výuky prostřednictvím ICT technologií III/2 - Inovace a zkvalitnění výuky prostřednictvím ICT SSOS_ZE_1.05
Energetický metabolizmus buňky
 Energetický metabolizmus buňky Buňky vyžadují neustálý přísun energie pro tvorbu a udržování biologického pořádku (život). Tato energie pochází z energie chemických vazeb v molekulách potravy (energie
Energetický metabolizmus buňky Buňky vyžadují neustálý přísun energie pro tvorbu a udržování biologického pořádku (život). Tato energie pochází z energie chemických vazeb v molekulách potravy (energie
- pro učitele - na procvičení a upevnění probírané látky - prezentace
 Číslo projektu Název školy Autor Tematická oblast CZ.1.07/1.5.00/34.0743 Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková Biologie 10 obecná biologie Organely eukaryotní buňky Ročník 1. Datum tvorby
Číslo projektu Název školy Autor Tematická oblast CZ.1.07/1.5.00/34.0743 Moravské gymnázium Brno s.r.o. RNDr. Monika Jörková Biologie 10 obecná biologie Organely eukaryotní buňky Ročník 1. Datum tvorby
BUNĚČ ORGANISMŮ KLÍČOVÁ SLOVA:
 BUNĚČ ĚČNÁ STAVBA ŽIVÝCH ORGANISMŮ KLÍČOVÁ SLOVA: Prokaryota, eukaryota, viry, bakterie, živočišná buňka, rostlinná buňka, organely buněčné jádro, cytoplazma, plazmatická membrána, buněčná stěna, ribozom,
BUNĚČ ĚČNÁ STAVBA ŽIVÝCH ORGANISMŮ KLÍČOVÁ SLOVA: Prokaryota, eukaryota, viry, bakterie, živočišná buňka, rostlinná buňka, organely buněčné jádro, cytoplazma, plazmatická membrána, buněčná stěna, ribozom,
Propojení metabolických drah. Alice Skoumalová
 Propojení metabolických drah Alice Skoumalová Metabolické stavy 1. Resorpční fáze po dobu vstřebávání živin z GIT (~ 2 h) glukóza je hlavní energetický zdroj 2. Postresorpční fáze mezi jídly (~ 2 h po
Propojení metabolických drah Alice Skoumalová Metabolické stavy 1. Resorpční fáze po dobu vstřebávání živin z GIT (~ 2 h) glukóza je hlavní energetický zdroj 2. Postresorpční fáze mezi jídly (~ 2 h po
- v interfázi dále viditelné - jadérko, jaderný skelet, jaderný obal
 Buňka buňka : 10-30 mikrometrů největší buňka : vajíčko životnost : hodiny: leukocyty, erytrocyty: 110 130 dní, hepatocyty: 1 2 roky, celý život organismu: neuron počet bb v těle: 30 biliónů pojem buňka
Buňka buňka : 10-30 mikrometrů největší buňka : vajíčko životnost : hodiny: leukocyty, erytrocyty: 110 130 dní, hepatocyty: 1 2 roky, celý život organismu: neuron počet bb v těle: 30 biliónů pojem buňka
A. chromozómy jsou rozděleny na 2 chromatidy spojené jen v místě centromery. B. vlákna dělícího vřeténka jsou připojena k chromozómům
 Karlova univerzita, Lékařská fakulta Hradec Králové Obor: všeobecné lékařství - test z biologie Vyberte tu z nabídnutých odpovědí (1-5), která je nejúplnější. Otázka Odpověď 1. Mezi organely membránového
Karlova univerzita, Lékařská fakulta Hradec Králové Obor: všeobecné lékařství - test z biologie Vyberte tu z nabídnutých odpovědí (1-5), která je nejúplnější. Otázka Odpověď 1. Mezi organely membránového
Univerzita Karlova v Praze, 1. lékařská fakulta
 Univerzita Karlova v Praze, 1. lékařská fakulta Tkáň svalová. Obecná charakteristika hladké a příčně pruhované svaloviny (kosterní a srdeční). Funkční morfologie myofibrily. Mechanismus kontrakce. Stavba
Univerzita Karlova v Praze, 1. lékařská fakulta Tkáň svalová. Obecná charakteristika hladké a příčně pruhované svaloviny (kosterní a srdeční). Funkční morfologie myofibrily. Mechanismus kontrakce. Stavba
NEMEMBRÁNOVÉ ORGANELY. Ribosomy Centrioly (jadérko) Cytoskelet: aktinová filamenta (mikrofilamenta) intermediární filamenta mikrotubuly
 NEMEMBRÁNOVÉ ORGANELY Ribosomy Centrioly (jadérko) Cytoskelet: aktinová filamenta (mikrofilamenta) intermediární filamenta mikrotubuly RIBOSOMY Částice složené z rrna a proteinů, skládají se z velké kulovité
NEMEMBRÁNOVÉ ORGANELY Ribosomy Centrioly (jadérko) Cytoskelet: aktinová filamenta (mikrofilamenta) intermediární filamenta mikrotubuly RIBOSOMY Částice složené z rrna a proteinů, skládají se z velké kulovité
Hořčík. Příjem, metabolismus, funkce, projevy nedostatku
 Hořčík Příjem, metabolismus, funkce, projevy nedostatku Příjem a pohyb v rostlině Příjem jako ion Mg 2+, pasivní, iont. kanály Mobilní ion v xylému i ve floému, možná retranslokace V místě funkce vázán
Hořčík Příjem, metabolismus, funkce, projevy nedostatku Příjem a pohyb v rostlině Příjem jako ion Mg 2+, pasivní, iont. kanály Mobilní ion v xylému i ve floému, možná retranslokace V místě funkce vázán
Biologie 11, 2014/2015, Ivan Literák BUNĚČNÝ CYKLUS A JEHO REGULACE
 Biologie 11, 2014/2015, Ivan Literák BUNĚČNÝ CYKLUS A JEHO REGULACE BUNĚČNÝ CYKLUS PROGRAMOVANÁ BUNĚČNÁ SMRT KONTINUITA ŽIVOTA: R. R. Virchow: Virchow: buňka buňka z buňky, z buňky, živočich živočich z
Biologie 11, 2014/2015, Ivan Literák BUNĚČNÝ CYKLUS A JEHO REGULACE BUNĚČNÝ CYKLUS PROGRAMOVANÁ BUNĚČNÁ SMRT KONTINUITA ŽIVOTA: R. R. Virchow: Virchow: buňka buňka z buňky, z buňky, živočich živočich z
Syllabus pro dosažení kvalifikace klinického embryologa
 Syllabus pro dosažení kvalifikace klinického embryologa Blok 1. Základní pojmy: buněčná biologie, molekulární biologie a genetika 1.1 Buňka Vnitřní organizace Řízení buněčného cyklu, kontrolní body Mitóza
Syllabus pro dosažení kvalifikace klinického embryologa Blok 1. Základní pojmy: buněčná biologie, molekulární biologie a genetika 1.1 Buňka Vnitřní organizace Řízení buněčného cyklu, kontrolní body Mitóza
Obecný metabolismus.
 mezioborová integrace výuky zaměřená na rostlinnou biochemii a fytopatologii CZ.1.07/2.2.00/28.0171 Obecný metabolismus. Regulace glykolýzy a glukoneogeneze (5). Prof. RNDr. Pavel Peč, CSc. Katedra biochemie,
mezioborová integrace výuky zaměřená na rostlinnou biochemii a fytopatologii CZ.1.07/2.2.00/28.0171 Obecný metabolismus. Regulace glykolýzy a glukoneogeneze (5). Prof. RNDr. Pavel Peč, CSc. Katedra biochemie,
Regulace metabolizmu lipidů
 Regulace metabolizmu lipidů Principy regulace A) krátkodobé (odpověď s - min): Dostupnost substrátu Alosterické interakce Kovalentní modifikace (fosforylace/defosforylace) B) Dlouhodobé (odpověď hod -
Regulace metabolizmu lipidů Principy regulace A) krátkodobé (odpověď s - min): Dostupnost substrátu Alosterické interakce Kovalentní modifikace (fosforylace/defosforylace) B) Dlouhodobé (odpověď hod -
EXTRACELULÁRNÍ SIGNÁLNÍ MOLEKULY
 EXTRACELULÁRNÍ SIGNÁLNÍ MOLEKULY 1 VÝZNAM EXTRACELULÁRNÍCH SIGNÁLNÍCH MOLEKUL V MEDICÍNĚ Příklad: Extracelulární signální molekula: NO Funkce: regulace vazodilatace (nitroglycerin, viagra) 2 3 EXTRACELULÁRNÍ
EXTRACELULÁRNÍ SIGNÁLNÍ MOLEKULY 1 VÝZNAM EXTRACELULÁRNÍCH SIGNÁLNÍCH MOLEKUL V MEDICÍNĚ Příklad: Extracelulární signální molekula: NO Funkce: regulace vazodilatace (nitroglycerin, viagra) 2 3 EXTRACELULÁRNÍ
PROKARYOTA např. baktérie
 PROKARYOTA např. baktérie Nemají buněčné jádro Genom dvoušroubovice DNA uložená v kruhovitém chromosomu Chromosom nemá centromeru Spolu s proteiny tvoří nukleoid (připevněn k membráně) Většina genů v jedné
PROKARYOTA např. baktérie Nemají buněčné jádro Genom dvoušroubovice DNA uložená v kruhovitém chromosomu Chromosom nemá centromeru Spolu s proteiny tvoří nukleoid (připevněn k membráně) Většina genů v jedné
