Souhrn údajů o přípravku
|
|
|
- Adéla Sedláčková
- před 8 lety
- Počet zobrazení:
Transkript
1 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU FLUCONAZOL Ardez 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka : Fluconazolum 2 mg/ml ve fyziologickém roztoku k intravenózní aplikaci. 3. LÉKOVÁ FORMA Roztok pro infúzi Popis přípravku: čirý bezbarvý roztok 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Léčbu je možné začít ještě před obdržením výsledků kultivačního nebo jiného laboratorního vyšetření, ale jakmile jsou výsledky těchto vyšetření dostupné, je třeba podle nich antiinfekční léčbu upravit. 1. Kryptokokóza, včetně kryptokokózové meningitidy a jiných forem infekce (např. plicní, kožní). K léčbě nemocných bez imunitního deficitu i pacientů s AIDS, po orgánové transplantaci či jinak imunosuprimovaných. Flukonazol Ardez lze použít pro udržovací léčbu k zabránění relapsu kryptokokového onemocnění u pacientů s AIDS. 2. Systémová kandidóza, včetně kandidémie, diseminovaná kandidóza a další formy invázní kandidové infekce, mezi něž patří infekce peritoneální, postižení endokardu, oka, plic a močového traktu. Léčba je indikována u pacientů s maligním onemocněním, léčených na jednotkách intensivní péče, kteří dostávají cytotoxickou nebo imunosupresivní terapii, anebo jsou vlivem jiných faktorů predisponováni ke kandidové infekci. 3. Slizniční kandidózy, k nimž patří orofaryngeální, jícnová a neinvazivní bronchopulmonální infekce, kandidurie, mukokutánní a chronická orální kandidóza (záněty vzniklé pod umělým chrupem). Léčit je možné jak nemocné imunologicky oslabené, tak i osoby bez imunologické zátěže. Prevence relapsu orofaryngeální kandidózy u pacientů s AIDS. 4. Kandidóza genitálu. Vaginální kandidóza, akutní či recidivující, dále jako profylaxe ke snížení výskytu rekurentní vaginální kandidózy (3 nebo více epizod ročně). Kandidová balanitida. 5. Prevence mykóz u pacientů s malignitami, u nichž je zvýšené riziko těchto infekcí důsledkem cytotoxické chemoterapie nebo radioterapie. 6. Dermatomykózy tj. tinea pedis, tinea corporis, tinea cruris, tinea versicolor, tine unguinum (onychomykóza) a kožní kandidové infekce. 7. Systémové endemické mykózy u imunokompetentních nemocných, jako jsou kokcidiomykóza, parakokcidiomykóza, sporotrichóza a histoplazmóza DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ Denní dávku flukazonolu volíme podle druhu a závažnosti fungální infekce. Ve většině případů vaginální kandidózy je dostatečná jednorázová dávka. Pokud charakter infekce vyžaduje opakované dávkování, pak musí léčba pokračovat až do vymizení klinických a laboratorních známek aktivity choroby. Při předčasném ukončení léčby může dojít k relapsu infekce. U pacientů s AIDS, s kryptokokovou meningitidou nebo recidivující orofaryngeální je třeba k zabránění relapsu obvykle nutné pokračovat udržovací terapii. 1
2 Dospělí 1. U kryptokokové meningitidy ale i v jiných lokalizacích kryptokokové infekce je obvyklá dávka 400 mg první den a dále mg denně v 1 denní dávce. U život ohrožujících infekcí způsobených Cryptococcus neoformans může být dávka zvýšena až na 800 mg 1 krát denně. Trvání léčby kryptokokvých infekcí závisí na klinické a mykologické odezvě, ale u kryptokokové meningitidy trvá alespoň 6 8 týdnů. K prevenci relapsu kryptokokové meningitidy je u pacientů s AIDS po dokončení úvodní útočné terapie vhodné trvale podávat flukonazol v denní dávce 200 mg. 2. U kandidémie, diseminované kandidózy a ostatních invazívních kandidových infekcí se obvykle první den podává 400 mg a dále 200 mg denně. V závislosti na klinické odpovědi může být denní dávka zvýšena na 400 mg. U život ohrožujících infekcí způsobených rodem Candida může být dávka zvýšena až na 800 mg 1krát denně. Na klinické odezvě závisí i délka léčby. 3. V případě oryfaryngeální kandidózy se obvykle podává mg v 1 denní dávce po dobu 7 14 dnů. U pacientů s těžkým poškozením imunity lze v případě potřeby pokračovat v terapii po delší dobu. U atrofické orální kandidózy vzniklé ve spojitosti s umělým chrupem se obvykle podává 50 mg 1 krát denně po dobu 14 dnů. Zubní náhradu současně dezinfikujeme lokálními antiseptiky. U ostatních kandidových slizničních infekcí (s výjimkou kandidózy genitálu viz níže) např. ezofagitida, neinvazivních bronchopulmonálních infekcí, kandidurie, mukokutánních kandidóz atd. je obvykle účinná denní dávka mg podávána dnů. U nemocných s AIDS je možné po dokončení útočné fáze léčby zabránit relapsu orofaryngeální kandidózy dávkou 150 mg 1 krát týdně. 4. Při léčbě vaginální kandidózy podáváme 150 mg flukonazolu v 1 perorální dávce. Ke snížení výskytu rekurentní vaginální kandidózy je možné podávat 150 mg 1krát měsíčně. Délka léčby je individuální, pohybuje se v rozmezí 4 12 měsíců. U některých pacientek je třeba doporučit častější dávkování. Jednorázovou dávku 150 mg používáme i pro léčbu kandidové balanitidy. 5. Pro prevenci kandidózy se doporučené dávkování pohybuje v závislosti na individuálním riziku vzniku mykotické infekce, a to od mg denně. Pacientům s vysokým rizikem systémové infekce, např. těm, u kterých lze předpokládat hlubokou či dlouhodobou neutropenii, doporučujeme podávat 400 mg denně v 1 dávce. Flukonazol je lépe začít podávat několik dnů před očekávaným nástupem neutropenie a v terapii pokračovat ještě dalších 7 dní potom, co počet neutrofilů dosáhl 1000/mm3. 6. Pro kožní infekce, včetně tinea pedis, corporis, cruris a infekce kandidové je doporučené dávkování 150 mg týdně nebo 50 mg denně. Léčba obvykle trvá 2 4 týdny, ale tinea pedis může vyžadovat až 6ti týdenní léčbu. U tinea versicolor je doporučená dávka 300 mg 1krát týdně po dobu 2 týdnů. U některých nemocných je někdy nutná ještě dávka 300 mg i ve 3 týdnu, zatímco u jiných může stačit jen jednorázové podání dávky mg. Je také možné použít alternativní dávkování 50 mg 1 krát denně po dobu 2 4 týdnů. Doporučená dávka k léčbě tinea unguium je 150 mg 1 krát týdně. Léčba by měla pokračovat až do doby, kdy je nehet poškozený infekcí nahrazen novým. To obvykle trvá 3 6 měsíců, a u nehtů palců 6 12 měsíců. Růst nehtů je velmi individuální a záleží i na věku pacienta. I po úspěšné léčbě chronické infekce nehtu může někdy přetrvávat jeho defigurace. 7. U systémových endemických mykóz je nutná dávka mg denně podávaná až po dobu 2 let. Délka léčby je individuální průměrně měsíců 2
3 u kokcidiomykózy, 2 17 měsíců u parakokcidiomykózy, 1 16 měsíců u sporotrichózy a 3 17 měsíců u histopazmózy. Děti Trvání léčby, tak jako u obdobných infekcí u dospělých, závisí na klinické a mykologické odezvě. Maximální denní dávky pro dospělé by neměly být u dětí překročeny. Flukonazol Ardez se podává v l dávce každý den. Doporučené dávkování flukonazolu u slizničních kandidóz je 3 mg/kg/den. První den léčby je vhodné podat nasycovací dávku 6 mg/kg, čímž se rychleji dosáhne ustálené hladiny. Léčba systémové kandidózy a kryptokokových infekcí vyžaduje dávku 6 12 mg/kg/den, v závislosti na celkové závažnosti onemocnění. U imunitně oslabených pacientů s rizikem neutropénie po chemoterapii nebo po radiační léčbě je jako prevenci fungálních infekcí vhodné podávat 3 2 mg/kg denně., podle hloubky a délky trvání indukované neutropenie (viz dávkování u dospělých) (děti s poruchou renálních funkcí viz dávkování u pacientů s poškozením ledvin). Děti do 4 týdnů U novorozenců probíhá vylučování flukonazolu pomalu. V prvních 2 týdnech života je dávkování léku v mg/kg shodné jako u ostatních dětí, avšak dávky podáváme každých 72 hodin. V průběhu týdne života podáváme stejnou dávku každých 48 hodin. Podávání pacientům ve vyšším věku Nejsou-li známky poškození ledvin, platí běžný způsob dávkování. U pacientů s renální poruchou (clearance kreatininu < 50 ml/min)dávkovací schéma upravujeme. Pacienti s poškozením ledvin Flukonazol se v nezměněné formě vylučuje převážně močí. Dávku při jednorázové léčbě není třeba upravovat. Pacientům (včetně dětí) s poruchou renálních funkcí léčených opakovanými dávkami podáváme počáteční nasycovací dávku mg a poté denní dávku (v závislosti na indikaci) upravíme podle následující tabulky: Clearance kreatininu ml/sec Procento doporučené (ml/min) dávky > 50 < = 50 (bez dialýzy) Pravidelná dialýza > 0,8 0,2 0,8 100% 50% 100% po každé dialýze Způsob podání Flukonazol lze podávat buď perorálně nebo formo intravenózní infúze nejvýše rychlostí 10 ml/min. Cesta podání závisí na klinickém stavu pacienta. Po přechodu od intravenózního k perorálnímu podání ( a pak naopak) se denní dávkování nemusí měnit. Infúze flukonazolu je připravena v 0,9% roztoku chloridu sodného. Na 200 mg (100 ml lahvička) připadá po 15 mmol Na + a Cl -. Vzhledem k tomu, že se flukonazol dodává ve fyziologickém roztoku, je třeba u pacientů vyžadujících omezení příjmu sodíku či tekutin věnovat pozornost jejich celkově podávanému množství Kontraindikace Flukonazol Ardez nepodáváme u pacientů s hypersenzivitou k tomuto léku či příbuzným azolovým látkám. U nemocných, kteří užívají opakované dávky flukonazolu 400 mg/den a vyší je kontraindikováno současné podávání terfenadinu. 3
4 Současné užívání cisapridu je kontraindikováno u pacientů, kteří užívají flukonazol (viz 4.5.) 4.4. Zvláštní upozornění a zvláštní opatření pro použití Při léčbě přípravkem Flukonazol Ardez může vzácně dojít k závažnému toxickému poškození jater s možným letálním zakončením. V případech flukonazolem navozené hepatoxicity nebyla nalezena závislost na velikosti denní dávky, délce terapie, pohlaví nebo věku. Po vysazení terapie je hepatoxicita flukonazolu obvykle reversibilní. Nemocní, u nichž se během léčby flukonazolem objeví patologické hodnoty jaterních testů, by vzhledem k možnému prohloubení hepatoxicity měli pečlivě sledovat. Pokud by byl flukonazol považován za příčinu klinických projevů spojených s jaterním poškozením, je třeba terapii tímto přípravkem přerušit. Zřídka se během léčby flukozanolem mohou objevit exfoliativní kožní reakce, jako je Stevens-Johnsonův syndrom a toxická epidermální nekrolýza. K závažným kožním reakcím na mnohá léčiva jsou náchylnější pacienti s AIDS. Pokud se u pacientů s povrchní kožní mykózou objeví exantém, jehož příčinou může být flukozanol, měla by být terapie tímto přípravkem přerušena. Jestliže se u pacientů s invázní nebo systémovou mykózou objeví mnohočetná vyrážka, je třeba je pečlivě sledovat a terapii flukonazolem přerušit, pokud se objeví bulózní léze nebo erythema multiforme. Současné podávání flukonazolu v dávce 400 mg spolu s terfenadinem je třeba pečlivě monotirovat (Viz Interakce s jinými léčivými přípravky a jiné formy interakce). Stejně jako u jiných azolových přípravků se vzácně vyskytly případy anafylaxe Interakce s jinými léčivými přípravky a jiné formy interakce Antikoagulantia: př studiu lékových interakcí zvyšoval flukonazol u zdravých mužů protrombinový čas (12 %) při podávání warfarinu. Stejně jako u ostatních azolových antimykotik, byly hlášeny krvácivé příhody (podlitiny, apistáze, krvácení do gastrointestinálního traktu, hematurie a melena). Tyto nežádoucí účinky byly důsledkem prodloužení protrombinového času u pacientů užívaných warfarin současně s flukozanolem. Protrombinový čas u pacientů užívajících antikoagulancia kumarinového typu by měl být pečlivě monitorován. Krátkodobě působící benzodiazepany: po perorálním podání midazolamu flukonazol způsoboval jeho významné zvýšení koncentrace s následnými psychomotorickými účinky. Tento účinek flukonazolu na midazolam se zdá být zřetelnější po perorálním podání flukozanolu než po jeho intravenózním podání. Jestliže u pacientů léčených flukonazolem je nutná souběžná léčba benzodiezapány, mělo by se uvažovat o možném snížení jejich dávek, a pacienti by měli být monitorováni s ohledem na tuto skutečnost. Látky obsahující sulfonylmočovinu: Flukonazol u zdravých osob prodlužoval sérový poločas současně podávaných perorálních sloučenin sulfonylmočoviny (chlorpropamid, glipizid, atolbutamid). Flukonazol a perorální látky obsahující sulfonylmočovinu lze u diabetiků podávat souběžně, je však třeba mít trvale na paměti možnost hypoglykemického stavu a proto častěji kontrolovat glykémii. Hydrochlorothiazid:souběžné podávání mnohočetných dávek hydrochlorthiazidu zdravým jedincům užívajícím flukozanol způsobuje zvýšení plazmatické koncentrace flukozanolu o 40 %. tento fakt není důvodem pro změnu dávkovacího režimu flukozanolu u osob souběžně užívajících diuretika, ale ordinující lékař by si toho měl být vědom. Fenytoin: souběžné podávaní flukonazolu a fenytoinu může klinicky významným způsobem zvýšit hladinu fenytoinu. Při souběžném podávání obou léků je nutné 4
5 sledovat hladiny fenytoinu a příslušnou dávku fenytoinu upravovat podle rozmezí terapeutických hladin. Perorální antikoncepce: Při současném podávání flukazonolu v dávce 50 mg a perorálních kontraceptiv nedochází k významnější změně sérové hladiny u ethynilestradiolu a levonorgestrolu, avšak při dávce 200 mg denně je plocha pod křivkou sérové koncentrace ethinylestradiolu i o 40 % zvýšena a levonorgestrolu o 24 %. Je tedy nepravděpodobné, že by opakované podávání flukonazolu v těchto dávkách ovlivňovalo účinnost podávaných perorálních kontraceptiv. Rifampicin: souběžné podávání flukozanolu a rifampicinu mělo za následek 25% snížení plochy pod křivkou flukozanolu a zkrácení jeh poločasu o 20 %. Pokud dostává pacient souběžně oba léky, je třeba zvážit zvýšení dávek flukonazolu. Cyklosporin: Klinické studie u pacientů po renální transplantaci potvrdila, že 200 mg flukonazolu denně zvolna zvyšuje koncentrace cyklosporinu. Ovšem v jiné studii, při které bylo opakovaně podáváno 100 mg flukozanolu denně, nedošlo u pacientů po transplantaci kostní dřeně ke změnám v hladinách cyklosporinu. Doporučuje se monitorovat plazmatické koncentrace cyklosporinu u pacientů souběžně užívajících flukonazol. Theofylin: v placebem kontrolované studii vzájemných interakcí vedlo podání 200 mg flukonazolu po 14 dnech k 18% poklesu střední plazmtické clearance theofylinu. U pacientů, kterým jsou podávány vysoké dávky theofylinu či kteří jsou z jiné příčiny zvýšeně ohroženi jeho toxicitou, je třeba při souběžné léčbě flukonazolem pátrat po známkách thefylinové toxicity a příslušně upravit jeho dávku, pokud k takovým projevům dojde. Terfenadin: protože byl popsán výskyt závažných dysrytmií následujících po prodloužení Qtc intervalu u pacientů, kteří užívali azolová antimykotika spolu s terfenadrinem, byly provedeny studie interakcí také u flukanozolu. Při podávání flukonazolu v dávce 200 mg denně se neprokázaly žádné změny v Qtc intervalu. Pokud je flukonazol užíván v dávce 400 mg nebo 800 mg denně souběžně s terfenadinem, dochází k signifikantnímu vzestupu sérových hladin terfenadinu. Užívání flukonazolu v dávce 400 mg/den a vyšší v kombinaci s terfenadinem je tedy kontraindikováno (viz 4.3. Kontraindikace). Při současném podávání flukonazolu v dávce 400 mg/den v kombinaci s terfenadinem je třeba nemocného pečlivě sledovat. Cisaprid: vyskytly se zprávy o srdečních příhodách včetně poruch komorového rytmu torsade de pointes u nemocných, kteří užívali souběžně flukonazol a cisaprid. Současné užívání cisapridu je kontraindikováno u pacientů, kteří užívají flukonazol. Rifabutin: vyskytly se zprávy o možné interakci při souběžném užívání rifabutinu a flukonazolu, kdy může dojít ke zvýšení sérových hladin rifabutinu. Objevily se zprávy o výskytu uveitivy u nemocných, kteří souběžně užívali flukozanol a rifabutin. Proto při souběžném podávání flukazonolu s rifambutinu je třeba nemocné pečlivě monitorovat. Tacrolimus: vyskytly se zprávy o možné interakci při souběžném podávání tacrolimu a flukonazolu, kdy může dojít ke zvýšení sérových hladin tacrolimu. Objevily se zprávy o výskytu nefrotoxicity u nemocných, kteří souběžně užívali flukonazol a tacrolimus. Proto při souběžném podávání flukonazolu a tacrolimu je třeba nemocné pečlivě monitorovat. Zidovudin:ve dvou klinických studiích byla pozorována zvýšená hladina zidovudinu způsobená sníženou konverzí zidovudinu na jeho hlvní metabolit. Při první studii byla studována hladina zidovudinu u pacientů s AIDS nebo ARC před a po podání 200 mg flukonazolu po dobu 15 dnů. Došlo k podstatnému zvýšení AUC (plochy pod křivkou plazmatické koncentrace) zidovudinu (20 %). Ve druhé, randomizované dvoufazově dvojitě zkřížené studii, byly zjišťovány hladiny zidovudinu u pacientů 5
6 s HIV. Ve dvou případech, s odstupem 21 dnů pacienti dostávali zidovudin 200 mg každých 8 hodin, a to buď samostatně nebo s flukonazolem v dávce 400 mg denně po dobu 7 dnů. Během současného podání s flukonazolem došlo k podstatnému zvýšení AUC zidovudinu (74%). Pacienti, kteří užívají tuto kombinaci by měli být monitorováni s ohledem na možnost rozvoje nežádoucích reakcí spojených s vyšší hladinou zidovudinu. Současné užívání flukonazolu s astemizolem nebo jinými léky metabolyzovanými systémem cytochromu P-450 může být spojeno se vzestupem sérových hladin těchtoléků. Než budou učiněny definitivní závěry, je třeba při souběžném podávání těchto léků s flukonazolem postupovat opatrně a nemocné pečlivě monitorovat. Interakční studie dále prokázaly, že orální vstřebávání flukonazolu se významně nezhoršuje při současném podávání spolu s jídlem, cimetidinem a antacidy a ani po celotělovém ozáření při transplataci kostní dřeně. Lékaři si musí být vědomi faktu, že studie interakcí s jinými léky nebyly dosud provedeny, ale že se stěmito interakcemi mohou setkat Těhotenství a kojení Podávání v době těhotenství: nebyly provedeny žádné kontrolované studie u těhotných žen, které užívaly flukonazol.vyskytly se zprávy o mnohočetných vrozených poruchách u novorozenců jejichž matky byly léčeny pro kokcidioidomykózu po 3 a více měsíců vysokými dávkami flukonazolu ( mg/den). Vztah mezi užíváním flukonazolu a těmito příhodami není jasný. U zvířat docházelo k nežádoucím účinkům na plod jen při podání vysokých dávek toxických pro matku. Nebyly popsány žádné účinky na plod při dávkách 5 nebo 10 mg/kg; zvýšená četnost anatomických zvláštností u plodu (nadpočetná žebra, dilatace ledvinné pánvičky) a opožděná osifikace byly pozorovány při dávkách 25 a 50 mg/kg a vyšších. Při dávkách v rozmezí od 80 mg/kg (průměrně vyšší než je doporučovaná dávka pro dospělé) do 320 mg/kg byla popisována zvýšená embryolethalita plodů potkanů, včetně abnormalit plodu zahrnující mimo jiné zvlněná žebra, rozštěp patra a abnormální kranio-faciální osifikace. Tyto účinky jsou shodné s inhibici syntézy estrogenu u potkanů, a mohou být výsledkem známých účinků sníženého množství estrogenu v těhotenství, při organogenezi a při porodu. Flukonazol se nedoporučuje podávat těhotným; ovšem s výjimkou pacientek s těžkými, život ohrožujícími fungálními infekcemi, u nichž očekávaný přínos léčby vyváží možné ohrožení plodu. Podávání během laktace Flukonazol proniká do mateřského mléka v koncentracích obdobných plazmatickým, proto je nevhodné ho podávat kojícím matkám Účinky na schopnost řídit a obsluhovat stroje Zkušenosti ukazují, že léčba flukonazolem pravděpodobně neovlivňuje schopnost řízení vozidla či obsluhy stroje Nežádoucí účinky Flukonazol Ardez je všeobecně dobře tolerován. Nejčastějšími nežádoucími účinky spojenými s užíváním flukonazolu jsou: Centrální a periferní nervový systém: bolesti hlavy. Dermatologické: vyrážka. Pokud u pacientů léčených pro povrchové mykotické infekce dojde k rozvoji rashe, 6
7 jehož vznik předpokládáme v souvislosti s podáváním flukonazolu, pak by měla být léčba přerušena. Pokud dojde k rozvoji rashe u pacientů léčených pro invazivní nebo systémovou mykózu, je třeba je pečlivě sledovat a pokud dojde k rozvoji bulózní dermatitídy, léčbu ihned přerušit. Gastrointestinální: nevolnost, bolesti v břiše, průjem a flatulence. U některých nemocných, obvykle s vážnou základní nemocí, zejména AIDS a maligními nádory, došlo v průběhu léčby flukonazolem nebo srovnatelnými přípravky ke změnám v renálních funkcích, hematologických výsledcích a k odchylkám v jaterních testech (viz Speciální upozornění), ale klinický význam všech těchto nálezů je sporný a jejich souvislost s léčbou nejistá. Jaterní/žlučové: jaterní toxicita včetně vzácných případů úmrtí, zvýšená hladina alkalické fosfatázy, zvýšená hladina bilirubinu, zvýšení AST, ALT. Další následující nežádoucí účinky se objevily v průběhu postmarketingového sledování: Centrální a priferni nervový systém: závratě, křeče. Dermatologické: alopecie, exfoliativní kožní poruchy včetně Stevens-Johnsonova syndromu a toxické epidermální nekrolýzy. Gastrointestinální: despepsie, zvracení. Hematopoetického a lymfatického systému: leukopenie včetně neutropenie a agranulocytózy, trombocytopenie. Imunologické: anafylaxe (včetně angioedemu, otoku tváře, svěděni). Jaterní/žlučové: jaterní selhání, hepatitida, hepatocelulární nekróza, žloutenka. Metabolické/nutriční: hypercholesterolemie, hypertriglycehdemie, hypokalemie. Ostatní: odchylky v chuťovém vnímání Předávkování Byly hlášeny případy předávkování flukonazolem, a v jednom případě u 42letého může, postiženého infekcí AIDS, po požití dávky 8200 mg flukonazolu došlo k rozvoji halucinací a paranoidního stavu. Pacient byl přijat do nemocnice a jeho stav se upravil během 48 hodin. Při předávkování je indikována symptomatická léčba (s eventuálními podpůrnými opatřeními a výplachem žaludku). Flukonazol je výrazně vylučován močí. Jeho eliminaci lze zřejmě urychlit forsírovanou volumovou diurézou. Tříhodinová hemodialýza sníží plazmatické hladiny přibližně o 50 %. 5. FARMAKOLOGICKÉ VLASTNOSTI Indikační skupina: antimykotikum. ATC skupina: J02AC01 7
8 5.1. Farmakodynamické vlastnosti Flukonazol, který patří do nové skupiny triazolových antifungálních přípravků, je silným, specifickým inhibitorem sterolové syntézy v houbách. Perorálně i intravenózně podaný flukonazol byl účinný v řadě fungálních infekcí na zvířecích modelech. Účinnost byla prokázána u oportunních mykóz způsobených druhy Candida spp., včetně systémové kandidózy imunokompromitovaných zvířat; dále u Cryptococcus neoformans, včetně intrakraniálních infekcí, u Microsporum spp. a u Trichophyton spp. Flukonazol byl účinný i u zvířecích modelů endemických mykóz, jako jsou infekce způsobené Blastomyces dermatitides, Coccidioides immitis, včetně intrakraniálních infekcí, Histoplasma capsulatum u normálních i imunosuprimovaných zvířat. Byly hlášeny případy superinfekce způsobené druhy Candidas jinými než Candida albicans, které nejsou většinou přirozeně citlivé k flukonazolu (např. Candida crusei). Takové případy mohou vyžadovat alternativní antimykotickou léčbu. Flukonazol vykazuje vysokou specifičnost vůči enzymům fungálních cytochromů P-450. V dávce 50 mg denně podávaný po 28 dní neovlivňoval plazmatické koncentrace testosteronu u mužů ani koncentrace steroidních hormonů u žen ve fertilním věku. Flukonazol mg denně neměl klinicky významný účinek na hladiny endogenních steroidů a hormonální odpověď po stimulaci ACTH u zdravých dobrovolníků. Interakční studie s antipyrinem ukázaly, že jedna ani více 50 mg dávek flukonazolu neovlivňuje metabolismus této látky Farmakokinetické vlastnosti Farmakokinetické vlastnosti flukonazolu jsou obdobné při intravenózním i perorálním podání. Perorálně podaný flukonazol se dobře vstřebává; plazmatické hladiny (a systémová biologická dostupnost) dosahují 90 % hladin po intravenózní aplikaci. Současné podání s jídlem perorální absorpci neovlivní. Po podání na lačno se vrchol plazmatické koncentrace objeví za minut a poločas eliminace z plazmy je přibližně 30 hodin. Plazmatické koncentrace jsou úměrné podané dávce. Devadesátiprocentního ustáleného stavu koncentrace v plazmě po opakovaném podání jedné denní dávky je dosaženo za 4 5 dnů. Podání iniciální dávky (první den léčby) ve výši dvojnásobku obvyklé denní dávky umožní dosáhnout 90ti procentního rovnovážného stavu již do druhého dne léčby. Distribuční objem léku se blíží celkové tělesné vodě. Vazba na bílkoviny plazmy je slabá (11 12 %). Flukonazol dobře proniká do všech tělesných tekutin. Ve slinách a sputu jsou koncentrace flukonazolu obdobné plazmatickým, v mozkomíšním moku dosahují u pacientů s mykotickou meningitidou přibližně 80% odpovídajících hladin v plazmě. Vysokých koncentrací v kůži, vyšších než v séru, dosahuje flukonazol ve stratům corneum, epidermis a dermis a ve vylučovaném potu. Akumuluje se ve stratům corneum. Při 1 denní dávce 50 mg byla koncentrace flukonazolu po 12 dnech 73 mikrogramů/g tkáně a 7 dní od ukončení léčby byla koncentrace stále ještě 5,8 mikrogramů/g tkáně. Při dávce 150 mg 1 týdně byla sedmý den koncentrace flukonazolu ve stratům corneum 23,4 mikrogramů/g tkáně a 7 dní po druhé dávce 7,1 mikrogramů/g tkáně. 8
9 Koncentrace flukonazolu v nehtech po 4 měsících užívání dávky 150 mg 1krát týdně byla 4,05 mikrogramů/g ve zdravých nehtech a 1,8 mikrogramů/g v postižených nehtech. Hladina flukonazolu byla v nehtech měřitelná ještě 6 měsíců po ukončení léčby. Nejvýznamnější exkreční cestou jsou ledviny; asi 80 % podané dávky se vylučuje do moči v nezměněné podobě. Clearance flukonazolu je přímo úměrná clearance kreatininu. Cirkulující metabolity nebyly prokázány. Dlouhý poločas eliminace z plazmy umožňuje léčbu jedinou dávkou používanou u vaginální kandidózy a dávkování 1 denně a 1 týdně u jiných indikací. Byla provedena studie srovnávající koncentrace ve slinách a v plazmě při jednotlivé dávce flukonazolu 100 mg podané buď v suspenzi, která byla 2 minuty ponechána v ústech a poté spolknuta nebo podané v tobolkách. Při užití suspenze byla nejvyšší koncentrace flukonazolu ve slinách pozorována 5 minut po požití a byla 182krát vyšší než nejvyšší koncentrace dosažená ve slinách 4 hodiny po požití tobolek. Zhruba po 4 hodinách byly v obou případech koncentrace flukonazolu ve slinách shodné. Nejvyšší AUC (0 96) ve slinách byly signifikantně vyšší u suspenze při srovnání s tobolkami. Nebyly pozorovány žádné rozdíly při eliminaci ze slin nebo v plazmatických farmakokinetických parametrech u obou lékových forem Předklinické údaje vztahující se k bezpečnosti Karcinogeneze Nebyl prokázán karcinogenní potenciál flukonazolu u myší a potkanů, léčených perorálně po 24 měsíců dávkami 2, 2,5, 5 nebo 10 mg/kg/den (přibližně 2 7krát vyššími dávkami než jsou doporučené pro člověka). U samců potkanů, léčených dávkami 5 a 10 mg/kg/den, byla zaznamenána zvýšená incidence hepatocelulárního adenomu. Mutageneze Flukonazol, následně po metabolické aktivaci, ale i bez ní, vykazoval negativní výsledky testu mutagenicity u 4 kmenů S. typhimurium a v systému myšího lymfomu L5178Y. Cytogenetické studie jak in vivo (buňky kostní dřeně myši po perorálním podání flukonazolu), tak in vitro (lidské lymfocyty vystavené dávce flukonazolu 1000 mikrogramů/ml) nepřinesly žádné známky chromozomálních mutací. Poruchy fertility Flukonazol neovlivňoval fertilitu samců a samic krys, léčených perorálními denními dávkami 5, 10 nebo 20 mg/kg nebo parenterálními dávkami 5, 25 nebo 75 mg/kg, ačkoli začátek porodu se při perorálních dávkách 20 mg/kg mírně opožďoval. Při perinatální studii na krysách při dávce léku 5, 20 a 40 mg/kg podaného intravenózně došlo u několika samic k funkčním poruchám děložních kontrakcí a prodloužení porodu. Postižené samice dostávaly 20 mg/kg (asi 5-15 násobek dávky doporučené u člověka) a 40 mg/kg. K ovlivnění porodu nedošlo při podávání dávky 5 mg/kg. Porodní poruchy způsobily zvýšený počet mrtvě narozených mláďat a zvýšily novorozeneckou úmrtnost při odpovídajícím dávkování. Ovlivnění porodu krys souvisí s druhově specifickým snížením estrogenů, jako následku vysokých dávek flukonazolu. Obdobné hormonální změny u žen užívajících flukonazol nenacházíme. (Viz. Farmakodynamické vlastnosti). 6. FARMACEUTICKÉ ÚDAJE 9
10 6.1.Seznam pomocných látek Intravenózní infúze Chlorid sodný, voda na injekci. Intravenózní infúze flukonazolu je isoosmotický, sterilní vodný roztok Inkompatibility Intravenózní injekce flukonazolu je kompatibilní s následujícími roztoky: a) 20% glukóza b) Ringerův roztok c) Hartmannův roztok d) chlorid draselný v glukóze e) 4,2%'bikarbonát sodný f) aminofusin g) fyziologický roztok. Flukonazol se podává zavedenou kanylou naředěný v jednom z výše uvedených roztoků. Ačkoli nebyla popsána žádná specifická inkompatibilita, nedoporučuje se před infúzí mísit flukonazol s jinými léky Doba použitelnosti 2 roky 6.4. Zvláštní opatření pro uchovávání Uchovávat při teplotě do 30 C, chraňte před mrazem Druh obalu a velikost balení Intravenózní infúze Silnostěnná lahvička z bezbarvého, čirého skla s propichovací zátkou, pertlovacím uzávěrem a víčkem, příbalová informace v jazyce českém, papírová skládačka. Velikost balení: inf.sol. 2 mg/ml Návod k použití přípravku, zacházením s ním a k jeho likvidaci Fluconazol Ardez je určen k intravenózní infúzi po naředění. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Ardez Pharma s.r.o., Praha, Česká republika 8. REGISTRAČNÍ ČÍSLO (A) 26/242/05-C 9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ DATUM REVIZE TEXTU
Složení Léčivá látka: Fluconazolum 2 mg v 1ml fyziologického roztoku, určeného pro intravenózní infuzi Pomocné látky: Chlorid sodný, voda na injekci.
 Příbalová informace RP Informace pro použití, čtěte pozorně! DIFLUCAN i.v. (Fluconazolum) Infuzní roztok Držitel rozhodnutí o registraci: Pfizer spol.s r.o., Praha, Česká republika Výrobce: Pfizer S.A.,
Příbalová informace RP Informace pro použití, čtěte pozorně! DIFLUCAN i.v. (Fluconazolum) Infuzní roztok Držitel rozhodnutí o registraci: Pfizer spol.s r.o., Praha, Česká republika Výrobce: Pfizer S.A.,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN- 50 FORCAN-150 FORCAN-200 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 50 mg, 150 mg nebo 200 mg v 1tvrdé tobolce;
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN- 50 FORCAN-150 FORCAN-200 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 50 mg, 150 mg nebo 200 mg v 1tvrdé tobolce;
2. CO MUSÍTE VĚDĚT NEŽ ZAČNETE FLUCONAZOL ARDEZ UŽÍVAT
 Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIFLUCAN i.v., infuzní roztok Diflucan 50 mg, tvrdé tobolky Diflucan 100 mg, tvrdé tobolky Diflucan 150 mg, tvrdé tobolky (fluconazolum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIFLUCAN i.v., infuzní roztok Diflucan 50 mg, tvrdé tobolky Diflucan 100 mg, tvrdé tobolky Diflucan 150 mg, tvrdé tobolky (fluconazolum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Celkové shrnutí vědeckého hodnocení přípravku Diflucan a souvisejících názvů (viz příloha I)
 PŘÍLOHA II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace předkládané Evropskou agenturou pro léčivé přípravky 31 Vědecké závěry Celkové
PŘÍLOHA II Vědecké závěry a zdůvodnění potřebných úprav souhrnu údajů o přípravku, označení na obalu a příbalové informace předkládané Evropskou agenturou pro léčivé přípravky 31 Vědecké závěry Celkové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Kvasinkové infekce kůže, zvláště způsobené rodem Candida (např. Candida albicans).
 sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
sp.zn. sukls69332/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Terbistad 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g krému obsahuje 10 mg terbinafini hydrochloridum. Pomocné látky se známým
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls161113/2009 a příloha sp. zn. sukls175411/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls161113/2009 a příloha sp. zn. sukls175411/2009 1. NÁZEV PŘÍPRAVKU Terfimed 250 Tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls161113/2009 a příloha sp. zn. sukls175411/2009 1. NÁZEV PŘÍPRAVKU Terfimed 250 Tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls100416/2012 a příloha ke sp. zn. sukls116705/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU P A R A L E N 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
Příloha č. 2 k rozhodnutí o opravě prodloužení registrace č.j.: sukls37854/2001 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU P A R A L E N 125 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta
sp.zn.: sukls201171/2012
 sp.zn.: sukls201171/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN - 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 150 mg v 1 tvrdé tobolce; Pomocné látky
sp.zn.: sukls201171/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORCAN - 150 tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: fluconazolum 150 mg v 1 tvrdé tobolce; Pomocné látky
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil DermGel Gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 mg terbinafini
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls105580/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil DermGel Gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 mg terbinafini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls204068/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej Kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini hydrochloridum
sp.zn.sukls204068/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej Kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tablety: Jedna tableta obsahuje 10 mg loratadinum. Sirup: Jeden ml sirupu obsahuje 1 mg loratadinum. Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tablety: Jedna tableta obsahuje 10 mg loratadinum. Sirup: Jeden ml sirupu obsahuje 1 mg loratadinum. Pomocné
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Pomocné látky: 1 ml také obsahuje 9 mg chloridu sodného (odpovídá 0,154 mmol sodíku)
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls21186/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Kabi 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls21186/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluconazol Kabi 2 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 50 ml infuzního
sp.zn.sukls196537/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej 10 mg/g kožní sprej, roztok
 sp.zn.sukls196537/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej 10 mg/g kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini
sp.zn.sukls196537/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lamisil Sprej 10 mg/g kožní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil Sprej obsahuje terbinafini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Muscoril cps. Jedna tvrdá tobolka obsahuje thiocolchicosidum 4 mg. Jedna ampule (2 ml) obsahuje thiocolchicosidum 4 mg.
 sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
sp.zn. sukls129911/2014 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
1/5. Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. EXACYL Injekční roztok
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 ke sdělení sp.zn.sukls38824/2012 1. NÁZEV PŘÍPRAVKU ANASTAR 1 MG Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje anastrozolum
Příloha č. 1 ke sdělení sp.zn.sukls38824/2012 1. NÁZEV PŘÍPRAVKU ANASTAR 1 MG Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje anastrozolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg Diflucan 100 mg Diflucan 150 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka obsahuje fluconazolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diflucan 50 mg Diflucan 100 mg Diflucan 150 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diflucan 50 mg Jedna tvrdá tobolka obsahuje fluconazolum
Pokyny pro podávání přípravku a sledování pacienta
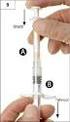 Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Pokyny pro podávání přípravku a sledování pacienta Informace pro lékaře a zdravotní sestry Červenec 2011 2 Úvod Tato příručka je určena předepisujícím lékařům a zdravotním sestrám a poskytuje praktický
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU. Chondrostad 1500 mg
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls30063/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Chondrostad 1500 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje 1884,0 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010
 Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
sp. zn. sukls85525/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GAVISCON LIQUID PEPPERMINT 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii alginas Natrii hydrogencarbonas Calcii carbonas 500,0 mg/10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls125919/2016 a sukls142652/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum
sp. zn. sukls125919/2016 a sukls142652/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42179/2007 1. NÁZEV PŘÍPRAVKU Ursofalk suspenze Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 5 ml Ursofalk suspenze
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42179/2007 1. NÁZEV PŘÍPRAVKU Ursofalk suspenze Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 5 ml Ursofalk suspenze
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls202096/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje fluconazolum 100 mg. Pomocné látky
sp. zn. sukls202096/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flukonazol PMCS 100 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje fluconazolum 100 mg. Pomocné látky
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
1. NÁZEV PŘÍPRAVKU MYCOSYST 150 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje fluconazolum 150 mg. Pomocné látky se známým účinkem: jedna tvrdá tobolka obsahuje
Jedna potahovaná tableta obsahuje glucosamini sulfas et natrii chloridum 942 mg, což odpovídá glucosamini sulfas 750 mg nebo glucosaminum 589 mg.
 sp.zn.sukls209140/2013 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prubeven 750 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje glucosamini sulfas
sp.zn.sukls209140/2013 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prubeven 750 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje glucosamini sulfas
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 krozhodnutí o změně registrace sp. zn. sukls239605/2009 a příloha k sp. zn. sukls137296/2009, sukls161897/2009, sukls161901/2009, sukls137266/2009, sukls33946/2010 1. NÁZEV PŘÍPRAVKU Bayflex
Příloha č. 3 krozhodnutí o změně registrace sp. zn. sukls239605/2009 a příloha k sp. zn. sukls137296/2009, sukls161897/2009, sukls161901/2009, sukls137266/2009, sukls33946/2010 1. NÁZEV PŘÍPRAVKU Bayflex
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014
 sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Příloha č.2 ke sdělení sp.zn.sukls7045/2013
 Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp. zn. sukls213851/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUKONAZOL PMCS 100 MG Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fluconazolum 100 mg v jedné tobolce
Příloha č. 3 ke sdělení sp. zn. sukls213851/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUKONAZOL PMCS 100 MG Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fluconazolum 100 mg v jedné tobolce
