3.1 Teplota a teplo Teplota
|
|
|
- Julie Sedláčková
- před 6 lety
- Počet zobrazení:
Transkript
1 3.1 Teplota a teplo Teplota t, T (angl. temperature) je stavová veličina, která se mění při zahřívání, nebo ochlazování tělesa, nebo soustavy těles měří se teploměry (nikoliv teplotoměry :-) kapalinové teploměry nezávisle na sobě sestrojili A. Celsius (0 C tání ledu, 100 C var vody) D. G. Farnheit (100 F teplota lidského těla) [t] = C Celsiův stupeň, vedlejší jednotka SI
2 Termodynamická (absolutní) teplota Teplota T byla nejdřív experimentálně zavedena jako stavová veličina, kterou měří teploměr (výška sloupce rtuti) proto jsou na Celsiově i Farnheitové stupnici kladné i záporné teploty s rozvojem fyzikální teorie nazvané termodynamika byla objevena absolutní nula, pod kterou není možné klesnout a zavedena termodynamická teplota [T] = K kelvin, hlavní a základní jednotka SI
3 Termodynamická (absolutní) teplota Teplota T William Thomson = lord Kelvin ponechal velikost dílku stupnice stejnou jakou stanovil Anders Celsius, ale nulu posunul na teplotu mezní absolutní nuly proto jsou převodní vztahy jednoduché T = ({t} + 273,15) K t = ({T} - 273,15) C termodynamická teplota nemůže být záporná, proto se jí říká také absolutní teplota [T] = K kelvin, hlavní a základní jednotka SI
4 Termodynamická (absolutní) teplota Teplota T William Thomson = lord Kelvin ponechal velikost dílku stupnice stejnou jakou stanovil Anders Celsius, ale nulu posunul na teplotu mezní absolutní nuly proto jsou převodní vztahy jednoduché T = ({t} + 273,15) K t = ({T} - 273,15) C termodynamická teplota nemůže být záporná, proto se jí říká také absolutní teplota [T] = K kelvin, hlavní a základní jednotka SI
5 Teplo a vnitřní energie tělesa Teplo Q (angl. quantity of heat) není stavová veličina, protože nemá smysl říkat, že v nějakém tělese (soustavě) je určité množství tepla teplo je dějová veličina popisující předávání vnitřní energie teplejším a chladnějším tělesem v průběhu vyrovnávání jejich teplot proto má stejnou jednotku jako práce W, která určuje předávání energie jednoho tělesa druhému (zde může jít o vnější mechanickou energii či o vnitřní energii) [Q] = J joule
6 Teplota a její měření - teploměry Teploměry kapalinové rtuťový (t t = -38,8 C, t v = 356,7 C) lihový (obarvený etanol, t t = -114,4 C) bimetalový plynový elektronické termistorový (el. odpor se mění s teplotou) termoelektrický (termočlánek el. napětí) tekuté krystaly mění barvu dle teploty (nepřesné)
7 Teplota a teploměry - zajímavosti Zajímavé teploměry lékařský maximální teploměr Jak je možné, že po změření teploty rtuť neklesá? maximo-minimální teploměr (trubička ve tvaru U) Jak funguje? Jak se vynuluje? termograf zapisovací teploměr používaný v meteorologii termostat spínací teploměr sloužící k udržení nastavené teploty (pračka, žehlička, elektrická trouba, ) Navrhněte konstrukci takového termostatu!
8 3.1p Vnitřní energie, tepelná výměna Vnitřní energie U je součtem kinetických a potenciálních energií částic, z nichž je těleso složeno, a vazeb mezi nimi protože každé těleso je z pohledu termiky soustavou mnoha částic (molekul, atomů, iontů), užíváme místo pojmu těleso pojem termodynamická soustava vnitřní energii soustavy může měnit trojí vzájemné působení s okolím okolím (oběma směry) konání práce tepelná výměna látková výměna soustava okolí
9 Změna vnitřní energie konáním práce Změna vnitřní energie DU = W tření dlaní pro zahřátí, když je nám zima rozdělávání ohně třením dvou dřev (v pravěku) zahřívání materiálu při obrábění (broušení, řezání, vrtání, soustružení, ) hoření meteoroidů v atmosféře ( padající hvězdy ) opačný směr = soustava konající práci na úkor své vnitřní energie = tepelný stroj (např. parní stroj, či spalovací motory v automobilech)
10 Změna vn. energie tepelnou výměnou Změna vnitřní energie DU = Q teplejší těleso předává teplo Q chladnějšímu tělesu tak dlouho, dokud se teploty nevyrovnají dříve si fyzikové mysleli, že teplo je zvláštní tekutina, která nemá žádnou hmotnost, a přelévá se vždycky z teplejšího tělesa do chladnějšího dnes víme, že to tak není, ale energii si předávají částice obou těles při vzájemných srážkách přitom celková vnitřní energie chladnějšího tělesa roste (což se projeví zvyšováním jeho teploty) a celková vnitřní energie teplejšího tělesa klesá
11 Tři způsoby tepelné výměny Změna vnitřní energie tepelnou výměnou DU = Q vedení (kondukce) proudění (konvekce) zářením (radiací) neboli sáláním Tepelná vodivost se u různých látek velmi liší: vodiče X izolanty velmi dobré vodiče tepla jsou kovy (hliník, měď) izolanty jsou sklo, porcelán, voda, vzduch, vakuum voda i vzduch však mohou snadno proudit
12 Tři způsoby tepelné výměny Proudění tekutin a tepelná výměna teplá tekutina stoupá nahoru, chladná klesá dolů pokud je umožněna cirkulace (tekutina samovolně proudí v nádobě, místnosti apod.) dochází k rychlé výměně tepla pokud nedochází k cirkulaci samovolně, můžeme jí pomoci (míchání horké polévky, oběhové čerpadlo v systému ústředního topení) efektní experiment: zahřívání zkumavky s ledem od jejího středu
13 3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní
14 Látka a změna vnitřní energie Změna vnitřní energie tělesa se projeví změnou teploty t látky, z níž je těleso vytvořeno tepelná kapacita C tělesa měrná tepelná kapacita c látky změnou skupenství látky, z níž je těleso vytvořeno skupenské teplo tání L t vypařování L v měrné skupenské teplo tání l t vypař. l v
15 Změna teploty látky - kalorimetrie Tepelná kapacita tělesa C (angl. capacity) dodáme-li tělesu teplo Q, vzroste jeho teplota o D t [C] = J.K -1 nebo J. C -1 Měrná tepelná kapacita látky c dodáme-li 1 kg látky teplo Q, vzroste jeho teplota o D t [c] = J.kg -1.K -1 nebo J.kg -1. C -1 C = Q D t c = C m = Q m D t Q = c m D t
16 Kalorimetrická rovnice Teplo Q 1 odevzdané 1. tělesem je rovno teplu Q 2 přijatému 2. tělesem (t 1 > t 2 ): Q 1 = Q 2 c 1 m 1 t 1 t = c 2 m 2 t t 2 Z kalorimetrické rovnice vypočítáme kteroukoliv veličinu, známe-li hodnoty všech zbývajících veličin.
17 Tání a tuhnutí látky Skupenské teplo tání tělesa L t (angl. latent heat) dodáme-li tělesu teplo L t, celé roztaje, aniž by se jeho teplota nějak změnila (latentní = skryté teplo) [L t ] = J Měrné skupenské teplo tání látky l t dodáme-li 1 kg látky teplo L t, roztaje, aniž by změnila teplotu [l t ] = J.kg -1 l t = L t m Při tuhnutí těleso uvolňuje teplo L t do svého okolí.
18 Látky krystalické a amorfní Látky krystalické a amorfní při tání a tuhnutí látky krystalické mají přesnou teplotu tání při dosažení této teploty se narůstání teploty zastaví a veškerý růst vnitřní energie se projevuje táním, směs pevné látky a kapaliny si udržuje stálou teplotu až do doby než všechna pevná látka roztaje látky amorfní nemají přesnou teplotu tání během určitého rozmezí teplot postupně měknou ( těstovatí ) a při přechodu postupně ztrácí svoji pevnost a čím dál tím víc se podobají kapalinám
19 Vypařování a zkapalňování látky Skupenské teplo vypařování tělesa L v je teplo potřebné k vypaření celého tělesa, přitom se ovšem může také měnit teplota tělesa, protože vypařování (na rozdíl od tání) probíhá za jakékoli teploty (ale, s výjimkou varu, jen z povrchu kapaliny) L v je latentní = skryté teplo; Q = c m Dt je teplo, které se projeví změnou teploty kapaliny [L v ] = J zvláštním způsobem vypařování je var kapaliny, při kterém se všechno teplo využívá na změnu skupenství a kapalina se vypařuje v celém objemu
20 Vypařování a zkapalňování látky Měrné skupenské teplo vypařování látky l v lze změřit při varu látky dodáme-li vroucí kapalině teplo {l v } J, vypaří se jí 1 kg [l t ] = J.kg -1 l v = L v m var kapaliny nastává při teplotě varu t v teplota varu kapaliny silně závisí na vnějším tlaku ve velehorách teplota varu nestačí k uvaření jídla naopak v tlakovém (Papinově) hrnci se maso uvaří mnohem rychleji než v obyčejném hrnci
21 Vypařování a vody v praxi Vypařuje se voda za jakékoli teploty? vyprané prádlo uschne na šňůře i v zimě louže vyschnou i za chladného, ale slunečného počasí Závisí teplota varu vody na vnějším tlaku? vezměte sebou do hor (na hřebeny) plynový vařič a laboratorní teploměr; zjistěte (podle mapy) svoji nadmořskou výšku a změřte teplotu varu vody (a nezapomeňte si uvařit čaj :-) vysvětlete efektní experiment (voda v baňce se začne vařit ve chvíli, kdy baňku polijeme studenou vodou)
22 Fázový diagram a trojný bod I pevná látka II kapalina III plyn K T kritický bod trojný bod I-II křivka tání I-III křivka sublimace T-K... křivka syté páry
23 Zajímavosti okolo skupenství látek Jsou ještě další skupenství hmoty? čtvrtým skupenstvím hmoty je plazma, tj. velmi žhavý a silně ionizovaný plyn zvláštní je např. také látka tvořící neutronové hvězdy jiná skupenství hmoty tedy hledejme ve Vesmíru Jaká je definice jednotky termodynamické teploty? kelvin je 1/273,16 díl termodynamické teploty trojného bodu vody to znamená, že teplota trojného bodu vody je 273,16 K, tedy 0,01 C
24 3.3 Částicová stavba látky Malé (nejmenší) částice látky očekávali nejprve filozofové (atomisté) a nazvali je atomy (z řeckého atomos = nedělitelný) starověké Řecko a Řím. Mnohem později chemici zjistili, že látky se slučují vždy v určitých hmotnostních poměrech, což lze vysvětlit existencí nejmenších částeček hmoty, které nazvali molekuly (lat. molekula = hmotička). Dnes víme, že i molekuly a atomy lze dále rozdělit, že mají svoji vnitřní strukturu.
25 Molekuly a jejich tepelný pohyb Řadu vlastností látek všech skupenství je možné vysvětlit pomocí molekul (atomy můžeme pokládat za jednoatomové molekuly), aniž bychom je dále pitvali (zkoumali jejich vnitřní strukturu). Jednou z typických vlastností molekul je neustálý a neuspořádaný pohyb, který nazýváme tepelný pohyb. Tento pohyb nemůžeme vidět, ale jeho důsledky pozorovat můžeme.
26 Důsledky tepelného pohybu molekul Difuze vzájemné pronikání a mísení dvou látek stejného skupenství (vůně ve vzduchu, barvivo ve vodě) Osmóza pronikání organických látek buněčnou stěnou Brownův jev můžeme pozorovat pod mikroskopem například na kapkách tuku v silně zředěném mléce (Robert Brown jej pozoroval na pylových zrnkách)
27 Mezimolekulové síly Mezimolekulové síly jsou při malých vzdálenostech odpudivé, při o něco větších vzdálenostech se mění na přitažlivé a s dalším zvětšováním vzdálenosti rychle slábnou. Způsobují soudržnost a přilnavost. Soudržnost (koheze) je síla držící těleso pohromadě. Přilnavost (adheze) je síla mezi dvěma hladkými povrchy (např. dvěma skleněnými deskami položenými na sobě).
28 Látkové množství Látkové množství n je dáno počtem molekul (nebo jiných částic = atomů, iontů, apod.) v daném tělese (látkové soustavě). [n] = mol Látková soustava má látkové množství 1 mol, jestliže obsahuje právě tolik částic, kolik je atomů v nuklidu uhlíku C12 o hmotnosti 12 g. Ale kolik tam těch částic je? Zkuste odhadnout!
29 Avogadrova konstanta udává počet částic v 1 mol látky. Experimentálně byla zjištěna hodnota N A = 6, mol -1 Vzpomeňme si na definici jednotky mol a vypočtěme hmotnost atomu uhlíku C12 m C12 = m N A = 0,012 kg 6, , kg A odtud snadno dopočítáme (i když ne zcela přesně!) hmotnost jednoho nukleonu (protonu nebo neutronu).
30 Atomová hmotnostní konstanta neboli unifikovaná atomová hmotnostní jednotka u = 1, je přibližně rovna hmotnosti jednoho nukleonu a vypočítáme pomocí ní přesně hmotnosti 1 atomu, či 1 molekuly, známe-li jejich relativní atomovou hmotnost A r, nebo relativní molekulovo hmotnost M r. kg m a = u A r m m = u M r
31 Molární hmotnost a molární objem jsou veličiny vztažené na 1 mol látky. Tedy hmotnost m, nebo objem V, celé látkové soustavy vydělíme látkovým množstvím n: M m = m n V m = V n Molární hmotnost můžeme ovšem spočítat také z hmotnosti jedné molekuly látky, jestliže ji vynásobíme Avogadrovou konstantou: M m = N A m m = N A u M r
32 Molekuly a skupenství látek Plyn Vzdálenosti mezi molekulami >> rozměry molekul, proto s už neprojevují přitažlivé síly. Při srážce molekul se projeví odpudivé síly, proto je můžeme považovat za dokonale pružné. Mezi srážkami se molekuly plynu pohybují RPP (platí pro ně 1. NPZ) různými rychlostmi a směry. Tlak plynu je dán současnými nárazy velkého počtu molekul na stěny nádoby. Plynem se budeme později podrobně zabývat.
33 Molekuly a skupenství látek Kapalina Vzdálenosti mezi molekulami rozměry molekul (obojí je řádově 0,1 nm = m), proto na každou molekulu působí přitažlivé síly sousedních molekul. Molekuly kmitají kolem své rovnovážné polohy *), nebo si i mohou vyměnit místo s některou sousední molekulou (tekutost). *) O jaký typ rovnovážné polohy se jedná? Zvláštní situace je v povrchové vrstvě kapaliny.
34 Povrchová síla, povrchové napětí Povrchová vrstva kapaliny se zdánlivě chová jako pružná blána, protože síly přitažlivosti mezi molekulami působí pouze směrem dovnitř kapaliny. Síly se snaží povrchové molekuly vtahovat dovnitř, což vysvětluje kulový tvar malých volných kapek i vznik výše uvedené blány, po které např. běhají vodoměrky, nebo na ni můžeme opatrně položit lehkou minci.
35 Kapilární jevy (elevace a deprese) Kapilární elevace pokud kapalina smáčí stěny nádoby (např. voda smáčí sklo), vystoupí v důsledku povrchového napětí v tenké trubičce (kapiláře) výše než je výška hladiny kapaliny v jejím okolí. Kapilární deprese pokud kapalina nesmáčí stěny nádoby (např. rtuť nesmáčí sklo), klesne v důsledku povrchového napětí v tenké trubičce (kapiláře) níž než je výška hladiny kapaliny v jejím okolí.
36 3.3p Krystaly, teplotní roztažnost V pevných látkách jsou molekuly (atomy, ionty, ) pevně vázány. Mohou jen kmitat kolem rovnovážné polohy. Pevné látky můžeme rozdělit na látky monokrystalické polykrystalické amorfní
37 Monokrystaly a polykrystalické látky Monokrystaly Jsou-li částice pravidelně uspořádány v celém objemu tělesa, vytvářejí okem viditelné pravidelné těleso, tzv. monokrystal. Polykrystalická látka je složena z velkého množství malých krystalů (zrn), které jsou uspořádány nahodile. Jednotlivá zrna nejsou vidět pouhým okem, ale dobře je můžeme pozorovat pod mikroskopem.
38 Amorfní (beztvaré) látky Amorfní látky (beztvaré látky) nemají částice pravidelně uspořádané ani v mikroskopickém měřítku (ani pod mikroskopem bychom neviděli krystalická zrna). Jejich vlastnosti se blíží vlastnostem kapalin. Příklady amorfních látek sklo, vosk, parafin, plasty Sklo velmi pomalu teče. Zahřátím lze tuto tekutost výrazně zvýšit a sklo tvarovat.
39 Amorfní a polykrystalické látky Jak od sebe odlišíme amorfní a polykrystalickou látku? Mikroskopem Vybroušený a vyleštěný kousek dáme pod mikroskop (komparační mikroskop umožňuje nasvícení vzorku shora). Pozorujeme-li drobná krystalická zrna, jde o polykrystalickou látku. Tavením Má-li látka nízký bod tání (abychom mohli použít rtuťový teploměr), budeme měřit teplotu zahřívané látky v závislosti na čase. Jakou křivku naměříme?
40 Teplotní roztažnost látek Pevné látky Zjišťujeme délkovou i objemovou teplotní roztažnost. Musíme s ní počítat při budování železnic, potrubí, elektrického vedení vysokého napětí, mostů, Různá roztažnost 2 různých kovů se používá u tzv. bimetalových teploměrů a termostatů. Kapaliny Jsou tekuté (mění tvar), proto nemají délkovou, ale jen objemovou teplotní roztažnost. Přibývající celkový objem se může projevit stoupáním kapaliny v měřicí trubičce teploměru (rtuť, obarvený líh).
41 Teplotní roztažnost látek Délková t 0, l 0 počáteční teplota a délka tyče t, l konečná teplota a délka tyče a teplotní součinitel délkové roztažnosti Objemová l = l 0 [1 a t t 0 ] V = V 0 [1 b t t 0 ]
42 Teplotní součinitelé roztažnosti U pevných látek platí b 3a Hodnoty a pro některé kovy olovo 2, K -1 hliník 2, K -1 měď 1, K -1 železo 1, K -1 wolfram 0, K -1
43 3.4 Ideální plyn Ideální plyn - makroskopicky bez vnitřního tření (tj. dokonale tekutý) dokonale stlačitelný Ideální plyn - mikroskopicky rozměry molekul plynu jsou zanedbatelně malé v porovnání se vzdálenostmi mezi nimi přitažlivé síly mezi molekulami jsou velmi slabé, takže je můžeme také zanedbat srážky mezi molekulami navzájem a se stěnami nádoby jsou dokonale pružné (platí pro ně ZZE)
44 Ideální plyn při stálé teplotě Stálá teplota izotermický děj platí pro něj Boylův Mariotův zákon součin tlaku a objemu plynu zůstává konstantní p 1 V 1 = p 2 V 2 nebo pv = konst.
45 Ideální plyn adiabaticky izolovaný Adiabaticky izolovaná soustava adiabatický děj neprobíhá tepelná výměna s okolím (nestíhá!) platí pro něj Poissonův zákon součin tlaku a objemu umocněného na exponent kappa (Poissonova konstanta) zůstává konstantní p 1 V 1 = p 2 V 2 nebo pv = konst. Poisonnova konstanta je pro jednoatomové plyny 5/3 a pro dvouatomové plyny 7/5
46 Izoterma a adiabata v p-v diagramu
47 Ideální plyn při stálém tlaku Stálý tlak izobarický děj platí pro něj Gay Lussacův zákon objem plynu se mění přímo úměrně jeho absolutní teplotě (teplotě T v kelvinech) jinak řečeno: poměr objemu plynu k jeho absolutní teplotě zůstává konstantní V 1 T 1 = V 2 T 2 nebo V T = konst.
48 Ideální plyn při stálém objemu Stálý objem izochorický děj platí pro něj Charlesův zákon tlak plynu se mění přímo úměrně jeho absolutní teplotě (teplotě T v kelvinech) jinak řečeno: poměr tlaku plynu k jeho absolutní teplotě zůstává konstantní p 1 T 1 = p 2 T 2 nebo p T = konst.
49 Izobara a izochora v p-v diagramu
50 Odvození stavové rovnice Odvození stavové rovnice ideálního plynu z Gay-Lussacova a Boyle-Mariottova zákona z počátečního stavu p 0, V 0, T 0 nejprve izobaricky zvýšíme teplotu na hodnotu T, přitom objem se zvětší na hodnotu V 1 ve druhém kroku izotermicky zvýšíme tlak z počátečního p 0 na konečný tlak p, přitom se objem změní z V 1 na V V 1 T = V 0 T 0 a pv = p 0 V 1
51 Odvození stavové rovnice Z obou rovnic vyjádříme V 1 V 1 = V 0 T a V T 1 = p V 0 p 0 a sestavíme rovnici p V = V 0 T p 0 T 0 kterou upravíme na tvar p V T = p 0 obecný tvar rovnice ideálního plynu V 0 T 0 = konst.
52 Molární plynová konstanta R Konstanta na pravé straně rovnice je rovna n R p V T = konst. p V T = n R kde n je látkové množství plynu a R = 8,31 J.K -1.mol -1 je molární plynová konstanta. Stavovou rovnici pak píšeme ve tvaru: p V = n RT
53 3.5 Základy termodynamiky Termodynamika zkoumá zákony přeměn různých druhů energie klíčovými pojmy jsou vnitřní energie soustavy, teplo, práce vnějších sil Tři zákony termodynamiky 1. TDZ je důsledkem ZZE 2. TDZ má dvě různé formulace, v té druhé se setkáme s perpetuem mobile druhého druhu 3. TDZ nám lépe objasní pojem absolutní nuly u termodynamické (Kelvinovy) teploty
54 První termodynamický zákon 1. TDZ je důsledkem ZZE Přírůstek DU vnitřní energie soustavy se rovná součtu práce W vykonaná okolními tělesy působícími na soustavu silami a tepla Q odevzdaného okolními tělesy soustavě. D U = W Q místo přírůstku (+) vnitřní energie můžeme mít její úbytek (-) místo práce konané okolím (+) může práci konat soustava (-) místo tepla odevzdaného okolními tělesy soustavě (+) můžeme uvažovat teplo přijaté okolními tělesy od soustavy (-)
55 Druhý termodynamický zákon 2. TDZ používají se dvě ekvivalentní (ale na první pohled rozdílné) formulace má statistickou povahu, říkáme-li nemůže, myslíme, že to má stejně nepatrnou pravděpodobnost, jako že hodíme šestku x po sobě První formulace 2. TDZ Při tepelné výměně těleso o vyšší teplotě nemůže samovolně přijímat teplo od tělesa s nižší teplotou.
56 Druhý termodynamický zákon Druhá formulace 2. TDZ Nelze sestrojit perpetuum mobile druhého druhu. Perpetuum mobile druhého druhu je periodicky pracující tepelný stroj, který pouze přijímá teplo od určitého tělesa (ohřívače) a koná stejně velkou mechanickou práci. Skutečný tepelný stroj může zužitkovat (využít ke konání práce) jen část tepla přijatého od ohřívače a část tepla musí vždy odevzdat chladiči.
57 Účinnost tepelného stroje Tepelný stroj pracuje cyklicky a v každém cyklu přijme od ohřívače teplo Q 1 odevzdá chladiči teplo Q 2 vykoná práci W = Q 1 - Q 2 jeho účinnost tedy je = W Q 1 = Q 1 Q 2 Q 1 = 1 Q 2 Q 1
58 Účinnost tepelného stroje Sadi Carnot francouzský inženýr odvodil vztah pro maximální teoreticky možnou účinnost cyklicky pracujícího tepelného stroje je-li teplota ohřívače T 1 a teplota chladiče T 2 max = T 1 T 2 T 1 = 1 T 2 T 1 jedná se o termodynamické (absolutní) teploty!
59 Třetí termodynamický zákon 3. TDZ Nulové termodynamické teploty (tzv. absolutní nuly) nelze žádným způsobem dosáhnout. Důkaz 3. TDZ důkaz provedeme sporem Kdyby šlo dosáhnout absolutní nuly, použili bychom takto ochlazené těleso jako chladič pro Carnotův tepelný stroj, ten by ale měl účinnost 100 % a měnil by všechno přijaté teplo na práci. Tak bychom získali perpetuum mobile druhého druhu, což je spor s 2. TDZ!
60 3.5p Tepelné motory Tepelné motory přehled s vnějším spalováním parní stroj parní a plynové turbíny Stirlingův stroj s vnitřním spalováním zážehový (čtyřdobý, dvoudobý, Wankelův) vznětový (nazývaný též Dieselův) spalovací turbíny (např. proudový motor, dvouproudový motor, raketové motory; turbovrtulový motor,...)
61 Vznětový motor čtyřdobý Nejperspektivnější typ motoru v silniční dopravě kromě energetických a ekonomických hledisek je dnes důležité také ekologické hledisko nejlépe z tepelných motorů vychází čtyřdobé vznětové motory, palivem je zpravidla nafta nebo stlačený zemní plyn zvýšení výkonu a účinnosti motoru a snížení emisí se dosahuje přeplňováním turbodmýchadlem a elektronicky řízeným vstřikováním paliva (Common Rail)
62 Váš projekt Tepelný motor tepelných motorů je celá řada, vyberte si podle toho, co vás zajímá (parní stroje, parní lokomotivy, osobní či nákladní automobily, lodě, letadla, kosmonautika, ekologie, ) a domluvte si téma s učitelem fyziky o svém typu motoru zjistěte co nejvíc (kdy a kým byl vynalezen, zdokonalen, použit v sériové výrobě, jaké jsou jeho parametry především výkon a účinnost, ale také hmotnost, hlučnost,...) o svém typu motoru napište stručné pojednání (jednu až dvě strany A4 v textovém editoru písmem 12pt) s vhodnými ilustracemi (schéma, fotografie, )
63 3.6 Velmi nízké a vysoké teploty Velmi nízké teploty na povrchu planety Země t <-40 C, +40 C> rtuť tuhne při -38,8 C; etanol (líh) při -114,4 C dusík má teplotu varu -195,8 C kapalný dusík se používá v biologii a medicíně k uchování spermií, vajíček, vzorků tkání, ve fyzice se používá k chlazení některých experimentálních aparatur a detektorů záření kapalný dusík se vyrábí ve velkém množství Proč zrovna dusík? (Jaké je složení vzduchu?)
64 Kapalné hélium a supratekutost Velmi nízké teploty nejdéle odolávalo zkapalnění hélium (1908) teplotu varu helia je jen 4,2 K (dusíku 77,35 K) kapalné helium je supratekuté vodiče ochlazené na teplotu kapalného hélia jsou supravodivé (zcela ztrácí elektrický odpor) lze dosáhnout ještě nižší teploty, přitom objevují nebo experimentálně ověřují zvláštní vlastnosti hmoty teplotě absolutní nuly se lze hodně přiblížit, ale nelze jí přesně dosáhnout (viz 3. TDZ)
65 Velmi vysoké teploty, plazma Velmi vysoké teploty na povrchu planety Země t <-40 C, +40 C> rtuť vaří při -356,7 C; etanol (líh) při 78,3 C vysoce ionizovaný plyn (elektrony se odpoutávají od jader atomů) se nazývá plazma vysoké teploty vznikají v důsledku termojaderných reakcí v nitru hvězd povrch našeho Slunce má teplotu asi C v nitru našeho Slunce je teplota asi C v nitru jiných hvězd může být ještě 100 x větší
66 Umělé Slunce na planetě Zemi? Umělá řízená termojaderná reakce jedním ze snů fyziků a techniků je možnost využití termojaderné reakce pro výrobu elektrické energie prozatím zůstává snem a daří se jen na velmi krátkou dobu v tokamaku (magnetická nádoba) pouze několik sekund až minut (tj není stabilní) ohřátím malého množství plynu pomocí pulzů záření výkoných laserů soustředěných na jedno místo (reakce se udrží jen zlomek sekundy)
67 Slunce přírodní X umělé Umělá řízená termojaderná reakce Proč se nám ji nedaří udržet, když na Slunci probíhá přírodní reakce samovolně miliardy let? Velmi horké a relativně husté plazma drží pohromadě gravitační síla, která je obrovská díky velké hmotnosti Slunce. Tak velké síly neumíme zatím na Zemi dosáhnout! Jakou povahu by musely mít síly držící pohromadě umělé Slunce? Zjistěte co je to tokamak!
68 Určeno pro prezentaci přednášky Vybrané kapitoly z fyziky pro studenty OVP. Byly použity materiály z které vycházejí z učebnice Ivan Štoll: Fyzika pro netechnické obory SOŠ a SOU, Prometheus, Praha 2001
3.3 Částicová stavba látky
 3.3 Částicová stavba látky Malé (nejmenší) částice látky očekávali nejprve filozofové (atomisté) a nazvali je atomy (z řeckého atomos = nedělitelný) starověké Řecko a Řím. Mnohem později chemici zjistili,
3.3 Částicová stavba látky Malé (nejmenší) částice látky očekávali nejprve filozofové (atomisté) a nazvali je atomy (z řeckého atomos = nedělitelný) starověké Řecko a Řím. Mnohem později chemici zjistili,
3.2 Látka a její skupenství
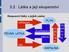 3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
3.2 Látka a její skupenství Skupenství látky a jejich změny sublimace PEVNÁ LÁTKA tání desublimace tuhnutí PLYN vy pa řo vá ní KAPALINA zka pal ňo vá ní Látka a změna vnitřní energie Změna vnitřní energie
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické
![Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické Termodynamika. T [K ]=t [ 0 C] 273,15 T [ K ]= t [ 0 C] termodynamická teplota: Stavy hmoty. jednotka: 1 K (kelvin) = 1/273,16 část termodynamické](/thumbs/24/2778201.jpg) Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Termodynamika termodynamická teplota: Stavy hmoty jednotka: 1 K (kelvin) = 1/273,16 část termodynamické teploty trojného bodu vody (273,16 K = 0,01 o C). 0 o C = 273,15 K T [K ]=t [ 0 C] 273,15 T [ K ]=
Ideální plyn. Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, Tepelné motory
 Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
Struktura a vlastnosti plynů Ideální plyn Vlastnosti ideálního plynu: Ideální plyn Stavová rovnice Děje v ideálním plynu Práce plynu, Kruhový děj, epelné motory rozměry molekul jsou ve srovnání se střední
IDEÁLNÍ PLYN. Stavová rovnice
 IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
IDEÁLNÍ PLYN Stavová rovnice Ideální plyn ) rozměry molekul jsou zanedbatelné vzhledem k jejich vzdálenostem 2) molekuly plynu na sebe působí jen při vzájemných srážkách 3) všechny srážky jsou dokonale
Molekulová fyzika a termika. Přehled základních pojmů
 Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika Přehled základních pojmů Kinetická teorie látek Vychází ze tří experimentálně ověřených poznatků: 1) Látky se skládají z částic - molekul, atomů nebo iontů, mezi nimiž jsou
Molekulová fyzika a termika:
 Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
Molekulová fyzika a termika: 1. Měření teploty: 2. Délková roztažnost a Objemová roztažnost látek 3. Bimetal 4. Anomálie vody 5. Částicová stavba látek, vlastnosti látek 6. Atomová hmotnostní konstanta
Základy molekulové fyziky a termodynamiky
 Základy molekulové fyziky a termodynamiky Molekulová fyzika je částí fyziky, která zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného silového působení částic, z nichž jsou
Základy molekulové fyziky a termodynamiky Molekulová fyzika je částí fyziky, která zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného silového působení částic, z nichž jsou
LOGO. Molekulová fyzika
 Molekulová fyzika Molekulová fyzika Molekulová fyzika vysvětluje fyzikální jevy na základě znalosti jejich částicové struktury. Jejím základem je kinetická teorie látek (KTL). KTL obsahuje tři tvrzení:
Molekulová fyzika Molekulová fyzika Molekulová fyzika vysvětluje fyzikální jevy na základě znalosti jejich částicové struktury. Jejím základem je kinetická teorie látek (KTL). KTL obsahuje tři tvrzení:
Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Molekulová fyzika, termika 2. ročník, sexta 2 hodiny týdně Fyzikální učebna vybavená audiovizuální technikou, interaktivní tabule, fyzikální pomůcky
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO.
 CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
CELKOVÉ OPAKOVÁNÍ UČIVA + ZÁPIS DO ŠKOLNÍHO SEŠITU část 03 VNITŘNÍ ENERGIE, TEPLO. 01) Složení látek opakování učiva 6. ročníku: Všechny látky jsou složeny z částic nepatrných rozměrů (tj. atomy, molekuly,
Fyzikální vzdělávání. 1. ročník. Učební obor: Kuchař číšník Kadeřník. Implementace ICT do výuky č. CZ.1.07/1.1.02/02.0012 GG OP VK
 Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
Fyzikální vzdělávání 1. ročník Učební obor: Kuchař číšník Kadeřník 1 2 Termika 2.1Teplota, teplotní roztažnost látek 2.2 Teplo a práce, přeměny vnitřní energie tělesa 2.3 Tepelné motory 2.4 Struktura pevných
ÚVODNÍ POJMY, VNITŘNÍ ENERGIE, PRÁCE A TEPLO POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D08_Z_OPAK_T_Uvodni_pojmy_vnitrni_energie _prace_teplo_t Člověk a příroda Fyzika
Látkové množství n poznámky 6.A GVN
 Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
Látkové množství n poznámky 6.A GVN 10. září 2007 charakterizuje látky z hlediska počtu částic (molekul, atomů, iontů), které tato látka obsahuje je-li v tělese z homogenní látky N částic, pak látkové
PLYNNÉ LÁTKY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
PLYNNÉ LÁTKY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Ideální plyn Po molekulách ideálního plynu požadujeme: 1.Rozměry molekul ideálního plynu jsou ve srovnání se střední vzdáleností molekul
TEPELNÉ JEVY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie
 TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
TEPELNÉ JEVY Mgr. Jan Ptáčník - GJVJ - Fyzika - Tercie Vnitřní energie tělesa Každé těleso se skládá z látek. Látky se skládají z částic. neustálý neuspořádaný pohyb kinetická energie vzájemné působení
VNITŘNÍ ENERGIE. Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika
 VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
VNITŘNÍ ENERGIE Mgr. Jan Ptáčník - GJVJ - Fyzika - 2. ročník - Termika Zákon zachování energie Ze zákona zachování mechanické energie platí: Ek + Ep = konst. Ale: Vnitřní energie tělesa Každé těleso má
Vnitřní energie, práce, teplo.
 Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
Vnitřní energie, práce, teplo. Vnitřní energie tělesa Částice uvnitř látek mají kinetickou a potenciální energii. Je to energie uvnitř tělesa, proto ji nazýváme vnitřní energie. Značíme ji písmenkem U
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA
 MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 4. TEPLO, TEPLOTA, TEPELNÁ VÝMĚNA Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. TEPLO Teplo je míra změny vnitřní energie, kterou systém vymění při styku s jiným
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 4. TEPLO, TEPLOTA, TEPELNÁ VÝMĚNA Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. TEPLO Teplo je míra změny vnitřní energie, kterou systém vymění při styku s jiným
Termodynamické zákony
 Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
Termodynamické zákony Makroskopická práce termodynamické soustavy Již jsme uvedli, že změna vnitřní energie soustavy je obecně vyvolána dvěma ději: tepelnou výměnou mezi soustavou a okolím a konáním práce
měření teploty Molekulová fyzika a termika Teplotní délková roztažnost V praxi úlohy
 měření teploty Molekulová fyzika a termika rozdíl mezi stupnicí celsiovskou a termodynamickou př. str. 173 (nové vydání s. 172) teplo(to)měry roztažnost látek rtuťový, lihový, bimetalový vodivost polovodičů
měření teploty Molekulová fyzika a termika rozdíl mezi stupnicí celsiovskou a termodynamickou př. str. 173 (nové vydání s. 172) teplo(to)měry roztažnost látek rtuťový, lihový, bimetalový vodivost polovodičů
Základní poznatky. Teplota Vnitřní energie soustavy Teplo
 Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Molekulová fyzika a termika Základní poznatky Základní poznatky Teplota Vnitřní energie soustavy Teplo Termika = část fyziky zabývající se studiem vlastností látek a jejich změn souvisejících s teplotou
Molekulová fyzika a termodynamika
 Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Molekulová fyzika a termodynamika Molekulová fyzika a termodynamika Úvod, vnitřní energie soustavy, teplo, teplota, stavová rovnice ideálního plynu Termodynamické zákony, termodynamické děje Teplotní a
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
Vnitřní energie, práce a teplo Zákon zachování mechanické energie V izolované soustavě těles je v každém okamžiku úhrnná mechanická energie stálá. Mění se navzájem jen potenciální energie E p a kinetická
9. Struktura a vlastnosti plynů
 9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
9. Struktura a vlastnosti plynů Osnova: 1. Základní pojmy 2. Střední kvadratická rychlost 3. Střední kinetická energie molekuly plynu 4. Stavová rovnice ideálního plynu 5. Jednoduché děje v plynech a)
Teplota a její měření
 Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
Teplota a její měření Teplota a její měření Číslo DUM v digitálním archivu školy VY_32_INOVACE_07_03_01 Teplota, Celsiova a Kelvinova teplotní stupnice, převodní vztahy, příklady. Tepelná výměna, měrná
LOGO. Struktura a vlastnosti plynů Ideální plyn
 Struktura a vlastnosti plynů Ideální plyn Ideální plyn Protože popsat chování plynů je nad naše možnosti, zavádíme zjednodušený model tzv. ideálního plynu, který má tyto vlastnosti: Částice ideálního plynu
Struktura a vlastnosti plynů Ideální plyn Ideální plyn Protože popsat chování plynů je nad naše možnosti, zavádíme zjednodušený model tzv. ideálního plynu, který má tyto vlastnosti: Částice ideálního plynu
Přehled otázek z fyziky pro 2.ročník
 Přehled otázek z fyziky pro 2.ročník 1. Z jakých základních poznatků vychází teorie látek + důkazy. a) Látka kteréhokoli skupenství se skládá z částic molekul, atomů, iontů. b) Částice se v látce pohybují,
Přehled otázek z fyziky pro 2.ročník 1. Z jakých základních poznatků vychází teorie látek + důkazy. a) Látka kteréhokoli skupenství se skládá z částic molekul, atomů, iontů. b) Částice se v látce pohybují,
UČIVO. Termodynamická teplota. První termodynamický zákon Přenos vnitřní energie
 PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
PŘEDMĚT: FYZIKA ROČNÍK: SEXTA VÝSTUP UČIVO MEZIPŘEDM. VZTAHY, PRŮŘEZOVÁ TÉMATA, PROJEKTY, KURZY POZNÁMKY Zná 3 základní poznatky kinetické teorie látek a vysvětlí jejich praktický význam Vysvětlí pojmy
1) Skupenství fáze, forma, stav. 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára)
 SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
SKUPENSTVÍ 1) Skupenství fáze, forma, stav 2) 3 druhy skupenství (1 látky): pevné (led) kapalné (voda) plynné (vodní pára) 3) Pevné látky nemění tvar, objem částice blízko sebe, pohybují se kolem urč.
Zákony ideálního plynu
 5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
5.2Zákony ideálního plynu 5.1.1 Ideální plyn 5.1.2 Avogadrův zákon 5.1.3 Normální podmínky 5.1.4 Boyleův-Mariottův zákon Izoterma 5.1.5 Gay-Lussacův zákon 5.1.6 Charlesův zákon 5.1.7 Poissonův zákon 5.1.8
Termika. Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději.
 Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
Termika Nauka o teple se zabývá měřením teploty, tepla a tepelnými ději. 1. Vnitřní energie Brownův pohyb a difúze látek prokazují, že částice látek jsou v neustálém neuspořádaném pohybu. Proto mají kinetickou
STRUKTURA A VLASTNOSTI PLYNŮ POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D09_Z_OPAK_T_Plyny_T Člověk a příroda Fyzika Struktura a vlastnosti plynů Opakování
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D09_Z_OPAK_T_Plyny_T Člověk a příroda Fyzika Struktura a vlastnosti plynů Opakování
Fyzika - Sexta, 2. ročník
 - Sexta, 2. ročník Fyzika Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
- Sexta, 2. ročník Fyzika Výchovné a vzdělávací strategie Kompetence komunikativní Kompetence k řešení problémů Kompetence sociální a personální Kompetence občanská Kompetence k podnikavosti Kompetence
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Vnitřní energie, práce a teplo
 Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
Vnitřní energie, práce a teplo Míček upustíme z výšky na podlahu o Míček padá zvětšuje se, zmenšuje se. Celková mechanická energie se - o Míček se od země odrazí a stoupá vzhůru zvětšuje se, zmenšuje se.
KAPALINY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
Vnitřní energie pevné látky < Vnitřní energie kapaliny < Vnitřní energie plynu (nejmenší energie)
 Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
Změny skupenství Při změně tělesa z pevné látky na kapalinu nebo z kapaliny na plyn se jeho vnitřní energie zvyšuje musíme dodávat teplo (zahřívat). Při změně tělesa z plynu na kapalinu, nebo z kapaliny
Termodynamika 1. UJOP Hostivař 2014
 Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Termodynamika 1 UJOP Hostivař 2014 Termodynamika Zabývá se tepelnými ději obecně. Existují 3 termodynamické zákony: 1. Celkové množství energie (všech druhů) izolované soustavy zůstává zachováno. 2. Teplo
Termodynamika. Děj, který není kvazistatický, se nazývá nestatický.
 Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
Termodynamika Zabývá se ději, při nichž se mění tepelná energie v jiné druhy energie (zejména mechanické). Studuje vlastnosti látek bez přihlédnutí k jejich mikrostruktuře. Je vystavěna na axiomech (0.,
ZŠ ÚnO, Bratří Čapků 1332
 Termika (Fyzika zajímavě) Pachner Úvodní obrazovka Obsah učebnice (vlevo) Seznamy a přehledy (tlačítka dole) Teorie Zajímavosti Osobnosti Úlohy Pokusy Pojmy Animace Lišta s nástroji (vpravo nahoře) Poznámky
Termika (Fyzika zajímavě) Pachner Úvodní obrazovka Obsah učebnice (vlevo) Seznamy a přehledy (tlačítka dole) Teorie Zajímavosti Osobnosti Úlohy Pokusy Pojmy Animace Lišta s nástroji (vpravo nahoře) Poznámky
VÝHODY A NEVÝHODY PNEUMATICKÝCH MECHANISMŮ
 VÝHODY A NEVÝHODY PNEUMATICKÝCH MECHANISMŮ Výhody: medium (vzduch) se nachází všude kolem nás možnost využití centrální výroby stlačeného vzduchu v závodě kompresor nemusí pracovat nepřetržitě (stlačený
VÝHODY A NEVÝHODY PNEUMATICKÝCH MECHANISMŮ Výhody: medium (vzduch) se nachází všude kolem nás možnost využití centrální výroby stlačeného vzduchu v závodě kompresor nemusí pracovat nepřetržitě (stlačený
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
SKUPENSKÉ PŘEMĚNY POJMY K ZOPAKOVÁNÍ. Testové úlohy varianta A
 Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
Škola: Autor: DUM: Vzdělávací obor: Tematický okruh: Téma: Masarykovo gymnázium Vsetín Mgr. Jitka Novosadová MGV_F_SS_3S3_D11_Z_OPAK_T_Skupenske_premeny_T Člověk a příroda Fyzika Skupenské přeměny Opakování
V izolované soustavě nedochází k výměně tepla s okolím. Dokonalá izolovaná soustava neexistuje, nejvíce se jí blíží kalorimetr nebo termoska.
 Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
Teplo a vnitřní energie pracovní list Vnitřní energie Všechny tělesa se skládají z částic, které vykonávají neustálý a neuspořádaný pohyb a které na sebe navzájem silově působí. Částice uvnitř všech těles
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA
 MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
MOLEKULOVÁ FYZIKA A TERMODYNAMIKA 2 metody zkoumání látek na základě vnějších projevů: I. KINETICKÁ TEORIE LÁTEK -studium vlastností látek na základě vnitřní struktury, pohybu a vzájemného působení jednotlivých
KINETICKÁ TEORIE LÁTEK
 ZÁKLADNÍ POZNATKY V mechanice je pohled na tělesa makroskopický makros = veliký, na zákon zachování energie pohlížíme tak, že nás nezajímá částicová struktura, v molekulové fyzice se zajímáme o tom, co
ZÁKLADNÍ POZNATKY V mechanice je pohled na tělesa makroskopický makros = veliký, na zákon zachování energie pohlížíme tak, že nás nezajímá částicová struktura, v molekulové fyzice se zajímáme o tom, co
VÝUKOVÝ MATERIÁL. 0301 Ing. Yvona Bečičková Tematická oblast
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
MOLEKULOVÁ FYZIKA A TERMKA MOLEKULOVÁ FYZIKA A TERMIKA
 Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 3.. 04 Název zpracovaného celku: MOLEKULOVÁ FYZIKA A TERMKA MOLEKULOVÁ FYZIKA A TERMIKA Studuje tělesa na základě jejich částicové struktury.
Předmět: Ročník: Vytvořil: Datum: FYZIKA PRVNÍ MGR. JÜTTNEROVÁ 3.. 04 Název zpracovaného celku: MOLEKULOVÁ FYZIKA A TERMKA MOLEKULOVÁ FYZIKA A TERMIKA Studuje tělesa na základě jejich částicové struktury.
POZNÁMKA: V USA se používá ještě Fahrenheitova teplotní stupnice. Převodní vztahy jsou vzhledem k volbě základních bodů složitější: 9 5
 TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
TEPLO, TEPLOTA Tepelný stav látek je charakterizován veličinou termodynamická teplota T Jednotkou je kelvin T K Mezi Celsiovou a Kelvinovou teplotní stupnicí existuje převodní vztah T 73,5C t POZNÁMKA:
Termodynamika 2. UJOP Hostivař 2014
 Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Termodynamika 2 UJOP Hostivař 2014 Skupenské teplo tání/tuhnutí je (celkové) teplo, které přijme pevná látka při přechodu na kapalinu během tání nebo naopak Značka Veličina Lt J Nedochází při něm ke změně
Chemická kinetika. Reakce 1. řádu rychlost přímo úměrná koncentraci složky
 Chemická kinetika Chemická kinetika Reakce 0. řádu reakční rychlost nezávisí na čase a probíhá konstantní rychlostí v = k (rychlost se rovná rychlostní konstantě) velmi pomalé reakce (prakticky se nemění
Chemická kinetika Chemická kinetika Reakce 0. řádu reakční rychlost nezávisí na čase a probíhá konstantní rychlostí v = k (rychlost se rovná rychlostní konstantě) velmi pomalé reakce (prakticky se nemění
Integrovaná střední škola, Hlaváčkovo nám. 673, Slaný
 Označení materiálu: VY_32_INOVACE_STEIV_FYZIKA1_11 Název materiálu: Teplo a teplota. Tematická oblast: Fyzika 1.ročník Anotace: Prezentace slouží k vysvětlení základních fyzikálních veličin tepla a teploty.
Označení materiálu: VY_32_INOVACE_STEIV_FYZIKA1_11 Název materiálu: Teplo a teplota. Tematická oblast: Fyzika 1.ročník Anotace: Prezentace slouží k vysvětlení základních fyzikálních veličin tepla a teploty.
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů.
 Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
Fyzika je přírodní věda, která zkoumá a popisuje zákonitosti přírodních jevů. Násobky jednotek název značka hodnota kilo k 1000 mega M 1000000 giga G 1000000000 tera T 1000000000000 Tělesa a látky Tělesa
13 otázek za 1 bod = 13 bodů Jméno a příjmení:
 13 otázek za 1 bod = 13 bodů Jméno a příjmení: 4 otázky za 2 body = 8 bodů Datum: 1 příklad za 3 body = 3 body Body: 1 příklad za 6 bodů = 6 bodů Celkem: 30 bodů příklady: 1) Sportovní vůz je schopný zrychlit
13 otázek za 1 bod = 13 bodů Jméno a příjmení: 4 otázky za 2 body = 8 bodů Datum: 1 příklad za 3 body = 3 body Body: 1 příklad za 6 bodů = 6 bodů Celkem: 30 bodů příklady: 1) Sportovní vůz je schopný zrychlit
3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj
 3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj a) tepelný děj přechod plynu ze stavu 1 do stavu tepelnou výměnou nebo konáním práce dále uvaž., že hmotnost plynu m = konst. a navíc
3.5 Tepelné děje s ideálním plynem stálé hmotnosti, izotermický děj a) tepelný děj přechod plynu ze stavu 1 do stavu tepelnou výměnou nebo konáním práce dále uvaž., že hmotnost plynu m = konst. a navíc
T0 Teplo a jeho měření
 Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
Teplo a jeho měření 1 Teplo 2 Kalorimetrie Kalorimetr 3 Tepelná kapacita 3.1 Měrná tepelná kapacita Měrná tepelná kapacita při stálém objemu a stálém tlaku Poměr měrných tepelných kapacit 3.2 Molární tepelná
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH
 SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA TERMODYNAMICKÁ TEPLOTNÍ STUPNICE, TEPLOTA 1) Převeďte hodnoty v
SBÍRKA ŘEŠENÝCH FYZIKÁLNÍCH ÚLOH MECHANIKA MOLEKULOVÁ FYZIKA A TERMIKA ELEKTŘINA A MAGNETISMUS KMITÁNÍ A VLNĚNÍ OPTIKA FYZIKA MIKROSVĚTA TERMODYNAMICKÁ TEPLOTNÍ STUPNICE, TEPLOTA 1) Převeďte hodnoty v
ZÁKLADNÍ POZNATKY MOLEKULOVÉ FYZIKY A TERMIKY. Mgr. Jan Ptáčník - GJVJ - 2. ročník - Molekulová fyzika a termika
 ZÁKLADNÍ POZNATKY MOLEKULOVÉ FYZIKY A TERMIKY Mgr. Jan Ptáčník - GJVJ - 2. ročník - Molekulová fyzika a termika Částicová struktura látek Látky jakéhokoli skupenství se skládají z částic Částicemi jsou
ZÁKLADNÍ POZNATKY MOLEKULOVÉ FYZIKY A TERMIKY Mgr. Jan Ptáčník - GJVJ - 2. ročník - Molekulová fyzika a termika Částicová struktura látek Látky jakéhokoli skupenství se skládají z částic Částicemi jsou
F8 - Změny skupenství Číslo variace: 1
 F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
F8 - Změny skupenství Číslo variace: 1 1. K vypařování kapaliny dochází: při každé teplotě v celém jejím objemu pouze při teplotě 100 C v celém objemu kapaliny pouze při normální teplotě a normálním tlaku
Teplota. fyzikální veličina značka t
 Teplota fyzikální veličina značka t Je to vlastnost předmětů a okolí, kterou je člověk schopen vnímat a přiřadit jí pocity studeného, teplého či horkého. Jak se tato vlastnost jmenuje? Teplota Naše pocity
Teplota fyzikální veličina značka t Je to vlastnost předmětů a okolí, kterou je člověk schopen vnímat a přiřadit jí pocity studeného, teplého či horkého. Jak se tato vlastnost jmenuje? Teplota Naše pocity
Molekulová fyzika a termika
 Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
Molekulová fyzika a termika Fyzika 1. ročník Vzdělávání pro konkurenceschopnost Inovace výuky oboru Informační technologie MěSOŠ Klobouky u Brna Mgr. Petr Kučera 1 Obsah témat v kapitole Molekulová fyzika
Zpracování teorie 2010/11 2011/12
 Zpracování teorie 2010/11 2011/12 Cykly Děje Proudění (turbíny) počet v: roce 2010/11 a roce 2011/12 Chladící zařízení (nakreslete cyklus a nakreslete schéma)... zde 13 + 2 (15) Izochorický děj páry (nakreslit
Zpracování teorie 2010/11 2011/12 Cykly Děje Proudění (turbíny) počet v: roce 2010/11 a roce 2011/12 Chladící zařízení (nakreslete cyklus a nakreslete schéma)... zde 13 + 2 (15) Izochorický děj páry (nakreslit
Vnitřní energie. Teplo. Tepelná výměna.
 Vnitřní energie. Teplo. Tepelná výměna. A) Výklad: Vnitřní energie vnitřní energie označuje součet celkové kinetické energie částic (tj. rotační + vibrační + translační energie) a celkové polohové energie
Vnitřní energie. Teplo. Tepelná výměna. A) Výklad: Vnitřní energie vnitřní energie označuje součet celkové kinetické energie částic (tj. rotační + vibrační + translační energie) a celkové polohové energie
Plyn. 11 plynných prvků. Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
Plyny Plyn T v, K 11 plynných prvků Vzácné plyny He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2 H 2 20 He 4.4 Ne 27 Ar 87 Kr 120 Xe 165 Rn 211 N 2 77 O 2 90 F 2 85 Cl 2 238 1 Plyn
6. Jaký je výkon vařiče, který ohřeje 1 l vody o 40 C během 5 minut? Měrná tepelná kapacita vody je W)
 TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
TEPLO 1. Na udržení stále teploty v místnosti se za hodinu spotřebuje 4,2 10 6 J tepla. olik vody proteče radiátorem ústředního topení za hodinu, jestliže má voda při vstupu do radiátoru teplotu 80 ºC
5.4 Adiabatický děj Polytropický děj Porovnání dějů Základy tepelných cyklů První zákon termodynamiky pro cykly 42 6.
 OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
OBSAH Předmluva 9 I. ZÁKLADY TERMODYNAMIKY 10 1. Základní pojmy 10 1.1 Termodynamická soustava 10 1.2 Energie, teplo, práce 10 1.3 Stavy látek 11 1.4 Veličiny popisující stavy látek 12 1.5 Úlohy technické
Teplota jedna ze základních jednotek soustavy SI, vyjadřována je v Kelvinech (značka K) další používané stupnice: Celsiova, Fahrenheitova
 1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
1 Rozložení, distribuce tepla Teplota je charakteristika tepelného stavu hmoty je to stavová veličina, charakterizující termodynamickou rovnováhu systému. Teplo vyjadřuje kinetickou energii částic. Teplota
FYZIKA 6. ročník 1_Látka a těleso _Vlastnosti látek _Vzájemné působení těles _Gravitační síla... 4 Gravitační pole...
 FYZIKA 6. ročník 1_Látka a těleso... 2 2_Vlastnosti látek... 3 3_Vzájemné působení těles... 4 4_Gravitační síla... 4 Gravitační pole... 5 5_Měření síly... 5 6_Látky jsou složeny z částic... 6 7_Uspořádání
FYZIKA 6. ročník 1_Látka a těleso... 2 2_Vlastnosti látek... 3 3_Vzájemné působení těles... 4 4_Gravitační síla... 4 Gravitační pole... 5 5_Měření síly... 5 6_Látky jsou složeny z částic... 6 7_Uspořádání
Teplo, práce a 1. věta termodynamiky
 eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
eplo, práce a. věta termodynamiky eplo ( tepelná energie) Nyní již víme, že látka (plyn) s vyšší teplotou obsahuje částice (molekuly), které se pohybují s vyššími rychlostmi a můžeme posoudit, co se stane
6. Stavy hmoty - Plyny
 skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
Digitální učební materiál
 Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
Evidenční číslo materiálu: 516 Digitální učební materiál Autor: Mgr. Pavel Kleibl Datum: 22. 1. 2013 Ročník: 8. Vzdělávací oblast: Člověk a příroda Vzdělávací obor: Fyzika Tematický okruh: Energie Téma:
metoda je základem fenomenologické vědy termodynamiky, statistická metoda je základem kinetické teorie plynů, na níž si princip této metody ukážeme.
 Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Přednáška 1 Úvod Při studiu tepelných vlastností látek a jevů probíhajících při tepelné výměně budeme používat dvě různé metody zkoumání: termodynamickou a statistickou. Termodynamická metoda je základem
Příklady k zápočtu molekulová fyzika a termodynamika
 Příklady k zápočtu molekulová fyzika a termodynamika 1. Do vody o teplotě t 1 70 C a hmotnosti m 1 1 kg vhodíme kostku ledu o teplotě t 2 10 C a hmotnosti m 2 2 kg. Do soustavy vzápětí přilijeme další
Příklady k zápočtu molekulová fyzika a termodynamika 1. Do vody o teplotě t 1 70 C a hmotnosti m 1 1 kg vhodíme kostku ledu o teplotě t 2 10 C a hmotnosti m 2 2 kg. Do soustavy vzápětí přilijeme další
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, BYSTRÉ 9. ROČNÍK. Změny skupenství. Filip Skalský, David Řehůřek
 ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
ABSOLVENTSKÁ PRÁCE ZÁKLADNÍ ŠKOLA, ŠKOLNÍ 24, 569 92 BYSTRÉ 9. ROČNÍK Změny skupenství Filip Skalský, David Řehůřek ŠKOLNÍ ROK 2011/2012 Prohlašujeme, že jsme absolventskou práci vypracovali samostatně
Vlastnosti kapalin. Povrchová vrstva kapaliny
 Struktura a vlastnosti kapalin Vlastnosti kapalin, Povrchová vrstva kapaliny Jevy na rozhraní pevného tělesa a kapaliny Kapilární jevy, Teplotní objemová roztažnost Vlastnosti kapalin Kapalina - tvoří
Struktura a vlastnosti kapalin Vlastnosti kapalin, Povrchová vrstva kapaliny Jevy na rozhraní pevného tělesa a kapaliny Kapilární jevy, Teplotní objemová roztažnost Vlastnosti kapalin Kapalina - tvoří
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
DUM č. 12 v sadě. 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia
 projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
STRUKTURA A VLASTNOSTI KAPALIN
 STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo
 Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo teplo, teplota, práce, tepelná vodivost Teplo část vnitřní energie tělesa = součet kinetické
Termika termika - teplota, teplo a práce termodynamické zákony tepelná vodivost - tepelná kapacita skupenské teplo teplo, teplota, práce, tepelná vodivost Teplo část vnitřní energie tělesa = součet kinetické
Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika v učebně fyziky, interaktivní tabule
 Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Předmět: Náplň: Třída: Počet hodin: Pomůcky: Fyzika (FYZ) Práce a energie, tepelné jevy, elektrický proud, zvukové jevy Tercie 1+1 hodina týdně Pomůcky, které poskytuje sbírka fyziky, a audiovizuální technika
Molekulová fyzika. (test version, not revised)
 Molekulová fyzika (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 1. října 2010 Obsah Úvod Kinetická teorie látek Modely skupenství Konstanty a veličiny Úvod Co jsme doposud zkoumali?
Molekulová fyzika (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 1. října 2010 Obsah Úvod Kinetická teorie látek Modely skupenství Konstanty a veličiny Úvod Co jsme doposud zkoumali?
Maturitní témata fyzika
 Maturitní témata fyzika 1. Kinematika pohybů hmotného bodu - mechanický pohyb a jeho sledování, trajektorie, dráha - rychlost hmotného bodu - rovnoměrný pohyb - zrychlení hmotného bodu - rovnoměrně zrychlený
Maturitní témata fyzika 1. Kinematika pohybů hmotného bodu - mechanický pohyb a jeho sledování, trajektorie, dráha - rychlost hmotného bodu - rovnoměrný pohyb - zrychlení hmotného bodu - rovnoměrně zrychlený
2.1 Empirická teplota
 Přednáška 2 Teplota a její měření Termika zkoumá tepelné vlastnosti látek a soustav těles, jevy spojené s tepelnou výměnou, chování soustav při tepelné výměně, změny skupenství látek, atd. 2.1 Empirická
Přednáška 2 Teplota a její měření Termika zkoumá tepelné vlastnosti látek a soustav těles, jevy spojené s tepelnou výměnou, chování soustav při tepelné výměně, změny skupenství látek, atd. 2.1 Empirická
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
F - Změny skupenství látek
 F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
F - Změny skupenství látek Určeno jako učební text pro studenty dálkového studia a jako shrnující text pro studenty denního studia. VARIACE 1 Tento dokument byl kompletně vytvořen, sestaven a vytištěn
TESTY Závěrečný test 2. ročník Skupina A
 1. Teplota tělesa se zvýšila o o C. Analogicky tomu lze říci, že se a) snížila o K. b) zvýšila o 93,15 K c) snížila o 53,15 K d) zvýšila o K. Částice v látce se pohybují a) neustáleným a uspořádaným pohybem
1. Teplota tělesa se zvýšila o o C. Analogicky tomu lze říci, že se a) snížila o K. b) zvýšila o 93,15 K c) snížila o 53,15 K d) zvýšila o K. Částice v látce se pohybují a) neustáleným a uspořádaným pohybem
Ch - Rozlišování látek
 Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Ch - Rozlišování látek Autor: Mgr. Jaromír JUŘEK Kopírování a jakékoliv další využití výukového materiálu je povoleno pouze s uvedením odkazu na www.jarjurek.cz. VARIACE 1 Tento dokument byl kompletně
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
 Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Fyzika, maturitní okruhy (profilová část), školní rok 2014/2015 Gymnázium INTEGRA BRNO
 1. Jednotky a veličiny soustava SI odvozené jednotky násobky a díly jednotek skalární a vektorové fyzikální veličiny rozměrová analýza 2. Kinematika hmotného bodu základní pojmy kinematiky hmotného bodu
1. Jednotky a veličiny soustava SI odvozené jednotky násobky a díly jednotek skalární a vektorové fyzikální veličiny rozměrová analýza 2. Kinematika hmotného bodu základní pojmy kinematiky hmotného bodu
TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY.
 TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Ideální plyn je zjednodušená představa skutečného plynu. Je dokonale stlačitelný
TERMODYNAMIKA Ideální plyn TENTO PROJEKT JE SPOLUFINANCOVÁN EVROPSKÝM SOCIÁLNÍM FONDEM A STÁTNÍM ROZPOČTEM ČESKÉ REPUBLIKY. Ideální plyn je zjednodušená představa skutečného plynu. Je dokonale stlačitelný
Vnitřní energie tělesa
 Vnitřní energie tělesa vnitřní energie tělesa je energie všech částic, z nichž se těleso skládá. Jde především o kinetickou a potenciální energii, ale může jít také o elektrickou či chemickou energii,
Vnitřní energie tělesa vnitřní energie tělesa je energie všech částic, z nichž se těleso skládá. Jde především o kinetickou a potenciální energii, ale může jít také o elektrickou či chemickou energii,
Test vlastnosti látek a periodická tabulka
 DUM Základy přírodních věd DUM III/2-T3-2-08 Téma: Test vlastnosti látek a periodická tabulka Střední škola Rok: 2012 2013 Varianta: A Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Test vlastnosti
DUM Základy přírodních věd DUM III/2-T3-2-08 Téma: Test vlastnosti látek a periodická tabulka Střední škola Rok: 2012 2013 Varianta: A Zpracoval: Mgr. Pavel Hrubý Mgr. Josef Kormaník TEST Test vlastnosti
ČÍSLO PROJEKTU: OPVK 1.4
 NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV: VY_32_INOVACE_185_Skupenství AUTOR: Ing. Gavlas Miroslav ROČNÍK, DATUM: 8., 16.11.2011 VZDĚL. OBOR, TÉMA: Fyzika, ČÍSLO PROJEKTU:
NÁZEV ŠKOLY: Základní škola Javorník, okres Jeseník REDIZO: 600 150 585 NÁZEV: VY_32_INOVACE_185_Skupenství AUTOR: Ing. Gavlas Miroslav ROČNÍK, DATUM: 8., 16.11.2011 VZDĚL. OBOR, TÉMA: Fyzika, ČÍSLO PROJEKTU:
Digitální učební materiál. III/2 Inovace a zkvalitnění výuky prostřednictvím ICT Příjemce podpory Gymnázium, Jevíčko, A. K.
 Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Digitální učební materiál Číslo projektu CZ.1.07/1.5.00/34.0802 Název projektu Zkvalitnění výuky prostřednictvím ICT Číslo a název šablony klíčové aktivity III/2 Inovace a zkvalitnění výuky prostřednictvím
Plyn. 11 plynných prvků. Vzácné plyny. He, Ne, Ar, Kr, Xe, Rn Diatomické plynné prvky H 2, N 2, O 2, F 2, Cl 2
 Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
Plyny Plyn T v, K Vzácné plyny 11 plynných prvků He, Ne, Ar, Kr, Xe, Rn 165 Rn 211 N 2 O 2 77 F 2 90 85 Diatomické plynné prvky Cl 2 238 H 2, N 2, O 2, F 2, Cl 2 H 2 He Ne Ar Kr Xe 20 4.4 27 87 120 1 Plyn
2 Jevy na rozhraní Kapilární tlak Kapilární jevy Objemová roztažnost kapalin 7
 Obsah Obsah 1 Povrchová vrstva 1 2 Jevy na rozhraní 3 2.1 Kapilární tlak........................... 4 2.2 Kapilární jevy........................... 5 3 Objemová roztažnost kapalin 7 1 Povrchová vrstva
Obsah Obsah 1 Povrchová vrstva 1 2 Jevy na rozhraní 3 2.1 Kapilární tlak........................... 4 2.2 Kapilární jevy........................... 5 3 Objemová roztažnost kapalin 7 1 Povrchová vrstva
