PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
|
|
|
- Kristýna Beranová
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ZPŮSOB PODÁNÍ, ŽADATEL A DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
2 Členský stát Dánsko Německo Irsko Itálie Španělsko Držitel rozhodnutí o registraci Valera Žadatel Valera Valera Smyšlený název Název Koncentrace Léková forma Způsob podání Obsah (koncentrace) Vantas 50 mg Implantát Subkutánní 50 mg Vantas 50 mg Implantát Subkutánní 50 mg Vantas 50 mg Implantát Subkutánní 50 mg Valera Vantas 50 mg Implantát Subkutánní 50 mg Valera Vantas 50 mg Implantát Subkutánní 50 mg 2
3 Spojené království (Velká Británie*) Valera Vantas 50 mg Implantát Subkutánní 50 mg 3
4 PŘÍLOHA II VĚDECKÉ ZÁVĚRY 4
5 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ PŘÍPRAVKU VANTAS (viz příloha I) V počátku svého přirozeného cyklu je karcinom prostaty androgen-dependentní. Později v klinickém průběhu se stává nezávislým na androgenech a je refrakterní na hormonální terapii. Avšak i během stavu, kdy není karcinom prostaty androgen-dependentní, je pravděpodobné, že obsahuje subpopulaci buněk, které jsou androgen-dependentní. Na základě těchto omezených údajů je v současné době u mužů s androgen non-dependentním karcinomem prostaty (AIPC) standardní léčbou pokračování v supresi androgenu. V minulosti bylo suprese testosteronu dosaženo bilaterální orchiektomií (chirurgická kastrace). Během posledních dvou desetiletí je k ablaci androgenů používána injekce dlouhodobě působícího agonisty hormonu uvolňujícího luteinizační hormon (LH-RHas). V podstatě je důležité dosáhnout co nejnižší sérové koncentrace testosteronu pro ADT k minimalizaci stimulace buněk karcinomu prostaty. Sérové koncentrace testosteronu, které odpovídají hladinám po kastraci, byly obecně nastaveny na méně než 50 ng/dl (1,7 nmol/l) vzhledem ke známé variabilitě hodnoty v referenčních laboratořích. Dosažení hladin testosteronu odpovídajících hladinám po kastraci je přijatelným náhradním konečným bodem u hormonálně citlivého pokročilého karcinomu prostaty, který může znamenat menší bolest z kostních metastáz, zlepšení proudu moči a v některých případech zpomalení progrese nádoru, ačkoli jednoznačný přínos, pokud jde o přežití, nebyl prokázán. Ablace androgenů je považována za paliativní léčbu. Dále pak v roce 2004 Výbor pro humánní léčivé přípravky přijal jako součást vědeckého doporučení od pracovní skupiny pro vědecké poradenství (SAWP) redukci testosteronu na hladiny odpovídající hladinám po kastraci u pokročilého nádoru prostaty jako platnou náhražku za klinickou účinnost. Dokumentovaný farmakologický konečný bod sérového testosteronu < 50 ng/dl, který byl dokumentován ve studiích přípravku Vantas 302, 301 a dále pak v dlouhodobé extenční studii 301, je tudíž přijatelným konečným bodem primární účinnosti u pacientů s pokročilým karcinomem prostaty. Při % účinností redukce sérového testosteronu jsou další aktivní srovnávací studie nadbytečné a nejsou proto nutné. Mohou být použiti další agonisté LHRH, ale to je zbytečné vzhledem k metaanalýze, kterou předložil žadatel. Orchiektomie není přijatelná, jsou-li dostupné reverzibilní metody, DES je obsolentní a nesteroidní anti-androgeny mohou mít nižší účinnost, jsou-li použity v monoterapii. Bezpečnostní databáze se zdá omezená, ale neobjevily se žádné nepředvídané bezpečnostní otázky, a to ani v americkém sledování po uvedení na trh, ani ve studiích. Údaje z dlouhodobé rozšířené studie 301 ukazují na dlouhodobou bezpečnost pro pacienty léčené přípravkem Vantas po dobu dvou a více let. Je třeba rozlišovat mezi bezpečnostními aspekty všeobecné androgenové supresní terapie a (lokální) bezpečností tohoto produktu. Bezpečnost androgenové suprese je dobře známá a další informace pro tento produkt nejsou nutné. Lokální bezpečnost přípravku Vantas byla dostatečně zkoumána a další srovnávací studie nejsou nutné. Je schválen návrh žadatele/držitele osvědčení o registraci, aby bylo v plánu řízení rizik obsaženo pět bezpečnostních aspektů farmakologické bdělosti (dva se týkají speciálně unikátní formule přípravku Vantas, zatímco další tři jsou klasifikovány jako skupinové účinky: vypuzování, celulitida, zarudnutí, osteoporóza a prodloužení QT intervalu). Závěrem Výbor pro humánní léčivé přípravky souhlasí, že odpovědi předložené žadatelem ukazují, že problémy byly vyřešeny. Přípravek Vantas je nový agonista LHRH a tato farmakologická třída byla zavedena do léčby pokročilého karcinomu prostaty před více než 20 lety. Nic nenaznačuje, že se jakýkoli z členů této třídy liší, pokud jde o účinnost a bezpečnost, a přípravek Vantas se nezdá být v tomto ohledu výjimkou. Údaje z dlouhodobé rozšířené studie 301 týkající se účinnosti a bezpečnosti podporují dlouhodobou účinnost a bezpečnost u pacientů, kteří dostávají paliativní léčbu implantátem histerelin pro pokročilý karcinom prostaty po dobu dvou a více let. Výbor pro humánní léčivé přípravky požaduje zahrnutí pěti bezpečnostních aspektů farmakologické bdělosti do výše zmíněného plánu řízení rizika, jak bylo navrženo žadatelem/držitelem osvědčení o registraci. 5
6 Výbor pro humánní léčivé přípravky doporučil udělit rozhodnutí o registraci, pro které jsou finálními verzemi souhrn údajů o přípravku, označení na obalu a příbalové informace, které byly formulovány v řízení koordinační skupiny, jak je uvedeno v příloze III pro přípravek Vantas. 6
7 PŘÍLOHA III SOUHRN ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 7
8 Platný souhrn údajů o přípravku, označení a příbalové informace jsou konečnými verzemi získanými v průběhu postupu koordinační skupiny. 8
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I. Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech
 PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
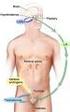 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa Androgenní suprese potlačuje růst prostatických buněk. Efektu lze dosáhnout chirurgickou kastrací
Příloha I. Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech.
 Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
PŘÍLOHA I. SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH
 PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH 1 Členský stát EU/EHP Držitel rozhodnutí o registraci Rakousko Pharmachemie B.V. Belgie Pharmachemie B.V.
PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH 1 Členský stát EU/EHP Držitel rozhodnutí o registraci Rakousko Pharmachemie B.V. Belgie Pharmachemie B.V.
Doporučené postupy pro hormonální léčbu karcinomu prostaty 2012
 Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
Závěr expertní komise ve složení: Babjuk M, Hora M, Katolická J, Kubecová M, Matoušková M, Melichar B, Petera J, Soumarová R, Študent V Podmínkou pro nasazení hormonální terapie je histologicky verifikovaný
POZMĚŇOVACÍ NÁVRHY 4-9
 EVROPSKÝ PARLAMENT 2009-2014 Výbor pro průmysl, výzkum a energetiku 3. 2. 2010 2008/0255(COD) POZMĚŇOVACÍ NÁVRHY 4-9 Návrh stanoviska Jorgo Chatzimarkakis (PE430.863v01-00) k návrhu nařízení Evropského
EVROPSKÝ PARLAMENT 2009-2014 Výbor pro průmysl, výzkum a energetiku 3. 2. 2010 2008/0255(COD) POZMĚŇOVACÍ NÁVRHY 4-9 Návrh stanoviska Jorgo Chatzimarkakis (PE430.863v01-00) k návrhu nařízení Evropského
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
Obsah léčivých látek. název přípravku. Loratadine Vitabalans 10 mg tablety. 10 mg tableta Perorální podání. Loratadine Vitabalans
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
(Smyšlený název) Název Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Tableta Perorální podání
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Bílé až téměř bílé válcovité tyčinky (přibližné rozměry: průměr 1,5 mm, délka 13 mm, hmotnost 44 mg), z biologicky degradovatelné polymerní matrice.
 Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
Sp.zn.sukls85858/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Reseligo 10,8 mg implantát v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje goserelinum
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) jodidu-( 131 I) sodného
Nové možnosti. terapeutického ovlivnění pokročilého karcinomu prostaty. Mám nádor prostaty a co dál? Jana Katolická
 MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
MEZINÁRODNÍ CENTRUM KLINICKÉHO VÝZKUMU Nové možnosti TVOŘÍME BUDOUCNOST MEDICÍNY terapeutického ovlivnění pokročilého karcinomu prostaty Jana Katolická Primář onkologicko-chirurgické oddělení Mám nádor
Příloha II. Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové závěry vědeckého hodnocení přípravku Methylphenidate Hexal a souvisejících
Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové závěry vědeckého hodnocení přípravku Methylphenidate Hexal a souvisejících
Smyšlený název Obsah léčivých látek Léková forma Živočišné druhy. Držitel rozhodnutí o registraci. Členský stát EU/EHP
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls61285/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Leptoprol 5 mg Implantát v předplněné injekční stříkačce 2. Kvalitativní a kvantitativní složení Jeden implantát obsahuje leuprorelinum
Sp.zn. sukls61285/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Leptoprol 5 mg Implantát v předplněné injekční stříkačce 2. Kvalitativní a kvantitativní složení Jeden implantát obsahuje leuprorelinum
Celkové shrnutí vědeckého hodnocení přípravku Kytril a souvisejících názvů (viz příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÉ INFORMACE PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 11 Vědecké závěry Celkové
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT IKARUS. Neintervenční epidemiologická studie
 CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
CEBO: (Center for Evidence Based Oncology) Incidence Kostních příhod u nádorů prsu PROJEKT Neintervenční epidemiologická studie PROTOKOL PROJEKTU Verze: 4.0 Datum: 26.09.2006 Strana 2 PROTOKOL PROJEKTU
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se aktualizovaných zpráv o bezpečnosti (PSUR) testosteron-undekanoátu (inekce)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se aktualizovaných zpráv o bezpečnosti (PSUR) testosteron-undekanoátu (inekce)
Hormonální léčba metastatického karcinomu prostaty. Marko Babjuk. FN Motol a 2 LFUK, Praha
 Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Hormonální léčba metastatického karcinomu prostaty Marko Babjuk FN Motol a 2 LFUK, Praha Hormonální osa DHT a AR Testosterone 5a-R AR s DHT ligandem (Dimery) DHT Hsp 70 RA (Inaktivní) Hsp 90 Androgen Response
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky
 Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
Léčebné predikce u karcinomu prsu pro rok 2013 chystané novinky Prof. MUDr. Jitka Abrahámová, DrSc Onkologická klinika TN a 1. LF UK KOC (NNB + VFN + TN) St Gallén 2011 Rozsah onemocnění T, N, M ER, PgR
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
ZOLADEX DEPOT 3,6 mg (goserelini acetas) implantát PŘÍBALOVÁ INFORMACE
 Příloha č. 2 ke sdělení sp.zn. sukls131194/2011 ZOLADEX DEPOT 3,6 mg (goserelini acetas) implantát PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha č. 2 ke sdělení sp.zn. sukls131194/2011 ZOLADEX DEPOT 3,6 mg (goserelini acetas) implantát PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci
 Příloha I Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci 1 Příloha IA: Léčivé přípravky doporučené pro zachování registrace a žádosti o registraci, u nichž byla
Příloha I Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci 1 Příloha IA: Léčivé přípravky doporučené pro zachování registrace a žádosti o registraci, u nichž byla
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Endometriosis: Prolongovaná léčba triptorelinem potlačí sekreci estradiolu a tak umožní uklidnění ektopické tkáně endometria.
 Příbalová informace Rp. Informace pro použití, čtěte pozorně! DIPHERELINE L.A. 3,75 mg Prášek pro přípravu injekční suspenze s rozpouštědlem Držitel rozhodnutí o registraci Beaufour Ipsen Pharma, 24 rue
Příbalová informace Rp. Informace pro použití, čtěte pozorně! DIPHERELINE L.A. 3,75 mg Prášek pro přípravu injekční suspenze s rozpouštědlem Držitel rozhodnutí o registraci Beaufour Ipsen Pharma, 24 rue
SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP)
 PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
PŘÍLOHA I SEZNAM SMYŠLENÝCH NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH (EHP) 1 Členský stát Držitel rozhodnutí o registraci Smyšlený
CELKOVÉ SHRNUTÍ VĚDECKÉHO HODNOCENÍ LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH KYSELINU VALPROOVOU/VALPROÁT (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV V SOUHRNECH ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÝCH INFORMACÍCH PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 104 VĚDECKÉ ZÁVĚRY CELKOVÉ SHRNUTÍ VĚDECKÉHO
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha II. Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 4 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Seasonique a souvisejících
Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 4 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Seasonique a souvisejících
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ELIGARD 22,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ELIGARD 22,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy o bezpečnosti (PSUR) pro ibuprofen, ibuprofen-lysin
Leflunomide Apotex 10 mg, tabletten. Leflunomide Apotex 20 mg, tabletten. LEFLUNOMIDA APOTEX 10 mg comprimidos EFG
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH) PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH) PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel rozhodnutí
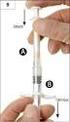
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Ethirfin a souvisejících názvů (viz příloha I) 1. Úvod Společnost
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ NEOBNOVENÍ ROZHODNUTÍ O REGISTRACI 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Ethirfin a souvisejících názvů (viz příloha I) 1. Úvod Společnost
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn. sukls131207/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 depotní injekci (odpovídá
Příloha č. 3 ke sdělení sp.zn. sukls131207/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 depotní injekci (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn. sukls131194/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 3,6 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 depotní injekci (odpovídá
Příloha č. 3 ke sdělení sp.zn. sukls131194/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 3,6 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 depotní injekci (odpovídá
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Živý virus onemocnění infekční burzitidy, kmen V EID 50 v dávce
 PŘÍLOHA I NÁZVY, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ, DOPORUČENÁ DÁVKA, OCHRANNÁ LHŮTA, ŽADATEL/DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH
PŘÍLOHA I NÁZVY, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ, DOPORUČENÁ DÁVKA, OCHRANNÁ LHŮTA, ŽADATEL/DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 5 Vědecké závěry Společnost Vale Pharmaceuticals dne 27. března 2015 předložila Spojenému království žádost o decentralizovaný postup pro kombinovaný přípravek s fixní dávkou
Příloha II Vědecké závěry 5 Vědecké závěry Společnost Vale Pharmaceuticals dne 27. března 2015 předložila Spojenému království žádost o decentralizovaný postup pro kombinovaný přípravek s fixní dávkou
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 406 Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci Ibuprofen je nesteroidní protizánětlivé léčivo (NSAID)
Příloha I. Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech
 Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený) název Koncentrace Léková forma Způsob podání
Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený) název Koncentrace Léková forma Způsob podání
Smyšlený název Léková forma Síla Živočišné druhy. Perorální suspenze toltrazurilu/ml
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHŮ LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBŮ PODÁNÍ, ŽADATELŮ/DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1/11 Členský
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHŮ LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBŮ PODÁNÍ, ŽADATELŮ/DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1/11 Členský
Obsah léčivých látek
 Příloha I Seznam názvů, lékových forem, obsahu léčivých látek ve veterinárním léčivém přípravku, živočišných druhů, způsobů podání, žadatelů rozhodnutí o registraci v členských státech 1/10 Členský stát
Příloha I Seznam názvů, lékových forem, obsahu léčivých látek ve veterinárním léčivém přípravku, živočišných druhů, způsobů podání, žadatelů rozhodnutí o registraci v členských státech 1/10 Členský stát
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls245027/2009 1. NÁZEV PŘÍPRAVKU UNDESTOR SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 měkká tobolka obsahuje 40 mg testosteroni
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls245027/2009 1. NÁZEV PŘÍPRAVKU UNDESTOR SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 měkká tobolka obsahuje 40 mg testosteroni
Celkové shrnutí vědeckého hodnocení přípravku Atacand Plus a související názvy (viz Příloha I)
 PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
PŘÍLOHA II VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ POTŘEBNÝCH ÚPRAV SOUHRNU ÚDAJŮ O PŘÍPRAVKU, OZNAČENÍ NA OBALU A PŘÍBALOVÝCH INFORMACÍ PŘEDKLÁDANÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 14 Vědecké závěry Celkové
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá goserelinum 10,8 mg).
 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg implantát v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá
1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg implantát v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls211633/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls211633/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Příloha IV. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 27 Vědecké závěry Celkové shrnutí vědeckého hodnocení postkoitálních antikoncepčních léčivých přípravků obsahujících levonorgestrel
Příloha IV Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 27 Vědecké závěry Celkové shrnutí vědeckého hodnocení postkoitálních antikoncepčních léčivých přípravků obsahujících levonorgestrel
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 7 Vědecké závěry Celkové shrnutí vědeckého hodnocení perorálních léčivých přípravků s metadonem obsahujících povidon Metadon je syntetický opioid. Metadon se používá k léčbě středně
Příloha II Vědecké závěry 7 Vědecké závěry Celkové shrnutí vědeckého hodnocení perorálních léčivých přípravků s metadonem obsahujících povidon Metadon je syntetický opioid. Metadon se používá k léčbě středně
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7 Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku Léková
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7 Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku Léková
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 3 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek pro přípravu injekční suspenze: Léčivá látka: Triptorelinum..... 4,2 mg *) (Ut triptorelini
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 3 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek pro přípravu injekční suspenze: Léčivá látka: Triptorelinum..... 4,2 mg *) (Ut triptorelini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls155572/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Sp.zn. sukls155572/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 7 Vědecké závěry Amitriptylin je dobře známé tricyklické antidepresivum s prokázaným mechanismem účinku a použitím (Brunton 2011). Amitriptylin je terciární amin, který působí
Příloha II Vědecké závěry 7 Vědecké závěry Amitriptylin je dobře známé tricyklické antidepresivum s prokázaným mechanismem účinku a použitím (Brunton 2011). Amitriptylin je terciární amin, který působí
Požadavky na farmaceutickou dokumentaci
 1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls173618/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls173618/2014 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CYSAXAL 100 mg tablety. Léčivá látka: Cyproteroni acetas
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CYSAXAL 100 mg tablety Léčivá látka: Cyproteroni acetas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CYSAXAL 100 mg tablety Léčivá látka: Cyproteroni acetas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls77487/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Jedna předplněná injekční stříkačka s práškem pro přípravu injekčního roztoku obsahuje 7,5 mg leuprorelini acetas, což odpovídá 6,96 mg leuprorelinum.
 sp. zn. sukls155452/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
sp. zn. sukls155452/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční
Příloha č. 3 k rozhodnutí o registraci sp.zn.:sukls55932/2008
 Příloha č. 3 k rozhodnutí o registraci sp.zn.:sukls55932/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LUCRIN DEPOT 30 mg Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.:sukls55932/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LUCRIN DEPOT 30 mg Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha II. Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Yvidually a souvisejících
Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Yvidually a souvisejících
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
Jedna předplněná injekční stříkačka s práškem pro injekční roztok obsahuje leuprorelini acetas 22,5 mg, což odpovídá leuprorelinum 20,87 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
Jedna předplněná injekční stříkačka s práškem pro injekční roztok obsahuje leuprorelini acetas 22,5 mg, což odpovídá leuprorelinum 20,87 mg.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls220020/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Sp.zn. sukls220020/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Proviron - 25 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesterolonum 25 mg v 1 tabletě Pomocné látky: monohydrát laktózy, methylparaben, propylparaben
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Proviron - 25 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesterolonum 25 mg v 1 tabletě Pomocné látky: monohydrát laktózy, methylparaben, propylparaben
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá goserelinum 10,8 mg).
 sp.zn. sukls73360/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá goserelinum
sp.zn. sukls73360/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZOLADEX DEPOT 10,8 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Goserelini acetas v 1 předplněné injekční stříkačce (odpovídá goserelinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 45 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 7,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční roztok
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ELIGARD 22,5 mg prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s práškem pro injekční
