Fázové rozhraní - plocha,na které se vlastnosti systému mění skokem ; fáze o určité tloušťce
|
|
|
- Štěpánka Dostálová
- před 7 lety
- Počet zobrazení:
Transkript
1 Fázové rozhraní Fázové rozhraní - plocha,na které se vlastnosti systému mění skokem ; fáze o určité tloušťce Homogenní - kapalina/plyn - povrch;kapalina/kapalina Nehomogenní - tuhá látka/plyn - povrch; tuhá látka/kapalina;tuhá látka/ tuhá látka Vlastnosti fázového rozhraní jsou ovlivňovány vlastnostmi stýkajících se fází. Molekuly ve fázovém rozhraní nejsou nehybné; tenká oblast mezifází je ve velmi turbulentním stavu. Většinou nastává rychlá výměna molekul.
2 Fázové rozhraní Plocha fázového rozhraní a tedy i podíl molekul, umístěných ve fázovém rozhraní roste se zmenšujícím se lineárním rozměrem částic. U systémů s velkým poměrem plochy fázového rozhraní k objemu systému připadá významný příspěvek na molekuly umístěné ve fázovém rozhraní.
3 Fázové rozhraní Závislost velikosti plochy fázového rozhraní A na poloměru r a počtu částic N vzniklých rozdělením kapky o objemu 1 cm 3 na částice stejné velikosti N (CM 3 ) R (M ) 6, , , , , , , , A (M 2 ) 4, , , , ,84 48,
4 Fázové rozhraní Vliv fázového rozhraní na vlastnosti systému je zvláště významný: u heterogenních disperzních systémů jejichž disperzní částice jsou malé; jsou to mikrodisperzní a hlavně heterogenní koloidně disperzní systémy s rozměry částic 1 nm až 1 μm, kde povrch částic dosahuje až řádově 1000 m 2 /cm 3 u tuhých porézních látek, které mají specifické povrchy také až 1000 m 2 /g.
5 Základní charakteristiky Existence rozdílných mezimolekulárních interakcí uvnitř kapaliny a na fázovém rozhraní se projevuje tím, že na vytvoření určité plochy nového povrchu (da) je třeba vynaložit práci (dw s ), která je úměrná počtu molekul převedených z objemové fáze do fázového rozhraní a tedy ploše nově vytvořeného rozhraní: dw s = da - povrchová energie nebo povrchové napětí A - plocha fázového rozhraní
6 Základní charakteristiky Při popisu jevů na mobilních fázových rozhraních se častěji než mezifázové energie používá pojmu mezifázové (povrchové) napětí, které je definováno jako tečná síla, působící ve směru povrchu na jednotku délky; rozměr této veličiny je síla/délka (v SI soustavě N m 1 ; častěji se ale používá tisíckrát menší jednotky mn m 1, hodnoty v mn m 1 jsou stejné jako hodnoty vyjádřené ve starších jednotkách dyn cm 1 ). Obě veličiny, volná mezifázová energie i mezifázové napětí, se shodují jak rozměrově, tak číselně.
7 Základní charakteristiky C B B F D A A l F K tomu, aby se příčka A B posunula doprava o s cm, je nutno vynaložit práci W = F s. Při tomto posunu se zvětší povrch kapalinového filmu o 2 l s. Odtud plyne, že práce potřebná kzvětšení povrchu o plošnou jednotku má číselně i rozměrově stejnou hodnotu jako povrchové napětí. F s = 2 l s F 2 l =
8 Základní charakteristiky U systémů s nezanedbatelnou plochou fázového rozhraní jsou přítomností fázového rozhraní ovlivňovány termodynamické vlastnosti celého systému. Celková práce je pak dána součtem práce objemové, povrchové a popř. i elektrické dw = dw obj + dw S (+ dw el ) = p dv + da + E dq
9 Termodynamický popis Pro systémy bez elektrického náboje mají známé spojené formulace I. a II. věty termodynamické tvar du = T ds p dv + da dh = T ds + V dp + da df = S dt p dv + da dg = S dt + V dp + da Za konstantního složení pro termodynamickou definici mezifázové energii plyne U H F G = = = = A A A A SV, S, p T, Vi T, p
10 Termodynamický popis Mezifázová energie je tedy rovna pro izotermickoizochorické děje Helmholtzově energii vztažené na jednotku plochy fázového rozhraní, pro izotermickoizobarické děje pak Gibbsově energii vztažené na jednotku plochy fázového rozhraní. Při změně velikosti plochy fázového rozhraní při izobaricko-izotermních a izochoricko-izotermních dějích se vyměňuje nejen práce, ale také teplo.
11 Termodynamický popis Při vratné jednotkové změně plochy fázového rozhraní se součet práce W s a tepla Q s označuje jako celková mezifázová energie σ = [T, V] změna vnitřní energie [T, p] změna entalpie způsobené jednotkovou změnou plochy fázového rozhraní (obě veličiny mají prakticky stejné hodnoty; jedna z fází je vždy kondenzovaná, proto jsou velmi málo ovlivňované tlakem).
12 Termodynamický popis Povrchové napětí s teplotou vždy klesá ( S/ A) T > 0 (slabě závisí na povaze látky, pro mnoho látek se blíží hodnotě 0,1 mj m 2 K 1 ). Zvětšení entropie v povrchové vrstvě čisté kapaliny je možno vysvětlit větší pohyblivostí molekul v povrchové vrstvě ve srovnání s vnitřkem fáze.
13 Zakřivení fázového rozhraní Konfigurace kapalného menisku je určena rovnováhou mezifázových a hydrostatických sil. Tuto rovnováhu popisuje Laplaceova rovnice: ΔP = P α P β = LG 1 R R 2 P α -tlak ve fázi α; P β -tlak ve fázi β;r 1, R 2 -poloměry křivosti
14 Zakřivení fázového rozhraní konvexní konkávní R 1 fáze fáze R R 2 2 R 1 R 1 > 0, R 2 > 0 r r fáze fáze r r (kulovité) R 1 R 2 R 1 = R 2 = r, κ = 2/r r r fáze fáze (válcovité) R 2 fáze R 2 (sedlovité) R 1 = r, R 2, κ = 1/r R1 R 1 fáze R 1 > 0, R 2 <0
15 Zakřivení fázového rozhraní Kritérium rovnováhy: p dv p dv da = 0 i válec e kapka dv = dv = dv p i válec Laplaceova rovnice: kapka da pe = = κ dv střední křivost 1 1 κ = + R R 1 2
16 Zakřivení fázového rozhraní Rozhraní kulovitého tvaru r A 2 = 4π r da = = 3 π r dv = 4 V π r dr π 2 r dr da 8 π r dr 2 = = π 2 dv 4 r dr r p i p = e 2 r Rozhraní válcovitého tvaru r R1 = r, R2 pi pe = r
17 Rovnováha na rozhraní tří fází Uspořádání třífázového systému závisí na hodnotách mezifázových energií. Mezifázová energie (mezifázové napětí) je vlastnost, která charakterizuje rozhraní mezi dvěma objemovými fázemi; rozhraní třífází průsečnice tří dvoufázových rozhraní je charakterizováno smáčecím (kontaktním) úhlem.
18 Rovnováha na rozhraní tří fází Hodnoty mezifázových energií a úhlu smáčecího úhlu umožňují porozumět takovým jevům jako jsou smáčení a rozestírání, které jsou důležité v řadě prakticky významných pochodů, jako např. detergence, příprava vodovzdorných povrchů, příprava ochranných povrchových vrstev, aplikace instekticidů,...,
19 Rovnováha na rozhraní tří fází i v mnohých inženýrských procesech přenos tepla v zařízeních, kde hlavní úlohu hraje vypařování a kondenzace, flotace aj. Studium mezifázových vlastností umožňuje nejen tyto jevy pochopit, ale také zjistit, jak ovlivnit vlastnosti fázového rozhraní, aby uvedené pochody probíhaly žádaným způsobem.
20 Rovnováha na rozhraní tří fází Jak mezifázové energie tak kontaktní úhel jsou veličiny, které mají původ v mezimolekulárních interakcích v objemových fázích. Jejich vzájemný vztah lze ukázat na příkladu třífázového systému kapka kapaliny umístěná na rovný povrch tuhé fáze
21 Rovnováha na rozhraní tří fází Youngova rovnice sg 0< θ < 90 = + cosθ s cosθ = sg g g s 0< cosθ < 1 sg < s g sg < + s g sg > s sg lg θ
22 Rovnováha na rozhraní tří fází cosθ = sg g s sg 90 < θ < 180 < + s g 1< cosθ < 0 sg < s sg < s g sg lg θ sl
23 Rovnováha na rozhraní tří fází rozestírání sg > cosθ 1 s g sg > + s g
24 Rovnováha na rozhraní tří fází θ = 0 dokonalé smáčení 0<θ <90 kapalina tuhou látku dobře smáčí tuhý povrch je lyofilní (např. křemen, sklo, oxidy a hydroxidy kovů atd.) 90 < θ < 180 kapalina tuhou látku špatně smáčí (nesmáčí) tuhý povrch je lyofobní (např. pevné uhlovodíky a jejich fluorované deriváty, polymery, listy rostlin, chit inová pokrývka hmyzu, kůže živočichů)
25 Youngova rovnice sg sl = lg cos θ (1) Platnost této jednoduché rovnice je již po staletí (kvalitativně ji navrhl již v r Thomas Young) předmětem diskusí: Youngova rovnice předpokládá ideální hladký homogenní povrch. I pečlivě připravené reálné povrchy však mohou být zcela jiné: drsné (každá rýha na povrchu může působit jako kapilára, v níž kapalina stoupá, je-li θ ostrý, nebo klesá, je-li θ tupý; drsný povrch je tedy obvykle lépe smáčen dobře smáčejícími kapalinami než povrch hladký, zatímco špatně smáčející kapaliny se budou lépe rozestírat na hladkých površích)
26 Youngova rovnice chemicky nehomogenní Oba tyto vlivy mohou být vzaty v úvahu v modifikované Youngově rovnici formou empirických koeficientů. Drsnost povrchu se koriguje zavedením koeficientu β > 1, neboť reálný povrch je větší než rovinný ideální povrch, do něhož se promítá lg : β lg cos θ = sg sl (2)
27 Youngova rovnice Hodnotu koeficientu β je možno zjistit porovnáním hodnot cos θ naměřených na drsném a hladkém povrchu. Také chemickou heterogenitu lze korigovat empirickými koeficienty. Jsou-li na povrchu např. dvě chemicky rozdílné složky, zastoupené zlomky ϕ 1 a ϕ 2 (ϕ 1 + ϕ 2 = 1), pak pro drsný povrch platí β lg cos θ = ϕ 1 ( s1g s1l ) + ϕ 2 ( s2g s2l ) (3)
28 Youngova rovnice I když tento tvar Youngovy rovnice popisuje reálné povrchy, obsahuje korekční faktory, které je obtížné vyhodnotit nezávisle. Vážnější problém je otázka, zda tuhý povrch je ve stavu skutečné termodynamické rovnováhy. Kolmo k povrchu tuhé látky působí složka povrchového napětí kapaliny lg sin θ, která může způsobit deformaci na obvodu kapky. I když u dostatečně pevných látek tato síla nestačí na deformaci povrchu, není jisté, že stav takového povrchu je termodynamicky stejný jako povrchu stav ideálního.
29 Youngova rovnice Vzhledem k tomu, že v Youngově rovnici vystupuje rozdíl sg sl, lze předpokládat, že případný nerovnovážný stav tuhé látky nepodstatný; v obou členech se totiž vyskytuje tatáž tuhá fáze a proto jde v podstatě pouze o lokální rozdíl mezi sousedními fázemi jednou kapalnou a jednou plynnou Jinou možností je eliminovat rozdíl sg sl a otestovat platnost Youngovy rovnice pomocí ekvivalentní, experimentálně přístupné veličiny, smáčecího tepla, pro které platí
30 Youngova rovnice s sg s s smáčení H H H = Δ dt d T H s = kde = dt d T dt d T sg sg s s ) ( ) ( sg s sg s dt d T =
31 Youngova rovnice Podle Youngovy rovnice je s sg = g cosθ ΔH smáčení = g cosθ + T d dt ( g cosθ )
32 Youngova rovnice Na povrchu tuhé látky může docházet k adsorpci, která vede ke snížení povrchové energie tuhé látky z hodnoty so (povrchová energie tuhé látky v rovnováze s vlastní parou) na hodnotu sg (povrchová energie tuhé látky v rovno-váze s parou kapaliny, popř. dalších látek přítomných v plynné fázi např. vody); rozdíl so sg = π (5) je označován jako povrchový nebo rozestírací tlak. Youngova rovnice má pak tvar lg cos θ = so π sl (6)
33 Youngova rovnice Je zřejmé, že hodnota θ se bude měnit v závislosti na hodnotách π. Tento vliv se významně uplatňuje u tuhých látek o vysoké povrchové energii (např. sklo, křemen, kovy, kovové oxidy, anorganické soli), která se adsorpcí snižuje. Jsou-li k dispozici adsorpční data (taková data jsou ale vzácná), je možno určit povrchový tlak integrací Gibbsovy adsorpční izotermy μ i = π (7) so sg = Γ μ io i,1 dμ i
34 Youngova rovnice (Γ i,1 je relativní adsorpce, μ i chemický potenciál). U nízkoenergetických povrchů (tuhé organické sloučeniny včetně polymerů) se so a sg jen málo liší povrchový tlak je nízký a obvykle se předpokládá, že jej lze zanedbat. Mezi tuhou látkou a kapalinou může docházet k chemické reakci krozpouštění tuhé látky kapalinou k botnání tuhé látky Při všech těchto dějích se mění sg i sl a tedy i pozorovaný úhel smáčení s časem.
35 Youngova rovnice Pro velmi malé kapky může k energetice smáčení značně přispívat také energie obvodu smáčení, tzv. liniové napětí κ. Tato veličina může nabývat jak kladné tak záporné hodnoty, které se pohybují od do 10 5 N ; pozitivní τ působí smršťování obvodu smáčení a tedy zvětšování úhlu smáčení, negativní τ naopak jeho zvětšování. Youngovu rovnici je pro tento případ třeba upravit do tvaru sg sl τ δ = lg cos θ (7)
36 Youngova rovnice kde δ je křivost obvodu smáčení (pro kruhový obvod smáčení δ = 1/r). Pro velké kapky je δ 0 a člen s liniovým napětím z rovnice (7) vymizí. Vliv liniového napětí může být významný u systémů s velmi malými poloměry linie smáčení (r <10nm, např. při heterogenní nukleaci, opalescenci kapiček kapaliny nebo kapilární kondenzaci v pórovitých tuhých látkách).
37 Youngova rovnice r r
1. Fázové rozhraní 1-1
 1. Fázové rozhraní 1.1 Charakteristika fázového rozhraní Velmi často se setkáváme s řadou fyzikálních či chemických procesů, které probíhají na rozhraní mezi sousedícími objemovými fázemi (fáze - určitá
1. Fázové rozhraní 1.1 Charakteristika fázového rozhraní Velmi často se setkáváme s řadou fyzikálních či chemických procesů, které probíhají na rozhraní mezi sousedícími objemovými fázemi (fáze - určitá
Interakce mezi kapalinou a vlákenným materiálem
 3. přednáška Interakce mezi kapalinou a vlákenným materiálem Jedním ze základních parametrů, které řídí interakci mezi kapalinou a pevnou látkou je GEOMETIE PEVNÉ LÁTKY (tvar strukturní komponenty a relativní
3. přednáška Interakce mezi kapalinou a vlákenným materiálem Jedním ze základních parametrů, které řídí interakci mezi kapalinou a pevnou látkou je GEOMETIE PEVNÉ LÁTKY (tvar strukturní komponenty a relativní
Chemie povrchů verze 2013
 Chemie povrchů verze 2013 Definice povrchu složitá, protože v nanoměřítku (na úrovni velikosti atomů) je elektronový obal atomů difúzní většinou definován fyzikální adsorpcí nereaktivních plynů Vlastnosti
Chemie povrchů verze 2013 Definice povrchu složitá, protože v nanoměřítku (na úrovni velikosti atomů) je elektronový obal atomů difúzní většinou definován fyzikální adsorpcí nereaktivních plynů Vlastnosti
Interakce mezi kapalinou a vlákenným materiálem
 3. přednáška Interakce mezi kapalinou a vlákenným materiálem OPAKOVÁNÍ Soudržnost dvou spojovaných ploch, tedy vazba mezi pevným povrchem vláken a adhezivem (pojivem) je chápána jako ADHEZE. Primární i
3. přednáška Interakce mezi kapalinou a vlákenným materiálem OPAKOVÁNÍ Soudržnost dvou spojovaných ploch, tedy vazba mezi pevným povrchem vláken a adhezivem (pojivem) je chápána jako ADHEZE. Primární i
2.2 Snížení energie systému záměnou fázových rozhraní Rovnováha na rozhraní tří fází
 2.2 Snížení energie systému záměnou fázových rozhraní Rovnováha na rozhraní tří fází Jevy na rozhraní tří stýkajících se fází, z nichž alespoň dvě jsou tekutiny (plyn nebo kapalina), jsou označovány termínem
2.2 Snížení energie systému záměnou fázových rozhraní Rovnováha na rozhraní tří fází Jevy na rozhraní tří stýkajících se fází, z nichž alespoň dvě jsou tekutiny (plyn nebo kapalina), jsou označovány termínem
Vlastnosti kapalin. Povrchová vrstva kapaliny
 Struktura a vlastnosti kapalin Vlastnosti kapalin, Povrchová vrstva kapaliny Jevy na rozhraní pevného tělesa a kapaliny Kapilární jevy, Teplotní objemová roztažnost Vlastnosti kapalin Kapalina - tvoří
Struktura a vlastnosti kapalin Vlastnosti kapalin, Povrchová vrstva kapaliny Jevy na rozhraní pevného tělesa a kapaliny Kapilární jevy, Teplotní objemová roztažnost Vlastnosti kapalin Kapalina - tvoří
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 8. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Adhezní síly v kompozitech
 Adhezní síly v kompozitech Nanokompozity Pro 5. ročník nanomateriály Fakulta mechatroniky Katedra materiálu Strojní fakulty Technická univerzita v Liberci Doc. Ing. Karel Daďourek, 2010 Vazby na rozhraní
Adhezní síly v kompozitech Nanokompozity Pro 5. ročník nanomateriály Fakulta mechatroniky Katedra materiálu Strojní fakulty Technická univerzita v Liberci Doc. Ing. Karel Daďourek, 2010 Vazby na rozhraní
Adhezní síly. Technická univerzita v Liberci Kompozitní materiály, 5. MI Doc. Ing. Karel Daďourek 2008
 Adhezní síly Technická univerzita v Liberci Kompozitní materiály, 5. MI Doc. Ing. Karel Daďourek 2008 Vazby na rozhraní Mezi fázemi v kompozitu jsou rozhraní mezifázové povrchy. Možné vazby na rozhraní
Adhezní síly Technická univerzita v Liberci Kompozitní materiály, 5. MI Doc. Ing. Karel Daďourek 2008 Vazby na rozhraní Mezi fázemi v kompozitu jsou rozhraní mezifázové povrchy. Možné vazby na rozhraní
Mol. fyz. a termodynamika
 Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Molekulová fyzika pracuje na základě kinetické teorie látek a statistiky Termodynamika zkoumání tepelných jevů a strojů nezajímají nás jednotlivé částice Molekulová fyzika základem jsou: Látka kteréhokoli
Měření povrchového napětí kapalin a kontaktních úhlů
 2. Přednáška Interakce mezi kapalinou a vlákenným materiálem Měření povrchového napětí kapalin a kontaktních úhlů Eva Kuželová Košťáková KCH, FP, TUL 2019 ADHEZE KAPALIN K PEVNÝM LÁTKÁM Povrchové napětí
2. Přednáška Interakce mezi kapalinou a vlákenným materiálem Měření povrchového napětí kapalin a kontaktních úhlů Eva Kuželová Košťáková KCH, FP, TUL 2019 ADHEZE KAPALIN K PEVNÝM LÁTKÁM Povrchové napětí
LOGO. Struktura a vlastnosti kapalin
 Struktura a vlastnosti kapalin Povrchová vrstva kapaliny V přírodě velmi často pozorujeme, že se povrch kapaliny, např. vody, chová jako pružná blána, která unese např. hmyz Vysvětlení: Molekuly kapaliny
Struktura a vlastnosti kapalin Povrchová vrstva kapaliny V přírodě velmi často pozorujeme, že se povrch kapaliny, např. vody, chová jako pružná blána, která unese např. hmyz Vysvětlení: Molekuly kapaliny
KAPALINY. Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník
 KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
KAPALINY Mgr. Jan Ptáčník - GJVJ - Fyzika - Termika - 2. ročník Kapaliny Krátkodosahové uspořádání molekul. Molekuly kmitají okolo rovnovážných poloh. Při zvýšení teploty se zmenšuje doba setrvání v rovnovážné
Základem molekulové fyziky je kinetická teorie látek. Vychází ze tří pouček:
 Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Molekulová fyzika zkoumá vlastnosti látek na základě jejich vnitřní struktury, pohybu a vzájemného působení částic, ze kterých se látky skládají. Termodynamika se zabývá zákony přeměny různých forem energie
Při reálném chromatografickém ději nikdy nedojde k ustavení rovnováhy mezi oběma fázemi První ucelená teorie respektující uvedenou skutečnost byla
 Teorie chromatografie - III Příprava předmětu byla podpořena projektem OPPA č. CZ.2.17/3.1.00/33253 4.3.3 Teorie dynamická Při reálném chromatografickém ději nikdy nedojde k ustavení rovnováhy mezi oběma
Teorie chromatografie - III Příprava předmětu byla podpořena projektem OPPA č. CZ.2.17/3.1.00/33253 4.3.3 Teorie dynamická Při reálném chromatografickém ději nikdy nedojde k ustavení rovnováhy mezi oběma
Obr. 9.1 Kontakt pohyblivé části s povrchem. Tomuto meznímu stavu za klidu odpovídá maximální síla, která se nezývá adhezní síla,. , = (9.
 9. Tření a stabilita 9.1 Tření smykové v obecné kinematické dvojici Doposud jsme předpokládali dokonale hladké povrchy stýkajících se těles, kdy se silové působení přenášelo podle principu akce a reakce
9. Tření a stabilita 9.1 Tření smykové v obecné kinematické dvojici Doposud jsme předpokládali dokonale hladké povrchy stýkajících se těles, kdy se silové působení přenášelo podle principu akce a reakce
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny
 Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Transportní jevy v plynech Reálné plyny Fázové přechody Kapaliny Hustota toku Zatím jsme studovali pouze soustavy, které byly v rovnovážném stavu není-li soustava v silovém poli, je hustota částic stejná
Fáze a fázové přechody
 Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
Kvantová a statistická fyzika 2 (Termodynamika a statistická fyzika) Fáze a fázové přechody Pojem fáze je zobecněním pojmu skupenství, označuje homogenní část makroskopického tělesa. Jednotlivé fáze v
2.4 Stavové chování směsí plynů Ideální směs Ideální směs reálných plynů Stavové rovnice pro plynné směsi
 1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
1. ZÁKLADNÍ POJMY 1.1 Systém a okolí 1.2 Vlastnosti systému 1.3 Vybrané základní veličiny 1.3.1 Množství 1.3.2 Délka 1.3.2 Délka 1.4 Vybrané odvozené veličiny 1.4.1 Objem 1.4.2 Hustota 1.4.3 Tlak 1.4.4
4. Napjatost v bodě tělesa
 p04 1 4. Napjatost v bodě tělesa Předpokládejme, že bod C je nebezpečným bodem tělesa a pro zabránění vzniku mezních stavů je m.j. třeba zaručit, že napětí v tomto bodě nepřesáhne definované mezní hodnoty.
p04 1 4. Napjatost v bodě tělesa Předpokládejme, že bod C je nebezpečným bodem tělesa a pro zabránění vzniku mezních stavů je m.j. třeba zaručit, že napětí v tomto bodě nepřesáhne definované mezní hodnoty.
STRUKTURA A VLASTNOSTI KAPALIN
 STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
STRUKTURA A VLASTNOSTI KAPALIN Struktura kapalin je něco mezi plynem a pevnou látkou Částice kmitají ale mohou se také přemísťovat Zvýšením teploty se a tím se zvýší tekutost kapaliny Malé vzdálenosti
Skupenské stavy látek. Mezimolekulární síly
 Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Skupenské stavy látek Mezimolekulární síly 1 Interakce iont-dipól Např. hydratační (solvatační) interakce mezi Na + (iont) a molekulou vody (dipól). Jde o nejsilnější mezimolekulární (nevazebnou) interakci.
Kapitola 3.6 Charakterizace keramiky a skla POVRCHOVÉ VLASTNOSTI. Jaroslav Krucký, PMB 22
 Kapitola 3.6 Charakterizace keramiky a skla POVRCHOVÉ VLASTNOSTI Jaroslav Krucký, PMB 22 SYMBOLY Řecká písmena θ: kontaktní úhel. σ: napětí. ε: zatížení. ν: Poissonův koeficient. λ: vlnová délka. γ: povrchová
Kapitola 3.6 Charakterizace keramiky a skla POVRCHOVÉ VLASTNOSTI Jaroslav Krucký, PMB 22 SYMBOLY Řecká písmena θ: kontaktní úhel. σ: napětí. ε: zatížení. ν: Poissonův koeficient. λ: vlnová délka. γ: povrchová
Adhezní síly v kompozitních materiálech
 Adhezní síly v kompozitních materiálech Obsah přednášky Adhezní síly, jejich původ a velikost. Adheze a smáčivost. Metoty určování adhezních sil. Adhezní síly na rozhraní Mezi fázemi v kompozitu jsou rozhraní
Adhezní síly v kompozitních materiálech Obsah přednášky Adhezní síly, jejich původ a velikost. Adheze a smáčivost. Metoty určování adhezních sil. Adhezní síly na rozhraní Mezi fázemi v kompozitu jsou rozhraní
Mezi krystalické látky nepatří: a) asfalt b) křemík c) pryskyřice d) polvinylchlorid
 Mezi krystalické látky nepatří: a) asfalt b) křemík c) pryskyřice d) polvinylchlorid Mezi krystalické látky patří: a) grafit b) diamant c) jantar d) modrá skalice Mezi krystalické látky patří: a) rubín
Mezi krystalické látky nepatří: a) asfalt b) křemík c) pryskyřice d) polvinylchlorid Mezi krystalické látky patří: a) grafit b) diamant c) jantar d) modrá skalice Mezi krystalické látky patří: a) rubín
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno
 Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Přednášky z lékařské biofyziky Biofyzikální ústav Lékařské fakulty Masarykovy univerzity, Brno JAMES WATT 19.1.1736-19.8.1819 Termodynamika principy, které vládnou přírodě Obsah přednášky Vysvětlení základních
Podle skupenského stavu stýkajících se objemových fází: kapalina / plyn (l/g) - povrch kapalina / kapalina (l/l) tuhá látka / plyn (s/g) - povrch
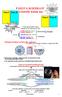 Fáze I Fáze II FÁZOVÁ ROZHRANÍ a koloidy kolem nás z mikroskopického, molekulárního hlediska Fáze I Fáze II z makroskopického hlediska Podle skupenského stavu stýkajících se objemových fází: kapalina /
Fáze I Fáze II FÁZOVÁ ROZHRANÍ a koloidy kolem nás z mikroskopického, molekulárního hlediska Fáze I Fáze II z makroskopického hlediska Podle skupenského stavu stýkajících se objemových fází: kapalina /
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů
 Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Termodynamika (td.) se obecně zabývá vzájemnými vztahy a přeměnami různých druhů energií (mechanické, tepelné, elektrické, magnetické, chemické a jaderné) při td. dějích. Na rozdíl od td. cyklických dějů
Fyzikální chemie. Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302. 14. února 2013
 Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
Fyzikální chemie Magda Škvorová KFCH CN463 magda.skvorova@ujep.cz, tel. 3302 14. února 2013 Co je fyzikální chemie? Co je fyzikální chemie? makroskopický přístup: (klasická) termodynamika nerovnovážná
VLASTNOSTI KAPALIN. Část 2. Literatura : Otakar Maštovský; HYDROMECHANIKA Jaromír Noskijevič; MECHANIKA TEKUTIN František Šob; HYDROMECHANIKA
 HYDROMECHANIKA LASTNOSTI KAPALIN Část 2 Literatura : Otakar Maštovský; HYDROMECHANIKA Jaromír Noskijevič; MECHANIKA TEKUTIN František Šob; HYDROMECHANIKA lastnosti kapalin: Molekulární stavba hmoty Příklad
HYDROMECHANIKA LASTNOSTI KAPALIN Část 2 Literatura : Otakar Maštovský; HYDROMECHANIKA Jaromír Noskijevič; MECHANIKA TEKUTIN František Šob; HYDROMECHANIKA lastnosti kapalin: Molekulární stavba hmoty Příklad
Nauka o materiálu. Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny
 Nauka o materiálu Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny Difuze v tuhých látkách Difuzí nazýváme přesun atomů nebo iontů na vzdálenost větší než je meziatomová vzdálenost. Hnací
Nauka o materiálu Přednáška č.10 Difuze v tuhých látkách, fáze a fázové přeměny Difuze v tuhých látkách Difuzí nazýváme přesun atomů nebo iontů na vzdálenost větší než je meziatomová vzdálenost. Hnací
Termodynamika materiálů. Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn
 Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
Termodynamika materiálů Vztahy a přeměny různých druhů energie při termodynamických dějích podmínky nutné pro uskutečnění fázových přeměn Důležité konstanty Standartní podmínky Avogadrovo číslo N A = 6,023.10
PROCESY V TECHNICE BUDOV 8
 UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
UNIVERZITA TOMÁŠE BATI VE ZLÍNĚ FAKULTA APLIKOVANÉ INFORMATIKY PROCESY V TECHNICE BUDOV 8 Dagmar Janáčová, Hana Charvátová Zlín 2013 Tento studijní materiál vznikl za finanční podpory Evropského sociálního
4. Měření některých fyzikálně-chemických charakteristik fázového rozhraní Equation Section 4 R (4.1)
 4. Měření některých fyzikálně-chemických charakteristik fázového rozhraní Equation Section 4 4.1 Povrchové a mezifázové napětí Mezi nejpoužívanější metody pro stanovení povrchového a mezifázového napětí
4. Měření některých fyzikálně-chemických charakteristik fázového rozhraní Equation Section 4 4.1 Povrchové a mezifázové napětí Mezi nejpoužívanější metody pro stanovení povrchového a mezifázového napětí
Nanomateriály a jejich charakterizace (2+0), navazující Mrg. 1 roč. ZS, CN349, Čt 9-11
 Nanomateriály a jejich charakterizace (2+0), navazující Mrg. 1 roč. ZS, CN349, Čt 9-11 2. Přednáška, 1.11.2012 Studium povrchových vlastností nanostrukturovaných materiálů (ablace materiálu, goniometrie,
Nanomateriály a jejich charakterizace (2+0), navazující Mrg. 1 roč. ZS, CN349, Čt 9-11 2. Přednáška, 1.11.2012 Studium povrchových vlastností nanostrukturovaných materiálů (ablace materiálu, goniometrie,
Fyzikální chemie. ochrana životního prostředí analytická chemie chemická technologie denní. Platnost: od 1. 9. 2009 do 31. 8. 2013
 Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Učební osnova předmětu Fyzikální chemie Studijní obor: Aplikovaná chemie Zaměření: Forma vzdělávání: Celkový počet vyučovacích hodin za studium: Analytická chemie Chemická technologie Ochrana životního
Třídění látek. Chemie 1.KŠPA
 Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Třídění látek Chemie 1.KŠPA Systém (soustava) Vymezím si kus prostoru, látky v něm obsažené nazýváme systém soustava okolí svět Stěny soustavy Soustava může být: Izolovaná = stěny nedovolí výměnu částic
Adsorpce. molekulární adsorpce: (g) (s), (l) (s)/(l),... iontová adsorpce Paneth Fajans. výměnná iontová adsorpce, protionty v aluminosilikátech
 Adsorpce 1/15 molekulární adsorpce: (g) (s), (l) (s)/(l),... iontová adsorpce Paneth Fajans výměnná iontová adsorpce, protionty v aluminosilikátech Ar na grafitu adsorpce: na povrch/rozhraní absorpce:
Adsorpce 1/15 molekulární adsorpce: (g) (s), (l) (s)/(l),... iontová adsorpce Paneth Fajans výměnná iontová adsorpce, protionty v aluminosilikátech Ar na grafitu adsorpce: na povrch/rozhraní absorpce:
1. Molekulová stavba kapalin
 1 Molekulová stavba kapalin 11 Vznik kapaliny kondenzací Plyn Vyjdeme z plynu Plyn je soustava molekul pohybujících se neuspořádaně všemi směry Pohybová energie molekul převládá nad energii polohovou Každá
1 Molekulová stavba kapalin 11 Vznik kapaliny kondenzací Plyn Vyjdeme z plynu Plyn je soustava molekul pohybujících se neuspořádaně všemi směry Pohybová energie molekul převládá nad energii polohovou Každá
2 Jevy na rozhraní Kapilární tlak Kapilární jevy Objemová roztažnost kapalin 7
 Obsah Obsah 1 Povrchová vrstva 1 2 Jevy na rozhraní 3 2.1 Kapilární tlak........................... 4 2.2 Kapilární jevy........................... 5 3 Objemová roztažnost kapalin 7 1 Povrchová vrstva
Obsah Obsah 1 Povrchová vrstva 1 2 Jevy na rozhraní 3 2.1 Kapilární tlak........................... 4 2.2 Kapilární jevy........................... 5 3 Objemová roztažnost kapalin 7 1 Povrchová vrstva
1141 HYA (Hydraulika)
 ČVUT v Praze, fakulta stavební katedra hydrauliky a hydrologie (K4) Přednáškové slidy předmětu 4 HYA (Hydraulika) verze: 09/008 K4 Fv ČVUT Tato webová stránka nabízí k nahlédnutí/stažení řadu pdf souborů
ČVUT v Praze, fakulta stavební katedra hydrauliky a hydrologie (K4) Přednáškové slidy předmětu 4 HYA (Hydraulika) verze: 09/008 K4 Fv ČVUT Tato webová stránka nabízí k nahlédnutí/stažení řadu pdf souborů
Osnova pro předmět Fyzikální chemie II magisterský kurz
 Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
Osnova pro předmět Fyzikální chemie II magisterský kurz Časový a obsahový program přednášek Týden Obsahová náplň přednášky Pozn. Stavové chování tekutin 1,2a 1, 2a Molekulární přístup kinetická teorie
Struktura a vlastnosti kapalin
 Struktura a vlastnosti kapalin (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Povrchová vrstva Jevy na rozhraní Kapilární tlak Kapilární jevy Objemová roztažnost
Struktura a vlastnosti kapalin (test version, not revised) Petr Pošta pposta@karlin.mff.cuni.cz 24. listopadu 2010 Obsah Povrchová vrstva Jevy na rozhraní Kapilární tlak Kapilární jevy Objemová roztažnost
7 Lineární elasticita
 7 Lineární elasticita Elasticita je schopnost materiálu pružně se deformovat. Deformace ideálně elastických látek je okamžitá (časově nezávislá) a dokonale vratná. Působí-li na infinitezimální objemový
7 Lineární elasticita Elasticita je schopnost materiálu pružně se deformovat. Deformace ideálně elastických látek je okamžitá (časově nezávislá) a dokonale vratná. Působí-li na infinitezimální objemový
Připravil: Roman Pavlačka, Markéta Sekaninová Hydrostatika
 Připravil: Roman Pavlačka, Markéta Sekaninová Hydrostatika OPVK CZ.1.07/2.2.00/28.0220, "Inovace studijních programů zahradnických oborů s důrazem na jazykové a odborné dovednosti a konkurenceschopnost
Připravil: Roman Pavlačka, Markéta Sekaninová Hydrostatika OPVK CZ.1.07/2.2.00/28.0220, "Inovace studijních programů zahradnických oborů s důrazem na jazykové a odborné dovednosti a konkurenceschopnost
4. Kolmou tlakovou sílu působící v kapalině na libovolně orientovanou plochu S vyjádříme jako
 1. Pojem tekutiny je A) synonymem pojmu kapaliny B) pojmem označujícím souhrnně kapaliny a plyny C) synonymem pojmu plyny D) označením kapalin se zanedbatelnou viskozitou 2. Příčinou rozdílné tekutosti
1. Pojem tekutiny je A) synonymem pojmu kapaliny B) pojmem označujícím souhrnně kapaliny a plyny C) synonymem pojmu plyny D) označením kapalin se zanedbatelnou viskozitou 2. Příčinou rozdílné tekutosti
ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE
 ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE FAKULTA STAVEBNÍ OBOR GEODÉZIE A KARTOGRAFIE KATEDRA VYŠŠÍ GEODÉZIE název předmětu úloha/zadání název úlohy Fyzikální geodézie 2/7 Gravitační potenciál a jeho derivace
ČESKÉ VYSOKÉ UČENÍ TECHNICKÉ V PRAZE FAKULTA STAVEBNÍ OBOR GEODÉZIE A KARTOGRAFIE KATEDRA VYŠŠÍ GEODÉZIE název předmětu úloha/zadání název úlohy Fyzikální geodézie 2/7 Gravitační potenciál a jeho derivace
6. Viskoelasticita materiálů
 6. Viskoelasticita materiálů Viskoelasticita materiálů souvisí se schopností materiálů tlumit mechanické vibrace. Uvažujme harmonické dynamické namáhání (tzn. střídavě v tahu a tlaku) materiálu v oblasti
6. Viskoelasticita materiálů Viskoelasticita materiálů souvisí se schopností materiálů tlumit mechanické vibrace. Uvažujme harmonické dynamické namáhání (tzn. střídavě v tahu a tlaku) materiálu v oblasti
TERMOMECHANIKA 1. Základní pojmy
 1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
1 FSI VUT v Brně, Energetický ústav Odbor termomechaniky a techniky prostředí prof. Ing. Milan Pavelek, CSc. TERMOMECHANIKA 1. Základní pojmy OSNOVA 1. KAPITOLY Termodynamická soustava Energie, teplo,
ÚVOD DO TERMODYNAMIKY
 ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
ÚVOD DO TERMODYNAMIKY Termodynamika: Nauka o obecných zákonitostech, kterými se se řídí transformace CELKOVÉ energie makroskopických systémů v její různé formy. Je založena na výsledcích experimentílních
Do známky zkoušky rovnocenným podílem započítávají získané body ze zápočtového testu.
 Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
Podmínky pro získání zápočtu a zkoušky z předmětu Chemicko-inženýrská termodynamika pro zpracování ropy Zápočet je udělen, pokud student splní zápočtový test alespoň na 50 %. Zápočtový test obsahuje 3
15,45 17,90 19,80 21,28. 24,38 28,18 27,92 28,48 dichlormethan trichlormethan tetrachlormethan kys. mravenčí kys. octová kys. propionová kys.
 zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270C vodík 2 mn m při teplotě 253C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m rtuť při 0 o C = 470 mn m organické
zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270C vodík 2 mn m při teplotě 253C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m rtuť při 0 o C = 470 mn m organické
rtuť při 0 o C = 470 mn m 1 15,45 17,90 19,80 21,28
 zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
zkapalněné plyny - velmi nízké; např. helium 0354 mn m při teplotě 270 C vodík 2 mn m při teplotě 253 C roztavené kovy - velmi vysoké; např. měď při teplotě tání = 00 mn m organické látky při teplotě 25
8 Elasticita kaučukových sítí
 8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
8 Elasticita kaučukových sítí Elastomerní polymerní látky (např. kaučuky) tvoří ze / chemické příčné vazby a / fyzikální uzly. Vyznačují se schopností deformovat se již malou silou nejméně o 00 % své původní
Nultá věta termodynamická
 TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
TERMODYNAMIKA Nultá věta termodynamická 2 Práce 3 Práce - příklady 4 1. věta termodynamická 5 Entalpie 6 Tepelné kapacity 7 Vnitřní energie a entalpie ideálního plynu 8 Výpočet tepla a práce 9 Adiabatický
Klasická termodynamika (aneb pøehled FCH I)
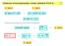 Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Klasická termodynamika (aneb pøehled FCH I) 1/16 0. zákon 1. zákon id. plyn: pv = nrt pv κ = konst (id., ad.) id. plyn: U = U(T) }{{} Carnotùv cyklus dq T = 0 2. zákon rg, K,... lim S = 0 T 0 S, ds = dq
Mechanika kontinua. Mechanika elastických těles Mechanika kapalin
 Mechanika kontinua Mechanika elastických těles Mechanika kapalin Mechanika kontinua Mechanika elastických těles Mechanika kapalin a plynů Kinematika tekutin Hydrostatika Hydrodynamika Kontinuum Pro vyšetřování
Mechanika kontinua Mechanika elastických těles Mechanika kapalin Mechanika kontinua Mechanika elastických těles Mechanika kapalin a plynů Kinematika tekutin Hydrostatika Hydrodynamika Kontinuum Pro vyšetřování
Řešení: Nejdříve musíme určit sílu, kterou působí kladka proti směru pohybu padajícího vědra a napíná tak lano. Moment síly otáčení kladky je:
 Přijímací zkouška na navazující magisterské studium - 16 Studijní program Fyzika - všechny obory kromě Učitelství fyziky-matematiky pro střední školy, Varianta A Příklad 1 (5 bodů) Jak dlouho bude padat
Přijímací zkouška na navazující magisterské studium - 16 Studijní program Fyzika - všechny obory kromě Učitelství fyziky-matematiky pro střední školy, Varianta A Příklad 1 (5 bodů) Jak dlouho bude padat
Fyzikální chemie Úvod do studia, základní pojmy
 Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
Fyzikální chemie Úvod do studia, základní pojmy HMOTA A JEJÍ VLASTNOSTI POSTAVENÍ FYZIKÁLNÍ CHEMIE V PŘÍRODNÍCH VĚDÁCH HISTORIE FYZIKÁLNÍ CHEMIE ZÁKLADNÍ POJMY DEFINICE FORMY HMOTY Formy a nositelé hmoty
GAUSSŮV ZÁKON ELEKTROSTATIKY
 GAUSSŮV ZÁKON ELEKTROSTATIKY PLOCHA JAKO VEKTOR Matematický doplněk n n Elementární plocha ΔS ds Ploše přiřadíme vektor, který 1) je k této ploše kolmý 2) má velikost rovnou velikosti (obsahu) plochy Δ
GAUSSŮV ZÁKON ELEKTROSTATIKY PLOCHA JAKO VEKTOR Matematický doplněk n n Elementární plocha ΔS ds Ploše přiřadíme vektor, který 1) je k této ploše kolmý 2) má velikost rovnou velikosti (obsahu) plochy Δ
b) Maximální velikost zrychlení automobilu, nemají-li kola prokluzovat, je a = f g. Automobil se bude rozjíždět po dobu t = v 0 fg = mfgv 0
 Řešení úloh. kola 58. ročníku fyzikální olympiády. Kategorie A Autoři úloh: J. Thomas, 5, 6, 7), J. Jírů 2,, 4).a) Napíšeme si pohybové rovnice, ze kterých vyjádříme dobu jízdy a zrychlení automobilu A:
Řešení úloh. kola 58. ročníku fyzikální olympiády. Kategorie A Autoři úloh: J. Thomas, 5, 6, 7), J. Jírů 2,, 4).a) Napíšeme si pohybové rovnice, ze kterých vyjádříme dobu jízdy a zrychlení automobilu A:
Autokláv reaktor pro promíchávané vícefázové reakce
 Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
Vysoká škola chemicko technologická v Praze Ústav organické technologie (111) Autokláv reaktor pro promíchávané vícefázové reakce Vypracoval : Bc. Tomáš Sommer Předmět: Vícefázové reaktory (prof. Ing.
U218 Ústav procesní a zpracovatelské techniky FS ČVUT v Praze. Seminář z PHTH. 3. ročník. Fakulta strojní ČVUT v Praze
 U218 Ústav procesní a zpracovatelské techniky FS ČVU v Praze Seminář z PHH 3. ročník Fakulta strojní ČVU v Praze U218 - Ústav procesní a zpracovatelské techniky 1 Seminář z PHH - eplo U218 Ústav procesní
U218 Ústav procesní a zpracovatelské techniky FS ČVU v Praze Seminář z PHH 3. ročník Fakulta strojní ČVU v Praze U218 - Ústav procesní a zpracovatelské techniky 1 Seminář z PHH - eplo U218 Ústav procesní
Neideální plyny. Z e dr dr dr. Integrace přes hybnosti. Neideální chování
 eideální plyny b H Q(, V, T )... e dp 3... dpdr... dr! h Integrace přes hybnosti QVT (,, ) pmkt! h 3 / e dr dr dr /... U kt... eideální chování p kt r B ( T) r B ( T) r 3 3 Vyšší koeficinety velice složité
eideální plyny b H Q(, V, T )... e dp 3... dpdr... dr! h Integrace přes hybnosti QVT (,, ) pmkt! h 3 / e dr dr dr /... U kt... eideální chování p kt r B ( T) r B ( T) r 3 3 Vyšší koeficinety velice složité
Měření povrchového napětí
 Měření povrchového napětí Úkol : 1. Změřte pomocí kapilární elevace povrchové napětí daných kapalin při dané teplotě. 2. Změřte pomocí kapkové metody povrchové napětí daných kapalin při dané teplotě. Pomůcky
Měření povrchového napětí Úkol : 1. Změřte pomocí kapilární elevace povrchové napětí daných kapalin při dané teplotě. 2. Změřte pomocí kapkové metody povrchové napětí daných kapalin při dané teplotě. Pomůcky
Tření je přítel i nepřítel
 Tření je přítel i nepřítel VIDEO K TÉMATU: http://www.ceskatelevize.cz/porady/10319921345-rande-s-fyzikou/video/ Tření je v určitých případech i prospěšné. Jde o to, že řada lidí si myslí, že tření má
Tření je přítel i nepřítel VIDEO K TÉMATU: http://www.ceskatelevize.cz/porady/10319921345-rande-s-fyzikou/video/ Tření je v určitých případech i prospěšné. Jde o to, že řada lidí si myslí, že tření má
6. Stavy hmoty - Plyny
 skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
skupenství plynné plyn x pára (pod kritickou teplotou) stavové chování Ideální plyn Reálné plyny Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti skupenství plynné reálný plyn ve stavu
Termodynamika v biochemii
 Termodynamika v biochemii Studium energetických změn Klasická x statistická Rovnovážná x nerovnovážná lineárn rní a nelineárn rní Základní pojmy Makroskopický systém, okolí systému Termodynamický systém
Termodynamika v biochemii Studium energetických změn Klasická x statistická Rovnovážná x nerovnovážná lineárn rní a nelineárn rní Základní pojmy Makroskopický systém, okolí systému Termodynamický systém
Základy vakuové techniky
 Základy vakuové techniky Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova konstanta), k = 1,38. 10-23 J/K.. Boltzmannova konstanta, T.. absolutní
Základy vakuové techniky Střední rychlost plynů Rychlost molekuly v p = (2 k N A ) * (T/M 0 ), N A = 6. 10 23 molekul na mol (Avogadrova konstanta), k = 1,38. 10-23 J/K.. Boltzmannova konstanta, T.. absolutní
VÝUKOVÝ MATERIÁL Ing. Yvona Bečičková Tematická oblast. Termika Číslo a název materiálu VY_32_INOVACE_0301_0220 Anotace
 VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
VÝUKOVÝ MATERIÁL Identifikační údaje školy Vyšší odborná škola a Střední škola, Varnsdorf, příspěvková organizace Bratislavská 2166, 407 47 Varnsdorf, IČO: 18383874 www.vosassvdf.cz, tel. +420412372632
Analýza napjatosti PLASTICITA
 Analýza napjatosti PLASTICITA TENZOR NAPĚTÍ Teplota v daném bodě je skalár, je to tenzor nultého řádu, který nezávisí na změně souřadného systému Síla je vektor, je to tenzor prvního řádu, v trojrozměrném
Analýza napjatosti PLASTICITA TENZOR NAPĚTÍ Teplota v daném bodě je skalár, je to tenzor nultého řádu, který nezávisí na změně souřadného systému Síla je vektor, je to tenzor prvního řádu, v trojrozměrném
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček
 Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Termomechanika 9. přednáška Doc. Dr. RNDr. Miroslav Holeček Upozornění: Tato prezentace slouží výhradně pro výukové účely Fakulty strojní Západočeské univerzity v Plzni. Byla sestavena autorem s využitím
Vlastnosti a zkoušení materiálů. Přednáška č.4 Úvod do pružnosti a pevnosti
 Vlastnosti a zkoušení materiálů Přednáška č.4 Úvod do pružnosti a pevnosti Teoretická a skutečná pevnost kovů Trvalá deformace polykrystalů začíná při vyšším napětí než u monokrystalů, tj. hodnota meze
Vlastnosti a zkoušení materiálů Přednáška č.4 Úvod do pružnosti a pevnosti Teoretická a skutečná pevnost kovů Trvalá deformace polykrystalů začíná při vyšším napětí než u monokrystalů, tj. hodnota meze
KLASICKÁ MECHANIKA. Předmětem mechaniky matematický popis mechanického pohybu v prostoru a v čase a jeho příčiny.
 MECHANIKA 1 KLASICKÁ MECHANIKA Předmětem mechaniky matematický popis mechanického pohybu v prostoru a v čase a jeho příčiny. Klasická mechanika rychlosti těles jsou mnohem menší než rychlost světla ve
MECHANIKA 1 KLASICKÁ MECHANIKA Předmětem mechaniky matematický popis mechanického pohybu v prostoru a v čase a jeho příčiny. Klasická mechanika rychlosti těles jsou mnohem menší než rychlost světla ve
3.3 Částicová stavba látky
 3.3 Částicová stavba látky Malé (nejmenší) částice látky očekávali nejprve filozofové (atomisté) a nazvali je atomy (z řeckého atomos = nedělitelný) starověké Řecko a Řím. Mnohem později chemici zjistili,
3.3 Částicová stavba látky Malé (nejmenší) částice látky očekávali nejprve filozofové (atomisté) a nazvali je atomy (z řeckého atomos = nedělitelný) starověké Řecko a Řím. Mnohem později chemici zjistili,
Kontraktantní/dilatantní
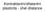 Kontraktantní/dilatantní plasticita - úhel dilatance směr přírůstku plastické deformace Na základě experimentálního měření dospěl St. Venant k závěru, že směry hlavních napětí jsou totožné se směry přírůstku
Kontraktantní/dilatantní plasticita - úhel dilatance směr přírůstku plastické deformace Na základě experimentálního měření dospěl St. Venant k závěru, že směry hlavních napětí jsou totožné se směry přírůstku
Gymnázium Jiřího Ortena, Kutná Hora
 Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
Předmět: Seminář chemie (SCH) Náplň: Obecná chemie, anorganická chemie, chemické výpočty, základy analytické chemie Třída: 3. ročník a septima Počet hodin: 2 hodiny týdně Pomůcky: Vybavení odborné učebny,
Termodynamika a živé systémy. Helena Uhrová
 Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
Termodynamika a živé systémy Helena Uhrová Základní pojmy termodynamiky soustava izolovaná otevřená okolí vlastnosti soustavy znaky popisující soustavu stav rovnováhy tok m či E =0 funkce stavu - soubor
5.7 Vlhkost vzduchu 5.7.5 Absolutní vlhkost 5.7.6 Poměrná vlhkost 5.7.7 Rosný bod 5.7.8 Složení vzduchu 5.7.9 Měření vlhkosti vzduchu
 Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Fázové přechody 5.6.5 Fáze Fázové rozhraní 5.6.6 Gibbsovo pravidlo fází 5.6.7 Fázový přechod Fázový přechod prvního druhu Fázový přechod druhého druhu 5.6.7.1 Clausiova-Clapeyronova rovnice 5.6.8 Skupenství
Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku
 Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku Teorie První termodynamický zákon je definován du dq dw (1) kde du je totální diferenciál vnitřní energie a dq a dw jsou neúplné
Úloha č.1: Stanovení molární tepelné kapacity plynu za konstantního tlaku Teorie První termodynamický zákon je definován du dq dw (1) kde du je totální diferenciál vnitřní energie a dq a dw jsou neúplné
Počet atomů a molekul v monomolekulární vrstvě
 Počet atomů a molekul v monomolekulární vrstvě ϑ je stupeň pokrytí ϑ = N 1 N 1p N 1 = ϑn 1p ν 1 = 1 4 nv a ν 1ef = γν 1 = γ 1 4 nv a γ je koeficient ulpění () F6450 1 / 23 8kT v a = πm = 8kNa T π M 0 ν
Počet atomů a molekul v monomolekulární vrstvě ϑ je stupeň pokrytí ϑ = N 1 N 1p N 1 = ϑn 1p ν 1 = 1 4 nv a ν 1ef = γν 1 = γ 1 4 nv a γ je koeficient ulpění () F6450 1 / 23 8kT v a = πm = 8kNa T π M 0 ν
BIOMECHANIKA DYNAMIKA NEWTONOVY POHYBOVÉ ZÁKONY, VNITŘNÍ A VNĚJŠÍ SÍLY ČASOVÝ A DRÁHOVÝ ÚČINEK SÍLY
 BIOMECHANIKA DYNAMIKA NEWTONOVY POHYBOVÉ ZÁKONY, VNITŘNÍ A VNĚJŠÍ SÍLY ČASOVÝ A DRÁHOVÝ ÚČINEK SÍLY ROTAČNÍ POHYB TĚLESA, MOMENT SÍLY, MOMENT SETRVAČNOSTI DYNAMIKA Na rozdíl od kinematiky, která se zabývala
BIOMECHANIKA DYNAMIKA NEWTONOVY POHYBOVÉ ZÁKONY, VNITŘNÍ A VNĚJŠÍ SÍLY ČASOVÝ A DRÁHOVÝ ÚČINEK SÍLY ROTAČNÍ POHYB TĚLESA, MOMENT SÍLY, MOMENT SETRVAČNOSTI DYNAMIKA Na rozdíl od kinematiky, která se zabývala
STRUKTURA PEVNÝCH LÁTEK A KAPALIN
 STRUKTURA PEVNÝCH LÁTEK A KAPALIN 18. POVRCHOVÁ VRSTVA KAPALIN, KAPILÁRNÍ ELEVACE, DEPRESE Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. POVRCHOVÉ NAPĚTÍ - Povrchové napětí je efekt, při kterém
STRUKTURA PEVNÝCH LÁTEK A KAPALIN 18. POVRCHOVÁ VRSTVA KAPALIN, KAPILÁRNÍ ELEVACE, DEPRESE Autor: Ing. Eva Jančová DESS SOŠ a SOU spol. s r. o. POVRCHOVÉ NAPĚTÍ - Povrchové napětí je efekt, při kterém
Struktura polymerů. Příprava (výroba).struktura vlastnosti. Materiálové inženýrství (Nauka o materiálu) Základní představy: přírodní vs.
 Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
Struktura polymerů Základní představy: přírodní vs. syntetické V.Švorčík, vaclav.svorcik@vscht.cz celulóza přírodní kaučuk Příprava (výroba).struktura vlastnosti Materiálové inženýrství (Nauka o materiálu)
Energie v chemických reakcích
 Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
Energie v chemických reakcích Energetická bilance reakce CH 4 + Cl 2 = CH 3 Cl + HCl rozštěpení vazeb vznik nových vazeb V chemických reakcích dochází ke změně vazeb mezi atomy. Vazebná energie uvolnění
ZMĚNY SKUPENSTVÍ LÁTEK
 ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
ZMĚNY SKUPENSTVÍ LÁTEK TÁNÍ A TUHNUTÍ - OSNOVA Kapilární jevy příklad Skupenské přeměny látek Tání a tuhnutí Teorie s video experimentem Příklad KAPILÁRNÍ JEVY - OPAKOVÁNÍ KAPILÁRNÍ JEVY - PŘÍKLAD Jak
PRAKTIKUM I. Oddělení fyzikálních praktik při Kabinetu výuky obecné fyziky MFF UK. Pracoval: Pavel Ševeček stud. skup.: F/F1X/11 dne:
 Oddělení fyzikálních praktik při Kabinetu výuky obecné fyziky MFF UK PRAKTIKUM I. Úloha č. VII Název: Studium kmitů vázaných oscilátorů Pracoval: Pavel Ševeček stud. skup.: F/F1X/11 dne: 27. 2. 2012 Odevzdal
Oddělení fyzikálních praktik při Kabinetu výuky obecné fyziky MFF UK PRAKTIKUM I. Úloha č. VII Název: Studium kmitů vázaných oscilátorů Pracoval: Pavel Ševeček stud. skup.: F/F1X/11 dne: 27. 2. 2012 Odevzdal
Měření teplotní roztažnosti
 KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření teplotní roztažnosti Úvod Zvyšování termodynamické teploty
KATEDRA EXPERIMENTÁLNÍ FYZIKY PŘÍRODOVĚDECKÁ FAKULTA UNIVERZITY PALACKÉHO V OLOMOUCI FYZIKÁLNÍ PRAKTIKUM Z MOLEKULOVÉ FYZIKY A TERMODYNAMIKY Měření teplotní roztažnosti Úvod Zvyšování termodynamické teploty
Kinetická teorie ideálního plynu
 Přednáška 10 Kinetická teorie ideálního plynu 10.1 Postuláty kinetické teorie Narozdíl od termodynamiky kinetická teorie odvozuje makroskopické vlastnosti látek (např. tlak, teplotu, vnitřní energii) na
Přednáška 10 Kinetická teorie ideálního plynu 10.1 Postuláty kinetické teorie Narozdíl od termodynamiky kinetická teorie odvozuje makroskopické vlastnosti látek (např. tlak, teplotu, vnitřní energii) na
DUM č. 12 v sadě. 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia
 projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
projekt GML Brno Docens DUM č. 12 v sadě 10. Fy-1 Učební materiály do fyziky pro 2. ročník gymnázia Autor: Vojtěch Beneš Datum: 03.05.2014 Ročník: 1. ročník Anotace DUMu: Kapaliny, změny skupenství Materiály
ELEKTRICKÝ PROUD ELEKTRICKÝ ODPOR (REZISTANCE) REZISTIVITA
 ELEKTRICKÝ PROD ELEKTRICKÝ ODPOR (REZISTANCE) REZISTIVITA 1 ELEKTRICKÝ PROD Jevem Elektrický proud nazveme usměrněný pohyb elektrických nábojů. Např.:- proud vodivostních elektronů v kovech - pohyb nabitých
ELEKTRICKÝ PROD ELEKTRICKÝ ODPOR (REZISTANCE) REZISTIVITA 1 ELEKTRICKÝ PROD Jevem Elektrický proud nazveme usměrněný pohyb elektrických nábojů. Např.:- proud vodivostních elektronů v kovech - pohyb nabitých
5. Stavy hmoty Kapaliny a kapalné krystaly
 a kapalné krystaly Vlastnosti kapalin kapalných krystalů jako rozpouštědla Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti kapaliny nestálé atraktivní interakce (kohezní síly) mezi molekulami,
a kapalné krystaly Vlastnosti kapalin kapalných krystalů jako rozpouštědla Evropský sociální fond Praha & EU: Investujeme do vaší budoucnosti kapaliny nestálé atraktivní interakce (kohezní síly) mezi molekulami,
Hydromechanické procesy Hydrostatika
 Hydromechanické procesy Hydrostatika M. Jahoda Hydrostatika 2 Hydrostatika se zabývá chováním tekutin, které se vzhledem k ohraničujícímu prostoru nepohybují - objem tekutiny bude v klidu, pokud výslednice
Hydromechanické procesy Hydrostatika M. Jahoda Hydrostatika 2 Hydrostatika se zabývá chováním tekutin, které se vzhledem k ohraničujícímu prostoru nepohybují - objem tekutiny bude v klidu, pokud výslednice
1 Rozdělení mechaniky a její náplň
 1 Rozdělení mechaniky a její náplň Mechanika je nauka o rovnováze a pohybu hmotných útvarů pohybujících se rychlostí podstatně menší, než je rychlost světla (v c). Vlastnosti skutečných hmotných útvarů
1 Rozdělení mechaniky a její náplň Mechanika je nauka o rovnováze a pohybu hmotných útvarů pohybujících se rychlostí podstatně menší, než je rychlost světla (v c). Vlastnosti skutečných hmotných útvarů
Fázová rozhraní a mezifázová energie
 Fázová ozhaní a mezifázová enegie 1/15 duhy: } l/ g {{ l/ } l mobilní s/g s/l s/s povch koule = 4π 2 Příklad. Kolik % molekul vody je na povchu kapičky mlhy o půměu 200 nm (hanice viditelnosti optickým
Fázová ozhaní a mezifázová enegie 1/15 duhy: } l/ g {{ l/ } l mobilní s/g s/l s/s povch koule = 4π 2 Příklad. Kolik % molekul vody je na povchu kapičky mlhy o půměu 200 nm (hanice viditelnosti optickým
Kovy - model volných elektronů
 Kovy - model volných elektronů Kovová vazba 1. Preferuje ji většina prvků vyskytujících se v přírodě. Kov je tvořen kladně nabitými ionty (s konfigurací vzácného plynu) a relativně velmi volnými elektrony.
Kovy - model volných elektronů Kovová vazba 1. Preferuje ji většina prvků vyskytujících se v přírodě. Kov je tvořen kladně nabitými ionty (s konfigurací vzácného plynu) a relativně velmi volnými elektrony.
(1 + v ) (5 bodů) Pozor! Je nutné si uvědomit, že v a f mají opačný směr! Síla působí proti pohybu.
 Přijímací zkouška na navazující magisterské studium - 017 Studijní program Fyzika - všechny obory kromě Učitelství fyziky-matematiky pro střední školy, Varianta A Příklad 1 (5 bodů) Těleso s hmotností
Přijímací zkouška na navazující magisterské studium - 017 Studijní program Fyzika - všechny obory kromě Učitelství fyziky-matematiky pro střední školy, Varianta A Příklad 1 (5 bodů) Těleso s hmotností
1. Látkové soustavy, složení soustav
 , složení soustav 1 , složení soustav 1. Základní pojmy 1.1 Hmota 1.2 Látky 1.3 Pole 1.4 Soustava 1.5 Fáze a fázové přeměny 1.6 Stavové veličiny 1.7 Složka 2. Hmotnost a látkové množství 3. Složení látkových
, složení soustav 1 , složení soustav 1. Základní pojmy 1.1 Hmota 1.2 Látky 1.3 Pole 1.4 Soustava 1.5 Fáze a fázové přeměny 1.6 Stavové veličiny 1.7 Složka 2. Hmotnost a látkové množství 3. Složení látkových
Přijímací zkouška na navazující magisterské studium 2015
 Přijímací zkouška na navazující magisterské studium 205 Studijní program: Studijní obory: Fyzika FFUM Varianta A Řešení příkladů pečlivě odůvodněte. Příklad (25 bodů) Pro funkci f(x) := e x 2. Určete definiční
Přijímací zkouška na navazující magisterské studium 205 Studijní program: Studijní obory: Fyzika FFUM Varianta A Řešení příkladů pečlivě odůvodněte. Příklad (25 bodů) Pro funkci f(x) := e x 2. Určete definiční
Kapaliny Molekulové vdw síly, vodíkové můstky
 Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
Kapaliny Molekulové vdw síly, vodíkové můstky Metalické roztavené kovy, ionty + elektrony, elektrostatické síly Iontové roztavené soli, FLINAK (LiF + NaF + KF), volně pohyblivé anionty a kationty, iontová
