PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Aleš Kubíček
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod NÁZEV PŘÍPRAVKU Zalmoxis 5 20 x 10 6 buněk/ml infuzní disperze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 2.1 Obecný popis Allogenní T-lymfocyty geneticky modifikované retrovirovým vektorem, který kóduje zkrácenou formu receptoru pro humánní nervový růstový faktor s nízkou afinitou (ΔLNGFR) a thymidinkinázu viru herpes simplex I (HSV-TK Mut2) Kvalitativní a kvantitativní složení Jeden vak přípravku Zalmoxis obsahuje zmrazenou disperzi o objemu ml v koncentraci 5-20 x 10 6 buněk/ml. Buňky jsou humánního původu a jsou geneticky modifikované kódováním γ-retrovirového vektoru s defektní replikací pro geny HSV-TK a ΔLNGFR tak, aby se tyto sekvence začlenily do genomu hostitelským buněk. Buněčné složení a konečný počet buněk se mění podle tělesné hmotnosti pacienta. Kromě T- lymfocytů mohou být přítomny NK buňky a zbytkové hladiny monocytů a B-lymfocytů. Pomocná látka se známým účinkem Jeden vak obsahuje přibližně 13,3 mmol (305,63 mg) sodíku v jedné dávce. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Infuzní disperze Neprůhledná, téměř bílá zmrazená disperze. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Přípravek Zalmoxis je indikován jako adjuvantní terapie při transplantaci haploidentických hematopoetických kmenových buněk u dospělých pacientů s vysoce rizikovými hematologickými malignitami (viz bod 5.1). 4.2 Dávkování a způsob podání Přípravek Zalmoxis musí být podáván za dohledu lékaře, který má zkušenosti s transplantací hematopoetických kmenových buněk u hematologických malignit. 2
3 Dávkování Doporučená dávka a schéma je 1 ± 0,2 x 10 7 buněk/kg v podobě intravenózní infuze v časovém intervalu dnů od transplantace za nepřítomnosti spontánní imunitní rekonstituce a/nebo rozvoje reakce štěpu proti hostiteli (GvHD). Další infuze se podávají v přibližně jednoměsíčních intervalech maximálně čtyřikrát, dokud nebude počet cirkulujících T-lymfocytů roven, nebo větší než 100 na µl. Zalmoxis se nesmí podat, pokud je v den plánované infuze po transplantaci haploidentických hematopoetických kmenových buněk počet cirkulujících T-lymfocytů 100/μl. Pediatrická populace Bezpečnost a účinnost u dětí a dospívajících (ve věku do 18 let) nebyla stanovena. Nejsou dostupné žádné údaje. Použití přípravku Zalmoxis u dětí a dospívajících mladších 18 let se proto nedoporučuje. Způsob podání Přípravek Zalmoxis je výlučně určen k použití jako léčivý přípravek specifický pro daného pacienta, který se podává po transplantaci hematopoetických kmenových buněk (HSCT) a podává se intravenózní infuzí. Přípravek Zalmoxis se musí podávat intravenózní infuzí po dobu minut. Je nutné podat celý objem vaku. Pokud se infuze musí přerušit, nesmí se obnovovat, pokud byl infuzní vak uchováván při pokojové teplotě (15 30 C) déle než 2 hodiny. Opatření, která je nutno učinit před manipulací s léčivým přípravkem nebo jeho podáním Před infuzí se musí potvrdit, že identita pacienta odpovídá zásadním jedinečným informacím uvedeným na štítku vaku s přípravkem Zalmoxis a na souvisejícím certifikátu o analýze (CoA). Vak se vyjme z kapalného dusíku, vloží do dvojitého obalu na vaky a nechá rozmrazit v předehřáté vodní lázni při 37 C. Po úplném rozmrazení buněčné disperze se vak osuší, dezinfikuje a je připraven k podání infuzí rychlostí předepsanou lékařem. Jakmile je infuze dokončena, vak se 2- až 3krát propláchne roztokem chloridu sodného, aby došlo k úplnému podání přípravku Zalmoxis. Je nutné podat celý objem vaku. 4.3 Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Imunitní rekonstituce definovaná jako počet cirkulujících T-lymfocytů 100 na μl v den plánované infuze po transplantaci haploidentických hematopoetických kmenových buněk. Reakce štěpu proti hostiteli vyžadující systémovou imunosupresivní terapii. 4.4 Zvláštní upozornění a opatření pro použití Obecné Přípravek Zalmoxis je přípravek specifický pro daného pacienta a za žádných okolností se nesmí podávat jiným pacientům. Nesmí být podán, pokud se objeví následující stavy: a) infekce vyžadující podávání gancikloviru (GVC) nebo valgancikloviru (VCV) v době infuze; b) reakce štěpu proti hostiteli vyžadující systémovou imunosupresivní terapii; c) probíhající systémová imunosupresivní terapie nebo podávání faktoru stimulujícího kolonie granulocytů (G-CSF) po transplantaci haploidentických hematopoetických kmenových buněk. Pacienti, u nichž platí podmínka a), mohou dostat přípravek Zalmoxis 24 hodin po vysazení antivirové terapie; pacienti, u nichž platí podmínky b) a c), mohou dostat přípravek Zalmoxis po adekvátním vymývacím období. 3
4 Přípravek Zalmoxis 5 20 x 10 6 buněk/ml infuzní disperze obsahuje 13,3 mmol (305,63 mg) sodíku v jedné dávce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku. Důrazně se doporučuje, aby na konci infuze přípravku Zalmoxis byl z vaku sejmut štítek s označením přípravku a uložen do dokumentace pacienta. Léčbu je třeba ukončit při výskytu jakékoli příhody 3. až 4. stupně související s podáním přípravku Zalmoxis nebo nežádoucí příhody 2. stupně, která se nezmírní na 1. stupeň nebo nižší během příštích 30 dní. Zalmoxis je získáván z dárcovských krevních buněk. Dárci jsou předběžně testováni a mají negativní nález přenosných infekčních chorob, při manipulaci s přípravkem Zalmoxis je však přesto třeba postupovat opatrně. Zdravotnický personál manipulující s přípravkem Zalmoxis proto musí přijmout vhodná bezpečnostní opatření (nosit ochranné rukavice a brýle), aby se předešlo možnému přenosu infekčních onemocnění. Případy, kdy přípravek Zalmoxis není možné dodat/podat infuzí V některých případech nemusí pacient přípravek Zalmoxis dostat kvůli problémům ve výrobě. Mohou existovat případy, kdy může ošetřující lékař stále považovat za vhodnější léčbu podat nebo využít alternativní léčbu. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nebyly provedeny žádné studie interakcí. 4.6 Fertilita, těhotenství a kojení Ženy v reprodukčním věku/antikoncepce u mužů a žen Riziko vertikálního přenosu viru vylučováním viru je teoreticky zanedbatelné, ale nelze jej vyloučit. Ženy ve fertilním věku musí mít negativní těhotenský test (ze séra nebo z moči) v době 14 dnů před zahájením léčby. Pacienti (muži i ženy) léčení (kteří budou léčeni) přípravkem Zalmoxis a jejich partneři/ky musí používat v době léčby přípravkem Zalmoxis (a až 6 měsíců poté) účinnou antikoncepci. Těhotenství Údaje o podávání přípravku Zalmoxis těhotným ženám nejsou k dispozici. Studie na zvířatech nebyly provedeny. Vzhledem k zamýšlenému klinickému použití v kontextu transplantace haploidentické kostní dřeně se neočekává, že tato léčba bude použita během těhotenství. Jako bezpečnostní opatření se přípravek Zalmoxis nesmí podávat během těhotenství a ženám ve fertilním věku, které nepoužívají antikoncepci. Bylo prokázáno, že buňky přípravku Zalmoxis mohou cirkulovat v těle léta po posledním podání. V případě těhotenství po podání léčby přípravkem Zalmoxis se neočekává nežádoucí účinek na těhotenství a vyvíjející se plod, protože lymfocyty neprocházejí placentou. Kojení Údaje o používání přípravku Zalmoxis během kojení nejsou k dispozici. Imunní buňky se vylučují do mateřského mléka v malých množstvích. Během terapie přípravkem Zalmoxis nebo po ní se doporučuje nekojit. Fertilita 4
5 Údaje o účinku přípravku Zalmoxis na lidskou fertilitu nejsou k dispozici. Režimy myeloablačního kondicionování prováděného v kontextu transplantace haploidentické kostní dřeně jsou však spojeny se sterilitou. 4.7 Účinky na schopnost řídit a obsluhovat stroje Přípravek Zalmoxis nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Na základě farmakologie léčivého přípravku se nepředpovídají žádné škodlivé účinky pro takové činnosti. Při posuzování schopnosti pacienta provádět úkoly, které vyžadují úsudek, motorické nebo kognitivní dovednosti, je nutné mít na paměti klinický stav pacienta a profil ADR přípravku Zalmoxis. 4.8 Nežádoucí účinky Shrnutí bezpečnostního profilu V klinické studii TK007 dostávalo každý měsíc přípravek Zalmoxis 30 pacientů s vysoce rizikovými hematologickými malignitami, kteří podstoupili haploidentickou transplantaci kmenových buněk,, a to až maximálně čtyři infuze. Nejčastějším nežádoucím účinkem hlášeným pacienty léčenými přípravkem Zalmoxis v klinickém hodnocení TK007 byla reakce štěpu proti hostiteli (GvHD). Seznam nežádoucích účinků v tabulce Nežádoucí účinky hlášené v klinické studii TK007 jsou uvedeny v tabulce 1 podle tříd orgánových systémů a četností výskytu. V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Tabulka 1. Nežádoucí účinky přípravku Zalmoxis hlášené ve studii TK007 Četnost výskytu a nežádoucí účinky Třída orgánových systémů Velmi časté ( 1/10) Časté ( 1/100 až <1/10) Novotvary benigní, maligní a blíže neurčené (zahrnující cysty a polypy) Poruchy imunitního systému Gastrointestinální poruchy Akutní GvHD (33 % pacientů) Potransplantační lymfoproliferativní porucha Chronická GvHD Střevní krvácení Poruchy jater a žlučových cest Poruchy krve a lymfatického systému Infekce a infestace Celkové poruchy a reakce v místě aplikace Jaterní selhání Febrilní neutropenie Snížený hemoglobin Snížený počet trombocytů Bronchitida Pyrexie Popis vybraných nežádoucích účinků Globálně se vyskytly akutní epizody GvHD u 10 pacientů (33 %) se střední dobou do nástupu 90 dnů po HSCT a 42 dnů po poslední infuzi buněk přípravku Zalmoxis. Akutní GvHD měla stupeň závažnosti 1 v jednom případě (3 %), stupeň závažnosti 2 nastal v sedmi (23 %) případech, stupeň 3 u jednoho (3 %) a stupeň 4 u jednoho (3 %). Všechny akutní příhody GvHD zcela odezněly po střední době trvání 12 dnů. Rozsáhlá chronická GvHD se objevila pouze u jednoho pacienta (3 %), nastala za 159 dnů od HSCT a 129 dnů od poslední infuze a plně odezněla po 107 dnech. V souvislosti s GvHD 5
6 nedošlo k žádným úmrtím ani dlouhodobým komplikacím. Jak akutní, tak chronické příhody GvHD se vyvinuly pouze u pacientů, kteří dosáhli rekonstituce imunity. K léčbě GvHD související s přípravkem Zalmoxis aktivací sebevražedného genu pacienti pro vlastní větší pohodlí dostávali intravenózně ganciklovir nebo perorálně valganciklovir. Po střední době léčby ganciklovirem nebo valganciklovirem 15 dnů odezněly všechny známky a příznaky 2. až 4. stupně a rozsáhlé chronické GvHD. Jeden pacient s 1. stupněm akutní GvHD nedostával žádnou léčbu. Sedm pacientů potřebovalo přidat imunosupresivní léčbu obsahující steroidy, mykofenolát a/nebo cyklosporin. Pediatrická populace V současnosti se nestuduje žádná specifická pediatrická skupina. V klinickém hodnocení TK007 byl léčen pouze jeden 17letý pacient s T-lymfoblastickým lymfomem dvěma infuzemi přípravku Zalmoxis. U tohoto pacienta nebyly hlášeny žádné nežádoucí účinky. Jiné zvláštní populace V klinickém hodnocení TK007 byla jednou infuzí přípravku Zalmoxis léčena pouze jedna 66letá žena. U pacientky se neobjevily žádné nežádoucí účinky. U pacientů ve věku 65 let a více nebyly pro používání přípravku Zalmoxis vyvozeny žádné důsledky. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměrů přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. 4.9 Předávkování Případy předávkování nejsou známy. V případě předávkování je zapotřebí pacienty pečlivě sledovat s ohledem na výskyt známek a příznaků nežádoucích účinků a neprodleně zahájit vhodnou symptomatickou léčbu. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Jiná cytostatika, ATC kód: dosud nepřidělen Mechanismus účinku Primární mechanismus účinku přípravku Zalmoxis je postaven na jeho schopnosti naroubovat a stimulovat rekonstituci imunity. Přípravek Zalmoxis se skládá z geneticky modifikovaných T-lymfocytů dárce, které exprimují HSV- TK Mut 2 jako sebevražedný gen. To umožňuje selektivní zabíjení dělicích se buněk po podání gancikloviru jako proléčiva (GCV), které se enzymaticky fosforyluje na aktivní trifosfátový analog HSV-TK. Trifosfátový GCV kompetitivně inhibuje začleňování deoxyguanosin trifosfátu (dgtp) do prodlužující se DNA, čímž zabíjí proliferující buňky. Pokud se objeví GvHD, bude podán ganciklovir/valganciklovir. Aktivované, transdukované T-lymfocyty, které způsobují GvHD, by měly přeměnit GCV na jeho toxickou formu a touto cestou podstoupit apoptózu. Uvedená strategie umožňuje přímé zacílení těch T-lymfocytů, které spouští odpověď GvHD. 6
7 Farmakodynamické účinky V klinické studii TK007 obdrželo celkem 30 léčených pacientů první infuzi buněk přípravku Zalmoxis ve střední době 43 dnů od data HSCT. Střední časový interval mezi první a následnými infuzemi buněk přípravku Zalmoxis byl 30 dnů. Pacienti s rekonstituovanou imunitou dosahovali počtu buněk CD /μl ve střední době 77 dnů po HSCT. Při rekonstituci imunity obzvláště představuje přípravek Zalmoxis vysoký podíl lymfocytů v krevním oběhu, zatímco v pozdějších časovým bodech podíl přípravku Zalmoxis progresivně klesá a netransdukované lymfocyty expandují z prekurzorů odvozených z dárce. Za jeden rok od podání přípravku Zalmoxis v repertoáru nově rekonstituovaných T-buněk dominují netransdukované buňky dárcovského původu, které se vyznačují polyklonálním vzorcem srovnatelným se zdravými jedinci. Klinická účinnost a bezpečnost Přípravek Zalmoxis byl vyhodnocován v klinické studii I./II. fáze (TK007) u dospělých pacientů s hematologickými malignitami při vysokém riziku relapsu, kteří dostávali transplantaci kmenových buněk od haploidentického dárce (tj. bez přizpůsobení lidského leukocytárního angitenu). Vysoce rizikové hematologické malignity léčené přípravkem Zalmoxis zahrnovaly akutní myeloidní leukémii (AML), sekundární AML, akutní lymfoblastickou leukémii, myelodysplastický syndrom a non- Hodgkinův lymfom. Léčebný plán zahrnoval podávání geneticky modifikovaných dárcovských T-lymfocytů (v rozsahu od 1 x 10 6 až 1 x 10 7 buněk/kg tělesné hmotnosti). Primárním cílem studie TK007 bylo vyhodnotit incidenci a dobu do rekonstituce imunity definované počtem CD3+ 100/μl v krevním oběhu po dvou po sobě následujících pozorováních a incidence GvHD a odpověď na ganciklovir. Kritéria pro podávání infuzí přípravku Zalmoxis zahrnovala jak nedostatek imunitní rekonstituce, tak GvHd. Z 30 pacientů, jimž byl podáván přípravek Zalmoxis, u 23 pacientů (77 %) došlo k imunitní rekonstituci se střední dobou 31 dnů po první infuzi. U pacientů, kteří dosáhli imunitní rekonstituce, byla hlášena mortalita bez relapsu (NRM) u 17 %, kdy 35 % těchto pacientů bylo bez známek onemocnění po 5 letech a 34 % bylo naživu po 10 letech. Výsledky analýz odpovídajících párů od celkem 36 pacientů léčených přípravkem Zalmoxis (22 z klinického hodnocení TK007 a 14 z probíhající fáze III klinického hodnocení TK008) a 127 kontrolních pacientů ukázaly, že tímto přípravkem léčení pacienti, kteří přežili první 3 týdny po transplantaci bez relapsu, měli lepší celkové přežití po jednom roce (OS) (40 % vs. 51 % (p = 0,03)) a jednoletou NRM (42 % vs. 23 % (p = 0,04)). Žádný významný rozdíl nebyl zjištěn v přežití bez známek leukémie a riziku relapsu. Pediatrická populace Evropská agentura pro léčivé přípravky udělila odklad povinnosti předložit výsledky studií s přípravkem Zalmoxis u jedné nebo více podskupin pediatrické populace za následující podmínky: adjuvantní léčba při transplantaci hematopoetických buněk (informace o použití u dětí viz bod 4.2). Tento léčivý přípravek byl registrován postupem tzv. podmíněného schválení. Znamená to, že jsou očekávány další důkazy o jeho přínosech. Evropská agentura pro léčivé přípravky nejméně jednou za rok vyhodnotí nové informace o tomto léčivém přípravku a tento souhrn údajů o přípravku bude podle potřeby aktualizován. 5.2 Farmakokinetické vlastnosti Povaha a zamýšlené použití přípravku jsou takové, že se konvenční studie týkající se farmakokinetiky včetně absorpce, distribuce, metabolismu a vylučování neprovádí. 5.3 Předklinické údaje vztahující se k bezpečnosti 7
8 Konvenční studie z oblastí toxikologie, kancerogenity, mutagenity a reprodukční toxikologie nebyly provedeny. Neklinické bezpečnostní údaje získané ve dvou odlišných zvířecích modelech imunodeficience pro reakci štěpu proti hostiteli nenaznačují zvláštní nebezpečí pro člověka, ale umožnily pouze velmi omezené hodnocení bezpečnosti. Hodnocení onkologického potenciálu in vitro naznačuje, že je riziko maligní transformace nízké. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Chlorid sodný Lidský albumin Dimethylsulfoxid 6.2 Inkompatibility Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky. 6.3 Doba použitelnosti 18 měsíců, když je uchováván v kapalném dusíku. Přípravek je zapotřebí podávat bezprostředně po rozmrazení. Doba uchovávání při použití by neměla překročit 2 hodiny při pokojové teplotě (15 30 C). 6.4 Zvláštní opatření pro uchovávání Uchovávejte v kapalném dusíku. 6.5 Druh obalu a obsah balení a zvláštní vybavení pro použití, podání nebo implantaci Jedna samostatná léčebná dávka v ml ethylenvinylacetátovém kryovaku, uloženém v kovové krabici. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Zalmoxis je léčivý přípravek specifický pro konkrétního pacienta. Totožnost pacienta se musí před infuzí sladit se zásadními informacemi o jedinečném dárci. Zalmoxis je získáván z dárcovských krevních buněk. Dárci jsou předběžně testováni a mají negativní nález přenosných infekčních chorob, při manipulaci s přípravkem Zalmoxis je však přesto postupovat opatrně (viz bod 4.4). Tento léčivý přípravek obsahuje geneticky modifikované buňky. Při likvidaci nepoužitého léčivého přípravku nebo odpadního materiálu je třeba postupovat podle místních předpisů pro biologickou bezpečnost platných pro tyto přípravky. Pracovní povrchy a materiál, které mohly přijít do kontaktu s přípravkem Zalmoxis se musí dekontaminovat vhodným dezinfekčním činidlem. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI 8
9 MolMed S.p.A. Via Olgettina Milano Itálie REGISTRAČNÍ ČÍSLO EU/1/16/1121/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE 10. DATUM REVIZE TEXTU Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky 9
10 PŘÍLOHA II A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU E. ZVLÁŠTNÍ POVINNOST DOKONČIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ 10
11 A. VÝROBCE BIOLOGICKÉ LÉČIVÉ LÁTKY A VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ Název a adresa výrobce biologické léčivé látky/biologických léčivých látek MolMed SpA Via Olgettina Milan Itálie Název a adresa výrobce odpovědného za propouštění šarží MolMed SpA Via Olgettina Milan Itálie B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz Příloha I: Souhrn údajů o přípravku, bod 4.2). C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE Pravidelně aktualizované zprávy o bezpečnosti Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky. Držitel rozhodnutí o registraci předloží první pravidelně aktualizovanou zprávu o bezpečnosti pro tento léčivý přípravek do 6 měsíců od jeho registrace. D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU Plán řízení rizik (RMP) Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu registrace a ve veškerých schválených následných aktualizacích RMP. Aktualizovaný RMP je třeba předložit: na žádost Evropské agentury pro léčivé přípravky, 11
12 při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik). Další opatření k minimalizaci rizik Před uvedením přípravku Zalmoxis v každém členském státě se musí držitel rozhodnutí o registraci (MAH) dohodnout o obsahu a formě vzdělávacích materiálů pro zdravotnický personál s příslušným národním orgánem. MAH zajistí, aby v každém členském státě, kde je Zalmoxis na trhu, obdrželi všichni zdravotníci, kteří jej podle všeho budou předepisovat, vydávat a podávat, metodickou příručku obsahující následující klíčové prvky: 1. Relevantní informace o bezpečnostním riziku reakce štěpu proti hostiteli (GvHD) Každý lékař si během léčby přípravkem Zalmoxis a po ní musí být vědom akutních a chronických příznaků GvHD a zajistit zásobu gancikloviru nebo valgancikloviru na svém oddělení, aby bylo možno nasadit léčbu včas. Pokud se během léčby přípravkem Zalmoxis či po ní rozvine akutní GvHD 2. či vyššího stupně nebo vznikne chronická GvHD, pacient musí být zaléčen ganciklovirem v dávce 10 mg/kg/den, rozdělené do dvou infuzí, nebo valganciklovirem 900 mg dvakrát denně, perorálně po 14 dní. Pokud po 3 dnech monoterapie ganciklovirem nebo valganciklovirem dochází k progresi GvHD, je nutno zahájit standardní imunosupresivní terapii. Zalmoxis má být podáván po uplynutí 24 hodin od vysazení gancikloviru nebo valgancikloviru a imunosupresivní terapie. 2. Relevantní informace o bezpečnostním rizikou současného podávání gancikloviru a valgancikloviru Ošetřující lékař musí zajistit, že pacienti nebudou dostávat ganciklovir nebo valganciklovir během 24 hodinách před podáním přípravku Zalmoxis. Delší interval by mohl být vhodný v případě selhání ledvin. 3. Relevantní informace o bezpečnostním riziku souběžné imunosupresivní terapie Pacientům nesmí být Zalmoxis podáván v těchto situacích: o o Vznik GVHD vyžadující systémovou imunosupresivní terapii; Probíhající systémová imunosupresivní terapie nebo podávání faktoru stimulujícího kolonie granulocytů (G-CSF) po transplantaci haploidentických hematopoetických kmenových buněk; Pacienti mohou být přípravkem Zalmoxis léčeni 24 hodin po vysazení antivirové nebo imunosupresivní terapie. Zalmoxis nesmí být pacientům podáván souběžně se systémovou imunosupresivní terapií, protože se na počátku imunitní rekonstituce může snížit jeho účinnost. Imunosupresivní terapie má také vliv na imunokompetentní buňky, které jsou v přípravku Zalmoxis podávány. Před infuzí tohoto léčivého přípravku je proto nutné vyčkat dobu přiměřenou k vyplavení výše uvedených látek. 4. Poznámky o důležitosti hlášení nežádoucích účinků a povzbuzování pacientů k registraci do studie TK011 (navázané na registr EBMT) 5. Podrobný popis podání přípravku Zalmoxis krok za krokem, rovněž se zaměřením na tyto body: o Požadavky na prostor při podání přípravku Zalmoxis 12
13 o o Uchovávání, přeprava a rozmrazení vaku s přípravkem Zalmoxis Sledování účinnosti přípravku Zalmoxis (imunitní rekonstituce) K monitoraci imunitní rekonstituce je během prvního měsíce po podání přípravku Zalmoxis třeba provádět jednou týdně kvantitativní analýzu CD3+ buněk. Při absenci imunitní rekonstituce je nutno podat další dávku přípravku Zalmoxis v intervalu 30 dní, maximálně však čtyři dávky. Při dosažení imunitní rekonstituce (doložené dvěma po sobě následujícími hodnotami CD3+ buněk 100/µl), musí být léčba přípravkem Zalmoxis zastavena. Povinnost dokončit poregistrační opatření Popis Neintervenční poregistrační studie bezpečnosti (PASS): Aby bylo možno ověřit bezpečnost a účinnost přípravku Zalmoxis v reálné klinické praxi, stejně jako dlouhodobou bezpečnost a účinnost u všech pacientů léčených tímto přípravkem, MAH by měl realizovat studii TK011 s využitím registru EBMT a vyhodnocením všech pacientů léčených tímto přípravkem a předložit získané výsledky. Informace o průběhu studie by měly být předkládány každoročně při prodloužení. Termín předložení zprávy z klinického hodnocení: 4. čtvrtletí Termín splnění 4. čtvrtletí 2022 E. ZVLÁŠTNÍ POVINNOST DOKONČIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ Tato registrace byla schválena postupem tzv. podmíněného schválení, a proto podle čl. 14 odst. (7) nařízení (ES) č. 726/2004 držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření: Popis Držitel rozhodnutí o registraci uskuteční v daném termínu níže uvedená opatření: K potvrzení účinnosti a bezpečnosti přípravku Zalmoxis jako adjuvantní léčby dospělých pacientů s vysoce rizikovými hematologickými malignitami po haploidentické transplantaci hemotopoetických kmenových buněk by měl MAH předložit výsledky studie TK008, randomizovaného klinické hodnocení fáze III léčby se zpětnou aplikací dárcovských HSV-Tk lymfocytů u pacientů s vysoce rizikovou akutní leukémií po haploidentické HCT. V rámci aktualizovaných zpráv o bezpečnosti přípravku (PSUR) by měly být předkládány i informace o náboru pacientů. Termín předložení zprávy z klinického hodnocení: březen Termín splnění Březen
14 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 14
15 A. OZNAČENÍ NA OBALU 15
16 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABICE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Zalmoxis 5 20 x 10 6 buněk/ml Infuzní disperze Allogenní T-lymfocyty geneticky modifikované retrovirovým vektorem, který kóduje zkrácenou formu receptoru pro humánní nervový růstový faktor s nízkou afinitou (ΔLNGFR) a thymidinkinázu viru herpes simplex I (HSV-TK Mut2) 2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK Jeden vak přípravku obsahuje zmrazenou disperzi o objemu ml v koncentraci 5 20 x 10 6 buněk/ml. 3. SEZNAM POMOCNÝCH LÁTEK Lidský albumin, dimethylsulfoxid, chlorid sodný. Další údaje naleznete v příbalové informaci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Infuzní disperze Objem vaku: ml Dávka: 1x10 7 buněk/kg Koncentrace: x10 x buněk/ml Celkový počet buněk: x10 X 5. ZPŮSOB A CESTA/CESTY PODÁNÍ Intravenózní podání Před použitím si přečtěte příbalovou informaci. 6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ Uchovávejte mimo dohled a dosah dětí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ Přípravek specifický pro daného pacienta, který nesmí být podáván jiným pacientům 16
17 8. POUŽITELNOST EXP: Doba použitelnosti po rozmrazení: 2 hodiny při pokojové teplotě (15 30 C) 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v kapalném dusíku. 10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Tento léčivý přípravek obsahuje geneticky modifikované buňky. Při likvidaci nepoužitého léčivého přípravku nebo odpadního materiálu je třeba postupovat podle místních předpisů pro biologickou bezpečnost platných pro tyto přípravky. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI MolMed S.p.A. Via Olgettina Milano Itálie 12. REGISTRAČNÍ ČÍSLO EU/1/16/1121/ ČÍSLO ŠARŽE, KÓD DÁRCE A KÓD LÉČIVÉHO PŘÍPRAVKU č. š.: Kód pacienta: Kód dárce: 14. KLASIFIKACE PRO VÝDEJ 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVĚ PÍSMU Nevyžaduje se - odůvodnění přijato 17. JEDINEČNÝ IDENTIFIKÁTOR 2D ČÁROVÝ KÓD Neuplatňuje se 17
18 18. JEDINEČNÝ IDENTIFIKÁTOR DATA ČITELNÁ OKEM Neuplatňuje se 18
19 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU PLASTOVÝ VAK 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Zalmoxis 5 20 x 10 6 buněk/ml Infuzní disperze Allogenní T-lymfocyty geneticky modifikované retrovirovým vektorem, který kóduje zkrácenou formu receptoru pro humánní nervový růstový faktor s nízkou afinitou (ΔLNGFR) a thymidinkinázu viru herpes simplex I (HSV-TK Mut2) 2. OBSAH LÉČIVÉ LÁTKY / LÉČIVÝCH LÁTEK Jeden vak přípravku obsahuje zmrazenou disperzi o objemu ml v koncentraci 5 20 x 10 6 buněk/ml. 3. SEZNAM POMOCNÝCH LÁTEK Lidský albumin, dimethylsulfoxid, chlorid sodný. Další údaje naleznete v příbalové informaci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Infuzní disperze Objem vaku: ml Dávka: 1x10 7 buněk/kg Koncentrace: x10 x buněk/ml Celkový počet buněk: x10 X 5. ZPŮSOB A CESTA/CESTY PODÁNÍ Intravenózní podání Před použitím si přečtěte příbalovou informaci. 6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ Uchovávejte mimo dohled a dosah dětí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ Přípravek specifický pro daného pacienta, který nesmí být podáván jiným pacientům 19
20 8. POUŽITELNOST EXP: Doba použitelnosti po rozmrazení: 2 hodiny při pokojové teplotě (15 30 C) 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v kapalném dusíku 10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Tento léčivý přípravek obsahuje geneticky modifikované buňky. Při likvidaci nepoužitého léčivého přípravku nebo odpadního materiálu je třeba postupovat podle místních předpisů pro biologickou bezpečnost platných pro tyto přípravky. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI MolMed S.p.A. Via Olgettina Milano Itálie 12. REGISTRAČNÍ ČÍSLO EU/1/16/1121/ ČÍSLO ŠARŽE, KÓD DÁRCE A KÓD LÉČIVÉHO PŘÍPRAVKU č. š.: Kód pacienta: Kód dárce: 14. KLASIFIKACE PRO VÝDEJ 15. NÁVOD K POUŽITÍ Neuplatňuje se 16. INFORMACE V BRAILLOVĚ PÍSMU Nevyžaduje se - odůvodnění přijato 20
21 17. JEDINEČNÝ IDENTIFIKÁTOR 2D ČÁROVÝ KÓD Neuplatňuje se 18. JEDINEČNÝ IDENTIFIKÁTOR DATA ČITELNÁ OKEM Neuplatňuje se 21
22 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU VAK 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Zalmoxis 5 20 x 10 6 buněk/ml infuzní disperze Intravenózní podání 2. ZPŮSOB PODÁNÍ 3. POUŽITELNOST Doba použitelnosti: Doba použitelnosti po rozmrazení: 2 hodiny 4. ČÍSLO ŠARŽE, KÓD DÁRCE A KÓD LÉČIVÉHO PŘÍPRAVKU č. š.: Kód pacienta: 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET Celkový počet buněk: x10 X 6. JINÉ MolMed SpA 22
23 B. PŘÍBALOVÁ INFORMACE 23
24 Příbalová informace: informace pro pacienta Zalmoxis 5 20 x 10 6 buněk/ml infuzní disperze Allogenní T-lymfocyty geneticky modifikované retrovirovým vektorem, který kóduje zkrácenou formu receptoru pro humánní nervový růstový faktor s nízkou afinitou (ΔLNGFR) a thymidinkinázu viru herpes simplex I (HSV-TK Mut2) Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoliv nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4. Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. - Máte-li jakékoliv další otázky, zeptejte se svého lékaře nebo lékaře, který má zkušenosti s léčbou krevního nádorového onemocnění. - Pokud se u Vás vyskytne kterýkoliv z nežádoucích účinků, sdělte to svému lékaři nebo lékaři, který má zkušenosti s léčbou krevního nádorového onemocnění. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci 1. Co je přípravek Zalmoxis a k čemu se používá 2. Čemu musíte věnovat pozornost, než Vám bude přípravek Zalmoxis podán 3. Jak se přípravek Zalmoxis podává 4. Možné nežádoucí účinky 5. Jak přípravek Zalmoxis uchovávat 6. Obsah balení a další informace 1. CO JE PŘÍPRAVEK ZALMOXIS A K ČEMU SE POUŽÍVÁ Přípravek Zalmoxis obsahuje bílé krvinky nazývané T-buňky, které byly získány od dárce. Tyto buňky budou geneticky upraveny zavedením sebevražedného genu (HSV-TK Mut2) do jejich genetického kódu, který lze aktivovat později v případě reakce štěpu proti hostiteli. Tím se zajistí, že buňky bude možné eliminovat předtím, než budou moci způsobit škodu buňkám pacienta. Přípravek Zalmoxis je určen k použití u dospělých s určitými krevními nádorovými onemocněními známými jako vysoce rizikové hematologické malignity. Podává se po transplantaci haploidentické kostní dřeně (transplantace hematopoetických (krvetvorných) buněk). Haploidentický znamená, že buňky byly získány od dárce, jehož tkáně částečně odpovídají tkáni pacienta. Přípravek Zalmoxis je podáván jako prevence proti komplikaci při transplantacích tkání, které navzájem zcela neodpovídají a jsou známy jako reakce štěpu proti hostiteli, kdy buňky dárce útočí na vlastní buňky pacienta. 2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ VÁM BUDE PŘÍPRAVEK ZALMOXIS PODÁN Nepoužívejte přípravek Zalmoxis: - jestliže jste alergický(á) na léčivou látku nebo na kteroukoli další složku tohoto přípravku (uvedenou v bodě 6), - jestliže budete v testech před infuzí mít hodnotu CD3+ lymfocytů rovnou 100 na µl nebo vyšší, 24
25 - jestliže máte reakci štěpu proti hostiteli, která vyžaduje použití léků na potlačení imunitního systému. Upozornění a opatření Přípravek Zalmoxis je přípravek specifický pro daného pacienta a za žádných okolností se nesmí podávat jiným pacientům. Lékař vás bude během léčby pečlivě sledovat. Informujte svého lékaře před používáním přípravku Zalmoxis, pokud: - máte infekce vyžadující podávání gancikloviru (GCV) nebo valgancikloviru (VCV) (antivirové přípravky) v době infuze. V tomto případě bude léčba přípravkem Zalmoxis odložena o 24 hodin po skončení antivirové léčby. - máte-li reakci štěpu proti hostiteli, která vyžaduje použití léků na potlačení imunitního systému. - užíváte léky na potlačení imunitního systému nebo užíváte G-CSF (který stimuluje kostní dřeň k tvorbě krvinek) po transplantaci kmenových buněk. V tomto případě může být přípravek Zalmoxis podán po adekvátním vymývacím období (doba nezbytná k odstranění přípravku z těla). - jste již dříve měl(a) jakýkoliv nežádoucí účinek po podání přípravku Zalmoxis a ten neodezněl během 30 dnů od jeho výskytu. Kdy nelze přípravek Zalmoxis podat V některých případech nemusí být možné, abyste dostal(a) naplánovanou infuzi přípravku Zalmoxis. Může k tomu dojít kvůli výrobním potížím. V takových případech bude informován váš ošetřující lékař a ten může stále považovat za vhodnější léčbu podat nebo pro Vás může vybrat alternativní léčbu. Děti a dospívající V současnosti nejsou pro tyto pacienty k dispozici žádné údaje. Použití přípravku Zalmoxis u dětí a dospívajících mladších 18 let se nedoporučuje. Další léčivé přípravky a přípravek Zalmoxis Nebyly provedeny žádné studie interakcí. Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Těhotenství a kojení Během těhotenství a kojení nebylo bezpečné používání přípravku Zalmoxis prokázáno. Těhotné a kojící ženy nesmí přípravek Zalmoxis používat. Ženy ve fertilním věku musí během léčby přípravkem Zalmoxis a ještě 6 měsíců po ukončení terapie používat účinnou antikoncepci. Pokud jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat. Řízení dopravních prostředků a obsluha strojů Přípravek Zalmoxis by neměl mít žádný vliv na schopnost řídit dopravní prostředky nebo obsluhovat stroje. Při posuzování schopnosti provádět úkoly, které vyžadují úsudek, motorické nebo kognitivní dovednosti, byste však měl(a) brát v úvahu svůj celkový stav. 25
26 Přípravek Zalmoxis obsahuje sodík Přípravek Zalmoxis 5 20 x 10 6 buněk/ml infuzní disperze obsahuje 13,3 mmol (305,63 mg) sodíku v jedné dávce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku. 3. JAK SE PŘÍPRAVEK ZALMOXIS PODÁVÁ Přípravek Zalmoxis smí být předepisován a podáván pouze v nemocnici lékařem nebo zdravotní sestrou, která je k podávání tohoto léčivého přípravku vyškolena. Praktické informace o manipulaci s přípravkem Zalmoxis a jeho podávání pro lékaře a zdravotní sestry můžete nalézt na konci této příbalové informace. Přípravek Zalmoxis byl vyroben specificky pro Vás a nelze jej podat žádnému jinému pacientovi. Počet buněk, který se má podat, závisí na Vaší tělesné hmotnosti. Dávka odpovídá 1 ± 0,2 x 10 7 buněk/kg. Přípravek Zalmoxis se podává intravenózně (do žíly) jako infuze (kapačka) po dobu přibližně minut a v časovém intervalu dnů od transplantace. Další infuze se podávají jednou měsíčně až po dobu 4 měsíců. Rozhodnutí přistoupit k další léčbě učiní Váš lékař a bude záviset na stavu Vaší imunity. Jestliže jste dostal(a) více přípravku Zalmoxis, než jste měl(a) Protože tento lék předepisuje lékař, každá dávka se připravuje pouze pro Vás a každý přípravek zahrnuje jednu dávku. Je nepravděpodobné, že dostanete více přípravku, než máte. Jestliže jste zapomněl(a) použít přípravek Zalmoxis Tento lék předepisuje lékař a je podáván v nemocnici za přísného dohledu a podle předem stanoveného schématu, proto nemůžete na svoji dávku zapomenout. Máte-li jakékoliv další otázky týkající se používání tohoto léčivého přípravku, zeptejte se svého lékaře. 4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Některé z těchto nežádoucích účinků mohou být závažné a mohou vést k hospitalizaci. Pokud máte jakékoli otázky týkající se příznaků nebo nežádoucích účinků, nebo máte z nějakých příznaků obavy, poraďte se neprodleně se svým lékařem. Velmi časté nežádoucí účinky (mohou postihnout více než 1 osobu z 10) Akutní reakce štěpu proti hostiteli (komplikace, která se může vyskytnout po transplantaci kmenových buněk nebo kostní dřeně, při níž nově transplantované buňky dárce zaútočí na tělo pacienta). Časté nežádoucí účinky (mohou postihnout až 1 osobu z 10) 26
27 - Potransplantační lymphoproliferativní porucha (zvýšení počtu bílých krvinek v krvi po transplantaci) - Chronická reakce štěpu proti hostiteli (komplikace, která může nastat po transplantaci kmenových buněk nebo kostní dřeně, kdy nově transplantované buňky od dárce napadají tělo pacienta) - Střevní krvácení - Jaterní selhání (porucha funkce jater) - Febrilní neutropenie (horečka se snížením počtu bílých krvinek) - Pokles hladiny hemoglobinu (snížení počtu červených krvinek) - Pokles počtu krevních destiček - Bronchitida (zánět průdušek, plicní infekce) - Horečka Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku. 5. JAK PŘÍPRAVEK ZALMOXIS UCHOVÁVAT Uchovávejte tento přípravek mimo dohled a dosah dětí. Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na obalu. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte v kapalném dusíku. Infúzní roztok se má použít bezprostředně po rozmrazení. Maximální doba od rozmrazení do infuze je 2 hodiny při pokojové teplotě (15 30 C). Obal se kontroluje kvůli přítomnosti jakékoliv abnormality na vnější krabici a na označení se kontroluje, zda pacient/dárce odpovídá. Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován jako biologický nebezpečný materiál obsahující geneticky upravené organismy a v souladu s místními požadavky.. Nemocniční personál odpovídá za správné uchovávání přípravku jak před použitím, tak během něj a rovněž za jeho správnou likvidaci. 6. OBSAH BALENÍ A DALŠÍ INFORMACE Co přípravek Zalmoxis obsahuje Léčivou látkou je allogenní T-lymfocyt geneticky modifikovaný retrovirovým vektorem, který kóduje zkrácenou formu receptoru pro humánní nervový růstový faktor s nízkou afinitou (ΔLNGFR) a thymidinkinázu viru herpes simplex I (HSV-TK Mut2). Jeden vak obsahuje zmrazenou disperzi o objemu ml v koncentraci 5 20 x 10 6 buněk/ml. 27
28 Dalšími složkami jsou chlorid sodný, lidský albumin a dimethylsulfoxid (viz bod 2). Jak přípravek Zalmoxis vypadá a co obsahuje toto balení Přípravek Zalmoxis je buněčná infuzní disperze, která vypadá jako neprůhledná, téměř bílá zmražená disperze buněk. Přípravek Zalmoxis je dodáván jako jedna samostatná léčebná dávka v ml ethylenvinylacetátových kryovacích. Držitel rozhodnutí o registraci a výrobce MolMed SpA Via Olgettina Milano Itálie Tel Fax info@molmed.com Tato příbalová informace byla naposledy revidována Tomuto léčivému přípravku bylo uděleno tzv. podmíněné schválení. Znamená to, že informace o tomto přípravku budou přibývat. Evropská agentura pro léčivé přípravky nejméně jednou za rok vyhodnotí nové informace o tomto léčivém přípravku a tato příbalová informace bude podle potřeby aktualizována. Další zdroje informací Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky Na těchto stránkách nalezente též odkazy na další webové stránky týkající se vzácných onemocnění a jejich léčby Následující informace jsou určeny pouze pro zdravotnické pracovníky: Praktické informace pro lékaře nebo zdravotníky týkající se manipulace s přípravkem Zalmoxis a jeho podávání. Přípravek Zalmoxis musí být podáván za dohledu lékaře, který má zkušenosti s transplantací hematopoietických kmenových buněk u hematologických malignit. Je důležité, abyste si přečetl(a) celý obsah tohoto postupu předtím, než budete přípravek Zalmoxis podávat. Dávka a průběh léčby Jeden vak obsahuje dárcovské geneticky modifikované T-lymfocyty pro expresi HSV-TK a ΔLNGFR v koncentraci 5 20 x 10 6 buněk/ml. 28
29 Léčba probíhá tak, že se podávají maximálně čtyři infuze přibližně v jednoměsíčních intervalech. Rozhodnutí o přistoupení k nové léčbě závisí na stavu dosažené rekonstituce imunity pacienta, když je počet cirkulujících T-lymfocytůroven, nebo větší než 100 na µl. Pokyny pro manipulaci s přípravkem Před manipulací s přípravkem Zalmoxis nebo jeho podáváním Přípravek Zalmoxis se dodává přímo do zdravotnického zařízení, kde se infuze bude podávat. Přeprava se provádí v kapalném dusíku. Vak se vloží do druhého vaku (vnitřní obal) a ten se umístí do hliníkové krabice (vnější obal). Celý obal se zabezpečí v nádobě s kapalným dusíkem, která je konstruována pro zachování vhodné přepravní a uchovávací teploty až do doby podání infuze. Pokud léčivý přípravek nebude bezprostředně připraven k infuzi, přeneste vak do kapalného dusíku. Chraňte před ozářením. Přípravek Zalmoxis se připravuje z lidské krve specifického dárce a obsahuje geneticky modifikované buňky. Dárci jsou testováni na přítomnost přenosných infekčních agens v souladu platnými místními předpisy. Nicméně riziko přenosu infekčních virů na zdravotníky nelze zcela vyloučit. V souladu s tím musí zdravotníci při manipulaci s přípravkem Zalmoxis přijmout vhodná bezpečnostní opatření (např. používat rukavice a brýle). Vnější a vnitřní obal je nutné zkontrolovat, aby se ověřil štítek označující přípravek a specifického pacienta na horní straně krabice a na vnitřním obalu. Co zkontrolovat před infuzí Zkontrolujte, zda certifikát o analýze obsahuje identifikační údaje pacienta, dobu použitelnosti a schválení k infuzi získané od držitele rozhodnutí o registraci. Zkontrolujte, že identita pacienta odpovídá zásadním a jedinečným informacím o pacientovi uvedeným na vaku s přípravkem Zalmoxis a na certifikátu o analýze. Jakmile bude pacient připraven k infuzi, zkontrolujte neporušenost vaku přípravku Zalmoxis. Vak by měl vypadat jako neprůhledná, téměř bílá zmražená buněčná disperze. Pokud na vaku budou viditelné trhliny nebo bude porušený, přípravek nepoužívejte. Dejte vak do dvou plastových obálek (dvojitý obal), aby nedošlo k přímému styku s vodou. Držte horní okraj obálky mimo dosah vody a současně ji vložte do vodní lázně o teplotě 37 ± 1 C, přičemž dbejte na to, aby voda nepronikla spojem. Pokud dojde k úniku během rozmrazování, přípravek nepoužívejte. Podávání Po úplném rozmrazení vyjměte vak s přípravkem Zalmoxis z dvojitého obalu, osušte ho a vnější povrch dezinfikujte. Co nejdříve přistupte k infuzi, nepřechovávejte vak ve vodní lázni po rozmrazení. Infuzí se musí podat celý objem vaku. Doporučená doba infuze je přibližně minut. Po infuzi Na konci infuze vak 2krát nebo 3krát propláchněte fyziologickým roztokem za použití sterilní techniky, aby byl přípravek Zalmoxis kompletně podán. Po dokončení proplachu je nutné sejmout štítek s označením daného pacienta a uložit jej do dokumentace příslušného pacienta. Kryovak a veškerý nepoužitý přípravek nebo odpad obsahující geneticky modifikované organismy musí být zlikvidován v souladu s místními požadavky. Infuzi přípravku Zalmoxis nepodávejte, pokud jste nedostal(a) certifikát o analýze. Je certifikát o analýzy označen jako neplatný. uplynula doba použitelnosti. jedinečné informace o pacientovi na infuzním vaku neodpovídají plánovanému pacientovi. došlo k jakémukoliv narušení celistvosti přípravku. 29
30 Doba použitelnosti a zvláštní opatření pro uchovávání Přípravek Zalmoxis má dobu použitelnosti 18 měsíců při uchovávání v kapalném dusíku. Přípravek Zalmoxis se musí použít neprodleně po vyjmutí z přepravního obalu. Pokud nebude přípravek Zalmoxis použit neprodleně, přeneste jej z přepravního obalu do kapalného dusíku. Doba použitelnosti po rozmrazení jsou 2 hodiny. 30
31 PŘÍLOHA IV ZÁVĚRY O UDĚLENÍ PODMÍNĚNÉ REGISTRACE PŘÍPRAVKU A PODOBNOSTI PŘEDLOŽENÉ EVROPSKOU AGENTUROU PRO LÉČIVÉ PŘÍPRAVKY 31
32 Závěry předložené Evropskou agenturou pro léčivé přípravky: Podmíněná registrace přípravku Výbor CHMP posoudil žádost a je toho názoru, že poměr přínosů a rizik je příznivý, a proto doporučuje, aby přípravku byla udělena podmíněná registrace, jak je podrobněji popsáno v Evropské veřejné zprávě o hodnocení. 32
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příbalová informace: informace pro uživatele. Fluorid (18F) sodný RadioMedic 1 10 GBq injekční roztok Natrii fluoridum ( 18 F)
 sp.zn. sukls298615/2018 Příbalová informace: informace pro uživatele Fluorid (18F) sodný RadioMedic 1 10 GBq injekční roztok Natrii fluoridum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls298615/2018 Příbalová informace: informace pro uživatele Fluorid (18F) sodný RadioMedic 1 10 GBq injekční roztok Natrii fluoridum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok
 sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn. sukls107935/2012
 sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta. ANACID 258 mg/388 mg perorální suspenze. Magnesii hydroxidum, Algeldrati suspensio
 sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
FLUDEOXYGLUCOSE (18F) UJV Injekční roztok. Fludeoxyglucosum ( 18 F)
 Sp.zn. sukls211025/2013 Příbalová informace: informace pro pacienta FLUDEOXYGLUCOSE (18F) UJV Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude
Sp.zn. sukls211025/2013 Příbalová informace: informace pro pacienta FLUDEOXYGLUCOSE (18F) UJV Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude
FLUDEOXYGLUKOSA INJ MBq/ml Injekční roztok
 sp.zn. sukls347612/2018 Příbalová informace: informace pro pacienta FLUDEOXYGLUKOSA INJ. 100-1500 MBq/ml Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls347612/2018 Příbalová informace: informace pro pacienta FLUDEOXYGLUKOSA INJ. 100-1500 MBq/ml Injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum
 Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bronchostop sirup. Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt
 Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příbalová informace: informace pro uživatele. 2-[ 18 F]-FDG 1-20 GBq injekční roztok Fludeoxyglucosum ( 18 F)
![Příbalová informace: informace pro uživatele. 2-[ 18 F]-FDG 1-20 GBq injekční roztok Fludeoxyglucosum ( 18 F) Příbalová informace: informace pro uživatele. 2-[ 18 F]-FDG 1-20 GBq injekční roztok Fludeoxyglucosum ( 18 F)](/thumbs/96/126829105.jpg) sp.zn. sukls298596/2018 Příbalová informace: informace pro uživatele 2-[ 18 F]-FDG 1-20 GBq injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls298596/2018 Příbalová informace: informace pro uživatele 2-[ 18 F]-FDG 1-20 GBq injekční roztok Fludeoxyglucosum ( 18 F) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
1. Co je přípravek Maltofer Fol žvýkací tablety a k čemu se používá. Maltofer Fol se používá k léčbě a prevenci nedostatku železa v organismu.
 sp.zn. sukls238178/2016 Příbalová informace: Informace pro uživatele Maltofer Fol tablety 100 mg / 0,35 mg, žvýkací tablety železo ve formě polymaltosum ferricum / kyselina listová Přečtěte si pozorně
sp.zn. sukls238178/2016 Příbalová informace: Informace pro uživatele Maltofer Fol tablety 100 mg / 0,35 mg, žvýkací tablety železo ve formě polymaltosum ferricum / kyselina listová Přečtěte si pozorně
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
Příbalová informace: informace pro uživatele. Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum
 sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
Příbalová informace: informace pro uživatele. Metastron 37 MBq/ml, injekční roztok
 sp.zn. sukls72263/2019 Příbalová informace: informace pro uživatele Metastron 37 MBq/ml, injekční roztok Strontii chloridum 89 Sr Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls72263/2019 Příbalová informace: informace pro uživatele Metastron 37 MBq/ml, injekční roztok Strontii chloridum 89 Sr Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příbalová informace: informace pro uživatele
 sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
 ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
Trihydrát octanu sodného Kyselina octová Chlorid sodný Hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu ph Voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge Erivedge může způsobit závažné vrozené vady Může vést
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
Starší pacienti: Pro tuto věkovou skupinu nejsou žádná zvláštní doporučení ohledně dávky.
 Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
Sp.zn. sukls59988/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ERAZABAN 10% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Docosanolum 100 mg v 1 g krému. Pomocné látky: 50 mg propylenglykolu / 1 g krému
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin
 Sp.zn.sukls151598/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Sp.zn.sukls151598/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUNORM 5% 50g/l, infuzní roztok Lidský albumin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Fludeoxyglucose (18F) Biont 200 1300 MBq/ml injekční roztok FLUDEOXYGLUCOSUM ( 18 F)
 Sp.zn. sukls117503/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fludeoxyglucose (18F) Biont 200 1300 MBq/ml injekční roztok FLUDEOXYGLUCOSUM ( 18 F) Přečtěte si pozorně celou příbalovou informaci
Sp.zn. sukls117503/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fludeoxyglucose (18F) Biont 200 1300 MBq/ml injekční roztok FLUDEOXYGLUCOSUM ( 18 F) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Příbalová informace: informace pro uživatele. Sodium Iodide (I123) Injection 37 MBq/ml, injekční roztok Natrii iodidum ( 123 I)
 Příbalová informace: informace pro uživatele Sodium Iodide (I123) Injection 37 MBq/ml, injekční roztok Natrii iodidum ( 123 I) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Sodium Iodide (I123) Injection 37 MBq/ml, injekční roztok Natrii iodidum ( 123 I) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok. železo ve formě polymaltosum ferricum
 sp.zn. sukls238918/2016 Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok železo ve formě polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls238918/2016 Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok železo ve formě polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro pacienta. Yttrium ( 90 Y) colloid suspension for local injection YTTRII-( 90 Y) CITRAS injekční suspenze
 sp.zn. sukls174761/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection YTTRII-( 90 Y) CITRAS injekční suspenze (V této příbalové informaci dále nazývaný
sp.zn. sukls174761/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection YTTRII-( 90 Y) CITRAS injekční suspenze (V této příbalové informaci dále nazývaný
Celaskon 100 mg ochucené tablety
 sp.zn. sukls294799/2017 Příbalová informace informace pro uživatele Celaskon 100 mg ochucené tablety acidum ascorbicum vitamin C Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls294799/2017 Příbalová informace informace pro uživatele Celaskon 100 mg ochucené tablety acidum ascorbicum vitamin C Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Kartonová krabice (skleněné/polyethylenové lahve) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička pro blistry a HDPE lahvičky} 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Teva 60 mg, tvrdé tobolky Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tobolka obsahuje
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička pro blistry a HDPE lahvičky} 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Teva 60 mg, tvrdé tobolky Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tobolka obsahuje
Příbalová informace: informace pro uživatele. SMECTA 3 g prášek pro perorální suspenzi. diosmectitum
 sp. zn. sukls76878/2017 Příbalová informace: informace pro uživatele SMECTA 3 g prášek pro perorální suspenzi diosmectitum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls76878/2017 Příbalová informace: informace pro uživatele SMECTA 3 g prášek pro perorální suspenzi diosmectitum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příbalová informace : Informace pro uživatele. Aknemycin 2000 Mast Erythromycinum
 sp.zn. sukls182807/2012 Příbalová informace : Informace pro uživatele Aknemycin 2000 Mast Erythromycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls182807/2012 Příbalová informace : Informace pro uživatele Aknemycin 2000 Mast Erythromycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection
Příbalová informace: Informace pro pacienta
 sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
Příbalová informace: informace pro uživatele AESCIN-TEVA. 20 mg, enterosolventní tablety. escinum alfa
 sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
Příbalová informace: Informace pro pacienta
 sp.zn.sukls17470/2014 Příbalová informace: Informace pro pacienta ERMM-1 111 MBq/ml, injekční suspenze Erbii-( 169 Er) citras (Citronan erbný-( 169 Er) v koloidní suspenzi) (V této příbalové informaci
sp.zn.sukls17470/2014 Příbalová informace: Informace pro pacienta ERMM-1 111 MBq/ml, injekční suspenze Erbii-( 169 Er) citras (Citronan erbný-( 169 Er) v koloidní suspenzi) (V této příbalové informaci
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. BALENÍ 30 mg/ 5 ml
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
Příbalová informace: informace pro uživatele. Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas
 Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Locatim perorální roztok pro novorozená telata mladší než 12 hodin 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bovinní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Locatim perorální roztok pro novorozená telata mladší než 12 hodin 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Bovinní
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
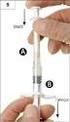 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
Příbalová informace: informace pro uživatele. Technescan LyoMAA 2 mg, kit pro radiofarmakum Albuminum humanum macroaggregatum
 sp.zn. sukls47767/2016 Příbalová informace: informace pro uživatele Technescan LyoMAA 2 mg, kit pro radiofarmakum Albuminum humanum macroaggregatum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls47767/2016 Příbalová informace: informace pro uživatele Technescan LyoMAA 2 mg, kit pro radiofarmakum Albuminum humanum macroaggregatum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí trachey (průdušnice)
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva sp.zn. sukls9243/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva sp.zn. sukls9243/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hirudoid forte gel 445mg/100g glycosaminoglycani polysulfas z hovězí
sp. zn. sukls180859/2015
 sp. zn. sukls180859/2015 Příbalová informace: informace pro pacienta DONA 1500 mg, prášek pro perorální roztok glucosamini sulfas cristallicus Přečtěte si pozorně celou příbalovou informaci dříve, než
sp. zn. sukls180859/2015 Příbalová informace: informace pro pacienta DONA 1500 mg, prášek pro perorální roztok glucosamini sulfas cristallicus Přečtěte si pozorně celou příbalovou informaci dříve, než
Příbalová informace: informace pro uživatele. MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas
 Příbalová informace: informace pro uživatele MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele MIBG (I123) injection injekční roztok Iobenguanum ( 123 I) a Iobenguani sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum
 sp.zn.sukls205603/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn.sukls205603/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum Přečtěte si pozorně tuto příbalovou
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
