MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY ROZHODNUTÍ
|
|
|
- Jaroslav Valenta
- před 5 lety
- Počet zobrazení:
Transkript
1 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 5. června 2019 Č.j.: MZDR 24548/2019-3/OVZ MZDRX016G953 ROZHODNUTÍ, jako správní úřad příslušný podle 11 písm. o) zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů, ve znění pozdějších předpisů (dále jen zákon o léčivech"), rozhodlo v řízení, jehož účastníky jsou společnosti PHARMOS, a.s., se sídlem Těšínská 1349/296, Radvanice, Ostrava, IČO: Avenier a.s., se sídlem Bidláky 837/20, Štýřice, Brno, IČO: I. Dle ustanovení 67 an. zákona č. 500/2004 Sb., správní řád, ve znění pozdějších předpisů, že ruší opatření Ministerstva zdravotnictví ze dne , č.j. MZDR 5122/2019-3/OVZ. II. Dle ustanovení 8 odst. 6 zákona o léčivech o tomto dočasném opatření: V zájmu ochrany veřejného zdraví a za účelem zajištění dostupnosti léčivých přípravků významných pro poskytování zdravotní péče v souladu s 8 odst. 6 zákona o léčivech povoluje distribuci, výdej a používání neregistrovaného humánního léčivého přípravku BCG vakcína, lyofilizovaná 0,05mg/dávka, prášek a rozpouštědlo pro injekční suspenzi / BCG VACCINE, FREEZE DRIED, Vaccinum Tubercuiosis (BCG) Cryodessication, výrobce BB-NCIPD Ltd.26, Yanko Sakazov Blvd, 1504 SOFIA, Bulharsko, v cizojazyčném vnějším i vnitřním obalu (bulharština) (dále jen bulharská BCG vakcína"). Distributorem do České republiky bude společnost PHARMOS, a.s., se sídlem Těšínská 1349/296, Ostrava, IČO:
2 Přímým distributorem do kalmetizačních pracovišť a pracovišť pneumoftizeologů v rámci České republiky bude společnost Avenier a.s., se sídlem Bidláky 20/837, Brno, IČO: Při distribuci, výdeji a používání uvedeného léčivého přípravku musí být splněny následující podmínky: - Distributor předloží Státnímu ústavu pro kontrolu léčiv OCABR certifikát každé dovezené šarže před jejím uvolněním do oběhu a dále předloží jednotlivé šarže bulharské BCG vakcíny k propuštění analogicky dle 102 zákona o léčivech. - Bulharská BCG vakcína bude dodávána v počtu 40 balení po 20 ampulích (1 balení obsahuje 20 ampulí, 1 ampule = 10 dávek), což odpovídá počtu dávek. - Narušení celistvosti balení přípravku je povoleno tak, aby na pracoviště mohly být dodávány jednotlivé ampule včetně ampule s rozpouštědlem, ke kterým bude vždy dodána kopie souhrnu údajů o přípravku v českém jazyce, za podmínky dodržení uchovávání přípravku dle souhrnu údajů o přípravku. - Povolení k distribuci a uvedení do oběhu v České republice neregistrované bulharské BCG vakcíny v cizojazyčném vnějším i vnitřním obalu se vydává od data tohoto rozhodnutí do doby ukončení výpadku dodávky polské vakcíny SZCZEPIONKA PRZECIWGRUŽLICZA BCG Lékaři budou povinně hlásit nežádoucí účinky v souladu s 93b odst. 1 zákona o léčivech, stejně tak jako i jiné nežádoucí účinky, které se vyskytnou v souvislosti s podáním neregistrovaného léčivého přípravku, a to způsobem stejným jako v 93b odst. 1 zákona o léčivech 1. Přípravek bude používán v souladu se souhrnem údajů o přípravku, který je součástí každého balení. V případě dávkování bulharské BCG vakcíny pro děti mladší 12 měsíců se v souladu s doporučením WHO (Report on BCG vaccine use for protection against mycobacterial infections including tuberculosis, leprosy, and other nontuberculous mycobacteria (NTM) infections ze dne ) stanovuje dávka 0,05 ml bulharské BCG vakcíny. Společnost Avenier a.s. zajistí ke každému balení výtisk souhrnu údajů o přípravku s textem v českém jazyce. Český překlad SPC léčivého přípravku uveřejní na svých internetových stránkách společně s tímto rozhodnutím. Dle doporučení WHO (WHO Technical Report Series, WHO Expert Committee on Biological Standardization, Sixty-second report) a blíže dle doporučení výrobce pro UNICEF 2 ) může být bulharská BCG vakcína po rekonstituci vystavena dennímu světlu pouze na minimální a nezbytně nutnou dobu. Není-li očkovací látka použita okamžitě po rekonstituci, musí být uchovávána při teplotě 2 C až 8 C, chráněna před denním světlem, po dobu maximálně 6 hodin. Po uplynutí této doby od rekonstituce musí být očkovací látka zlikvidována
3 V souladu s 152 odst. 5 ve spojení s 85 odst. 2 písm. a) zákona č. 500/2004 Sb., správní řád, ve znění pozdějších předpisů (dále jen správní řád") Ministerstvo vylučuje odkladný účinek rozkladu. Odůvodnění: konstatuje, že se jedná o očkovací látku na zajištění pravidelného očkování podle vyhlášky č. 537/2006 Sb., o očkování proti infekčním nemocem, ve znění pozdějších předpisů (dále jen vyhláška č. 537/2006 Sb."), a to o očkování proti tuberkulóze, pro které v současné době neexistuje v České republice jiná alternativa registrovanými přípravky. V České republice byla registrována vakcína proti tuberkulóze - BCG VACCINE SSI, držitele rozhodnutí o registraci Statens Sérum Institut, Copenhagen, Dánsko, reg. č. 59/533/00-C, u tohoto přípravku však byla na žádost držitele rozhodnutí o registraci zrušena registrace. Platnost registrace skončila k Zrušení registrace přípravku nebylo z důvodu bezpečnosti či kvality přípravku, ale z rozhodnutí držitele rozhodnutí o registraci přípravku zdůvodněného obchodními zájmy společnosti. vydalo dne rozhodnutí, č. j. MZDR 11432/2015-3/0VZ, o možnosti použití neregistrovaného léčivého přípravku dle 8 odst. 6 zákona o léčivech pro přípravek SZCZEPIONKA PRZECIWGRUZLICZA BCG 10 BIOMED-LUBLIN Wytwómia Surowic i Szczepionek Spótka Akcyjna Uniwersytecka 10, Lublin, Polsko, s platností na období 3 let, nebo na celkové množství dávek. Dne bylo Ministerstvo zdravotnictví prostřednictvím distributora Avenier a.s. informováno o ohlášeném výpadku dodávek polské vakcíny, a to do konce druhého čtvrtletí roku Vzhledem k výše uvedenému proběhlo jednání dne se zástupci orgánů ochrany veřejného zdraví a oddělení léčiv a zdravotnických prostředků (), odborných společností (ČPFS ČLS JEP), Státního ústavu pro kontrolu léčiv a distributorů, za účelem zajištění dodávek alternativního léčivého přípravku k očkování proti tuberkulóze. Pracovní skupina přijala rozhodnutí zajistit pro Českou republiku očkovací látku proti tuberkulóze, a to bulharskou BCG vakcínu. Bulharská BCG vakcína obsahuje živé oslabené bakterie Mycobacterium bovis pocházející z kultury bakterií BCG (Bacillus Calmette Guerin). Vakcína je určena k preventivnímu očkování proti tuberkulóze, kočkování novorozenců a přeočkování dětí a dospělých, kteří mají negativní tuberkulinový test s omezením pro rizikové skupiny jedinců uvedených v příbalové informaci. Držitelem rozhodnutí o registraci je BB-NCIPD Ltd., 26 Yanko Sakazov Blvd., 1504 Sofia, Bulharsko. Registrační číslo přípravku je ; vakcína je registrována od roku 2006, registrace byla prodloužená v roce Přípravek je registrován v členském státě Evropské unie.
4 K výše uvedenému postupu vydal Státní ústav pro kontrolu léčiv souhlasné stanovisko ze dne , č. j. SUKL50539/2019. rozhodlo o vyloučení odkladného účinku rozkladu podaného proti tomuto rozhodnutí z důvodu naléhavého veřejného zájmu, který spatřuje v nutné aktuální potřebě bulharské BCG vakcíny k zajištění očkování proti tuberkulóze podle vyhlášky č. 537/2006 Sb., jak je uvedeno výše v odůvodnění tohoto rozhodnutí. Vydané rozhodnutí je výjimečným a dočasným opatřením vyvolaným nutností zajistit pravidelné očkování touto vakcínou a naplnit tak povinnosti vyplývající pro ze zákona č. 258/2000 Sb., o ochraně veřejného zdraví a o změně některých souvisejících zákonů, věznění pozdějších předpisů, a jeho prováděcího předpisu, tj. vyhlášky č. 537/2006 Sb., kdy nedostupnost této vakcíny by mohla závažným způsobem ohrozit veřejné zdraví. Odkladný účinek rozkladu by byl v rozporu s důvody, které vedou k vydání tohoto mimořádného opatření. V souladu s 8 odst. 6 zákona o léčivech nenese držitel rozhodnutí o registraci, výrobce a zdravotničtí pracovníci odpovědnost za důsledky vyplývající z použití bulharské BCG vakcíny způsobem stanoveným v tomto rozhodnutí. Odpovědnost za vady léčivých přípravků podle zákona č. 89/2012 Sb., občanský zákoník, ve znění pozdějších předpisů, není dotčena. Vzhledem k nutnosti stanovení dalších podmínek opatření bylo nutno s ohledem na naléhavý veřejný zájem na ochraně veřejného zdraví zrušit původní opatření ze dne , č.j. MZDR 5122/2019-3/OVZ. konstatuje, že rovněž obdrželo žádost o zrušení původního rozhodnutí. Zrušením původního rozhodnutí a jeho nahrazení tímto rozhodnutím nedojde k újmě účastníků řízení. Poučení: Proti tomuto rozhodnutí lze v souladu s 152 odst. 1 správního řádu podat u Ministerstva rozklad, a to ve lhůtě 15 dnů ode dne doručení tohoto rozhodnutí. O rozkladu rozhoduje ministr zdravotnictví. Rozklad nemá odkladný účinek. /Mg^HÉva (jottvaldóvá hlavní hygienická ČR a náměstkyně ministra
5 Doložka autorizované konverze do dokumentu obsaženého v datové zprávě Sděluji, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby elektronické pod pořadovým číslem , skládající se z 4 listů, se doslovně shoduje s obsahem vstupu. Autorizovanou konverzí dokumentu se nepotvrzuje správnost a pravdivost údajů obsažených v dokumentu a jejich soulad s právními předpisy. Zajišťovací prvek: bez zajišťovacího prvku Subjekt, který autorizovanou konverzi dokumentu provedl: Datum vyhotovení doložky: Jméno, příjmení a podpis osoby, která autorizovanou konverzi dokumentu provedla: Olga Čmejlová Poznámka: Kontrolu této doložky lze provést v centrální evidenci doložek přístupné způsobem umožňujícím dálkový přístup na adrese
OPATŘENI OBECNÉ POVAHY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 7. ledna 2019 Č. j.: MZDR 32517/2017-9/FAR Sp. zn. OLZP: S22/2018 llllllllllllllllllllllllllllllulllllllulllllll MZDRX014T6DT OPATŘENI OBECNÉ POVAHY
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 7. ledna 2019 Č. j.: MZDR 32517/2017-9/FAR Sp. zn. OLZP: S22/2018 llllllllllllllllllllllllllllllulllllllulllllll MZDRX014T6DT OPATŘENI OBECNÉ POVAHY
Adam VOJTECH ministr zdravotnictví ROZHODNUTI
 Adam VOJTECH ministr zdravotnictví V Praze dne -9-05-2018 Č.j.: MZDR 16268/2018-3/PRO III MZDRX0127JE1 ROZHODNUTI Ministr zdravotnictv, jako nadř zený správn orgán př slušný podle 149 odst. 6 zákona č.
Adam VOJTECH ministr zdravotnictví V Praze dne -9-05-2018 Č.j.: MZDR 16268/2018-3/PRO III MZDRX0127JE1 ROZHODNUTI Ministr zdravotnictv, jako nadř zený správn orgán př slušný podle 149 odst. 6 zákona č.
OPATŘENI OBECNÉ POVAHY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 7. ledna 2019 Č. j.: MZDR 25069/2018-8/FAR Sp. zn. O ZP: S 5/2018 MZDRX014SN44 OPATŘENI OBECNÉ POVAHY Ministerstvo zdravotnictví České republiky (dále
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 7. ledna 2019 Č. j.: MZDR 25069/2018-8/FAR Sp. zn. O ZP: S 5/2018 MZDRX014SN44 OPATŘENI OBECNÉ POVAHY Ministerstvo zdravotnictví České republiky (dále
DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ
 1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 12./
 1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 19. října 2018 Č.j.: MZDR 13392/2018-8/FAR Sp. zn.: FAR S9/2018 *MZDRX013YJDY* MZDRX013YJDY Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 19. října 2018 Č.j.: MZDR 13392/2018-8/FAR Sp. zn.: FAR S9/2018 *MZDRX013YJDY* MZDRX013YJDY Ministerstvo zdravotnictví České republiky jako příslušný
Jméno, příjmení a podpis osoby, která autorizovanou konverzi dokumentu provedla: Mgr. Marcel Kubis
 Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 59316073-27874-140417091347, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 59316073-27874-140417091347, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 21. ledna 2019 Č. j.: MZDR 3053/2019-3/OLZP Sp. zn. OLZP: Z2/2019 *MZDRX014Z9XA* MZDRX014Z9XA Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 21. ledna 2019 Č. j.: MZDR 3053/2019-3/OLZP Sp. zn. OLZP: Z2/2019 *MZDRX014Z9XA* MZDRX014Z9XA Ministerstvo zdravotnictví České republiky jako příslušný
Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE
 Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE 5. 12. 2017 Zákon o léčivech - Práva a povinnosti držitele rozhodnutí o registraci - 33 (3) Držitel rozhodnutí o registraci
Legislativa upravující distribuci léčiv Alena Tomášková MZ ČR, ODBOR FARMACIE 5. 12. 2017 Zákon o léčivech - Práva a povinnosti držitele rozhodnutí o registraci - 33 (3) Držitel rozhodnutí o registraci
Jak vyhledávat v databázi léků.
 Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
 Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 60867995-52137-140602112212, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 60867995-52137-140602112212, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA 10 tel , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS84672/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS84672/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 8. října 2018 Č. j.: MZDR 26547/2018-6/FAR Sp. zn.: FAR S5/2018 *MZDRX013V6N6* MZDRX013V6N6 Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 8. října 2018 Č. j.: MZDR 26547/2018-6/FAR Sp. zn.: FAR S5/2018 *MZDRX013V6N6* MZDRX013V6N6 Ministerstvo zdravotnictví České republiky jako příslušný
 Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 61753910-28769-140623150234, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
Ověřovací doložka konverze do dokumentu obsaženého v datové zprávě Ověřuji pod pořadovým číslem 61753910-28769-140623150234, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby
FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ
 1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA 10 tel , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS43279/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel. 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS43279/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BCG VACCINE SSI 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml rekonstituované BCG vakcíny obsahuje: Léčivá látka: Mycobacterium bovis attenuatum (BCG) stratus
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BCG VACCINE SSI 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml rekonstituované BCG vakcíny obsahuje: Léčivá látka: Mycobacterium bovis attenuatum (BCG) stratus
[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv
![[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv [ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv](/thumbs/93/112264798.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
MUDr. Alice Němcová 2017 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV. Kantorek; dostupné z
 Studijní medikace distribuce,uchovávání, příprava a dopočitatelnost, spolupráce s lékárnou a možnost zajištění LP po skončení KH z pohledu regulační autority MUDr. Alice Němcová Kantorek; dostupné z http://kantorek.webzdarma.cz/kantorek_f.htm
Studijní medikace distribuce,uchovávání, příprava a dopočitatelnost, spolupráce s lékárnou a možnost zajištění LP po skončení KH z pohledu regulační autority MUDr. Alice Němcová Kantorek; dostupné z http://kantorek.webzdarma.cz/kantorek_f.htm
PREVENAR - zákonnost stanovení úhrady z veřejného zdravotního pojištění a maximální ceny (právní rozbor)
 PREVENAR - zákonnost stanovení úhrady z veřejného zdravotního pojištění a maximální ceny (právní rozbor) 1. Úvod Činnost Státního ústavu pro kontrolu léčiv (SÚKL) při zařazení údaje o úhradě léčivého přípravku
PREVENAR - zákonnost stanovení úhrady z veřejného zdravotního pojištění a maximální ceny (právní rozbor) 1. Úvod Činnost Státního ústavu pro kontrolu léčiv (SÚKL) při zařazení údaje o úhradě léčivého přípravku
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
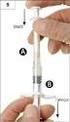
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
Aktuality v očkování 2015
 Aktuality v očkování 2015 XI. Hradecké vakcinologické dny 2015 1.- 3.10. 2015 MUDr. Hana Cabrnochová, MBA Česká vakcinologická společnost ČLS JEP Katedra PLDD IPVZ Praha Aktuální témata roku 2015 Odmítání
Aktuality v očkování 2015 XI. Hradecké vakcinologické dny 2015 1.- 3.10. 2015 MUDr. Hana Cabrnochová, MBA Česká vakcinologická společnost ČLS JEP Katedra PLDD IPVZ Praha Aktuální témata roku 2015 Odmítání
LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB.
 LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB. Mgr. Karel Ulrych Sekce registrací Zákon č. 66/2017 Sb. ze dne 31. 1. 2017 Změna zákona o léčivech, obsahující zejména úpravu zákona v reakci na nové nařízení
LEGISLATIVNÍ NOVINKY NOVELA Č. 66/2017 SB. Mgr. Karel Ulrych Sekce registrací Zákon č. 66/2017 Sb. ze dne 31. 1. 2017 Změna zákona o léčivech, obsahující zejména úpravu zákona v reakci na nové nařízení
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze 2. října 2018 Č. j.: MZDR 40675/2018-4/FAR Sp. zn.: FAR S3/2018 *MZDRX013SB27* MZDRX013SB27 Ministerstvo zdravotnictví České republiky
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze 2. října 2018 Č. j.: MZDR 40675/2018-4/FAR Sp. zn.: FAR S3/2018 *MZDRX013SB27* MZDRX013SB27 Ministerstvo zdravotnictví České republiky
B D ABCDEFB E EB B FB E B B B B E EB B E B B F B
 Toto rozhodnutí ze dne 11.01.2016, č.j. 085 EX 14048/15-11, nabylo právní moci dne 24.03.2016.Připojení doložky právní moci provedl Soudní exekutor JUDr. Milan Suchánek, dne 06.05.2016.Datum doložky provedení
Toto rozhodnutí ze dne 11.01.2016, č.j. 085 EX 14048/15-11, nabylo právní moci dne 24.03.2016.Připojení doložky právní moci provedl Soudní exekutor JUDr. Milan Suchánek, dne 06.05.2016.Datum doložky provedení
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA 10 tel.: , fax.: ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
Legislativní problematika očkování dospělých. X.Hradecké vakcinologické dny
 Legislativní problematika očkování dospělých X.Hradecké vakcinologické dny Něco z historie Průběžné četné změny právních předpisů.. 2009 změny v organizaci a kompetencích OHS, zejm. distribuce vakcín,
Legislativní problematika očkování dospělých X.Hradecké vakcinologické dny Něco z historie Průběžné četné změny právních předpisů.. 2009 změny v organizaci a kompetencích OHS, zejm. distribuce vakcín,
439/2000 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 6. prosince 2000 o očkování proti infekčním nemocem
 439/2000 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 6. prosince 2000 o očkování proti infekčním nemocem Ministerstvo zdravotnictví stanoví podle 108 odst. 1 k provedení 45, 46 odst. 1, 2 a 6 a 47 odst.
439/2000 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 6. prosince 2000 o očkování proti infekčním nemocem Ministerstvo zdravotnictví stanoví podle 108 odst. 1 k provedení 45, 46 odst. 1, 2 a 6 a 47 odst.
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY O P A T Ř E N Í O B E C N É P O V A HY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 1. listopadu 2018 Č.j.: MZDR 29196/2018-10/FAR Sp. zn.: FAR S6/2018 *MZDRX0144797* MZDRX0144797 O P A T Ř E N Í O B E C N É P O V A HY Ministerstvo zdravotnictví
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 1. listopadu 2018 Č.j.: MZDR 29196/2018-10/FAR Sp. zn.: FAR S6/2018 *MZDRX0144797* MZDRX0144797 O P A T Ř E N Í O B E C N É P O V A HY Ministerstvo zdravotnictví
MZ A POHLED NA LÉKOVÉ INTERAKCE. PharmDr. Alena Tomášková 24. únor 2015
 MZ A POHLED NA LÉKOVÉ INTERAKCE PharmDr. Alena Tomášková 24. únor 2015 Lékové interakce O lékové interakci mluvíme tehdy, když při současném podávání dvou nebo více léčivých přípravků dojde ke změně účinku
MZ A POHLED NA LÉKOVÉ INTERAKCE PharmDr. Alena Tomášková 24. únor 2015 Lékové interakce O lékové interakci mluvíme tehdy, když při současném podávání dvou nebo více léčivých přípravků dojde ke změně účinku
Žádost o dovoz veterinárního léčivého přípravku registrovaného v jiném členském státě
 Pokyn Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv ÚSKVBL / REG 1/2008 Žádost o dovoz veterinárního léčivého přípravku registrovaného v jiném členském státě Platnost od: 17.3. 2008 Platnost
Pokyn Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv ÚSKVBL / REG 1/2008 Žádost o dovoz veterinárního léčivého přípravku registrovaného v jiném členském státě Platnost od: 17.3. 2008 Platnost
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Překlad z polského jazyka do českého jazyka modifikovaný dle odborných postupů platných pro Českou republiku. Neregistrovaný léčivý přípravek. Použití je schváleno Ministerstvem zdravotnictví podle 8 odstavce
Překlad z polského jazyka do českého jazyka modifikovaný dle odborných postupů platných pro Českou republiku. Neregistrovaný léčivý přípravek. Použití je schváleno Ministerstvem zdravotnictví podle 8 odstavce
A. OZNAČENÍ NA OBALU
 A. OZNAČENÍ NA OBALU 1 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ OBSAHUJÍCÍ 1 BALENÍ S 50 LAHVIČKAMI SUSPENZE A 2 BALENÍ PO 25 LAHVIČKÁCH S EMULZÍ 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pandemrix, suspenze a emulze pro
A. OZNAČENÍ NA OBALU 1 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ OBSAHUJÍCÍ 1 BALENÍ S 50 LAHVIČKAMI SUSPENZE A 2 BALENÍ PO 25 LAHVIČKÁCH S EMULZÍ 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pandemrix, suspenze a emulze pro
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 8. října 2018 Č. j.: MZDR 29196/2018-9/FAR Sp. zn.: FAR S6/2018 *MZDRX013V6TC* MZDRX013V6TC Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 8. října 2018 Č. j.: MZDR 29196/2018-9/FAR Sp. zn.: FAR S6/2018 *MZDRX013V6TC* MZDRX013V6TC Ministerstvo zdravotnictví České republiky jako příslušný
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS214190/2011 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS214190/2011 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
Jak vyhledávat v databázi léků. www.olecich.cz
 Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
Metodika provádění pravidelného očkování v roce 2012 a 2013
 Metodika provádění pravidelného očkování v roce 2012 a 2013 (aktualizovaná verze ke dni 15. 4. 2013) Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění
Metodika provádění pravidelného očkování v roce 2012 a 2013 (aktualizovaná verze ke dni 15. 4. 2013) Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění
[ 1 ] MVDr. Vratislav Krupka. 2013 Státní ústav kontrolu léčiv
![[ 1 ] MVDr. Vratislav Krupka. 2013 Státní ústav kontrolu léčiv [ 1 ] MVDr. Vratislav Krupka. 2013 Státní ústav kontrolu léčiv](/thumbs/27/11027025.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Novela zákona o léčivech 2013 Distribuce a zprostředkování Vládní novela 70/2013 Seminář GMP 4.4.2014 MVDr.Vratislav Krupka Vedoucí oddělení SDP [ 3 ] Povinnosti
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Novela zákona o léčivech 2013 Distribuce a zprostředkování Vládní novela 70/2013 Seminář GMP 4.4.2014 MVDr.Vratislav Krupka Vedoucí oddělení SDP [ 3 ] Povinnosti
Pokyn DIS-13 verze 6 Hlášení dodávek distribuovaných humánních léčivých přípravků
 Pokyn DIS-13 verze 6 Hlášení dodávek distribuovaných humánních léčivých přípravků Tento pokyn nahrazuje DIS-13 verze 5 s účinností od 1.1.2019. Pokyn je vydáván na základě 77 odst. 1 písm. f) zákona č.
Pokyn DIS-13 verze 6 Hlášení dodávek distribuovaných humánních léčivých přípravků Tento pokyn nahrazuje DIS-13 verze 5 s účinností od 1.1.2019. Pokyn je vydáván na základě 77 odst. 1 písm. f) zákona č.
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 NEJČASTĚJŠÍ OBLASTI OTÁZEK PharmDr. Gabriela Vaculová Seminář SDP, SÚKL Praha 21. 9. 2016, 22.9. 2016 3 Oblasti dotazů zaslané k semináři Provádění vnitřních inspekcí Řízení rizik Ověřování účinnosti
2 NEJČASTĚJŠÍ OBLASTI OTÁZEK PharmDr. Gabriela Vaculová Seminář SDP, SÚKL Praha 21. 9. 2016, 22.9. 2016 3 Oblasti dotazů zaslané k semináři Provádění vnitřních inspekcí Řízení rizik Ověřování účinnosti
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A HY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 26. dubna 2018 Č.j.: MZDR 16343/2018-4/FAR *MZDRX0128PEI* MZDRX0128PEI P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A HY České republiky (dále
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 26. dubna 2018 Č.j.: MZDR 16343/2018-4/FAR *MZDRX0128PEI* MZDRX0128PEI P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A HY České republiky (dále
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
98/2012 Sb. VYHLÁŠKA. ze dne 22. března 2012
 98/2012 Sb. VYHLÁŠKA ze dne 22. března 2012 o zdravotnické dokumentaci Změna: 236/2013 Sb. Změna: 364/2015 Sb. Změna: XXX/2017 Sb. Ministerstvo zdravotnictví stanoví podle 120 zákona č. 372/2011 Sb., o
98/2012 Sb. VYHLÁŠKA ze dne 22. března 2012 o zdravotnické dokumentaci Změna: 236/2013 Sb. Změna: 364/2015 Sb. Změna: XXX/2017 Sb. Ministerstvo zdravotnictví stanoví podle 120 zákona č. 372/2011 Sb., o
ul. Lipowa Chotomów společně podnikající pod názvem: IMCA spółka cywilna, Jan Bogacki Magdalena Bogacka ul. Lipowa Chotomów
 Úřad pro registraci léčivých přípravků, zdravotnických prostředků a biocidních přípravků Al. Jerozolimskie 181C, 02222 Varšava, tel. +48 22 4921100. fax +48 22 4921109 NIP (DIČ) 5213211182 REGON (IČ) 015249601
Úřad pro registraci léčivých přípravků, zdravotnických prostředků a biocidních přípravků Al. Jerozolimskie 181C, 02222 Varšava, tel. +48 22 4921100. fax +48 22 4921109 NIP (DIČ) 5213211182 REGON (IČ) 015249601
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 4. října 2018 Č.j.: MZDR 25530/2018-5/FAR Sp. zn.: FAR S4/2018 *MZDRX013U057* MZDRX013U057 Ministerstvo zdravotnictví České republiky jako příslušný správní
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze 4. října 2018 Č.j.: MZDR 25530/2018-5/FAR Sp. zn.: FAR S4/2018 *MZDRX013U057* MZDRX013U057 Ministerstvo zdravotnictví České republiky jako příslušný správní
Doložka autorizované konverze do dokumentu obsaženého v datové zprávě
 ZK-06-2017-13, př. 2 Počet stran: 10 Doložka autorizované konverze do dokumentu obsaženého v datové zprávě Sděluji, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby elektronické
ZK-06-2017-13, př. 2 Počet stran: 10 Doložka autorizované konverze do dokumentu obsaženého v datové zprávě Sděluji, že tento dokument, který vznikl převedením vstupu v listinné podobě do podoby elektronické
Typy kontrol a průběh kontroly I (kontrola LEK)
 1 Typy kontrol a průběh kontroly I (kontrola LEK) PharmDr. Ivan Buzek Odbor lékárenství a distribuce Právní rámec s léčivými přípravky při poskytování lékárenské péče 2 Zákony a prováděcí předpisy Zákon
1 Typy kontrol a průběh kontroly I (kontrola LEK) PharmDr. Ivan Buzek Odbor lékárenství a distribuce Právní rámec s léčivými přípravky při poskytování lékárenské péče 2 Zákony a prováděcí předpisy Zákon
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
Metodika provádění pravidelného očkování v roce 2012 a 2013
 Metodika provádění pravidelného očkování v roce 2012 a 2013 (aktualizovaná verze ke dni 3. 4. 2013) Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění
Metodika provádění pravidelného očkování v roce 2012 a 2013 (aktualizovaná verze ke dni 3. 4. 2013) Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA 10 tel.: , fax.: ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz SUKLS1615/2010 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz SUKLS1615/2010 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA 10 tel.: , fax.: ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz SUKLS222504/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 tel.: 272 185 111, fax.: 271 732 377, e-mail: posta@sukl.cz SUKLS222504/2013 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 9. dubna 2019 Č. j.: MZDR 15900/2019-5/OLZP Sp. zn. OLZP: S8/2019 *MZDRX015U4L9* MZDRX015U4L9 Ministerstvo zdravotnictví České republiky jako příslušný
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY V Praze dne 9. dubna 2019 Č. j.: MZDR 15900/2019-5/OLZP Sp. zn. OLZP: S8/2019 *MZDRX015U4L9* MZDRX015U4L9 Ministerstvo zdravotnictví České republiky jako příslušný
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
Vyvěšeno dne:
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Sp. zn. SUKLS33666/2016 Č.jedn. sukl96807/2016 Šrobárova 48 100 41 Praha 10 Telefon: +420 272 185 111 Fax: +420 271 732 377 E-mail: posta@sukl.cz Web: www.sukl.cz Vyřizuje/linka
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Sp. zn. SUKLS33666/2016 Č.jedn. sukl96807/2016 Šrobárova 48 100 41 Praha 10 Telefon: +420 272 185 111 Fax: +420 271 732 377 E-mail: posta@sukl.cz Web: www.sukl.cz Vyřizuje/linka
ne méně 30 IU(25 Lf) Tetani anatoxinum 1
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU LAHVIČKA + LAHVIČKA X 1 LAHVIČKA + LAHVIČKA X 10 LAHVIČKA + LAHVIČKA X 20 LAHVIČKA + LAHVIČKA X 25 LAHVIČKA + LAHVIČKA X 40 LAHVIČKA + LAHVIČKA X 50
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU LAHVIČKA + LAHVIČKA X 1 LAHVIČKA + LAHVIČKA X 10 LAHVIČKA + LAHVIČKA X 20 LAHVIČKA + LAHVIČKA X 25 LAHVIČKA + LAHVIČKA X 40 LAHVIČKA + LAHVIČKA X 50
Metodika provádění pravidelného očkování. Obsah: I. ÚVOD DO PROBLEMATIKY... 1
 Verze: 2017/01 Vydáno: 24.1.2017 Metodika provádění pravidelného očkování Obsah: I. ÚVOD DO PROBLEMATIKY... 1 II. ANTIGENNÍ SLOŽENÍ OČKOVACÍCH LÁTEK PRO PRAVIDELNÁ OČKOVÁNÍ... 2 III. OBECNÁ CHARAKTERISTIKA
Verze: 2017/01 Vydáno: 24.1.2017 Metodika provádění pravidelného očkování Obsah: I. ÚVOD DO PROBLEMATIKY... 1 II. ANTIGENNÍ SLOŽENÍ OČKOVACÍCH LÁTEK PRO PRAVIDELNÁ OČKOVÁNÍ... 2 III. OBECNÁ CHARAKTERISTIKA
Exekuční příkaz. exekuční příkaz k provedení exekuce prodejem nemovitostí:
 Toto rozhodnutí ze dne 04.12.2012, č.j. 120 EX 48346/12-14, nabylo právní moci dne 28.12.2012. Připojení doložky právní moci provedl JUDr. Dalimil Mika, LL.M., v.r. soudní exekutor, dne 11.01.2013. Číslo
Toto rozhodnutí ze dne 04.12.2012, č.j. 120 EX 48346/12-14, nabylo právní moci dne 28.12.2012. Připojení doložky právní moci provedl JUDr. Dalimil Mika, LL.M., v.r. soudní exekutor, dne 11.01.2013. Číslo
(1) Pro předepsání, přípravu, výdej a použití individuálně připravovaného léčivého přípravku s obsahem
 Strana 2978 Sbírka zákonů č. 236 / 2015 236 VYHLÁŠKA ze dne 4. září 2015 o stanovení podmínek pro předepisování, přípravu, distribuci, výdej a používání individuálně připravovaných léčivých přípravků s
Strana 2978 Sbírka zákonů č. 236 / 2015 236 VYHLÁŠKA ze dne 4. září 2015 o stanovení podmínek pro předepisování, přípravu, distribuci, výdej a používání individuálně připravovaných léčivých přípravků s
Povolení čj /
 Strana 2/4 Strana 3/4 Správce daně stanovuje ve smyslu 43i odst. 3 písm. c) zákona o spotřebních daních tyto další podmínky: 1. Uživatel je povinen vést evidenci o příjmu, výdeji a použití vybraných výrobků
Strana 2/4 Strana 3/4 Správce daně stanovuje ve smyslu 43i odst. 3 písm. c) zákona o spotřebních daních tyto další podmínky: 1. Uživatel je povinen vést evidenci o příjmu, výdeji a použití vybraných výrobků
Co přináší novela zákona o léčivech? PharmDr. Alena Tomášková odbor farmacie
 Co přináší novela zákona o léčivech? PharmDr. Alena Tomášková odbor farmacie Zákon o léčivech Návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon
Co přináší novela zákona o léčivech? PharmDr. Alena Tomášková odbor farmacie Zákon o léčivech Návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS52437/2008 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz SUKLS52437/2008 V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním
Metodika provádění pravidelného očkování v roce 2012 a 2013
 Metodika provádění pravidelného očkování v roce 2012 a 2013 Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění a proces provádění pravidelných povinných
Metodika provádění pravidelného očkování v roce 2012 a 2013 Metodika provádění pravidelného očkování v roce 2012 a 2013 (dále jen Metodika ) upravuje způsob zajištění a proces provádění pravidelných povinných
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
123/2006 Sb. VYHLÁŠKA ČÁST PRVNÍ EVIDENCE NÁVYKOVÝCH LÁTEK A PŘÍPRAVKŮ
 123/2006 Sb. VYHLÁŠKA ze dne 31. března 2006 o evidenci a dokumentaci návykových látek a přípravků Ministerstvo zdravotnictví stanoví podle 32 odst. 3 a 33 odst. 2 zákona č. 167/1998 Sb., o návykových
123/2006 Sb. VYHLÁŠKA ze dne 31. března 2006 o evidenci a dokumentaci návykových látek a přípravků Ministerstvo zdravotnictví stanoví podle 32 odst. 3 a 33 odst. 2 zákona č. 167/1998 Sb., o návykových
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
Nařízení Státní veterinární správy. mimořádná veterinární opatření. Letní ošetření
 ČJ.: SVS/2013/033429-S Nařízení Státní veterinární správy Krajská veterinární správa Státní veterinární správy pro Středočeský kraj dále jen "KVS SVS pro Středočeský kraj" jako místně a věcně příslušný
ČJ.: SVS/2013/033429-S Nařízení Státní veterinární správy Krajská veterinární správa Státní veterinární správy pro Středočeský kraj dále jen "KVS SVS pro Středočeský kraj" jako místně a věcně příslušný
Klíčové změny v legislativě
 Klíčové změny v legislativě Mgr. Radomíra Urbanová Obchodní ředitelka regionu Morava a Východní Čechy PHOENIX lékárenský velkoobchod Zákon č. 340/2015 Sb., o registru smluv 2 Zákon č. 340/2015 Sb. o registru
Klíčové změny v legislativě Mgr. Radomíra Urbanová Obchodní ředitelka regionu Morava a Východní Čechy PHOENIX lékárenský velkoobchod Zákon č. 340/2015 Sb., o registru smluv 2 Zákon č. 340/2015 Sb. o registru
Přehled postupu vykazování jednotlivých očkování
 S účinností od 1. ledna 2012 jsou zdravotní pojišťovny působící v České republice povinny hradit z veřejného zdravotního pojištění léčivé přípravky obsahující očkovací látky pro pravidelná očkování podle
S účinností od 1. ledna 2012 jsou zdravotní pojišťovny působící v České republice povinny hradit z veřejného zdravotního pojištění léčivé přípravky obsahující očkovací látky pro pravidelná očkování podle
[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv
![[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv [ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv](/thumbs/92/109768502.jpg) [ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
[ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
Nemocniční výjimka pokyn UST-37
 1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
Texty SmPC a PIL jak s nimi po novu
 Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
LEK-12 verze 1 Podmínky pro klinická hodnocení léčivých přípravků v lékárnách
 LEK-12 verze 1 Podmínky pro klinická hodnocení léčivých přípravků v lékárnách Tento pokyn nahrazuje pokyn LEK-12 s platností od 1. 1. 2018. Pokyn je vydáván na základě a v souladu s ustanovením 56 odst.
LEK-12 verze 1 Podmínky pro klinická hodnocení léčivých přípravků v lékárnách Tento pokyn nahrazuje pokyn LEK-12 s platností od 1. 1. 2018. Pokyn je vydáván na základě a v souladu s ustanovením 56 odst.
Jedna tableta s prodlouženým uvolňováním obsahuje quetiapinum 50 mg (ve formě quetiapini fumaras).
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
Šrobárova Praha 10. Vyřizuje/linka PharmDr. Gabriela Vaculová/405
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48 00 4 Praha 0 Telefon: +420 272 85 Fax: +420 27 732 377 E-mail: posta@sukl.cz Web: www.sukl.cz ADRESÁT PHARMOS, a.s. ADRESA PRO DORUČENÍ Těšínská 349/296 Ostrava
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48 00 4 Praha 0 Telefon: +420 272 85 Fax: +420 27 732 377 E-mail: posta@sukl.cz Web: www.sukl.cz ADRESÁT PHARMOS, a.s. ADRESA PRO DORUČENÍ Těšínská 349/296 Ostrava
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml
 OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
STAHOVÁNÍ LÉČIVÉHO PŘÍPRAVKU CALCIUM PANTOTHENICUM ZENITVA METODICKÝ POSTUP PRO LÉKÁRNY, LÉKAŘE A DISTRIBUTORY
 STAHOVÁNÍ LÉČIVÉHO PŘÍPRAVKU CALCIUM PANTOTHENICUM ZENITVA METODICKÝ POSTUP PRO LÉKÁRNY, LÉKAŘE A DISTRIBUTORY 1. Kterých léčivých přípravků se stahování týká? Stahování se týká všech šarží s platnou dobou
STAHOVÁNÍ LÉČIVÉHO PŘÍPRAVKU CALCIUM PANTOTHENICUM ZENITVA METODICKÝ POSTUP PRO LÉKÁRNY, LÉKAŘE A DISTRIBUTORY 1. Kterých léčivých přípravků se stahování týká? Stahování se týká všech šarží s platnou dobou
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, PRAHA , fax ,
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV tel. Šrobárova 48, 100 41 PRAHA 10 272 185 111, fax 271 732 377, e-mail: posta@sukl.cz V souladu s ustanovením 39o zákona č. 48/1997 Sb., o veřejném zdravotním pojištění,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Vyvěšeno dne:
 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Sp. zn. SUKLS96174/2014 Č.jedn. sukl127276/2014 Šrobárova 48 Telefon: +420 272 185 111 E-mail: posta@sukl.cz 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Vyřizuje/linka
STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Sp. zn. SUKLS96174/2014 Č.jedn. sukl127276/2014 Šrobárova 48 Telefon: +420 272 185 111 E-mail: posta@sukl.cz 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Vyřizuje/linka
Aktuální léková politika. PharmDr. Alena Tomášková odbor farmacie
 Aktuální léková politika PharmDr. Alena Tomášková odbor farmacie Zákon o léčivech Návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech),
Aktuální léková politika PharmDr. Alena Tomášková odbor farmacie Zákon o léčivech Návrh zákona, kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů (zákon o léčivech),
STÁTNÍ ÚSTAV Šrobárova 48 Telefon: PRO KONTROLU LÉČIV Praha 10 Fax: Web:
 STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS32119/2014 Vyřizuje/linka: Mgr. Dominik Leplt
STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS32119/2014 Vyřizuje/linka: Mgr. Dominik Leplt
P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze dne 8. prosince 2017 Č.j.: MZDR 57929/2017-3/FAR *MZDRX010WP3B* MZDRX010WP3B P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze dne 8. prosince 2017 Č.j.: MZDR 57929/2017-3/FAR *MZDRX010WP3B* MZDRX010WP3B P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Kartonová krabice (skleněné/polyethylenové lahve) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 3.2.2015 2 ZMĚNY EU POŽADAVKŮ PRO SPRÁVNOU VÝROBNÍ PRAXI PRO LÉČIVÉ LÁTKY Ing. Zdenka Durdíková Státní ústav pro kontrolu léčiv, Praha 3 Přehled legislativy Zákon o léčivech č. 378/2007 Sb. - 69a, 70 Pokyn
3.2.2015 2 ZMĚNY EU POŽADAVKŮ PRO SPRÁVNOU VÝROBNÍ PRAXI PRO LÉČIVÉ LÁTKY Ing. Zdenka Durdíková Státní ústav pro kontrolu léčiv, Praha 3 Přehled legislativy Zákon o léčivech č. 378/2007 Sb. - 69a, 70 Pokyn
