Instruktážní brožura k správné aplikaci přípravku XIAPEX
|
|
|
- Klára Vávrová
- před 8 lety
- Počet zobrazení:
Transkript
1 Instruktážní brožura k správné aplikaci přípravku XIAPEX Tato instruktážní brožura byla vytvořena za účelem zajištění správné léčby pacientů s Dupuytrenovou kontrakturou léčivým přípravkem XIAPEX.
2 Dupuytrenova kontraktura a anatomie ruky Dupuytrenova kontraktura je pomalu progredující onemocnění pojivové tkáně postihující palmární fascie ruky. Může vést ke flekčním kontrakturám prstů a následně k významnému funkčnímu poškození a omezení. V počátečním proliferačním stádiu onemocnění se fibroblasty mění v myofibroblasty, což je doprovázeno depozicí kolagenu a tvorbou uzlů. V následném involučním stádiu se myofibroblasty seřadí podél linií tahu. Uzly se ztlušťují, vytvářejí se pruhy a začínají vznikat kontraktury. V konečném reziduálním stádiu dojde k vymizení myofibroblastů, které na svém místě zanechávají tlusté kolagenní pruhy a progresivní kontraktury. Dupuytrenovou kontrakturou jsou nejčastěji postiženy metakarpofalangeální (MP) a proximální interfalangeální (PIP) klouby, přičemž kontraktura se nejčastěji objevuje na čtvrtém a pátém prstu. Postižení prvního a druhého prstu není výjimečné, bývá ale mírnější. Nemoc je často bilaterální a může postihnout více prstů.
3 Přehled anatomie ruky 1,2,3,4 Centrem působení Dupuytrenovy kontraktury je komplex palmárních fascií. Skládá se z pěti anatomických komponent: radiální (thenarová) aponeuróza (RA), ulnární (hypothenarová) aponeuróza (UA), palmární (centrální) aponeuróza (PA), palmodigitální fascie a digitální fascie (obrázek 1). Obrázek 1. Komplex palmárních fascií laterální digitální list Clelandovo ligamentum Graysonovo ligamentum nervově-cévní svazek Digitální fascie spirální pruh pretendinózní pruh Palmodigitální fascie Pretendinózní pruh pátého prstu Palmární fascie Palmární aponeuróza se skládá ze tří typů vláken: longitudinálních vláken, transverzálních vláken a vertikálních neboli superficiálních vláken. Vertikální vlákna probíhají obloukovitě ke kůži a u hlaviček metakarpů vytvářejí distální palmární rýhu. Kožní vtaženiny, které často pozorujeme u Dupuytrenovy kontraktury, vznikají díky pevnému zakotvení těchto vertikálních vláken do kůže. Longitudinální vlákna vytvářejí struktury nazývané snopce - fascikuly (výraz snopce, v anglosaské literatuře bands, se používá pro normální fascii, patologicky ztluštělé snopce se označují jako pruhy, neboli cords ). V češtině však tato terminologie není zcela jednotná a výraz pruhy se používá i pro normální fascii.. Palmární fascie Longitudinální vlákna se vějířovitě rozbíhají a v úrovni hlaviček metakarpů se rozdělují do čtyř pretendinózních snopců (fasciculi praetendinosi), které vedou na druhý, třetí, čtvrtý a pátý prst. Další kratší pretendinózní snopec se upíná na první prst, tento snopec je ale slabý a není vždy přítomen. Pretendinózní longitudinální vlákna končí u hlaviček metacarpů (v palmodigitální fascii) a rozdělují se do tří vrstev (obrázek 2). Hluboká vrstva přechází dorzálně a téměř vertikálně. Povrchová vrstva se upíná do kůže v místě palmární digitální rýhy (rýha na bázi prstu na palmární straně ruky). Digitální fascie Střední vrstva pretendinózních longitudinálních vláken se rozděluje do dvou snopců přecházejících na každou stranu flexorových šlach. Ty pokračují distálně a dorzálně pod ligamentum metacarpale transversum superficiale, neboli starším názvem ligamentum natatorium (obrázek 1). Vlákna rotují o 90 stupňů a distálně od ligamentum natatorium (natatory ligament, NL) se vnořují a pokračují jako laterální digitální listy. Obrázek 2. Longitudinální vlákna ve fascii Palmárně Kůže Retrahující vlákna Longitudinální vlákna Transverzální vlákna Povrchová vrstva Střední vrstva Hluboká vrstva Pretendinózní svazek Dorzálně Distálně Proximálně Tyto listy se nacházejí laterálně od nervově-cévního svazku. Z laterálních digitálních listů vybíhají vlákna na každou stranu nervově-cévního svazku, na palmární stranu (Graysonovo ligamentum) a na dorzální stranu (Clelandovo ligamentum). Je důležité si uvědomit, že nervově-cévní svazek leží hluboce pod palmární fascií, ale směrem k prstům se dostává více povrchově. Přehled anatomie ruky Patoanatomie Dupuytrenovy kontraktury Přípravek XIAPEX Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
4 Přehled anatomie ruky 1,2,3,4 Flexory prstů Základními flexory prstů jsou musculus flexor digitorum profundus (FDP) a musculus flexor digitorum superficialis (FDS) a jejich šlachy (obrázek 3). V úrovni MP klubu vstupuje šlacha FDS do flexorové pochvy spolu se šlachou FDP. V okamžiku vstupu do pochvy se začíná šlacha FDS zplošťovat. V proximální třetině proximální falangy se rozděluje, obchází šlachu FDP a pokračuje dorzálně ke svému úponu na palmární straně baze střední falangy. Od úrovně PIP kloubu probíhá šlacha FDP palmárně od šlachy FDS a pokračuje distálně po úroveň distálního interfalangeálního kloubu (DIP). Tam se tvoří široký úpon na bazi proximální palmární třetiny distální falangy. Flexorová pochva se skládá z poutek (v anglosaské literatuře pulley ), které zabezpečují uložení flexorových šlach blízko středu otáčení, což umožňuje lépe ovládat flexi prstů. Obrázek 3. Flexorový a extenzorový aparát Šlacha extenzoru Metakarp Sagitální pruhy Šlacha FDS Šlacha FDP Musculus lumbricalis Musculus interosseus Proximální phalanx Vinculum longus Vinculum brevis Laterální pruh dors. aponeurozy Centrální pruh dors. aponeurozy Úpon later. pruhů Distální phalanx Retinaculum transversum Přehled anatomie ruky Patoanatomie Dupuytrenovy kontraktury Přípravek XIAPEX Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
5 Patoanatomie Dupuytrenovy kontraktury 1,2,3 U Dupuytrenovy kontraktury se normální svazky mění v ztluštělé pruhy, které se zkracují a vedou ke kontrakturám v MP, PIP a někdy i v DIP kloubech. Kromě tvorby kontraktur mohou některé pruhy dislokovat nervově-cévní svazky, čímž vzniká riziko poškození těchto struktur při operativních zákrocích a při perkutánní fasciotomii jehlou. Kontrakce povrchové vrstvy pretendinózního pruhu, jenž se upíná do kůže, vede ve dlani mezi distální palmární rýhou a palmo-digitální rýhou ke vzniku kožních vtaženin. Obrázek 4. Dupuytrenovy pruhy Komisurální pruh tvaru Y Laterální pruh Centrální pruh Spirální pruh Retrovaskulární pruh Pretendinózní pruh Natatorní pruh Pruh m. abduktor digiti minimi Pretendinózní pruh prvního prstu Druhy pruhů Ačkoliv je pozorována variabilita, rozlišuje se několik hlavních druhů pruhů: pretendinózní pruh, natatorní pruh, spirální pruh, centrální pruh a laterální pruh (Obrázky 4 a 5). Pretendinózní pruh, který nalézáme u Dupuytrenovy kontraktury nejčastěji, vzniká z pretendinózního svazku. Typicky způsobuje MP kontraktury. Natatorní pruh vzniká z ligamentum metacarpale transversum superficiale, neboli starším názvem ligamentum natatorium, a může vytvářet kontraktury 2., 3. a 4. meziprstního prostoru, což omezuje abdukci. Spirální pruh se může vyvinout z pretendinózního svazku, laterálního digitálního listu a Graysonova ligamenta. Vede ke kontrakturám MP a PIP kloubů obvykle na pátém, ale také na jiných prstech. Ve dlani je spirální pruh oproti nervově-cévnímu svazku uložen více povrchově. Na prstu se v počátečních stadiích Dupuytrenovy kontraktury spirálovitě obtáčí kolem nervově-cévního svazku, jak se ale fascie ztlušťuje a kontrahuje, pruh se vyrovnává. To vede k dislokaci svazku z původní pozice směrem ke střední čáře prstu (přičemž svazek se v této chvíli obtáčí kolem pruhu). Čím výraznější je kontraktura spirálního pruhu, tím více jsou nervově-cévní struktury dislokovány povrchově a ke střední čáře, což zvyšuje riziko, že dojde k jejich poškození při chirurgickém zákroku nebo perkutánní fasciotomii jehlou. Ačkoliv je výskyt nižší, je třeba uvážit i možnost vzniku tzv. spirálního nervu. V některých případech mohou spirální pruhy, zejména pruhy vznikající hluboko ve dlani, zespodu křížit nervověcévní svazek nebo pouze nerv (protože se dělí více proximálně než doprovázející tepna) a dislokovat ho proximálně a směrem ke střední čáře. To se může někdy projevit kruhovým okrskem houbovitě měkké přebytečné kůže v dlani na libovolné straně pruhu v úrovni MP kloubu. Podobný jev byl pozorován i u axiálních digitopalmárních pruhů (tj. centrálních pruhů). Toto je taktéž důležité rozpoznat před jakýmkoliv operačním zákrokem. Centrální pruh nemá obyčejně žádný fasciální prekurzor a je obvykle pouze prodloužením pretendinózního pruhu na prsty. Objevuje se ve střední čáře a upíná se do pochvy flexorových šlach poblíž PIP kloubu. Obvykle nezpůsobuje dislokaci nervově-cévního svazku. Patoanatomie Dupuytrenovy kontraktury Přípravek XIAPEX Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
6 Patoanatomie Dupuytrenovy kontraktury 1,2,3 Obrázek 5. Anatomie prstu Normální Abnormální Zřídka se mohou manifestovat retrovaskulární pruhy, které nejsou dobře definované, a předpokládá se, že vznikají z retrovaskulárních snopců nacházejících se hluboko pod nervově-cévním svazkem. Nezpůsobují kontraktury PIP kloubů. Graysonovo ligamentum Nervově-svalový svazek Ligamentum natatorium Arteria digitalis communis Nervus digitalis communis Clelandovo ligamentum Laterální digitální list Pretendinózní svazek Spirální svazek Transverzální ligamentum palmární aponeurózy Retrovaskulární pruh Spirální pruh Nervově-cévní svazek Povrchová část spirálního pruhu Arteria digitalis communis Vnitřní sval Centrální pruh Laterální pruh Natatorní pruh Pretendinózní pruh Nervus digitalis communis Komisurální pruhy se mohou vytvořit na prvním prstu z distálního komisurálního ligamenta (radiální prodloužení natatorního ligamenta) a z proximálních komisurálních ligament (radiální prodloužení transverzálního ligamenta palmární aponeurózy). Oba tyto pruhy způsobují kontrakturu prvního meziprstního prostoru. Pretendinózní pruh na prvním prstu není běžný, ale pokud vznikne, způsobuje flekční deformitu MP kloubu prvního prstu. Rozdíly mezi normální a abnormální anatomií prstu jsou zobrazeny níže (obrázek 5). Tyto náčrty ukazují patologické změny, které se objevují při rozvoji Dupuytrenovy kontraktury na prstu. Všechny náčrty z této části byly překresleny podle referencí 1 4. Laterální pruhy vznikají z laterálního digitálního listu a upínají se do kůže nebo pochvy flexorových šlach poblíž Graysonova ligamenta. Tyto pruhy vedou ke kontrakturám PIP kloubů a někdy ke kontrakturám DIP kloubů. Kvůli svému objemu mohou laterální pruhy dislokovat nervově-cévní svazek směrem ke střední čáře. Rovněž se mohou objevit jiné druhy pruhů. Pruh musculus abductor digiti minimi, neboli izolovaný digitální pruh, vzniká na pátém prstu od svalu musculus abductor digiti minimi. Probíhá povrchově od nervově-cévního svazku, ale příležitostně ho může zachytit a dislokovat. Patoanatomie Dupuytrenovy kontraktury Přípravek XIAPEX Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
7 Přípravek XIAPEX XIAPEX () byl vyvinut jako cílená terapie pro léčbu pacientů s Dupuytrenovou kontrakturou, která se projevuje hmatatelným pruhem. XIAPEX obsahuje dvě různé kolagenázy izolované a purifikované z bakterie Clostridium histolyticum. Farmakologický účinkem je selektivní lýza kolagenu v místě injekce (tedy v místě Dupuytrenova pruhu). Jeho terapeutická aktivita je tedy lokalizovaná, a proto na účinek nevyžaduje systémovou expozici. Dvě kolagenázy se vzájemně doplňují, štěpí řetězce kolagenu a rozvolňují patologické kolagenové pruhy, které kontrakturu způsobují. AUX-I (kolagenáza I. třídy) štěpí terminální části řetězce kolagenu a AUX-II (kolagenáza II. třídy) štěpí vnitřní segment tohoto řetězce (obrázek 6). Obrázek 6. XIAPEX mechanizmus účinku štěpí kolagen na různých místech vícero peptidových fragmentů rychlé štěpení N-konec NC-doména Kolagenní doména C-konec NC-doména Dupuytrenovy pruhy sestávají převážně z kolagenu typu I a III, což jsou substráty jak pro AUX-I, tak i AUX-II. Protože jiné měkké tkáně ruky, včetně vazů a šlach, jsou taktéž citlivé k působení těchto kolagenáz, je důležité, aby odpovědný lékař pochopil mechanizmus účinku a vhodný způsob aplikace přípravku XIAPEX. Je důležité zmínit, že podpůrné struktury nervů, arterií a vén obsahují hlavně kolagen typu IV, který je k působení přípravku XIAPEX rezistentní. Tato brožura obsahuje informace nezbytné pro: přípravu roztoku na injekci, injekci přípravku XIAPEX do pruhu ležícího nad postiženým MP nebo PIP kloubem, provedení extenze prstu za účelem přerušení pruhu, poskytnutí vhodné péče pacientům léčeným pří- pravkem XIAPEX. XIAPEX smí podávat pouze lékař vhodně poučený o správné aplikaci přípravku a zkušený v diagnostice a léčbě Dupuytrenovy kontraktury. Přípravek XIAPEX Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
8 Informace pro pacienta Před aplikací přípravku XIAPEX je důležité ujistit se, že pacient jasně chápe následující informace. Postup výkonu a očekávaný výsledek léčby Léčba přípravkem XIAPEX sestává z injekce a následné extenze prstu (1 den po aplikaci) za účelem přerušení patologického pruhu. V některých případech je možné dosáhnout uspokojivého výsledku již po jedné injekci. V jiných případech je potřeba další aplikace. Do stejného pruhu, pokud nedošlo k jeho ruptuře, se smějí aplikovat maximálně 3 injekce ve 4 týdenních intervalech. Je důležité poznamenat, že navzdory úspěšnému rozvolnění léčeného pruhu může dojít k rekurenci kontraktury. Upozornění pro pacienty současně užívající jinou medikaci Pje třeba dbát zvláštní opatrnosti při použití přípravku XIAPEX u pacientů s poruchou srážení krve nebo pacientů užívajících antikoagulační léčbu. Použití přípravku XIAPEX se nedoporučuje u pacientů, kteří užili antikoagulancia (s výjimkou acetylsalicylové kyseliny v denní dávce do 150 mg) během předcházejících 7 dní před plánovanou aplikací injekce. Je třeba dbát zvláštní opatrnosti při podávání přípravku XIAPEX pacientům se současnou léčbou fluorochinolonovými antibiotiky. Léčba přípravkem XIAPEX se nedoporučuje u pacientů, kteří užili tetracyklinová antibiotika později než 14 dní před plánovanou injekcí. Upozornění při graviditě Pacientky by měly být upozorněny, že se použití přípravku XIAPEX se nedoporučuje v těhotenství, a že by měla být léčba odložena na období po těhotenství. Kontraindikace XIAPEX je kontraindikován u pacientů s hypersenzitivitou na kolagenázu nebo jakoukoliv jinou složku přípravku. Nežádoucí reakce spojené s léčbou Po injekci a/nebo extenzi prstu se mohou objevit lokální nežádoucí reakce. Nejčastějšími reakcemi je lokální otok, tvorba modřin a bolest kolem oblasti vpichu na ošetřené ruce. Většina těchto reakcí ustoupí do dvou týdnů po injekci. Vznik těchto lokálních reakcí je očekávaný a nemusí nutně znamenat neúspěšný zákrok nebo trvalé poškození ruky. Vážné nežádoucí reakce spojené s léčbou Mohou se rovněž, ač zřídka, objevit vážné vedlejší účinky jako poškození šlachy, ruptura šlachy anebo poškození vazu. Možná rizika Po injekci přípravku XIAPEX se může objevit vážná alergická reakce, proto by měl být pacient před opuštěním zdravotnického zařízení pozorován po dobu 30 minut v zájmu sledování jakýchkoliv známek a symptomů vážné alergické reakce, tj. rozsáhlejší zčervenání nebo vyrážka, otok, zúžení hrdla anebo ztížené dýchání. Pacienti by měli být poučeni, aby při výskytu jakýchkoliv podobných známek a symptomů okamžitě kontaktovali lékaře. Rovněž existuje teoretické riziko zkřížené reaktivity s endogenními metaloproteinázami lidské matrix (MMPs) (včetně rozvoje muskuloskeletálního syndromu a rozvoje nebo exacerbace autoimunitních onemocnění). Doposud však nebyly pozorovány žádné klinické důkazy. Více informací o bezpečnosti najdete v poslední části brožury. Informace pro pacienta Příprava Postup při rekonstrukci postihujících MP klouby
9 Příprava Dávkování Určená dávka v jedné injekci představuje 0,58 mg přípravku XIAPEX. XIAPEX může být najednou aplikován pouze do jednoho pruhu. V případě potřeby terapie dalších pruhů je nutné zachovat mezi aplikacemi odstup 30 dní. XIAPEX musí být před použitím rekonstituován při zachování zásad asepse. Před rekonstitucí zkontrolujte exspiraci a ujistěte se, že je balení v době použitelnosti. Je důležité si uvědomit, že XIAPEX musí být rekonstituován s použitím různého množství diluentu v závislosti od toho, zdali se bude podávat do pruhu kontrahujícího MP nebo PIP kloub. Rekonstituce XIAPEX je dodáván ve skleněných lahvičkách na jedno použití, které obsahují 0,9 mg sterilního lyofilizovaného prášku na rekonstituci (obrázek 7). Každá lahvička přípravku XIAPEX musí být rekonstituována pomocí sterilního diluentu, který je součástí balení. Diluent obsahuje 2 mm chlorid vápenatý v 0,9 % roztoku chloridu sodného (0,03 % chloridu vápenatého v 0,9% roztoku chloridu sodného). Balení obsahující XIAPEX a diluent skladujte v lednici při teplotách od 2 C do 8 C. Před rekonstitucí vyjměte lahvičky z lednice a nechte je odstát při pokojové teplotě (20-25 C) alespoň 15 minut, ne však déle než 60 minut. Poté pokračujte rekonstitucí tak, jak je popsána na další straně (obrázek 8). Rekonstituovaný roztok přípravku XIAPEX musí být průhledný a čistý. Před injekcí roztok prohlédněte a všímejte si, jestli neobsahuje nerozpuštěné částečky a nejeví změny barvy. Pokud je roztok zakalený, NEPOUŽÍVEJTE HO. Rekonstituovaný XIAPEX můžete před upotřebením skladovat při pokojové teplotě (20-25 C) po dobu maximálně jedné hodiny anebo v lednici při teplotě od 2 C do 8 C po dobu až čtyř hodin. Po uskladnění v lednici musíte roztok před použitím nechat odstát při pokojové teplotě po dobu asi 15 minut. Obrázek 7. Lahvičky diluentu a přípravku XIAPEX Před rekonstitucí přípravku XIAPEX se ujistěte, že v místnosti, kde proběhne aplikace, je/jsou k dispozici: 2. pohotovostní medikace pro léčbu případných alergických reakcí (injekční souprava adrenalinu (1:1000 pro s.c. injekci) a antihistaminika) 1. dvě stříkačky se zatavenou jehlou délky 12,7 mm, velikosti 26 nebo 27 gauge a se stupnicí po 0,01 ml dílcích jedna stříkačka je potřebná na rekonstituci a druhá na samotnou injekci přípravku XIA- PEX 3. obvaz pro krytí prstu pacienta po injekci 4. výtisk této výukové brožury, která obsahuje pokyny k přípravě, injekci a provedení Příprava Postup při rekonstrukci postihujících MP klouby
10 Postup při rekonstrukci Obrázek 8. Postup při rekonstituci přípravku XIAPEX Znovu zkontrolujte pruh, do kterého má být proveden vpich, a vhodně tuto oblast označte, abyste se vyhnuli nepřesné aplikaci. Pruh kontrahující metakarpofalangeální kloub (MP) Do stříkačky natáhněte 0,39 ml diluentu. Pruh kontrahující MP kloub Do stříkačky natáhněte 0,25 ml roztoku. 0,39 ml pro MP kloub 0,31 ml pro PIP kloub Diluent pomalu vstříkněte do lahvičky s přípravkem XIAPEX. Znehodnoťte stříkačku a zbytek diluentu. Směs jemně promíchejte krouživými pohyby tak, aby se rozpustil všechen prášek. LAHVIČKU S ROZTOKEM NEPŘEVRACEJTE ANI NEPROTŘEPÁVEJTE. 0,25 ml pro MP kloub 0,20 ml pro PIP kloub Pruh kontrahující proximální interfalangeální kloub (PIP) Do stříkačky natáhněte 0,31 ml diluentu. Pruh kontrahující PIP kloub Do stříkačky natáhněte 0,20 ml roztoku. Všechny kroky rekonstituce přípravku XIAPEX provádějte podle zásad asepse, s použitím sterilního alkoholu a v souladu s aktuálním místním standardem péče. Před rekonstitucí přípravku XIAPEX zkontrolujte, že se balení nachází v době použitelnosti. Roztok aplikujte podle postupu uvedeného v této brožuře. Postup při rekonstrukci postihujících MP klouby
11 postihujících MP klouby VÝBĚR A PŘÍPRAVA MÍSTA VPICHU 1. KROK Objemy pro rekonstituci a aplikaci se liší v závislosti na tom, který kloub je kontrahován pruhem, jenž má být léčen. U pruhů kontrahujících MP klouby musí být na rekonstituci každé dávky použitých 0,39 ml diluentu. Objem, jenž má být injikován do pruhů kontrahujících MP klouby, představuje 0,25 ml. V případech, kdy je na stejném prstu postižen MP i PIP kloub, by měl být nejprve léčen pruh kontrahující MP kloub, neboť úspěšné rozvolnění MP pruhu může na léčeném prstu povolit i PIP kontrakturu. Těsně před podáním přípravku XIAPEX ošetřete kůži v místě aplikace antiseptickým přípravkem a nechte ji oschnout. Podání lokálního anestetika před injekcí přípravku XIAPEX se NEDOPORU- ČUJE, neboť může ovlivnit schopnost rozpoznání parestézie v případě zavedení jehly do nervu. Tabulka 1. Objem pro rekonstituci u léčby MP kloubu Rekonstituce přípravku XIAPEX s lahvičkou na jedno použití Léčený kloub Množství sterilního diluentu potřebného pro rekonstituci Objem, ve kterém bude podáno 0,58 mg přípravku XIAPEX MP kloub 0,39 ml 0,25 ml Postup aplikace Optimálním místem vpichu je bod, v němž je pruh nejdál od flexorové šlachy nacházející se pod ním. To je obvykle bod na pruhu, jakoby tětivě, nejvzdálenější od vrstev pod ním, jakoby rukověti luku. V místě vpichu nesmí pruh těsně naléhat na kůži (obrázek 9), což ulehčí správnou aplikaci a sníží riziko natržení kůže při provádění extenze prstu. Znovu zkontrolujte pruh, který má být ošetřen, a ujistěte se, že je oblast vhodně označena. Při výběru místa vpichu zvažte pravděpodobnou pozici jiných necílových struktur ruky, abyste minimalizovali riziko expozice šlach a vazů přípravkem XIAPEX. Doporučená místa vpichu pro léčbu pruhů kontrahujících MP klouby jsou vyobrazeny na obrázku 10. Obrázek 9. Výběr místa vpichu adherence kůže k pruhu u kontraktury MP kloubu palmo-digitální rýha místa adherence kůže do těchto míst neinjikovat distální palmární rýha Obrázek 10. Výběr místa vpichu kontraktury MP kloubů distální digitální rýha v tomto místě NEINJIKUJTE u kontraktur MP kloubů palmo-digitální rýha optimální oblast vpichu u kontraktur MP kloubů distální palmární rýha proximální palmární rýha postihujících MP klouby
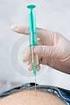
12 postihujících MP klouby VEDENÍ VPICHU 2. KROK Do druhé stříkačky natáhněte 0,25 ml rekonsti- tuovaného roztoku přípravku XIAPEX. Špičku jehly vpíchněte do daného pruhu a dbejte na to, aby jehla v pruhu zůstala (obrázek 11). Vhodné umístění jehly lze poznat podle zvýšené rezistence pruhu a zrnité konzistence. Vyvarujte se propíchnutí pruhu špičkou jehly, abyste minimalizovali možnost injekce přípravku XIAPEX do okolních tkání. Vpich nesmí být hlubší než 2-3 mm. Pokud jehla projde skrz pruh, nemusíte vždy ucítit změnu konzistence, a proto může být hloubka vpichu cenným vodítkem. Pokud vpich způsobí parestézii nebo je podezření, že se jehla nachází ve šlaše, jehlu povytáhněte a znovu zasuňte do pruhu. Pokud si nejste jist správným umístěním jehly, požádejte pacienta, aby pomalu a opatrně o několik stupňů flektoval a extendoval ošetřovaný prst v DIP a PIP kloubech. Pokud při tom zpozorujete pohyb jehly, je pravděpodobné, že se nachází ve šlaše, a je potřeba ji povytáhnout a znovu zasunout do jiného místa. Obrázek 11. Umístění injekce podkožní tuk hluboký tuk bezkonusová stříkačka s jehlou velikosti 26 nebo 27 gauge rekonstituovaný roztok přípravku XIAPEX kůže Dupuytrenův pruh šlacha flexoru metakarp postihujících MP klouby
13 postihujících MP klouby APLIKACE PŘÍPRAVKU XIAPEX 3. KROK Ujistěte se, že se jehla nachází v pruhu. Poté zatlačte na píst stříkačky a dbejte na to, aby špička jehly neprošla daným pruhem. Do prvního místa injikujte jednu třetinu celkové dávky. Pokud se jehla nachází ve správném místě, v průběhu aplikace ucítíte jemnou rezistenci. Povytáhněte jehlu směrem od pruhu, zatímco její špičku udržujete pod kůží, a přemístěte ji lehce distálně (přibližně 2-3 mm). Pokud jste si jist, že se špička jehly nachází v pruhu, injikujte do místa další třetinu dávky (obrázek 12). Znovu povytáhněte špičku jehly směrem od pruhu (její špičku udržujete pod kůží) a přemístěte ji proximálně od prvního místa aplikace (přibližně 2-3 mm). Ujistěte se, že se špička jehly nachází v pruhu a injikujte poslední třetinu dávky (obrázek 12). V případě, že se u pacienta vyskytuje komisurální pruh tvaru Y, který je vytvořen kombinací centrálního a natatorního pruhu, proveďte vpich nad bifurkací tohoto pruhu (obrázek 13). Nepoužitý roztok přípravku XIAPEX znehodnoťte. Neskladujte jej, nemíchejte s jiným roztokem ani ho dále nepoužívejte. Obrázek 12. Cílová místa injekce Obrázek 13. Místo injekce přípravku XIAPEX u pruhu tvaru Y injekce přípravku XIAPEX ve třech krocích počáteční, distální a proximální místo kůže podkožní tuk Dupuytrenův pruh hluboký tuk šlacha flexoru kůže podkožní tuk rekonstituovaný roztok přípravku XIAPEX Dupuytrenův pruh hluboký tuk šlachy flexorů proximální falanga metakarp postihujících MP klouby
14 VÝBĚR A PŘÍPRAVA MÍSTA VPICHU 1. KROK Objemy pro rekonstituci a aplikaci se liší v závislosti na tom, který kloub je kontrahován pruhem, jenž má být ošetřen. U pruhů kontrahujících PIP klouby musí být na rekonstituci každé dávky použitých 0,31 ml diluentu. Objem, jenž má být injikován do pruhů kontrahujících PIP klouby, představuje 0,20 ml. Při aplikaci přípravku XIAPEX do pruhů kontrahujících PIP klouby je potřeba zvýšené pozornosti a opatrnosti, neboť klinické studie poukazují na zvýšené riziko ruptur šlach a poškození vazů ve spojení s léčbou PIP kontraktur přípravkem XIAPEX. Postup aplikace Optimálním místem vpichu je bod, v němž je pruh nejdál od flexorové šlachy nacházející se pod ním. To je obvykle bod na pruhu, jakoby tětivě luku, nejvzdálenější od vrstev pod ním, jakoby rukověti luku. V místě vpichu nesmí pruh těsně naléhat na kůži (obrázek 14), což ulehčí správnou aplikaci a sníží riziko natržení kůže při provádění extenze prstu. Znovu zkontrolujte pruh, který má být léčen, a ujistěte se, že je oblast vhodně označena. Při výběru místa vpichu zvažte pravděpodobnou pozici jiných necílových struktur ruky, abyste minimalizovali riziko expozice šlach a vazů přípravkem XIAPEX. Doporučená místa vpichu pro léčbu pruhů kontrahujících PIP klouby jsou vyobrazeny na obrázku 15. V případech, kdy je na stejném prstu postižen MP i PIP kloub, by měl být nejprve léčen pruh kontrahující MP kloub, neboť úspěšné rozvolnění MP pruhu může na léčeném prstu povolit i PIP kontrakturu. Těsně před podáním přípravku XIAPEX ošetřete kůži v místě aplikace antiseptickým přípravkem a nechte ji oschnout. Podání lokálního anestetika před injekcí přípravku XIAPEX se NEDOPORU- ČUJE, neboť může ovlivnit schopnost rozpoznání parestézie v případě zavedení jehly do nervu. Při léčbě pruhu u PIP kloubu dbejte na to, aby se Obrázek 14. Výběr místa vpichu adherence kůže k pruhu u kontraktury PIP kloubu distální digitální rýha místa adherence kůže do těchto míst neinjikovat palmo-digitální rýha místo vpichu nacházelo tak blízko palmo-digitální rýze, jak je to jen možné ne dál než 4 mm distálně od této rýhy (obrázek 15). Pak vyberte bod na tětivě v maximální vzdálenosti od struktur pod pruhem. Toto je obzvlášť důležité u pruhů v blízkosti PIP kloubu na pátém prstu v zájmu snížení rizika poškození šlachy nebo vazů. Tabulka 2. Objem pro rekonstituci a aplikaci u léčby PIP kloubu Rekonstituce přípravku XIAPEX Léčený kloub Objem sterilního rozpouštědla potřebného pro rekonstituci Objem pro podání dávky 0,58 mg přípravku XIAPEX PIP kloub 0,31 ml 0,20 ml Obrázek 15. Výběr místa vpichu kontraktury PIP kloubů distální digitální rýha do tohoto místa NEINJIKUJTE místa vpichu u PIP kontraktur 4 mm oblast vpichu palmo-digitální rýha distální palmární rýha proximální palmární rýha DIP PIP MP
15 VEDENÍ VPICHU JEHLOU 2. KROK Do druhé stříkačky natáhněte 0,20 ml rekonstituovaného roztoku. Špičku jehly vpíchněte do daného pruhu a dbejte na to, aby jehla v pruhu zůstala (obrázek 16). Vhodné umístění jehly lze poznat podle zvýšené rezistence pruhu a zrnité konzistence. Vyvarujte se propíchnutí pruhu špičkou jehly, abyste minimali- zovali možnost injekce přípravku XIAPEX do okolních tkání. Vpich nesmí být hlubší než 2-3 mm. Pokud jehla projde skrz pruh, nemusíte vždy ucítit změnu konzistence, a proto může být hloubka vpichu cenným vodítkem. Pokud vpich způsobí parestézii nebo je podezření, že se jehla nachází ve šlaše, jehlu povytáhněte a znovu zasuňte do pruhu. Pokud si nejste jist správným umístěním jehly, požádejte pacienta, aby pomalu a opatrně o několik stupňů flektoval a extendoval ošetřovaný prst v DIP a PIP kloubech. Pokud při tom zpozorujete pohyb jehly, je pravděpodobné, že se nachází ve šlaše, a je potřeba ji povytáhnout a znovu zasunout do jiného místa. Obrázek 16. Umístění vpichu podkožní tuk hluboký tuk bezkonusová stříkačka s jehlou velikosti 26 nebo 27 gauge rekonstituovaný roztok přípravku XIAPEX kůže Dupuytrenův pruh šlacha flexoru metakarp
16 APLIKACE PŘÍPRAVKU XIAPEX 3. KROK Ujistěte se, že se jehla nachází v pruhu. Poté zatlačte na píst stříkačky a dbejte na to, aby špička jehly neprošla daným pruhem. Do prvního místa injikujte jednu třetinu celkové dávky. Pokud se jehla nachází ve správném místě, v průběhu aplikace ucítíte jemnou rezistenci. Povytáhněte jehlu směrem od pruhu, zatímco její špičku udržujete pod kůží, a přemístěte ji lehce distálně (přibližně 2-3 mm). Pokud jste si jist, že se špička jehly nachází v pruhu, injikujte do místa další třetinu dávky (obrázek 17). Znovu povytáhněte špičku jehly směrem od pruhu (její špičku udržujte pod kůží), a přemístěte ji proximálně od prvního místa aplikace (přibližně 2-3 mm). Ujistěte se, že se špička jehly nachází v pruhu, injikujte poslední třetinu dávky (obrázek 17). Obrázek 17. Cílová místa injekce injekce přípravku XIAPEX ve třech krocích počáteční, distální a proximální místo kůže podkožní tuk Dupuytrenův pruh hluboký tuk šlacha flexoru metakarp Nepoužitý roztok přípravku XIAPEX znehodnoťte. Neskladujte jej, nemíchejte s jiným roztokem ani ho dále nepoužívejte.
17 Po ukončení aplikace přípravku XIAPEX obvažte s použitím tlustého krytí ošetřenou ruku pacienta a instruujte ho, aby omezoval její pohyb a používání. Požádejte pacienta, aby se zdržel flexe a extenze prstů dané ruky, aby tak redukoval rozšíření přípravku XIAPEX z ošetřeného pruhu. Rovněž je potřeba pacienta upozornit, aby se sám nepokoušel přerušit injikovaný pruh a aby ruku po dobu jednoho dne od zákroku udržoval co nejvíce elevovanou. Po zákroku musí být pacient pozorován kvůli potenciálním nežádoucím účinkům včetně anafylaxe nebo systémové přecitlivělosti (viz symptomy zmíněné dále). Pokud je pacient stabilní a neprojevil žádné známky systémové přecitlivělosti nebo jiných systémových nežádoucích účinků, může po době observace (30 minut) opustit zdravotnické zařízení. Pacienta požádejte, aby se znovu dostavil následující den za účelem provedení procedury extenze prstu. Potenciální symptomy přecitlivělosti nebo blížící se anafylaxe: opakované kýchání generalizovaný erytém, pruritus, nebo parestézie lokalizovaný nebo generalizovaný angioedém potíže s dýcháním pocit tíhy na hrudníku nebo zúženého hrdla závratě synkopa
18 24 hodin po aplikaci injekce U některých pacientů může po aplikaci přípravku XIAPEX dojít ke spontánní ruptuře ošetřeného pruhu a to ještě před následnou návštěvou (po 24 hodinách). Pokud se tak nestalo, je potřeba provést extenzi prstu za účelem ruptury pruhu. Dle uvážení lékaře může být použita lokální anestezie. Síla, vyvíjená v průběhu extenze prstu, musí být konstantní a nepřerušovaná, až do intenzity dosahující prahu bolesti pacienta. Vyhněte se přímému tlaku na místo vpichu, poněvadž může být ještě citlivé (obrázky 18 a 19). Prsty udržujte v extenzi po dobu přibližně sekund. U pacientů s adhezí kůže k ošetřenému pruhu může v průběhu extenze prstu dojít kromě ruptury pruhu zároveň i k natržení kůže. Pokud se v ní objeví trhlinky, ošetřete vzniklé rány standardním postupem. Pokud se nezdaří ruptura pruhu po první extenzi, můžete provést druhou a třetí extenzi v 5-10 minutových intervalech dle potřeby. V průběhu jedné následné návštěvy neprovádějte více než tři extenze prstu. Při manipulaci s PIP kloubem udržujte MP kloub ve flexi, abyste omezili vliv tažných sil pouze na pruh postihující PIP kloub. Obrázek 18. První extenze prstu Obrázek 19. Druhá extenze prstu
19 V případě, že nedošlo k ruptuře pruhu po třech extenzích, naplánujte další ambulantní návštěvu přibližně o 4 týdny později. Pokud pruh způsobující kontrakturu zůstává intaktní, může pacient podstoupit další léčebný cyklus přípravkem XIAPEX až do maximálního celkového počtu tří cyklů (obrázek 20). Následné sledování po prvním dni Po extenzi prstu se doporučuje nasazení fixační dlahy, poněvadž v programu klinického vývoje byla pacientům dlaha poskytnuta na použití v noci po dobu až 4 měsíců. Taktéž poučte pacienta, aby vykonával flekční a extenzní cvičení ošetřeného prstu i doma. Doporučte mu návrat k jeho běžným denním aktivitám. Pacient by se měl vyhýbat namáhavým činnostem, až dokud mu nedoporučíte jinak. V souladu s místními léčebnými standardy je potřeba zabezpečit běžnou analgezii a péči o ránu, modřiny a otoky. Obrázek 20. Opakování léčebných cyklů 1. den injekce přípravku XIAPEX Následující den extenze prstu Po 30 dnech následná návštěva V případě potřeby cyklus zopakujte až 3 injekce do jednoho pruhu
20 informace o bezpečnosti XIAPEX (kolagenáza clostridium histolyticum) je indikován pro léčbu Dupuytrenovy kontraktury u dospělých pacientů s hmatatelným pruhem. Důsledně se řiďte popsanými postupy podání injekce, abyste snížil riziko ruptury šlachy nebo poškození vazů. Těhotenství Pacientky by měli být upozorněny, že použití přípravku XIAPEX v těhotenství se nedoporučuje a léčba by měla být odložena na období po těhotenství. Upozornění a speciální opatření Riziko alergické reakce XIAPEX je kontraindikován u pacientů s předchozí přecitlivělostí na kolagenázu nebo jakoukoliv jinou složku přípravku. Lékař musí být připraven na jakékoliv potenciální alergické reakce, jež se mohou objevit záhy po podání injekce a musí být dostupná vhodná medikace pro případ systémové alergické reakce. Po podání přípravku XIAPEX může být pacient propuštěn pouze tehdy, nejeví-li žádné známky systémové přecitlivělosti nebo anafylaxe. Speciální opatření při podávání injekce Je třeba dbát speciální opatrnosti a jistoty, že XIAPEX injikujete do patologického pruhu způsobujícího kontrakturu a nikoliv do okolních tkání. Podání do jakýchkoliv struktur obsahujících kolagen může vést k poškození, které může být i trvalé, jako například ruptura šlachy nebo poškození vazů. Pokud máte podezření na poškození šlachy nebo vazů, založte pacientovi fixační dlahu a zařiďte následné sledování a péči vhodným chirurgickým specialistou. Použití u pacientů s poruchou srážení krve Použití přípravku XIAPEX u pacientů, kteří užili antikoagulancia (s výjimkou kyseliny acetylsalicylové v denní dávce do 150 mg) v průběhu 7 dní před aplikací injekce přípravku XIAPEX, nebylo prozkoumáno, a proto není doporučeno. S opatrností používejte XIAPEX u pacientů se známou poruchou koagulace. Interakce s jinými přípravky a jiné formy interakce Použití přípravku XIAPEX se nedoporučuje u pacientů, kteří užili tetracyklinové antibiotika v průběhu 14 dní před injekcí. Ačkoliv v klinickém programu přípravku XIAPEX nebyl se současným užíváním fluorochinolonových antibiotik spojen žádný případ ruptury/poškození šlachy, fluorochinolonová antibiotika jsou spojena s rizikem poškození šlach včetně tendinitidy a ruptury šlachy. Dbejte proto zvýšené opatrnosti při podávání přípravku XIAPEX u pacientů současně užívajících fluorochinolonová antibiotika. Nežádoucí reakce V klinickém programu přípravku XIAPEX (n=1082) pozorovali téměř všichni pacienti nežádoucí reakce spojené s podáním přípravku XIAPEX a/nebo s procedurou extenze prstu. Většina těchto nežádoucích reakcí byly lokální reakce mírné až střední závažnosti, které vymizely do dvou týdnů po podání injekce. Mezi nejčastěji uváděné nežádoucí příhody patřil periferní edém (omezený na léčenou končetinu), kontuze, bolest v místě vpichu, bolest v končetině a krvácení v místě vpichu (spíše ve formě tvorby modřin než prostého krvácení). Někteří pacienti hlásili kožní léze (natržení adherentní kůže nad ošetřovaným pruhem), které vznikly v průběhu extenze prstu. Dbejte proto zvýšené opatrnosti u Dupuytrenových pruhů adherujících ke kůži, neboť je u nich vyšší riziko kožních lézí jako důsledku farmakologického účinku přípravku a procedury extenze prstu na kůži nad daným pruhem.
21 informace o bezpečnosti V tabulce 3 jsou shrnuty nežádoucí reakce, jež se objevily u > 5 % pacientů v klinickém programu přípravku XIAPEX. Tabulka 3. Nežádoucí reakce 5 Nežádoucí reakce Periferní edém Kontuze Bolest v místě vpichu Bolest v končetině Krvácení v místě vpichu Citlivost Otok v místě vpichu Ekchymóza Pruritus Kožní léze Lymfadenopatie Krvavý puchýř Bolest v axile Pruritus v místě vpichu Hematom XIAPEX (n=1082) 76,7 % 54,2 % 40,6 % 35,8 % 34,0 % 28,5 % 24,5 % 17,9 % 12,5 % 10,9 % 10,9 % 9,0 % 6,7 % 5,3 % 5,2 % Podání cizích proteinů do lidských tkání podle očekávání vyvolá protilátkovou odpověď. V klinickém programu měla většina pacientů měsíc po první injekci přípravku XIAPEX detekovatelné protilátky proti AUX-I i AUX-II. Po čtvrté injekci přípravku XIAPEX byli na protilátky proti AUX-I i AUX-II séropozitivní všichni pacienti. Nebyla pozorována žádná zjevná korelace mezi tvorbou protilátek a klinickou odpovědí nebo nežádoucí reakcí. Existuje teoretické riziko reakce mezi protilátkami proti přípravku XIAPEX a metaloproteinázami lidské matrix. V klinickém programu však nebyly pozorovány nežádoucí reakce poukazující na rozvoj nebo exacerbaci autoimunitních onemocnění nebo rozvoj muskuloskeletálního syndromu (MSS). Pokud by se měl vyvinout, MSS by se objevil postupně, přičemž je charakterizován jednou nebo více následujícími známkami nebo symptomy: artralgie, myalgie, tuhost kloubů, tuhost šíje, edém rukou, palmární fibróza a ztluštění nebo tvorba uzlíků ve šlachách. Vážné nežádoucí reakce Většina vážných nežádoucích reakcí hlášena od pacientů léčených přípravkem XIAPEX se omezovala pouze na ošetřenou ruku. Reakce zahrnovaly tři případy ruptury šlachy a jeden případ ruptury šlachového poutka. Všechny tyto případy se objevily u kontraktur v úrovni PIP kloubu pátého prstu. Rovněž byl hlášen jeden případ tendinitidy. Dále se objevil jeden komplexní regionální bolestivý syndrom a jedna senzorická abnormalita ošetřené ruky. Tyto vážné nežádoucí reakce se v klinickém programu objevily s frekvencí 1/1000 a 1/100. Hlášení nežádoucích účinků Jakékoliv nežádoucí reakce s možností asociace s podáním přípravku XIAPEX musí být okamžitě zdokumentovány a nahlášeny. Pro více informací o hlášení nežádoucích reakcí prosím kontaktujte místní zastoupení společnosti Pfizer nebo svého obchodního zástupce.. Podezření na závažné nebo neočekávané nežádoucí účinky hlaste, prosím, Státnímu ústavu pro kontrolu léčiv ( popřípadě oddělení farmakovigilance společnosti Pfizer: Mgr. Jana Vinšová tel.: , fax: Při hlášení podezření na nežádoucí účinek, prosím, poskytněte všechny dostupné informace, včetně anamnézy, souběžně užívané medikace, data vzniku nežádoucího účinku a zahájení léčby. Další informace V případě potřeby dalších informací kontaktujte oddělení Medicínských informací společnosti Pfizer: Mgr. Vladimíra Sochová medicalinfo.cz@pfizer.com, tel.:
22
23 Zkrácená informace o přípravku Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem. Léčivá látka: Kolagenáza Clostridium histolyticum 0,9 mg. Indikace: Léčba Dupuytrenovy kontraktury u dospělých pacientů s hmatným vazivovým pruhem kontraktury. Dávkování: 0,58 mg na injekci do hmatného vazivového pruhu Dupuytrenovy kontraktury. Objem rekonstituovaného přípravku Xiapex, který má být podán do vazivového pruhu Dupuytrenovy kontraktury, se liší v závislosti na kloubu, který má být léčen. Přibližně 24 hodin po injekci může být podle potřeby prováděna extenze prstu, která usnadní uvolnění kontraktury. Xiapex musí podávat lékař, který byl řádně vyškolen ve správném způsobu podání přípravku a se zkušenostmi v diagnostice a vedení léčby Dupuytrenovy kontraktury. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku. Zvláštní upozornění: Xiapex smí být aplikován pouze do Dupuytrenovy kontraktury. Xiapex rozkládá kolagen, musí se tedy dbát zvýšené opatrnosti, aby se injekce nepodala do šlach, nervů, krevních cév nebo jiných struktur ruky obsahujících kolagen. Injekce přípravku Xiapex do struktur obsahujících kolagen může vést k poškození těchto struktur a možnému trvalému zranění, jako je například ruptura šlachy nebo porušení ligamenta. Xiapex je nutné používat s opatrností u pacientů s koagulačními poruchami nebo pacientů, kteří užívají antikoagulancia. Podobně jako u všech nehumánních proteinových léčivých přípravků může u pacientů dojít k tvorbě protilátek proti léčebnému proteinu. U pacientů s Dupuytrenovou kontrakturou, která přiléhá ke kůži, může být zvýšené riziko vzniku kožních lézí v důsledku farmakologického účinku přípravku Xiapex a extenze prstu na kůži ležící nad léčenou kontrakturou. Interakce: Použití přípravku Xiapex se nedoporučuje u pacientů, kterým byla v průběhu 14 dnů před podáním injekce přípravku Xiapex podávána tetracyklinová antibiotika (např. doxycyklin). Těhotenství a kojení: Použití přípravku Xiapex v těhotenství se nedoporučuje. Nežádoucí účinky: Velmi časté: lokální reakce v místě injekce (periferní edém - omezený na místo injekce, kontuze, krvácení a bolesti v místě injekce, svědění, ekchymózy, bolest končetin; Časté: bolesti lymfatických uzlin, krvavé puchýře, puchýře, vyrážka, axilární bolesti, reakce v místě injekce (zánět, otok, erytém, svědění, pocit tepla), puchýřky, lacerace kůže, artralgie, otok kloubu, myalgie. Předávkování: Očekává se, že bude spojeno s vyšším výskytem lokálních účinků v místě injekce. Uchovávání: Uchovávejte v chladničce (2-8 C). Balení: obsahuje jednu injekční lahvičku s práškem (0,58mg) a jednu injekční lahvičku s rozpouštědlem (3 ml). Jméno a adresa držitele rozhodnutí o registraci: Pfizer Limited, Ramsgate Road, Sandwich, Kent, CT13 9NJ, Velká Británie. Datum poslední revize textu: Registrační číslo: EU/1/11/671/001. Výdej léčivého přípravku je vázán na lékařský předpis. Přípravek není hrazen z prostředků veřejného zdravotního pojištění. Před předepsáním se prosím seznamte s úplnou informací o přípravku. REFERENCE: 1. Rayan G. Hand Clinics (1999) 15(1): Hughes TB. et al. J Am Soc Surg Hand (2003) 3(1): Townley et al. BMJ (2006) 332; McGrouther DA, The Hand (1982) 14(3): FDA submission dossier. Auxilium Pharmaceuticals SPC a PIL přípravku XIAPEX. Pfizer, spol. s r.o., Stroupežnického 17, Praha 5 tel.: , fax: ,
24 Pfizer spol. s r.o., Stroupežnického 17, Praha 5 tel.: , fax: , XIA
Edukační materiály. Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI
 Edukační materiály Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme
Edukační materiály Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme
Edukační materiály. Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI
 Edukační materiály Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI ŠKOLICÍ BROŽURA K INJEKCI DUPUYTRENOVA KONTRAKTURA NÁSLEDUJÍCÍ ŠKOLICÍ BROŽURA JE NAVRŽENA TAK, ABY ZAJISTILA VHODNOU
Edukační materiály Xiapex Kolagenáza clostridium histolyticum ŠKOLICÍ BROŽURA K INJEKCI ŠKOLICÍ BROŽURA K INJEKCI DUPUYTRENOVA KONTRAKTURA NÁSLEDUJÍCÍ ŠKOLICÍ BROŽURA JE NAVRŽENA TAK, ABY ZAJISTILA VHODNOU
Přednáška Klinická kineziologie II Kinetika kloubů ruky
 Přednáška Klinická kineziologie II 25. 3. 2013 Kinetika kloubů ruky - pohyblivost ruky patří z největší části do oblasti jemné motoriky = větší roli zde hraje pohybová koordinace, než svalová síla - pro
Přednáška Klinická kineziologie II 25. 3. 2013 Kinetika kloubů ruky - pohyblivost ruky patří z největší části do oblasti jemné motoriky = větší roli zde hraje pohybová koordinace, než svalová síla - pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s práškem obsahuje 0,9 mg
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s práškem obsahuje 0,9 mg
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
ČESKÁ SPOLEČNOST CHIRURGIE RUKY ČLS JEP. Kurzy chirurgie ruky TÉMA: TRAUMATOLOGIE II.
 ČESKÁ SPOLEČNOST CHIRURGIE RUKY ČLS JEP Kurzy chirurgie ruky 2018-2020 TÉMA: TRAUMATOLOGIE II. 20. - 21. ZÁŘÍ 2019 Cyklus 2, Kurz 4 Kurzy chirurgie ruky, cyklus 2, 2018-2020 Kurz 2.4: TRAUMATOLOGIE II.
ČESKÁ SPOLEČNOST CHIRURGIE RUKY ČLS JEP Kurzy chirurgie ruky 2018-2020 TÉMA: TRAUMATOLOGIE II. 20. - 21. ZÁŘÍ 2019 Cyklus 2, Kurz 4 Kurzy chirurgie ruky, cyklus 2, 2018-2020 Kurz 2.4: TRAUMATOLOGIE II.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Souhrn údajů o přípravku
 sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Souhrn údajů o přípravku
 Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
3. LÉKOVÁ FORMA Injekční suspenze vpředplněné injekční stříkačce; bezbarvá průhledná tekutina, v jednodávkových inj. stříkačkách (sklo, typu I).
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná)
 Příloha č. 1 ke sdělení sp. zn. sukls205477/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná)
Příloha č. 1 ke sdělení sp. zn. sukls205477/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná)
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. APIGUARD gel (25% Thymolum) pro podání ve včelím úlu
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls158765/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě
Příbalová informace: informace pro uživatele. Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem kolagenáza Clostridium histolyticum
 Příbalová informace: informace pro uživatele Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem kolagenáza Clostridium histolyticum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Xiapex 0,9 mg prášek pro přípravu injekčního roztoku s rozpouštědlem kolagenáza Clostridium histolyticum Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) letrozolu byly přijaty
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TETAVAX Injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TETAVAX Injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
For Internal Use Only
 Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls59573/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná)
1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Příbalová informace: informace pro uživatele. Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas
 Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
RÁDCE PACIENTA. Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu
 RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
Příbalová informace: Informace pro uživatele. NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele. NovoThirteen IU prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro pacienta. Belkyra 10 mg/ml injekční roztok. acidum deoxycholicum
 Sp.zn.sukls140937/2015 Příbalová informace: informace pro pacienta Belkyra 10 mg/ml injekční roztok acidum deoxycholicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls140937/2015 Příbalová informace: informace pro pacienta Belkyra 10 mg/ml injekční roztok acidum deoxycholicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pediatrická populace 1/5. sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU
 sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn. sukls316718/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TETAVAX, injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
ENCEPUR PRO DOSPĚLÉ Virus encephalitidis inactivatum purificatum (K 23) Injekční suspenze
 Příbalová informace - Rp Informace pro použití, čtěte pozorně! ENCEPUR PRO DOSPĚLÉ Virus encephalitidis inactivatum purificatum (K 23) Injekční suspenze Držitel rozhodnutí o registraci a výrobce Novartis
Příbalová informace - Rp Informace pro použití, čtěte pozorně! ENCEPUR PRO DOSPĚLÉ Virus encephalitidis inactivatum purificatum (K 23) Injekční suspenze Držitel rozhodnutí o registraci a výrobce Novartis
BELOTERO Intense. Složení Síťovaný hyaluronát sodný: Fosfátový pufr o ph 7 q.s.:
 BELOTERO Intense Popis Přípravek BELOTERO Intense je sterilní, nepyrogenní, viskoelastický, bezbarvý, průhledný gel ze síťovaného hyaluronátu sodného neživočišného původu ve fyziologickém fosfátovém pufru.
BELOTERO Intense Popis Přípravek BELOTERO Intense je sterilní, nepyrogenní, viskoelastický, bezbarvý, průhledný gel ze síťovaného hyaluronátu sodného neživočišného původu ve fyziologickém fosfátovém pufru.
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příbalová informace: informace pro uživatele. FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum
 Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Nobivac L4, injekční suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka (1 ml) obsahuje: Léčivé látky: Inaktivované
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Nobivac L4, injekční suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka (1 ml) obsahuje: Léčivé látky: Inaktivované
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Act-HIB Vaccine, prášek pro přípravu inj. roztoku s rozpouštědlem Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Act-HIB Vaccine, prášek pro přípravu inj. roztoku s rozpouštědlem Vakcína proti Haemophilus influenzae b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka:
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
MEDICI-H IMP s.r.o., Gerstnerova 5, 170 00 Praha 7, tel.: +420 233 370 630, fax: +420 233 373 556 e-mail: medici-h@medici-h.cz, www.medici-h.
 V období od 30. 8. 2013 do 31. 10. 2013 bylo ve stájích Scuderie Gerardi nacházejících se ve čtvrti Petraia, Potenza (PZ) ošetřováno 7 koní v plné závodní síle a používaných pro překážkové dostihy a parkurové
V období od 30. 8. 2013 do 31. 10. 2013 bylo ve stájích Scuderie Gerardi nacházejících se ve čtvrti Petraia, Potenza (PZ) ošetřováno 7 koní v plné závodní síle a používaných pro překážkové dostihy a parkurové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
NEREGISTROVANÝ PŘÍPRAVEK použití povoleno v rámci specifického léčebného programu SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae type b polysaccharide
 sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
Příbalová informace: informace pro uživatele
 sp.zn.sukls44515/2015 Příbalová informace: informace pro uživatele TETAVAX Injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) Tetani anatoxinum Přečtěte si pozorně celou
sp.zn.sukls44515/2015 Příbalová informace: informace pro uživatele TETAVAX Injekční suspenze v předplněné injekční stříkačce Vakcína proti tetanu (adsorbovaná) Tetani anatoxinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Belohair 5% kožní roztok minoxidilum
 sp.zn. sukls252758/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Belohair 5% kožní roztok minoxidilum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls252758/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Belohair 5% kožní roztok minoxidilum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání
 Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
