Příbalová informace: informace pro uživatele
|
|
|
- Pavel Němec
- před 8 lety
- Počet zobrazení:
Transkript
1 Příbalová informace: informace pro uživatele Zinbryta 150 mg injekční roztok v předplněné injekční stříkačce Zinbryta 150 mg injekční roztok v předplněném peru daclizumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4. Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. Kromě této příbalové informace obdržíte od svého lékaře i Kartu pacienta. Karta pacienta obsahuje důležité bezpečností informace, které potřebujete znát před zahájením léčby přípravkem Zinbryta a během této léčby. Ponechte si příbalovou informaci a Kartu pacienta pro případ, že si je budete potřebovat přečíst znovu. Ponechte si příbalovou informaci a Kartu pacienta u sebe po celou dobu léčby a dále ještě 4 měsíce po poslední dávce přípravku Zinbryta, protože nežádoucí účinky se mohou vyskytnout i po ukončení léčby. Máte-li jakékoli další otázky, zeptejte se svého lékaře. Tento přípravek byl předepsán výhradně Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné známky onemocnění jako Vy. Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci 1. Co je přípravek Zinbryta a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete přípravek Zinbryta používat 3. Jak se přípravek Zinbryta používá 4. Možné nežádoucí účinky 5. Jak přípravek Zinbryta uchovávat 6. Obsah balení a další informace 7. Návod na injekční podání přípravku Zinbryta 1. Co je přípravek Zinbryta a k čemu se používá Léčivou látkou v přípravku Zinbryta je daklizumab. Jedná se o druh přípravku nazývaný monoklonální protilátka. K čemu se přípravek Zinbryta používá Přípravek Zinbryta se používá k léčbě relabujících (opětovně se vracejících) forem roztroušené sklerózy (RS) u dospělých. Při RS imunitní systém způsobuje zánět, který poškozuje ochrannou vrstvu (nazývanou myelin) obklopující nervy centrálního nervového systému (včetně mozku a míchy). Ztráta myelinu se nazývá demyelinizace. To má za následek, že nervy přestanou správně pracovat. Pacienti s relabující formou RS mají opakované ataky (relapsy) příznaků postižení nervového systému, které jsou způsobeny tím, že nervy nepracují správně. Tyto příznaky se u jednotlivých pacientů liší, ale obvykle zahrnují potíže při chůzi, problémy se zrakem či udržením rovnováhy. 1
2 Příznaky mohou po odeznění relapsu zcela vymizet, ale postupem času může dojít k tomu, že některé problémy přetrvávají i mezi jednotlivými relapsy a mohou zasahovat do každodenních činností. Jak přípravek Zinbryta působí Přípravek Zinbryta působí tak, že zabraňuje imunitnímu systému, aby poškozoval mozek a míchu. To může pomoci snížit počet relapsů, které máte, a zpomalit invalidizující účinky RS. Přestože léčba přípravkem Zinbryta RS nevyléčí, může zabránit zhoršování Vašeho stavu. 2. Čemu musíte věnovat pozornost, než začnete přípravek Zinbryta používat Nepoužívejte přípravek Zinbryta - jestliže jste v minulosti měl(a) závažnou alergickou reakci na daklizumab, nebo na kteroukoliv další složku tohoto přípravku, uvedenou v bodě 6. Upozornění a opatření Než začnete přípravek Zinbryta používat, obraťte se na svého lékaře: - Jestliže jste někdy měl(a) problémy s játry. Přípravek Zinbryta může způsobit závažné poruchy funkce jater, proto Váš lékař musí rozhodnout, zda je pro Vás přípravek Zinbryta vhodný. - Jestliže máte nebo jste v minulosti měl(a) depresi. - Jestliže máte závažnou infekci, jako je například zápal plic. - Jestliže jste někdy měl(a) tuberkulózu (nazývanou též TBC) nebo žijete v oblasti, kde jsou infekce TBC časté, může být riziko TBC u Vás vyšší. Před zahájením léčby přípravkem Zinbryta můžete být testován(a) na TBC a během léčby budete monitorován(a). Možné poruchy funkce jater Přípravek Zinbryta může způsobit závažné poruchy funkce jater. Přestože jste v minulosti neměl(a) žádné problémy s játry, Váš lékař Vám odebere vzorek krve, aby vyšetřil funkci jater. Bude nutné provést: - krevní testy před zahájením léčby, - měsíčně krevní testy během léčby, - krevní testy po dobu 4 měsíců po ukončení léčby. Nežádoucí účinky se mohou projevit i po ukončení léčby přípravkem Zinbryta (viz Závažné nežádoucí účinky uvedené v době 4). Je velice důležité, abyste pravidelně podstupoval(a) krevní testy. Obdržíte Kartu pacienta, kde naleznete další informace o tom, na co si máte během používání přípravku Zinbryta dávat pozor. Tuto kartu noste během léčby a čtyři měsíce po ukončení léčby při sobě. V případě jakékoliv léčby, i když se nebude jednat o léčbu roztroušené sklerózy, ukažte Kartu pacienta lékaři, lékárníkovi nebo zdravotní sestře. Pokud se u Vás objeví kterýkoliv z následujících příznaků, okamžitě kontaktujte svého lékaře: pocit na zvracení neznámého původu (nevolnost), zvracení, bolest břicha, zvýšená únava, ztráta chuti k jídlu, zežloutnutí kůže nebo očního bělma, 2
3 tmavé (čajové) zabarvení moči. Tyto příznaky mohou naznačovat problémy s játry. Jestliže se u Vás vyskytnou problémy s játry, Váš neurolog může léčbu přípravkem Zinbryta přerušit a odeslat Vás k hepatologovi (specialistovi na játra) (viz bod 4. Možné nežádoucí účinky). Děti a dospívající Přípravek Zinbryta není určen k použití u dětí a dospívajících mladších 18 let. Bezpečnost a účinnost přípravku Zinbryta nejsou v této věkové skupině známy. Starší populace Přípravek Zinbryta byl na pacientech starších 55 let testován pouze v omezené míře. Pokud je Vám více než 55 let, lékař Vám přesto může přípravek Zinbryta předepsat. Další léčivé přípravky a přípravek Zinbryta Informujte svého lékaře o všech lécích, vitamínech či rostlinných přípravcích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Očkování Jestliže se potřebujete nechat očkovat, zeptejte se nejdříve svého lékaře, protože přípravek Zinbryta může mít vliv na účinek očkovací látky. U pacientů léčených přípravkem Zinbryta nebylo prokázáno snížení účinnosti vakcíny proti sezónní chřipce (neaktivní vakcína). Účinek přípravku Zinbryta na jiné vakcíny (živé vakcíny) však není znám. Těhotenství a kojení Jelikož údaje o podávání přípravku Zinbryta těhotným ženám jsou omezené, je nutno zvážit přínosy léčby pro matku a riziko pro dítě. Jestliže jste těhotná nebo kojíte, domníváte se, že můžete být těhotná, nebo plánujete otěhotnět, poraďte se se svým lékařem dříve, než začnete tento přípravek používat. Není známo, zda se přípravek Zinbryta vylučuje do mateřského mléka. Lékař Vám poradí, jak se rozhodnout, zda máte ukončit kojení či léčbu přípravkem Zinbryta. Řízení dopravních prostředků a obsluha strojů Nepředpokládá se, že přípravek Zinbryta ovlivňuje schopnost řídit a obsluhovat stroje. Lékař Vám sdělí, zda Vám Vaše onemocnění umožňuje bezpečně řídit vozidla a obsluhovat stroje. Přípravek Zinbryta obsahuje malé množství sodíku Jedna dávka přípravku Zinbryda obsahuje 0,14 mmol sodíku. To znamená, že v podstatě je bez sodíku a přípravek tudíž mohou používat i pacienti na dietě s nízkým obahem sodíku. 3. Jak se přípravek Zinbryta používá Přípravek Zinbryta Vám předepíše lékař, který má zkušenosti s léčbou RS. Vždy používejte tento přípravek přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), poraďte se se svým lékařem. Doporučená dávka Dávka přípravku Zinbryta je 150 mg jednou za měsíc. Snažte se podávat si injekci přípravku Zinbryta každý měsíc ve stejný den, abyste si datum podání injekce snadno zapamatoval(a). Podávejte si injekci například první pondělí každého měsíce. Každý měsíc budete muset rovněž podstoupit krevní testy za účelem kontroly funkce jater. Je velice důležité, abyste tento test nevynechal(a). Zkuste si datum odběru krve pro každý měsíc pevně stanovit. Jestliže se domníváte, že jste krevní odběr vynechal(a), kontaktujte svého lékaře. 3
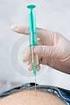
4 Podávání injekce pacientem Přípravek Zinbryta se podává injekčně pod kůži (subkutánní injekce) do stehna, břicha či zadní strany paže. Podrobné pokyny o podání injekce přípravku Zinbryta jsou uvedeny v bodě 7. Návod na injekční podání přípravku Zinbryta. Lékař nebo zdravotní sestra Vás mají náležitě zacvičit, abyste si injekci přípravku Zinbryta mohl(a) podávat sám(sama). Přečtěte si a dodržujte pokyny uvedené v návodu v bodě 7. Návod na injekční podání přípravku Zinbryta. Máte-li se zacházením s injekční stříkačkou/perem problémy, obraťte se svého lékaře nebo zdravotní sestru, kteří Vám s podáním injekce pomohou. Jak dlouho používat přípravek Zinbryta Lékař Vám sdělí, jak dlouho budete muset přípravek Zinbryta používat. Pokud Vás o to lékař nepožádá, neprovádějte žádné změny. Pokud Vám lékař sdělil, abyste přípravek Zinbryta přestal(a) používat, nezačínejte ho používat znovu, dokud Vám k tomu lékař nedá pokyn. Jestliže jste použil(a) více přípravku Zinbryta, než jste měl(a) Jestliže jste si podal(a) více injekcí, než je obvyklá dávka, a zaznamenal(a) jste jakékoliv nežádoucí účinky nebo máte obavy, obraťte se na svého lékaře nebo zdravotní sestru. Jsou známy případy, kdy byla pacientům podána dvojnásobná dávka přípravku Zinbryta oproti doporučené dávce a nebyly zaznamenány žádné mimořádné závažné nežádoucí účinky. Jestliže jste zapomněl(a) použít přípravek Zinbryta Přípravek Zinbryta se podává injekčně jednou za měsíc. Snažte se podávat si injekci přípravku Zinbryta každý měsíc ve stejný den, abyste si datum podání injekce snadno zapamatoval(a). Jestliže jste si zapomněl(a) dávku podat a od data plánovaného podání injekce neuplynuly ještě více než 2 týdny, podejte si injekci co nejdříve, jak to bude možné. Potom pokračujte jako obvykle a dodržujte zvolený den pro podávání injekce. Pokud od vynechání dávky (od data plánovaného podání injekce) uplynuly více než 2 týdny, zapomenutou dávku vynechejte úplně a další dávku si podejte v obvyklý den. V žádném případě nepoužijte dvě injekce najednou, abyste nahradil(a) vynechanou dávku. 4. Možné nežádoucí účinky Podobně jako všechny léky může mít i tento přípravek nežádoucí účinky, které se ale nemusí vyskytnout u každého. Nesnažte se tyto nežádoucí účinky léčit sám(sama), ale obraťte se na svého lékaře nebo zdravotní sestru. V případě výskytu některých nežádoucích účinků může Váš lékař léčbu přerušit a odeslat Vás ke specialistovi. Závažné nežádoucí účinky: Porucha funkce jater: (časté mohou postihnout až 1 z 10 lidí) pocit na zvracení neznámého původu (nevolnost), zvracení, 4
5 bolest břicha, zvýšená únava, ztráta chuti k jídlu (anorexie), zežloutnutí kůže nebo očního bělma, tmavé (čajové) zabarvení moči. Ihned kontaktujte svého lékaře. Může se jednat o příznaky závažné poruchy funkce jater. Více informací o těchto nežádoucích účincích naleznete v Kartě pacienta. Kožní reakce: (časté mohou postihnout až 1 z 10 lidí) závažná rozsáhlá vyrážka. Deprese: (méně časté mohou postihnout až 1 ze 100 lidí) pocit neobvyklého smutku, beznaděje či negativní pocity vůči sobě samému, podrážděnost, lehké rozrušení, nervozita, úzkost, sebevražedné myšlenky či myšlenky na sebepoškození. Plicní infekce: (časté mohou postihnout až 1 z 10 lidí) plicní infekce (např. zápal plic, zánět průdušek) Zánět zažívacího ústrojí (kolitida): (méně časté mohou postihnout až 1 ze 100 lidí) přetrvávající průjem, bolest břicha, horečka, krev ve stolici. Bolest břicha může být rovněž příznakem poruchy funkce jater, viz bod výše Porucha funkce jater. Nízká hladina určitého typu bílých krvinek (nazývaných lymfocyty): Přípravek Zinbryta Vám může snížit hladinu těchto bílých krvinek, proto budete každé 3 měsíce absolvovat krevní testy. Pokud se u Vás vyskytne kterýkoli ze závažných nežádoucích účinků, ihned kontaktujte svého lékaře. Ostatní nežádoucí účinky: Velmi časté nežádoucí účinky (mohou postihnout více než 1 z 10 lidí) infekce dýchacích cest, např. kašel či nachlazení (zánět sliznice nosohltanu, infekce horních cest dýchacích). Časté nežádoucí účinky (mohou postihnout až 1 z 10 lidí) chřipka, bolest v krku, zánět mandlí (zánět hltanu, zánět hrtanu), rýma, 5
6 kožní vyrážka včetně zanícení, podráždění, svědění, odlupování či suchosti pokožky (dermatitida, ekzém, lupénka), kožní infekce (folikulitida-zánět vlasového míšku, akné), snížení počtu bílých krvinek (prokáže se při krevních testech), zvýšení tělesné teploty (horečka), zvýšení hladiny jaterních enzymů v krvi (prokáže se při krevních testech), zanícení či zvětšení lymfatických uzlin (lymfadenopatie, lymfadenitida-zánět mízních uzlin), průjem, změny v krvi (anémie), které mohou způsobit únavu či bledost. Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nesnažte se nežádoucí účinky léčit sám(sama). Nežádoucí účinky můžete hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku. 5. Jak přípravek Zinbryta uchovávat Uchovávejte tento přípravek mimo dohled a dosah dětí. Nepoužívejte tento přípravek po uplynutí doby použitelnosti, uvedené na krabičce a štítku za "EXP". Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Uchovávejte předplněnou injekční stříkačku/pero přípravku Zinbryta v původním obalu, aby byl přípravek chráněn před světlem. Balení otevřete, pouze pokud budete potřebovat novou injekční stříkačku/pero. Uchovávejte v chladničce (2 C - 8 C). o Chraňte před mrazem. Jakýkoli náhodně zmrazený přípravek Zinbryda zlikvidujte. Pokud není chladnička k dispozici, je možné injekční stříkačky/pera přípravku Zinbryta uchovávat při pokojové teplotě (do 30 o C) v původním obalu po dobu až 30 dní. o Ujistěte se, že doba, po kterou je přípravek Zinbryta mimo chladničku, není delší než 30 dní. o Jestliže byl přípravek Zinbryta uchováván mimo chladničku do dobu delší než celkem 30 dní, nebo pokud si nejste jistý(á), jak dlouho byl přípravek Zinbryta uchováván při pokojové teplotě, injekční stříkačku/pero zlikvidujte (viz bod 7 Návod na injekční podání přípravku Zinbryta). Po zahřátí na pokojovou teplotu nedávejte přípravek Zinbryta zpět do chladničky. Další informace Nepoužívejte tento přípravek, pokud si všimnete následujícího: Jestliže je injekční stříkačka/pero prasklá(é) nebo rozbitá(é). Jestliže je roztok zakalený nebo jsou-li v něm vidět plovoucí částice. Jestliže roztok není bezbarvý až nažloutlý. Jestliže pero spadlo na zem nebo je viditelně poškozené. Likvidace Nevyhazujte žádné léčivé přípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s přípravky, které již nepoužíváte. Tato opatření pomáhají chránit životní prostředí. 6
7 6. Obsah balení a další informace Co přípravek Zinbryta obsahuje Léčivou látkou je: daclizumabum. Jedna předplněná injekční stříkačka obsahuje daclizumabum 150 mg v 1 ml injekčního roztoku. Jedno předplněné pero obsahuje daclizumabum 150 mg v 1 ml injekčního roztoku. Dalšími složkami jsou: natrium-sukcinát, kyselina jantarová, chlorid sodný, polysorbát 80, voda na injekci (přečtěte si bod 2 Přípravek Zinbryta obsahuje malé množství sodíku). Jak přípravek Zinbryta vypadá a co obsahuje toto balení Zinbryta je bezbarvá až nažloutlá, čirá až opalescentní tekutina v injekční stříkačce/peru. Velikosti balení: Jedno balení přípravku obsahuje jednu předplněnou skleněnou injekční stříkačku/jedno předplněné pero s nasazenou jehlou připravenou k injekčnímu podání. Dostupné je rovněž i vícečetné balení, které obsahuje tři balení po jedné injekční stříkačce/jednom peru. Na trhu nemusí být všechny velikosti balení. Držitel rozhodnutí o registraci Biogen Idec Ltd. Innovation House 70 Norden Road Maidenhead Berkshire SL6 4AY Velká Británie Výrobce Biogen (Denmark) Manufacturing ApS Biogen Allé 1 Hillerød DK-3400 Dánsko Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci: België/Belgique/Belgien Biogen Belgium N.V./S.A България ТП ЕВОФАРМА Česká republika Biogen (Czech Republic) s.r.o Danmark Biogen (Denmark) A/S Lietuva UAB "JOHNSON & JOHNSON" Luxembourg/Luxemburg Biogen Belgium N.V./S.A Magyarország Biogen Hungary Kft. +36 (1) Malta Pharma MT limited /9 7
8 Deutschland Biogen GmbH +49 (0) Eesti UAB "JOHNSON & JOHNSON" Eesti filiaal Ελλάδα Genesis Pharma SA España Biogen Spain SL France Biogen France SAS +33 (0) Hrvatska Medis Adria d.o.o (0) Ireland Biogen Idec (Ireland) Ltd (0) Ísland Icepharma hf Italia Biogen Italia s.r.l Κύπρος Genesis Pharma Cyprus Ltd Latvija UAB "JOHNSON & JOHNSON" filiāle Latvijā Nederland Biogen Netherlands B.V Norge Biogen Norway AS Österreich Biogen Austria GmbH Polska Biogen Poland Sp. z o.o Portugal Biogen Portugal Sociedade Farmacêutica Unipessoal, Lda România Johnson & Johnson Romania S.R.L Slovenija Biogen Pharma d.o.o Slovenská republika Biogen Slovakia s.r.o Suomi/Finland Biogen Finland Oy Sverige Biogen Sweden AB United Kingdom Biogen Idec Limited +44 (0) Tato příbalová informace byla naposledy revidována 08/2016. Další zdroje informací Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky Návod na druhé straně 7. Návod na injekční podání přípravku Zinbryta 8
9 Jak přípravek Zinbryta injekčně podávat Přečtěte si tento návod k použití dříve, než začnete přípravek Zinbryta používat a pokaždé, když dostanete nové balení. Nové balení může obsahovat nové informace. Tato informace nenahrazuje konzultaci s Vaším lékařem nebo zdravotní sestrou o Vašem zdravotním stavu a léčbě. Poznámka: Před prvním použitím předplněné injekční stříkačky přípravku Zinbryta Vám nebo osobě, která o Vás pečuje, musí lékař nebo zdravotní sestra ukázat, jak si připravit a podat injekci pomocí předplněné injekční stříkačky přípravku Zinbryta. Nepoužívejte více než jednu předplněnou injekční stříkačku za měsíc. Předplněná injekční stříkačka přípravku Zinbryta je určena pouze k podkožnímu podání (subkutánní injekce). Každá předplněná injekční stříkačka přípravku Zinbryta je určena pouze pro jedno použití a nelze ji znovu použít. Nedávejte předplněnou injekční stříkačku přípravku Zinbryta žádné jiné osobě. Co budete k podání injekce přípravku Zinbryta potřebovat Předplněnou injekční stříkačku přípravku Zinbryta Předplněná injekční stříkačka 150 mg Obrázek A Další pomůcky, které nejsou součástí balení (viz obrázek B): tampon napuštěný alkoholem gázový polštářek adhezivní (samolepicí) obvaz/náplast Zeptejte se svého lékaře, lékárníka nebo zdravotní sestry, jak zlikvidovat použité injekční stříkačky. Tampon s alkoholem Gázový polštářek Náplast Obrázek B Součásti předplněné injekční stříkačky přípravku Zinbryta (viz obrázek C) Kryt jehly Léčivo Skleněný válec Příruba pro uchopení Píst 9 Obrázek C
10 Příprava na podání injekce Poznámka: Než si připravíte injekci k podání, vyjměte z chladničky injekční stříkačku a nechte ji zahřát na pokojovou teplotu. To trvá zhruba 30 minut. K zahřátí předplněné injekční stříkačky přípravku Zinbryta nepoužívejte vnější zdroje tepla, jako je horká voda. Příruba umožní lepší uchopení injekční stříkačky a musí zůstat připojená. 1. Připravte si pomůcky a umyjte si ruce Najděte si dobře osvětlenou, čistou, rovnou plochu, jako např. stůl. Připravte si veškeré pomůcky, které budete potřebovat, abyste si injekci mohl(a) sám(sama) podat, nebo aby Vám mohla být podána. Umyjte si ruce mýdlem a vodou. 2. Zkontrolujte předplněnou injekční stříkačku přípravku Zinbryta Zkontrolujte dobu použitelnosti uvedenou na předplněné injekční stříkačce přípravku Zinbryta (viz obrázek D). Nepoužívejte přeplněnou injekční stříkačku přípravku Zinbryta po uplynutí doby použitelnosti. Zkontrolujte, zda je léčivo Zinbryta bezbarvé až nažloutlé (viz obrázek E). Nepoužívejte předplněnou injekční stříkačku přípravku Zinbryta, jestliže je tekutina zakalená nebo obsahuje-li plovoucí částice. o V léčivu Zinbryta můžete vidět vzduchové bubliny. To je normální a bubliny není třeba před podáním injekce vytlačovat. Doba použitelnosti Obrázek D Léčivo Obrázek E 10
11 Podání injekce 3. Zvolte a očistěte místo podání injekce Předplněná injekční stříkačka přípravku Zinbryta je určena k podkožnímu podání (subkutánní injekce). Stehno Předplněná injekční stříkačka přípravku Zinbryta má být aplikována do stehna, břicha nebo zadní strany paže (viz obrázek F) Injekci nepodávejte přímo do pupku. Injekci nepodávejte do místa na těle, kde je kůže podrážděná, citlivá, zarudlá, pohmožděná, potetovaná, zanícená či zjizvená. Zvolte si místo podání injekce a otřete kůži tamponem napuštěným alkoholem. Před podáním injekce nechte zvolené místo podání oschnout. Před podáním injekce se tohoto místa již nedotýkejte, ani na něj nefoukejte. Obrázek F Břicho Zadní strana paže 4. Odstraňte kryt jehly Jednou rukou uchopte injekční stříkačku za skleněný válec. Dbejte na to, abyste touto rukou netlačil(a) na přírubu. Druhou rukou pevně uchopte kryt jehly a stáhněte jej z jehly v přímém směru (viz obrázek G). Při odstraňování krytu jehly postupujte opatrně, abyste se o jehlu neporanil(a). Nedotýkejte se jehly. Kryt jehly Jehla Upozornění Kryt jehly na předplněnou injekční stříkačku přípravku Zinbryta znovu nenasazujte. Mohl(a) byste se o jehlu poranit. Obrázek G 11
12 5. Jemně stiskněte kůži v místě podání injekce Palcem a ukazováčkem jemně stiskněte kůži v okolí očištěného místa podání injekce tak, aby vznikla kožní řasa (viz obrázek H). Obrázek H 6. Aplikujte injekci Držte předplněnou injekční stříkačku přípravku Zinbryta pod úhlem k místu podání injekce (viz obrázek I). Jehlu rychle vpíchněte přímo do kožního ohybu. Do kůže musí proniknout celá jehla (viz obrázek I.) Po vpíchnutí celé jehly kůži uvolněte. Netahejte za píst injekční stříkačky zpětným pohybem. Obrázek I Pomalu stlačujte píst, dokud se injekční stříkačka zcela nevyprázdní (viz obrázek J). Dokud nebude píst úplně zatlačen, předplněnou injekční stříkačku přípravku Zinbryta z místa vpichu nevytahujte. Obrázek J 12
13 7. Vytáhněte předplněnou injekční stříkačku z místa podání injekce Vytáhněte jehlu přímým pohybem vzhůru (viz obrázek K). Upozornění Kryt jehly na předplněnou injekční stříkačku přípravku Zinbryta znovu nenasazujte. Mohl(a) byste se o jehlu poranit. Předplněná injekční stříkačka přípravku Zinbryta není určena k opakovanému použití. Obrázek K Po podání injekce 8. Zlikvidujte použitou předplněnou injekční stříkačku přípravku Zinbryta Poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou, jak správně zlikvidovat použitou injekční stříkačku. 9. Ošetřete místo podání injekce Dle potřeby přiložte na místo podání injekce gázový polštářek, obvaz či náplast. Všeobecná upozornění Předplněná injekční stříkačka přípravku Zinbryta není určena k opakovanému použití. Předplněnou injekční stříkačku přípravku Zinbryta nedávejte žádné další osobě. Uchovávejte přeplněnou injekční stříkačku přípravku Zinbryta a veškeré ostatní léčivé přípravky mimo dosah a dohled dětí. Podmínky uchovávání Uchovávejte v chladničce při teplotě mezi 2 C a 8 C v původním uzavřeném obalu, aby byl přípravek chráněn před světlem. Pokud je to nutné, je možné přípravek Zinbryta uchovávat mimo chladničku při teplotě do 30 C v původním uzavřeném obalu po dobu až 30 dní. Po zahřátí na pokojovou teplotu nedávejte předplněnou injekční stříkačku přípravku Zinbryta zpět do chladničky. Chraňte před mrazem a nevystavujte vysokým teplotám. 13
14 7. Návod na injekční podání přípravku Zinbryta Jak přípravek Zinbryta injekčně podávat Přečtěte si tento návod k použití dříve, než začnete přípravek Zinbryta používat a pokaždé, když dostanete nové balení. Nové balení může obsahovat nové informace. Tato informace nenahrazuje konzultaci s Vaším lékařem nebo zdravotní sestrou o Vašem zdravotním stavu a léčbě. Poznámka: Před prvním použitím pera Vám nebo osobě, která o Vás pečuje, musí lékař nebo zdravotní sestra ukázat, jak si připravit a podat injekci pomocí pera. Nepoužívejte více než jedno pero za měsíc. Upozornění neodstraňujte víčko z pera, dokud nebudete připraven(a) aplikovat si injekci. Nepoužívejte pero, pokud spadlo na zem nebo je-li viditelně poškozené. Pero je určeno pouze k podkožnímu podání (subkutánní injekce). Každé pero je určeno pouze pro jedno použití. Nedávejte pero žádné jiné osobě. Co budete k podání injekce pomocí pera přípravku Zinbryta potřebovat (viz obrázek A): 1 pero přípravku Zinbryta 150 mg Pero 150 mg Obrázek A Další pomůcky, které nejsou součástí balení (viz obrázek B): tampon napuštěný alkoholem gázový polštářek adhezivní (samolepicí) obvaz/náplast Zeptejte se svého lékaře, lékárníka nebo zdravotní sestry, jak zlikvidovat použitá pera. Tampon s alkoholem Gázový polštářek obr. B Náplast 14
15 Před použitím Součásti pera přípravku Zinbryta (viz obrázek C): Zobrazují se zelené pruhy Tělo Okénko zobrazující léčivo Víčko Stavové okénko Před aplikací je viditelné léčivo. Obrázek C Po použití Součásti pera přípravku Zinbryta (viz obrázek D): Zobrazují se zelené zaškrtávací symboly Tělo Okénko zobrazující léčivo Kryt jehly Stavové okénko Po aplikaci je viditelný žlutý píst. Obrázek D Jehla Poznámka: Jehla je zakrytá krytem jehly a není vidět (viz obrázek D). Nedotýkejte se krytu jehly, ani na něj netlačte, mohl(a) byste se o jehlu poranit. Příprava na podání injekce Poznámka: Než si připravíte injekci k podání, vyjměte z chladničky pero a nechte jej zahřát na pokojovou teplotu. To trvá zhruba 30 minut. K zahřátí pera nepoužívejte vnější zdroje tepla, jako je horká voda. Upozornění neodstraňujte víčko z pera, dokud nebudete připraven(a) aplikovat si injekci. 1. Připravte si pomůcky a umyjte si ruce Najděte si dobře osvětlenou, čistou, rovnou plochu, jako např. stůl. Připravte si veškeré pomůcky, které budete potřebovat, abyste si injekci mohl(a) podat, nebo aby Vám mohla být podána. Umyjte si ruce mýdlem a vodou. 15
16 2. Zkontrolujte pero přípravku Zinbryta Zkontrolujte dobu použitelnosti uvedenou na peru (viz obrázek E). Zkontrolujte stavové okénko na peru. Ujistěte se, že ve stavovém okénku jsou viditelné zelené pruhy (viz obrázek F). Na peru zkontrolujte okénko zobrazující léčivo a ujistěte se, že léčivo Zinbryta je bezbarvé až nažloutlé (viz obrázek G). o V okénku zobrazujícím léčivo můžete vidět vzduchové bubliny. To je normální a nemá to vliv na Vaši dávku léčiva. Nepoužívejte pero, jestliže: o uplynula doba použitelnosti (obrázek E). o ve stavovém okénku nevidíte zelené pruhy (obrázek F). o tekutina je zakalená nebo obsahuje-li plovoucí částice (obrázek G). Doba použitelnosti Obrázek F Okénko zobrazující léčivo Stavové okénko Obrázek E Obrázek G Podání injekce 3. Zvolte a očistěte místo podání injekce Pero je učeno pouze k podkožnímu podání (subkutánní injekce). Pero má být aplikováno do stehna, břicha nebo zadní strany paže (viz vyznačená místa na obrázku H). Injekci nepodávejte do místa na těle, kde je kůže podrážděná, zarudlá, pohmožděná, potetovaná, zanícená či zjizvená. Injekci nepodávejte přímo do pupku. o Jestliže jsou některá místa pro aplikaci pro Vás obtížně dosažitelná, požádejte o pomoc osobu, která o Vás pečuje a která byla zaškolena. Zvolte si místo podání injekce a otřete kůži tamponem napuštěným alkoholem. Před podáním injekce nechte zvolené místo oschnout. Před podáním injekce se tohoto místa již nedotýkejte, ani na něj nefoukejte. Obrázek H Stehno Břicho Zadní strana paže 16
17 4. Odstraňte víčko pera přípravku Zinbryta Stáhněte víčko z pera v přímém směru a dejte je stranou na zlikvidování po aplikaci injekce (viz obrázek I). o Jehla je zakrytá krytem jehly a není vidět (viz obrázek I). Po odstranění víčka je pero připraveno k podání injekce. Upozornění víčko na pero znovu nenasazujte. Upozornění nedotýkejte se krytu jehly, ani na něj netlačte, mohl(a) byste se o jehlu poranit. Obrázek I Víčko Kryt jehly 5. Umístěte pero přípravku Zinbryta nad místo podání injekce Umístěte pero nad zvolené místo podání injekce. o Pero držte kolmo k místu podání injekce. o Ujistěte se, že ve stavovém okénku vidíte zelené pruhy (viz obrázek J). Obrázek J 17
18 6. Aplikujte injekci pomocí pera přípravku Zinbryta Pevně zatlačte pero do místa podání injekce a držte jej. Zatlačením pera směrem dolů se vpíchne jehla a automaticky se spustí podání injekce (viz obrázek K). o Uslyšíte cvakání. Znamená to, že probíhá aplikace injekce. o Pero nadále držte v místě podání injekce. Spustí se cvakání Obrázek K Až cvakání ustane, zkontrolujte stavové okénko. Ujistěte se, že ve stavovém okénku jsou viditelné zelené zaškrtávací symboly (viz obrázek L). Upozornění dokud neustane cvakání a dokud ve stavovém okénku neuvidíte zelené zaškrtávací symboly, pero z místa podání injekce nezvedejte. Cvaknutí! Cvakání Cvaknutí! ustane Cvakn nutí! 7. Vytáhněte pero přípravku Zinbryta z místa podání injekce Zvedněte pero z místa podání injekce. Vysune se kryt jehly a jehlu zakryje (viz obrázek M). Víčko na pero znovu nenasazujte. Obrázek L Obrázek M 18
19 8. Ujistěte se, že jste si podal(a) / byla Vám podána plná dávka přípravku Zinbryta Zkontrolujte stavové okénko. Ujistěte se, že jsou ve stavovém okénku vidět zelené zaškrtávací symboly (viz obrázek N). Zkontrolujte okénko zobrazující léčivo. V okénku zobrazujícím léčivo byste měl(a) vidět žlutý píst (viz obrázek O). Obrázek N Jestliže v místě podání injekce spatříte krev, setřete ji gázovým polštářkem a použijte obvaz nebo místo přelepte náplastí. Žlutý píst Obrázek O Po podání injekce 9. Zlikvidujte použité pero přípravku Zinbryta Poraďte se se svým lékařem, lékárníkem nebo zdravotní sestrou, jak správně zlikvidovat použitá pera. 10. Ošetřete místo podání injekce Dle potřeby přiložte na místo podání injekce gázový polštářek, obvaz či náplast. Podmínky uchovávání Uchovávejte v chladničce při teplotě mezi 2 C a 8 C v původním uzavřeném obalu, aby byl přípravek chráněn před světlem. Pokud je to nutné, je možné přípravek Zinbryta uchovávat mimo chladničku při teplotě do 30 C v původním uzavřeném obalu po dobu až 30 dní. Po zahřátí na pokojovou teplotu nedávejte pero přípravku Zinbryta zpět do chladničky. Chraňte před mrazem a nevystavujte vysokým teplotám. Uchovávejte pero přípravku Zinbryta a veškeré ostatní léčivé přípravky mimo dosah a dohled dětí. 19
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Zinbryta 150 mg injekční roztok v předplněné injekční stříkačce Zinbryta 150 mg injekční roztok v předplněném peru daclizumabum beta Tento přípravek podléhá
Příbalová informace: informace pro uživatele Zinbryta 150 mg injekční roztok v předplněné injekční stříkačce Zinbryta 150 mg injekční roztok v předplněném peru daclizumabum beta Tento přípravek podléhá
Příbalová informace: informace pro uživatele. Spinraza 12 mg injekční roztok. nusinersenum
 Příbalová informace: informace pro uživatele Spinraza 12 mg injekční roztok nusinersenum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příbalová informace: informace pro uživatele Spinraza 12 mg injekční roztok nusinersenum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
Příbalová informace: informace pro uživatele. Spinraza 12 mg injekční roztok. nusinersenum
 Příbalová informace: informace pro uživatele Spinraza 12 mg injekční roztok nusinersenum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příbalová informace: informace pro uživatele Spinraza 12 mg injekční roztok nusinersenum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
Příbalová informace: informace pro pacienta. Azomyr 0,5 mg/ml perorální roztok desloratadinum
 Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 94 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 125 mikrogramů
Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 94 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 125 mikrogramů
Příbalová informace: informace pro pacienta. Zurampic 200 mg potahované tablety lesinuradum
 Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněném peru Plegridy 94 mikrogramů injekční roztok v předplněném peru Plegridy 125 mikrogramů injekční roztok
Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněném peru Plegridy 94 mikrogramů injekční roztok v předplněném peru Plegridy 125 mikrogramů injekční roztok
sp.zn. sukls107935/2012
 sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
Příbalová informace: informace pro uživatele. Ferriprox 500 mg potahované tablety Deferipronum
 Příbalová informace: informace pro uživatele Ferriprox 500 mg potahované tablety Deferipronum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele Ferriprox 500 mg potahované tablety Deferipronum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele. AVONEX 30 mikrogramů/0,5 ml injekčního roztoku (Interferonum beta-1a) Předplněná injekční stříkačka
 Příbalová informace: informace pro uživatele AVONEX 30 mikrogramů/0,5 ml injekčního roztoku (Interferonum beta-1a) Předplněná injekční stříkačka Přečtěte si pozorně celou příbalovou informaci dříve, než
Příbalová informace: informace pro uživatele AVONEX 30 mikrogramů/0,5 ml injekčního roztoku (Interferonum beta-1a) Předplněná injekční stříkačka Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
1. Co je přípravek Maltofer Fol žvýkací tablety a k čemu se používá. Maltofer Fol se používá k léčbě a prevenci nedostatku železa v organismu.
 sp.zn. sukls238178/2016 Příbalová informace: Informace pro uživatele Maltofer Fol tablety 100 mg / 0,35 mg, žvýkací tablety železo ve formě polymaltosum ferricum / kyselina listová Přečtěte si pozorně
sp.zn. sukls238178/2016 Příbalová informace: Informace pro uživatele Maltofer Fol tablety 100 mg / 0,35 mg, žvýkací tablety železo ve formě polymaltosum ferricum / kyselina listová Přečtěte si pozorně
Příbalová informace: informace pro pacienta. TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum
 Příbalová informace: informace pro pacienta TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Příbalová informace: informace pro pacienta TAGRISSO 40 mg potahované tablety TAGRISSO 80 mg potahované tablety osimertinibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro pacienta. Fasenra 30 mg injekční roztok v předplněné injekční stříkačce benralizumabum
 Příbalová informace: informace pro pacienta Fasenra 30 mg injekční roztok v předplněné injekční stříkačce benralizumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro pacienta Fasenra 30 mg injekční roztok v předplněné injekční stříkačce benralizumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: Informace pro pacienta
 Příbalová informace: Informace pro pacienta CONBRIZA 20 mg potahované tablety Bazedoxifenum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: Informace pro pacienta CONBRIZA 20 mg potahované tablety Bazedoxifenum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bronchostop sirup. Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt
 Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněném peru Plegridy 94 mikrogramů injekční roztok v předplněném peru Plegridy 125 mikrogramů injekční roztok
Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněném peru Plegridy 94 mikrogramů injekční roztok v předplněném peru Plegridy 125 mikrogramů injekční roztok
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 94 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 125 mikrogramů
Příbalová informace: informace pro uživatele Plegridy 63 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 94 mikrogramů injekční roztok v předplněné injekční stříkačce Plegridy 125 mikrogramů
Příbalová informace: informace pro uživatele. Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum
 Příbalová informace: informace pro uživatele Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele Fampyra 10 mg tablety s prodlouženým uvolňováním fampridinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Neulasta 6 mg, injekční roztok v předplněné injekční stříkačce pegfilgrastimum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Neulasta 6 mg, injekční roztok v předplněné injekční stříkačce pegfilgrastimum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Neulasta 6 mg, injekční roztok v předplněné injekční stříkačce pegfilgrastimum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls93493/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BRONCHIPRET TYMIÁN A PRVOSENKA, POTAHOVANÉ TABLETY 160 mg/60 mg Thymi extractum siccum, Primulae extractum siccum Přečtěte si pozorně tuto
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
Příbalová informace: informace pro pacienta. Integrilin 0,75 mg/ml infuzní roztok eptifibatidum
 Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro pacienta. ANACID 258 mg/388 mg perorální suspenze. Magnesii hydroxidum, Algeldrati suspensio
 sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
sp.zn. sukls264215/2017 Příbalová informace: informace pro pacienta ANACID 258 mg/388 mg perorální suspenze Magnesii hydroxidum, Algeldrati suspensio Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Fasturtec 1,5 mg/ml, prášek a rozpouštědlo pro koncentrát pro infuzní roztok rasburicasum
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Fasturtec 1,5 mg/ml, prášek a rozpouštědlo pro koncentrát pro infuzní roztok rasburicasum Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Fasturtec 1,5 mg/ml, prášek a rozpouštědlo pro koncentrát pro infuzní roztok rasburicasum Přečtěte si pozorně celou příbalovou informaci
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele CELVAPAN injekční suspenze Vakcína proti chřipce (H1N1)v (celý virion, namnožená na buňkách Vero, inaktivovaná) Přečtěte si pozorně
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele CELVAPAN injekční suspenze Vakcína proti chřipce (H1N1)v (celý virion, namnožená na buňkách Vero, inaktivovaná) Přečtěte si pozorně
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Gardasil 9 injekční suspenze v předplněné injekční stříkačce 9valentní očkovací látka proti lidskému papilomaviru (rekombinantní, adsorbovaná) Tento přípravek
Příbalová informace: informace pro uživatele Gardasil 9 injekční suspenze v předplněné injekční stříkačce 9valentní očkovací látka proti lidskému papilomaviru (rekombinantní, adsorbovaná) Tento přípravek
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná), které nejsou uvedeny v
 INFORMACE PRO UŽIVATELE Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) vakcínou. Máte-l, které nejsou uvedeny v V : 1. Co je vakcína Synflorix a k 2. nflorix. 3. Jak se vakcína Synflorix
INFORMACE PRO UŽIVATELE Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) vakcínou. Máte-l, které nejsou uvedeny v V : 1. Co je vakcína Synflorix a k 2. nflorix. 3. Jak se vakcína Synflorix
Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok. železo ve formě polymaltosum ferricum
 sp.zn. sukls238918/2016 Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok železo ve formě polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls238918/2016 Příbalová informace: Informace pro uživatele Maltofer 50 mg/ml, perorální kapky, roztok železo ve formě polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. Benepali 50 mg, injekční roztok v předplněném peru etanerceptum
 Příbalová informace: informace pro uživatele Benepali 50 mg, injekční roztok v předplněném peru etanerceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele Benepali 50 mg, injekční roztok v předplněném peru etanerceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele. Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum
 sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bonviva 3 mg injekční roztok Acidum ibandronicum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bonviva 3 mg injekční roztok Acidum ibandronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bonviva 3 mg injekční roztok Acidum ibandronicum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele. Baraclude 0,05 mg/ml perorální roztok entecavirum
 Příbalová informace: informace pro uživatele Baraclude 0,05 mg/ml perorální roztok entecavirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele Baraclude 0,05 mg/ml perorální roztok entecavirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
POKYNY PRO POUŽITÍ. Budete potřebovat následující položky, které jsou obsaženy v balení:
 POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
Příbalová informace: informace pro pacienta. Maltofer 50 mg/ml perorální kapky, roztok
 sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. Loceryl 5% léčivý lak na nehty amorolfini hydrochloridum
 sp.zn. sukls154670/2013 Příbalová informace: informace pro uživatele Loceryl 5% léčivý lak na nehty amorolfini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls154670/2013 Příbalová informace: informace pro uživatele Loceryl 5% léčivý lak na nehty amorolfini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: Informace pro pacienta. Aerius 0,5 mg/ml perorální roztok desloratadinum
 Příbalová informace: Informace pro pacienta Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: Informace pro pacienta Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele AESCIN-TEVA. 20 mg, enterosolventní tablety. escinum alfa
 sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls180859/2015
 sp. zn. sukls180859/2015 Příbalová informace: informace pro pacienta DONA 1500 mg, prášek pro perorální roztok glucosamini sulfas cristallicus Přečtěte si pozorně celou příbalovou informaci dříve, než
sp. zn. sukls180859/2015 Příbalová informace: informace pro pacienta DONA 1500 mg, prášek pro perorální roztok glucosamini sulfas cristallicus Přečtěte si pozorně celou příbalovou informaci dříve, než
PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum
 PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum - - - Musíte se poradit s po 2 týdnech. - Bez porady s - V 1. Co je PANTOLOC Control a k 2. 3. Jak se PANTOLOC Control používá 4. Možné nežádoucí
PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum - - - Musíte se poradit s po 2 týdnech. - Bez porady s - V 1. Co je PANTOLOC Control a k 2. 3. Jak se PANTOLOC Control používá 4. Možné nežádoucí
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Maltofer 10 mg/ml sirup
 sp.zn.: sukls229281/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Maltofer 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.: sukls229281/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Maltofer 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele. IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara)
 Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
Sp.zn.sukls133559/2018
 Sp.zn.sukls133559/2018 Příbalová informace: informace pro uživatele Betahistin Actavis 24 mg tablety betahistini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls133559/2018 Příbalová informace: informace pro uživatele Betahistin Actavis 24 mg tablety betahistini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta Tecfidera 120 mg enterosolventní tvrdé tobolky Tecfidera 240 mg enterosolventní tvrdé tobolky dimethylis fumaras Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta Tecfidera 120 mg enterosolventní tvrdé tobolky Tecfidera 240 mg enterosolventní tvrdé tobolky dimethylis fumaras Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum)
 sp.zn. sukls8590/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls8590/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE BENZOCAIN LIFE PHARMA 8 MG Pastilky (benzocainum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret
 sp.zn.sukls240326/2018 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento
sp.zn.sukls240326/2018 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Sinupret perorální kapky, roztok Herbarum extractum pro Sinupret Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento
Příbalová informace informace pro uživatele. RILUTEK 50 mg potahované tablety Riluzolum
 PŘÍBALOVÁ INFORMACE Příbalová informace informace pro uživatele RILUTEK 50 mg potahované tablety Riluzolum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože
PŘÍBALOVÁ INFORMACE Příbalová informace informace pro uživatele RILUTEK 50 mg potahované tablety Riluzolum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek užívat, protože
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE. TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum
 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte
Příloha č. 1 k rozhodnutí o změně registrace č. j. MZDR 61316/2014 (sp. zn. sukls204443/2010) PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace č. j. MZDR 61316/2014 (sp. zn. sukls204443/2010) PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEDELIX SIRUP Hederae helicis folii extractum spissum (hustý extrakt
Příloha č. 1 k rozhodnutí o změně registrace č. j. MZDR 61316/2014 (sp. zn. sukls204443/2010) PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEDELIX SIRUP Hederae helicis folii extractum spissum (hustý extrakt
Příbalová informace: Informace pro pacienta. Aerius 5 mg potahované tablety desloratadinum
 Příbalová informace: Informace pro pacienta Aerius 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: Informace pro pacienta Aerius 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro pacienta. TYSABRI 300 mg koncentrát pro infuzní roztok Natalizumabum
 Příbalová informace: informace pro pacienta TYSABRI 300 mg koncentrát pro infuzní roztok Natalizumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro pacienta TYSABRI 300 mg koncentrát pro infuzní roztok Natalizumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Alpicort 2 mg/ml + 4 mg/ml kožní roztok prednisolonum, acidum salicylicum
 sp.zn. sukls176806/2014 Příbalová informace: informace pro uživatele Alpicort 2 mg/ml + 4 mg/ml kožní roztok prednisolonum, acidum salicylicum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls176806/2014 Příbalová informace: informace pro uživatele Alpicort 2 mg/ml + 4 mg/ml kožní roztok prednisolonum, acidum salicylicum Přečtěte si pozorně celou příbalovou informaci dříve, než
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta Tecfidera 120 mg enterosolventní tvrdé tobolky Tecfidera 240 mg enterosolventní tvrdé tobolky dimethylis fumaras Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro pacienta Tecfidera 120 mg enterosolventní tvrdé tobolky Tecfidera 240 mg enterosolventní tvrdé tobolky dimethylis fumaras Přečtěte si pozorně celou příbalovou informaci
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 B. PŘÍBALOVÁ INFORMACE 2 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dasselta 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 B. PŘÍBALOVÁ INFORMACE 2 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dasselta 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace : Informace pro uživatele. Aknemycin 2000 Mast Erythromycinum
 sp.zn. sukls182807/2012 Příbalová informace : Informace pro uživatele Aknemycin 2000 Mast Erythromycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls182807/2012 Příbalová informace : Informace pro uživatele Aknemycin 2000 Mast Erythromycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn. sukls110147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA SOMATULINE AUTOGEL 60 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 90 mg, injekční roztok v předplněné stříkačce SOMATULINE
sp.zn. sukls110147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA SOMATULINE AUTOGEL 60 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 90 mg, injekční roztok v předplněné stříkačce SOMATULINE
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Mycosten 10 mg/g Shampoo Ciclopiroxum šampon Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Mycosten 10 mg/g Shampoo Ciclopiroxum šampon Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas
 Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro pacienta. Forxiga 5 mg potahované tablety Forxiga 10 mg potahované tablety dapagliflozinum
 Příbalová informace: informace pro pacienta Forxiga 5 mg potahované tablety Forxiga 10 mg potahované tablety dapagliflozinum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro pacienta Forxiga 5 mg potahované tablety Forxiga 10 mg potahované tablety dapagliflozinum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Dacogen 50 mg prášek pro koncentrát pro infuzní roztok Decitabinum
 Příbalová informace: informace pro uživatele Dacogen 50 mg prášek pro koncentrát pro infuzní roztok Decitabinum Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro uživatele Dacogen 50 mg prášek pro koncentrát pro infuzní roztok Decitabinum Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
Příbalová informace: informace pro pacienta. Ristaben 50 mg potahované tablety Sitagliptinum
 Příbalová informace: informace pro pacienta Ristaben 50 mg potahované tablety Sitagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro pacienta Ristaben 50 mg potahované tablety Sitagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: Informace pro pacienta
 sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
sp.zn.sukls98480/2015 Příbalová informace: Informace pro pacienta Mucoplant břečťanový sirup proti kašli sirup Léčivá látka: Hederae helicis folii extractum siccum (suchý extrakt z břečťanového listu)
PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Mimpara 30 mg potahované tablety Mimpara 60 mg potahované tablety Mimpara 90 mg potahované tablety Cinacalceti hydrochloridum Přečtěte si pozorně celou příbalovou
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Příbalová informace: Informace pro uživatele. NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele. NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum
 sp.zn. sukls221673/2011 Příbalová informace: Informace pro uživatele NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls221673/2011 Příbalová informace: Informace pro uživatele NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta Briviact 10 mg potahované tablety Briviact 25 mg potahované tablety Briviact 50 mg potahované tablety Briviact 75 mg potahované tablety Briviact 100 mg potahované
Příbalová informace: informace pro pacienta Briviact 10 mg potahované tablety Briviact 25 mg potahované tablety Briviact 50 mg potahované tablety Briviact 75 mg potahované tablety Briviact 100 mg potahované
Příbalová informace: informace pro uživatele Silkis 3 mikorgramy/g mast (calcitriolum)
 Sp.zn. sukls210281/2016 a k sp.zn. sukls63246/2017 Příbalová informace: informace pro uživatele Silkis 3 mikorgramy/g mast (calcitriolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn. sukls210281/2016 a k sp.zn. sukls63246/2017 Příbalová informace: informace pro uživatele Silkis 3 mikorgramy/g mast (calcitriolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. HBVAXPRO 10 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna)
 Příbalová informace: informace pro uživatele HBVAXPRO 10 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než se necháte očkovat,
Příbalová informace: informace pro uživatele HBVAXPRO 10 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než se necháte očkovat,
Příbalová informace: informace pro uživatele. FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum
 Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls51148/2011 Příbalová informace: informace pro uživatele FINALGON 4 mg/g + 25 mg/g, mast nonivamidum/nicoboxilum Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Protopic 0,03% mast Tacrolimusum monohydricum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Protopic 0,03% mast Tacrolimusum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Protopic 0,03% mast Tacrolimusum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele. Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok
 sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
sp.zn. sukls301709/2016 Příbalová informace: informace pro uživatele Sodium Chromate ( 51 Cr) Solution 37 MBq/ml, radionuklidový prekurzor, roztok Natrii chromas ( 51 Cr) Přečtěte si pozorně celou příbalovou
Příbalová informace: Informace pro uživatele. NovoThirteen IU prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. HBVAXPRO 40 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna)
 Příbalová informace: informace pro uživatele HBVAXPRO 40 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než se necháte očkovat,
Příbalová informace: informace pro uživatele HBVAXPRO 40 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než se necháte očkovat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum
 sp.zn.sukls205603/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn.sukls205603/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Bronchipret tymián a břečťan sirup Thymi extractum fluidum, Hederae helicis folii extractum fluidum Přečtěte si pozorně tuto příbalovou
Příbalová informace: informace pacienta. LIVOSTIN nosní sprej, suspenze. levocabastini hydrochloridum
 sp.zn.sukls94010/2015 Příbalová informace: informace pacienta LIVOSTIN nosní sprej, suspenze levocabastini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls94010/2015 Příbalová informace: informace pacienta LIVOSTIN nosní sprej, suspenze levocabastini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE. Galvus 50 mg tablety Vildagliptinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
Příbalová informace: informace pro pacienta. Zinforo 600 mg prášek pro koncentrát pro infuzní roztok ceftarolinum fosamilum
 Příbalová informace: informace pro pacienta Zinforo 600 mg prášek pro koncentrát pro infuzní roztok ceftarolinum fosamilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta Zinforo 600 mg prášek pro koncentrát pro infuzní roztok ceftarolinum fosamilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) Přečtěte si pozorně celou příbalovou
Příbalová informace: Informace pro pacienta. Aerius 5 mg tablety dispergovatelné v ústech desloratadinum
 Příbalová informace: Informace pro pacienta Aerius 5 mg tablety dispergovatelné v ústech desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: Informace pro pacienta Aerius 5 mg tablety dispergovatelné v ústech desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
Rotarix perorální suspenze v Živá rotavirová vakcína
 INFORMACE PRO UŽIVATELE Rotarix perorální suspenze v Živá rotavirová vakcína Vaše dí - - Máte- - - Pokud s V : 1. Co je Rotarix a k 2. 3. Jak se Rotarix podává 4. 5 Jak Rotarix uchovávat 6. Další informace
INFORMACE PRO UŽIVATELE Rotarix perorální suspenze v Živá rotavirová vakcína Vaše dí - - Máte- - - Pokud s V : 1. Co je Rotarix a k 2. 3. Jak se Rotarix podává 4. 5 Jak Rotarix uchovávat 6. Další informace
