Edukační materiál. Yervoy (ipilimumab) Časté otázky Brožura pro. zdravotníky
|
|
|
- Alexandra Bártová
- před 10 lety
- Počet zobrazení:
Transkript
1 Edukační materiál Yervoy (ipilimumab) Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých. 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. Pokud se hlášení týká biologického léčiva, je třeba doplnit i přesný obchodní název a číslo šarže. Podezření na nežádoucí účinky mohou být také hlášena farmakovigilančnímu oddělení společnosti Bristol-Myers Squibb, a to telefonicky na číslo , nebo faxem na číslo , nebo em na adresu safety_czech@bms.com.
2 Obsah Co je účelem této brožury? Co je účelem této brožury? Co je to YERVOY TM? Co je třeba zajistit před a v průběhu podávání přípravku? Reakce na infúzi Nežádoucí účinky Co je Informační brožura pro pacienty? Kde lze získat další informace? Tuto brožuru připravila firma Bristol-Myers Squibb pro lékaře a další zdravotníky, kteří se podílejí na léčbě pacientů přípravkem YERVOY TM (ipilimumab). Tento edukační materiál je povinnou podmínkou pro bezpečné a účinné používání léčivého přípravku Yervoy s cílem dále minimalizovat vybraná závažná rizika. Prosím prostudujte rovněž Souhrn údajů o přípravku Yervoy k získání kompletních informací o jeho bezpečném užívání. Tato brožura poskytuje: informace o použití přípravku YERVOY informace o možných nežádoucích účincích a způsobu jejich léčby pokyny, jak pacientům prezentovat Informační brožuru pro pacienty a Výstražnou kartičku pro pacienta a jejich účel. Co je to YERVOY? YERVOY je lék podporující boj imunitního systému s nádorem stimulací T-buněk. Jedná se o imunoglobulin IgG1 - rekombinantní, plně humánní monoklonální protilátku, která blokuje antigen CTLA-4 (cytotoxický T-lymfocytární antigen 4), což je molekula na T-buňkách, která působí jako přirozená brzda imunitní odpovědi. 1 Jaké jsou indikace přípravku? Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých
3 Reakce na infúzi Co je třeba zajistit před a v průběhu podávání přípravku? Před zahájením léčby a před každou dávkou je třeba vyšetřit: jaterní testy testy funkce štítné žlázy známky nebo symptomy imunitně podmíněných nežádoucích účinků, včetně průjmu nebo kolitidy a informovat se o případném těhotenství, jelikož podávání přípravku v těhotenství se nedoporučuje, pokud klinický přínos nepřevyšuje potenciální riziko. Byly hlášeny nějaké reakce na infúzi? V klinických studiích se objevily jednotlivé případy těžkých reakcí na infúzi. 1 Jak reakce na infúzi přípravku léčit? Závažné reakce na infúzi: Infúzi přestaňte podávat a zajistěte příslušnou terapii. 2 Mírné nebo středně těžké reakce na infúzi: Lze řešit snížením rychlosti infúze do ustoupení příznaků. Dle uvážení ošetřujícího lékaře lze zajistit symptomatickou léčbu. Pacienti s mírnou nebo středně těžkou reakcí mohou dostat další dávky, avšak s pečlivým sledováním. Před dalšími dávkami přípravku lze zvážit premedikaci podle klinické potřeby. 2 Upozornění U pacientů s autoimunitním onemocněním v anamnéze se doporučuje pečlivé zhodnocení potenciálního poměru přínosu a rizik. Podávání přípravku YERVOY je třeba se vyhýbat u pacientů se závažnou aktivní autoimunitní chorobou, kde je další imunitní aktivace potenciálně bezprostředně život ohrožující. 4 5
4 Nežádoucí účinky Jaké jsou možné nežádoucí účinky přípravku YERVOY? Při podávání přípravku YERVOY může docházet k zánětlivým nežádoucím účinkům způsobeným zvýšenou či nadměrnou aktivitou imunitního systému (imunitně podmíněné nežádoucí účinky), které pravděpodobně souvisí s mechanismem účinku. Imunitně podmíněné nežádoucí účinky mohou být závažné nebo životu nebezpečné a mohou postihovat gastrointestinální systém, játra, kůži a nervový, endokrinní nebo i jiný systém či orgán. Zatímco většina těchto nežádoucích účinků se vyskytne během indukčního období, jejich výskyt byl hlášen také i několik měsíců po poslední dávce přípravku. 1 Pokud nebude zjištěna alternativní etiologie potíží, je nutno považovat případný průjem, zvýšenou četnost stolice, krev ve stolici, zvýšené hodnoty testu jaterní funkce, vyrážku a endokrinopatie za příznaky způsobené zánětem a přípravkem YERVOY. 1 Časná diagnostika a náležitá léčba jsou nezbytné k minimalizaci životu nebezpečných komplikací. K vyřešení závažných imunitních reakcí možná bude nutné nasadit vysoké dávky systémových kortikosteroidů a případně i další terapii imunosupresivy. 1 Pokyny ke specifické léčbě pacientů, u nichž se vyskytnou nežádoucí účinky po podání přípravků YERVOY, najdete v Souhrnu údajů o přípravku. Kdy se nežádoucí účinky přípravku YERVOY nejspíše objeví? Většina imunitně podmíněných nežádoucích účinků se v minulosti vyskytla během indukčního období (obvykle dojde k výskytu nežádoucích účinků v mediánu několika týdnů, ale jsou známy i případy po podání první dávky či několik dní po ní). Hlášen však byl jejich výskyt i několik měsíců po poslední dávce. Proto je nutné pacienty sledovat i po ukončení léčby. 1 K jakým imunitně podmíněným nežádoucím účinkům může dojít u pacientů léčených přípravkem YERVOY? Hlavní imunitně podmíněné nežádoucí účinky jsou: Zánět střev (kolitida), která se může zhoršit a vyústit v krvácení nebo perforaci (proděravení) střeva. Možné příznaky kolitidy: průjem (vodnatá, řídká nebo měkká stolice), zvýšená pohyblivost střev, krvavá nebo tmavá stolice, bolesti břicha, zvracení a nevolnost. 3 Zánět jater (hepatitida), který může vést k selhání jater. Možné známky a příznaky: abnormální jaterní funkce, žloutenka, únava. 3 Zánět kůže, který může vést k těžké kožní reakci (toxická epidermální nekrolýza). Možné známky a příznaky těžké kožní reakce: vyrážka se svěděním nebo bez něj, olupování kůže, suchá kůže. 3 Zánět nervů, který může vést k neuropatii. Možné příznaky: svalová slabost, necitlivost nebo mravenčení v rukou nebo nohou, ztráta vědomí nebo obtíže při probouzení. 3 Zánět endokrinních žláz (včetně hypofýzy, nadledvin a štítné žlázy), který může narušit jejich funkci. Možné příznaky: bolesti hlavy, rozmazané nebo dvojité vidění, únava, snížený zájem o sex (libido), změny chování. 3 Zánět očí. Možné příznaky: zarudnutí či bolest v oku, zrakové potíže nebo rozmazané vidění. 3 U pacientů léčených přípravkem YERVOY ve studii MDX byly navíc hlášeny následující nežádoucí účinky, u nichž je podezření na imunologický vliv: uveitida, eosinofilie, zvýšení hladiny lipáz a glomerulonefritida. Kromě toho byl u pacientů léčených přípravkem YERVOY 3 mg/kg + vakcínou proti peptidu gp100 hlášen výskyt iritidy, hemolytické anémie, zvýšené hladiny amylázy, selhání více orgánů a pneumonitidy
5 Nežádoucí účinky Jak imunitně podmíněné nežádoucí účinky léčit? Při řešení imunitně podmíněných nežádoucích účinků je klíčem časná intervence a léčba. Doporučení k léčbě jsou podrobně uvedená v bodu 4.4 Souhrnu údajů o přípravku. 1 Imunitně podmíněné nežádoucí účinky se většinou vyřeší do 6 týdnů v průběhu další léčby nebo po jejím ukončení. 1 Mírné nežádoucí účinky 1 Lze léčit symptomaticky. U suspektních imunitně podmíněných nežádoucích účinků před podáním kortikosteroidu eliminujte možné alternativní příčiny (nesouvisející s imunitním systémem). 1 Další informace najdete v Souhrnu údajů o přípravku YERVOY. Pacientům zdůrazněte, že se nesmí sami pokoušet o léčbu nežádoucích účinků. Požádejte je, aby ihned kontaktovali svého ošetřujícího lékaře. Některé nežádoucí účinky se mohou bez léčby rychle zhoršit. 3 Časná diagnostika a příslušná léčba jsou nezbytné k minimalizaci životu nebezpečných komplikací. Přetrvávající mírné nebo středně závažné nežádoucí účinky 1 Terapie perorálními kortikosteroidy (prednison 1 mg/kg/den nebo ekvivalent) Vysazení plánované dávky přípravku YERVOY. Pokud dojde k ústupu potíží nebo návratu k výchozímu stavu, lze podávání přípravku YERVOY obnovit*. Symptomy se zhoršují, jsou závažné nebo život ohrožující 1 Terapie vysokými i.v. dávkami kortikosteroidů (methylprednisolon 2 mg/kg/den nebo ekvivalent). Pokud se příznaky zlepší, je na zvážení postupné snižování dávky kortikosteroidů během nejméně 4 týdnů. Pokud symptomy přetrvávají i po 5-7 dnech, je na zvážení léčba alternativní imunosupresivní terapií. Ukončete podávání přípravku YERVOY **. * Více informací najdete v aktuálním Souhrnu údajů o přípravku YERVOY. ** U kožních imunitně podmíněných nežádoucích účinků: Stupeň 3: Vysaďte plánovanou dávku. Vyrážka stupně 4 nebo svědění stupně 3: Ukončete léčbu přípravkem YERVOY. 8 9
6 Co je Informační brožura pro pacienty? Kde lze získat další informace? Ošetřující lékař by měl poskytnout Informační brožuru pro pacienty všem pacientům léčeným přípravkem YERVOY, jakmile se začnou léčit nebo požádají o nový výtisk. Může ji také použít jako podklad k edukaci pacientů během léčby přípravkem YERVOY. Tato brožura přináší pacientům informace o jejich léčbě, a co je nejdůležitější, přináší informace o tom, co dělat v případě výskytu nežádoucích účinků (například imunitně podmíněných). Další informace o přípravku YERVOY najdete v jeho Souhrnu údajů o přípravku, nebo navštivte ev. zavolejte na číslo Poznámky: Informační brožura pro pacienty obsahuje také Výstražnou kartičku pro pacienta s kontaktními údaji ošetřujícího lékaře, kterou má mít pacient neustále při sobě a má ji ukázat každému zdravotnickému pracovníkovi, který ho bude z jakéhokoli důvodu ošetřovat. Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty YERVOY (ipilimumab) Výstražná kartička pro pacienta Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli nežádoucí účinek, sdělte to svému lékaři. Nežádoucí účinky můžete hlásit také přímo Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení nežádoucích účinků naleznete na webových stránkách Tento edukační materiál je povinnou podmínkou pro bezpečné a účinné používání přípravku Yervoy s cílem dále minimalizovat vybraná závažná rizika. 1 Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli nežádoucí účinek, sdělte to svému lékaři. Nežádoucí účinky můžete hlásit také přímo Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení nežádoucích účinků naleznete na webových stránkách Tento edukační materiál je povinnou podmínkou pro bezpečné a účinné používání přípravku Yervoy s cílem dále minimalizovat vybraná závažná rizika. 1. Souhrn údajů o přípravku YERVOY. 2. Protocol for: Hodi FS, O Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med. 2010;363: DOI: /NEJMoa Accessible at: 3. Příbalová informace přípravku YERVOY
7 YERVOY pro dospělé pacienty s pokročilým melanomem Další informace o přípravku YERVOY najdete na adrese nebo si vyžádejte lékařské informace na čísle Job XXXXXXXX, datum schválení: XX.XX.2015
Časté otázky. Brožura pro. zdravotníky
 Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých. 1 Yervoy podléhá dalšímu sledování, které umožní rychlé
Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých. 1 Yervoy podléhá dalšímu sledování, které umožní rychlé
Průvodce použitím přípravku YERVOY (ipilimumab)
 Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
Průvodce použitím přípravku YERVOY (ipilimumab) Informační brožura pro pacienty Yervoy podléhá dalšímu sledování, které umožní rychlé získávání nových informací o bezpečnosti. Pokud se u Vás vyskytne jakýkoli
zdravotníky Časté otázky Brožura pro
 koncentrát pro přípravu Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých, kteří už absolvovali jinou
koncentrát pro přípravu Časté otázky Brožura pro zdravotníky Přípravek YERVOY je indikován k léčbě pokročilého melanomu (neresekovatelného nebo metastazujícího) u dospělých, kteří už absolvovali jinou
Edukační materiál. YERVOY (ipilimumab) Důležitá upozornění k předcházení závažných následků možných nežádoucích účinků léčivého přípravku YERVOY
 Edukační materiál YERVOY (ipilimumab) Důležitá upozornění k předcházení závažných následků možných nežádoucích účinků léčivého přípravku YERVOY Přípravek YERVOY (ipilimumab) je indikován k léčbě pokročilého
Edukační materiál YERVOY (ipilimumab) Důležitá upozornění k předcházení závažných následků možných nežádoucích účinků léčivého přípravku YERVOY Přípravek YERVOY (ipilimumab) je indikován k léčbě pokročilého
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
BAVENCIO (avelumab) Váš průvodce informacemi pro pacienta
 Váš průvodce informacemi pro pacienta BAVENCIO (avelumab) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Váš průvodce informacemi pro pacienta BAVENCIO (avelumab) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příručka k přípravku KEYTRUDA. (pembrolizumab) Informace pro pacienty. Informace pro pacienty
 Příručka k přípravku KEYTRUDA (pembrolizumab) Informace pro pacienty Informace pro pacienty Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příručka k přípravku KEYTRUDA (pembrolizumab) Informace pro pacienty Informace pro pacienty Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH)
 Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Přímé sdělení pro zdravotnické pracovníky týkající se spojitosti mezi léčbou Sprycelem (dasatinibem) a plicní arteriální hypertenzí (PAH) Se souhlasem Evropské lékové agentury (EMA) a její
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Ipilimumab je plně lidská monoklonální protilátka anti-ctla-4 (IgG1κ) produkovaná ovariálními buňkami čínského křečíka rekombinantní DNA technologií.
 1. NÁZEV PŘÍPRAVKU YERVOY 5 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje ipilimumabum 5 mg. Jedna 10 ml lahvička obsahuje ipilimumabum 50 mg.
1. NÁZEV PŘÍPRAVKU YERVOY 5 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje ipilimumabum 5 mg. Jedna 10 ml lahvička obsahuje ipilimumabum 50 mg.
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
KEYTRUDA. (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby
 Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
Edukační materiál KEYTRUDA (pembrolizumab) Seznam důležitých imunitně zprostředkovaných nežádoucích účinků a jejich příznaků, včetně opatření a léčby Brožura pro Zdravotnického pracovníka Tento léčivý
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) dexamethasonu (kromě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU YERVOY 5 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje ipilimumabum 5 mg. Jedna 10 ml
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU YERVOY 5 mg/ml koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml koncentrátu obsahuje ipilimumabum 5 mg. Jedna 10 ml
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Návod pro pacienta / pečovatele
 Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu infuzního roztoku
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Tecentriq (atezolizumab) Důležité bezpečnostní informace pro minimalizaci rizika imunitně podmíněných nežádoucích reakcí pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Tento léčivý přípravek podléhá dalšímu. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Tecentriq
EDUKAČNÍ MATERIÁLY Tento léčivý přípravek podléhá dalšímu. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Tecentriq
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) pro ibuprofen / pseudoefedrin
Co byste měl(a) vědět o léčivém přípravku
 Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
Co byste měl(a) vědět o léčivém přípravku Důležité bezpečnostní informace pro pacienty léčené přípravkem MabThera 1 Co byste měl(a) vědět o přípravku MabThera Pokud máte revmatoidní artritidu (RA), granulomatózu
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI
 PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
PŘÍLOHA III DODATKY K SOUHRN ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 1 DODATKY MAJÍ BÝT ZAŘAZENY DO ODPOVÍDAJÍCÍCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH MOXIFLOXACIN Následující
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
EXELON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY
 XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
Příbalová informace: informace pro pacienta. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok
 sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls36126/2014 Příbalová informace: informace pro pacienta ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy/aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I. Vědecké závěry
 Příloha I Vědecké závěry 1 Vědecké závěry Daklizumab beta je humanizovaná monoklonální protilátka IgG1, která moduluje signalizaci IL-2 blokádou signalizace CD25-dependentního receptoru pro IL-2 s vysokou
Příloha I Vědecké závěry 1 Vědecké závěry Daklizumab beta je humanizovaná monoklonální protilátka IgG1, která moduluje signalizaci IL-2 blokádou signalizace CD25-dependentního receptoru pro IL-2 s vysokou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
Příloha IV. Vědecké závěry
 Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Příloha IV Vědecké závěry 57 Vědecké závěry Dne 7. června 2017 byla Evropská komise (EK) informována o případu úmrtí v důsledku fulminantního selhání jater u pacienta léčeného daklizumabem v rámci průběžné
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Důležité informace pro pacienty
 MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
MAVENCLAD (cladribinum) Důležité informace pro pacienty OBSAH Seznámení s přípravkem MAVENCLAD Jak se přípravek MAVENCLAD podává? Nežádoucí účinky a možná rizika Lymfopenie Herpes zoster (pásový opar)
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis
 Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU
 EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
Požadavky SÚKL k vytváření, obsahu a distribuci edukačních materiálů určených pro zdravotnické pracovníky a pacienty
 PHV-7 Požadavky SÚKL k vytváření, obsahu a distribuci edukačních materiálů určených pro zdravotnické pracovníky a pacienty Platnost od: 25.4.2014 Pokyn blíže vymezuje pojmy a upravuje podmínky poskytování
PHV-7 Požadavky SÚKL k vytváření, obsahu a distribuci edukačních materiálů určených pro zdravotnické pracovníky a pacienty Platnost od: 25.4.2014 Pokyn blíže vymezuje pojmy a upravuje podmínky poskytování
Informační karta pro pacientku
 Informační karta pro pacientku Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u
Informační karta pro pacientku Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta
 sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
Příbalová informace: informace pro uživatele. IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara)
 Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
Příbalová informace: informace pro uživatele IMVANEX injekční suspenze Vakcína proti pravým neštovicím (živý modifikovaný virus vakcínie Ankara) Tento přípravek podléhá dalšímu sledování. To umožní rychlé
ACTYNOX 50 % / 50 % V/V Oxid dusný (dinitrogenii oxidum) / kyslík (oxygenum) Medicinální plyn, stlačený PRŮVODCE PRO ZDRAVOTNICKÉ PRACOVNÍKY
 Edukační materiály Orgány veřejného zdraví stanovily určité podmínky pro tržní rozvoj přípravku ACTYNOX. Jednou z nich je předávat tyto informace zdravotnickým pracovníkům jako součást povinného plánu
Edukační materiály Orgány veřejného zdraví stanovily určité podmínky pro tržní rozvoj přípravku ACTYNOX. Jednou z nich je předávat tyto informace zdravotnickým pracovníkům jako součást povinného plánu
Hlášení těhotenství (formulář)
 Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Hlášení těhotenství (formulář) OSOBA PODÁVAJÍCÍ HLÁŠENÍ Počáteční Následné sledování Jméno a příjmení: Upřesnění: Lékař (specializace) Lékárník pacient ostatní (upřesněte) Kontaktní adresa: Telefonní číslo:
Příbalová informace: informace pro uživatele. Pentasa čípky mesalazinum
 sp.zn. sukls136107/2009 Příbalová informace: informace pro uživatele Pentasa čípky mesalazinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
sp.zn. sukls136107/2009 Příbalová informace: informace pro uživatele Pentasa čípky mesalazinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy (PSUR) pro bendamustin-hydrochlorid byly
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
Příbalová informace: informace pro pacienta. Maltofer 50 mg/ml perorální kapky, roztok
 sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Jak sledovat bezpečnost léčivých přípravků v ČR problémy a výzvy MUDr. Jana Mladá Státní ústav pro kontrolu léčiv 3 O čem dnes? Monitorování bezpečnosti léčivých přípravků Farmakovigilanční systém Chyby
2 Jak sledovat bezpečnost léčivých přípravků v ČR problémy a výzvy MUDr. Jana Mladá Státní ústav pro kontrolu léčiv 3 O čem dnes? Monitorování bezpečnosti léčivých přípravků Farmakovigilanční systém Chyby
Brožura s informacemi pro pacienta a rodiče pacienta s ahus
 Brožura s informacemi pro pacienta a rodiče pacienta s ahus Schválena SÚKL dne 18. března 2019 SLOVNÍK POJMŮ Atypický hemolytickouremický syndrom (ahus) Vzácná porucha způsobená chronickou a nadměrnou
Brožura s informacemi pro pacienta a rodiče pacienta s ahus Schválena SÚKL dne 18. března 2019 SLOVNÍK POJMŮ Atypický hemolytickouremický syndrom (ahus) Vzácná porucha způsobená chronickou a nadměrnou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno
 C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
C Z E C H G R O U P CZECH GROUP 1 Rozdíly mezi novými a klasickými léky u mnohočetného myelomu Luděk Pour IHOK FN Brno C M G M Y E L O M A Č E S K Á M YE LO M O VÁ S K U P IN A Setkání klubu pacientů 11.5.2016
REAKCE ŠTĚPU PROTI HOSTITELI
 REAKCE ŠTĚPU PROTI HOSTITELI Autor: Daniela Hamaňová, Veronika Hanáčková Výskyt Výskyt akutní reakce štěpu proti hostiteli se pohybuje globálně v rozmezí 26% - 34% u transplantací od příbuzných dárců a
REAKCE ŠTĚPU PROTI HOSTITELI Autor: Daniela Hamaňová, Veronika Hanáčková Výskyt Výskyt akutní reakce štěpu proti hostiteli se pohybuje globálně v rozmezí 26% - 34% u transplantací od příbuzných dárců a
CNV. Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab)
 CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Základní informace o interferenci daratumumabu s testy krevní kompatibility
 EDUKAČNÍ MATERÁLY Daratumumab Základní informace o interferenci daratumumabu s testy krevní kompatibility Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERÁLY Daratumumab Základní informace o interferenci daratumumabu s testy krevní kompatibility Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Alendrogen 70 MG tablety acidum alendronicum
 Příloha č. 2 k rozhodnutí o prodloužení registrac sp. zn. sukls21232/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Alendrogen 70 MG tablety acidum alendronicum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o prodloužení registrac sp. zn. sukls21232/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Alendrogen 70 MG tablety acidum alendronicum Přečtěte si pozorně celou příbalovou
(alemtuzumab 12 mg i.v.)
 EDUKAČNÍ MATERIÁL Pomůcka pro podání přípravku Tento text je pouze doporučením a pomůckou pro podávání léčivého přípravku Lemtrada. Nenahrazuje edukační materiály, které jsou k dispozici pro předepisující
EDUKAČNÍ MATERIÁL Pomůcka pro podání přípravku Tento text je pouze doporučením a pomůckou pro podávání léčivého přípravku Lemtrada. Nenahrazuje edukační materiály, které jsou k dispozici pro předepisující
Fluorochinolonová antibiotika omezení používání potvrzeno
 Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
Fluorochinolonová antibiotika omezení používání potvrzeno Důležité upozornění k omezení používání fluorochinolonových antibiotik v klinické praxi. Prosím, věnujte mu pozornost. Děkuji Míša Matoušková Fluorochinolonová
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
Vaše léčba přípravkem XALKORI (Crizotinibum)
 EDUKAČNÍ MATERIÁLY Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
EDUKAČNÍ MATERIÁLY Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou.
VÁŠ PRŮVODCE PRO PŘÍPRAVEK. (aflibercept solution for injection)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE)
 PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
Oddíl 1 O přípravku Lucentis
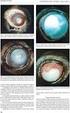 mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE. ASACOL Čípky. Mesalazinum
 sp.zn.sukls133510/2014 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE ASACOL Čípky Mesalazinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
sp.zn.sukls133510/2014 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE ASACOL Čípky Mesalazinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
sp.zn.: sukls109613/2011 a k sp.zn.: sukls199799/2010, sukls87859/2013
 sp.zn.: sukls109613/2011 a k sp.zn.: sukls199799/2010, sukls87859/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE LIPANOR Tvrdé tobolky Ciprofibratum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn.: sukls109613/2011 a k sp.zn.: sukls199799/2010, sukls87859/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE LIPANOR Tvrdé tobolky Ciprofibratum Přečtěte si pozorně celou příbalovou informaci dříve,
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Edukační materiál. OPDIVO (nivolumab) Riziko imunitně podmíněných nežádoucích účinků a jejich zvládání
 Edukační materiál OPDIVO (nivolumab) Přípravek OPDIVO je indikován k léčbě různých typů nádorů, v monoterapii nebo v kombinaci s ipilimumabem. Kompletní seznam schválených indikací a informace o tom, u
Edukační materiál OPDIVO (nivolumab) Přípravek OPDIVO je indikován k léčbě různých typů nádorů, v monoterapii nebo v kombinaci s ipilimumabem. Kompletní seznam schválených indikací a informace o tom, u
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. IMODIUM tvrdé tobolky (loperamidi hydrochloridum)
 Příloha č. 1 ke sdělení sp.zn. sukls139104/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE IMODIUM tvrdé tobolky (loperamidi hydrochloridum) Tento přípravek je dostupný bez lékařského předpisu. Přesto
Příloha č. 1 ke sdělení sp.zn. sukls139104/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE IMODIUM tvrdé tobolky (loperamidi hydrochloridum) Tento přípravek je dostupný bez lékařského předpisu. Přesto
Příbalová informace: informace pro uživatele. DULCOLAX 10 mg čípky bisacodylum
 sp. zn. sukls69505/2016 Příbalová informace: informace pro uživatele DULCOLAX 10 mg čípky bisacodylum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp. zn. sukls69505/2016 Příbalová informace: informace pro uživatele DULCOLAX 10 mg čípky bisacodylum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele AESCIN-TEVA. 20 mg, enterosolventní tablety. escinum alfa
 sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
