Gastroenterologie a hepatologie
|
|
|
- Dana Tomanová
- před 6 lety
- Počet zobrazení:
Transkript
1 Gastroenterologie a hepatologie Gastroenterology and Hepatology asopis eské gastroenterologické spole nosti, eské hepatologické spole nosti, Slovenskej gastroenterologickej spolo nosti a Slovenskej hepatologickej spolo nosti Vydává LS JEP indexed in SCOPUS, CHEMICAL TITLES, EXCERPTA MEDICA/EMBASE, CHEMICAL ABSTRACTS, INIS Atomindex, Food Science and Technology Abstracts, Bibliographia Medica echoslovaca Doporu ený postup eské hepatologické spole nosti LS JEP pro dia gnostiku a lé bu akutních porfyrií Czech Society of Hepatology guidelines for dia gnosis and treatment of acute porphyrias R. Br ha, L. Vítek, J. Šperl, P. Urbánek ISSN - (Print); ISSN - X (On-line) reprint duben ro ník íslo
2
3 Hereditárny angioedém Hepatologie: ako prí ina doporu ené bolestí postupy brucha doi:. /amgh Doporu ený postup eské hepatologické spole nosti LS JEP pro dia gnostiku a lé bu akutních porfyrií Czech Society of Hepatology guidelines for dia gnosis and treatment of acute porphyrias R. Br ha, L. Vítek,, J. Šperl, P. Urbánek IV. interní klinika klinika gastroenterologie a hepatologie. LF UK a VFN v Praze Ústav léka ské bio chemie a laboratorní dia gnostiky,. LF UK a VFN v Praze Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha Interní klinika. LF UK a ÚVN Praha Úvod Porfyrie jsou vzácné metabolické choroby zp sobené vrozeným enzymatickým defektem nebo získanou poruchou syntézy hemu. D sledkem enzymatického defektu je zvýšená tvorba porfyrin, porfyrinogen i jejich prekurzor vedoucí k jejich hromad ní ve tkáních, p ípadn ke zvýšenému vylu ování do mo i a stolice [ ]. Defekt m že být na jakémkoli stupni syntézy hemu a v závislosti na konkrétním postižení se porfyrie mohou manifestovat r znými klinickými symp tomy (kožními, b išními, jaterními, neurologickými, psychiatrickými, kardiovaskulárními aj.). Základní d lení porfyrií dle klinického pr b hu je na akutní a chronické. Mezi klinicky významné akutní porfyrie pat í v R: akutní intermitentní porfyrie (AIP), variantní porfyrie (VP) a hereditární koproporfyrie (HCP). Všechny mají autozomáln dominantní d di nost a podobný pr b h s akutními atakami. Prevalence akutních porfyrií je cca :, vykazuje velkou geogra- ckou rozdílnost a ast ji jsou postiženy ženy [ ]. Akutní intermitentní porfyrie AIP je klinicky nej ast jší porfyrií v R s prevalencí cca :. Dia gnóza Laboratorní dia gnostika Vyšet ovací algoritmus p i podez ení na porfyrickou nemoc V zásad je nutné odlišovat t i základní klinické situace:. Podez ení na chronické porfyrie, v našich podmínkách se jedná prakticky pouze o PCT (porphyria cutaakutní porfyrie je v tšinou složitá, nebo všechny symp tomy jsou nespecifické a onemocn ní je pom rn vzácné [ ]. První manifestace v tšinou bývá u mladších jedinc (mezi. a. rokem) a je extrémn vzácná p ed pubertou. Mezi jednotlivými atakami pa cienti v tšinou nemají žádné obtíže. AIP se m že projevit r znými symptomy: b išními (intermitentní difuzní bolesti b icha, kolikovité bolesti, zvracení, ileózní stavy, n kdy úporná zácpa), neurologickými (parestezie, periferní parézy i plegie vedoucí až k respira ní insu cienci, parézy i plegie hlavových nerv, bolesti hlavy, epilepsie, zmatenost, porucha v domí, k e e, poruchy polykání, mo ová retence i inkontinence), psychiatrickými (agitace, nespavost, halucinace, neurózy, p íznaky psychóz a depresí), kardiovaskulárními (tachykardie, hypertenze, arytmie, zm ny na EKG), laboratorními (hyponatremie), p i atace m že být p ítomna tmavá mo (oranžová, ervená), akutní ataka VP a HCP m že být navíc provázena bulózními kožními pro- jevy na k ži exponované UV sv tlu (fotosenzitivita), do klinického obrazu akutních porfyrií nepat í jaterní léze. Akutní ataka je asto zp sobena n kte rým z vyvolávajících faktor : léky v tšinou nov nasazená medikace (antibio tika, kontraceptiva, analgetika) viz seznam rizikových a bezpe ných lék [, ], alkohol, hladov ní (cílené hubnutí, zm na dietních návyk, vynucené hladov ní p i onemocn ní gastrointestinálního traktu), hormonální zm ny p edevším zvýšený progesteron p i menstrua ním cyklu, stres, infekce, opera ní zákrok. Gastroent Hepatol 2017; 71(2):
4 Hereditárny Doporu ený angioedém postup eské ako hepatologické prí ina bolestí spole nosti brucha LS JEP pro dia gnostiku a lé bu akutních porfyrií Tab.. Základní laboratorní nálezy u jednotlivých typ porfyrií. Tab.. Basic laboratory ndings in di erent type of porphyrias. ALA PBG Odpad celkových porfyrin PCT v norm v norm > g/ hod ataka akutní porfyrie zvýšení zvýšení > g/ hod akutní porfyrie v remisi v norm v norm v norm sekundární koproporfyrinurie v norm v norm g/ hod otrava olovem zvýšení v norm > g/ hod PCT porphyria cutanea tarda, ALA kyselina -aminolevulová, PBG porfobilinogen nea tarda). Nemoc se manifestuje bu kožními p íznaky nebo jako jaterní léze nejasné etiologie. Ve sbírané mo i nacházíme vysoký odpad celkových porfyrin p i normálních hladinách kyseliny -aminolevulové (ALA) a porfobilinogenu (PBG) v erstvé ran ní mo i.. Ataky akutních porfyrií, p i kterých dochází k elevaci všech t í základních analyt, tedy ALA a PBG v erstvé ran ní mo i i k elevaci odpadu celkových porfyrin v mo i sbírané.. Nález u pa cient mimo ataku, který m že být prakticky normální. Pokud však máme klinické podez ení (nap. na základ typických anamnestických údaj ), je vhodné provést chromatografické vyšet ení porfyrin ve vzorku stolice a vyšet ení emisního maxima plazmatických porfyrin. U všech pa cient s odpadem mo- ových porfyrin nad g/ l se provádí frakcionace mo ových porfyrin vysokoú in nou kapalinovou chromatografií (HPLC high performance liquid chromatography). K odlišení akutních porfyrií stanovujeme emisní maximum plazmatických porfyrin. K dispozici je i stanovení aktivit enzym bio syntetické dráhy porfyrin v erytrocytech. Laboratorní i klinický obraz podobný atace akutní porfyrie m že být sou- ástí otravy olovem [ ]. Olovo v organizmu mimo jiné inhibuje enzymy podílející se na syntéze hemu (zejména ALA-dehydratázu). Postižené osoby mají vyšší hodnoty -ALA a koproporfyrinu III v mo i (p i normálních hodnotách PGB v mo i), normocytární normochromní anémii s typickým bazo lním te kováním erytrocyt a p edevším vysoké hodnoty olova v séru i v mo i. Stejn tak je t eba odlišit od skute né porfyrie tzv. sekundární koproporfyrinurii. Vyšší hodnoty koproporfyrin v mo i mohou provázet mnoho chronických jaterních onemocn ní i jiných chorobných stav (nej ast ji se jedná o pa cienty s jaterní chorobou p i chronickém abúzu alkoholu). Takoví pa cienti nemají žádné p íznaky porfyrie a izolovaná koproporfyrinurie je jedinou abnormitou metabolizmu porfyrin. Typické výsledky základních vyšet- ení shrnuje tab.. Jednotlivé laboratorní metody používané v dia gnostice porfyrií Metody základní (m ly by být k dispozici na každém odd lení klinické bio chemie krajského typu):. Stanovení PBG a ALA v erstvé ranní mo i: PBG i ALA jsou markery ataky akutní porfyrie; vyšet ení se provádí z ml erstvé mo i; oba analyty jsou citlivé na sv tlo, teplo, dobu skladování a výkyvy ph; referen ní rozmezí: PBG <, mg/ dl, ALA <, mg/ dl.. Stanovení celkových porfyrin v mo i sbírané hod a ve vzorku stolice: odpad celkových porfyrin mo í je markerem akutní i chronické porfyrické choroby i sekundární koproporfynurie; porfyriny jsou op t citlivé na teplo a sv tlo, mo je t eba sbírat do nádoby obalené alobalem a uchovávat v chladu, pro stanovení je pot eba alespo ml mo i/ g stolice; referen ní rozmezí celkové porfyriny v mo i < g/ hod, ve stolici < ng/ g sušiny. Metody speciální (k dispozici v Hepatologické laborato i Ústavu léka ské bio chemie a laboratorní dia gnostiky,. LF UK a VFN v Praze):. Stanovení emisního maxima plazmatických porfyrin : principem stanovení je využití uorescence porfyrin ; porfyriny po excitaci sv tlem o vlnové délce nm erven fluoreskují, vlnová délka emitovaného sv tla je pak charakteristická pro jednotlivé porfyrie.. HPLC frakcionace porfyrin v mo i a ve stolici: vyšet ení se provádí v ml sbírané mo i/ g stolice, bio logický materiál je možné skladovat do m síce p i C.. K dispozici jsou i vyšet ení enzymových aktivit, stanovení volného a Zn-protoporfyrinu, event. molekulární dia gnostika. Lé ba ataky akutní porfyrie Lé ba závisí na závažnosti stavu. Speci- cká lé ba je indikována jen u pa cient s klinickými p íznaky akutní ataky a sou asn zvýšenou exkrecí ALA/ PBG do mo i [, ]. Mírná forma akutní ataky Mírná forma akutní ataky (nap. mírné bolesti bez dalších komplikací, jako je zvracení, hyponatremie i neuro- Gastroent Hepatol 2017; 71(2):
5 Doporu ený postup eské hepatologické spole nosti Hereditárny LS JEP pro angioedém dia gnostiku ako a lé bu prí ina akutních bolestí porfyrií brucha logické projevy) m že být zvládnuta zvýšením perorálního p íjmu cukr (slazené nápoje a vysokoenergetická strava) po dobu hod a odstran ním p ípadné vyvolávající p í iny. V ostatních p ípadech by m la být zvážena specifická lé ba hemarginátem [ ] a další podp rná lé ba. Závažn jší forma akutní ataky Pa cienti s akutní atakou porfyrie by m li být v p ípad neurologických komplikací (k e e, respira ní insuficience, porucha v domí), t žké hyponatremie (pod m mol/ l) i srde ních arytmií hospitalizováni na JIP. Zásadním opat ením je odstran ní i lé ba možných spoušt cích faktor (rizikové léky, infekce) a vylou ení jiné p í iny obtíží (apendicitida, cholecystitida, t hotenství apod.). Lé ba hemarginátem Speci ckým lékem akutní ataky porfyrie je hemarginát v nitrožilním podání (Normosang ), který zp tnovazebn snižuje aktivitu ALA-syntázy. Podání hemarginátu je indikováno v t žších stavech (protrahované a silné bolesti, zvracení, hyponatremie, k e e, psychóza kardiovaskulární projevy a p edevším neuropatie) [ ]. Hemarginát se podává ve form nitrožilní infuze v dávce mg/ kg/ den, v tšinou dny po sob. Samotnou infuzi i infuzní set je t eba chránit p ed sv tlem (alobalová fólie). Hemarginát dráždí žilní st nu a opakované podávání periferní intravenózní kanylou vede k destrukci povrchových žil na horních kon etinách. Po aplikaci infuze je nutné kanylu dostate n propláchnout (alespo ml fyziologického roztoku, zprvu bolus po ml a zbytek v infuzi), poté kanylu odstranit a další infuzi podat z jiného místa. Riziko poškození žilní st ny se týká i podání do centrálních žil. Riziko poškození žilní st ny lze pravd podobn snížit na ed ním hemarginátu v albuminu ( %) namísto ve fyziologickém roztoku. Bylo popsáno podání hemarginátu i u t hotných a považuje se v této situaci za bezpe né. Analgetická lé ba K analgezii mohou být podávány opiáty (mor n i fentanyl), nesmí být podán petidin. P ed podáním jakéhokoli léku je však vhodné si ov it jeho bezpe nost v b žn dostupných databázích (viz výše). Opiáty by nem ly být podávány mimo nemocni ní za ízení. Lé ba nauzey a zvracení Nauzea a zvracení mohou být tlumeny ondansetronem. Lé ba kardiálních komplikací Hypertenze a tachykardie atenololem, propranololem i labetalolem, k e e diazepamem (s ur itými výhradami) i magnézium sulfátem. Lé ba dalších komplikací Úzkosti i agitace m že být lé ena chlorpromazinem. Podávání chlorpromazinu bylo d íve (p i nedostupnosti hemarginátu) doporu ováno jako standardní sou ást lé by akutní ataky porfyrie. Lé ba hyponatremie Je t eba dbát na dodržování vodní bilance a úpravu p ípadné hyponatremie (vzniká až u % pa cient s atakou akutní porfyrie; p í inou m že být syndrom nep im ené sekrece antidiuretického hormonu i ztráty natria ledvinami a zažívacím ústrojím). Úprava hyponatremie by m la být pomalá (vzestup sérové hodnoty natria o m mol/ l za hod), používá se nap. fyziologický roztok. Monitorace vitálních funkcí Vhodná je monitorace EKG, monitorace saturace kyslíku, kontroly krevního tlaku ve ty ech hodinových intervalech, monitorace neurologických funkcí den n. Nutné jsou pravidelné kontroly krevních minerál, glykemie, acidobazické rovnováhy, krevního obrazu. V p ípad pot eby zajistit odpovídající enterální i parenterální výživu. Lé ba zvýšeným p íjmem cukr Zvýšený p íjem cukr býval standardním postupem p ed zavedením hemarginátu do klinické praxe (glukóza také áste n tlumí aktivitu ALA-syntázy). Dnes se v tšinou jedná o zvýšený perorální p íjem potravin a nápoj s vysokým obsahem cukr u pa cient s lehkým pr b hem ataky (viz výše). Nitrožilní podání glukózy m že paradoxn zhoršit hyponatremii a se zavedením hemarginátu do lé by ztratilo z v tší ásti sv j význam. Speci cké situace Progresivní neuropatie (v tšinou navazuje na b išní symp tomatologii a m že vést k t žkým parézám až k respira ní insu cienci) je absolutní indikací k okamžitému podání hemarginátu. U t chto pa cient je po zvládnutí akutní ataky nutná dlouhodobá rehabilita ní lé ba. Neuropatické bolesti lze tlumit gabapentinem. Plný ústup neurologických obtíží (bolesti a parestezie) trvá m síce a n kdy mohou obtíže z stat trvale. Prognóza Prognóza je dobrá p i asné dia gnóze a ádné lé b první ataky s následným d sledným vyvarováním se všech možných spoušt cích faktor a asné lé b p ípadné další ataky. Rodin ní p íslušníci postiženého jedince, u kterých byla genetickým screeningem zjišt na patologická mutace, by se m li vyvarovat obecn známých spoušt cích mechanizm a m li by být informováni o možných p íznacích akutní ataky. Vhodná je také dispenzarizace ve specializovaných centrech. Kontakty Biochemická dia gnostika Laborato pro výzkum nemocí jater a metabolizmu hemu Ústav léka ské bio chemie a laboratorní dia gnostiky Gastroent Hepatol 2017; 71(2):
6 Hereditárny Doporu ený angioedém postup eské ako hepatologické prí ina bolestí spole nosti brucha LS JEP pro dia gnostiku a lé bu akutních porfyrií. LF UK a VFN v Praze Na Bojišti Praha tel.: vitek@cesnet.cz (prof. MUDr. L. Vítek, Ph.D.) Molekulární dia gnostika Laborato pro studium mitochondriálních poruch Klinika d tského a dorostového léka ství. LF UK a VFN v Praze Ke Karlovu Praha tel.: Klinické konzultace IV. interní klinika. LF UK a VFN v Praze tel.: bruha@cesnet.cz (prof. MU Dr. R. Br ha, CSc.) Interní klinika. LF UK a ÚVN Praha tel.: petr.urbanek@uvn.cz (prof. MU Dr. P. Urbánek, CSc.) Klinika hepatogastroenterologie Transplantcentrum, IKEM, Praha tel. jan.sperl@ikem.cz (MU Dr. J. Šperl, CSc.) Poznámka Hemarginát je v R dostupný v podob preparátu Normosang mg/ ml ( ml v balení). Preparát má v R platnou registraci (kód SÚKL ), nemá stanovenou úhradu z ve ejného zdravotního pojišt ní. Podání léku je možné po p edchozím schválení revizním léka em p íslušné zdravotní pojiš ovny (Povolení úhrady LP dle zákona. / Sb., o ve ejném zdravotním pojišt ní). Literatura. Meyer UA, Strand LJ, Doss M et al. Intermittent acute porphyria demonstration of a genetic defect in porphobilinogen metabolism. N Engl J Med ; ( ):.. Elder G, Harper P, Badminton M et al. The incidence of inherited porphyrias in Europe. J Inherit Metab Dis ; ( ):. doi:. / s Ehrmann J, H lek P (eds). Hepatologie. Praha: Grada Publishing :.. Welsh Medicines Information Centre. Drugs that are considered to be SAFE for use in the acute porphyrias. [online]. Available from: wp- -content/ uploads/ / / -porphyria-safe-list-final.pdf.. European Porphyria Network. Available from: / porphyria.eu/ en/ content/ home.. War ren MJ, Cooper JB, Wood SP et al. Lead poisoning, haem synthesis and -aminolaevulinic acid dehydratase. Trends Biochem Sci ; ( ):.. Pischik E, Kauppinen R. An update of clinical management of acute intermittent porphyria. Appl Clin Genet ; :. doi:. / TACG.S.. Kauppinen R. Porphyrias. Lancet ; ( ):.. Her rick AL, McColl KE, Moore MR et al. Control led trial of haem arginate in acute hepatic porphyria. Lancet ; ( ):.. Stein P, Badminton M, Barth J et al. Best practice guidelines on clinical management of acute attacks of porphyria and their complications. Ann Clin Biochem ; (Pt ):. doi:. /. Auto i deklarují, že v souvislosti s p edm tem studie nemají žádné komer ní zájmy. The authors declare they have no potential con icts of interest concerning drugs, products, or services used in the study. Redak ní rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských asopis. The Editorial Board declares that the manuscript met the ICMJE uniform requirements for biomedical papers. Doru eno/ Submitted:.. P ijato/ Accepted:.. prof. MU Dr. Radan Br ha, CSc. IV. interní klinika klinika gastroenterologie a hepatologie. LF UK a VFN v Praze U Nemocnice, Praha bruha@cesnet.cz Gastroent Hepatol 2017; 71(2):
7
8 Léčba akutních záchvatů jaterních porfýrií (akutní intermitentní porfýrie, porfýrie variegata, hereditární koproporfýrie) Léčbu přípravkem Výdej lé ivého p ípravku je vázaný na léka ský p edpis. Každá oprávn ná žádost léka e o tento lé ivý p ípravek je hrazena ze zdravotního pojišt ní. Aktuálni informace o výši úhrady ze zdravotního pojišt ní naleznete na nebo u konkrétní zdravotní pojiš ovny. Další informace o tomto p ípravku získáte u místního zástupce pro eskou republiku na telefonním ísle: , nebo prost ednictvím mailboxu: InfoCzechia@orphan-europe.com. Jakékoliv podez ení na závažný nebo neo ekávaný nežádoucí ú inek a jiné skute nosti závažné pro zdraví lé ených osob nahlaste na farmakovigilan ní odd lení OrphanEurope do mailboxu: PVCzechia@orphan-europe.com, tel.: , nebo prost ednictvím národního systému hlášení nežádoucích ú ink na adresu: Státní ústav pro kontrolu lé iv, Odd lení farmakovigilance, Šrobárova 48, Praha 10, Tel.: , Fax: , farmakovigilance@sukl.cz. Hlášení je možné zasílat pomocí tišt ného nebo elektronického formulá e dostupného na webových stránkách SÚKL, vše pot ebné najdete na: Literatura: 1. Hift R The acute porphyrias. European Gastroenterology & Hepatology. Volume 8 Issue 1 Spring zahajte okamžitě nebo co nejdříve po nástupu záchvatu. 1 V případě časné intervence zabrání rozvoji vážných komplikací, např. motorické neuropatie a encefalopatie. 1 SOUHRN ÚDAJ O P ÍPRAVKU 1. NÁZEV P ÍPRAVKU Normosang 25 mg/ml, koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lidský hemin 25 mg/ml. Jedna ampulka o objemu 10 ml obsahuje 250 mg lidského heminu. Po na ed ní jedné 10ml ampulky ve 100 ml 0,9% roztoku NaCl obsahuje na ed ný roztok 2273 mikrogram lidského heminu na jeden ml. Pomocná látka se známým ú inkem: ethanol 96 % (1 g/10 ml) (viz bod 4.4). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Koncentrát pro infuzní roztok. Normosang je tmav zbarvený koncentrát pro infuzní roztok. 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Lé ba akutních záchvat jaterní porfyrie (akutní intermitentní porfyrie, porphyria variegata, hereditární koproporfyrie) Dávkování a zp sob podání Dávkování Doporu ená denní dávka je 3 mg/kg jednou denn po dobu ty dn, na ed ná ve 100 ml 0,9% chloridu sodného ve sklen né láhvi a podávaná intravenózní infuzí po dobu alespo 30 minut do velké p edloketní nebo centrální žíly s použitím vloženého ltru. Dávka nemá p ekro it 250 mg (1 ampulka) denn. Výjime n m že být lé ebná kúra za p ísného biochemického dozoru opakována, pokud je na první lé ebnou kúru nedostate ná reakce. Starší pacienti Není nutná žádná úprava dávky. D ti a dospívající Záchvaty porfyrie jsou u d tí vzácné, ale omezené zkušenosti s tyrosinemií sv d í pro to, že je bezpe né použít dávku nep esahující 3 mg/kg denn po dobu 4 dn, podávanou za stejných bezpe nostních opat ení jako u dosp lých pacient. Zp sob podání Infuze je nutné podávat do velké p edloketní nebo centrální žíly po dobu alespo 30 minut. Po infuzi je t eba žílu propláchnout 100 ml 0,9% NaCl. Doporu uje se nejprve vypláchnout žílu 3 až 4 bolusovými injekcemi 10 ml 0,9% NaCl, po kterých m že být zbývající objem fyziologického roztoku infundován po dobu minut. Návod na p ípravu roztoku je uveden v bod Kontraindikace Hypersenzitivita na lé ivou látku nebo na kteroukoli pomocnou látku uvedenou v bod Zvláštní upozorn ní a opat ení pro použití P ed zahájením lé by je nutné potvrdit záchvat jaterní porfyrie adou klinických a biologických kritérií: - p esv d ivá rodinná nebo osobní anamnéza, - p esv d ivé klinické známky, - kvantitativní stanovení kyseliny delta-aminolevulové a porfobilinogenu v mo i (p ednostn oproti klasickým test m podle WATSONA-SCHWARZE nebo HOESCHA, které jsou považovány za mén spolehlivé). ím d íve po za átku záchvatu se zahájí lé ba p ípravkem Normosang, tím vyšší je její ú innost. Výsledkem podávání infuzí p ípravku Normosang je to, že bolesti b icha a další gastrointestinální p íznaky obvykle b hem 2-4 dn vymizí. Neurologické komplikace (paralýza a psychické poruchy) jsou lé bou ovlivn ny mén. Protože porfyrické záchvaty jsou asto spojeny s r znými kardiovaskulárními a neurologickými manifestacemi, je t eba zajistit vhodné sledování pacienta. Je také d ležité varovat pacienty p ed rizikem, že záchvaty jsou zhoršovány i vyvolávány hladov ním nebo užíváním ur itých lé ivých p ípravk (zejména estrogen, barbiturát a steroid ), protože tyto p ípravky jsou schopny nep ímo indukovat aktivitu syntetázy kyseliny delta-aminolevulové prost ednictvím zvýšených požadavk jater na hem. Protože na ed ný roztok je hypertonický, musí být podáván pouze velmi pomalou intravenózní infuzí. Aby se zabránilo podrážd ní žíly, je nutné podávat infuzi po dobu alespo 30 minut do velké žíly na p edloktí nebo do centrální žíly. Po podání p ípravku Normosang m že v žíle použité pro infuzi dojít k žilní trombóze. N kolik p ípad popisuje trombózu dutých žil a jejich hlavních p ítok (ky elních a podklí kových žil). Riziko trombózy dutých žil nelze vylou it. Po opakovaných infuzích byly hlášeny zm ny periferních žil, které mohou zabránit použití postižených žil pro podávání dalších infuzí, což vyžaduje použití centrální žilní linky. Proto se doporu uje po infuzi propláchnout žílu 100 ml 0,9% NaCl. Pokud bude intravenózní kanyla zavedena p íliš dlouho, mechanické drážd ní a rovn ž iritace injek ní tekutinou mohou zp sobit vaskulární poškození, které m že vést k extravazaci. P ed infuzí p ípravku Normosang kanylu vyzkoušejte a b hem infuze ji pravideln kontrolujte. V p ípad extravazace m že dojít ke kožní diskoloraci. Po opakovaných infuzích byly hlášeny zvýšené koncentrace sérového feritinu. Proto se doporu uje, aby byl sérový feritin m en v pravidelných intervalech pro monitorování zásob železa v organismu. Pokud je to zapot ebí, je nutné provést další vyšet ovací metody a u init terapeutická opat ení. Tmavá barva p ípravku Normosang m že dát plazm neobvyklé zbarvení. Mezi standardní opat ení k p edcházení infekcí z lé ivých p ípravk p ipravených z lidské krve nebo plazmy pat í selekce dárc, vyšet ení darovaných krevních dávek na speci cké markery infekcí a ú inné kroky k inaktivaci a odstran ní vir p i výrob. Navzdory tomu nelze p i podávání lé ivých p ípravk p ipravených z lidské krve nebo plazmy p enos infek ních zárodk zcela vylou it. To také platí pro neznámé nebo nov vznikající viry a jiné patogeny. Uvedená opat ení jsou považována za ú inná k prevenci obalených vir, nap íklad HIV, HBV a HCV. D razn doporu ujeme p i každém podání p ípravku Normosang pacientovi zaznamenat název a. šarže výrobku, aby tak bylo možno dohledat, jaká šarže byla komu podána. Normosang obsahuje 1 g ethanolu (96 %) na 10ml ampulku. To m že být škodlivé pro pacienty trpící onemocn ním jater, alkoholismem, epilepsií, poškozením nebo onemocn ním mozku, a také pro t hotné ženy a pro d ti. Obsah ethanolu v p ípravku Normosang m že modi kovat nebo zvýšit ú inek dalších lé iv. Normosang nemá být použit jako preventivní lé ba, protože dostupné údaje jsou p íliš omezené a dlouhodobé podávání pravidelných infuzí nese riziko p etížení železem (viz bod 4.8. Nežádoucí ú inky). Jako dopln k lé by p ípravkem Normosang a jiných nezbytných opat ení, jako je eliminace vyvolávacích faktor, se doporu uje zajistit dostate ný p ísun sacharid Interakce s jinými lé ivými p ípravky a jiné formy interakce B hem lé by p ípravkem Normosang se zvyšuje enzymová aktivita enzym P450. Metabolismus sou asn podávaných lék, které jsou metabolizovány cytochromovými enzymy P450 (jako nap íklad estrogeny, barbituráty a steroidy), se m že b hem podávání p ípravku Normosang zvýšit, což vede k nižší systémové expozici Fertilita, t hotenství a kojení T hotenství Speci cké experimentální a klinické údaje nejsou dispozici, a proto rizika b hem t hotenství nejsou de nována; nicmén doposud nebyly pozorovány u novorozenc, jejichž matky byly lé eny p ípravkem Normosang b hem t hotenství, žádné následky. Kojení Ú inky p ípravku Normosang nebyly ov ovány b hem kojení. Ale protože je do mate ského mléka vylu ováno mnoho látek, je p i podávání p ípravku Normosang b hem kojení vhodné dodržovat opatrnost. Pro omezené údaje není možné doporu it podávání p ípravku Normosang b hem t hotenství a kojení, pokud to není nezbytn nutné Ú inky na schopnost ídit a obsluhovat stroje Neexistuje žádný d kaz, který sv d í pro to, že Normosang nep ízniv ovliv uje schopnost ídit nebo obsluhovat stroje Nežádoucí ú inky Nej ast ji hlášené nežádoucí ú inky jsou reakce v míst infuze, které se objevují zejména tehdy, jestliže se infuze podává do žil, které jsou p íliš malé (viz bod 4.4. Zvláštní upozorn ní a opat ení pro použití). Hlášené nežádoucí ú inky jsou uvedeny níže podle t ídy orgánových systém a podle frekvence. Frekvence jsou de novány takto: velmi asté ( 1/10) asté ( 1/100 až <1/10), mén asté ( 1/1000 až <1/100), vzácné ( 1/10000 až < 1/1000), velmi vzácné (<1/10000), není známo (z dostupných údaj nelze ur it). Poruchy imunitního systému Vzácné: anafylaktoidní reakce, p ecitliv lost (jako nap íklad poléková dermatitida a edém jazyka). Poruchy nervového systému Není známo: bolesti hlavy Cévní poruchy Velmi asté: špatný žilní p ístup Není známo: trombóza v míst vpichu, žilní trombóza Celkové poruchy a reakce v míst aplikace asté: ebitida v míst infuze, bolest v míst infuze, otok v míst infuze Vzácné: pyrexie Není známo: erytém v míst vpichu, pruritus v míst vpichu, extravazace, nekróza v míst vpichu Vyšet ení Mén asté: zvýšená hladina sérovéhu feritinu Není známo: zvýšená hladina kreatininu v krvi Po n kolika letech lé by opakovanými infuzemi byly hlášeny zvýšené koncentrace sérového feritinu, což m že ukazovat na p etížení železem (viz bod 4.4. Zvláštní upozorn ní a opat ení pro použití). Poruchy k že a podkožní tkán Není známo: kožní diskolorace Hlášení podez ení na nežádoucí ú inky Hlášení podez ení na nežádoucí ú inky po registraci lé ivého p ípravku je d ležité. Umož uje to pokra ovat ve sledování pom ru p ínos a rizik lé ivého p ípravku. Žádáme zdravotnické pracovníky, aby hlásili podez ení na nežádoucí ú inky na adresu: Státní ústav pro kontrolu lé iv Šrobárova Praha 10 Webové stránky: P edávkování V pokusech na zví atech s p ípravkem Normosang byly akutní toxické ú inky po podávání vysokých dávek namí eny proti játr m. Celkové dávky desetkrát vyšší než dávky doporu ované pro podávání u lov ka také snížily krevní tlak laboratorních potkan. Vysoké dávky mohou zp sobit poruchy hemostázy. Normosang obsahuje 4000 mg propylenglykolu na ampulku o objemu 10 ml. Propylenglykol ve vysokých dávkách m že vyvolat nežádoucí ú inky na centrální nervový systém, laktátovou acidózu, renální a hepatální toxicitu, zvýšení osmolarity plazmy a hemolytické reakce. Byly hlášeny p ípady p edávkování p ípravkem Normosang. Nap íklad jeden pacient zaznamenal slabé zvracení, bolest a citlivost p edloktí (na míst infuze) a jeho uzdravování probíhalo bez komplikací. Jiný pacient, kterému bylo podáno 10 ampulek p ípravku Normosang (2500 mg lidského heminu) v jediné infuzi, zaznamenal fulminantní selhání jater, u dalšího pacienta s d ív jšími záznamy chronického selhání jater, kterému byly podány 4 ampulky p ípravku Normosang (1000 mg lidského heminu) nastalo akutní selhání jater s nutnou transplantací jater. Jeden pacient dostával 12 ampulek p ípravku Normosang (3000 mg lidského heminu) b hem dvou dn, což m lo za následek hyperbilirubinemii, anemii a generalizovanou hemoragickou diatézu. Ú inky p etrvávaly n kolik dn po podávání, ale pacient se poté zotavil bez následk. Bylo také hlášeno, že vysoká dávka (1000 mg) hematinu, jiné formy hemu, vyvolala u jednoho pacienta p echodné renální selhání. Je nutné pe liv monitorovat parametry krevní koagulace, hepatální, renální a pankreatické funkce až do jejich normalizace. Je t eba také provád t kardiovaskulární monitorování (možnost arytmií). Lé ebná opat ení - Pro vazbu voln cirkulujícího a potenciáln reaktivního heminu se mají podávat infuze albuminu. - Podávání aktivního uhlí umožní p erušit enterohepatální ob h hemu. - Pro eliminaci propylenglykolu je nutná hemodialýza. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: jiné hematologické p ípravky, ATC kód: BO6AB. Hem-arginát je indikován u jaterních porfyrií (akutní intermitentní porfyrie, porphyria variegata a hereditární koproporfyrie). Tyto porfyrie jsou charakterizovány výskytem enzymatického bloku v dráze biosyntézy hemu, což má za následek: 1) de cit hemu nezbytného pro syntézu r zných hemoprotein. 2) hlavn akumulaci prekurzor hemu p ed metabolickým blokem, tyto prekurzory jsou pro organismus p ímo nebo nep ímo toxické. Podávání heminu snížením de citu hemu potla uje zp tnou vazbou aktivitu syntetázy delta-aminolevulové kyseliny (klí ového enzymu v syntéze porfyrin ), což snižuje produkci porfyrin a toxických prekurzor hemu. Proto tedy p isp ním k znovunastolení normálních hladin hemoprotein a respira ních pigment koriguje hem biologické poruchy pozorované u pacient s porfyrií. Protože biologická dostupnost hem- arginátu je srovnatelná s dostupností methemalbuminu, p irozené formy transportu hemu, je toto ú inné jak b hem remise, tak b hem akutního záchvatu. V obou p ípadech, ale obzvlášt b hem akutního záchvatu, je pravd podobné, že infuze heminu upraví mo ové vylu ování kyseliny delta-aminolevulové a porfobilinogenu, dvou hlavních prekurzor, jejichž akumulace je charakteristickým rysem onemocn ní. Toto platí jak pro akutní intermitentní porfyrii tak pro porphyria variegata. Na rozdíl od starších galenických p ípravk infuze hem-arginátu nevyvolávají u zdravých dobrovolník žádné závažné zm ny v parametrech koagulace a brinolýzy. Bylo prokázáno, že všechny tyto parametry z stávají nezm n né s výjimkou koncentrací faktor IX a X, které do asn poklesly o 10 až 15 % Farmakokinetické vlastnosti Po intravenózní infuzi heminu (3 mg/kg) byly farmakokinetické parametry (pr m r ± SD) pozorované u zdravých dobrovolník a pacient s porfyrií následující: - C(o) 60,0 ± 17 g/ml - Elimina ní polo as (t½) 10,8 ± 1,6 hodin - Celková plazmatická clearance 3,7 ± 1,2 ml/min - Distribu ní objem 3,4 ± 0,9 l Po opakovaných infuzích se polo as hemu v organismu zvyšuje; po 4. infuzi se prodlouží na 18,1 hodiny P edklinické údaje vztahující se k bezpe nosti Neklinické údaje získané na základ farmakologických studií bezpe nosti, toxicity po jednorázovém a opakovaném podávání, mutagenity a imunogenity neodhalily žádné zvláštní riziko pro lov ka. Protože p ípravek Normosang je lidského p vodu, nemá smysl provád t neklinické studie s dlouhodobou lé bou, proto tedy kancerogenní potenciál a reproduk ní toxicita nebyly zkoumány. 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Arginin, ethanol 96%, propylenglykol, voda na injekci Inkompatibility Tento lé ivý p ípravek nesmí být mísen s jinými lé ivými p ípravky s výjimkou t ch, které jsou uvedeny v bod Doba použitelnosti 2 roky. Po na ed ní roztok použijte do 1 hodiny Zvláštní opat ení pro uchovávání Uchovávejte v chladni ce (2 C - 8 C). Uchovávejte ampulku v krabi ce, aby byl p ípravek chrán n p ed sv tlem. Podmínky uchovávání tohoto lé ivého p ípravku po jeho na ed ní jsou uvedeny v bod Druh obalu a obsah balení 10 ml roztoku v ampulce (sklen ná, typ I) balení po 4 ks Zvláštní opat ení pro likvidaci p ípravku P íprava roztoku Normosang, poskytovaný v ampulkách, se má na edit bezprost edn p ed podáváním ve 100 ml 0,9% roztoku NaCl ve sklen né láhvi; požadované množství p ípravku, vypo tené podle hmotnosti pacienta, je p eneseno z ampulky do sklen né láhve. ed ní se má p ipravit ve sklen né láhvi, protože v plastové nádob z PVC je degradace heminu pon kud rychlejší. Nep ipravujte více než jednu ampulku denn. Roztok má být použit b hem jedné hodiny po na ed ní. Protože roztok p ípravku Normosang je tmav zbarvený dokonce i po na ed ní, je obtížné vizuáln ov it nep ítomnost ástic v suspenzi. Doporu uje se proto používat infuzní soupravu s ltrem. Veškerý nepoužitý lé ivý p ípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Orphan Europe Immeuble Le Wilson 70 avenue du Général de Gaulle, F Puteaux, Francie 8. REGISTRA NÍ ÍSLO(A) 80/271/06-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrac e: Datum posledního prodloužení registrace: DATUM REVIZE TEXTU
Akutní jaterní porfýrie
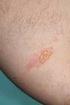 Akutní jaterní porfýrie CO DĚLAT MÁTE-LI PODEZŘENÍ NA ZÁCHVAT AKUTNÍ JATERNÍ PORFÝRIE? Mgr. Katarína Francová Orphan Drug Specialist Project Manager mobil: +420 702 211 762 e-mail: kfrancova@orphan-europe.com
Akutní jaterní porfýrie CO DĚLAT MÁTE-LI PODEZŘENÍ NA ZÁCHVAT AKUTNÍ JATERNÍ PORFÝRIE? Mgr. Katarína Francová Orphan Drug Specialist Project Manager mobil: +420 702 211 762 e-mail: kfrancova@orphan-europe.com
Akutní jaterní porfýrie
 Akutní jaterní porfýrie CO DĚLAT MÁTE-LI PODEZŘENÍ NA ZÁCHVAT AKUTNÍ JATERNÍ PORFÝRIE? Mgr. Katarína Francová Orphan Drug Specialist Project Manager mobil: +420 702 211 762 e-mail: kfrancova@orphan-europe.com
Akutní jaterní porfýrie CO DĚLAT MÁTE-LI PODEZŘENÍ NA ZÁCHVAT AKUTNÍ JATERNÍ PORFÝRIE? Mgr. Katarína Francová Orphan Drug Specialist Project Manager mobil: +420 702 211 762 e-mail: kfrancova@orphan-europe.com
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
Příbalová informace: informace pro uživatele. Normosang 25 mg/ml, koncentrát pro infuzní roztok. Lidský hemin
 Sp.zn.sukls151003/2014 Příbalová informace: informace pro uživatele Normosang 25 mg/ml, koncentrát pro infuzní roztok. Lidský hemin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls151003/2014 Příbalová informace: informace pro uživatele Normosang 25 mg/ml, koncentrát pro infuzní roztok. Lidský hemin Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
S O UH R N Ú D AJ Ů O P ŘÍPR AVK U
 sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příbalová informace. GlaxoSmithKline Biologicals S.A., Rue de l Institut 89, 1330 Rixensart, Belgie
 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml
 Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
Příbalová informace: informace pro uživatele. Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum
 Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
3. LÉKOVÁ FORMA Prášek pro perorální roztok MOVICOL je sypký bílý prášek s charakteristickou limetkovou a citronovou příchutí.
 sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 0,5 mg/ml perorální suspenze pro kočky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
Souhrn údajů o přípravku
 Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011
 Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující adjuvans MF59C.1 (Sezóna 2013/2014)
 sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
Symposium klinické biochemie FONS Diagnostika a diferenciální diagnostika porfyrií. Milan Jirsa. IKEM Praha ÚLBLD 1.
 FONS 2016 Diagnostika a diferenciální diagnostika porfyrií Milan Jirsa IKEM Praha ÚLBLD 1.LF UK Praha FONS Biosyntéza hemu 2016 Prekurzory porfyrinů Porfyrinogeny Matouš B. a kol. Základy lékařské chemie
FONS 2016 Diagnostika a diferenciální diagnostika porfyrií Milan Jirsa IKEM Praha ÚLBLD 1.LF UK Praha FONS Biosyntéza hemu 2016 Prekurzory porfyrinů Porfyrinogeny Matouš B. a kol. Základy lékařské chemie
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE. Aminoplasmal Hepa - 10% infuzní roztok
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
DIABETES MELLITUS. Diabetes dělíme na diabetes mellitus 1. typu a 2. typu, pro každý typ je charakteristická jiná příčina vzniku a jiná léčba.
 DIABETES MELLITUS Diabetes mellitus je dnes jedním z nejzávažnějších onemocnění hromadného výskytu. Diabetiků v celém světě významně přibývá. Dnes dosahuje výskyt diabetu v České republice kolem 7 %, pravděpodobně
DIABETES MELLITUS Diabetes mellitus je dnes jedním z nejzávažnějších onemocnění hromadného výskytu. Diabetiků v celém světě významně přibývá. Dnes dosahuje výskyt diabetu v České republice kolem 7 %, pravděpodobně
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Amizolmet 500 mg/ml injekční roztok. Metamizolum natricum monohydricum
 Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Použití homeopatického léčivého přípravku v uvedených terapeutických indikacích je založeno výhradně na homeopatických zkušenostech.
 sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
Akutní stavy Ztráty vody a iont byly hrazeny infúzemi glukózy nebo pitím vody. Vznikající hypoosmolalita ECT vedla k p esunu ásti vody z ECT do ICT.
 Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
Strana 1 (celkem 6 Strana 1 (celkem 6) Odd lení laboratorní medicíny nemocnice Šternberk Jívavská 20, 78516, eská Republika Tel 585087308 fax 585087306 E-mail olm@nemstbk.cz info:www.nemstbk.cz/olm ----------------------------------------------
HYPERTENZE VYSOKÝ KREVNÍ TLAK
 HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
klinické aspekty Diagnostika porfyrické nemoci - Část 2 L. Vítek Akutní porfyrie Charakteristiky porfyrií
 Diagnostika porfyrické nemoci - Část 2 L. Vítek Akutní porfyrie Jak bylo uvedeno v předchozí části sdělení v minulém čísle časopisu FONS, patří do této skupiny porfyrických chorob akutní intermitentní
Diagnostika porfyrické nemoci - Část 2 L. Vítek Akutní porfyrie Jak bylo uvedeno v předchozí části sdělení v minulém čísle časopisu FONS, patří do této skupiny porfyrických chorob akutní intermitentní
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI
 PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 41 PŘIPRAVOVANÉ ZMĚNY, KTERÉ BUDOU DOPLNĚNY DO PŘÍSLUŠNÝCH ČÁSTÍ SOUHRNU ÚDAJŮ O PŘÍPRAVKU PRO PŘÍPRAVKY OBSAHUJÍCÍ KABERGOLIN 4.2
PŘÍLOHA III DODATKY K SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACI 41 PŘIPRAVOVANÉ ZMĚNY, KTERÉ BUDOU DOPLNĚNY DO PŘÍSLUŠNÝCH ČÁSTÍ SOUHRNU ÚDAJŮ O PŘÍPRAVKU PRO PŘÍPRAVKY OBSAHUJÍCÍ KABERGOLIN 4.2
Žvýkací tableta Bílé, kulaté, bikonvexní nepotahované tablety o průměru 16 mm, které mohou mít malé skvrny.
 Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
Press kit Můžeme se zdravou stravou vyvarovat střevních zánětů?
 Press kit Můžeme se zdravou stravou vyvarovat střevních zánětů? 1 Chronické střevní problémy trápí stále více pacientů V posledních letech roste počet těch, kteří se potýkají s chronickými střevními záněty.
Press kit Můžeme se zdravou stravou vyvarovat střevních zánětů? 1 Chronické střevní problémy trápí stále více pacientů V posledních letech roste počet těch, kteří se potýkají s chronickými střevními záněty.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Merck Santé, 2, rue du Pressoir Vert, 45400 Semoy, Francie Merck, SL, Poligono Merck, 08100 Mollet Del Valles (Barcelona), Španělsko Složení
 U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
Žvýkací tablety Bílé, kulaté, bikonvexní nepotažené žvýkací tablety, které mohou mít světle žluté skvrny.
 sp.zn.sukls55165/2015; sukls229256/2015, sukls223777/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D3 500 mg/ 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
sp.zn.sukls55165/2015; sukls229256/2015, sukls223777/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D3 500 mg/ 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta
Číslo materiálu v sad :8
 St ední pr myslová škola strojnická Olomouc, t. 17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka modern Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 P írodov dné
St ední pr myslová škola strojnická Olomouc, t. 17. listopadu 49 Výukový materiál zpracovaný v rámci projektu Výuka modern Registrační číslo projektu: CZ.1.07/1.5.00/34.0205 Šablona: III/2 P írodov dné
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJU O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls187311/2014 a sp.zn.sukls124014/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gelaspan 4%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: Gelatina succinata
Sp.zn.sukls187311/2014 a sp.zn.sukls124014/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gelaspan 4%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: Gelatina succinata
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mannitol 20% w/v Intravenous Infusion BP Bieffe Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mannitolum: 200 g/l Jeden ml obsahuje 200 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mannitol 20% w/v Intravenous Infusion BP Bieffe Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mannitolum: 200 g/l Jeden ml obsahuje 200 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls68143/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zofran čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ FORMA Čípky Bílý, hladký homogenní
sp.zn. sukls68143/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zofran čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ FORMA Čípky Bílý, hladký homogenní
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls51952/2012 a sp.zn.: sukls111468/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 100 mg/ ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum
sp.zn.: sukls51952/2012 a sp.zn.: sukls111468/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 100 mg/ ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum
www.printo.it/pediatric-rheumatology/cz/intro
 www.printo.it/pediatric-rheumatology/cz/intro Behcetova nemoc Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se BN diagnostikuje? Diagnóza se stanovuje hlavně na základě klinických projevů, její potvrzení splněním
www.printo.it/pediatric-rheumatology/cz/intro Behcetova nemoc Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1 Jak se BN diagnostikuje? Diagnóza se stanovuje hlavně na základě klinických projevů, její potvrzení splněním
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
SOUHRN ÚDAJŮ O PŘĺPRAVKU
 sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
ANALERGIN NEO Potahované tablety 20 x 5 mg
 ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
Psi: Snížení mortality a klinických příznaků parvovirózy (enterické formy) psů od 1 měsíce věku.
 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
A/California/7/2009 (H1N1)pdm09, použitá varianta A/Brisbane/10/2010, divoký typ
 1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Zovirax 200 mg, Zovirax 400 mg, Zovirax 800 mg. Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aciclovirum 200 mg v jedné tabletě. Aciclovirum 400 mg v jedné
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Zovirax 200 mg, Zovirax 400 mg, Zovirax 800 mg. Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aciclovirum 200 mg v jedné tabletě. Aciclovirum 400 mg v jedné
Plánujete miminko? Připravte se včas
 Press kit Plánujete miminko? Připravte se včas 1 Několik zásad na začátek Každá nastávající maminka si prochází složitým obdobím, kdy se snaží dbát na to, aby svému tělu dodala vše potřebné pro správný
Press kit Plánujete miminko? Připravte se včas 1 Několik zásad na začátek Každá nastávající maminka si prochází složitým obdobím, kdy se snaží dbát na to, aby svému tělu dodala vše potřebné pro správný
HODNOTÍCÍ STANDARDY pro hodnocení kvality a bezpečí poskytovatele lůžkové zdravotní péče
 CQS - CZECH ASSOCIATION FOR QUALITY CERTIFICATION SECRETARIAT: Prosecká 412/74, 190 00 Praha 9 - Prosek IČ: 69346305 DIČ: CZ69346305 tel.: +420 286 019 533, +420 286 019 534 e-mail: jolsanska@cqs.cz, vfiliac@ezu.cz
CQS - CZECH ASSOCIATION FOR QUALITY CERTIFICATION SECRETARIAT: Prosecká 412/74, 190 00 Praha 9 - Prosek IČ: 69346305 DIČ: CZ69346305 tel.: +420 286 019 533, +420 286 019 534 e-mail: jolsanska@cqs.cz, vfiliac@ezu.cz
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SMLOUVA MEZI ESKOU REPUBLIKOU A JAPONSKEM O SOCIÁLNÍM ZABEZPE ENÍ LÉKA SKÁ ZPRÁVA
 SMLOUVA MEZI ESKOU REPUBLIKOU A JAPONSKEM O SOCIÁLNÍM ZABEZPE ENÍ LÉKA SKÁ ZPRÁVA Vyplní kompetentní instituce v Japonsku / lánky 13 až 19 Smlouvy / 13 19 lánek 7 Správního ujednání / ást A: Vyplní žadatel
SMLOUVA MEZI ESKOU REPUBLIKOU A JAPONSKEM O SOCIÁLNÍM ZABEZPE ENÍ LÉKA SKÁ ZPRÁVA Vyplní kompetentní instituce v Japonsku / lánky 13 až 19 Smlouvy / 13 19 lánek 7 Správního ujednání / ást A: Vyplní žadatel
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Pokyny pro zdravotnické z a ízení poskytující substitu ní lé bu (papírové hlá enky)
 Pokyny pro zdravotnické z a ízení poskytující substitu ní lé bu (papírové hlá enky) Registrace zdravotnického za ízení, které poskytuje substitu ní lé bu, do Národního registru u ivatel léka sky indikované
Pokyny pro zdravotnické z a ízení poskytující substitu ní lé bu (papírové hlá enky) Registrace zdravotnického za ízení, které poskytuje substitu ní lé bu, do Národního registru u ivatel léka sky indikované
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 1. Co je přípravek Biodroxil a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete přípravek Biodroxil užívat 3. Jak se přípravek Biodroxil užívá 4. Možné nežádoucí účinky 5. Jak přípravek
1. Co je přípravek Biodroxil a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete přípravek Biodroxil užívat 3. Jak se přípravek Biodroxil užívá 4. Možné nežádoucí účinky 5. Jak přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
Co byste měli vědět o přípravku
 Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden ml roztoku obsahuje dinatrii levofolinas 54,65 mg, což odpovídá acidum levofolinicum 50 mg.
 Sp.zn.sukls180635/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levofolic 50 mg/ml injekční nebo infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje dinatrii levofolinas
Sp.zn.sukls180635/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levofolic 50 mg/ml injekční nebo infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje dinatrii levofolinas
Příbalová informace: informace pro uživatele. Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum
 Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Možnosti sb ru dat o uživatelích drog. MUDr. B la Studni ková Hygienická stanice hl. m. Prahy Centrální pracovišt drogové epidemiologie
 Možnosti sb ru dat o uživatelích MUDr. B la Studni ková Hygienická stanice hl. m. Prahy Centrální pracovišt ové epidemiologie Základní pojmy - 1 Návykové látky alkohol, omamné látky, psychotropní látky
Možnosti sb ru dat o uživatelích MUDr. B la Studni ková Hygienická stanice hl. m. Prahy Centrální pracovišt ové epidemiologie Základní pojmy - 1 Návykové látky alkohol, omamné látky, psychotropní látky
OK Omega-3 Complete. o A 90 % DDD o D 3 100% DDD o E 40% DDD o Q10 má 60 mg
 OK Omega-3 Complete posiluje činnost srdce - kardiovaskulární systém, je více zaměřená na srdce než Gama a Omega snižuje hladinu cholesterolu i když dokáže plně nahradit léky, nemá vedlejší účinky a nevzniká
OK Omega-3 Complete posiluje činnost srdce - kardiovaskulární systém, je více zaměřená na srdce než Gama a Omega snižuje hladinu cholesterolu i když dokáže plně nahradit léky, nemá vedlejší účinky a nevzniká
Revmatická horečka a post-streptokoková reaktivní artritida
 www.printo.it/pediatric-rheumatology/cz/intro Revmatická horečka a post-streptokoková reaktivní artritida Verze č 2016 2. DIAGNOSA A TERAPIE 2.1 Jak se revmatická horečka diagnostikuje? Žádný konkrétní
www.printo.it/pediatric-rheumatology/cz/intro Revmatická horečka a post-streptokoková reaktivní artritida Verze č 2016 2. DIAGNOSA A TERAPIE 2.1 Jak se revmatická horečka diagnostikuje? Žádný konkrétní
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 200 mg (= 82,0 mg alaninum; 134,6 mg glutaminum)
 sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy
 PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Trachisan 8 mg proti bolesti v krku, pastilky. Lidocaini hydrochloridum monohydricum
 Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
Bílé až téměř bílé oválné potahované tablety o průměru 9 mm, hladké na obou stranách.
 sp.zn. sukls84715/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tianeptin Mylan 12,5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tianeptinum natricum 12,5 mg.
sp.zn. sukls84715/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tianeptin Mylan 12,5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tianeptinum natricum 12,5 mg.
Press kit Ochrana před pohlavními chorobami musí být povinností
 Press kit Ochrana před pohlavními chorobami musí být povinností 1 Světový den boje proti AIDS nám připomíná důležitost prevence V prosinci si svět připomíná Světový den boje proti AIDS a také to, jak je
Press kit Ochrana před pohlavními chorobami musí být povinností 1 Světový den boje proti AIDS nám připomíná důležitost prevence V prosinci si svět připomíná Světový den boje proti AIDS a také to, jak je
PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum)
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Laboratorní příručka
 F a k u l t n í n e m o c n i c e K r á l o v s k é V i n o h r a d y, Š r o b á r o v a 5 0, P r a h a 1 0 Ústav soudního lékařství Laboratorní příručka ÚSTAV SOUDNÍHO LÉKAŘSTVÍ Toxikologická laboratoř
F a k u l t n í n e m o c n i c e K r á l o v s k é V i n o h r a d y, Š r o b á r o v a 5 0, P r a h a 1 0 Ústav soudního lékařství Laboratorní příručka ÚSTAV SOUDNÍHO LÉKAŘSTVÍ Toxikologická laboratoř
Oxid uhelnatý: základní informace
 Oxid uhelnatý: základní informace LIFEPAK 15, jehož uvedení na trh Physio-Control připravuje, bude mimo jiné umožňovat neinvazivní diagnostiku SpCO. Čím může být významná dostupnost rychlé, neinvazivní
Oxid uhelnatý: základní informace LIFEPAK 15, jehož uvedení na trh Physio-Control připravuje, bude mimo jiné umožňovat neinvazivní diagnostiku SpCO. Čím může být významná dostupnost rychlé, neinvazivní
106/2001 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 2. března 2001 o hygienických požadavcích na zotavovací akce pro děti
 106/2001 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 2. března 2001 o hygienických požadavcích na zotavovací akce pro děti Ministerstvo zdravotnictví stanoví podle 108 odst. 1 zákona č. 258/2000 Sb.,
106/2001 Sb. VYHLÁŠKA Ministerstva zdravotnictví ze dne 2. března 2001 o hygienických požadavcích na zotavovací akce pro děti Ministerstvo zdravotnictví stanoví podle 108 odst. 1 zákona č. 258/2000 Sb.,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Nulsora 1,5 mg tableta je kulatá, bílá, o průměru přibližně 6 mm, na jedné straně vyraženo C, na druhé straně vyraženo 1.
 Sp.zn.sukls173628/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nulsora 1,5 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 1,5 mg. Pomocná látka se známým
Sp.zn.sukls173628/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nulsora 1,5 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 1,5 mg. Pomocná látka se známým
Tablety. Egianti 0,75 mg jsou kulaté, bílé tablety, o průměru přibližně 6 mm, na jedné straně vyraženo C a na druhé straně 2.
 Sp.zn. sukls199092/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Egianti 0,75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 0,75 mg. Pomocná látka se známým
Sp.zn. sukls199092/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Egianti 0,75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 0,75 mg. Pomocná látka se známým
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Složení přípravku Nutryelt vyjádřené jako množství soli v 1 ampuli (10 ml) a v 1 litru.
 Sp.zn. sukls69705/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení přípravku vyjádřené jako množství soli v 1 ampuli (10 ml)
Sp.zn. sukls69705/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení přípravku vyjádřené jako množství soli v 1 ampuli (10 ml)
