Emdogent 100 gentamicin 100 mg/ml injekční roztok skot, prasata, koně, psi, kočky
|
|
|
- Jaroslava Sedláková
- před 6 lety
- Počet zobrazení:
Transkript
1 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů a žadatelů / držitelů rozhodnutí o registraci v členských státech 1/39
2 Členský stát EU/EHP Žadatel / držitel rozhodnutí o registraci Název INN Síla Léková forma Druh zvířete Cesta Rakousko Vana GmbH Wolfgang Schmälzl Gasse Wien Austria Gentavan 5%- Durchstichflasche für Tiere gentamicin 50 mg/ml injekční roztok skot, telata, prasata, koně, hříbata, psi, kočky, Belgie EMDOKA bvba John Lijsenstraat 16 B-2321 Hoogstraten Belgium Emdogent 100 gentamicin 100 mg/ml injekční roztok skot, prasata, koně, psi, kočky, Belgie Belgie VMD nv Hoge Mauw 900 B-2370 Arendonk Belgium KELA NV Sint Lenaartseweg Hoogstraten Belgium Gentaveto 5 gentamicin 50 mg/ml injekční roztok prasata intramuskulární Genta-Kel 5% gentamicin 50 mg/ml injekční roztok skot (telata) intramuskulární Bulharsko Biovet JSC 39 Petar Rakov Str Peshtera Bulgaria ГЕНТАМИЦИН 10% инжекционен разтвор GENTAMYCIN 10% solution for injection gentamicin 100 mg/ml injekční roztok skot, prasata, psi, kočky, 2/39
3 Bulharsko Biovet JSC 39 Petar Rakov Str Peshtera Bulgaria ГЕНТАМИЦИН 4% инжекционен разтвор GENTAMYCIN 4% solution for injection gentamicin 40 mg/ml injekční roztok skot, prasata, psi, kočky, Bulharsko Interchemie werken "de Adelaar" B.V. Hosterweg 26a 5811 AC Castenray The Netherlands ГЕНТА-100 GENTA-100 gentamicin 100 mg/ml injekční roztok skot, telata, prasata intramuskulární Bulharsko VetProm JSC 26, Otets Paisii Str 2400 Radomir Bulgaria ГЕНТАМИЦИН 40 mg/ml инжекционен разтвор / GENTAMICIN 40 mg/ml solutio pro injectionibus gentamicin 40 mg/ml injekční roztok telata, prasata, psi, kočky Chorvatsko Krka - Farma d.o.o. Radnička cesta Zagreb Croatia GENTAMICIN 80 mg/ml gentamicin 80 mg/ml injekční roztok skot, koně neurčení k produkci potravin, prasata, psi, kočky intramuskulární (skot, prasata), (koně), (psi, kočky) Chorvatsko PROPHARMA VET d.o.o. Vijenac A. Cesarca Osijek Croatia NEOGENT gentamicin 80 mg/ml injekční roztok skot, prasata, koně, psi, kočky 3/39
4 Kypr FATRO S.p.A. Via Emilia, Ozzano Emilia (Bologna) AAGENT, 50 mg/ml, solution for injection for calves and piglets up to one month old. gentamicin 50 mg/ml injekční roztok telata a selata do jednoho měsíce věku, Italy Kypr Dimitrios Christophorou 169 Tseriou Av. Gentamycin 5% 50mg/ml ενέσιμο gentamicin 85.0 mg/ml injekční roztok skot, psi, kočky, 2048 Strovolos Nicosia διάλυμα για βοοειδή, Cyprus σκύλους και γάτες Česká republika FATRO S.p.A. Via Emilia, Ozzano Emilia (Bologna) AAGENT 50 mg/ml injekční roztok gentamicin 50 mg/ml injekční roztok telata, hříbata a selata ve věku jednoho měsíce, Italy Česká republika KELA NV Sint Lenaartseweg Hoogstraten Belgium GENTA-KEL IU/ml injekční roztok gentamicin 81 mg/ml injekční roztok telata, prasata, psi Estonsko Interchemie werken "De Adelaar" Eesti AS Vanapere tee 14, Pringi Genta-100 EE gentamicin 100 mg/ml injekční roztok skot, prasata, koně intramuskulární Viimsi Harju County Estonia 4/39
5 Estonsko Estonsko Estonsko Francie Francie Francie Interchemie werken "De Adelaar" Eesti AS Vanapere tee 14, Pringi Viimsi Harju County Estonia KELA NV Sint Lenaartseweg Hoogstraten Belgium Huvepharma AD 33 James Boucher Blvd. Sofia 1407 Bulgaria VIRBAC 1ere Avenue 2065 MLID Carros Cedex France Vetoquinol SA Magny-Vernois Lure France VIRBAC 1ere Avenue 2065 MLID Carros Cedex France Genta-100 gentamicin 100 mg/ml injekční roztok skot, prasata intramuskulární Genta-kel gentamicin 50 mg/ml injekční roztok telata, psi, Gentacin gentamicin 100 mg/ml injekční roztok telata, psi PANGRAM 4 % gentamicin UI/ml injekční roztok telata, psi, kočky FORTICINE SOLUTION gentamicin UI/ml injekční roztok telata G.4 gentamicin UI/ml injekční roztok telata, psi, kočky 5/39
6 Francie CEVA SANTE ANIMALE 10 Avenue de la Ballastiere Libourne France VETRIGEN gentamicin UI/ml injekční roztok telata, selata intramuskulární Německo CP-Pharma Handelsgesellschaft mbh Ostlandring 13 Genta 100 mg/ml gentamicin 100 mg/ml injekční roztok skot, prasata, koně označení jako neurčení k, Burgdorf Germany porážce pro lidskou spotřebu, psi, kočky Německo animedica GmbH Im Südfeld 9 Vepha-Gent forte gentamicin 50 mg/ml injekční roztok skot, prasata, koně označení, Senden-Bösensell jako neurčení k Germany porážce pro lidskou spotřebu, psi, kočky Německo Bela-Pharm GmbH & Co. KG Lohner Str Vechta Gentacin gentamicin 50 mg/ml injekční roztok skot, prasata, koně označení jako neurčení k, Germany porážce pro lidskou spotřebu, psi, kočky Německo animedica GmbH Im Südfeld 9 Gentamicin 50 gentamicin 50 mg/ml injekční roztok skot, prasata, koně označení, Senden-Bösensell jako neurčení k Germany porážce pro lidskou spotřebu, psi, kočky 6/39
7 Německo animedica GmbH Im Südfeld Senden-Bösensell Germany Genta-Sulfat 81 gentamicin 50 mg/ml injekční roztok skot, prasata, koně označení jako neurčení k porážce pro lidskou spotřebu, psi, kočky, Německo Bela-Pharm GmbH & Co. KG Lohner Str Vechta Germany Vetogent Inj. gentamicin 85 mg/ml injekční roztok skot, prasata, koně označení jako neurčení k porážce pro lidskou spotřebu, psi, kočky, Německo Bremer Pharma GmbH Werkstr Warburg Germany Gentafromm gentamicin 50 mg/ml injekční roztok skot, psi, kočky, Německo Eurovet Animal Health B.V. Handelsweg 25 NL-5531 AE Bladel The Netherlands Genta 5% gentamicin 50 mg/ml injekční roztok skot, prasata, psi, kočky, ptáci v zájmovém chovu, Řecko PROVET SA Aspropyrgos Attikis Greece GENTAMICIN/PROVET gentamicin 50 mg/ml injekční roztok telata, psi, kočky intramuskulární Řecko KELA NV Sint Lenaartseweg Hoogstraten Belgium GENTAKEL gentamicin 50 mg/ml injekční roztok telata, prasata, psi intramuskulární 7/39
8 Maďarsko KELA NV Sint Lenaartseweg Hoogstraten Belgium Neogent 5 % injekció A.U.V. gentamicin 50 mg/ml injekční roztok skot, prasata, psi skot, prasata: intramuskulární psi: intramuskulární nebo Irsko KELA NV Sint Lenaartseweg Hoogstraten Belgium Genta 50 mg/ml solution for injection. gentamicin 50 mg/ml injekční roztok skot intramuskulární Itálie FATRO S.p.A. Via Emilia, Ozzano Emilia (Bologna) Italy Aagent gentamicin 50 mg/ml injekční roztok telata, selata (v 1. měsíci života), Itálie FATRO S.p.A. Via Emilia, Ozzano Emilia (Bologna) Italy Aagent 10% gentamicin 100 mg/ml injekční roztok telata, selata (v 1. měsíci života), Itálie Industria Italiana Integratori Trei S.p.A. Via Affarosa, Rio Saliceto (Reggio Emilia) Italy Gentabiotic gentamicin 100 mg/ml injekční roztok telata, selata, psi, kočky, intraperitoneální 8/39
9 Lotyšsko Huvepharma EOOD 3A Nikolay Haytov street Sofia 1113 Bulgaria Gentacin gentamicin 100 mg/ml injekční roztok skot, prasata, koně, psi, kočky, Lotyšsko Bela-Pharm GmbH & Co. KG Lohner Str Vechta Germany Gentamycin 5 gentamicin 85 mg/ml injekční roztok skot, prasata, koně, psi, kočky, Lotyšsko CP-Pharma Handelsgesellschaft mbh Ostlandring Burgdorf Germany Genta- 100 gentamicin 100 mg/ml injekční roztok skot, koně, psi, kočky, Lotyšsko KELA NV Sint Lenaartseweg Hoogstraten Belgium Genta-kel 10% gentamicin 100 mg/ml injekční roztok skot, prasata, koně, psi, Lotyšsko Industrial Veterinaria, S.A. Esmeralda, 19 E Esplugues de Llobregat (Barcelona) Spain Gentaprim trimethoprim gentamicin sulfát sulfadimetho xinum 40 mg/ml 30 mg/ml 200 mg/ml injekční roztok skot, prasata, koně, psi, kočky intramuskulární Lotyšsko Bremer Pharma GmbH Werkstr Warburg Germany Gentamicin BREMER PHARMA gentamicin 50 mg/ml injekční roztok skot, psi, kočky, 9/39
10 Lotyšsko KELA NV Sint Lenaartseweg Hoogstraten Belgium Genta-kel 5% gentamicin 50 mg/ml injekční roztok skot, prasata, psi, Lotyšsko CP-Pharma Handelsgesellschaft mbh Ostlandring 13 Genta gentamicin 100 mg/ml injekční roztok skot, koně, psi, kočky, Burgdorf Germany Litva CP-Pharma Handelsgesellschaft mbh Ostlandring 13 Genta 100 mg/ml, injekcinis tirpalas gentamicin 100 mg/ml injekční roztok skot, prasata, koně, psi, kočky, Burgdorf Germany Litva Dopharma Research B.V. Zalmweg 24m 4941 VX Raamsdonksveer The Netherlands GENTA-JECT, injekcinis tirpalas gentamicin 100 mg/ml injekční roztok skot, telata, prasata, selata, koně, psi, kočky, Litva Bela-Pharm GmbH & Co. KG Lohner Str Vechta Gentacin, injekcinis tirpalas gentamicin 85 mg/ml injekční roztok skot, telata, prasata, selata, odstávčata, koně,, Germany hříbata, psi, kočky Litva Interchemie werken "de Adelaar" B.V. Hosterweg 26a 5811 AC Castenray GENTA 100 mg/ml injekcinis tirpalas galvijams ir kiaulėms gentamicin 100 mg/ml injekční roztok skot, telata, prasata intramuskulární The Netherlands 10/39
11 Malta CENAVISA, S.L. Camí Pedra Estela s/n Reus (Tarragona) Spain Gentacen gentamicin 100 mg/ml injekční roztok telata do 13 týdnů věku intramuskulární Malta Industrial Veterinaria, S.A. Esmeralda, 19 E Esplugues de Llobregat (Barcelona) Spain Gentaprim trimethoprim gentamicin sulfadimetho xin 40 mg/ml 30 mg/ml 200 mg/ml injekční roztok skot, prasata intramuskulární Malta Laboratorios Calier, S.A. Barcelones, 26 - El Ramassar Les Franqueses del Valles (Barcelona) Spain GENTACALIER gentamicin 40 mg/ml injekční roztok skot, telata, prasata, selata Portugalsko IAPSA PORTUGUESA PECUÁRIA, LDA Avenida do Brasil nº 88 7º Esq Lisboa Portugal GENTAYET 40 mg/ml solução injectável gentamicin 40 mg/ml injekční roztok skot, koně, psi, kočky Portugalsko KELA NV Sint Lenaartseweg Hoogstraten Belgium GENTA-kel 05, solução injectável para bovinos, suínos, cães, gatos gentamicin 50 mg/ml injekční roztok skot, prasata, psi, kočky (pouze psi) 11/39
12 Portugalsko VETLIMA - SOC. DISTRIBUIDORA DE PROD. AGRO-PECUÁRIOS, SA GENTAVET solução injectavel gentamicin 40 mg/ml injekční roztok skot (telata), prasata (selata), drůbež (kuřata, Centro Empresarial da Rainha, Lote Vila Nova da krůty), psi, kočky Rainha Portugal Rumunsko Alapis SA Aspropyrgos mailbox 26 Athens GENTAMICIN 5% Gentamicin Provet 50mg/ml gentamicin 50 mg/ml injekční roztok telata, selata, psi, kočky intramuskulární Greece Rumunsko Dopharma B.V. Zalmweg VX Raamsdonksveer The Netherlands GENTA-JECT 10% gentamicin 100 mg/ml injekční roztok skot, prasata, Rumunsko PASTEUR - Filiala Filipesti SRL Str. Principala nr. 944 GENTAMICINA FP 10% gentamicin 100 mg/ml injekční roztok skot, prasata, psi, kočky, Filipestii de Padure Jud. Prahova Romania 12/39
13 Slovenská republika FATRO S.p.A. Via Emilia, Ozzano Emilia Aagent 50 mg/ml injekčný roztok gentamicin 50 mg/ml injekční roztok telata a selata v prvním měsíci života, koně, (Bologna) označení jako Italy neurčení k porážce pro lidskou spotřebu Slovinsko KRKA, d.d. Novo mesto, Šmarješka cesta 6 GENTAMICIN KRKA 80 mg/ml raztopina za injiciranje za govedo, gentamicin 80 mg/ml injekční roztok skot, prasata, psi, kočky intramuskulární 8501 Novo mesto prašiče, pse in mačke Slovenia Španělsko Laboratorios Maymo, S.A. Via Augusta, Barcelona MAYCOLI INYECTABLE ESP gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k Spain produkci potravin Španělsko MEVET, S.A.U. Poligono Industrial El Segre Parcela Lérida Spain GENTAVALL 40 MG/ML SOLUCIÓN INYECTABLE ESP gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k produkci potravin, psi, kočky Španělsko Laboratorios Calier, S.A. Barcelones, 26 - El Ramassar GENTACALIER ESP gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k Les Franqueses del Valles (Barcelona) produkci potravin, psi, Spain kočky 13/39
14 Španělsko Laboratorios e Industrias Iven, S.A. Luis I, 56 Poligono Industrial Vallecas Madrid Spain VETERSAN GENTAMICINA ES gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k produkci potravin, psi, kočky Španělsko LABIANA LIFE SCIENCES, S.A. Venus, 26. Can Parellada Industrial Terrassa (Barcelona) Spain GENTASOL ESP gentamicin 80 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k produkci potravin, psi, kočky Španělsko Laboratorios e Industrias Iven, S.A. Luis I, 56 Poligono Industrial Vallecas Madrid Spain GENTAMICIVEN ESP gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k produkci potravin, psi, kočky Španělsko SUPER S DIANA, S.L. Ctra. C-17, Km Parets del Valles (Barcelona) Spain GENDIAN 60mg/ml SOLUCIÓN INYECTABLE ESP gentamicin 60 mg/ml injekční roztok skot (telata do 250 kg), koně neurčení k produkci potravin, psi 14/39
15 Španělsko CENAVISA, S.L. Camí Pedra Estela s/n Reus (Tarragona) Spain PURMICINA 40 MG/ML SOLUCIÓN INYECTABLE ESP gentamicin 40 mg/ml injekční roztok skot (telata do 250 kg), prasata (sající selata), koně neurčení pro lidskou spotřebu, psi, kočky Španělsko CENAVISA, S.L. Camí Pedra Estela s/n Reus (Tarragona) Spain GENTACEN 100mg/ml SOLUCIÓN INYECTABLE ESP gentamicin 100 mg/ml injekční roztok telata (do 13 týdnů věku) intramuskulární Španělsko S.P. VETERINARIA, S.A. Ctra Reus Vinyols, km 4.1 Riudoms (Tarragona) Spain GENTAVIN 100mg/ml SOLUCIÓN INYECTABLE ESP gentamicin 100 mg/ml injekční roztok telata (do 13 týdnů věku) intramuskulární Španělsko MEVET, S.A.U. Poligono Industrial El Segre Parcela Lérida Spain GENTAVALL 5mg/ml SOLUCIÓN INYECTABLE ESP gentamicin 5 mg/ml injekční roztok selata, psi, kočky intramuskulární Španělsko LABORATORIOS HIPRA, S.A. Avda. la Selva 135 Amer (Girona) Spain GENTIPRA ESP gentamicin 50 mg/ml injekční roztok skot (telata do 250 kg) Nizozemsko Dopharma Research B.V. Zalmweg 24m 4941 VX Raamsdonksveer The Netherlands Genta-ject 10% gentamicin 100 mg/ml injekční roztok telata do 13 týdnů věku intramuskulární 15/39
16 16/39
17 Příloha II Vědecké závěry a zdůvodnění změn v souhrnu údajů o přípravku 17/39
18 Celkové shrnutí vědeckého hodnocení veterinárních léčivých přípravků obsahujících gentamicin ve formě injekčního roztoku určených k skotu a prasatům (viz příloha I) 1. Úvod Gentamicin je aminoglykosidové antibiotikum indikované k léčbě řady bakteriálních infekcí. Obvykle se používá ve formě soli síranu. Veterinární léčivý přípravek gentamicin se používá zejména ve formě injekčního roztoku u skotu, prasat, koní, koček a psů. Po žádosti o registraci generického přípravku belgické Federální agentuře pro léčivé přípravky a zdravotnické výrobky podle čl. 13 odst. 1 směrnice 2001/82/ES, v platném znění, se ukázalo, že u referenčního přípravku Genta 100 mg/ml schváleného v Německu neexistují žádné údaje o reziduích daného přípravku, podle kterých by bylo možné určit ochranné lhůty pro maso a vnitřnosti skotu a prasat. Belgie nemohla na základě údajů dostupných v evropské veřejné zprávě o hodnocení maximálních limitů reziduí (EPMAR) Výboru pro veterinární léčivé přípravky (CVMP) ohledně gentamicinu (EMEA/MRL/803/01) 1 potvrdit, že ochranné lhůty 95 dnů pro skot a 60 dnů pro prasata jsou bezpečné. Navíc z údajů, které jsou u srovnatelných přípravků v Belgii k dispozici, jasně vyplývá, že hladiny reziduí mohou být v navrhovaných ochranných lhůtách vyšší, než jsou maximální limity reziduí (MRL). Belgie proto dospěla k názoru, že při těchto ochranných lhůtách stanovených pro referenční přípravek Genta 100 mg/ml (držitel rozhodnutí o registraci: CP-Pharma) a následně pro jeho generický přípravek Emdogent 100 (žadatel: Emdoka) není bezpečnost spotřebitelů zajištěna. Belgie také uvedla, že u veterinárních léčivých přípravků obsahujících gentamicin ve formě injekčního roztoku jsou v Evropské unii schváleny různé ochranné lhůty pro skot a prasata, např. pro maso a vnitřnosti skotu od 28 do 210 dnů, pro kravské mléko od 2 do 7 dnů, přičemž u některých přípravků je uvedeno nepoužívat u krav, jejichž mléko je určeno pro lidskou spotřebu, a pro maso a vnitřnosti prasat od 28 do 150 dnů. Proto Belgie dne 8. ledna 2016 zahájila podle článku 35 směrnice 2001/82/ES postup pro veterinární léčivé přípravky obsahující gentamicin ve formě injekčního roztoku určené k skotu a prasatům. Výbor pro veterinární léčivé přípravky (CVMP) byl požádán, aby přezkoumal všechny dostupné údaje o depleci (snižování obsahu) reziduí a doporučil ochranné lhůty pro skot (maso a mléko) a prasata. 2. Diskuze týkající se dostupných údajů Deplece reziduí v mase a vnitřnostech skotu Ve všech předložených studiích deplece (snižování obsahu) reziduí byl gentamicin podán intramuskulárně ve vodném injekčním roztoku. K přípravku Aagent 50 mg/ml injekční roztok (držitel rozhodnutí o registraci: Fatro) byla předložena studie u telat splňující požadavky správné laboratorní praxe. Plán studie odpovídá současným standardům. Studie zahrnovala telata do 1 měsíce věku. Zvířata ve skupinách po pěti byla léčena dávkou 4 mg/kg živé hmotnosti jednou denně po dobu 3 dnů, přičemž byla poražena za 30, 40, 50, 60, 70, 80 nebo 90 dnů po poslední dávky. Pomocí validované metody vysokoúčinné kapalinové chromatografie s hmotnostní spektrometrií (HPLC/MS-MS) byly analyzovány ledviny, játra, tuk, svaly a místo vpichu injekce (bezprostřední místo vpichu i okolí). Analýza výsledků v jednotlivých tkáních vedla ke stanovení maximální ochranné lhůty 103 dnů na základě deplece reziduí v játrech a za použití 1 CVMP EPMAR for gentamicin (EMEA/MRL/803/01) - _Report/2009/11/WC pdf 18/39
19 statistické metody podle pokynu výboru CVMP pro přístup k harmonizaci ochranných lhůt (EMEA/CVMP/036/95) 2. Přípravek Aagent 50 mg/ml injekční roztok byl zkoumán také ve studiích deplece u dospělého skotu. Studie splňuje požadavky správné laboratorní praxe a držitel rozhodnutí o registraci (Fatro) ji považuje za předběžnou studii. Nebyly odebrány žádné kontrolní vzorky z okolí místa vpichu injekce. Měřené reziduum (gentamicinu) nebylo zavedené indikátorové reziduum a dolní mez stanovitelnosti (LLOQ) metody HPLC-MS/MS odpovídala maximálnímu limitu reziduí (MRL) pro svaly a tuk. Nebyly předloženy žádné údaje o stabilitě. Studie zahrnovala skupiny po čtyřech zvířatech, jimž byla podávána dávka 4 mg/kg živé hmotnosti jednou denně po dobu 5 dnů a která byla poražena za 21, 35, 49 nebo 70 dnů po poslední dávky. Analyzovány byly ledviny, játra, tuk, svaly a místo vpichu injekce. Po 70 dnech, v poslední den odběru, koncentrace gentamicinu stále přesahovala maximální limity reziduí ve všech vzorcích jater a ledvin, přičemž v některých případech dosáhla hladina v ledvinách více než dvojnásobku a v játrech více než trojnásobku stávajícího maximálního limitu reziduí. Z těchto údajů nelze určit žádnou spolehlivou ochrannou lhůtu. Byla předložena studie splňující požadavky správné laboratorní praxe, která zkoumala přípravek Gentamicina 4 % solucion inyectabile (vztahující se rovněž na přípravky Gentacalier 40 mg/ml, Maycoli inyectable 40 mg/ml, Gentavall 40 mg/ml, Vetersan gentamicina 40 mg/ml, Gentamiciven 40 mg/ml a Purmicina 40 mg/ml (držitelé rozhodnutí o registraci: Laboratorios Calier, Laboratorios Maymo, Super's Diana, Mevet, Laboratorios e Industrias Iven a Cenavisa)). Studie splňuje současné standardy, přestože nebyl analyzován tuk a svaly (mimo místa vpichu injekce). Z hlediska celkových dostupných údajů o depleci reziduí gentamicinu je však známo, že tuk a svaly (mimo sval v místě vpichu injekce) nejsou limitující tkáně. Do studie byla zařazena ruminující telata ve věku 6 7 měsíců. Zvířata ve skupinách po čtyřech byla léčena dávkou 4 mg/kg živé hmotnosti každých 12 hodin po dobu 3 dnů, přičemž byla poražena za 80, 100, 130 nebo 170 dnů po poslední dávky. Pomocí validované metody vysokoúčinné kapalinové chromatografie s hmotnostní spektrometrií (HPLC/MS-MS) byly analyzovány ledviny, játra a místo vpichu injekce (bezprostřední místo i okolí). Analýza výsledků pro jednotlivé tkáně vedla ke stanovení maximální ochranné lhůty 192 dnů vypočtené na základě deplece reziduí v játrech s použitím statistické metody. Další předložená studie prováděná na telatech se týká přípravku Vetrigen (držitel rozhodnutí o registraci: Ceva Sante Animale), nesplňuje však požadavky správné laboratorní praxe. Studie zkoumala neruminující zvířata o hmotnosti přibližně kg. Zvířata ve skupinách po třech byla léčena dávkou 4 mg/kg živé hmotnosti každých 12 hodin po dobu 4,5 dne (9 injekcí), přičemž byla poražena za 15 nebo 60 dnů po poslední dávky. Mikrobiologickou metodou, pro kterou nejsou dostupné žádné odpovídající validační údaje, byly analyzovány ledviny, játra, tuk, svaly a místo vpichu injekce bez kontrolního vzorku z okolí. Při poslední porážce, tj. po 60 dnech, byly hladiny reziduí v játrech a v ledvinách pod maximálním limitem reziduí (MRL), nelze ovšem vyvodit žádné jednoznačné závěry ohledně tuku, svalů a zejména místa vpichu injekce, neboť příslušná hranice citlivosti představovala dvojnásobek MRL. Celkově nelze z této studie odvodit ochrannou lhůtu. Byla předložena studie splňující požadavky správné laboratorní praxe a zkoumající přípravek Gentaject 10% (držitel rozhodnutí o registraci: Dopharma). Studie splňuje současné standardy, přestože byla použita mikrobiologická analytická metoda a nebyl odebrán kontrolní vzorek z okolí místa vpichu (na druhé straně byla u každého zvířete analyzována dvě místa vpichu, na každé straně jedno). Mikrobiologický test byl odpovídajícím způsobem validován. Zařazená zvířata byla neruminující telata ve věku přibližně 3 měsíce, u nichž bylo uvedeno, že byla během studie krmena pevným krmivem. Zvířata ve skupinách po čtyřech byla léčena dávkou 2 mg/kg živé hmotnosti každých 12 hodin po dobu 3 dnů, přičemž byla poražena za 76, 90, 104 nebo 126 dnů po poslední dávky. Analyzovány 2 CVMP note for guidance on the approach towards harmonisation of withdrawal periods (EMEA/CVMP/036/95) /39
20 byly ledviny, játra, svaly, tuk a místo vpichu injekce. Nemohla být použita statistická metoda, protože u žádné z poživatelných tkání nebyl k dispozici dostatečný počet údajů. Za použití alternativní metody a na základě údajů analýzy ledvin byla při 10% bezpečnostní rezervě vypočtena ochranná lhůta 139 dnů. Přípravky Forticine Solution 1% ad 4% (držitel rozhodnutí o registraci: Vetoquinol) byly zkoumány v jedné hlavní studii za použití 1% roztoku se zaměřením na ledviny, játra a svaly a v jedné konfirmační studii za použití 4% roztoku po doložení plazmatické bioekvivalence s 1% silou, ve které bylo analyzováno pouze místo vpichu injekce. V obou studiích byla zahrnuta telata ve věku nejvýše 1,5 měsíce, pravděpodobně neruminující. Studie buď nesplňovala požadavky správné laboratorní praxe, nebo nebylo toto kritérium známo. V hlavní studii byla podána jedna dávka 4 mg/kg živé hmotnosti a poté tři injekce 2 mg/kg živé hmotnosti každých 12 hodin. Analytická metoda využívala rozdělovací kapalinovou chromatografii s fluorometrickou detekcí, nebyly však k dispozici údaje dokládající validitu metody. Monitorovány byly pouze 3 ze 4 doporučených složek indikátorových reziduí gentamicinu. U každé porážky byla zahrnuta pouze dvě zvířata (14 hodin, 7 dnů, 14 dnů, 28 dnů). Vzhledem k dolní mezi stanovitelnosti (LLOQ), která je nejasná a možná vyšší než příslušné maximální limity reziduí (MRL), nelze odvodit žádný závěr ohledně reziduí ve svalech a játrech. V játrech byly v posledním časovém bodu, tj. 28. den po poslední dávky, všechny koncentrace reziduí pod stávající hodnotou maximálního limitu reziduí (MRL), i když se pohybovaly relativně blízko MRL (680 a 700 µg/kg). Celkově nelze z této studie odvodit ochrannou lhůtu. V konfirmační studii místa vpichu injekce nebyly odebrány kontrolní vzorky z okolí, ale u každého z 6 zvířat byla použita 3 místa vpichu. Podaná dávka činila 3 mg/kg živé hmotnosti každých 8 hodin po dobu 3 dnů. Analytickou metodou bylo bakteriologické hodnocení, pro které nebyly k dispozici odpovídající validační údaje, s dolní mezí stanovitelnosti (LLOQ) 100 µg/kg, tj. dvojnásobek stávajícího použitelného maximálního limitu reziduí (50 µg/kg pro svaly). Z tohoto důvodu nelze studii použít k doložení bezpečné ochranné lhůty, i přesto, že nebyla zjištěna žádná rezidua přesahující hranici senzitivity 100 µg/kg. Další studie u skotu i prasat splňující požadavky správné laboratorní praxe byla provedena s přípravkem Gentamicin 40 mg/ml injekční roztok (držitel rozhodnutí o registraci: Vetprom), přičemž jako analytická metoda byla použita enzymová imunoanalýza. Tato studie nebyla předložena ve formě kompletní zprávy, ale spíše jako souhrn. Úplné validační údaje nejsou k dispozici. Deplece reziduí byla sledována pouze v ledvinách a játrech, zejména nebylo analyzováno místo vpichu injekce. U každé porážky byla zahrnuta pouze dvě zvířata. Studie byla provedena u ruminujícího skotu ( kg). Podaná dávka činila 4 mg/kg živé hmotnosti, první den s 12hodinovým odstupem a poté s 24hodinovým odstupem až do 5. dne včetně. Skupiny skotu byly poraženy za 60, 70, 80 nebo 90 dnů po poslední dávky. Rezidua v ledvinách i játrech klesla 80. den pod maximální limit reziduí (MRL). Vzhledem k nedostatkům této studie z ní však nelze vyvodit spolehlivou ochrannou lhůtu. Ve zprávách o hodnocení obnovení registrace, které posuzoval příslušný vnitrostátní orgán Belgie, byla identifikována studie, která podporuje ochrannou lhůtu pro přípravek Genta-kel 5% u telat (držitel rozhodnutí o registraci: Kela). Není však k dispozici žádná úplná zpráva ze studie ani zpráva o validaci analytické metody. Není známo, zda studie splňuje požadavky správné laboratorní praxe. Studie zahrnovala neruminující telata ve věku 8 11 týdnů, jimž byl podáván gentamicin v dávce 3 mg/kg živé hmotnosti dvakrát denně po dobu 3 po sobě jdoucích dnů. Zvířata ve skupinách po čtyřech až pěti byla postupně porážena za 4, 11, 20 nebo 89 dnů po poslední dávky. Deplece reziduí byla analyzována metodou LC-MS/MS v ledvinách, játrech, tuku, svalech a místě vpichu injekce (bez kontrolního vzorku z okolí). I v posledním časovém bodu, tj. po 89 dnech, byla v játrech (ve 2 z 5 vzorků) zjištěna rezidua stále přesahující maximální limit reziduí (MRL). Použití statistické metody 20/39
21 pro posouzení údajů zjištěných z jater není považováno za vhodné, protože není splněn předpoklad homoskedasticity. U ostatních tkání lze použít alternativní metodu. Nicméně vzhledem k reziduím přesahujícím maximální limit reziduí (MRL) v játrech po 89 dnech a vzhledem k tomu, že není dostupná úplná zpráva ze studie ani zpráva o validaci analytické metody, nelze z této studie odvodit ochrannou lhůtu. Ochranné lhůty pro maso a vnitřnosti skotu Celkem lze pro skot odvodit ochranné lhůty ze tří studií, a to 103 dnů pro přípravek Aagent 50 mg/ml (držitel rozhodnutí o registraci: Fatro), 192 dnů pro přípravky Gentacalier 40 mg/ml, Maycoli inyectable 40 mg/ml, Gentavall 40 mg/ml, Vetersan gentamicina 40 mg/ml, Gentamiciven 40 mg/ml a Purmicina 40 mg/ml (držitelé rozhodnutí o registraci: Laboratorios Calier, Laboratorios Maymo, Super's Diana, Mevet, Laboratorios e Industrias Iven a Cenavisa) a 139 dnů pro přípravek Genta-ject 10% (držitel rozhodnutí o registraci: Dopharma). Není vhodné sloučit údaje o reziduích pro výpočet celkové ochranné lhůty u všech přípravků, protože ve studiích byly použity různé dávkovací režimy. Pro výše uvedené konkrétní přípravky se uvažuje stanovit ochranné lhůty 103, 192 a 139 dnů použité v příslušných studiích, pokud je doporučený režim dávkování stejný jako v příslušné studii, nebo pokud odpovídá nižšímu nebo stejnému dávkování z hlediska celkové expozice. U přípravků uvedených v předcházejícím odstavci, jejichž maximální doporučené dávky přesahují dávky použité v příslušných studiích reziduí, je třeba použít ochrannou lhůtu pro nejhorší případ odvozenou přímo z údajů o reziduích, tj. 192 dnů, za předpokladu, že celková dávka doporučená v souhrnu údajů o přípravku nepřekračuje celkovou dávku podanou ve studii, z níž byla vypočtena tato ochranná lhůta (tj. 24 mg gentamicinu na kg živé hmotnosti). U přípravků, kde předložená studie deplece reziduí nepokrývá doporučený dávkovací režim, nebo u přípravků, k nimž nebyly předloženy žádné údaje, je třeba použít ochrannou lhůtu pro nejhorší případ vypočítanou přímo z údajů o depleci reziduí, tj. 192 dnů. To odpovídá dávkovacímu režimu 4 mg/kg živé hmotnosti každých 12 hodin po dobu 3 dnů při objemu injekce 20 ml a koncentraci 40 mg/ml. Lze se domnívat, že tato ochranná lhůta je dostatečně dlouhá, aby pokryla rozdíly ve složení přípravků, které by mohly mít vliv na depleci reziduí. Každý takový vliv je pravděpodobně pouze omezený z hlediska složení dostupných přípravků a vzhledem k velmi dlouhé době, po kterou deplece probíhá, a také s ohledem na skutečnost, že všechny přípravky, jichž se toto přezkoumání týká, jsou vodné roztoky. Ochrannou lhůtu 192 dnů nelze použít u přípravků, u nichž celková doporučená dávka přesahuje dávku použitou ve studii reziduí, tj. 24 mg gentamicinu na kg živé hmotnosti. U přípravků, kde celková dávka přesáhne dávku, která je podložena dostupnými spolehlivými údaji o reziduích (tj. u přípravků podávaných v celkových dávkách přesahujících 24 mg gentamicinu na kg živé hmotnosti u skotu), souhlasí výbor CVMP s extrapolací ochranných lhůt na základě farmakokinetických principů. Nejde o standardní přístup, který by byl uveden v pokynech výboru CVMP. Nicméně v souvislosti s tímto postupem přezkoumání, pokud jsou již přípravky schváleny a k dispozici jsou jen omezené údaje o depleci reziduí, je použití tohoto pragmatického přístupu považováno za přijatelný způsob, jak zachovat dostupnost léčivých přípravků a současně zajistit bezpečnost spotřebitelů. Farmakokinetický přístup používá k odvození ochranných lhůt zjištěný terminální poločas deplece v tkáních, ochrannou lhůtu stanovenou na základě údajů a dávku, která má být podána, podle tohoto vzorce: WP nová = WP stará + {log 2 (D nová /D stará ) x T 1/2 (závěrečná fáze)} zaokrouhleno nahoru Kde: WP nová je ochranná lhůta přípravku, pro který se ochranná lhůta určuje; WP stará je ochranná lhůta přípravku, podle nějž je doporučeno provést extrapolaci; D nová je dávka přípravku, pro kterou se určuje 21/39
22 ochranná lhůta; D stará je dávka přípravku, podle které je doporučeno provést extrapolaci; T 1/2 (závěrečná fáze) je terminální poločas. Tento výpočet lze použít za předpokladu, že kinetika deplece je lineární a že při depleci reziduí pod maximální limit reziduí (MRL) je dokončena distribuce v tkáních. Průměrný vypočítaný poločas činí 20,41 dne. Touto metodou dojdeme k doporučené extrapolované ochranné lhůtě 214 dnů při maximální doporučené celkové dávce u většiny dotčených přípravků, tj. 50 mg gentamicinu na kg živé hmotnosti. Pouze u jednoho přípravku (Gentamicin Bremer Pharma, schváleného v Lotyšsku, držitel rozhodnutí o registraci: Bremer Pharma) je doporučena vyšší celková dávka 80 mg gentamicinu na kg živé hmotnosti. V tomto případě je doporučena extrapolovaná ochranná lhůta 228 dnů. Je třeba zdůraznit, že použitá metoda extrapolace je pragmatický přístup, jehož cílem je zachovat dostupnost přípravků a současně zajistit bezpečnost spotřebitelů. Je známo, že v údajích existují určité nejasnosti ohledně terminálního poločasu a linearity kinetiky deplece ve vztahu k dávkám, což jsou v obou případech předpoklady správného použití extrapolace. Je třeba se zaměřit na ty přípravky dotčené tímto postupem, které mají vysokou maximální doporučenou dávku a u nichž nelze stanovit ochrannou lhůtu obvyklým způsobem na základě údajů o reziduích. U přípravků, u nichž je maximální doporučená dávka nižší než dávka použitá ve studiích reziduí zahrnujících nejhorších případy (24 mg gentamicinu na kg živé hmotnosti), není použití tohoto způsobu extrapolace považováno za vhodné, protože použití nejdelší vypočtené ochranné lhůty má za následek zahrnutí celkové bezpečnostní rezervy, která má pokrývat nedostatek konkrétních nebo adekvátních údajů. Některé z dotčených přípravků lze podávat i starším zvířatům, než jaká byla zahrnuta do studií, což představuje vyšší celkový objem injekcí, který by mohl znamenat pomalejší depleci z důvodu sníženého poměru povrch / objem místa vpichu bolusu. Proto nelze ochranné lhůty extrapolovat na vyšší objemy injekcí, než jaké byly použity ve studiích. Ze všech těchto údajů, jsou-li zváženy souhrnně, však vyplývá, že přinejmenším pro objem injekce do 20 ml u telat není místo vpichu injekce limitující tkání, a proto se lze domnívat, že by riziko pro spotřebitele související s vyššími objemy injekcí zůstalo nízké. Ochranná lhůta 192 dnů byla stanovena u ruminujících zvířat, výbor se však domnívá, že ji lze použít i u neruminujících telat. Dotčené přípravky jsou navíc určeny pro parenterální injekční, vliv fyziologie zažívání je tedy pravděpodobně omezený. Navíc z porovnání studií s přípravky Aagent 50 mg/ml injekční roztok (držitel rozhodnutí o registraci: Fatro) a Genta-ject 10% (držitel rozhodnutí o registraci: Dopharma) vyplynulo, že deplece reziduí není u velmi mladých zvířat pomalejší, protože ochranná lhůta je u telat do jednoho měsíce věku krmených mléčnou krmnou směsí a doplňkem pevné stravy kratší (103 dnů) než u starších telat krmených pevným krmivem. To do určité míry potvrzuje rychlá deplece pozorovaná u přípravku Forticine Solution 1% (držitel rozhodnutí o registraci: Vetoquinol), podávaného rovněž mladým telatům krmeným mléčnou krmnou směsí. Doba deplece reziduí je u gentamicinu dlouhá a ve většině případů pokryje období, kdy budou zvířata alespoň částečně ruminující. Deplece reziduí v mase a vnitřnostech prasat Ve všech předložených studiích deplece reziduí byl gentamicin podáván intramuskulárně jako vodný injekční roztok. K dispozici je studie zkoumající přípravek Aagent 50 mg/ml injekční roztok (držitel rozhodnutí o registraci: Fatro). Tato studie na selatech splňuje požadavky správné laboratorní praxe a její plán odpovídá současným standardům. Použitá selata byla mladší než 1 měsíc. Zvířata ve skupinách po pěti byla léčena dávkou 4 mg/kg živé hmotnosti jednou denně po dobu 3 dnů a poražena za 30, 40, 50 nebo 60 dnů po poslední dávky. Analyzovány byly ledviny, játra, kůže + tuk, svaly a místo vpichu injekce (bezprostřední místo vpichu i okolí) pomocí validované metody HPLC/MS-MS. Z analýzy 22/39
23 výsledků u jednotlivých tkání vyplývá maximální ochranná lhůta 66 dnů, týkající se deplece reziduí v kůži + tuku a v místě vpichu injekce a získaná alternativní metodou výpočtu. Přípravek Aagent 50 mg/ml injekční roztok byl hodnocen také ve studiích deplece u dospělých prasat. Tato studie splňuje požadavky správné laboratorní praxe a držitel rozhodnutí o registraci (Fatro) ji považuje za předběžnou studii. Nebyl analyzován žádný kontrolní vzorek z okolí místa vpichu injekce. Nebyl analyzován žádný kombinovaný vzorek kůže a tuku, neboť byl odebrán pouze vzorek tuku. Měřené reziduum, gentamicin, nebylo indikátorové reziduum a dolní mez stanovitelnosti (LLOQ) u metody HPLC-MS/MS se rovnala maximálnímu limitu reziduí pro svaly a tuk. Nebyly předloženy žádné údaje o stabilitě. Dospělá prasata ve skupinách po čtyřech dostávala dávku 4 mg/kg živé hmotnosti jednou denně po dobu 5 dnů a byla poražena za 7, 21, 35 nebo 49 dnů po poslední dávky. Analyzovány byly ledviny, játra, tuk, svaly a místo vpichu injekce. Po 49 dnech, v poslední den odběru vzorků, byla hladina ve všech vzorcích z ledvin a jater nad maximálním limitem reziduí (MRL), přičemž v některých vzorcích z ledvin byl MRL překročen více než dvojnásobně a v některých vzorcích z jater více než trojnásobně. Kromě toho v jednom vzorku z místa vpichu injekce byla koncentrace i po 49 dnech mírně nad maximálním limitem reziduí (MRL). Proto nelze z těchto údajů určit žádnou spolehlivou ochrannou lhůtu. Další dostupná studie prováděná na prasatech se týká přípravku Vetrigen (držitel rozhodnutí o registraci: Ceva Sante Animale). Tato studie nesplňuje požadavky správné laboratorní praxe. Studie zahrnuje zvířata o hmotnosti 23 až 27 kg. Zvířata ve skupinách po třech byla léčena dávkou 4 mg/kg živé hmotnosti každých 12 hodin po dobu 4,5 dne (9 injekcí), přičemž byla poražena za 15 nebo 60 dnů po poslední dávky. Mikrobiologickou metodou, pro kterou nejsou dostupné žádné odpovídající validační údaje, byly analyzovány ledviny, játra, tuk, svaly a místo vpichu injekce bez kontrolního vzorku z okolí. Při poslední porážce, tj. po 60 dnech, byly hladiny reziduí v játrech a v ledvinách pod maximálním limitem reziduí (MRL), nelze ovšem vyvodit žádné jednoznačné závěry ohledně tuku, svalů a zejména místa vpichu injekce, neboť příslušná hranice citlivosti představovala dvojnásobek MRL. Z této studie nelze vyvodit spolehlivou ochrannou lhůtu. Studie provedená s přípravkem Gentavall 5 mg/ml (držitel rozhodnutí o registraci: Mevet) nesplňovala jednoznačně požadavky správné laboratorní praxe (ve studii byla použita překvapivě nízká dávka 5 mg na zvíře, a to u novorozených selat (ve věku 3 5 dnů), která byla podána jednou). V ostatních ohledech studie splňuje současné standardy, ačkoli nebyly analyzovány svaly (kromě místa vpichu injekce) a tuk, což lze akceptovat, protože tyto tkáně nejsou z hlediska deplece reziduí gentamicinu limitující. Byla použita validovaná analytická metoda HPLC-MS/MS. Zvířata ve skupinách po čtyřech byla poražena za 40, 45 nebo 50 dnů po poslední dávky. Analyzovány byly ledviny, játra a místo vpichu. Z důvodu velikosti zvířat nemohl být odebrán kontrolní vzorek z okolí místa vpichu injekce. Jak lze vzhledem k podané dávce očekávat, deplece byla ve všech tkáních rychlá a již v prvním časovém bodu odběru, tj. po 40 dnech, byly hladiny pod maximálním limitem reziduí. Ochranná lhůta vyvozená z těchto údajů alternativní metodou s 10% bezpečnostním rozpětím, týkající se jediné dávky 5 mg/zvíře, byla u selat stanovena na 44 dnů. Studie podle správné laboratorní praxe zahrnující skot i prasata byla provedena s přípravkem Gentamicin 40 mg/ml injekční roztok (držitel rozhodnutí o registraci: Vetprom) a jako analytická metoda byla použita enzymová imunoanalýza. Tato studie nebyla předložena ve formě kompletní zprávy, ale spíše jako souhrn. Úplné validační údaje nejsou k dispozici. Deplece reziduí byla sledována pouze v ledvinách a játrech, zejména nebylo analyzováno místo vpichu injekce. U každé porážky byla zahrnuta pouze dvě zvířata. Studie byla provedena u ruminujícího skotu ( kg) a u prasat (35 40 kg). Podaná dávka činila 4 mg/kg živé hmotnosti, první den s 12hodinovým odstupem a poté s 24hodinovým odstupem až do 5. dne včetně. Skupiny prasat byly poraženy za 14, 28, 35 nebo 40 dnů po poslední dávky. Rezidua v ledvinách i v játrech klesla 28. den pod maximální limit reziduí. Vzhledem k nedostatkům této studie z ní však nelze odvodit spolehlivou ochrannou lhůtu. 23/39
24 Ve zprávách o hodnocení obnovení registrace, které posuzoval příslušný vnitrostátní orgán Belgie, byly zjištěny dvě studie, které podporují ochranné lhůty pro přípravky Genta-kel 5% (držitel rozhodnutí o registraci: Kela) a Gentaveto-5 u telat (držitel rozhodnutí o registraci: VMD). Ke studii s přípravkem Genta-kel 5% není k dispozici úplná zpráva, kdežto ke studii s přípravkem Gentaveto-5 byla úplná zpráva předložena. Ve studii s přípravkem Genta-kel 5% (držitel rozhodnutí o registraci: Kela) u selat byla použita dávka 3 mg/kg živé hmotnosti dvakrát denně, délku léčby nelze zjistit. Zvířata byla ve skupinách po čtyřech až pěti poražena za 3, 10, 17, 27, 67 nebo 89 dnů po poslední dávky. Analyzovány byly ledviny, játra, tuk, svaly a místo vpichu injekce (bez odebrání vzorku z okolí) validovanou metodou LC- MS/MS, výsledky týkající se tuku však nejsou k dispozici. Z této studie nelze odvodit žádnou ochrannou lhůtu, protože ve všech tkáních, pro které byly k dispozici adekvátní údaje z posledního časového bodu, tj. 89. den po poslední dávky, byla zjištěna rezidua přesahující maximální limit reziduí. Byla provedena studie s přípravkem Gentaveto-5 (držitel rozhodnutí o registraci: VMD) u prasat o hmotnosti 3,75 až 8 kg, kterým byla podávána dávka 5 mg/kg živé hmotnosti každých 12 hodin po dobu 5 dnů. Zvířata ve skupinách po pěti byla poražena za 14, 42, 70 nebo 112 dnů po poslední dávky. Deplece reziduí byla analyzována v ledvinách, játrech, kůži + tuku a v místě vpichu injekce pomocí validované metody LC-MS/MS. Z okolí místa vpichu injekce nebyl odebrán žádný kontrolní vzorek, ale u každého zvířete byla analyzována 2 místa vpichu injekce, jejichž vzdálenost byla považována za dostatečně malou. Za 112 dnů po poslední injekci, tedy v posledním časovém bodu, byly všechny koncentrace pod maximálním limitem reziduí. Schválená ochranná lhůta 146 dnů byla odvozena pomocí alternativní metody s bezpečnostním rozpětím 30 % a lze ji považovat za bezpečnou pro spotřebitele. Ochranné lhůty u prasat U cílového druhu prasat byly zjištěny tři studie, z nichž lze odvodit dostatečně spolehlivou ochrannou lhůtu. Jde o studie s přípravky Gentavall 5 mg/ml (držitel rozhodnutí o registraci: Mevet), Aagent 50 mg/ml injekční roztok (držitel rozhodnutí o registraci: Fatro) a Gentaveto-5 (držitel rozhodnutí o registraci: VMD). Ochranné lhůty jsou 44 dnů pro přípravek Gentavall 5 mg/ml, 66 dnů pro přípravek Aagent 50 mg/ml injekční roztok a 146 dnů pro přípravek Gentaveto-5. Tyto lhůty se nevztahují ke stejnému dávkování. Je třeba uvést, že ochranná lhůta 44 dnů u selat vycházející ze studie s přípravkem Gentavall 5 mg/ml (držitel rozhodnutí o registraci: Mevet) odpovídá velmi přesným podmínkám podávání (jediná injekce 5 mg u novorozených zvířat). Z toho vyplývá, že u výše uvedených přípravků podávaných v příslušných studiích je nutno použít ochranné lhůty 44, 66 a 146 dnů, pokud je doporučený režim dávkování stejný jako v příslušné studii, nebo pokud odpovídá nižšímu nebo stejnému dávkování z hlediska celkové expozice. U přípravků uvedených v předcházejícím odstavci, jejichž maximální doporučené dávky přesahují dávky použité ve studiích reziduí, je třeba použít ochrannou lhůtu pro nejhorší případ odvozenou přímo z údajů o reziduích, tj. 146 dnů, za předpokladu, že celková dávka doporučená v souhrnu údajů o přípravku nepřekračuje celkovou dávku podanou ve studii, z níž byla vypočtena tato ochranná lhůta (tj. 50 mg gentamicinu na kg živé hmotnosti). Ochrannou lhůtu 146 dnů lze použít také u dalších přípravků za předpokladu, že celková doporučená dávka nepřekračuje celkovou dávku podanou v příslušné studii (tj. 50 mg gentamicinu na kg živé hmotnosti). Je třeba uvést, že dávka použitá v příslušné studii (50 mg gentamicinu na kg živé hmotnosti) zřejmě pokrývá všechny v současné době doporučené režimy dávkování. Lze se domnívat, že tato ochranná lhůta pro nejhorší případ dostatečně pokrývá možné účinky vyplývající z rozdílů ve složení přípravků. Ze složení dostupných přípravků skutečně vyplývá, že je velmi podobné, včetně 24/39
25 běžných konzervantů a pufrovacích systémů, které pravděpodobně neovlivňují rychlost absorpce a které jsou obsaženy ve velmi malém relativním množství. Kromě toho je doba, po kterou deplece probíhá, velmi dlouhá a všechny přípravky, které jsou předmětem tohoto přezkoumání, jsou vodné roztoky. V případě prasat se všechny stanovené ochranné lhůty vztahují na maximální objem injekce 1 ml při koncentraci 50 mg/ml a nelze je přímo extrapolovat na větší objemy ani na větší dávky na jedno místo vpichu injekce. Proto je třeba omezit objem injekce maximálně na 1 ml na místo vpichu injekce nebo na 50 mg gentamicinu na místo vpichu injekce u přípravků o síle přesahující 50 mg gentamicinu na ml. Údaje o depleci reziduí v kravském mléce Údaje o depleci reziduí v kravském mléce byly předloženy pouze u přípravku Aagent 50 mg/ml injekční roztok (držitel rozhodnutí o registraci: Fatro), ačkoli přípravek není schválen k použití u laktujících krav. Studie zahrnuje pouze 8 zvířat a držitel rozhodnutí o registraci ji považuje za pilotní. Měřené reziduum (gentamicin) neodpovídá určenému indikátorovému reziduu a dostupné údaje nejsou dostatečné, aby bylo možné ověřit validitu analytické metody HPL-MS/MS. Podávaná dávka činila 4 mg/kg živé hmotnosti jednou denně po dobu 5 dnů. Koncentrace reziduí v mléce byla stanovena za 12, 24, 36, 48, 60, 72, 84 a 96 hodin po poslední dávky. Nízký počet zvířat a údajů neumožnil analýzu výsledků při použití statistických metod TTSC (doby do bezpečné koncentrace) nebo SCLR (bezpečné koncentrace na základě lineární regrese s možností měření pod mezí stanovitelnosti), jak je uvedeno v pokynech výboru CVMP pro stanovení ochranných lhůt pro mléko (EMEA/CVMP/473/98) 3. Pomocí metody SCPM (bezpečné koncentrace na základě údajů za jednotlivý časový bod, povolující údaje pod mezí stanovitelnosti) byla vypočtena ochranná lhůta 72 hodin, což odpovídá prvním časovým bodům, kdy byly všechny koncentrace pod maximálním limitem reziduí (MRL), přestože u 7 z 8 zvířat byla rezidua pod MRL již za 48 hodin po posledním dávky. Celkově nebyly údaje z této studie považovány za dostatečné pro účely odvození ochranné lhůty pro mléko. Ve studii reziduí v mléce popsané ve zprávě EPMAR výboru CVMP pro gentamicin (EMA/CVMP/619817/2015) 4 bylo léčeno pět laktujících krav opakovanými intramuskulárními dávkami 4 mg gentamicinu / kg živé hmotnosti / den po dobu 3 dnů. Vzorky mléka byly odebírány až do 90 hodin po poslední dávky. Rezidua gentamicinu v poživatelných tkáních a v mléce byly stanoveny mikrobiologickým testem s mezí stanovitelnosti 50 μg/kg (1/2 maximálního limitu reziduí). V žádném odebraném vzorku mléka nebyla zachycena rezidua s antimikrobiální aktivitou, což dokládá celkově velmi rychlou depleci. Při pragmatickém přístupu, jehož účelem je zachovat dostupnost přípravku pro laktující krávy a současně zajistit bezpečnost spotřebitelů, je považováno za vhodné stanovit pro všechny přípravky indikované u laktujících krav maximální ochrannou lhůtu schválenou v současné době, tj. 7 dnů. Tato ochranná lhůta zahrnuje široké bezpečnostní rozmezí s ohledem na dostupné údaje. Obecná hlediska Na základě informací, které měl výbor CVMP k dispozici, lze usuzovat, že existuje několik přípravků, u nichž jsou pokyny k dávkování uvedené v informacích o přípravku nejasné. Odpovědností každého příslušného vnitrostátního orgánu je uplatnit doporučení z tohoto stanoviska podle doporučené maximální dávky uvedené ve schváleném souhrnu údajů o přípravku a přijmout opatření, pokud informace o přípravku nelze správně interpretovat. 3 CVMP Note for guidance for the determination of withdrawal periods for milk (EMEA/CVMP/473/98) CVMP EPMAR for gentamicin (EMA/CVMP/619817/2015) - _Report/2016/03/WC pdf 25/39
26 Lze se domnívat, že cesta pravděpodobně nevede k vyšší hladině reziduí než intramuskulární cesta, a proto lze ochranné lhůty odvozené ze ho doporučit také pro. Subkutánní již ale nelze doporučit u skotu a prasat, protože kinetika deplece z místa vpichu injekce je i nadále neznámá a může být limitující. Stejná zdůvodnění, použitá pro stanovení ochranných lhůt u přípravků obsahujících gentamicin jako jedinou léčivou látku, lze uplatnit také pro gentamicin v kombinaci s trimethoprimem a sulfadimethoxinem. Vzhledem k obzvláště dlouhému přetrvávání gentamicinu v tkáních, které se netýká ostatních látek v kombinovaných přípravcích, není z hlediska ochranných lhůt obecně schválených u přípravků obsahujících tromethoprim a sulfonamidy žádný důvod očekávat jakýkoli dlouhodobý vliv interakcí na rezidua. Opakovaná léčba v určitém časovém rozmezí vede s velkou pravděpodobností k akumulaci reziduí gentamicinu v játrech, ledvinách a případně i v místě vpichu injekce léčených zvířat, a proto je třeba v informacích o přípravku jasně uvést, že během ochranné lhůty je nutné se vyhnout opakované léčbě. 3. Vyhodnocení přínosů a rizik V rámci tohoto postupu přezkoumání nebyla hodnocena kvalita, bezpečnost cílových zvířat, bezpečnost uživatele, riziko pro životní prostředí ani účinnost. Ochranné lhůty pro skot (maso a mléko) a prasata je třeba upravit dle doporučení, aby byla zajištěna bezpečnost spotřebitelů. Subkutánní cestu již nelze pro skot a prasata doporučit, neboť kinetika deplece z místa vpichu injekce je i nadále neznámá a může být limitující. Do informací o přípravku je třeba přidat upozornění, že je nutné vyhnout se opakované léčbě během ochranné lhůty. Celkový poměr přínosů a rizik přípravků zahrnutých do tohoto postupu byl považován za příznivý pod podmínkou, že budou provedeny doporučené změny v informacích o přípravku (viz příloha III). Zdůvodnění změn v souhrnu údajů o přípravku, označení na obalu a příbalové informaci Vzhledem k tomu, že na základě údajů o depleci reziduí u skotu a prasat výbor CVMP usoudil, že ochranné lhůty pro skot (maso a mléko) a prasata je třeba změnit, aby byla zajištěna bezpečnost spotřebitelů, vzhledem k neexistenci údajů o depleci reziduí při cestě výbor CVMP usoudil, že cestu u skotu a prasat je třeba z informací o přípravku odstranit, opakovaná léčba v rámci určitého časového období vede s velkou pravděpodobností k akumulaci reziduí gentamicinu v játrech, ledvinách a potenciálně i v místě vpichu injekce léčených zvířat, výbor CVMP proto usoudil, že je třeba do informací o přípravku přidat upozornění, že je nutné vyhnout se opakované léčbě během ochranné lhůty, výbor CVMP usoudil, že celkový poměr přínosů a rizik je u přípravků zahrnutých do tohoto postupu i nadále příznivý pod podmínkou, že budou provedeny změny v informacích o přípravku, výbor CVMP doporučil pozměnit rozhodnutí o registraci veterinárních léčivých přípravků obsahujících gentamicin ve formě injekčního roztoku určených k u skotu a prasat (viz příloha I), aby bylo 26/39
Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech Členský stát EU/EHP Žadatel / držitel rozhodnutí
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech Členský stát EU/EHP Žadatel / držitel rozhodnutí
Seznam názvů, lékových forem, síly veterinárních léčivých přípravků, cílových druhů zvířat, držitelů rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů, lékových forem, síly veterinárních léčivých přípravků, cílových druhů zvířat, držitelů rozhodnutí o registraci v členských státech 1/16 Členský stát EU/EHP Držitel rozhodnutí o
Příloha I Seznam názvů, lékových forem, síly veterinárních léčivých přípravků, cílových druhů zvířat, držitelů rozhodnutí o registraci v členských státech 1/16 Členský stát EU/EHP Držitel rozhodnutí o
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM LÉČIVÝCH PŘÍPRAVKŮ, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM LÉČIVÝCH PŘÍPRAVKŮ, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH EMEA/CVMP/269630/2006-CS cervenec 2006 1/7 Členský stát
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM LÉČIVÝCH PŘÍPRAVKŮ, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBU PODÁNÍ A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH EMEA/CVMP/269630/2006-CS cervenec 2006 1/7 Členský stát
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/9 Členský
Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg. Amoxicilin 200 mg Kyselina klavulanová 50 mg Prednisolon 10 mg
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cesty podání, ochranných lhůt, žadatelů a držitelů rozhodnutí o registraci v členských státech 1/7 Členský
Název INN Síla Léková forma. Chanil 34 mg/ml Oral Suspension for Cattle. Zanil Oxyklozanid 34 mg/ml Perorální suspenze
 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání a žadatelů / držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát EU/EHP Žadatel
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání a žadatelů / držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát EU/EHP Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
Příloha I. Seznam názvů, lékové formy, síly veterinárního léčivého přípravku, cílové druhy, způsoby podání, žadatel v členských státech
 Příloha I Seznam názvů, lékové formy, síly veterinárního léčivého přípravku, cílové druhy, způsoby podání, žadatel v členských státech 1 Členský stát EU/EHS Žadatel Název INN Léková forma Síla Cílový druh
Příloha I Seznam názvů, lékové formy, síly veterinárního léčivého přípravku, cílové druhy, způsoby podání, žadatel v členských státech 1 Členský stát EU/EHS Žadatel Název INN Léková forma Síla Cílový druh
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY LÉČIVÝCH PŘÍPRAVKŮ, CEST PODÁNÍ, DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA 1 NÁZEV, LÉKOVÁ FORMA, SÍLA, CÍLOVÝ DRUH, ZPŮSOB PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI
 PŘÍLOHA 1 NÁZEV, LÉKOVÁ FORMA, SÍLA, CÍLOVÝ DRUH, ZPŮSOB PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI Austria Wyeth Lederle Pharma GmbH, Fort Dodge Waidhausengasse 19/9, A-1140, Vienna Austria Contact: Dr.
PŘÍLOHA 1 NÁZEV, LÉKOVÁ FORMA, SÍLA, CÍLOVÝ DRUH, ZPŮSOB PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI Austria Wyeth Lederle Pharma GmbH, Fort Dodge Waidhausengasse 19/9, A-1140, Vienna Austria Contact: Dr.
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY, CEST PODÁNÍ LÉKU, DRUHŮ ZVÍŘAT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH A NORSKU
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY, CEST PODÁNÍ LÉKU, DRUHŮ ZVÍŘAT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH A NORSKU EMEA/CVMP/195/04-CS 11 únor 2004 1 Členský stát Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY, CEST PODÁNÍ LÉKU, DRUHŮ ZVÍŘAT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH A NORSKU EMEA/CVMP/195/04-CS 11 únor 2004 1 Členský stát Držitel rozhodnutí
(Nelegislativní akty) NAŘÍZENÍ
 24.5.2017 L 135/1 II (Nelegislativní akty) NAŘÍZENÍ NAŘÍZENÍ KOMISE (EU) 2017/880 ze dne 23. května 2017, kterým se stanoví pravidla použití maximálního limitu reziduí stanoveného pro farmakologicky účinnou
24.5.2017 L 135/1 II (Nelegislativní akty) NAŘÍZENÍ NAŘÍZENÍ KOMISE (EU) 2017/880 ze dne 23. května 2017, kterým se stanoví pravidla použití maximálního limitu reziduí stanoveného pro farmakologicky účinnou
PŘÍLOHA I. Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech
 PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
PŘÍLOHA I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený název) Název Koncentrace Léková forma Způsob
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍLOHA I. 8. prosince
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY, ZPŮSOBU PODÁNÍ, DRUHŮ ZVÍŘAT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V PŘÍSLUŠNÝCH ČLENSKÝCH STÁTECH, NA ISLANDU A V NORSKU 8. prosince 2004 1 Členský stát Rakousko
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, SÍLY, ZPŮSOBU PODÁNÍ, DRUHŮ ZVÍŘAT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V PŘÍSLUŠNÝCH ČLENSKÝCH STÁTECH, NA ISLANDU A V NORSKU 8. prosince 2004 1 Členský stát Rakousko
Seznam názvů, lékových forem, sil veterinárního léčivého přípravku, druhů zvířat, cest podání a držitelů rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů, lékových forem, sil veterinárního léčivého přípravku, druhů zvířat, cest podání a držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát EU/EHP Žadatel / držitel
Příloha I Seznam názvů, lékových forem, sil veterinárního léčivého přípravku, druhů zvířat, cest podání a držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát EU/EHP Žadatel / držitel
Smyšlený název Obsah léčivých látek Léková forma Živočišné druhy. Držitel rozhodnutí o registraci. Členský stát EU/EHP
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek veterinárního léčivého přípravku, živočišných druhů a držitelů rozhodnutí o registraci v členských státech 1/10 Členský stát EU/EHP Držitel
Amoxicillin trihydrate. Amoxicillin trihydrate. Trihydrát amoxicilinu. Amoxicillin trihydrate. Amoxicillin trihydrate. Amoxicillin trihydrate
 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, živočišných druhů, způsobů podání, indikací/ochranných lhůt a žadatelů/držitelů rozhodnutí o registraci v členských státech
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, živočišných druhů, způsobů podání, indikací/ochranných lhůt a žadatelů/držitelů rozhodnutí o registraci v členských státech
Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o registraci v členských státech 1 Členský Držitel rozhodnutí o Název INN
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o registraci v členských státech 1 Členský Držitel rozhodnutí o Název INN
Příloha I. Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci
 Příloha I Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci 1 Příloha IA: Léčivé přípravky doporučené pro zachování registrace a žádosti o registraci, u nichž byla
Příloha I Seznam léčivých přípravků registrovaných na vnitrostátní úrovni a žádostí o registraci 1 Příloha IA: Léčivé přípravky doporučené pro zachování registrace a žádosti o registraci, u nichž byla
Obsah léčivých látek
 Příloha I Seznam názvů, lékových forem, obsahu léčivých látek ve veterinárním léčivém přípravku, živočišných druhů, způsobů podání, žadatelů rozhodnutí o registraci v členských státech 1/10 Členský stát
Příloha I Seznam názvů, lékových forem, obsahu léčivých látek ve veterinárním léčivém přípravku, živočišných druhů, způsobů podání, žadatelů rozhodnutí o registraci v členských státech 1/10 Členský stát
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/7 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I. EMEA/CVMP/345752/2008-CS 16. července 2008 1/14
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH EMEA/CVMP/345752/2008-CS 16. července
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, SÍLA VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH EMEA/CVMP/345752/2008-CS 16. července
Smyšlený název Léková forma Síla Živočišné druhy. Perorální suspenze toltrazurilu/ml
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHŮ LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBŮ PODÁNÍ, ŽADATELŮ/DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1/11 Členský
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHŮ LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÝCH DRUHŮ, ZPŮSOBŮ PODÁNÍ, ŽADATELŮ/DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1/11 Členský
(Smyšlený název) Název Vertimen 8 mg Tabletten. Vertimen 16 mg Tabletten. Vertisan 16 mg Таблетка. Vertisan 8 mg Tableta 8 mg Tableta Perorální podání
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH)PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, ŽADATEL(É), DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel
PŘÍBALOVÁ INFORMACE PRO:
 PŘÍBALOVÁ INFORMACE PRO: Meloxidolor 5 mg/ml injekční roztok pro psy, kočky, skot a prasata 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE,
PŘÍBALOVÁ INFORMACE PRO: Meloxidolor 5 mg/ml injekční roztok pro psy, kočky, skot a prasata 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE,
Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech
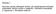 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech Členský stát EU/EHP Belgie Bulharsko Česká republika
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat a žadatelů / držitelů rozhodnutí o registraci v členských státech Členský stát EU/EHP Belgie Bulharsko Česká republika
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
Informace ÚSKVBL o závadách v jakosti veterinárních léčivých přípravků a veterinárních přípravků
 Informace ÚSKVBL o závadách v jakosti veterinárních léčivých přípravků a veterinárních přípravků Datum zjištění Název VLP/VP Číslo registrace/ Držitel registraci/ Číslo šarže Velikost balení Důvod Opatření
Informace ÚSKVBL o závadách v jakosti veterinárních léčivých přípravků a veterinárních přípravků Datum zjištění Název VLP/VP Číslo registrace/ Držitel registraci/ Číslo šarže Velikost balení Důvod Opatření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/16 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU YPOZANE 1,875 mg tablety pro psy YPOZANE 3,75 mg tablety pro psy YPOZANE 7,5 mg tablety pro psy YPOZANE 15 mg tablety pro psy 2.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/16 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU YPOZANE 1,875 mg tablety pro psy YPOZANE 3,75 mg tablety pro psy YPOZANE 7,5 mg tablety pro psy YPOZANE 15 mg tablety pro psy 2.
Příloha I. Seznam vnitrostátně schválených léčivých přípravků
 Příloha I Seznam vnitrostátně schválených léčivých přípravků 1 Členský stát EHP Držitel rozhodnutí o registraci Název přípravku Léčivá látka + množství Léková forma Způsob podání Belgie Pfizer S.A. (Belgium)
Příloha I Seznam vnitrostátně schválených léčivých přípravků 1 Členský stát EHP Držitel rozhodnutí o registraci Název přípravku Léčivá látka + množství Léková forma Způsob podání Belgie Pfizer S.A. (Belgium)
(Nelegislativní akty) NAŘÍZENÍ
 20.10.2017 CS L 271/1 II (Nelegislativní akty) NAŘÍZENÍ PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2017/1914 ze dne 19. října 2017 o salinomycinátu sodného (Sacox 120 microgranulate a Sacox 200 microgranulate) jako
20.10.2017 CS L 271/1 II (Nelegislativní akty) NAŘÍZENÍ PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2017/1914 ze dne 19. října 2017 o salinomycinátu sodného (Sacox 120 microgranulate a Sacox 200 microgranulate) jako
DOPORUČENÍ. L 95/64 Úřední věstník Evropské unie 29.3.2014
 L 95/64 Úřední věstník Evropské unie 29.3.2014 DOPORUČENÍ DOPORUČENÍ KOMISE ze dne 27. března 2014 o druhém koordinovaném plánu kontrol s cílem posoudit rozšíření podvodných praktik při uvádění některých
L 95/64 Úřední věstník Evropské unie 29.3.2014 DOPORUČENÍ DOPORUČENÍ KOMISE ze dne 27. března 2014 o druhém koordinovaném plánu kontrol s cílem posoudit rozšíření podvodných praktik při uvádění některých
Neodolatelný SELECTAN ORAL SELECTAN ORAL. 23 mg/ml koncentrát k použití v pitné vodě. Vysoký příjem, nejlepší léčba.
 SELECTAN ORAL 23 mg/ml koncentrát k použití v pitné vodě Neodolatelný Vysoký příjem, nejlepší léčba. SELECTAN ORAL představuje léčivý roztok v pitné vodě řešící opakující se infekce u prasat. : nová molekula
SELECTAN ORAL 23 mg/ml koncentrát k použití v pitné vodě Neodolatelný Vysoký příjem, nejlepší léčba. SELECTAN ORAL představuje léčivý roztok v pitné vodě řešící opakující se infekce u prasat. : nová molekula
(Text s významem pro EHP)
 6.5.2015 CS L 115/25 PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2015/724 ze dne 5. května 2015 o retinyl-acetátu, retinyl-palmitátu a retinyl-propionátu jako doplňkových látek pro všechny druhy (Text s významem pro
6.5.2015 CS L 115/25 PROVÁDĚCÍ NAŘÍZENÍ KOMISE (EU) 2015/724 ze dne 5. května 2015 o retinyl-acetátu, retinyl-palmitátu a retinyl-propionátu jako doplňkových látek pro všechny druhy (Text s významem pro
DOPORUČENÍ. L 48/28 Úřední věstník Evropské unie 21.2.2013
 L 48/28 Úřední věstník Evropské unie 21.2.2013 DOPORUČENÍ DOPORUČENÍ KOMISE ze dne 19. února 2013 o koordinovaném plánu kontrol s cílem posoudit rozšíření podvodných praktik při uvádění některých potravin
L 48/28 Úřední věstník Evropské unie 21.2.2013 DOPORUČENÍ DOPORUČENÍ KOMISE ze dne 19. února 2013 o koordinovaném plánu kontrol s cílem posoudit rozšíření podvodných praktik při uvádění některých potravin
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/12
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/12 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI 1/12 Členský stát Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku
SPECTRON 100 mg/ml roztoku k použití v pitné vodě pro kuřata a krůty
 SPECTRON 100 mg/ml roztoku k použití v pitné vodě pro kuřata a krůty Nejširší možnost ochrany Spectron je velmi účinné baktericidní antibiotikum na drůbežích farmách po celém světě. Zcela široké spektrum
SPECTRON 100 mg/ml roztoku k použití v pitné vodě pro kuřata a krůty Nejširší možnost ochrany Spectron je velmi účinné baktericidní antibiotikum na drůbežích farmách po celém světě. Zcela široké spektrum
Zahraniční hosté v hromadných ubyt. zařízeních podle zemí / Foreign guests at collective accommodation establishments: by country 2006*)
 Pro více informací kontaktujte / For further information please contact: Ing. Hana Fojtáchová, e-mail: fojtachova@czechtourism.cz Ing. Martin Košatka, e- mail: kosatka@czechtourism.cz Zahraniční hosté
Pro více informací kontaktujte / For further information please contact: Ing. Hana Fojtáchová, e-mail: fojtachova@czechtourism.cz Ing. Martin Košatka, e- mail: kosatka@czechtourism.cz Zahraniční hosté
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci INN Smyšlený název
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci INN Smyšlený název
EUREKA aeurostars: poradenská činnost a služby pro přípravu a podávání projektů
 EUREKA EUREKA aeurostars: poradenská činnost a služby pro přípravu a podávání projektů Svatopluk Halada, AIP ČR Josef Martinec, MŠMT Praha, 18. 3. 2014 EUREKA > 2 EUREKA obecně nabízí Kontakt s Národními
EUREKA EUREKA aeurostars: poradenská činnost a služby pro přípravu a podávání projektů Svatopluk Halada, AIP ČR Josef Martinec, MŠMT Praha, 18. 3. 2014 EUREKA > 2 EUREKA obecně nabízí Kontakt s Národními
PŘÍLOHA I. EMEA/CVMP/283947/2008-CS červen /7
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHU LÉČIVÝCH LÁTEK, ŽIVOČIŠNÝCH DRUHŮ, FREKVENCE A ZPŮSOBŮ PODÁNÍ, DOPORUČENÝCH DÁVEK, OCHRANNÝCH LHŮT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH ZEMÍCH,
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÝCH FOREM, OBSAHU LÉČIVÝCH LÁTEK, ŽIVOČIŠNÝCH DRUHŮ, FREKVENCE A ZPŮSOBŮ PODÁNÍ, DOPORUČENÝCH DÁVEK, OCHRANNÝCH LHŮT A DRŽITELŮ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH ZEMÍCH,
Příloha č. 1: Vstupní soubor dat pro země EU 1. část
 Příloha č. 1: Vstupní soubor dat pro země EU 1. část Reálný HDP na obyvatele v Eurech Belgie 27500 27700 27800 28600 29000 29500 30200 30200 29200 29600 29800 29009 Bulharsko 2300 2500 2600 2800 3000 3200
Příloha č. 1: Vstupní soubor dat pro země EU 1. část Reálný HDP na obyvatele v Eurech Belgie 27500 27700 27800 28600 29000 29500 30200 30200 29200 29600 29800 29009 Bulharsko 2300 2500 2600 2800 3000 3200
Obsah léčivých látek. název přípravku. Loratadine Vitabalans 10 mg tablety. 10 mg tableta Perorální podání. Loratadine Vitabalans
 Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
Příloha I Seznam názvů, lékových forem, obsahů léčivých látek v léčivých přípravcích, způsobu podání, žadatelů / držitelů rozhodnutí o registraci v členských státec 1 Členský stát EU/EHP Držitel rozhodnutí
Název přípravku INN Síla Léková forma Druh zvířete. 5 mg/ml. Closantel a. Roztok pro nalévání na hřbet Skot Lokální podání Laboratories Ltd
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cest podání, držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát (EU/EHP) Držitel rozhodnutí
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cest podání, držitelů rozhodnutí o registraci v členských státech 1/15 Členský stát (EU/EHP) Držitel rozhodnutí
Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o registraci v Členských Státech
 Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o v Členských Státech Page 1/9 Členský stát Držitel rozhodnutí o Název přípravku
Příloha I Seznam názvů, lékových forem, sil veterinárních léčivých přípravků, druhů zvířat, způsobů podání, držitelů rozhodnutí o v Členských Státech Page 1/9 Členský stát Držitel rozhodnutí o Název přípravku
Postavení českého trhu práce v rámci EU
 29. 4. 2016 Postavení českého trhu práce v rámci EU Pravidelná analýza se zaměřuje na mezinárodní porovnání vybraných indikátorů trhu práce v členských zemích EU. Téměř ve všech zemích EU28 se ve 4. čtvrtletí
29. 4. 2016 Postavení českého trhu práce v rámci EU Pravidelná analýza se zaměřuje na mezinárodní porovnání vybraných indikátorů trhu práce v členských zemích EU. Téměř ve všech zemích EU28 se ve 4. čtvrtletí
Příloha I. Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech.
 Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
Příloha I Seznam názvů, lékových forem, síly léčivého přípravku, způsobu podání, žadatelů v členských státech. 1 Členský stat EU/EEA Žadatel Smyšlený název Síla Léková forma Cesta podání Belgie Mometasone
Přístup veterinárních lékařů k problematice rezistence na antibiotika
 Přístup veterinárních lékařů k problematice rezistence na antibiotika Prof. MVDr. Alfred Hera CSc. Mgr. Lucie Pokludová Dr. Tisková konference u příležitosti Evropského antibiotického dne PRAHA 16.11.
Přístup veterinárních lékařů k problematice rezistence na antibiotika Prof. MVDr. Alfred Hera CSc. Mgr. Lucie Pokludová Dr. Tisková konference u příležitosti Evropského antibiotického dne PRAHA 16.11.
PŘÍLOHA I. SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVých PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, žadatelé, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Bulharsko Francie Německo Irsko
Členský stát EU/EEA. Doporučená dávka. Držitel registračního. Cesta podání. Název Léková forma INN/Síla Cílové druhy. Ochranné lhůty.
 Příloha I Seznam názvů, lékových forem a sil veterinárních léčivých přípravků, druhů, cest podání, ochranných lhůt, držitelů o registraci v členských státech 1/36 Rakousko DECTOMAX 10 Skot 2/36 Bulharsko
Příloha I Seznam názvů, lékových forem a sil veterinárních léčivých přípravků, druhů, cest podání, ochranných lhůt, držitelů o registraci v členských státech 1/36 Rakousko DECTOMAX 10 Skot 2/36 Bulharsko
Rada Evropské unie Brusel 17. března 2016 (OR. en)
 Rada Evropské unie Brusel 17. března 2016 (OR. en) Interinstitucionální spis: 2014/0013 (NLE) 15436/15 AGRI 684 AGRIORG 101 PRÁVNÍ PŘEDPISY A JINÉ AKTY Předmět: NAŘÍZENÍ RADY, kterým se mění nařízení (EU)
Rada Evropské unie Brusel 17. března 2016 (OR. en) Interinstitucionální spis: 2014/0013 (NLE) 15436/15 AGRI 684 AGRIORG 101 PRÁVNÍ PŘEDPISY A JINÉ AKTY Předmět: NAŘÍZENÍ RADY, kterým se mění nařízení (EU)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
Příušnice v ČR z hlediska sérologických přehledů, kontrol proočkovanosti a epidemií
 Příušnice v ČR z hlediska sérologických přehledů, kontrol proočkovanosti a epidemií P. Pazdiora XI. Hradecké vakcinologické dny 1.-3.10.2015 Počet Příušnice v ČR a Plzeňském kraji (1980-2015*) 100000 ČR
Příušnice v ČR z hlediska sérologických přehledů, kontrol proočkovanosti a epidemií P. Pazdiora XI. Hradecké vakcinologické dny 1.-3.10.2015 Počet Příušnice v ČR a Plzeňském kraji (1980-2015*) 100000 ČR
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZUPREVO 40 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivá látka: Tildipirosinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZUPREVO 40 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivá látka: Tildipirosinum
(Nelegislativní akty) NAŘÍZENÍ
 22.2.2019 L 51 I/1 II (Nelegislativní akty) NAŘÍZENÍ NAŘÍZENÍ KOMISE (EU) 2019/316 ze dne 21. února 2019, kterým se mění nařízení (EU) č. 1408/2013 o použití článků 107 a 108 Smlouvy o fungování Evropské
22.2.2019 L 51 I/1 II (Nelegislativní akty) NAŘÍZENÍ NAŘÍZENÍ KOMISE (EU) 2019/316 ze dne 21. února 2019, kterým se mění nařízení (EU) č. 1408/2013 o použití článků 107 a 108 Smlouvy o fungování Evropské
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH
 PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH 1 Členský stát EU/EHP Držitel rozhodnutí o registraci Rakousko Pharmachemie B.V. Belgie Pharmachemie B.V.
PŘÍLOHA I SEZNAM JMEN, LÉKOVÁ FORMA, SÍLA PŘÍPRAVKU, CESTY PODÁNÍ, ŽADATELÉ V ČLENSKÝCH ZEMÍCH 1 Členský stát EU/EHP Držitel rozhodnutí o registraci Rakousko Pharmachemie B.V. Belgie Pharmachemie B.V.
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOBY PODÁNÍ, ŽADATELÉ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EEA Itálie Španělsko Švédsko Držitel
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
NÁZEV, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI / ŽADATEL O ROZHODNUTÍ O REGISTRACI
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI / ŽADATEL O ROZHODNUTÍ O REGISTRACI 1 Nizozemsko NL 10351 AST Beheer BV Sulfatrim
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, SÍLA LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITEL ROZHODNUTÍ O REGISTRACI / ŽADATEL O ROZHODNUTÍ O REGISTRACI 1 Nizozemsko NL 10351 AST Beheer BV Sulfatrim
Dlouhodobá konvergence ve Střední Evropě
 Czech Republic Dlouhodobá konvergence ve Střední Evropě Pro ROBUST 2018, 23. ledna 2018 Miroslav Singer Generali CEE Holding Prague 17. ledna 2017 Osnova Růst reálného HDP definice ( staré a nové ekonomiky
Czech Republic Dlouhodobá konvergence ve Střední Evropě Pro ROBUST 2018, 23. ledna 2018 Miroslav Singer Generali CEE Holding Prague 17. ledna 2017 Osnova Růst reálného HDP definice ( staré a nové ekonomiky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
Příloha II. Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky
 Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové závěry vědeckého hodnocení přípravku Methylphenidate Hexal a souvisejících
Příloha II Vědecké závěry a zdůvodnění kladného stanoviska předkládané Evropskou agenturou pro léčivé přípravky 6 Vědecké závěry Celkové závěry vědeckého hodnocení přípravku Methylphenidate Hexal a souvisejících
V Bruselu dne COM(2016) 618 final ZPRÁVA KOMISE
 EVROPSKÁ KOMISE V Bruselu dne 23.9.2016 COM(2016) 618 final ZPRÁVA KOMISE Zpráva k usnadnění výpočtu množství přiděleného Evropské unii a zpráva k usnadnění výpočtu společného množství přiděleného Unii,
EVROPSKÁ KOMISE V Bruselu dne 23.9.2016 COM(2016) 618 final ZPRÁVA KOMISE Zpráva k usnadnění výpočtu množství přiděleného Evropské unii a zpráva k usnadnění výpočtu společného množství přiděleného Unii,
Příloha I. Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, držitelé rozhodnutí o registraci v členských státech
 Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby, držitelé rozhodnutí o v členských státech 1 Bulharsko Bulharsko Česká republika Kwizda Pharma GmbH Effingergasse 21 1160 Vienna
Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby, držitelé rozhodnutí o v členských státech 1 Bulharsko Bulharsko Česká republika Kwizda Pharma GmbH Effingergasse 21 1160 Vienna
PŘÍBALOVÁ INFORMACE. Pantoprazol Actavis 40 mg i.v. prášek pro přípravu injekčního roztoku. Pantoprazolum
 Příloha č.2 k rozhodnutí o registraci sp.zn.sukls19642/2008 PŘÍBALOVÁ INFORMACE Pantoprazol Actavis 40 mg i.v. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtěte si pozorně celou příbalovou
Příloha č.2 k rozhodnutí o registraci sp.zn.sukls19642/2008 PŘÍBALOVÁ INFORMACE Pantoprazol Actavis 40 mg i.v. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtěte si pozorně celou příbalovou
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Název INN Léková forma Síla Živočišné druhy. Injekční suspenze 50 mg/ml Skot Subkutánní injekce
 Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cest podání, a držitelů rozhodnutí o registraci v členských státech 1/13 Členský stát EU/EHP Belgie Česká
Příloha I Seznam názvů, lékových forem, síly veterinárního léčivého přípravku, živočišných druhů, cest podání, a držitelů rozhodnutí o registraci v členských státech 1/13 Členský stát EU/EHP Belgie Česká
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/19
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/19 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZOLVIX 25 mg/ml perorální roztok pro ovce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Jeden ml obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/19 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ZOLVIX 25 mg/ml perorální roztok pro ovce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Jeden ml obsahuje
*+, -+. / 0( & -.7,7 8 (((!# / (' 9., /,.: (; #< # #$ (((!# / "
 !"!#$ %" &' ( ) *+, -+. / 0(123! " ## $%%%& %' 45 6& -.7,7 8 (((!# / (' 9., /,.: (; #< # #$ (((!# / " * = < & ' ; '.: '. 9'= '= -+. > 8= '7 :' ' '.8 55, 5' 9'= '= -?7 +., '+.8 @ A:.. =. 0(1237 7 : :' @.
!"!#$ %" &' ( ) *+, -+. / 0(123! " ## $%%%& %' 45 6& -.7,7 8 (((!# / (' 9., /,.: (; #< # #$ (((!# / " * = < & ' ; '.: '. 9'= '= -+. > 8= '7 :' ' '.8 55, 5' 9'= '= -?7 +., '+.8 @ A:.. =. 0(1237 7 : :' @.
INFORMACE Z MONITORINGU TRŽNÍ PRODUKCE MLÉKA
 INFORMACE Z MONITORINGU TRŽNÍ PRODUKCE MLÉKA V Praze dne 30. listopadu 2015 Situace v ČR V rámci sledování tržní produkce mléka v ČR bylo za období od 1. 10. 2015 do 31. 10. 2015 dodáno registrovaným prvním
INFORMACE Z MONITORINGU TRŽNÍ PRODUKCE MLÉKA V Praze dne 30. listopadu 2015 Situace v ČR V rámci sledování tržní produkce mléka v ČR bylo za období od 1. 10. 2015 do 31. 10. 2015 dodáno registrovaným prvním
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Počet hostů / Number of guests. % podíl / % share
 Zahraniční hosté v hromadných ubyt. zařízeních podle zemí / Foreign at collective accommodation establishments: by country hostů / Průměrná doba pobytu ve dnech/ Average length of stay total 2 715 571
Zahraniční hosté v hromadných ubyt. zařízeních podle zemí / Foreign at collective accommodation establishments: by country hostů / Průměrná doba pobytu ve dnech/ Average length of stay total 2 715 571
PŘÍLOHA SDĚLENÍ KOMISE EVROPSKÉMU PARLAMENTU A RADĚ
 EVROPSKÁ KOMISE V Bruselu dne 21.12.2016 COM(2016) 829 final ANNEX 1 PŘÍLOHA SDĚLENÍ KOMISE EVROPSKÉMU PARLAMENTU A RADĚ Přizpůsobení stropu vlastních zdrojů a stropu prostředků na závazky v souvislosti
EVROPSKÁ KOMISE V Bruselu dne 21.12.2016 COM(2016) 829 final ANNEX 1 PŘÍLOHA SDĚLENÍ KOMISE EVROPSKÉMU PARLAMENTU A RADĚ Přizpůsobení stropu vlastních zdrojů a stropu prostředků na závazky v souvislosti
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7
 PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7 Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku Léková
PŘÍLOHA I NÁZEV, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK, ŽIVOČIŠNÉ DRUHY, ZPŮSOBY PODÁNÍ A DRŽITELÉ ROZHODNUTÍ O REGISTRACI 1/7 Žadatel nebo držitel rozhodnutí o registraci Vymyšlený název přípravku Léková
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU GESTAVET-PROST 75 g/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý ml obsahuje: Léčivá(é) látka(y): Dexcloprostenolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU GESTAVET-PROST 75 g/ml, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý ml obsahuje: Léčivá(é) látka(y): Dexcloprostenolum
PŘÍLOHA NAŘÍZENÍ KOMISE (EU) /,
 EVROPSKÁ KOMISE V Bruselu dne 11.12.2017 C(2017) 8238 final ANNEX 1 PŘÍLOHA NAŘÍZENÍ KOMISE (EU) /, kterým se mění přílohy II, IV, VI, VII a VIII nařízení Evropského parlamentu a Rady (ES) č. 767/2009
EVROPSKÁ KOMISE V Bruselu dne 11.12.2017 C(2017) 8238 final ANNEX 1 PŘÍLOHA NAŘÍZENÍ KOMISE (EU) /, kterým se mění přílohy II, IV, VI, VII a VIII nařízení Evropského parlamentu a Rady (ES) č. 767/2009
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
Průměrná doba pobytu ve dnech/ Average length of stay. % podíl / % share
 Zahraniční hosté v hromadných ubyt. zařízeních podle zemí / Foreign at collective accommodation 1. - 3 čtvrtletí 2010 Průměrná doba pobytu ve dnech/ Average length of stay index počet hostů 1-3 Q 2010/1-3
Zahraniční hosté v hromadných ubyt. zařízeních podle zemí / Foreign at collective accommodation 1. - 3 čtvrtletí 2010 Průměrná doba pobytu ve dnech/ Average length of stay index počet hostů 1-3 Q 2010/1-3
Leflunomide Apotex 10 mg, tabletten. Leflunomide Apotex 20 mg, tabletten. LEFLUNOMIDA APOTEX 10 mg comprimidos EFG
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH) PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel rozhodnutí
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÉHO(LÉČIVÝCH) PŘÍPRAVKU(Ů), LÉKOVÁ(É) FORMA(Y), KONCENTRACE, ZPŮSOB(Y) PODÁNÍ, DRŽITEL(É) ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát EU/EHP Držitel rozhodnutí
Živý virus onemocnění infekční burzitidy, kmen V EID 50 v dávce
 PŘÍLOHA I NÁZVY, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ, DOPORUČENÁ DÁVKA, OCHRANNÁ LHŮTA, ŽADATEL/DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH
PŘÍLOHA I NÁZVY, LÉKOVÁ FORMA, OBSAH LÉČIVÝCH LÁTEK VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB PODÁNÍ, DOPORUČENÁ DÁVKA, OCHRANNÁ LHŮTA, ŽADATEL/DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH
TRACES - Import živých zvířat do ČR 1 / 2017
 TRACES - Import živých zvířat do ČR 1 / 2017 země původu skot prasata ovce kozy drůbež Belgie 0 0 0 0 0 Bulharsko 0 0 0 0 0 Dánsko 0 11 227 0 0 0 Francie 0 0 0 42 13 810 Chorvatsko 0 0 0 0 0 Itálie 0 0
TRACES - Import živých zvířat do ČR 1 / 2017 země původu skot prasata ovce kozy drůbež Belgie 0 0 0 0 0 Bulharsko 0 0 0 0 0 Dánsko 0 11 227 0 0 0 Francie 0 0 0 42 13 810 Chorvatsko 0 0 0 0 0 Itálie 0 0
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/30
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/30 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Meloxoral 1,5 mg/ml perorální suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/30 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Meloxoral 1,5 mg/ml perorální suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka:
PROVÁDĚCÍ ROZHODNUTÍ KOMISE
 21.2.2013 Úřední věstník Evropské unie L 48/23 PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 19. února 2013 o finanční podpoře Unie pro koordinovaný plán kontrol s cílem posoudit rozšíření podvodných praktik při
21.2.2013 Úřední věstník Evropské unie L 48/23 PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 19. února 2013 o finanční podpoře Unie pro koordinovaný plán kontrol s cílem posoudit rozšíření podvodných praktik při
Česká republika v mezinárodním srovnání za rok 2009 (vybrané údaje)
 Česká republika v mezinárodním srovnání za rok 2009 (vybrané údaje) ZEMĚDĚLSTVÍ, LESNICTVÍ Obsah: 4.1. Využívání půdy zemědělstvím, 2007 4.2. Pracovní síla v zemědělství celkem, index (2005 = 100) 4.3.
Česká republika v mezinárodním srovnání za rok 2009 (vybrané údaje) ZEMĚDĚLSTVÍ, LESNICTVÍ Obsah: 4.1. Využívání půdy zemědělstvím, 2007 4.2. Pracovní síla v zemědělství celkem, index (2005 = 100) 4.3.
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Rakousko Rakousko Rakousko Rakousko Belgie Belgie AstraZeneca
PŘÍLOHA I SEZNAM NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ, LÉKOVÉ FORMY, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Rakousko Rakousko Rakousko Rakousko Belgie Belgie AstraZeneca
Síla Léková forma Druhy zvířat Způsob(y) podání. Žadatel/držitel rozhodnutí o registraci. Členský stát/ehp. látka(y):
 Příloha I Seznam názvů, sil veterinárních léčivých přípravků, druhů zvířat, způsobu, doporučené dávky a žadatelů/držitelů rozhodnutí v členských státech 1/130 Rakousko Bayer Austria GmbH Herbststraße 6-10
Příloha I Seznam názvů, sil veterinárních léčivých přípravků, druhů zvířat, způsobu, doporučené dávky a žadatelů/držitelů rozhodnutí v členských státech 1/130 Rakousko Bayer Austria GmbH Herbststraße 6-10
Úvod do veřejných financí. Fiskální federalismus. Veřejné příjmy a veřejné výdaje
 Veřejné finance Úvod do veřejných financí Fiskální federalismus Veřejné příjmy a veřejné výdaje Úvod do Veřejných financí Pojem VeFi Soustava veřejných rozpočtů Státní rozpočet Problém fiskální nerovnováhy
Veřejné finance Úvod do veřejných financí Fiskální federalismus Veřejné příjmy a veřejné výdaje Úvod do Veřejných financí Pojem VeFi Soustava veřejných rozpočtů Státní rozpočet Problém fiskální nerovnováhy
Příloha I. Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech
 Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený) název Koncentrace Léková forma Způsob podání
Příloha I Seznam názvů léčivých přípravků, lékové formy, koncentrace, způsoby podání, žadatelé v členských státech 1 Členský stát EU/EHP Žadatel (Smyšlený) název Koncentrace Léková forma Způsob podání
Doxyprex premix 25kg - premix pro medikaci krmiva pro prasata (po odstavu)
 Doxyprex premix 25kg - premix pro medikaci krmiva pro prasata (po odstavu) Popis zboží: SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU DOXYPREX 100 mg/g premix pro medikaci krmiva pro
Doxyprex premix 25kg - premix pro medikaci krmiva pro prasata (po odstavu) Popis zboží: SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU DOXYPREX 100 mg/g premix pro medikaci krmiva pro
ZPRÁVA KOMISE EVROPSKÉMU PARLAMENTU A RADĚ O POTRAVINÁCH A SLOŽKÁCH POTRAVIN OŠETŘOVANÝCH IONIZUJÍCÍM ZÁŘENÍM ZA ROK 2010
 EVROPSKÁ KOMISE V Bruselu dne 26.1.2012 KOM(2012) 17 v konečném znění ZPRÁVA KOMISE EVROPSKÉMU PARLAMENTU A RADĚ O POTRAVINÁCH A SLOŽKÁCH POTRAVIN OŠETŘOVANÝCH IONIZUJÍCÍM ZÁŘENÍM ZA ROK 2010 ZPRÁVA KOMISE
EVROPSKÁ KOMISE V Bruselu dne 26.1.2012 KOM(2012) 17 v konečném znění ZPRÁVA KOMISE EVROPSKÉMU PARLAMENTU A RADĚ O POTRAVINÁCH A SLOŽKÁCH POTRAVIN OŠETŘOVANÝCH IONIZUJÍCÍM ZÁŘENÍM ZA ROK 2010 ZPRÁVA KOMISE
Florfeni-kel 300mg/ml inj. 100ml
 Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Kelaprofen inj. 100ml
 Kelaprofen inj. 100ml Popis zboží: Kelaprofen 100 mg/ml injekční roztok pro skot, koně a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ v 1 ml: Léčivá látka: Ketoprofenum 100 mg Pomocné látky: Benzylalkohol
Kelaprofen inj. 100ml Popis zboží: Kelaprofen 100 mg/ml injekční roztok pro skot, koně a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ v 1 ml: Léčivá látka: Ketoprofenum 100 mg Pomocné látky: Benzylalkohol
Rada Evropské unie Brusel 7. října 2016 (OR. en) Jeppe TRANHOLM-MIKKELSEN, generální tajemník Rady Evropské unie
 Rada Evropské unie Brusel 7. října 2016 (OR. en) 13015/16 FIN 631 PRŮVODNÍ POZNÁMKA Odesílatel: Datum přijetí: 7. října 2016 Příjemce: Č. dok. Komise: COM(2016) 660 final Jordi AYET PUIGARNAU, ředitel,
Rada Evropské unie Brusel 7. října 2016 (OR. en) 13015/16 FIN 631 PRŮVODNÍ POZNÁMKA Odesílatel: Datum přijetí: 7. října 2016 Příjemce: Č. dok. Komise: COM(2016) 660 final Jordi AYET PUIGARNAU, ředitel,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Nalbuphin OrPha, 10mg/ml injekční roztok Nalbuphini hydrochloridum
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls148132/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nalbuphin OrPha, 10mg/ml injekční roztok Nalbuphini hydrochloridum Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls148132/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nalbuphin OrPha, 10mg/ml injekční roztok Nalbuphini hydrochloridum Přečtěte si pozorně
SPOLEČNÁ ZEMĚDĚLSKÁ POLITIKA PO ROCE 2013
 SPOLEČNÁ ZEMĚDĚLSKÁ POLITIKA PO ROCE 2013 Seminář Svazu chovatelů českého strak. skotu 4. prosince 2012, Skalský Dvůr Ing. Jan Veleba, prezident AK ČR AK ČR PK ČR ZS ČR Konsorcium nevládních organizací
SPOLEČNÁ ZEMĚDĚLSKÁ POLITIKA PO ROCE 2013 Seminář Svazu chovatelů českého strak. skotu 4. prosince 2012, Skalský Dvůr Ing. Jan Veleba, prezident AK ČR AK ČR PK ČR ZS ČR Konsorcium nevládních organizací
