PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Sára Hrušková
- před 9 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod NÁZEV PŘÍPRAVKU ATryn 1750 IU prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje nominálně 1750 IU* antitrombinum alfa**. Po rekonstituci obsahuje 1 ml roztoku 175 IU antitrombinum alfa. Specifická aktivita přípravku ATryn je asi 7 IU/mg proteinu. * účinnost (IU) se určuje pomocí chromogenního stanovení podle Evropského lékopisu. ** rekombinantní forma lidského antitrombinu, která se vyrábí technologií rekombinantní DNA v mléce transgenních koz (rdna). Pomocná látka se známým účinkem Tento léčivý přípravek obsahuje 38 mg (1,65 mmol) sodíku v jedné 10ml injekční lahvičce. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek pro přípravu infuzního roztoku. Prášek je bílý až téměř bílý. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace ATryn je indikován k profylaxi žilního tromboembolismu při operaci dospělých pacientů s vrozeným deficitem antitrombinu. Normálně se podává ve spojení s heparinem nebo heparinem o nízké molekulové hmotnosti. 4.2 Dávkování a způsob podání Léčbu je nutné zahájit pod dohledem lékaře, který má zkušenosti s léčbou pacientů s vrozeným deficitem antitrombinu. Dávkování Vzhledem k rozdílům ve farmakokinetice antitrombinu alfa a antitrombinu vyrobeného z plazmy je při léčbě přípravkem ATryn nutné dodržovat konkrétní doporučení pro dávku popsaná dále. Při léčbě vrozeného deficitu antitrombinu je nutné dávku a trvání léčby individuálně upravit pro jednotlivé pacienty. Přitom je nutné brát v úvahu rodinnou anamnézu tromboembolických příhod, současné faktory klinických rizik a laboratorní hodnocení. Počet podávaných jednotek antitrombinu alfa je vyjádřen v mezinárodních jednotkách (IU), což odpovídá současnému standardu Světové zdravotnické organizace pro koncentrát antitrombinu. Aktivita antitrombinu (AT) v plazmě je vyjádřena jako procento (vzhledem k lidské plazmě) nebo v mezinárodních jednotkách 2
3 (vzhledem k mezinárodnímu standardu pro antitrombin v plazmě). Jedna mezinárodní jednotka (IU) aktivity antitrombinu je ekvivalentní tomuto množství antitrombinu v jednom ml normální lidské plazmy. Výpočet požadované dávky antitrombinu alfa je založen na aktivitě antitrombinu v plazmě před léčbou a na tělesné hmotnosti. Terapeutickým cílem léčby antitrombinem alfa je zvýšit a udržovat normální aktivitu antitrombinu mezi % (0,8 1,2 IU/ml) po dobu trvání léčby. Počáteční léčba začíná podáním nasycovací dávky, jejímž cílem je dosažení 100% úrovně aktivity antitrombinu. Počáteční nasycovací dávka je založena na tělesné hmotnosti a na úrovni aktivity antitrombinu před léčbou. Požadovaná nasycovací dávka se stanoví podle následujícího vzorce: Nasycovací dávka (IU) = [(100 aktivita AT pacienta před léčbou v %) /2,28] x tělesná hmotnost v kg Obvyklá nasycovací dávka u chirurgických pacientů (výchozí aktivita AT 50 %, tělesná hmotnost 75 kg) s vrozeným deficitem antitrombinu v rizikových klinických situacích je IU/kg tělesné hmotnosti. Nasycovací dávku je nutné podat jako 15 minutovou infúzi, po níž je okamžitě aplikována udržovací infúze. Požadovaná udržovací dávka pro chirurgické pacienty je podávána jako kontinuální infúze a stanoví se dle dále uvedeného vzorce: Udržovací dávka (IU/hodinu) = [(100 aktivita AT pacienta před léčbou v %) /10,22] x tělesná hmotnost v kg Obvyklá udržovací dávka u chirurgických pacientů s vrozeným deficitem antitrombinu v rizikových klinických situacích činí 4-5 IU/kg/h. Během vysilujících stavů (např. těžký chirurgický zákrok, konkomitantní podávání heparinu) může být aktuální dávka vyšší. Viz doporučení pro monitorování lékových hladin a úpravu dávkování. V léčbě se musí pokračovat, dokud nedojde ke snížení rizika vzniku žilního tromboembolismu, a/nebo dokud nebyla navozena účinná následná antikoagulace. Monitorování lékových hladin a úprava dávkování Dávku je nutné upravit na základě laboratorních měření aktivity antitrombinu. Odezva se může u jednotlivých pacientů lišit a může dosahovat různých úrovní recovery in vivo a různých poločasů. Při zahájení léčby a těsně po chirurgickém zákroku může být nutné časté hodnocení aktivity antitrombinu a úprava dávkování. Po zahájení infúze udržovací dávky je nutné odebrat krev pro stanovení úrovně aktivity AT 45 minut po zahájení podávání infúze nasycovací dávky. V případě, že se aktivita AT pohybuje v rozmezí 80 % až 120 % (0,8-1,2 IU/ml), není nutné upravovat dávkování. V případě, že je aktivita AT nižší než 80 %, zvyšte rychlost udržovací infúze o 50 %. V případě, že je aktivita AT vyšší než 120 %, snižte rychlost infúze o 30 %. Zkontrolujte úroveň aktivity AT 30 minut po jakékoli změně rychlosti infúze nebo čtyři hodiny po té, co se hodnota pohybuje v cílovém rozmezí. Dále je nutné aktivitu antitrombinu kontrolovat jednou až dvakrát denně a dávku upravit odpovídajícím způsobem. Úroveň hladiny antitrombinu musí být udržována vyšší než 80 % po dobu trvání léčby, pokud klinické údaje neindikují jinou účinnou hladinu. Je možné, že chirurgický výkon ovlivní úrovně aktivity AT. Proto je po operaci nutné provést další kontrolu úrovně aktivity AT. V případě, že je úroveň aktivity AT nižší než 80 %, lze podat 15 minutovou infúzi bolusu AT, aby se rychle obnovila úroveň aktivity AT. Dávku lze vypočítat tak, že použijete aktivitu AT po chirurgickém zákroku ve vzorci pro výpočet nasycovací dávky uvedeném výše. Pediatrická populace Bezpečnost a účinnost přípravku ATryn u dětí a mladistvých (<18 let) nebyla doposud stanovena. K dispozici nejsou žádné údaje. Hladina antitrombinu u dětí se může lišit od hladiny u dospělých, a to především u novorozenců. 3
4 Způsob podání: K intravenóznímu podání. Nasycovací dávku je nutné podat jako 15minutovou infúzi, po níž je okamžitě aplikována udržovací infúze. Pokyny pro rekonstituci léčivého přípravku před podáním viz bod Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku viz bod 6.1. Hypersenzitivita na kozí proteiny nebo mléčné složky kozího původu. 4.4 Zvláštní upozornění a opatření pro použití Hypersenzitivní reakce Stejně jako u jiných intravenózních proteinoých přípravků jsou možné hypersenzitivní reakce alergického typu. Během aplikace infúze je pacienty nutné přísně monitorovat a pečlivě sledovat, zda se u nich neprojevují jakékoli příznaky. Pacienty je nutné informovat o časných známkách hypersenzitivních reakcí včetně vyrážky, generalizované kopřivky, pocitu tlaku na prsou, sípotu, hypotenze a anafylaxe. Pokud se tyto symptomy projeví po podání, je nutné, aby se pacienti obrátili na svého lékaře. V případě šoku je nutné aplikovat standardní lékařský postup. U pacientů léčených tímto léčivým přípravkem je třeba sledovat možné klinické imunitní reakce. Je třeba sledovat a dokládat stav protilátek. Zkušenosti s opakovanou léčbou tímto léčivým přípravkem jsou velmi omezené. V těchto situacích je důležitý zejména přísný dohled s ohledem na imunologické reakce. Těhotenství Vzhledem k rozdílům ve farmakokinetických vlastnostech přípravku ATryn u těhotných a netěhotných pacientek nelze doporučit dávkování v těhotenství nebo peripartálním období. Užívání konkomitantních antikoagulancií Klinický a biologický dohled, je-li antitrombin používán společně s heparinem, heparinem o nízké molekulové hmotnosti nebo dalšími antikoagulancii, které mohou zesílit antikoagulační aktivitu antitrombinu: - Aby bylo možné vhodně upravit dávku antikoagulantu a zabránit nadměrné hypokoagulabilitě, je nutné provádět kontroly rozsahu antikoagulace (APTT, a tam, kde je to vhodné aktivity antifaktoru Xa), a to pravidelně, v krátkých intervalech a zvláště v prvních minutách/hodinách po zahájení použití antitrombinu. - Hladiny antitrombinu musí být měřeny denně, aby bylo možné upravit individuální dávku. Je nutné vzít v úvahu riziko snížení hladin antitrombinu v důsledku dlouhé léčby nefrakcionovaným heparinem. Obsah sodíku Tento přípravek obsahuje 1,65 mmol (nebo 37,9 mg) sodíku v jedné injekční lahvičce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Žádné studie interakcí nebyly provedeny. Náhrada antitrombinu během podávání antikoagulantů, které zesilují antikoagulační aktivitu antitrombinu (např. heparin, heparin o nízké molekulové hmotnosti), může zvyšovat riziko krvácení. Poločas rekombinantního antitrombinu se může změnit konkomitantní léčbou těmito antikoagulanty v důsledku 4
5 změny obratu antitrombinu. Současné podávání antitrombinu s heparinem, heparinem o nízké molekulové hmotnosti nebo jinými antikoagulanty, které zvyšují antikoagulační aktivitu antitrombinů u pacienta se zvýšeným rizikem krvácení, je tedy nutné klinicky a biologicky monitorovat. 4.6 Fertilita, těhotenství a kojení Těhotenství O použití antitrombinu alfa u těhotných žen jsou k dispozici omezené klinické údaje. Dostupné údaje nenaznačují, že má přípravek škodlivý účinek na matku nebo dítě. Studie provedené na potkanech nenaznačily škodlivé účinky na porod, embryonální/fetální a postnatální vývoj. Vzhledem k rozdílům ve farmakokinetických vlastnostech tohoto léčivého přípravku, však u těhotných a netěhotných pacientek nelze v tomto okamžiku doporučit dávkování v těhotenství (viz bod 4.4). Antitrombin alfa proto nemá být podáván těhotným ženám. Kojení Není známo, zdali je antitrombin alfa nebo jeho metabolity vylučovány do lidského mateřského mléka. Nelze vyloučit riziko u kojenců. Je nutno rozhodnout, zda přerušit kojení, nebo ukončit léčbu přípravkem ATryn, přičemž je nutno uvážit výhody kojení pro dítě a výhody léčby pro ženu. Fertilita K dispozici nejsou žádné informace týkající se možných účinků antitrombinu alfa na fertilitu muže nebo ženy. 4.7 Účinky na schopnost řídit a obsluhovat stroje Není relevantní. 4.8 Nežádoucí účinky Souhrn bezpečnostního profilu Nejčastěji hlášené nežádoucí účinky pozorované v klinických hodnoceních jsou závratě, bolest hlavy, krvácení, nauzea, krvácení v místě vpichu, krvácení po provedení výkonu a sekrece z rány. Nejzávažnější hlášené nežádoucí účinky pozorované v klinických hodnoceních jsou krvácení a krvácení po provedení výkonu. Tabulkový seznam nežádoucích účinků V klinických hodnoceních, jichž se účastnili pacienti s vrozeným deficitem antitrombinu (n = 35), byl v souvislosti s léčbou přípravkem ATryn hlášen jeden mírný nežádoucí účinek svědění v místě aplikace. Nežádoucí účinky zjištěné v dalších klinických studiích s pacienty se získaným deficitem antitrombinu, kteří podstoupili chirurgický zákrok na srdci (n = 118) a zdravými dobrovolníky (n = 102), které souvisejí s léčbou přípravkem ATryn a které byly hlášeny více než jednou, jsou uvedeny v následující tabulce v členění dle třídy orgánových systémů. Nežádoucí účinky jsou uvedeny v následující tabulce v členění dle třídy orgánových systémů a četnosti. Četnost je definována jako: časté ( 1/100 až < 1/10) a méně časté ( 1/1,000 až <1/100). Třídy orgánových systémů podle Frekvence Nežádoucí účinky databáze MedDRA Poruchy nervového systému Časté Závratě, Bolest hlavy Cévní poruchy Časté Krvácení Gastrointestinální poruchy Časté Nauzea Celkové poruchy a reakce v místě aplikace Časté Krvácení v místě vpichu 5
6 Poranění, otravy a procedurální komplikace Méně časté Časté Pocit horka Erytém v místě infúze Bolest v místě infúze Vyrážka v místě infúze Podlitina v místě vpichu Krvácení po provedení výkonu Sekrece z rány Až do 90 dnů po léčbě přípravkem ATryn nebyly zjištěny žádné protilátky proti antitrombinu alfa. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. 4.9 Předávkování Nebyl hlášen žádný případ předávkování. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antitrombotická agens: skupina heparinů. ATC kód: B01AB02. Mechanismus účinku Antitrombin, glykoprotein s molekulovou hmotností 58 kd, který obsahuje 432 aminokyselin, patří do skupiny serpinů (inhibitorů serin proteázy). Je jedním z nejdůležitějších přirozených inhibitorů koagulace krve. Nejsilněji inhibované faktory jsou trombin a faktor Xa, ale i faktory kontaktní aktivace, faktory vnitřního systému (intrinsic system) a komplex faktor VIIa/tkáňový faktor. Aktivita antitrombinu je výrazně zvýšena heparinem a antikoagulační účinky heparinu jsou závislé na přítomnosti antitrombinu. Antitrombin obsahuje dvě funkčně důležité domény. První obsahuje reakční centrum a poskytuje místo štěpení pro proteinázy, jako je trombin, což je předpoklad vytvoření stabilního komplexu proteinázainhibitor. Druhé je doména vážící glykosaminoglykany zodpovídající za interakci s heparinem a příbuznými látkami, která zrychluje inhibici trombinu. Komplexy inhibitor koagulační enzym jsou odbourávány retikulo-endoteliálním systémem. Normální aktivita antitrombinu u dospělých je % (0,8-1,2 IU/ml) a úroveň u novorozenců činí asi % (0,4-0,6 IU/ml). Klinická účinnost a bezpečnost Ve formální klinické studii, jejíž součástí byla sériová ultrazvuková vyšetření (Duplex), bylo dokázáno, že antitrombin alfa je účinný ve vysoce rizikových klinických situacích při prevenci tromboembolických příhod u čtrnácti pacientů s vrozeným deficitem antitrombinu. Některé další údaje byly získány od řady pacientů v programu výjimečného použití. Tento léčivý přípravek byl registrován za výjimečných okolností. Znamená to, že vzhledem k vzácnosti onemocnění nebylo možné získat úplné informace o tomto léčivém přípravku. Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nové informace, které budou dostupné, a tento souhrn údajů o přípravku bude podle potřeby aktualizován. 5.2 Farmakokinetické vlastnosti 6
7 Po intravenózním podání přípravku ATryn (intravenózní bolusová dávka 50 IU/kg nebo 100 IU/kg tělesné hmotnosti) pacientům s vrozeným deficitem antitrombinu, u nichž se neprojevovaly klinické příznaky trombózy a jimž nebyl podáván heparin, byl přírůstek recovery (incremental) 2,07 ± 1,54 %/IU/kg tělesné hmotnosti (střední hodnota ± směrodatná odchylka). Farmakokinetické parametry populace pro přípravek ATryn odvozené ze stejné studie (průměrná hodnota + směrodatná odchylka) jsou následující: plocha pod křivkou: 587,88 ± 1,63 (% x h), poločas distribuce: 1,74 ± 1,28 h, poločas eliminace: 10,16 ± 1,28 h, průměrná doba prodlení (MRT): 8,57 ± 1,24 h, clearance: 0,665 ± 0,0493 l/h (průměrná hodnota ± směrodatná chyba). 5.3 Předklinické údaje vztahující se k bezpečnosti Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání, genotoxicity a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Glycin Natrium-citrát Chlorid sodný 6.2 Inkompatibility Studie kompatibility nejsou k dispozici, a proto tento léčivý přípravek nesmí být mísen s žádnými dalšími léčivými přípravky. 6.3 Doba použitelnosti Neotevřené injekční lahvičky: 4 roky. Z mikrobiologického hlediska by měl být přípravek použit okamžitě po rekonstituci. Nicméně chemická a fyzikální stabilita byla prokázána po dobu 3 hodin po rekonstituci a 8 hodin po rozředění při teplotě do 25 C. 6.4 Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 C 8 C). Pokyny pro uchovávání léčivého přípravku po jeho rekonstituci viz bod Druh obalu a obsah balení Prášek ve skleněné injekční lahvičce (typu I) se zátkou (silikonizovaná bromobutylová pryž) uzavřené zátkou (hliník) a snímacím víčkem (plast). Velikost balení: 1, 10 nebo 25 injekčních lahviček. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Tento léčivý přípravek je určen pouze na jedno použití. Rekonstituce/ředění Injekční lahvičky musejí být před rekonstitucí přeneseny do teploty do 25 C. Prášek je nutné rekonstituovat 10 ml vody na injekci, která se vstříkne podél boční stěny injekční lahvičky; injekční lahvičkou jemně zatočte (netřepejte s ní), abyste zabránili vzniku pěny. 7
8 Rekonstituovaný přípravek je nutné před podáním vizuálně zkontrolovat, zda neobsahuje pevné částice a/nebo nedošlo ke změně jeho zbarvení. Roztok musí být čirý nebo lehce opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo jsou v nich částice. Rekonstituovaný roztok je třeba použít okamžitě a ne déle než 3 hodiny po rekonstituci. Lze přidat isotonický roztok chloridu sodného 9 mg/ml (0,9 %), získáte tak koncentraci vhodnou pro podávání. Podání Po úplném rozpuštění lze rekonstituovaný přípravek natáhnout do sterilní jednorázové injekční stříkačky. Rekonstituovaný přípravek je nutné podávat intravenózní infúzí pomocí sterilní jednorázové injekční stříkačky nebo infuzního vaku s filtrační vložkou o velikosti pórů 0,22 mikronů. Obsah stříkaček je nutné podávat okamžitě a ne déle než 3 hodiny po rekonstituci. Po rekonstituci je nutné podávat roztok připravený v infuzních vacích okamžitě a ne déle než 8 hodin po naředění. Kompatibilita s infuzními hadičkami z PVC s filtračními vložkami byla prokázána. Likvidace Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI GTC Biotherapeutics UK Limited 10 Norwich Street London EC4A 1 BD VELKÁ BRITÁNIE 8. REGISTRAČNÍ ČÍSLO(A) EU/1/06/355/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 28. července 2006 Datum posledního prodloužení registrace: 5. srpna DATUM REVIZE TEXTU Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky 8
9 PŘÍLOHA II A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE> D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ 9
10 A. VÝROBCE/VÝROBCI BIOLOGICKÉ LÉČIVÉ LÁTKY /BIOLOGICKÝCH LÉČIVÝCH A VÝROBCE ODPOVĚDNÝ/VÝROBCI ODPOVĚDNÍ ZA PROPOUŠTĚNÍ ŠARŽÍ Název a adresa výrobce/výrobců biologické léčivé látky/biologických léčivých látek Lonza Biologics, Inc. 97 South Street Hopkinton, MA USA Název a adresa výrobce odpovědného/výrobců odpovědných za propouštění šarží MedImmune Pharma BV Lagelandseweg CG Nijmegen, Nizozemsko B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Výdej léčivého přípravku je vázán na lékařský předpis s omezením (viz příloha I: Souhrn údajů o přípravku, bod 4.2). C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE Pravidelně aktualizované zprávy o bezpečnosti Požadavky pro předkládání pravidelně aktualizovaných zpráv o bezpečnosti pro tento léčivý přípravek jsou uvedeny v seznamu referenčních dat Unie (seznam EURD) stanoveném v čl. 107c odst. 7 směrnice 2001/83/ES a jakékoli následné změny jsou zveřejněny na evropském webovém portálu pro léčivé přípravky. D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU Plán řízení rizik (RMP) Držitel rozhodnutí o registraci uskuteční požadované činnosti a intervence v oblasti farmakovigilance podrobně popsané ve schváleném RMP uvedeném v modulu registrace a ve veškerých schválených následných aktualizacích RMP. Aktualizovaný RMP je třeba předložit: na žádost Evropské agentury pro léčivé přípravky, při každé změně systému řízení rizik, zejména v důsledku obdržení nových informací, které mohou vést k významným změnám poměru přínosů a rizik, nebo z důvodu dosažení význačného milníku (v rámci farmakovigilance nebo minimalizace rizik). E. ZVLÁŠTNÍ POVINNOST USKUTEČNIT POREGISTRAČNÍ OPATŘENÍ PRO REGISTRACI PŘÍPRAVKU ZA VÝJIMEČNÝCH OKOLNOSTÍ>> Tato registrace byla schválena za výjimečných okolností, a proto podle článku 14(8) nařízení (ES) č. 726/2004 držitel rozhodnutí o registraci uskuteční v daném termínu následující opatření: Popis Protokol GTC AT HD : Multicentrická, nadnárodní studie posuzující bezpečnost a účinnost antitrombinu alfa u pacientů s vrozenou deficiencí antitrombinu (AT) v situacích představujících vysoké riziko trombózy. Termín splnění 31/03/
11 Popis Budou předloženy výsledky dokončené studie GTC AT HD a zejména výsledky šetření u těhotných pacientek léčených během peripartálního období. Bude předložena změna registrace s cílem rozšířit indikace a dávkování pro těhotné ženy. Postmarketingové sledování a) Před uvedením na trh v libovolné členské zemi EU, držitel rozhodnutí o registraci připraví postmarketingový program sledování pro sběr následujících informací o pacientech s vrozeným deficitem AT léčených přípravkem ATryn Demografie Indikace Dávkování a způsob podání Délka léčby Před léčbou pomocí přípravku ATryn Použití antikoagulans Nežádoucí účinky léčiva včetně nedostatku účinnosti Tvorba protilátek Termín splnění 31/03/2018 Lékaři by se měli povzbuzovat k zařazení pacientů do programu sledování a výsledky sledování by se měly poskytovat při aktualizaci EU-RMP (EU Risk Management Plan) nebo v době ročního přehodnocení, v závislosti na tom, co nastane dříve. b) Před uvedením na trh v libovolné členské zemi EU, držitel rozhodnutí o registraci připraví program imunologického sledování a poskytne lékařům testování protilátek pro anti-atryn protilátky. Toto testování protilátek se musí poskytnout na požádání lékaře a když držitel rozhodnutí o registraci obdrží zprávu naznačující možnou imunitní reakci nebo nedostatek účinnosti. c) Držitel rozhodnutí o registraci zajistí, že materiál poskytnutý lékařům poskytuje informace o postmarketingovém programu sledování a o programu imunologického sledování. Tento postmarketingový program sledování bude běžet až do té doby, než do něho bude zahrnuto 40 pacientů. 11
12 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 12
13 A. OZNAČENÍ NA OBALU 13
14 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (1, 10 NEBO 25 INJEKČNÍCH LAHVIČEK) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ATryn IU prášek pro infuzní roztok. antitrombin alfa (rdna) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna injekční lahvička obsahuje nominálně 1750 IU antitrombinum alfa*. Po rekonstituci obsahuje 1 ml roztoku 175 IU antitrombinum alfa. * rekombinantní forma lidského antitrombinu. 3. SEZNAM POMOCNÝCH LÁTEK Pomocné látky: Glycin Chlorid sodný Natrium-citrát 4. LÉKOVÁ FORMA A OBSAH BALENÍ Prášek pro infuzní roztok (1750 IU) 1 injekční lahvička 10 injekčních lahviček 25 injekčních lahviček 5. ZPŮSOB A CESTA/CESTY PODÁNÍ Intravenózní podání. Před použitím si přečtěte příbalovou informaci. 6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ Uchovávejte mimo dohled a dosah dětí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ 8. POUŽITELNOST EXP 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v chladničce. 10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Určeno pouze k jednorázovému použití. 14
15 Jakýkoli nepoužitý léčivý přípravek zlikvidujte v souladu s místními požadavky. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI GTC Biotherapeutics UK Limited 10 Norwich Street Londýn, Velká Británie 12. REGISTRAČNÍ ČÍSLO/ČÍSLA EU/1/06/355/001 EU/1/06/355/002 EU/1/06/355/ ČÍSLO ŠARŽE <, KÓD DÁRCE A KÓD LÉČIVÉHO PŘÍPRAVKU> Č. šarže 14. KLASIFIKACE PRO VÝDEJ Výdej léčivého přípravku vázán na lékařský předpis. 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVĚ PÍSMU Nevyžaduje se - odůvodnění přijato 15
16 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK INJEKČNÍ LAHVIČKY 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ ATryn IU prášek pro infuzní roztok antitrombin alfa (rdna) Intravenózní podání. 2. ZPŮSOB PODÁNÍ 3. POUŽITELNOST EXP 4. ČÍSLO ŠARŽE Č. šarže. 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 1750 IU antitrombinu alfa 6. JINÉ Uchovávejte v chladničce. GTC Biotherapeutics UK Limited, Londýn, Velká Británie 16
17 B. PŘÍBALOVÁ INFORMACE 17
18 Příbalová informace: informace pro uživatele ATryn 1750 IU prášek pro infuzní roztok antitrombinum alfa (rdna) Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Jak hlásit nežádoucí účinky je popsáno v závěru bodu 4. Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás důležité údaje. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. - Máte-li jakékoli další otázky, zeptejte se svého lékaře. - Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Viz bod 4. Co naleznete v této příbalové informaci 1. Co je ATryn a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete ATryn používat 3. Jak se Atryn používá 4. Možné nežádoucí účinky 5 Jak přípravek ATryn uchovávat 6. Obsah balení a další informace 1. Co je ATryn a k čemu se používá ATryn obsahuje antitrombin alfa, který je podobný přirozeně se vyskytujícímu lidskému antitrombinu. Antitrombin v těle blokuje trombin, což je látka, která hraje hlavní úlohu při srážení krve. Máte-li vrozený nedostatek antitrombinu, je hladina antitrombinu v krvi nižší než normálně. To může mít za následek zvýšenou tendenci ke srážení krve v cévách. Může to být v cévách nohou (trombóza hlubokých žil) nebo dalších cévách těla (tromboembolické onemocnění). Během těžšího chirurgického zákroku je toto riziko tendence ke srážení krve ještě větší. Proto je důležité, aby byla hladina antitrombinu v krvi v takových situacích udržována na dostatečné úrovni. Tento léčivý přípravek je podáván pacientům, kteří mají vrozený nedostatek antitrombinu (dědičná nízká hladina proteinu antitrombinu). Podává se při operacích k zabránění výskytu problémů v důsledku tvoření krevních sraženin v cévách. Obvykle se podává ve spojení s heparinem nebo nízkomolekulárním heparinem (další látka, která pomáhá bránit tvorbě krevních sraženin). 2. Čemu musíte věnovat pozornost, než začnete Atryn používat Nepoužívejte ATryn: - Jestliže jste alergický/á (přecitlivělý/á) na antitrombin alfa nebo kteroukoli další složku přípravku ATryn. - Jestliže máte alergii na kozí produkty, jako je antitrombin alfa vyráběný technologií rekombinantní DNA (rdna) v mléce transgenních koz.. Upozornění a opatření Pokud se u vás projeví vyrážka, svědivé podlitiny nebo otoky po celé kůži, pocit tlaku na prsou, sípot (obtížně se vám dýchá), okamžitě se obraťte na svého lékaře, neboť se může jednat o příznaky těžké alergické reakce. Pro účely zjištění, zda u Vás nedošlo ke vzniku alergické reakce, Vám může být před podáním přípravku ATryn a za určitou dobu po jeho podání odebrána a vyšetřena krev. Děti a dospívající 18
19 K dispozici nejsou žádné informace o podávání přípravku ATryn pacientům mladším 18 let. Tento léčivý přípravek Vám proto nemá být podáván, pokud je Vám méně než 18 let. Další léčivé přípravky a ATryn Informujte svého lékaře o všech lécích, které užíváte, které jste v nedávné době užíval(a) nebo které možná budete užívat. Pokud se ATryn používá společně s heparinem (lék snižující srážlivost krve), nebo s jinými léky snižujícími srážlivost krve, může se zvýšit riziko krvácení. Váš lékař proto bude bedlivě sledovat užívání tohoto léčivého přípravku, pokud bude podáván společně s těmito léky snižujícími srážlivost krve. Těhotenství a kojení Přípravek ATryn není indikován pro použití u těhotných žen. Není známo, zda je ATryn přítomen v mateřském mléku. Proto se během léčby přípravkem ATryn nedoporučuje kojení. ATryn obsahuje sodík Tento přípravek obsahuje 1,65 mmol (nebo 37,9 mg) sodíku v jedné injekční lahvičce. Nutno vzít v úvahu u pacientů na dietě s nízkým obsahem sodíku. 3. Jak se ATryn používá Vaše léčba bude zahájena pod dohledem lékaře se zkušenostmi s péčí o pacienty s vrozeným nedostatkem antitrombinu. Zdravotnické zařízení připraví roztok přípravku ATryn, který vám bude podáván do žíly. Aby u Vás nedošlo k rozvoji tvorby krevních sraženin, bude Vám lék podáván až do doby, kdy lékař rozhodne, že je bezpečné léčbu ukončit. Jestliže jste použil více ATryn, než jste měl Lékař Vám poskytne vhodnou léčbu, pokud se u Vás objeví konkrétní nežádoucí účinky. Jestliže jste přestal používatatryn O možnosti ukončení léčby přípravkem ATryn se prosím poraďte se svým lékařem. Máte-li jakékoli další otázky, týkající se užívání tohoto léku, zeptejte se svého lékaře. 4. Možné nežádoucí účinky Podobně jako všechny léky, může mít i přípravek ATryn nežádoucí účinky, které se ale nemusí vyskytnout u každého. Pokud u Vás dojde ke vzniku kopřivky, svědivých podlitin nebo výronů, tlaku na hrudi, dušnosti (potíže s dýcháním), měl/a byste ihned vyhledat lékaře, jelikož se může jednat o příznaky těžké alergické reakce. U studií s přípravkem ATryn byly hlášeny následující nežádoucí účinky: Časté nežádoucí účinky (mohou postihnout až 1 z 10 osob) jsou: svědění v místě infúze závratě bolest hlavy krvácení (v místě infúze nebo po operaci) nevolnost Méně časté nežádoucí účinky (mohou postihnout až 1 ze 100 osob) jsou: pocit horka reakce v místě infúze, jako bolest, podlitiny a zarudnutí Hlášení nežádoucích účinků Pokud se u Vás vyskytne kterýkoli z nežádoucích účinků, sdělte to svému lékaři. Stejně postupujte v případě jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci. Nežádoucí účinky můžete 19
20 hlásit také přímo prostřednictvím národního systému hlášení nežádoucích účinků uvedeného v Dodatku V. Nahlášením nežádoucích účinků můžete přispět k získání více informací o bezpečnosti tohoto přípravku.. 5. Jak Atryn uchovávat Uchovávejte mimo dohled a dosah dětí. Neotevřené injekční lahvičky: Uchovávejte v chladničce (2 C 8 C). Nepoužívejte tento přípravek po uplynutí doby použitelnosti uvedené na krabičce a štítku injekční lahvičky za EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Rekonstituované/rozředěné roztoky: Z mikrobiologického hlediska by měl být přípravek použit okamžitě po rekonstituci. Nicméně chemická a fyzikální stabilita byla prokázána po dobu 3 hodin po rekonstituci a 8 hodin po rozředění při teplotě do 25 C. 6. Obsah balení a další informace Co přípravek ATryn obsahuje Léčivou látkou je antitrombin alfa*: 1750 IU. Po rekonstituci obsahuje 1 ml roztoku 175 IU antitrombinu alfa. Specifická aktivita přípravku ATryn je asi 7 IU/mg proteinu. * rekombinantní forma lidského antitrombinu, která se vyrábí technologií rekombinantní DNA v mléce transgenních koz (rdna). Pomocnými látkami jsou: glycin, chlorid sodný, natrium-citrát. Jak přípravek ATryn vypadá a co obsahuje toto balení Přípravek ATryn je dodáván jako prášek pro přípravu infuzního roztoku (1750 IU prášku v injekční lahvičce) Prášek je bílý až téměř bílý. Velikosti balení: 1, 10 nebo 25 injekčních lahviček. Držitel rozhodnutí o registraci a výrobce Držitel rozhodnutí o registraci GTC Biotherapeutics UK Limited, 10 Norwich Street, London EC4A 1BD, VELKÁ BRITÁNIE. Výrobce MedImmune Pharma BV Lagelandseweg CG Nijmegen, Nizozemsko. Tato příbalová informace byla naposledy revidována Tento léčivý přípravek byl registrován za výjimečných okolností. Znamená to, že vzhledem ke vzácné povaze tohoto onemocnění nebylo možné získat o tomto léčivém přípravku úplné informace. Evropská agentura pro léčivé přípravky každoročně vyhodnotí jakékoli nové informace týkající se tohoto léčivého přípravku a tato příbalová informace bude podle potřeby aktualizována. 20
21 Podrobné informace o tomto léčivém přípravku jsou k dispozici na webových stránkách Evropské agentury pro léčivé přípravky < > Následující informace jsou určeny pouze pro zdravotnické pracovníky: Tento léčivý přípravek je určen pouze na jedno použití. Rekonstituce/ředění Injekční lahvičky musejí být před rekonstitucí přeneseny do teploty do 25 C. Prášek je nutné rekonstituovat 10 ml vody na injekci, která se vstříkne podél boční stěny injekční lahvičky a jemně rozvíří (netřepejte s ní), abyste zabránili vzniku pěny. Rekonstituovaný roztok je nutné před podáním vizuálně zkontrolovat, zda neobsahuje pevné částice a/nebo nedošlo ke změně jeho zabarvení. Roztok musí být čirý nebo slabě opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo jsou v nich částice. Injekční lahvičky je nutné použít okamžitě a ne déle než 3 hodiny po rekonstituci. Lze přidat isotonický roztok chloridu sodného 9 mg/ml (0,9%), získáte tak koncentraci vhodnou pro podávání. Podání Po úplném rozpuštění lze rekonstituovaný přípravek natáhnout do sterilní injekční jednorázové stříkačky. Rekonstituovaný přípravek je nutné podávat intravenózní infuzí pomocí sterilní injekční jednorázové stříkačky nebo infuzního vaku s filtrační vložkou o velikosti pórů 0,22 mikronů. Obsah stříkaček je nutné podávat okamžitě a ne déle než 3 hodiny po rekonstituci. Po rekonstituci je nutné podávat roztok připravený v infuzních vacích okamžitě a ne déle než 8 hodin po naředění. Kompatibilita s infuzními hadičkami z PVC s filtračními vložkami byla prokázána. Likvidace Všechen nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Terapeutickým cílem léčby antitrombinem alfa je zvýšit a udržovat aktivitu antitrombinu mezi % (0,8 1,2 IU/ml) po dobu trvání léčby. Počáteční léčba začíná podáním nasycovací dávky, jejímž cílem je dosažení 100% úrovně aktivity antitrombinu. Počáteční nasycovací dávka je založena na tělesné hmotnosti a na úrovni aktivity antitrombinu před léčbou. Požadovaná nasycovací dávka se stanoví podle následujícího vzorce: Nasycovací dávka (IU) = [(100 aktivita AT pacienta před léčbou v %) /2,28] x tělesná hmotnost v kg Obvyklá nasycovací dávka u chirurgických pacientů (výchozí aktivita AT 50 %, tělesná hmotnost 75 kg) s vrozeným deficitem antitrombinu v rizikových klinických situacích je IU/kg tělesné hmotnosti. Nasycovací dávku je nutné podat jako 15 minutovou infúzi, po níž je okamžitě aplikována udržovací infúze. Požadovaná udržovací dávka pro chirurgické pacienty je podávána jako kontinuální infúze a stanoví se dle dále uvedeného vzorce: Udržovací dávka (IU/hodinu) = [(100 aktivita AT pacienta před léčbou v %) /10,22] x tělesná hmotnost v kg Obvyklá udržovací dávka u chirurgických pacientů s vrozeným deficitem antitrombinu v rizikových klinických situacích činí 4 5IU./kg/h. Během vysilujících stavů (např. těžký chirurgický zákrok, 21
22 konkomitantní podávání heparinu) může být aktuální dávka vyšší. Viz doporučení pro monitorování lékových hladin a úpravu dávkování. V léčbě je nutno pokračovat, dokud nedojde ke snížení rizika vzniku žilního tromboembolismu, a/nebo dokud nebude navozena účinná následná antikoagulace. Monitorování lékových hladin a úprava dávkování Dávku je nutné upravit na základě laboratorních měření aktivity antitrombinu. Odezva se může u jednotlivých pacientů lišit a může dosahovat různých úrovní recovery in vivo a různých poločasů. Při zahájení léčby a těsně po chirurgickém zákroku může být nutné časté hodnocení aktivity antitrombinu a úprava dávkování. Po zahájení infúze udržovací dávky je nutné odebrat krev pro stanovení úrovně aktivity AT 45 minut po zahájení podávání infúze nasycovací dávky. V případě, že se aktivita AT pohybuje v rozmezí 80 % až 120 % (0,8-1,2 IU/ml), není nutné upravovat dávkování. V případě, že je aktivita AT nižší než 80 %, zvyšte rychlost udržovací infúze o 50 %. V případě, že je aktivita AT vyšší než 120 %, snižte rychlost infúze o 30 %. Zkontrolujte úroveň aktivity AT 30 minut po jakékoli změně rychlosti infúze nebo čtyři hodiny po té, co se hodnota pohybuje v cílovém rozmezí. Dále je nutné aktivitu antitrombinu kontrolovat jednou až dvakrát denně a dávku upravit odpovídajícím způsobem. Úroveň hladiny antitrombinu musí být udržována vyšší než 80 % po dobu trvání léčby, pokud klinické údaje neindikují jinou účinnou hladinu. Je možné, že chirurgický výkon ovlivní úrovně aktivity AT. Proto po operaci nutné provést další kontrolu úrovně aktivity AT. V případě, že je úroveň aktivity AT nižší než 80 %, lze podat 15 minutovou infúzi bolusu AT, aby se rychle obnovila úroveň aktivity AT. Dávku lze vypočítat tak, že použijete aktivitu AT po chirurgickém zákroku ve vzorci pro výpočet nasycovací dávky uvedeném výše. Pediatrická populace Bezpečnost a účinnost přípravku ATryn u dětí a dospívajících (<18 let) nebyla doposud stanovena. K dispozici nejsou žádné údaje. Hladina antitrombinu u dětí se může lišit od hladiny u dospělých, a to především u novorozenců. Způsob podání Intravenózní podání. Nasycovací dávku je nutné podat jako 15minutovou infúzi, po níž je okamžitě aplikována udržovací infúze. 22
Pomocné látky: natrium-kalcium-edetát trometamol-hydrochlorid trometamol roztok hydroxidu sodného 1mol/l kyselina chlorovodíková 25% voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější obal 20ml/ 50ml/ 60ml/ 100ml/ 150ml/ 200ml/ 500ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU XENETIX 300 300 mgi/ml Iobitridolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Iobitridolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější obal 20ml/ 50ml/ 60ml/ 100ml/ 150ml/ 200ml/ 500ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU XENETIX 300 300 mgi/ml Iobitridolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Iobitridolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička pro PVC-Al blistry a HDPE lahvičky 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. Pregabalin Archie Samuel 150 mg tvrdé tobolky
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na HDPE lahvičky 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na HDPE lahvičky 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg
Voda na injekci, hydrogenuhličitan sodný, hydroxid sodný, kyselina chlorovodíková
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (KARTONOVÁ KRABICE) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU balance 2,3% glucose, 1,75 mmol/l calcium 2. OBSAH LÉČIVÝCH LÁTEK 1 litr roztoku připraveného k použití obsahuje: Natrii chloridum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (KARTONOVÁ KRABICE) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU balance 2,3% glucose, 1,75 mmol/l calcium 2. OBSAH LÉČIVÝCH LÁTEK 1 litr roztoku připraveného k použití obsahuje: Natrii chloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III
 sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
BIOVISC ORTHO SINGLE
 Česky BIOVISC ORTHO SINGLE Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová 30 mg Fosfátem pufrovaný fyziologický
Česky BIOVISC ORTHO SINGLE Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová 30 mg Fosfátem pufrovaný fyziologický
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem
 sp.zn. sukls143762/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Atenativ je ve formě
sp.zn. sukls143762/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Atenativ je ve formě
Příbalová informace: informace pro pacienta. Panadol Baby čípky paracetamolum čípky
 sp. zn. sukls29099/2016 Příbalová informace: informace pro pacienta Panadol Baby čípky paracetamolum čípky Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp. zn. sukls29099/2016 Příbalová informace: informace pro pacienta Panadol Baby čípky paracetamolum čípky Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Ruconest 2100 j. prášek pro přípravu injekčního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 2100 jednotek conestatum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Ruconest 2100 j. prášek pro přípravu injekčního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 2100 jednotek conestatum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční stříkačce Gadobutrolum
 Sp.z. sukls177880/2014 a k sp.zn. sukls129971/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční
Sp.z. sukls177880/2014 a k sp.zn. sukls129971/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gadovist 1,0 mmol/ml injekční roztok Gadobutrolum Gadovist 1,0 mmol/ml injekční roztok v předplněné injekční
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009. PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum
 Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Betaserc 24 tablety Betahistini dihydrochloridum
 sp.zn. sukls142274/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Betaserc 24 tablety Betahistini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls142274/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Betaserc 24 tablety Betahistini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: Informace pro pacienta
 Sp.zn.sukls112683/2014 Příbalová informace: Informace pro pacienta Betahistin-ratiopharm 16 mg tablety (betahistini dihydrochloridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls112683/2014 Příbalová informace: Informace pro pacienta Betahistin-ratiopharm 16 mg tablety (betahistini dihydrochloridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FACTOR VII BAXTER 600 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ FACTOR VII BAXTER je dodáván ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FACTOR VII BAXTER 600 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ FACTOR VII BAXTER je dodáván ve formě
Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas 133,5 mg a calcii carbonas 80 mg.
 Sp.zn.sukls222111/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gaviscon žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas
Sp.zn.sukls222111/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gaviscon žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas
PROVÁDĚCÍ ROZHODNUTÍ KOMISE. ze dne 11.1.2012
 EVROPSKÁ KOMISE V Bruselu dne 11.1.2012 K(2011)10128 v konečném znění PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 11.1.2012 kterým se zamítá stanovení léčivého přípravku Tecovirimat jako léčivého přípravku pro
EVROPSKÁ KOMISE V Bruselu dne 11.1.2012 K(2011)10128 v konečném znění PROVÁDĚCÍ ROZHODNUTÍ KOMISE ze dne 11.1.2012 kterým se zamítá stanovení léčivého přípravku Tecovirimat jako léčivého přípravku pro
Příbalová informace: Informace pro uživatele. Sclefic 50 mg potahované tablety riluzolum
 sp.zn. sukls94414/2013 Příbalová informace: Informace pro uživatele Sclefic 50 mg potahované tablety riluzolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls94414/2013 Příbalová informace: Informace pro uživatele Sclefic 50 mg potahované tablety riluzolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro uživatele. Voluven. 6% infuzní roztok
 sp.zn. sukls12104/2014 Příbalová informace: informace pro uživatele Voluven 6% infuzní roztok Hydroxyethylamyla (hydroxyethylškroby, HES 130/0,4) v izotonickém roztoku chloridu sodného Tento přípravek
sp.zn. sukls12104/2014 Příbalová informace: informace pro uživatele Voluven 6% infuzní roztok Hydroxyethylamyla (hydroxyethylškroby, HES 130/0,4) v izotonickém roztoku chloridu sodného Tento přípravek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
Příbalová informace: Informace pro uživatele
 Příbalová informace: Informace pro uživatele Flolan 0,5 mg, prášek a rozpouštědlo pro infuzní roztok Flolan 1,5 mg, prášek a rozpouštědlo pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Příbalová informace: Informace pro uživatele Flolan 0,5 mg, prášek a rozpouštědlo pro infuzní roztok Flolan 1,5 mg, prášek a rozpouštědlo pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls153370-72/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gemtex 200 mg, prášek pro přípravu infuzního roztoku Gemtex 1 000 mg, prášek pro přípravu
Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls153370-72/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gemtex 200 mg, prášek pro přípravu infuzního roztoku Gemtex 1 000 mg, prášek pro přípravu
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Atosiban SUN 6,75 mg/0,9 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 0,9 ml roztoku obsahuje atosibanum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Atosiban SUN 6,75 mg/0,9 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička s 0,9 ml roztoku obsahuje atosibanum
Sp.zn.sukls74932/2014 Příbalová informace: informace pro uživatele. Desloratadin STADA 5 mg potahované tablety desloratadinum
 Sp.zn.sukls74932/2014 Příbalová informace: informace pro uživatele Desloratadin STADA 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls74932/2014 Příbalová informace: informace pro uživatele Desloratadin STADA 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum
 Příbalová informace: informace pro uživatele Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Kyprolis 60 mg prášek pro infuzní roztok carfilzomibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Kyprolis 60 mg prášek pro infuzní roztok carfilzomibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls23305/2011
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls23305/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FENTANYL-JANSSEN, 0,5 mg/10 ml, injekční roztok Fentanylum Přečtěte si pozorně celou
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls23305/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FENTANYL-JANSSEN, 0,5 mg/10 ml, injekční roztok Fentanylum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Obsah anti-d imunoglobulinu obsaženého v přípravku PARTOBULIN SDF je stanoven metodou dle Evropského lékopisu.
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls215609/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PARTOBULIN SDF Lidský anti-d imunoglobulin k intramuskulárnímu podání. 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls215609/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PARTOBULIN SDF Lidský anti-d imunoglobulin k intramuskulárnímu podání. 2. KVALITATIVNÍ
1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
 Příloha č. 2 k opravě rozhodnutí o změně registrace sp.zn. sukls141465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
Příloha č. 2 k opravě rozhodnutí o změně registrace sp.zn. sukls141465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Příbalová informace: informace pro pacienta Hexvix, 85 mg, prášek a rozpouštědlo pro přípravu roztoku do močového měchýře. hexylis aminolevulinatis
 Příbalová informace: informace pro pacienta Hexvix, 85 mg, prášek a rozpouštědlo pro přípravu roztoku do močového měchýře hexylis aminolevulinatis Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro pacienta Hexvix, 85 mg, prášek a rozpouštědlo pro přípravu roztoku do močového měchýře hexylis aminolevulinatis Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fertavid 150 IU/0,18 ml injekční roztok follitropinum beta Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prekurzor radiofarmaka Yttriga, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sterilního roztoku obsahuje 0,1-300 GBq yttria ( 90 Y) (což
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prekurzor radiofarmaka Yttriga, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sterilního roztoku obsahuje 0,1-300 GBq yttria ( 90 Y) (což
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls44489/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls44489/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Haemate P
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls76361/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Haemate P Prášek pro přípravu injekčního roztoku s rozpouštědlem. (lidský koagulační faktor
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls76361/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Haemate P Prášek pro přípravu injekčního roztoku s rozpouštědlem. (lidský koagulační faktor
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Jedna předplněná injekční stříkačka obsahuje immunoglobulinum humanum anti-d 1500 IU (300 mikrogramů).
 sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍBALOVÁ INFORMACE 22
 PŘÍBALOVÁ INFORMACE 22 Příbalová informace: Informace pro uživatele VELETRI 0,5 mg prášek pro infuzní roztok VELETRI 1,5 mg prášek pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE 22 Příbalová informace: Informace pro uživatele VELETRI 0,5 mg prášek pro infuzní roztok VELETRI 1,5 mg prášek pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná Pro dospělé Přečtěte
Příbalová informace: informace pro uživatele VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná Pro dospělé Přečtěte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Canifug-Lösung 1%
 sp.zn. :sukls129584/2012 a sp.zn.:sukls 130459/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Canifug-Lösung 1% Kožní sprej, roztok (Clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve,
sp.zn. :sukls129584/2012 a sp.zn.:sukls 130459/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Canifug-Lösung 1% Kožní sprej, roztok (Clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Levoftamid 5 mg/ml, oční kapky, roztok Levofloxacinum hemihydricum
 Sp. zn. sukls178097/2014 Příbalová informace: informace pro pacienta Levoftamid 5 mg/ml, oční kapky, roztok Levofloxacinum hemihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp. zn. sukls178097/2014 Příbalová informace: informace pro pacienta Levoftamid 5 mg/ml, oční kapky, roztok Levofloxacinum hemihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka se známým účinkem: 1 g masti obsahuje 2 mg kyseliny sorbové.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum 4 mg a nicoboxilum 25 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum 4 mg a nicoboxilum 25 mg. Pomocná látka se známým účinkem:
Příbalová informace: informace pro pacienta. Acetylcystein Saneca 600 mg šumivé tablety acetylcysteinum
 Sp.zn.sukls32697/2015 Příbalová informace: informace pro pacienta Acetylcystein Saneca 600 mg šumivé tablety acetylcysteinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls32697/2015 Příbalová informace: informace pro pacienta Acetylcystein Saneca 600 mg šumivé tablety acetylcysteinum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
RADA EVROPSKÉ UNIE. Brusel 16. dubna 2013 (OR. en) 8481/13 DENLEG 34 AGRI 240
 RADA EVROPSKÉ UNIE Brusel 16. dubna 2013 (OR. en) 8481/13 DENLEG 34 AGRI 240 PRŮVODNÍ POZNÁMKA Odesílatel: Evropská komise Datum přijetí: 11. dubna 2013 Příjemce: Generální sekretariát Rady Č. dok. Komise:
RADA EVROPSKÉ UNIE Brusel 16. dubna 2013 (OR. en) 8481/13 DENLEG 34 AGRI 240 PRŮVODNÍ POZNÁMKA Odesílatel: Evropská komise Datum přijetí: 11. dubna 2013 Příjemce: Generální sekretariát Rady Č. dok. Komise:
Příbalová informace: informace pro uživatele. Febichol 100 mg měkké tobolky (fenipentolum)
 sp.zn.: sukls41365/2009 Příbalová informace: informace pro uživatele Febichol 100 mg měkké tobolky (fenipentolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.: sukls41365/2009 Příbalová informace: informace pro uživatele Febichol 100 mg měkké tobolky (fenipentolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek užívat,
1. NÁZEV PŘÍPRAVKU. Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
1. NÁZEV PŘÍPRAVKU Orgalutran 0,25 mg/0,5 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Předplněná injekční stříkačka obsahuje 0,25 mg ganirelixum v 0,5 ml vodného roztoku. Léčivá látka ganirelixum
sp.zn. sukls99903/2013
 sp.zn. sukls99903/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN POMERANČ BEZ CUKRU 8,75 mg pastilky flurbiprofenum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls99903/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN POMERANČ BEZ CUKRU 8,75 mg pastilky flurbiprofenum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Panadol potahované tablety paracetamolum
 sp.zn. sukls251375/2011 (OTC) PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Panadol potahované tablety paracetamolum Přečtětě si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls251375/2011 (OTC) PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Panadol potahované tablety paracetamolum Přečtětě si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: informace pro pacienta. Integrilin 0,75 mg/ml infuzní roztok eptifibatidum
 Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
ZODAC GTT 10 mg/ml perorální kapky, roztok cetirizini dihydrochloridum
 sp.zn.sukls170782/2014 Příbalová informace: informace pro pacienta ZODAC GTT 10 mg/ml perorální kapky, roztok cetirizini dihydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn.sukls170782/2014 Příbalová informace: informace pro pacienta ZODAC GTT 10 mg/ml perorální kapky, roztok cetirizini dihydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. Cezera 5 mg potahované tablety levocetirizini dihydrochloridum
 Sp.zn.sukls125653/2015 Příbalová informace: informace pro uživatele Cezera 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls125653/2015 Příbalová informace: informace pro uživatele Cezera 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
1. CO JE PŘÍPRAVEK OFTAQUIX OČNÍ KAPKY A K ČEMU SE POUŽÍVÁ
 Příloha č. 2 k rozhodnutí o prodloužení registrace č.j. sukls1207/2006 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Oftaquix 5 mg/ml oční kapky Levofloxacinum Přečtěte si, prosím, pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o prodloužení registrace č.j. sukls1207/2006 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Oftaquix 5 mg/ml oční kapky Levofloxacinum Přečtěte si, prosím, pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tractocile 6,75 mg/0,9 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička 0,9 ml roztoku obsahuje 6,75 mg atosibanum (ve formě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Tractocile 6,75 mg/0,9 ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička 0,9 ml roztoku obsahuje 6,75 mg atosibanum (ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příbalová informace: Informace pro pacienta
 Sp. zn. sukls99747/2013, sukls99748/2013 Příbalová informace: Informace pro pacienta Cefepim MIP 1 g, prášek pro injekční/infuzní roztok Cefepim MIP 2 g, prášek pro injekční/infuzní roztok cefepimum Přečtěte
Sp. zn. sukls99747/2013, sukls99748/2013 Příbalová informace: Informace pro pacienta Cefepim MIP 1 g, prášek pro injekční/infuzní roztok Cefepim MIP 2 g, prášek pro injekční/infuzní roztok cefepimum Přečtěte
Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen
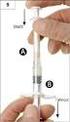 Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen NovoThirteen : rekombinantní léčba vrozeného nedostatku podjednotky A faktoru XIII Před použitím přípravku NovoThirteen je důležité
Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen NovoThirteen : rekombinantní léčba vrozeného nedostatku podjednotky A faktoru XIII Před použitím přípravku NovoThirteen je důležité
Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54
1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE. Gemcitabin Mylan 38 mg/ml prášek pro přípravu infuzního roztoku gemcitabini hydrochloridum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Gemcitabin Mylan 38 mg/ml prášek pro přípravu infuzního roztoku gemcitabini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Gemcitabin Mylan 38 mg/ml prášek pro přípravu infuzního roztoku gemcitabini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum
 sp.zn. sukls184192/2014 Příbalová informace: informace pro uživatele Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls184192/2014 Příbalová informace: informace pro uživatele Enap i.v. 1,25 mg/1 ml injekční roztok enalaprilatum dihydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Označování dle 11/2002 označování dle ADR, označování dle CLP
 Označování dle 11/2002 označování dle ADR, označování dle CLP Nařízení 11/2002 Sb., Bezpečnostní značky a signály 4 odst. 1 nařízení 11/2002 Sb. Nádoby pro skladování nebezpečných chemických látek, přípravků
Označování dle 11/2002 označování dle ADR, označování dle CLP Nařízení 11/2002 Sb., Bezpečnostní značky a signály 4 odst. 1 nařízení 11/2002 Sb. Nádoby pro skladování nebezpečných chemických látek, přípravků
Příbalová informace: informace pro pacienta. Atosiban Accord 37,5 mg/5 ml koncentrát pro infuzní roztok. atosibanum
 Sp.zn.sukls113617/2014 Příbalová informace: informace pro pacienta Atosiban Accord 37,5 mg/5 ml koncentrát pro infuzní roztok atosibanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls113617/2014 Příbalová informace: informace pro pacienta Atosiban Accord 37,5 mg/5 ml koncentrát pro infuzní roztok atosibanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.: sukls244138/2011
 sp.zn.: sukls244138/2011 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná
sp.zn.: sukls244138/2011 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VAQTA Adult 50 U/ml injekční suspenze v předplněné injekční stříkačce Očkovací látka proti hepatitidě typu A, inaktivovaná, adsorbovaná
Příbalová informace: informace pro uživatele. APO-BICALUTAMID 150 mg potahované tablety (bicalutamidum)
 Příbalová informace: informace pro uživatele APO-BICALUTAMID 150 mg potahované tablety (bicalutamidum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele APO-BICALUTAMID 150 mg potahované tablety (bicalutamidum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele. Herbapax Sirup
 sp.zn. sukls17122/2014 Příbalová informace: informace pro uživatele Herbapax Sirup Přečtěte si pozorně tuto příbalovou informaci, dříve, než začnete tento přípravek užívat protože obsahuje pro vás důležité
sp.zn. sukls17122/2014 Příbalová informace: informace pro uživatele Herbapax Sirup Přečtěte si pozorně tuto příbalovou informaci, dříve, než začnete tento přípravek užívat protože obsahuje pro vás důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn. sukls110147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA SOMATULINE AUTOGEL 60 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 90 mg, injekční roztok v předplněné stříkačce SOMATULINE
sp.zn. sukls110147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA SOMATULINE AUTOGEL 60 mg, injekční roztok v předplněné stříkačce SOMATULINE AUTOGEL 90 mg, injekční roztok v předplněné stříkačce SOMATULINE
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010 l. NÁZEV PŘÍPRAVKU OCTANINE F 500 OCTANINE F 1000 Prášek a rozpouštědlo pro injekční roztok Souhrn údajů o přípravku 2. KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010 l. NÁZEV PŘÍPRAVKU OCTANINE F 500 OCTANINE F 1000 Prášek a rozpouštědlo pro injekční roztok Souhrn údajů o přípravku 2. KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010
 Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Pantoprazol Pliva 40 mg I.V. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtete
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Pantoprazol Pliva 40 mg I.V. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtete
Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum
 sp.zn. sukls144430/2014 Příbalová informace: informace pro pacienta Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls144430/2014 Příbalová informace: informace pro pacienta Ebrantil i.v. 25, injekční roztok Ebrantil i.v. 50, injekční roztok urapidilum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Metronidazol B. Braun 5 mg/ml, infuzní roztok. metronidazolum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Rhesonativ 625 IU/ml, injekční
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Rhesonativ 625 IU/ml, injekční
Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRACETAM AL 800 PIRACETAM AL 1200 potahované tablety piracetamum Přečtěte si
Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRACETAM AL 800 PIRACETAM AL 1200 potahované tablety piracetamum Přečtěte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Nasomaris 1 mg/ml nosní sprej, roztok. Xylometazolini hydrochloridum
 Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls73350/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nasomaris 1 mg/ml nosní sprej, roztok Xylometazolini hydrochloridum Přečtěte si pozorně tuto
Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls73350/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nasomaris 1 mg/ml nosní sprej, roztok Xylometazolini hydrochloridum Přečtěte si pozorně tuto
Příbalová informace: informace pro pacienty. Chloramphenicol VUAB 1 g. prášek pro injekční roztok chloramphenicolum
 sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas)
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls19458/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas) Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls19458/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas) Přečtěte si pozorně
Příbalová informace: Informace pro uživatele
 Příbalová informace: Informace pro uživatele Immunate Stim Plus 1000 IU FVIII/750 IU VWF Prášek a rozpouštědlo pro injekční roztok Léčivé látky: Factor VIII coagulationis humanus/ Factor von Willebrand
Příbalová informace: Informace pro uživatele Immunate Stim Plus 1000 IU FVIII/750 IU VWF Prášek a rozpouštědlo pro injekční roztok Léčivé látky: Factor VIII coagulationis humanus/ Factor von Willebrand
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Dracenax 2,5 mg Letrozolum potahované tablety
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls172883/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dracenax 2,5 mg Letrozolum potahované tablety Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls172883/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dracenax 2,5 mg Letrozolum potahované tablety Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. DECA-DURABOLIN 50 nandroloni decanoas injekční roztok
 sp.zn.: sukls22271/2010 a sp.zn.: sukls86217/2012, sukls76090/2013, sukls93995/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DECA-DURABOLIN 50 nandroloni decanoas injekční roztok Přečtěte si pozorně
sp.zn.: sukls22271/2010 a sp.zn.: sukls86217/2012, sukls76090/2013, sukls93995/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DECA-DURABOLIN 50 nandroloni decanoas injekční roztok Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příbalová informace: Informace pro pacienta
 Sp.zn.sukls55678/2015 Příbalová informace: Informace pro pacienta Flonidan 10 mg DISTAB Tableta dispergovatelná v ústech loratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls55678/2015 Příbalová informace: Informace pro pacienta Flonidan 10 mg DISTAB Tableta dispergovatelná v ústech loratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna injekční lahvička obsahuje jmenovitě 500 m.j.* moroctocogum alfa**
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ReFacto AF 500 IU prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje jmenovitě 500 m.j.* moroctocogum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ReFacto AF 500 IU prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje jmenovitě 500 m.j.* moroctocogum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40mg prášek pro přípravu injekčního roztoku pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40mg prášek pro přípravu injekčního roztoku pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Jeden ml obsahuje: Proteinum plasmatis humani... 200 mg (čistota minimálně 98% IgG)
 1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
Příbalová informace: informace pro uživatele. Prostavasin prášek pro infuzní roztok Alprostadilum
 Příbalová informace: informace pro uživatele Prostavasin prášek pro infuzní roztok Alprostadilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Prostavasin prášek pro infuzní roztok Alprostadilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocné látky se známým účinkem: monohydrát laktózy, hlinitý lak oranžové žluti (E110).
 sp.zn. sukls113741/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AESCIN TEVA 20mg enterosolventní tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ escinum alfa 20 mg v jedné enterosolventní tabletě.
sp.zn. sukls113741/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AESCIN TEVA 20mg enterosolventní tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ escinum alfa 20 mg v jedné enterosolventní tabletě.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Oxaliplatin Hospira 5 mg/ml koncentrát pro přípravu infuzního roztoku. Oxaliplatinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Oxaliplatin Hospira 5 mg/ml koncentrát pro přípravu infuzního roztoku Oxaliplatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Oxaliplatin Hospira 5 mg/ml koncentrát pro přípravu infuzního roztoku Oxaliplatinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Nolpaza 40 mg enterosolventní tablety. Pantoprazolum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40 mg enterosolventní tablety Pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Nolpaza 40 mg enterosolventní tablety Pantoprazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
