Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls2393/2008, sukls2394/2008 a příloha k sp.zn.: sukls185930/2010, sukls185937/2010
|
|
|
- Vendula Sedláčková
- před 8 lety
- Počet zobrazení:
Transkript
1 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls2393/2008, sukls2394/2008 a příloha k sp.zn.: sukls185930/2010, sukls185937/ NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Targocid 200 mg Targocid 400 mg Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: teicoplaninum 200 mg nebo 400 mg v jedné lahvičce. Přípravek obsahuje sodík. (9,44/9,75 mg v lahvičce s 200/400 mg teikoplaninu). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek pro přípravu injekčního roztoku s rozpouštědlem Popis přípravku: Prášek pro přípravu injekčního roztoku: nažloutlý, homogenní lyofilizát Rozpouštědlo: čirá, bezbarvá tekutina 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Teikoplanin je indikován k léčbě infekcí vyvolaných citlivými grampozitivními baktériemi včetně kmenů rezistentních na jiná antibiotika (methicilin, oxacilin, cefalosporiny): endokarditidy, septikémie, infekce kostí a kloubů, respirační infekce, infekce kůže a měkkých tkání, infekce močových cest, peritonitidy spojené s chronickou ambulantní peritoneální dialýzou (CAPD). Teikoplanin je rovněž indikován k léčbě infekcí u pacientů alergických na peniciliny nebo cefalosporiny. Teikoplanin může být použit profylakticky v případech rizika vzniku grampozitivní infekce (například u chirurgických výkonů ve stomatologii nebo v ortopedii). Teikoplanin je rovněž indikován jako perorální léčba u průjmů spojených s antibiotickou léčbou, vyvolaných kmeny Clostridium difficile Dávkování a způsob podání Teikoplanin může být podáván intravenózně nebo intramuskulárně zpravidla jednou denně, v případě závažných infekcí se doporučuje podávat počáteční dávky po 12 hodinách během prvních 1-4 dní. Intravenózní aplikace je možná jednak formou injekce během 3-5 minut nebo formou nitrožilní infuze po dobu 30 minut. 1/9
2 U novorozenců má být přípravek aplikován pouze v pomalé 30minutové infuzi. Podávání teikoplaninu intraventrikulárně se nedoporučuje (viz body 4.4 a 4.8). Při volbě odpovídajících dávek teikoplaninu je třeba přihlédnout k závažnosti onemocnění i místu infekce. U závažných infekcí by neměla sérová koncentrace teikoplaninu C min klesnout pod 10 mg/l. Délka léčby: Délka léčby závisí na závažnosti infekce na jejím klinickém a bakteriologickém vývoji. V zásadě má léčba pokračovat ještě 3 dny po odeznění horečky a/nebo klinických příznaků. V případě endokarditidy nebo osteomyelitidy se doporučuje trvání léčby po dobu nejméně 3 týdnů. Dospělí pacienti Pro většinu grampozitivních infekcí Slabá a střední infekce: Úvodní léčba: 400 mg i.v. (6 mg/kg) Udržovací léčba: 200 mg (3 mg/kg) i.v. nebo i.m. Závažné infekce : Úvodní léčba: 400 mg i.v. třikrát ve 12 hodinových intervalech 1 až 4 dny Udržovací léčba: 400 mg i.v. nebo i.m. jedenkrát denně Standardní dávka 400 mg odpovídá přibližně dávce 6 mg/kg tělesné hmotnosti. U pacientů s tělesnou hmotností větší než 85 kg se doporučuje použít dávku 6 mg/kg. Některé závažné klinické stavy (popáleniny, endokarditidy způsobené Staphylococcus aureus) vyžadují vyšší dávky teikoplaninu 12 mg/kg tělesné hmotnosti. Profylaxe v chirurgii: 400 mg (nebo 6 mg/kg u pacientů s tělesnou hmotností nad 85 kg) jednorázově intravenózně v době indukce anestezie. Průjmy spojené s antibiotickou léčbou, vyvolané kmeny Clostridium difficile: 200 mg dvakrát denně per os. Děti - od 2 měsíců do 16 let Pro většinu grampozitivních infekcí: Úvodní léčba: 10 mg/kg i.v. třikrát ve 12 hodinových intervalech Udržovací léčba: 6 mg/kg i.v. nebo i.m. jedenkrát denně Těžké infekce a infekce u pacientů s neutropenií: Úvodní léčba: 10 mg/kg i.v. třikrát ve 12 hodinových intervalech Udržovací léčba: 10 mg/kg i.v. jedenkrát denně - do 2 měsíců Doporučená jednorázová úvodní dávka v prvém dnu léčby je 16 mg/kg i.v., udržovací dávka v dalších dnech 8 mg/kg i.v. 1 denně. Při intravenózním podání je třeba přípravek aplikovat v pomalé 30 minutové i.v. infuzi. Pacienti vyššího věku Úprava dávkování není nutná při normální funkci ledvin Pacienti s onemocněním ledvin 2/9
3 Dávkovací schéma není třeba upravovat do 4. dne léčby. Po tomto časovém období má být dávkování upraveno na základě stanovení sérových koncentrací tak, aby C min nepoklesly pod 10 mg/l. Po 4. dnu léčby: - při středně těžké renální insuficienci (clearance kreatininu mezi ml/min): udržovací dávka má být snížena na polovinu, buď tak, že se denně aplikuje poloviční dávka, nebo se přípravek podává v normální dávce obden. - při těžké renální insuficienci (clearance kreatininu < 40 m/min) a u hemodialyzovaných pacientů: udržovací dávka má být snížena na 1/3 obvyklé doporučené dávky: buď se podává obvyklá dávka každý třetí den, nebo se aplikuje jedna třetina této dávky denně. Teikoplanin se nedá odstranit z organismu hemodialýzou. Intraperitoneální podání v léčbě peritonitidy u pacienti léčených CAPD (kontinuální ambulantní peritoneální dialýza) U peritonitidy vyvolané grampozitivními bakteriemi u CAPD pacientů se podává v prvém týdnu léčby 20 mg/l v každém vaku, ve druhém týdnu 20 mg/l v každém druhém vaku a ve třetím týdnu 20 mg/l pouze ve vaku aplikovaném přes noc. U pacientů s horečkou se musí na začátku podat úvodní jednorázová dávka 400 mg i.v. Teikoplanin je stabilní v roztoku pro peritoneální dialýzu (1,36% nebo 3,86 % dextrosy). Takový roztok nesmí být podán déle než po 24 hodinách od rekonstituce. Kombinovaná léčba Pokud je třeba léčba s maximální antibakteriální aktivitou (např. stafylokoková endokarditida) a pokud nelze vyloučit infekci kombinovanou s gramnegativními bakteriemi (např. empirická léčba horečky u pacientů s neutropenií) lze podat kombinovanou léčbu s dalším vhodným přípravkem. Profylaxe endokarditidy způsobené grampozitivními bakteriemi před stomatologickým zákrokem u pacientů s onemocněním srdeční chlopně: Při anestezii 400 mg (6mg/kg) teikoplaninu i.v Kontraindikace Přecitlivělost na teikoplanin Zvláštní upozornění a opatření pro použití Teikoplanin je třeba podávat s opatrností u pacientů se známou přecitlivělostí na vankomycin vzhledem k možné zkřížené hypersenzitivitě. Přesto předchozí zkušenost s tzv. syndromem červeného muže (červeného krku) v souvislosti s vankomycinem není kontraindikací pro podání teikoplaninu. Při podávání teikoplaninu byly hlášeny případy trombocytopenie, především v v dávkách vyšších než jsou doporučené. Doporučuje se především během prvního měsíce léčby provádět pravidelné hematologické kontroly. Sériové funkční testy sluchu mají být prováděny v následujících případech: - u dlouhodobě léčených pacientů s ledvinovou nedostatečností - u pacientů léčených současně a postupně léčivými přípravky, které mohou mít neurotoxické a/nebo nefrotoxické a/nebo ototoxické vlastnosti. Mezi takové patří: aminoglykosidy, kolistin, amfotericin B, cyklosporin, cisplatina, furosemid a kyselina etakrynová. 3/9
4 Není důkaz o synergické toxicitě těchto přípravků s teikoplaninem. Superinfekce: Především dlouhodobé podávání teikoplaninu stejně jako jiných antibiotik může vést k nárůstu rezistentních organismů. Je nutné opakované zkoumání stavu pacienta. Pokud dojde k vzniku superinfekce během léčby, je třeba učinit příslušná opatření. Byly hlášeny případy vzniku záchvatů při intravertikulárním podání (viz body 4.2. a 4.8). Přípravek Targocid 200 mg obsahuje 9,44 mg sodíku v jedné injekční lahvičce. Přípravek Targocid 400 mg obsahuje 9,95 mg sodíku v jedné injekční lahvičce. Nutno vzít v úvahu u pacientů s dietou s kontrolovaným příjmem sodíku Interakce s jinými léčivými přípravky a jiné formy interakce Teikoplanin a roztoky aminoglykosidů jsou nekompatibilní a nesmí být míchány do injekcí, přesto je lze společně použít v dialyzačních roztocích a mohou být bez omezení použity při léčbě peritonitidy související s CAPD. Vzhledem k vyššímu riziku nežádoucích účinků by teikoplanin má být podáván se zvýšenou opatrností u pacientů léčených současně nefrotoxickými nebo ototoxickými léky, jako jsou aminoglykosidy, amfotericin B, cyklosporin a furosemid (viz bod 4.4) Těhotenství a kojení Není dostatek dat o použití teikoplaninu u těhotných žen. Studie u experimentálních zvířat prokázaly reprodukční toxicitu při podávání vysokých dávek (viz bod 5.3). Při vysokých dávkách u potkanů byl zvýšený výskyt narození mrtvých mláďat a zvýšení neonatální mortality. Potenciální riziko u lidí není známo. Teikoplanin se nedoporučuje podávat těhotným ženám, pokud to není nezbytně nutné. Není známo, jestli teikoplanin přechází do mateřského mléka. Vylučování teikoplaninu do mateřského mléka nebylo u zvířat studováno. Při rozhodování zda pokračovat/přestat s kojením, či pokračovat/přestat používat teikoplanin je nutno brát v úvahu výhody kojení pro dítě a přínos léčby teikoplaninem pro matku Účinky na schopnost řídit a obsluhovat stroje Teikoplanin může způsobovat závratě a bolesti hlavy. Schopnost řídit a obsluhovat stroje může být ovlivněna. Pacienti, u kterých se projeví tyto příznaky, nemají řídit a obsluhovat stroje Nežádoucí účinky Orgánová třída Infekce a infestace časté ( 1/10) Časté ( 1/100 až <1/10 ) Méně časté ( 1/1 000 až <1/100) Vzácné ( 1/ až<1/1 000) Absces vzácné (<1/10 000) Není známo (z dostupných údajů nelze určit)* Superinfekce (přerůstání necitlivých organismů) 4/9
5 Orgánová třída Poruchy krve a lymfatického systému Poruchy imunitního systému Poruchy nervového systému Poruchy ucha a labyrintu časté ( 1/10) Časté ( 1/100 až <1/10 ) Méně časté ( 1/1 000 až <1/100) Eosinofilie, trombocytopenie, leukopenie Anafylaktická reakce Závratě, bolesti hlavy Vzácné ( 1/ až<1/1 000) vzácné (<1/10 000) Není známo (z dostupných údajů nelze určit)* Agranulocytó za, neutropenie Anafylaktický šok Záchvaty po intraventrikulárn ím podání Hluchota (lehká ztráta sluchu), tinnitus, vestibulární porucha Cévní poruchy Flebitida Tromboflebitida Respirační, hrudní a mediastinální poruchy Gastrointestinál ní poruchy Poruchy kůže a podkožní tkáně Poruchy ledvin a močových cest Celkové poruchy a reakce v místě aplikace Erytém (zčervenání), vyrážka (kožní vyrážka), svědění Bolest, pyrexie (horečka) Bronchospasmus Nauzea, zvracení, diarea Urtika, angioedém, exfoliativní dermatitida, toxická epidermální nekrolýza, erythema multiforme, Stevens- Johnsonův syndrom Selhání ledvin Absces v místě injekce, zimnice (rigor) 5/9
6 Orgánová třída Vyšetření časté ( 1/10) Časté ( 1/100 až <1/10 ) * postmarketingové zkušenosti Méně časté ( 1/1 000 až <1/100) Abnormální hladiny transamináz (tranzitorní abnormality v hladinách transamináz), abnormální hladiny alkalické fosfatázy v krvi (tranzitorní abnormality v hladinách alkalické fosfatázy), zvýšení sérových hladin kreatininu (tranzitorní zvýšení hladiny kreatininu v séru) Vzácné ( 1/ až<1/1 000) vzácné (<1/10 000) Není známo (z dostupných údajů nelze určit)* infuzinfuzinfuzinfuz 4.9. Předávkování Byly popsány případy náhodného předávkování u dětí. V jednom případě u 29 denního novorozence byla pozorována agitace po aplikaci dávky 400 mg i.v. (95 mg/kg). Léčba předávkování teikoplaninem je symptomatická. Přípravek nelze z oběhu odstranit hemodialýzou a pouze pomalu pomocí peritoneální dialýzy. 5. FARMAKOLOGICKÉ VLASTNOSTI Farmakoterapeutická skupina: Glykopeptidová antibiotika ATC kód: J01XA Farmakodynamické vlastnosti Teikoplanin je baktericidní, glykopeptidové antibiotikum, produkované aktinomycetou Actinoplanes teichomyceticus. Je účinné na aerobní a anaerobní grampozitivní mikroorganismy. Inhibuje růst citlivých baktérií inhibicí syntézy buněčné stěny v místě odlišném od cefalosporinů. Teikoplanin je účinný proti stafylokokům (včetně kmenů rezistentních na methicilin, oxacilin a jiná bet-laktamová antibiotika), streptokoky, enterokoky, Listeria monocytogenes, mikrokoky, corynebakteria skupiny J/K a grampozitivní anaeroby včetně Clostridium difficile a peptokoky. 6/9
7 Vzhledem k povaze mechanismu účinku teikoplaninu je nepravděpodobné, že by se u baktérií mohla vyvinout "one-step" rezistence. "Multi-step" rezistence byla in vitro zjištěna až po mnohonásobných pasážích. Byly popsány vyšší minimální inhibiční koncentrace teikoplaninu u několika kmenů Staphylococcus haemolyticus. Teikoplanin nevykazuje zkříženou rezistenci s jinými skupinami antibiotik. Určitá zkřížená rezistence byla zjištěna mezi vankomycinem a teikoplaninem u enterokoků. Teikoplanin je vychytáván leukocyty a makrofágy a zachovává si protistafylokokovou aktivitu uvnitř těchto buněk Farmakokinetické vlastnosti Teikoplanin se podává parenterálně. Biologická dostupnost po jednorázovém podání dávky 3-6 mg/kg nitrosvalově je vyšší než 90%. Po orálním podání se teikoplanin za normálních podmínek nevstřebává ze zažívacího traktu; 40% podané dávky je přítomno ve stolici v mikrobiologicky aktivní formě. Po intravenózní aplikaci dávek 3-6 mg/kg tělesné hmotnosti činí terminální poločas eliminace přibližně 150 hodin; celková plazmatická clearance se pohybuje od 11,9 ml/h/kg do 14,7 ml/h/kg. Uvedený dlouhý biologický poločas umožňuje podávání přípravku jedenkrát denně. Při aplikaci dávky 6 mg/kg intravenózně v čase 0, 12 a 24 hodin a dále jedenkrát za 24 hodin ve 30minutové infuzi by předpokládané minimální hladiny 10 mg/l před další aplikací přípravku bylo dosaženo ve 4. dnu. C max a C min v ustáleném stavu dosáhly předpokládaných hodnot 64 mg/l a 19 mg/l v 28. dnu. Teikoplanin snadno proniká do kůže (podkožního tuku), puchýřů, myokardu, plicní tkáně a pleurální tekutiny, kostí a kloubní tekutiny. Do mozkomíšního moku proniká jen v malém rozsahu. Přibližně 90-95% teikoplaninu se váže na plazmatické bílkoviny, tato vazba je však slabá. Distribuční objem v ustáleném stavu po intravenózní dávce 3-6 mg/kg se pohybuje od 0,94 l/kg do 1,4 l/kg. Po parenterální aplikaci se teikoplanin metabolizuje v minimálním rozsahu, kolem 3%. Přibližně 80% podané dávky se vylučuje močí. Renální clearance po 3-6 mg/kg i.v. činí 10,4 až 12,1 ml/h/kg Předklinické údaje vztahující se k bezpečnosti Data z předklinických studií ukazují, že teikoplanin má relativně nízkou akutní toxicitu a vysoké hodnoty LD50 byly prokázány ve studiích při intravenózním podávání u psů (750 mg/kg), potkanů (106 mg/kg) a myší (715 mg/kg). Tyto dávky daleko převyšují terapeutické dávky u lidí, což ukazuje na široké terapeutické rozmezí. Teikoplanin byl uspokojivě tolerován ve studiích chronické a subakutní toxicity. Navíc bylo prokázáno, že přípravek nemá žádný mutagenní a teratogenní účinek a ani nebyly nalezeny žádné abnormality v plodnosti nebo reprodukční kapacitě nebo peri- /postnatálním vývoji. Studie senzibilizace na potkanech, myších a morčatech neprokázaly, že by teikoplanin měl jakýkoliv senzibilizační potenciál. 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Chlorid sodný 7/9
8 Rozpouštědlo: voda na injekci 6.2. Inkompatibility Tento léčivý přípravek smí být podáván v následujících infuzních roztocích: - 0.9% izotonický fyziologický roztok. - Ringerův roztok - Ringer-laktátový roztok - 5% roztok glukózy - roztok 0,18 % NaCl a 4 % roztok glukózy. - TARGOCID roztok pro infuzi v 0.9% izotonickém fyziologickém roztoku, Ringerově roztoku, Ringer-laktátovém roztoku, 5% roztoku glukózy, roztoku 0,18 % NaCl a 4 % roztoku glukózy musí být použit co nejdříve po naředění. Může být skladován při 5ºC po dobu pouze 24 hodin. Teikoplanin a roztoky aminoglykosidů jsou při přímém mísení inkompatibilní, proto nesmí být před injekcí míseny Doba použitelnosti Přípravek nesmí být použit po uplynutí doby použitelnosti uvedené na obalu. Použitelnost: neotevřený přípravek: 3 roky Po rekonstituci: Chemická a fyzikální stabilita po otevření před použitím byla prokázána na dobu 8 hodin při pokojové teplotě nebo 24 hodin při teplotě 2 8 C. Z mikrobiologického hlediska má být přípravek použit okamžitě. Není-li použit okamžitě, doba a podmínky uchovávání přípravku po otevření a rekonstituci před použitím jsou v odpovědnosti uživatele a normálně by doba neměla být delší než 24 hodin při 2 až 8 C, pokud rekonstituce neproběhla za kontrolovaných a validovaných aseptických podmínek Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 0 C. Podmínky uchovávání rekonstituovaného léčivého přípravku viz bod 6.3. Podle zásad správné lékárenské praxe má být roztok použit bezprostředně po jeho přípravě Druh obalu a velikost balení Prášek pro přípravu injekčního roztoku: injekční lahvička z bezbarvého skla s pryžovou zátkou a hliníkovou pertlí s plastovým krytem Rozpouštědlo: ampule z bezbarvého skla Rozpouštědlo: Skleněná ampule Balení: 1 lahvička + l ampule s rozpouštědlem, krabička 6.6. Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním a) Pomalu vstřikovat předepsané množství sterilní vody do lahvičky. b) Jemně otáčet lahvičkou v dlaních, dokud se prášek úplně nerozpustí tak, aby se zabránilo tvorbě pěny. 8/9
9 JE DŮLEŽITÉ DOSÁHNOUT TOHO, ABY SE ROZPUSTIL VŠECHEN PRÁŠEK, I KOLEM ZÁTKY. Při roztřepání roztoku se vytvoří pěna, která ztíží zpětné získání požadovaného objemu. Přesto, je-li teikoplanin úplně rozpuštěn, pěna nezmění koncentraci roztoku, která zůstává 200 mg ve 3 ml (200 mg lahvička) nebo 400 mg ve 3 ml (400 mg lahvička). Vytvoří-li se v lahvičce pěna, je třeba nechat lahvičku stát přibližně 15 minut. c) Odtáhnout pomalu roztok teikoplaninu pomalu z lahvičky. Pro získání celého objemu je třeba umístit jehlu do středu gumové zátky. d) Připravený roztok obsahuje 200 mg teikoplaninu ve 3 ml (200 mg lahvička) a 400 mg ve 3 ml (400 mg lahvička). Správná příprava roztoku a opatrné natažení do stříkačky je velmi důležité; nedostatečná opatrnost při přípravě může vést k podání nižší dávky. e) Konečný roztok je izotonický s plazmou a má ph 7,2-7,8. f) Připravený roztok může být injikován přímo nebo může být dále ředěn s: - 0,9% roztokem chloridu sodného - kombinovanými laktátovými roztoky (Ringer-laktát, Hartmann) - 5% roztokem glukózy - 0,18% roztokem chloridu sodného a 4% roztokem glukózy - roztoky pro peritoneální dialýzu, obsahující 1,36% nebo 3,86% glukózy Intravenózní injekce: Po přípravě roztoku k použití je Targocid pacientovi injikován intravenózně přímo nebo po převedení do infuzního systému do proximální části těla. Targocid lze podat rychle, např. během 3 až 5 minut. Při podání v rychlé infuzi se Targocid rekonstituuje ve ml izotonického fyziologického roztoku nebo roztoku natrium-laktátu a je podán infuzí během 30 minut. Intramuskulární injekce: Po přípravě roztoku k použití může být Targocid podán intramuskulárně. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI sanofi-aventis, s.r.o. Praha Česká republika 8. REGISTRAČNÍ ČÍSLO 15/216/93-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE / DATUM REVIZE TEXTU /9
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele
 sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010
 Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. Sukls121294/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
Sp. zn. Sukls121294/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
Prášek pro koncentrát pro infuzní roztok Popis přípravku Bílý až téměř bílý prášek.
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls240195/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 500 mg Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls240195/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 500 mg Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha III. Souhrn údajů o přípravku, označení na obalu a příbalová informace
 Příloha III Souhrn údajů o přípravku, označení na obalu a příbalová informace Poznámka: Toto SPC, označení na obalu a příbalová informace je verze platná v době rozhodnutí Komise. Po rozhodnutí Komise
Příloha III Souhrn údajů o přípravku, označení na obalu a příbalová informace Poznámka: Toto SPC, označení na obalu a příbalová informace je verze platná v době rozhodnutí Komise. Po rozhodnutí Komise
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Florfeni-kel 300mg/ml inj. 100ml
 Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
1/5. Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls234450/2010
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls234450/2010 PŘÍBALOVÁ INFORMACE - Rp Informace pro použití, čtěte pozorně! PROSTAPHLIN 1000 mg prášek pro přípravu injekčního roztoku (oxacillinum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls234450/2010 PŘÍBALOVÁ INFORMACE - Rp Informace pro použití, čtěte pozorně! PROSTAPHLIN 1000 mg prášek pro přípravu injekčního roztoku (oxacillinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum
 sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU VANCOMYCIN PHARMASWISS 500 mg, prášek pro přípravu infuzního roztoku VANCOMYCIN PHARMASWISS
Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU VANCOMYCIN PHARMASWISS 500 mg, prášek pro přípravu infuzního roztoku VANCOMYCIN PHARMASWISS
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 200 mg (= 82,0 mg alaninum; 134,6 mg glutaminum)
 sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 1 NÁZEV PŘÍPRAVKU Vankomycin Pfizer 1 000 mg prášek pro koncentrát pro infuzní roztok SOUHRN
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 1 NÁZEV PŘÍPRAVKU Vankomycin Pfizer 1 000 mg prášek pro koncentrát pro infuzní roztok SOUHRN
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
sp. zn. sukls145265/2013 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU VULMIZOLIN 1,0 Prášek pro přípravu injekčního roztoku
 sp. zn. sukls145265/2013 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU VULMIZOLIN 1,0 Prášek pro přípravu injekčního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ VULMIZOLIN 1,0: cefazolinum natricum 1,05
sp. zn. sukls145265/2013 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU VULMIZOLIN 1,0 Prášek pro přípravu injekčního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ VULMIZOLIN 1,0: cefazolinum natricum 1,05
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae type b polysaccharide
 sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Granule pro perorální roztok. Bílé až téměř bílé granule v jednodávkovém sáčku.
 Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
sp.zn.: sukls49677/2013
 sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROSTAPHLIN 1000 mg Prášek pro injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: oxacillinum natricum monohydricum v množství 1,1 g což odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROSTAPHLIN 1000 mg Prášek pro injekční roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: oxacillinum natricum monohydricum v množství 1,1 g což odpovídá
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
1/5. Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. EXACYL Injekční roztok
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
Jedna injekční lahvička obsahuje vancomycinum 1000 mg (jako vancomycini hydrochloridum), což odpovídá IU
 Sp. zn. sukls59024/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
Sp. zn. sukls59024/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
kontaminovaných operačních výkonů, ale i u čistých operací, při kterých dochází k aplikaci
 ANTIMIKROBNÍ PROFYLAXE Antibiotická profylaxe je aplikace vybraných antibakteriálních léčiv s cílem snížit výskyt infekcí v místě operačního výkonu. Použití profylaxe je indikováno nejen u kontaminovaných
ANTIMIKROBNÍ PROFYLAXE Antibiotická profylaxe je aplikace vybraných antibakteriálních léčiv s cílem snížit výskyt infekcí v místě operačního výkonu. Použití profylaxe je indikováno nejen u kontaminovaných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls234450/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls234450/2010 1. NÁZEV PŘÍPRAVKU PROSTAPHLIN 1000 mg Prášek pro přípravu injekčního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ I KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls234450/2010 1. NÁZEV PŘÍPRAVKU PROSTAPHLIN 1000 mg Prášek pro přípravu injekčního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ I KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Příloha č.2 ke sdělení sp.zn.sukls7045/2013
 Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
Příloha č.2 ke sdělení sp.zn.sukls7045/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Inflamalgin 10 mg/1 g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 0,01 g v 1 g gelu (l%) Úplný
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambex 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Účinná látka: Ambroxoli hydrochloridum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls79891/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambex 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Účinná látka: Ambroxoli hydrochloridum
Souhrn údajů o přípravku
 apříloha č. 3 k rozhodnutí o registraci č.j. 9903/04 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ONDANSETRON ARDEZ 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Ondansetroni hydrochloridum dihydricum
apříloha č. 3 k rozhodnutí o registraci č.j. 9903/04 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ONDANSETRON ARDEZ 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Ondansetroni hydrochloridum dihydricum
1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. AMIKIN 500 mg AMIKIN 1g injekční roztok. amikacini disulfas
 Příbalová informace: informace pro uživatele AMIKIN 500 mg AMIKIN 1g injekční roztok amikacini disulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele AMIKIN 500 mg AMIKIN 1g injekční roztok amikacini disulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum
 sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 600 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut C. monohydricum) 600 mg v 1 tabletě. Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 600 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut C. monohydricum) 600 mg v 1 tabletě. Úplný
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
3 LÉKOVÁ FORMA Tableta s prodlouženým uvolňováním. Růžové, kulaté bikonvexní tablety s vyraženým '35' na jedné straně, na druhé straně hladké.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna ampulka přípravku Somatostatin Eumedica 3 mg obsahuje somatostatinum 3 mg.
 sp.zn.sukls207834/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampulka přípravku Somatostatin
sp.zn.sukls207834/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampulka přípravku Somatostatin
Přípravek Dicynone 250, injekční roztok je indikován u dospělých, dětí a novorozenců.
 sp.zn. sukls224465/2009 a sp.zn. sukls119748/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 250, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ l ampulka obsahuje etamsylatum 250mg
sp.zn. sukls224465/2009 a sp.zn. sukls119748/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 250, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ l ampulka obsahuje etamsylatum 250mg
Prášek pro koncentrát pro infuzní roztok. Popis přípravku: bílý až krémový porézní koláč.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls116891/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Kabi 500 mg Vancomycin Kabi 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls116891/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Kabi 500 mg Vancomycin Kabi 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae typus b polysaccharidum konjugovaný s tetanickým toxoidem jako bílkovinným nosičem
 sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
2. Čemu musíte věnovat pozornost, než začnete přípravek Vancomycin CNP Pharma používat
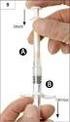 sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
Vankomycin Mylan se může užít i perorálně (ústy) k léčbě závažných infekcí zažívacího taktu způsobených bakteriemi citlivými na vankomycin.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls30246/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro přípravu infuzního roztoku vancomycini
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls30246/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro přípravu infuzního roztoku vancomycini
BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku
 Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
Příloha č. 2 ke sdělení sp. zn. sukls18805/2011 a příloha ke sp. zn. sukls18806/2011 Příbalová informace:informace pro uživatele BONEFOS (Dinatrii clodronas) koncentrát pro přípravu infúzního roztoku Držitel
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ORENZYM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 200 m.j. (36,60 mg)
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ORENZYM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 200 m.j. (36,60 mg)
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
