Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku
|
|
|
- Adéla Müllerová
- před 9 lety
- Počet zobrazení:
Transkript
1 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g Ceftazidim Genim 2 g Ceftazidimum pentahydricum Prášek pro přípravu injekčního a infuzního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci pro případ, že ji budete potřebovat přečíst znovu. - Máte-li případně další otázky, zeptejte se prosím svého lékaře nebo lékárníka. - Tento přípravek byl předepsán Vám, a proto jej nedávejte žádné další osobě. Mohl by jí uškodit, a to i tehdy, má-li stejné příznaky jako Vy. - Jestliže se u Vás objeví nějaké závažné nežádoucí účinky nebo zaznamenáte nějaké nežádoucí účinky, které nejsou uvedeny v této příbalové informaci, sdělte to prosím svému lékaři. V příbalové informaci naleznete: 1. Co je Ceftazidim Genim a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete Ceftazidim Genim užívat 3. Jak se Ceftazidim Genim užívá 4. Možné nežádoucí účinky 5. Jak se přípravek Ceftazidim Genim uchovává 6. Další informace 1. CO JE CEFTAZIDIM GENIM A K ČEMU SE POUŽÍVÁ Ceftazidim Genim je širokospektré antibiotikum patřící do III. generace cefalosporinů. Ceftazidim působí baktericidně, tj. zabíjí bakterie. Mechanismus jeho účinku spočívá v narušení tvorby bakteriální buněčné stěny. Přípravek Ceftazidim Genim Vám se používá k terapii infekčních onemocnění (monoinfekcí nebo smíšených infekcí) vyvolaných mikroorganismy citlivými na ceftazidim. Měl by se použít pouze tehdy, jestliže penicilin nebo penicilinové deriváty s úzkým spektrem nemohou být použity: - nosokomiální pneumonie (nemocniční zánět plic) - infekce dýchacího ústrojí u pacientů s cystickou fibrózou. - empirická léčba febrilní neutropenie (přípravek se začne podávat dříve, než se zjistí, který mikroorganismus febrilní neutropenii, neboli infekci s horečkami u pacientů, kteří mají výrazně snížený počet bílých krvinek, způsobil) - akutní meningitida (zánět mozkových blan) - infekce horního močového ústrojí a závažné infekce pocházející z močového ústrojí Monoterapie ceftazidimem se užívá k léčbě závažných infekcí způsobených kmeny citlivými na ceftazidim. Je důležité uvážit nutnost kombinované léčby ceftazidimem s jinými aminoglykosidy nebo antibiotiky s anaerobní aktivitou. Ceftazidim se používá k léčbě pouze v nemocnici! Je nutno brát v úvahu oficiální doporučení o použití antibakteriálně působících léčivých látek. 2.ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE CEFTAZIDIM 1/7
2 GENIM UŽÍVAT Pokud víte, že jste přecitlivělý/á na ceftazidim nebo jiné cefalosporinové antibiotikum, na penicilinová antibiotika, případně jste-li přecitlivělý/á na některou z pomocných složek přípravku, měl/a byste na to upozornit lékaře a tento přípravek by Vám neměl být podán. Zvláštní opatrnost při použití přípravku Ceftazidim Genim je zapotřebí: Vyskytne-li se u Vás alergická reakce na ceftazidim, musí lékař podávání přípravku Ceftazidim Genim zastavit. Závažné reakce z přecitlivělosti mohou vyžadovat další specifickou léčbu. Aplikace vysokých dávek cefalosporinů souběžně s nefrotoxickými léčivými přípravky (tj.přípravky, které mají toxický vliv na ledviny), jako jsou aminoglykosidová antibiotika nebo silná diuretika (např. furosemid), může nepříznivě ovlivnit funkci ledvin. Klinické zkušenosti ukázaly, že při aplikaci ceftazidimu v doporučených dávkách není vznik tohoto problému pravděpodobný. Nebylo prokázáno, že by ceftazidim v běžných terapeutických dávkách nepříznivě ovlivňoval funkci ledvin. Ceftazidim je vylučován ledvinami, a při omezené funkci ledvin je proto zapotřebí v závislosti na stupni poruchy funkce ledvin snížit dávkování. U pacientů s poruchou funkce ledvin, u kterých nebylo náležitě sníženo dávkování, byly v některých případech hlášeny neurologické nežádoucí účinky (viz Možné nežádoucí účinky). Dlouhotrvající podávání může (tak, jako je tomu i u ostatních širokospektrých antibiotik) vést k přerůstání necitlivých mikroorganismů (např. kvasinek, enterokoků), což může vyžadovat zastavení podávání přípravku Ceftazidim Genim nebo zavedení náležitých opatření. Stejně jako při podávání jiných cefalosporinů nebo penicilinů s rozšířeným spektrem účinku může u některých zpočátku citlivých kmenů rodu Enterobacter a Serratia vzniknout během terapie ceftazidimem rezistence vůči tomuto léčivému přípravku. Lékař proto bude opakovaně kontrolovat Váš stav. Těhotenství a kojení Klinické zkušenosti u těhotných žen jsou limitované. Studie na živočiších neukazují zvýšené riziko vývojových vad plodu. Podávání přípravku těhotným ženám musí být zvláště důkladně zváženo. Ceftazidim se vylučuje do mateřského mléka, ale riziko účinku na dítě se při obvyklých dávkách nezdá pravděpodobné. U matek, které potřebují léčbu ceftazidimem a kojí, se musí zvážit potenciální riziko pro dítě. Řízení dopravních prostředků a obsluha strojů Nebyly prováděny specifické studie vlivu ceftazidimu na snížení pozornosti při řízení motorových vozidel a obsluze strojů. Vzájemné působení s dalšími léčivými přípravky Prosím, informujte svého lékaře o všech lécích, které užíváte nebo jste užíval/a v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu. Souběžná užívání léčivých přípravků působících nefrotoxicky (např.furosemid) může nepříznivě ovlivnit funkci ledvin. Plánuje-li se souběžné podávání přípravků Ceftazidim Genim s chloramfenikolem, makrolidovými nebo tetracyklinovými antibiotiky, je nutné brát v úvahu možnost antagonistického (vzájemně se rušícího) působení. 3. JAK SE CEFTAZIDIM GENIM UŽÍVÁ Dávkování závisí na závažnosti, citlivosti, lokalizaci a typu infekce, na věku pacienta a na stavu funkce ledvin. Přesné dávkování vždy určí lékař. Obvyklé dávkování: Dospělí Obyčejně 1-2 g každých 12 hodin. U imunodeficitních pacientů může být dávka zvýšena na 2 g každých 8 hodin. Při meningitidě 2 g každých 8 hodin. 2/7
3 Jestliže je prokázáno, že původcem meningitidy je Pseudomonas spp., ceftazidim se musí kombinovat s jinými antibiotiky nebo musí být kontrolována jeho koncentrace v likvoru. V případě infekce močového traktu by se mělo podávat 500 mg každých 12 hodin. U starších pacientů (starších 70 let) by se měla denní dávka snížit o 50% (maximální denní dávka 3 g). Dospělí pacienti s cystickou fibrózou při pseudomonádových plicních infekcích: 100 až 150 mg/kg/den, rozděleně ve 3 dílčích dávkách. U dospělých s normální renální funkcí byly bez patologického efektu použity dávky 9 g/den. Děti: Děti starší 2 měsíců: mg/kg/24hod., rozděleně ve 2 nebo 3 dílčích dávkách. U infikovaných imunokompromitovaných dětí nebo u dětí s cystickou fibrózou nebo s meningitidou lze podávat dávky až 150 mg/kg/den, rozdělené ve 3 dílčích dávkách. Maximální denní dávka je 6 g. Novorozenci a děti mladší 2 měsíců by měly dostávat mg/kg/24 hod. rozděleno do 2 dílčích dávek. Při meningitidě by měly dostávat novorozenci 50 mg/kg každých 12 hodin a každých 8 hodin děti starší 8 dní. U novorozenců může být biologický poločas ceftazidimu 3-4 krát delší než u dospělých. U pacientů s poruchou ledvin: ceftazidim není metabolizován a je pouze eliminován glomerulární filtrací. U pacientů s poruchou funkce ledvin se musí dávka snížit jak je následně uvedeno pro kompenzaci prodlouženého vylučování: 1 g nebo 2 g je vždy podáno na začátku jako dávka saturační. Clearance kreatininu Doporučená udržovací dávka x denně 1 g x denně 1 g x denně 0,5 g < 5 0,5 g každých 48 hodin Výše uvedené dávky se mohou zvýšit o 50%, jsou-li k tomu klinické důvody, např. u pacientů s cystickou fibrózou. U dialyzovaných pacientů je adekvátní sérová koncentrace udržována přidáním 1 g na konci každé dialýzy. Při kontinuální arterio-venózní hemofiltraci (CAVH) se podává 1 g denně jako bolus nebo rozděleně do více dávek. U peritoneálně dialyzovaných pacientů se k nitrožilními podání podává mg ceftazidimu/2 l dialyzačního roztoku. U všech dialyzovaných pacientů se doporučuje počáteční dávka 1 g intravenózně. Jestliže je dávkování nejasné a jestliže je renální funkce signifikantně horší (clearance kreatininu pod 25 ml/min), musí se sérová koncentrace monitorovat. Koncentrace před podáním nové dávky nesmí přesáhnout 40 mg/l. Pacientům s renálním selháním, kteří podstupují kontinuální arterio-venózní hemodialýzu nebo vysokoprůtokovou hemofiltraci na jednotce intenzivní péče, se podává 1 g denně, a to buď v jedné denní dávce, nebo rozděleně v několika dílčích dávkách. U pacientů podstupujících nízkoprůtokovou hemofiltraci se má dávkování řídit pokyny uvedenými pod nadpisem Dávkování u pacientů s renální dysfunkcí. Dávkování u pacientů podstupujících veno-venózní hemofiltraci nebo veno-venózní hemodialýzu U pacientů podstupujících veno-venózní hemofiltraci nebo veno-venózní hemodialýzu je třeba se řídit doporučeným dávkováním uvedeným v následujících tabulkách. Doporučené dávkování ceftazidimu při kontinuální veno-venózní hemofiltraci: Reziduální renální funkce Udržovací dávka (mg) při rychlosti ultrafiltrace 3/7
4 (clearance kreatininu ) ( ml/min ) : * 5 ml/min 16,7 ml/min 33,3 ml/min 50 ml/min 0 ml/min ( 0 ml/sec) 250 mg 250 mg 500 mg 500 mg 5 ml/min ( 0,08 ml sec ) 250 mg 250 mg 500 mg 500 mg 10 ml/min ( 0,17 ml/sec ) 250 mg 500 mg 500 mg 750 mg 15 ml/min ( 0,25 ml/sec ) 250 mg 500 mg 500 mg 750 mg 20 ml/min ( 0,33 ml/sec ) 500 mg 500 mg 500 mg 750 mg *Udržovací dávka se podává po 12 hodinách. Doporučené dávkování ceftazidimu při kontinuální veno-venózní hemodialýze Reziduální renální Udržovací dávka (mg ) při rychlosti přítoku dialyzátu : * funkce 1l/hod. 2l/hod. (clearance kreatininu) Rychlost ultrafiltrace (l/hod.) Rychlost ultrafiltrace(l/hod.) 0,5 l/hod. 1,0 l/hod. 2,0 l/hod. 0,5 l/hod. 1,0 l/hod. 2,0 l/hod. 0 ml/min ( 0 ml/sec) 500 mg 500 mg 500 mg 500 mg 500 mg 750 mg 5ml/min (0,08ml/sec) 500 mg 500 mg 750 mg 500 mg 500 mg 750 mg 10ml/min(0,17ml/sec) 500 mg 500 mg 750 mg 500 mg 750 mg 1000 mg 15ml/min(0,25ml/sec) 500 mg 750 mg 750 mg 750 mg 750 mg 1000 mg 20ml/min(0,33ml/sec) 750 mg 750 mg 1000 mg 750 mg 750 mg 1000 mg * Udržovací dávka se podává po 12 hodinách Způsob podání Roztok přípravku Ceftazidim Genim připravený z prášku pro přípravu injekčního nebo infuzního roztoku se podává nitrožilní injekcí nebo nitrožilní infúzí nebo nitrosvalovou injekcí. 4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY Podobně jako všechny léčivé přípravky, může mít i Ceftazidim Genim nežádoucí účinky, které se ale nemusí vyskytnout u každého. (Nežádoucí účinky se objevily přibližně u 5 % pacientů léčených ceftazidimem.) Tabulka výskytu nežádoucích účinků podle četnosti výskytu a orgánového systému: Četnost Orgánový systém Nežádoucí účinek Časté (>1/100 Méně časté ( 1/1 000 až <1/100 Celkové a jinde nezařazené poruchy a lokální reakce po podání Poruchy kůže a podkoží Poruchy krve a lymfatického systému Poruchy nervového Místní kožní reakce, zánět žíly po nitrožilním podání Svědění, zarudnutí, vyrážka. Eosinofilie, trombocytopenie, trombocytóza, leukopenie, neutropenie, lymfocytóza, positivní Coombsův test. (tj. změny v krevním obraze) Bolesti hlavy,závratě, mravenčení a poruchy vnímání 4/7
5 Vzácné ( 1/ až <1/1000 Velmi vzácné (<1/10000 systému Poruchy gastrointestinálního traktu Poruchy imunitního systému Poruchy kůže a podkoží Poruchy gastrointestinálního traktu Poruchy jater a žlučových cest Poruchy ledvin a močového ústrojí Poruchy reprodukčního systému a choroby prsů Poruchy krve a lymfatického systému Poruchy jater a žlučových cest Poruchy imunitního systému chuti. Křeče a poruchy vědomí. Nevolnost, zvracení, průjem, bolesti břicha. makulopapulózní vyrážka a horečka jako reakce z přecitlivělosti Erythema multiforme (ostrůvkovité zarudnutí kůže), Stevens-Johnsonův syndrom, toxická epidermální nekrolýza (poškození kůže s olupováním kůže). Pseudomembranózní kolitida (zánět tlustého střeva). Zvýšená hladina transamináz, LDH, GGT, alkalických fosfatáz. (tj. zvýšené jaterní testy) Snížení glomerulární filtrace (filtrace krve v ledvinách při tvorbě moči), zvýšení močoviny a hladiny kreatininu v krvi. Kvasinková infekce pochvy a zánět pochvy Agranulocytóza, hemolytická anémie. (tj. změny v krevním obraze) Žloutenka. Otok a celková závažná (anafylaktická) reakce jako reakce z přecitlivělosti Existuje mírné riziko superinfekce druhem Enterococcus a Candida. Mohou se objevit křeče, poruchy vědomí a encefalopatie, zvláště u pacientů s poruchou funkce ledvin, pokud dávka nebyla přizpůsobena. 5. JAK SE PŘÍPRAVEK CEFTAZIDIM GENIM UCHOVÁVÁ Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem. Doba použitelnosti Přípravek nesmí být použit po uplynutí doby použitelnosti vyznačené na obalu. Připravené roztoky ceftazidimu ve vodě na injekci nebo v kompatibilních tekutinách pro parenterální podání si zachovávají účinnost po dobu 8 hodin při teplotě do 25 C nebo 24 hodin při teplotě 2-8 C. Je-li přípravek Ceftazidim Genim 1g rekonstituován pro intramuskulární injekci v 1% roztoku lidokainu, je takto připravený roztok určen k okamžité spotřebě. 6.DALŠÍ INFORMACE Jak Ceftazidim Genim vypadá a co balení obsahuje Ceftazidim Genim 1 g a Ceftazidim Genim 2 g je prášek pro přípravu injekčního a infuzního roztoku. Léčivá látka Ceftazidim Genim 1 g: Ceftazidimum pentahydricum 1,165 g, což odpovídá Ceftazidimum 1 g, v jedné lahvičce. Ceftazidim Genim 2 g: Ceftazidimum pentahydricum 2,33 g, což odpovídá Ceftazidimum 2 g, v jedné lahvičce. 5/7
6 Pomocné látky: uhličitan sodný Popis přípravku: Bílý nebo téměř bílý krystalický prášek. Velikost balení je 1 x 1 g (20 ml lahvička) 1 x 2 g (50 ml lahvička) Držitel rozhodnutí o registraci : Genim s.r.o., Praha, Česká republika Výrobce SVUS Pharma a.s., Hradec Králové, Česká republika O další informace se obraťte na místní zastoupení Držitele rozhodnutí o registraci. Uchovávejte mimo dosah a dohled dětí. Datum poslední revize textu Následující informace je určena pouze pro zdravotnické pracovníky Návod pro zacházení s přípravkem Přípravek Ceftazidim Genim v obou silách dodává výrobce v lahvičkách, v nichž je snížený tlak. Při rozpouštění přípravku se uvolňuje oxid uhličitý a vzniká přetlak. Bublinky oxidu uhličitého v připraveném roztoku nejsou na závadu. Velikost lahvičky (obsah ceftazidimu) 1 g 2 g Způsob podání Nitrosvalová injekce Nitrožilní bolusová injekce Nitrožilní infúze Nitrožilní bolusová injekce Nitrožilní infúze Objem rozpouštědla, který je třeba přidat (ml) * Přibližná koncentrace vzniklého roztoku (mg/ml) 260 * POZNÁMKA: Rozpouštědlo (ředidlo) se přidává ve dvou dávkách (viz dále Návod k přípravě roztoků pro nitrožilní infuzi nebo nitrožilní bolusovou injekci). Ceftazidim Genim je kompatibilní s většinou tekutin běžně používaných k nitrožilnímu nebo nitrosvalovému podání; jako rozpouštědlo (ředidlo) se však nedoporučuje infuzní roztok hydrogenuhličitanu sodného. Barva připravených roztoků může být od světle žluté až po jantarovou, v závislosti na koncentraci, použitém rozpouštědle (ředidle) a podmínkách uchovávání. Tyto rozdíly v barvě roztoků (za předpokladu, že byla dodržena doporučení k přípravě a uchování uvedená v tomto souhrnu údajů o přípravku) nemají nepříznivý vliv na účinnost přípravku. Návod k přípravě roztoků pro nitrožilní infuzi nebo nitrožilní bolusovou injekci : 10 50* /7
7 1. Jehlou injekční stříkačky propíchněte uzávěr lahvičky, zasuňte jehlu dovnitř a vstříkněte do lahvičky první dávku rozpouštědla (do lahviček Ceftazidim Genim l g a Ceftazidim Genim 2 g 10 ml rozpouštědla). 2. Vytáhněte jehlu ven a protřepejte obsah lahvičky, dokud nevznikne čirý roztok. 3. Propíchněte uzávěr lahvičky jinou jehlou, která vyrovná přetlak uvnitř lahvičky na úroveň okolního tlaku vzduchu. 4. Tuto protipřetlakovou jehlu nechte zasunutou skrz uzávěr do lahvičky a jehlou s injekční stříkačkou opět propíchněte uzávěr lahvičky a přidejte zbytek rozpouštědla. Pak obě jehly vytáhněte ven, protřepejte obsah lahvičky a připravte ji k aplikaci nitrožilní infuzí či nitrožilní bolusovou injekcí. Návod k přípravě roztoků pro nitrosvalovou injekci ( Ceftazidim Genim 1g): 1. Přípravek Ceftazidim Genim 1g se rozpustí ve 3 ml roztoku lidokainu. Roztok se musí podat okamžitě formou hluboké intragluteální injekce.tento roztok nesmí byt podán intravenózně. Takto připravený roztok je určen k okamžité spotřebě. UPOZORNĚNÍ: K zachování sterility přípravku je důležité, aby se uzávěr lahvičky nepropichoval protipřetlakovou jehlou dříve, než dojde k úplnému rozpuštění prášku na čirý roztok. Ceftazidim v roztoku o koncentraci 1 mg/ml až 40 mg/ml je kompatibilní s těmito tekutinami k parenterálnímu podání: - 0,9% roztok chloridu sodného (fyziologický roztok) - 5% roztok glukózy - 0,9% roztok chloridu sodného + 5% roztok glukózy Je-li přípravek Ceftazidim Genim 1g rekonstituován pro intramuskulární injekci, může se ředit 3 ml 1% roztoku lidokainu. Takto připravený roztok je určen k okamžité spotřebě. 7/7
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g, prášek pro přípravu injekčního roztoku Ceftazidim
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls191471/2011, sukls191473/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ceftazidim Genim 1 g, prášek pro přípravu injekčního roztoku Ceftazidim
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Rp.
 Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls59635-36/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Rp. Ceftazidim Stragen 1 g, prášek pro přípravu infúzního roztoku Ceftazidim Stragen
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls59635-36/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Rp. Ceftazidim Stragen 1 g, prášek pro přípravu infúzního roztoku Ceftazidim Stragen
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Ceftazidim Genim 1 g Ceftazidim Genim 2 g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ceftazidim Genim 1 g: Ceftazidimum pentahydricum 1,165 g, což odpovídá 1 g
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Ceftazidim Genim 1 g Ceftazidim Genim 2 g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ceftazidim Genim 1 g: Ceftazidimum pentahydricum 1,165 g, což odpovídá 1 g
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls244312/2011, sukls244322/2011 a příloha k sp.zn. sukls44457/2008, sukls44458/2008
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls244312/2011, sukls244322/2011 a příloha k sp.zn. sukls44457/2008, sukls44458/2008 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Rp. Ceftazidim
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls244312/2011, sukls244322/2011 a příloha k sp.zn. sukls44457/2008, sukls44458/2008 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Rp. Ceftazidim
Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum
 sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls53459/2016 Příbalová informace: informace pro pacienta AXETINE 750 mg AXETINE 1,5 g Prášek pro injekční/infuzní roztok Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SEFOTAK 1G Prášek pro přípravu injekčního roztoku Cefotaximum natricum
 Příloha č. 1 ke sdělení sp. zn. sukls173688/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SEFOTAK 1G Prášek pro přípravu injekčního roztoku Cefotaximum natricum Přečtěte si pozorně celou příbalovou
Příloha č. 1 ke sdělení sp. zn. sukls173688/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SEFOTAK 1G Prášek pro přípravu injekčního roztoku Cefotaximum natricum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku
 Příloha č. 1a k rozhodnutí o změně registrace sp.zn. sukls116762/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku (Cefuroximum) Přečtěte si
Příloha č. 1a k rozhodnutí o změně registrace sp.zn. sukls116762/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefuroxim Kabi 750 mg, prášek pro přípravu injekčního roztoku (Cefuroximum) Přečtěte si
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TIENAM 500 mg/500 mg i.v. Prášek pro přípravu infuzního roztoku (Imipenemum monohydricum a cilastatinum natricum) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TIENAM 500 mg/500 mg i.v. Prášek pro přípravu infuzního roztoku (Imipenemum monohydricum a cilastatinum natricum) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. Ceftazidim Mylan 1 g prášek pro injekční nebo infuzní roztok Ceftazidim Mylan 2 g.
 Sp. zn. sukls185832/2012, sukls192306/2012 a sp. zn. sukls47708/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Ceftazidim Mylan 1 g prášek pro injekční nebo infuzní roztok Ceftazidim Mylan 2 g prášek
Sp. zn. sukls185832/2012, sukls192306/2012 a sp. zn. sukls47708/2013 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Ceftazidim Mylan 1 g prášek pro injekční nebo infuzní roztok Ceftazidim Mylan 2 g prášek
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010
 Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
2. CO MUSÍTE VĚDĚT NEŽ ZAČNETE FLUCONAZOL ARDEZ UŽÍVAT
 Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace RP Informace pro použití, čtěte pozorně! Fluconazol Ardez Infúzní roztok K intravenóznímu podání 2 mg/ ml 200 mg/100 ml Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg prášek pro injekční roztok. (Ampicilinum/sulbactamum)
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls207005/2010 a příloha k sp.zn. sukls122247/2012 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn. sukls207005/2010 a příloha k sp.zn. sukls122247/2012 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Rp. Ampicillin and Sulbactam IBI 1 g + 500 mg
Příbalová informace: informace pro uživatele. Zinacef 750 mg Zinacef 1,5 g prášek pro injekční/infuzní roztok Cefuroximum
 Příbalová informace: informace pro uživatele Zinacef 750 mg Zinacef 1,5 g prášek pro injekční/infuzní Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele Zinacef 750 mg Zinacef 1,5 g prášek pro injekční/infuzní Cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
Simdax Příbalová informace
 Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
Simdax Příbalová informace Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro přípravu infuzního roztoku (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.:sukls128376/2010
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.:sukls128376/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MERONEM 500 mg, prášek pro přípravu injekčního nebo infuzního roztoku MERONEM 1
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.:sukls128376/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MERONEM 500 mg, prášek pro přípravu injekčního nebo infuzního roztoku MERONEM 1
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní roztok Ceftazidimum
Příbalová informace: informace pro uživatele Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní roztok Ceftazidimum
Příbalová informace: informace pro uživatele. Unasyn Prášek pro injekční roztok (Ampicillinum/sulbactamum)
 Příbalová informace: informace pro uživatele Unasyn Prášek pro injekční roztok (Ampicillinum/sulbactamum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
Příbalová informace: informace pro uživatele Unasyn Prášek pro injekční roztok (Ampicillinum/sulbactamum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: Informace pro pacienta. Cefepim Noridem 2 g prášek pro injekční/infuzní roztok. Cefepimum
 Sp.zn. sukls145218/2017, sukls145223/2017 Příbalová informace: Informace pro pacienta Cefepim Noridem 1 g prášek pro injekční/infuzní roztok Cefepim Noridem 2 g prášek pro injekční/infuzní roztok Cefepimum
Sp.zn. sukls145218/2017, sukls145223/2017 Příbalová informace: Informace pro pacienta Cefepim Noridem 1 g prášek pro injekční/infuzní roztok Cefepim Noridem 2 g prášek pro injekční/infuzní roztok Cefepimum
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příbalová informace: informace pro uživatele. Cefuroxim Kabi 1500 mg, prášek pro injekční/infuzní roztok. cefuroximum
 Sp. zn. sukls91788/2016 Příbalová informace: informace pro uživatele Cefuroxim Kabi 1500 mg, prášek pro injekční/infuzní roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp. zn. sukls91788/2016 Příbalová informace: informace pro uživatele Cefuroxim Kabi 1500 mg, prášek pro injekční/infuzní roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Klimicin injekční roztok. clindamycinum
 sp.zn.sukls213147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Klimicin injekční roztok clindamycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn.sukls213147/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Klimicin injekční roztok clindamycinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele
 sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
Příbalová informace: informace pro pacienty. Chloramphenicol VUAB 1 g. prášek pro injekční roztok chloramphenicolum
 sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls75310/2015 Příbalová informace: informace pro pacienty Chloramphenicol VUAB 1 g prášek pro injekční roztok chloramphenicolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Metronidazol B. Braun 5 mg/ml, infuzní roztok. metronidazolum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum
 sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok. Sulperazonum/sulbactamum
 Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele. Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas
 Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Bricanyl 0,5 mg/ml injekční roztok terbutalini sulfas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp. zn. sukls34348/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ampicillin/Sulbactam Mylan 1 g/0,5 g prášek pro injekční / infuzní roztok léčivé látky: sulbactamum 0,5 g a ampicillinum 1 g Přečtěte
Sp. zn. sukls34348/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ampicillin/Sulbactam Mylan 1 g/0,5 g prášek pro injekční / infuzní roztok léčivé látky: sulbactamum 0,5 g a ampicillinum 1 g Přečtěte
Ataralgin tablety PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Paracetamolum, Guaifenesinum, Coffeinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ataralgin tablety Paracetamolum, Guaifenesinum, Coffeinum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ataralgin tablety Paracetamolum, Guaifenesinum, Coffeinum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek
Příbalová informace: informace pro uživatele AESCIN-TEVA. 20 mg, enterosolventní tablety. escinum alfa
 sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls113741/2015 Příbalová informace: informace pro uživatele AESCIN-TEVA 20 mg, enterosolventní tablety escinum alfa Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum
 Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Pavulon 4mg = 2ml injekční roztok. Pancuronii bromidum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pavulon 4mg = 2ml injekční roztok Pancuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Pavulon 4mg = 2ml injekční roztok Pancuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si
Příbalová informace: informace pro uživatele
 Sp. zn. sukls40595/2015 Příbalová informace: informace pro uživatele Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní
Sp. zn. sukls40595/2015 Příbalová informace: informace pro uživatele Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní
Příbalová informace: informace pro pacienta. DALACIN C injekční roztok (clindamycini dihydrogenphosphas)
 Příbalová informace: informace pro pacienta DALACIN C injekční roztok (clindamycini dihydrogenphosphas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro pacienta DALACIN C injekční roztok (clindamycini dihydrogenphosphas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta. DALACIN C 150 mg DALACIN C 300 mg Tvrdé tobolky (clindamycini hydrochloridum)
 Příbalová informace: informace pro pacienta DALACIN C 150 mg DALACIN C 300 mg Tvrdé tobolky (clindamycini hydrochloridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta DALACIN C 150 mg DALACIN C 300 mg Tvrdé tobolky (clindamycini hydrochloridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. MUCOSOLVAN junior Sirup Ambroxoli hydrochloridum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MUCOSOLVAN junior Sirup Ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek je
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MUCOSOLVAN junior Sirup Ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás důležité údaje. Tento přípravek je
Příbalová informace: informace pro pacienta. Maltofer 50 mg/ml perorální kapky, roztok
 sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls229282/2011 Příbalová informace: informace pro pacienta Maltofer 50 mg/ml perorální kapky, roztok polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta
 sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
! Příbalová informace: informace pro uživatele. ! SUPRAX prášek pro perorální suspenzi (cefiximum)
 sp.zn.sukls531/2014 Příbalová informace: informace pro uživatele SUPRAX prášek pro perorální suspenzi (cefiximum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.sukls531/2014 Příbalová informace: informace pro uživatele SUPRAX prášek pro perorální suspenzi (cefiximum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
Příbalová informace: informace pro uživatele. Cefobid 1g Prášek pro injekční roztok. cefoperazonum
 Příbalová informace: informace pro uživatele Cefobid 1g Prášek pro injekční roztok cefoperazonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro uživatele Cefobid 1g Prášek pro injekční roztok cefoperazonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: Informace pro uživatele. Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum)
 sp.zn. sukls273948/2016 Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls273948/2016 Příbalová informace: Informace pro uživatele Simdax 2,5 mg/ml koncentrát pro infuzní roztok (Levosimendanum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. DOXIUM 500 mg tvrdé tobolky. Calcii dobesilas monohydricus
 sp.zn. sukls178298/2011 a sp.zn. sukls285789/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DOXIUM 500 mg tvrdé tobolky Calcii dobesilas monohydricus Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls178298/2011 a sp.zn. sukls285789/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DOXIUM 500 mg tvrdé tobolky Calcii dobesilas monohydricus Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu infuzního roztoku
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls242661/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ATG-Fresenius S (Immunoglobulinum antithymocytarum cuniculum) Koncentrát pro přípravu
Prášek pro infuzní roztok Aciclovirum
 sp.zn. sukls178224/2013 PŘÍBALOVÁ INFORMACE:INFORMACE PRO UŽIVATELE HERPESIN 250 Prášek pro infuzní roztok Aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls178224/2013 PŘÍBALOVÁ INFORMACE:INFORMACE PRO UŽIVATELE HERPESIN 250 Prášek pro infuzní roztok Aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
DUOMOX 250 DUOMOX 375 DUOMOX 500 DUOMOX 750 DUOMOX 1000 Dispergovatelné tablety
 sp.zn.: sukls211191/2012, sukls211192/2012, sukls211193/2012, sukls211194/2012, sukls211195/2012, Příbalová informace: informace pro uživatele DUOMOX 250 DUOMOX 375 DUOMOX 500 DUOMOX 750 DUOMOX 1000 Dispergovatelné
sp.zn.: sukls211191/2012, sukls211192/2012, sukls211193/2012, sukls211194/2012, sukls211195/2012, Příbalová informace: informace pro uživatele DUOMOX 250 DUOMOX 375 DUOMOX 500 DUOMOX 750 DUOMOX 1000 Dispergovatelné
! Suprax 200 mg potahované tablety (cefiximum)
 sp.zn.sukls6631/2014 Příbalová informace: informace pro uživatele Suprax 200 mg potahované tablety (cefiximum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.sukls6631/2014 Příbalová informace: informace pro uživatele Suprax 200 mg potahované tablety (cefiximum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PERFALGAN 10 mg/ml, infuzní roztok paracetamolum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
sp.zn.sukls170650/2014
 sp.zn.sukls170650/2014 Příbalová informace: informace pro uživatele AMBROXOL AL KAPKY 7,5 mg / ml ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls170650/2014 Příbalová informace: informace pro uživatele AMBROXOL AL KAPKY 7,5 mg / ml ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SUMAMED 500 mg infuze prášek pro přípravu infuzního roztoku (azithromycinum)
 Příloha č. 1 ke sdělení sp. zn. sukls177461/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SUMAMED 500 mg infuze prášek pro přípravu infuzního roztoku (azithromycinum) Přečtěte si pozorně celou příbalovou
Příloha č. 1 ke sdělení sp. zn. sukls177461/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SUMAMED 500 mg infuze prášek pro přípravu infuzního roztoku (azithromycinum) Přečtěte si pozorně celou příbalovou
Příbalová informace: Informace pro uživatele. NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum
 sp.zn. sukls221673/2011 Příbalová informace: Informace pro uživatele NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls221673/2011 Příbalová informace: Informace pro uživatele NEO-BRONCHOL 15 mg pastilky ambroxoli hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
Fortum 500 mg Fortum 1 g Fortum 2 g (Ceftazidimum pentahydricum) prášek pro přípravu injekčního roztoku
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.:sukls193468/2010, sukls193469/2010, sukls193471/2010 Příbalová informace. Informace pro použití, čtěte pozorně! Fortum 500 mg Fortum 1 g Fortum
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.:sukls193468/2010, sukls193469/2010, sukls193471/2010 Příbalová informace. Informace pro použití, čtěte pozorně! Fortum 500 mg Fortum 1 g Fortum
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro uživatele
 sp. zn. sukls210428-9/2012 a sukls199150/2013 a sukls199152/2013 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro uživatele PIPERACILLIN/TAZOBACTAM IBIGEN 2 g/0,25 g prášek pro infuzní roztok PIPERACILLIN/TAZOBACTAM
sp. zn. sukls210428-9/2012 a sukls199150/2013 a sukls199152/2013 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro uživatele PIPERACILLIN/TAZOBACTAM IBIGEN 2 g/0,25 g prášek pro infuzní roztok PIPERACILLIN/TAZOBACTAM
Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum
 Příbalová informace: informace pro pacienta Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Norcuron 4 mg prášek pro přípravu injekčního roztoku vecuronii bromidum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Norcuron 4 mg prášek pro přípravu injekčního roztoku vecuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Norcuron 4 mg prášek pro přípravu injekčního roztoku vecuronii bromidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
Příbalová informace: informace pro pacienta
 Příbalová informace: informace pro pacienta Unasyn 1,5 g prášek pro injekční roztok Ampicillinum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
Příbalová informace: informace pro pacienta Unasyn 1,5 g prášek pro injekční roztok Ampicillinum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum
 Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
Souhrn údajů o přípravku
 Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.:sukls193468//2010, sukls193469/2010, sukls193471/2010 1. NÁZEV PŘÍPRAVKU Fortum 500 mg Fortum 1 g Fortum 2 g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn.:sukls193468//2010, sukls193469/2010, sukls193471/2010 1. NÁZEV PŘÍPRAVKU Fortum 500 mg Fortum 1 g Fortum 2 g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
sp.zn. sukls107935/2012
 sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
sp.zn. sukls107935/2012 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta Mucoplant proti kašli s jitrocelem a medem sirup Plantaginis extractum fluidum Přečtěte si pozorně tuto příbalovou
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. CEFUROXIM-RATIOPHARM 250 mg CEFUROXIM-RATIOPHARM 500 mg potahované tablety cefuroximum axetili
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls36308-09/2007 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE CEFUROXIM-RATIOPHARM 250 mg CEFUROXIM-RATIOPHARM 500 mg potahované tablety cefuroximum axetili
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls36308-09/2007 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE CEFUROXIM-RATIOPHARM 250 mg CEFUROXIM-RATIOPHARM 500 mg potahované tablety cefuroximum axetili
1. CO JE PŘÍPRAVEK VIDAZA A K ČEMU SE POUŽÍVÁ
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vidaza 25 mg/ml prášek pro přípravu injekční suspenze Azacitidinum Přečtěte si pozorně celou příbalovou informaci dříve, než vám začne být tento přípravek podáván.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vidaza 25 mg/ml prášek pro přípravu injekční suspenze Azacitidinum Přečtěte si pozorně celou příbalovou informaci dříve, než vám začne být tento přípravek podáván.
PŘÍBALOVÁ INFORMACE - INFORMACE PRO PACIENTA MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO PACIENTA MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO PACIENTA MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum
 sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
sp.zn.sukls103902/2015, sukls103869/2015 Příbalová informace: informace pro uživatele Harpagofyt ležatý Apomedica 600 mg potahované tablety Harpagophyti radicis extractum siccum Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
sp.zn. sukls171995/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní roztok 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fortum 500 mg, prášek pro injekční roztok Fortum 1 g, prášek pro injekční nebo infuzní roztok Fortum 2 g, prášek pro injekční nebo infuzní roztok 2. KVALITATIVNÍ
sp.zn.sukls59948/2015
 sp.zn.sukls59948/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vitamin C-Injektopas 7,5 g 150 mg/ml koncentrát pro infuzní roztok acidum ascorbicum Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn.sukls59948/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vitamin C-Injektopas 7,5 g 150 mg/ml koncentrát pro infuzní roztok acidum ascorbicum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bronchostop sirup. Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt
 Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls194081/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls194081/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ondansetron Kabi 2 mg/ml/ml, injekční roztok ondansetron Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls194081/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ondansetron Kabi 2 mg/ml/ml, injekční roztok ondansetron Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls178251/2009
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls178251/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan Mylan 1 mg/ml koncentrát pro přípravu infuzního roztoku topotecanum Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls178251/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan Mylan 1 mg/ml koncentrát pro přípravu infuzního roztoku topotecanum Přečtěte si pozorně
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok Ibandronic Acid Accord 6 mg koncentrát pro infuzní roztok acidum ibandronicum
 Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Ibandronic Acid Accord 2 mg koncentrát pro infuzní roztok acidum ibandronicum Máte- Pokud se kterýkoli z než V 1. Ibandronic Acid Accord a k 2. Ibandronic Acid Accord používat 3. Ibandronic Acid Accord
Příbalová informace: informace pro pacienta. Sulperazon 2 g IM/IV Prášek pro injekční roztok. Cefoperazonum/sulbactamum
 Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Cefoperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Cefoperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE 2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE STOPTUSSIN SIRUP UŽÍVAT
 PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Tento přípravek je dostupný bez lékařského předpisu. Přesto však Stoptussin sirup musíte užívat
PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. Tento přípravek je dostupný bez lékařského předpisu. Přesto však Stoptussin sirup musíte užívat
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Meropenem Zentiva 500 mg Meropenem Zentiva 1000 mg prášek pro injekční/infuzní roztok Meropenemum
 Sp. zn. sukls179496/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Meropenem Zentiva 500 mg Meropenem Zentiva 1000 mg prášek pro injekční/infuzní roztok Meropenemum Přečtěte si pozorně celou příbalovou
Sp. zn. sukls179496/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Meropenem Zentiva 500 mg Meropenem Zentiva 1000 mg prášek pro injekční/infuzní roztok Meropenemum Přečtěte si pozorně celou příbalovou
Ferrum. Opakovaná léčba Diafer 50 mg/ml injekčním roztokem je používána k doplnění a udržení zásob železa v těle.
 sp.zn. sukls57833/2014 Příbalová informace: informace pro pacienta 50 mg/ml injekční roztok Ferrum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete
sp.zn. sukls57833/2014 Příbalová informace: informace pro pacienta 50 mg/ml injekční roztok Ferrum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete
Příbalová informace: informace pro uživatele Bromhexin 12 BC 12 mg/ml, perorální kapky, roztok bromhexini hydrochloridum
 sp.zn.sukls34096/2016 Příbalová informace: informace pro uživatele Bromhexin 12 BC 12 mg/ml, perorální kapky, roztok bromhexini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn.sukls34096/2016 Příbalová informace: informace pro uživatele Bromhexin 12 BC 12 mg/ml, perorální kapky, roztok bromhexini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete
sp.zn.sukls36362/2014
 sp.zn.sukls36362/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MEDOXIN 250 mg potahované tablety MEDOXIN 500 mg potahované tablety Tablety Cefuroximum Přečtěte si pozorně celou příbalovou informaci
sp.zn.sukls36362/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MEDOXIN 250 mg potahované tablety MEDOXIN 500 mg potahované tablety Tablety Cefuroximum Přečtěte si pozorně celou příbalovou informaci
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
 Příloha č. 2 k rozhodnutí o registraci sp. zn.:sukls17388/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MEDOCLAV 1000 mg/200 mg prášek pro přípravu injekčního/infuzního roztoku Amoxicillinum/acidum
Příloha č. 2 k rozhodnutí o registraci sp. zn.:sukls17388/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE MEDOCLAV 1000 mg/200 mg prášek pro přípravu injekčního/infuzního roztoku Amoxicillinum/acidum
2. Čemu musíte věnovat pozornost, než začnete přípravek Vancomycin CNP Pharma používat
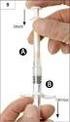 sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
