Souhrn údajů o přípravku
|
|
|
- Radovan Konečný
- před 9 lety
- Počet zobrazení:
Transkript
1 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU 1,5% 1,25, roztok pro peritoneální dialýzu 2,3% 1,25, roztok pro peritoneální dialýzu 4,25% 1,25, roztok pro peritoneální dialýzu 1,5% 1,75, roztok pro peritoneální dialýzu 2,3% 1,75, roztok pro peritoneální dialýzu 4,25% 1,75, roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1,5%/2,3%/4,25% 1,25/1,75 se dodává ve dvoukomorovém vaku. Jedna komora obsahuje zásaditý roztok laktátu, druhá komora obsahuje kyselý roztok elektrolytů s obsahem glukosy. Smísením obou roztoků otevřením středního švu mezi dvěma komorami získáme neutrální roztok připravený k použití. PŘED SMÍSENÍM 1 litr kyselého roztoku elektrolytů s obsahem glukosy obsahuje: natrii chloridum calcii chloridum dihydricum magnesii chloridum hexahydricum glucosum monohydricum odp. glucosum 1.5% 2.3% 4.25% 1.5% 2.3% 4.25% g g g g g g g g g g g g g g g g g g g g 1 litr zásaditého roztoku laktátu obsahuje: natrii lactas 7,85 g (jako natrii lactatis solutio) PO SMÍSENÍ 1 litr neutrálního roztoku připraveného k použití obsahuje: natrii chloridum natrii lactas jako natrii 1.5% 2.3% 4.25% 1/15 1.5% 2.3% 4.25% g g g g g g g g g g g g
2 lactatis solutio 50% calcii chloridum dihydricum magnesii chloridum hexahydricum glucosum anhydricum jako glucosum monohydr g g g g g g g g g g g g 15.0 g g 42.5 g 15.0 g g 42.5 g 1.5% Na Ca ++ Mg Cl % mosm/l 4.25% mosm/l 1.5% mosm/l 2.3% mosm/l 4.25% Laktát 35 Glucosum 83.2 Teoretická osmolarita mosm/l mosm/l ph Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Roztok pro peritoneální dialýzu. Dvoukomorový vak obsahující čirý až bezbarvý vodný roztok. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Pro použití u pacientů s dekompenzovaným chronickým renálním selháním různé patogenese, které může být léčeno peritoneální dialýzou. 4.2 Dávkování a způsob použití Dávkování 2/15
3 Tento roztok je výhradně určen pro intraperitoneální použití. Způsob terapie, frekvence aplikace a požadovaná doba ponechání v peritoneu budou určeny ošetřujícím lékařem. Není-li stanoveno jinak, pacient dostává infuzi 2000 ml roztoku na jednu výměnu čtyřikrát denně. Roztok se ponechá v dutině 2 10 hodin a poté se vypustí. Pro jednotlivé pacienty je nutné individuálně upravit dávku, objem a počet výměn roztoku. Pokud se na začátku terapie objeví bolesti z napětí v břišní dutině, objem roztoku pro výměnu by měl být dočasně snížen na ml. U pacientů s vyšší hmotností, pokud došlo ke ztrátě zbytkové funkce ledvin, bude nezbytné zvýšení objemu dialyzačního roztoku. U těchto pacientů, nebo u pacientů s tolerancí většího objemu, může být podáván na výměnu roztok o objemu ml. Pro přerušovanou nebo kontinuální cyklickou peritoneální dialýzu s použitím přístroje je doporučeno provádět více než jednu výměnu roztoku a použít vaky s větším obsahem. U dětí je doporučena dávka v závislosti na věku, velikosti a tělesné hmotnosti (30-40 ml/kg tělesné váhy). Pro starší pacienty není potřebné speciální dávkování. Peritoneální dialýza roztoky o vyšší koncentraci glukosy (2,3 % nebo 4,25 %) se používá, pokud je tělesná váha vyšší než požadovaná suchá váha. V závislosti na koncentraci glukosy v roztoku pro peritoneální dialýzu vzrůstá odstraňování tekutin z těla. Tyto roztoky mají být používány opatrně s ohledem na ohrožení peritoneální membrány, aby se předešlo dehydrataci pacienta a aby zátěž glukosou byla co nejnižší. Předepsané dávky pro dialýzu mají být podávány denně. Peritoneální dialýza je dlouhodobé léčení prováděné opakováním aplikace jednotlivých roztoků. 1.5% / 1.5% / obsahuje 15 g glukosy v 1000 ml roztoku. Postup a doba používání 2.3% / 2.3% / obsahuje g glukosy v 1000 ml roztoku. 4.25% / 4.25% / obsahuje 42.5 g glukosy v 1000 ml roztoku. Pro roztok stay safe platí, že nejdříve zahřejte roztok připravený k použití na teplotu těla. Pro zahřátí se doporučuje použít vhodný ohřívač. Doba zahřívání vaku o obsahu 2000 ml s počáteční teplotou 22 C je přibližně 120 minut. Více informací naleznete v návodu k použití ohřívače vaků. Použití mikrovlnného ohřevu není doporučeno z důvodů nebezpečí lokálního přehřátí. Roztoky ve dvou komorách musí být smíchány před použitím. Přesný návod k použití je popsán v bodě 6.6. Podle doporučení lékaře se dávka ponechává v peritoneální dutině po dobu 2-10 hodin (rovnovážná doba), poté má být vypuštěna. 1.5% / Podle požadované úrovně osmotického tlaku může být 1,5% 2.3% / Podle požadované úrovně osmotického tlaku může být 2,3% 3/ % / Podle požadované úrovně osmotického tlaku může být 4,25%
4 1,25/1,75 použit v kombinaci s jiným roztokem pro peritoneální dialýzu s vyšším obsahem glukosy (tj. s vyšší osmolaritou). 1,25/1,75 následně použit v kombinaci s jiným roztokem pro peritoneální dialýzu s nižším nebo vyšším obsahem glukosy (tj. s nižší nebo vyšší osmolaritou). 1,25/1,75 následně použit v kombinaci s jiným roztokem pro peritoneální dialýzu s nižším obsahem glukosy (tj. s nižší osmolaritou). Dříve než pacient může provádět peritoneální dialýzu doma, musí být příslušně proškolen, musí zvládnout techniku a prokázat, že je schopen dialýzu provádět. Zaškolení má provádět kvalifikovaný personál. Ošetřující lékař se musí ujistit, že pacient dostatečně zvládá techniku peritoneální dialýzy před tím než bude propuštěn z nemocniční péče k provádění peritoneální dialýzy doma. V případě jakýchkoliv problémů nebo pochybností by měl pacient kontaktovat ošetřujícího lékaře. Peritoneální dialýza by měla probíhat do té doby, dokud je potřeba terapie nahrazující funkci ledvin. 4.3 Kontraindikace Pro tento konkrétní roztok pro peritoneální dialýzu 1.5%/2.3% 1.5%/2.3% nesmí být použit u pacientů se závažnou hypokalémií a při závažné hypokalcemii, 4.25% 4.25%. nesmí být použit u pacientů se závažnou hypokalémií, při závažné hypokalcemii, hypovolémii a při arteriální hypotenzi. 1.5%/2.3% 1.5%/2.3% nesmí být použit u pacientů se závažnou hypokalémií a při závažné hyperkalcemii % 4.25% nesmí být použit u pacientů se závažnou hypokalémií, při závažné hyperkalcemii, hypovolémii a při arteriální hypotenzi. Pro peritoneální dialýzu obecně Peritoneální dialýza nesmí být prováděna při žádné z následujících potíží: nedávné břišní zranění nebo operace, dřívější břišní chirurgické zákroky s fibrózními srůsty, závažné břišní popáleniny, abdominální perforace, rozsáhlé zánětlivé stavy pokožky břicha (dermatitis), zánětlivá onemocnění střev (Crohnova nemoc, vředová kolika, divertikulitida), peritonitida, vnitřní nebo zevní abdominální fistule, pupeční, tříselná nebo jiná abdominální kýla, vnitřní abdominální nádory, ileus, plicní onemocnění (zejména pneumonie), sepse, laktátová acidóza, extrémní hyperlipidemie, ve výjimečných případech urémie, která nemůže být zvládnuta peritoneální dialýzou, 4/15
5 kachexie a závažná ztráta váhy, zvláště když není možné zajistit adekvátní proteinovou výživu, u pacientů psychicky nebo mentálně neschopných provádět peritoneální dialýzu podle instrukcí lékaře. Pokud se během peritoneální dialýzy objeví jakákoliv z výše uvedených obtíží, lékař rozhodne, jak v terapii pokračovat. 4.4 Zvláštní upozornění a zvláštní opatření pro použití Roztok může být použit pouze po pečlivém zvážení výhod a rizik: - při ztrátě elektrolytů zvracením a/nebo průjmem (to může vyžadovat dočasné použití dialyzačního roztoku s draslíkem). 1.5%/2.3%/4.25% pacienti s hyperparat;yreózou: K zajištění přiměřeného enterálního příjmu vápníku, může být nezbytné podávat kalciové vazače fosfátů a/nebo vitamin D. hypokalcemie: Je třeba uvažovat o dočasném nebo trvalém použití roztoku pro peritoneální dialýzu s vyšší koncentrací vápníku, v případě že není možné zajištění přiměřeného enterálního příjmu vápníku pomocí kalciových vazačů fosfátu a/nebo vitaminu D 1.5%/2.3%/4.25% hyperkalcemie, např. z důvodu podávání kalciových vazačů fosfátu a/nebo vitaminu D, (měla by být zvážena dočasná nebo trvalá změna použití roztoku s nižší koncentrací vápníku). Pacienti používající digitalis: Pravidelné sledování hladiny draslíku v séru je nezbytné. Vážná hypokalémie vyžaduje použití dialyzačního roztoku s obsahem draslíku společně s úpravou výživy. pacienti s rozsáhlou polycystickou chorobou ledvin. Vypouštěná tekutina má být kontrolována na čistotu a objem. Zákal, který může nebo nemusí být doprovázen bolestí břicha, nebo bolest břicha samotná, jsou indikátory peritonitidy. Při peritoneální dialýze dochází k úbytku proteinů, aminokyselin a vitamínů rozpustných ve vodě. Předejít nedostatku je třeba zajištěním adekvátní výživy nebo náhrady. Během dlouhotrvající peritoneální dialýzy se může změnit propouštěcí schopnost peritoneální membrány, primárně indikovaná snížením ultrafiltrace. Ve vážných případech musí být zastavena peritoneální dialýza a zavedena hemodialýza. Je doporučeno monitorování následujících parametrů: - tělesná hmotnost, pro včasné rozpoznání hyperhydratace a dehydratace, - hladina sodíku, draslíku, vápníku, hořčíku a fosfátů v krevním séru, acidobazická rovnováha, krevní plyny a bílkoviny, - hladina kreatininu a močoviny v séru, - parathormon a další ukazatele kostního metabolismu, - hladina cukru v krvi, - zbytková funkce ledvin, k přizpůsobení peritoneální dialýzy. Starší pacienti Dříve než se u starších pacientů zahájí peritoneální dialýza, má být zváženo vyšší nebezpečí výskytu kýly. Doba použitelnosti roztoku připraveného k použití 5/15
6 Roztok připravený k použití má být použit okamžitě, ale nejpozději do 24 hodin po smíchání (viz bod 6.3). Manipulace (viz bod 6.6) Plastové kontejnery mohou být občas poškozeny při přepravě nebo při skladování. To může být příčinnou kontaminace a produkce mikroorganismů v dialyzačním roztoku. Proto musí být před připojením vaku a použitím dialyzačního roztoku vždy provedena pečlivá kontrola. Každé, i malé poškození uzávěru a svárů nebo okrajů obalu musí být prověřeno, protože roztok by mohl být kontaminován. Poškozené vaky nebo vaky se zakaleným obsahem nesmí být nikdy použity. Mohou se používat pouze čiré roztoky pro dialýzu a vaky nepoškozené. Nepoužité zbytky roztoku musí být znehodnoceny. Vnější obal má být odstraněn pouze před použitím. Nepoužívejte dříve smíchané roztoky. V průběhu výměny vaků s roztokem musí být udržovány aseptické podmínky, aby se snížilo riziko infekce. Roztok pro peritoneální dialýzu se nesmí použít pro intravenózní infuzi. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Používání roztoku pro peritoneální dialýzu může snížit působení jiných léků, které prostupují peritoneální membránou. Může být nezbytné upravit dávky těchto léků. Významný úbytek draslíku v krevním séru může zvýšit četnost nepříznivých reakcí spojených s léky obsahujícími digitális. Hladina draslíku musí být sledována zvláště pečlivě v případě souběžné terapie léky obsahujícími digitális. 1.5%/2.3%/4.25% Při současném podávání přípravků s obsahem vápníku nebo vitamínu D se může objevit hyperkalcemie. Použití diuretik, může pomoci udržování zbývající funkce ledvin, ale zároveň může vést k nerovnováze vody a elektrolytů. U diabetických pacientů musí být upravena denní dávka inzulinu nebo perorálních léků snižujících množství cukru v krvi podle zvýšeného příjmu glukosy. 4.6 Těhotenství a kojení Klinické údaje o použití roztoků 1,5%/2,3%/4,25% 1,25/1,75 na zvířatech a u těhotných žen nejsou k dispozici. Při předepsání peritoneální dialýzy v průběhu těhotenství nebo kojení je postupovat s opatrností. 4.7 Účinky na schopnost řídit a obsluhovat stroje 1,5%/2,3%/4,25% 1,25/1,75 zanedbatelný vliv na schopnost řídit a používat technická zařízení. nemá žádný nebo 4.8 Nežádoucí účinky 1,5%/2,3%/4,25% 1,25/1,75 je roztok elektrolytů se složením obdobným krvi. Rovněž má roztok neutrální hodnotu ph, která je obdobná jako fyziologická hodnota ph. 6/15
7 Samotná peritoneální dialýza, nebo dialyzační roztok mohou vyvolat následující nežádoucí účinky. Možné nežádoucí účinky spojené s dialyzačním roztokem 1.5%/2.3%/4.25% Endokrinní poruchy Sekundární hyperparatyroidismus s potenciálním narušením kostního metabolismu Poruchy metabolismu a výživy - Zvýšení hladiny cukru v krvi; hyperlipidemie; zvýšení tělesné hmotnosti následkem zvýšeného příjmu glukosy z roztoku pro peritoneální dialýzu. Srdeční a cévní poruchy - Tachykardie; hypotenze; hypertenze. Respirační, hrudní a mediastinální poruchy - Dyspnoe. 1.5%/2.3%/4.25% Poruchy ledvin a močových cest Narušení elektrolytové rovnováhy, např. hypokalémie (velmi běžná (> 10 %)), hypokalcemie. 7/15 1.5%/2.3%/4.25% Poruchy ledvin a močových cest Narušení elektrolytové rovnováhy, např. hypokalémie (velmi běžná (> 10 %)), hyperkalcemie v kombinaci se vzrůstem příjmu vápníku, např. při podávání kalciových vazačů fosfátu. Celkové a jinde nezařazené poruchy - Závratě; otoky; narušení hydratace indikované výrazným snížením (dehydratace) nebo zvýšením (hyperhydratace) tělesné váhy. Při používání roztoků s vyšší koncentrací glukosy se může objevit vážná dehydratace. Možné nežádoucí účinky léčebné procedury Infekce a infestace - Peritonitida (velmi běžná (> 10 %), infekce výstupního místa a průběhu katetru (velmi běžná (> 10 %), velmi vzácně sepse (< 0,01 %) včetně ojedinělých zpráv. Respirační, hrudní a mediastinální poruchy - Dyspnoe způsobená vzedmutím bránice; bolesti v zádech. Gastrointestinální poruchy - průjem; obstipace; kýla (velmi běžné ((> 10 %)), abdominální napětí a pocit plnosti. Celkové poruchy a reakce v místě aplikace: - Celková slabost; zarudnutí, otok, mokvání, strupy a bolest v místě vstupu katetru Poruchy spojené s peritoneální dialýzou - zakalený vypouštěný dialyzát; problémy s napouštěním nebo vypouštěním dialyzačního roztoku. Peritonitida je indikována zakaleným vypouštěným dialyzátem. Později se může rozvinout abdominální bolest, horečka a celková slabost nebo ve velmi vzácných případech sepse. Pacient by měl okamžitě vyhledat lékařskou pomoc. Vak se zakalenou tekutinou má být
8 uzavřen sterilní čepičkou a posouzena mikrobiologická kontaminace a vyhodnocení počtu leukocytů. V případě infekce vstupu a průběhu katetru má být problém konzultován co nejdříve s ošetřujícím lékařem. 4.9 Předávkování Žádná závažná situace s předávkováním nebyla hlášena. Nadměrné napuštění dialyzačního roztoku je možné snadno vypustit do prázdného vaku. Avšak, jestliže výměna vaků se provádí příliš často nebo rychle, může se objevit dehydratace nebo elektrolytová nerovnováha, což vyžaduje okamžitou lékařskou péči. Jestliže se jedna výměna zapomene, pak se zpravidla čas ponechání příštích vaků roztoku zkrátí tak, aby bylo dosaženo celkového požadovaného denního množství dialyzačního roztoku (např. 4 x 2000 ml). Nesprávná rovnováha může vést k hyper- nebo dehydrataci a elektrolytové nerovnováze. Nejpravděpodobnějším důsledkem předávkování roztoky 1,5%/2,3%/4,25% 1,25/1,75 je dehydratace. Poddávkování, přerušení terapie nebo přerývání terapie může vést k život ohrožující hyperhydrataci s periferními otoky a srdeční dekompenzací a/nebo k dalším symptomům urémie, které ohrožují život. Musí být zachována obecně platná pravidla první pomoci a intenzivní péče. Pacient může potřebovat okamžitou hemodialýzu. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: roztok pro peritoneální dialýzu ATC kód: B05D B 1,5%/2,3%/4,25% 1,25/1,75 představuje laktátem tlumené roztoky elektrolytů obsahující glukosu, s indikací peritoneálně aplikované terapie dekompenzovaného renálního onemocnění různého původu. Pro kontinuální ambulantní peritoneální dialýzu (CAPD) je charakteristická více či méně stálá přítomnost obvykle 2 litrů dialyzačního roztoku v peritoneální dutině. Tento dialyzační roztok je nahrazován čerstvým roztokem třikrát až pětkrát denně. Základním principem každé peritoneální dialýzy je použití peritonea jako polopropustné membrány, která dovoluje výměnu rozpuštěných látek a vody mezi krví a dialyzačním roztokem, která probíhá prolínáním a přenosem podle jejich fyzikálně-chemických vlastností. Elektrolytový profil roztoku je v podstatě stejný jako u fyziologického séra, ačkoli byl upraven (např. obsah draslíku) pro použití u pacientů s urémií, aby umožňoval terapii nahrazující funkci ledvin pomocí intraperitoneálních látek a výměny tekutin. 1.5%/2.3%/4.25% Koncetrace vápníku v těchto dialyzačních roztocích je, což snižuje nebezpečí hyperkalcemie při současné léčbě přípravky s obsahem kalciových vazačů fosfátu a/nebo vitaminu D. Látky, které jsou normálně vylučovány s močí, jako uremické odpadní produkty, například močovina a kreatinin, anorganický fosfát, kyselina močová, další rozpuštěné látky a voda, jsou odstraňovány z těla do dialyzačního roztoku. Rovnováha tekutin může být udržována podáváním roztoků s různou koncentrací glukosy, které mají vliv na odstranění tekutin (ultrafiltraci). Sekundární metabolická acidóza při dekompenzovaném renálním selhání je vyrovnána přítomností laktátu v roztoku. Úplný metabolismus laktátu má za následek vznik bikarbonátu. 8/15
9 5.2 Farmakokinetické vlastnosti Uremické odpadní produkty (např. močovina, kreatinin, kyselina močová), anorganický fosfát a elektrolyty jako sodík, draslík, vápník a hořčík jsou odstraňovány z těla do dialyzačního roztoku prolínáním a/nebo konvekcí. Dialyzační glukosa je použita v roztocích 1,5%/2,3%/4,25% 1,25/1,75 jako osmotický prostředek a je pomalu absorbována za snižování difúzního gradientu mezi dialyzačním roztokem a mimobuněčnou tekutinou. Ultrafiltrace je maximální na začátku časového intervalu a dosahuje vrcholu přibližně po 2 až 3 hodinách. Později je absorpce spojena s progresivním úbytkem ultrafiltrátu. 1.5%/2.3%/4.25% Po 4 hodinách je průměrně 100 ml ultrafiltrátu s 1,5 % roztokem glukosy, 400 ml s 2,3 % glukosy a 800 ml s 4,25 % glukosy. V průběhu šestihodinového časového intervalu je absorbováno 60 až 80 % dialyzované glukosy. 1.5%/2.3%/4.25% Použitý laktát jako pufr je v průběhu 6 hodinového časového intervalu téměř zcela vstřebán. Pacienti s normální funkcí ledvin rychle metabolizují laktát, což je patrné z normálních hodnot intermediálních metabolitů. Přesun vápníku závisí na koncentraci glukosy v dialyzačním roztoku, na vypouštěném objemu, na množství ionizovaného vápníku v séru a na koncentraci vápníku v dialyzačním roztoku. Čím vyšší je koncentrace glukosy, vypouštěný objem a koncentrace vápníku v séru, a zároveň čím nižší je koncentrace vápníku v dialyzačním roztoku, tím vyšší je přesun vápníku od pacienta do dialyzátu. 1.5%/2.3%/4.25% Lze odhadnout, že typický rozvrh pro CAPD, tj. tři vaky s 1.5% a jeden 4.25 % koncentrací glukosy denně a koncentrací kalcia mohou odstranit až 160 mg kalcia denně, což umoňuje vyšší příjem perorální léků s obsahem vápníku a vitaminu D bez rizika vzniku hyperkalcemie. 5.3 Preklinické údaje vztahující se k bezpečnosti přípravku S roztoky 1,5%/2,3%/4,25% 1,25/1,75 nebyly prováděny žádné preklinické studie toxicity, ale klinické studie peritoneálního dialyzačního roztoku s podobným složením neindikovaly žádné vážné riziko toxicity. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Kyselina chlorovodíková 25% Hydroxid sodný Hydrogenuhličitan sodný Voda na injekci 6.2 Inkompatibility Přidávání léků může být provedeno pouze na základě předpisu lékaře, z důvodu nebezpečí inkompatibility a kontaminace. Tento lék nemá být použit s jiným léky s výjimkou těch, které jsou uvedeny v bodě /15
10 6.3 Doba použitelnosti Doba použitelnosti v originálním obalu: 2 roky. Doba použitelnosti po smísení: Chemická a fyzikální stabilita je prokázána na 24 hodin při teplotě 20 C. 6.4 Zvláštní opatření pro uchovávání Uchovávat při teplotě nad 4 C. 6.5 Druh obalu a velikost balení Dvoukomorový vak: Roztok laktátu: roztok elektrolytů s obsahem glukosy = 1 : 1 Dvoukomorový systém vaků složený z dvoukomorového non-pvc vaku, který je ve vnějším ochranném přebalu, oba z polyolefínového vícevrstvého filmu. K dispozici jsou tři následující verze obalů: Stay safe systém sestává z dvoukomorového vaku, systému hadiček z polyolefínů, systému konektor (DISC) s otočným přepínačem (polypropylen) a z drenážního vaku rovněž z polyolefínového vícevrstvého filmu. Sleep safe systém sestává z dvoukomorového vaku a konektoru, který je z polypropylenu. Safe lock systém sestává z dvoukomorového vaku a safe lock konektoru, který je z polykarbonátu. Velikost balení: stay safe 4 vaky x 1500 ml 4 vaky x 2000 ml 4 vaky x 2500 ml 4 vaky x 3000 ml sleep safe 4 vaky x 3000 ml 2 vaky x 5000 ml 2 vaky x 6000 ml safe lock 2 vaky x 5000 ml 2 vaky x 6000 ml Na trhu nemusí být všechny velikosti balení. 6.6 Návod k použití přípravku a zacházení s ním Pouze pro jednorázové použití. Všechny nepoužité zbytky roztoku musí být zlikvidovány. Pro roztoky stay safe platí, že roztok připravený k použití se nejdříve zahřeje na tělesnou teplotu. Pro ohřev vaků do objemu ml je možné použít vhodnou nahřívací plotýnku. Doba ohřevu pro ml vak při počáteční teplotě 22 C je cca 120 min. Teplota je kontrolována automaticky a je nastavena na 39 C +- 1 C. Podrobnější informace jsou uvedeny v návodu k použití ohřívače vaků. Použití mikrovlnné trouby není doporučeno, hrozí nebezpečí lokálního přehřátí. Vaky sleep safe a safe lock se používají s 10/15
11 cyclerem. Ohřev pak probíhá automaticky na zařízení uvnitř cycleru. Výměna vaků probíhá až po ohřátí roztoku. Návod k použití systému stay safe Balance : 1. Příprava roztoku - kontrola ohřátého vaku s roztokem (etiketa, doba použitelnosti, čirost roztoku, neporušenost vaku a obalu, celistvost peelového švu) - umístěte vak na pevnou podložku - otevřete ochranný přebal vaku a dezinfekční čepičky - umyjte si ruce antimikrobiálním roztokem - srolujte vak, který leží na vnějším přebalu, z jedné strany krajů až se střední šev otevře. Roztoky z obou komor se smíchají automaticky. - nyní srolujte vak z horního kraje až se zcela otevře peelový šev dolního trojúhelníku. - zkontrolujte, jestli jsou všechny peelové švy zcela otevřeny - zkontrolujte, jestli je roztok čirý a vak neprosakuje 2. Příprava na výměnu vaků - Zavěste vak s roztokem na horní závěs infuzního stojanu, rozviňte set vaku s roztokem, DISK konektor vložte do organizeru. Poté co rozvinete hadičky spojující drenážní vak, zavěste vak na nižší závěs infuzního stojanu a vložte dezinfekční čepičku do organizeru. - Vložte koncovku katetru do organizeru. - Vydezinfikujte si ruce a odstraňte ochrannou čepičku z DISC konektoru a odložte ji stranou. - Připojte koncovku peritoneálního katetru k DISCu. 3. Vypouštění -Otevřete tlačku na katetru. Automaticky začne vypouštění. -Poloha ( ) 4. Propláchnutí setu -Po úplném vypuštění, čerstvý roztok propláchne sety mezi vakem s roztokem a odpadním vakem (asi 5 sec.). -Poloha ( ) 5. Napouštění - Zahajte napouštění nastavením přepínačem na polohu - Poloha 6. Bezpečnostní krok - Uzavřete koncovku peritoneálního katetru zasunutím PINu do konektoru katetru. - Poloha ( ) 7. Odpojení - Odšroubujte kryt nové dezinfekční čepičky a našroubujte kryt na použitou dezinfekční čepičku. -Odšroubujte koncovku peritoneálního katetru z DISCu a našroubujte na ni novou dezinfekční čepičku. 8. Uzavření DISCu -Uzavřete DISC konektor otevřeným koncem použité dezinfekční čepičky, která je v pravém otvoru organizéru. 9. Zkontrolujte vypuštěný dialyzát - jeho čirost a váhu a je-li čirý, zlikvidujte jej. 11/15
12 1. Sety 2. Vstup pro aplikaci léku/odběr biologického materiálu 3. Peelový šev 4. DISC konektor 5. Port Návod k použití pro systém sleep safe 3000 ml: 1. Příprava roztoku - kontrola vaku s roztokem (etiketa, doba použitelnosti, čirost roztoku, neporušenost vaku, ochranného přebalu a peelových švů) - položte vak na pevnou podložku - otevřete ochranný obal vaku. - umyjte si ruce za použití antimikrobiálního roztoku - srolujte vak, který leží na vnějším přebalu, z jedné strany krajů až se střední šev otevře. Roztoky z obou komor se smíchají automaticky. - nyní srolujte vak z horního kraje až se zcela otevře peelový šev dolního trojúhelníku. - zkontrolujte, jestli jsou všechny peelové švy zcela otevřeny. - zkontrolujte, jestli je roztok čirý a vak neprosakuje - takto připravený roztok k použití má být použit okamžitě, nejpozději ale do 24 hodin po smísení (viz také bod 6.3). - léky, pokud jsou předepsány, mohou být za aseptických podmínek podávány do roztoku připraveného k použití vstupem (2) pro jejich aplikaci. 2. Rozviňte set (1) od vaku s peritoneálním roztokem. 3. Odstraňte ochrannou čepičku. 4. Vložte konektor vaku do zásuvky přístroje sleep safe cycleru. 5. Nyní je vak s peritoneálním roztokem připraven k připojení sleep.safe setu. 12/15
13 Obr. 1. Set 2. Vstup pro aplikaci léků 3. Port 4. Peelový šev Návod k použití pro systém sleep safe 5000 ml a 6000 ml: 1. Příprava roztoku - kontrola vaku s roztokem (etiketa, doba použitelnosti, čirost roztoku, neporušenost vaku, ochranného přebalu a peelových švů) - položte vak na pevnou podložku - otevřete ochranný obal vaku. - umyjte si ruce za použití antimikrobiálního roztoku - rozložte střední peelový šev a konektor vaku - srolujte vak, který leží na vnějším přebalu, z diagonálního konce proti konektoru. Střední šev (4) se otevře. - pokračujte dokud se rovněž neotevře peelový šev malé komůrky (5). - zkontrolujte, jestli jsou všechny peelové švy zcela otevřeny. - zkontrolujte, jestli je roztok čirý a vak neprosakuje 2. Rozviňte set (1) od vaku s peritoneálním roztokem. 3. Odstraňte ochrannou čepičku. 4. Vložte konektor vaku do zásuvky přístroje sleep safe cycleru. 5. Nyní je vak je nyní připraven k připojení sleep.safe setu. 13/15
14 1. Set 2. Vstup pro aplikaci léků 3.Port 4. Střední peelový šev 5. Peelový šev malé komůrky Návod k použití pro systém safe lock : 1. Příprava roztoku - kontrola vaku s roztokem (etiketa, doba použitelnosti, čirost roztoku, neporušenost vaku, ochranného přebalu a peelových švů) - položte vak na pevnou podložku - otevřete ochranný obal vaku. - umyjte si ruce za použití antimikrobiálního roztoku - rozložte střední peelový šev a konektor vaku - srolujte vak, který leží na vnějším přebalu, z diagonálního konce proti konektoru. Střední šev (4) se otevře. - pokračujte dokud se rovněž neotevře peelový šev malé komůrky (5). - zkontrolujte, jestli jsou všechny peelové švy zcela otevřeny. - zkontrolujte, jestli je roztok čirý a vak neprosakuje. 2. Odstraňte ochrannou čepičku z konektoru (1) ze setu. 3. Spojte hadičky s vakem. 4. Zlomte vnitřní zámek u středního peelového setu ohnutím hadičky a pinu více než 90 na obě strany. 5. Nyní je vak připraven k použití. 1. Set 2. Vstup pro aplikaci léků 3. Port 4. Střední peelový šev 5. Peelový šev malé komůrky Obecné podmínky platné pro všechny systémy podávání: Roztoky připravené k použití mají být podávány okamžitě, ale pokud to není možné, tak nejpozději do 24 hodin po smísení (viz bod 6.3). Léky, pokud jsou předepsány, mohou být přidány do roztoku připraveného k použití vstupem pro aplikaci léků (2) tak, aby nedošlo ke kontaminaci roztoku. Pouze níže uvedené léky v uvedených koncentracích smí být přidány pokud jsou předepsány ošetřujícím lékařem: heparin I.U./l, inzulin 20 I.U./l, vankomycin mg/l, teikoplanin 400 mg/l, cefazolin 500 mg/l, ceftazidim 250 mg/l, gentamicin 8 mg/l. Po pečlivém smíchání a kontrole, zda se nevyskytuje zákal nebo částečky, musí být roztok pro peritoneální dialýzu okamžitě použit (nesmí se uchovávat). 14/15
15 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Fresenius Medical Care Deutschland GmbH Bad Homburg v.d.h Německo 8. REGISTRAČNÍ ČÍSLA 1,5% 1,25 : 87/261/03-C 2,3% 1,25 : 87/263/03-C 4,25% 1,25 : 87/262/03-C 1,5% 1,75 : 87/297/02-C 2,3% 1,75 : 87/299/02-C 4,25% 1,75 : 87/298/02-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE 1,5% 1,25 : / ,3% 1,25 : / ,25% 1,25 : / ,5% 1,75 : / ,3% 1,75 : / ,25% 1,75 : / DATUM REVIZE TEXTU /15
- Léčivé látky jsou, natrii chloridum, natrii hydrogenocarbonas, calcii chloridum dihydricum, magnesii chloridum hexahydricum a glucosum
 Příbalová informace bicanova 1.5% Glucose Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat
Příbalová informace bicanova 1.5% Glucose Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat
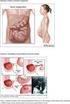
CAPD/DPCA 18 roztok pro peritoneální dialýzu
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAPD/DPCA 18 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAPD/DPCA 18 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls115314/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU bicavera 2,3 % glucose, 1,75 mmol/l calcium Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ bicavera 2,3 % glucose,
sp.zn.sukls115314/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU bicavera 2,3 % glucose, 1,75 mmol/l calcium Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ bicavera 2,3 % glucose,
Držitel rozhodnutí o registraci: Fresenius Medical Care Deutschland GmbH, D Bad Homburg, Německo
 příbalová informace platná pro kód SÚKLu 0021582 sp.zn. sukls213129/2014 Příbalová informace Informace pro použití čtěte pozorně! Držitel rozhodnutí o registraci: Fresenius Medical Care Deutschland GmbH,
příbalová informace platná pro kód SÚKLu 0021582 sp.zn. sukls213129/2014 Příbalová informace Informace pro použití čtěte pozorně! Držitel rozhodnutí o registraci: Fresenius Medical Care Deutschland GmbH,
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE PŘÍPRAVEK BICAVERA POUŽÍVAT
 PŘÍBALOVÁ INFORMACE: Informace pro uživatele bicavera 1,5 % glukosy roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE: Informace pro uživatele bicavera 1,5 % glukosy roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls40079/2007. Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls40079/2007 1. Název přípravku bicanova 2.3 % Glucose roztok pro peritoneální dialýzu 2. Kvalitativní a kvantitativní složení Souhrn údajů
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls40079/2007 1. Název přípravku bicanova 2.3 % Glucose roztok pro peritoneální dialýzu 2. Kvalitativní a kvantitativní složení Souhrn údajů
balance 1,5 % glucose, 1,75 mmol/l calcium, roztok pro peritoneální dialýzu
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 1,5 % glucose, 1,75 mmol/l calcium, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 1,5 % glucose, 1,75 mmol/l calcium, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
2. Čemu musíte věnovat pozornost, než začnete přípravek bicavera používat
 sp.zn. sukls115314/2014 Příbalová informace: Informace pro uživatele bicavera 1,5 % glucose, 1,75 mmol/l calcium Roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls115314/2014 Příbalová informace: Informace pro uživatele bicavera 1,5 % glucose, 1,75 mmol/l calcium Roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls66698/2012
 sp.zn. sukls66698/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CAPD/DPCA 17 Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml obsahuje: Calcii chloridum dihydricum 0,1838
sp.zn. sukls66698/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CAPD/DPCA 17 Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml obsahuje: Calcii chloridum dihydricum 0,1838
Držitel rozhodnutí o registraci: Fresenius Medical Care Deutschland GmbH, Bad Homburg, Německo. 356 mosmol/l. 83,2 mmol/l.
 Příbalová informace Informace pro použití Čtěte prosím pozorně následující instrukce obsahující důležité informace pro použití tohoto zdravotnického výrobku. Pokud máte další otázky, obraťte se prosím
Příbalová informace Informace pro použití Čtěte prosím pozorně následující instrukce obsahující důležité informace pro použití tohoto zdravotnického výrobku. Pokud máte další otázky, obraťte se prosím
sp.zn. sukls66698/2012
 sp.zn. sukls66698/2012 Příbalová informace: informace pro uživatele CAPD/DPCA 17 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn. sukls66698/2012 Příbalová informace: informace pro uživatele CAPD/DPCA 17 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
PŘÍBALOVÁ INFORMACE: Informace pro uživatele. bicanova 2,3% Glucose, roztok pro peritoneální dialýzu
 PŘÍBALOVÁ INFORMACE: Informace pro uživatele bicanova 2,3% Glucose, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE: Informace pro uživatele bicanova 2,3% Glucose, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
CAPD/DPCA 17 roztok pro peritoneální dialýzu
 sp.zn. sukls244549/2015 Příbalová informace: Informace pro pacienta CAPD/DPCA 17 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn. sukls244549/2015 Příbalová informace: Informace pro pacienta CAPD/DPCA 17 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls238876/2009, sukls238879/2009, sukls238883/2009 1. NÁZEV PŘÍPRAVKU CAPD/DPCA 2 CAPD/DPCA 3 CAPD/DPCA 4 roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls238876/2009, sukls238879/2009, sukls238883/2009 1. NÁZEV PŘÍPRAVKU CAPD/DPCA 2 CAPD/DPCA 3 CAPD/DPCA 4 roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příbalová informace: informace pro uživatele. CAPD/DPCA 4 roztok pro peritoneální dialýzu
 sp.zn. sukls238883/2009 Příbalová informace: informace pro uživatele CAPD/DPCA 4 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn. sukls238883/2009 Příbalová informace: informace pro uživatele CAPD/DPCA 4 roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Malá komora Roztok elektrolytů
 Sp.zn.sukls122209/2014 a sp.zn.sukls210400/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duosol bez kalia roztok pro hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Malá komora Roztok elektrolytů
Sp.zn.sukls122209/2014 a sp.zn.sukls210400/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duosol bez kalia roztok pro hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Malá komora Roztok elektrolytů
multibic 4 mmol/l draslíku roztok pro hemofiltraci
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE multibic 4 mmol/l draslíku roztok pro hemofiltraci - Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE multibic 4 mmol/l draslíku roztok pro hemofiltraci - Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls42312/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls42312/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU bez 2 mmol/l 3 mmol/l 4 mmol/l Roztok pro hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls42312/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU bez 2 mmol/l 3 mmol/l 4 mmol/l Roztok pro hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
ĹHÁj 1. NÁZEV PŘÍPRAVKU. .J1JNiUSV Pi<D 10 TCL Llčp (
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. suklss7lo/009 - a příloha k sp. Zfl. sukls93l 1/008 SOUHRN ÚDAJŮ O PŘÍPRAVKU.J1JNiUSV Pi
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. suklss7lo/009 - a příloha k sp. Zfl. sukls93l 1/008 SOUHRN ÚDAJŮ O PŘÍPRAVKU.J1JNiUSV Pi
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls147563/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Accusol 35 Roztok pro hemofiltraci, hemodialýzu a hemodiafitraci. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls147563/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Accusol 35 Roztok pro hemofiltraci, hemodialýzu a hemodiafitraci. 2. KVALITATIVNÍ A KVANTITATIVNÍ
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE BALANCE UŽÍVAT
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 2,3 % glucose, 1,75 mmol/l calcium, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 2,3 % glucose, 1,75 mmol/l calcium, roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta. Duosol s 2 mmol/l kalia roztok pro hemofiltraci
 Sp.zn.sukls122209/2014 a sp.zn.sukls210400/2014 Příbalová informace: informace pro pacienta Duosol s 2 mmol/l kalia roztok pro hemofiltraci Přečtěte si pozorně celou příbalovou informaci dříve, než Vám
Sp.zn.sukls122209/2014 a sp.zn.sukls210400/2014 Příbalová informace: informace pro pacienta Duosol s 2 mmol/l kalia roztok pro hemofiltraci Přečtěte si pozorně celou příbalovou informaci dříve, než Vám
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE BALANCE UŽÍVAT
 sp. zn. sukls138033/2013 PIL pro vel. balení 4 x 2500 ml stay safe, kód SÚKLu 15045: PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 2,3 % glucose, 1,25 mmol/l calcium, roztok pro peritoneální dialýzu
sp. zn. sukls138033/2013 PIL pro vel. balení 4 x 2500 ml stay safe, kód SÚKLu 15045: PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE balance 2,3 % glucose, 1,25 mmol/l calcium, roztok pro peritoneální dialýzu
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT
 Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
Příloha č. 2a k rozhodnutí o změně registrace sp. zn. sukls58787/2011 Souhrn údajů o přípravku PHOXILIUM 1,2 MMOL/L FOSFÁT 1. Název přípravku PHOXILIUM 1,2 mmol/l fosfát Roztok pro hemodialýzu/hemofiltraci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls7559/2015 1. NÁZEV PŘÍPRAVKU Hemosol B0 roztok pro hemodialýzu/hemofiltraci SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ S LOŽENÍ Přípravek Hemosol B0 je balený ve dvoukomorovém
sp.zn. sukls7559/2015 1. NÁZEV PŘÍPRAVKU Hemosol B0 roztok pro hemodialýzu/hemofiltraci SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ S LOŽENÍ Přípravek Hemosol B0 je balený ve dvoukomorovém
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007. Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok Souhrn údajů o přípravku 2.SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.: sukls40076/2007 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok Souhrn údajů o přípravku 2.SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls128356/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Biphozyl Roztok pro hemodialýzu/hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek Biphozyl se dodává ve dvoukomorovém vaku.
Sp.zn.sukls128356/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Biphozyl Roztok pro hemodialýzu/hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek Biphozyl se dodává ve dvoukomorovém vaku.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls182457/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku Ringerfundin B. Braun obsahuje:
sp.zn.sukls182457/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku Ringerfundin B. Braun obsahuje:
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ glucosum Ph.Eur. 1,36 % w/v nebo glucosum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ glucosum Ph.Eur. 1,36 % w/v nebo glucosum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 CLEAR-FLEX Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v mg/l Směs aminokyselin alaninum 951 argininum 1071
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 CLEAR-FLEX Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v mg/l Směs aminokyselin alaninum 951 argininum 1071
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden litr roztoku pro peritoneální dialýzu obsahuje:
1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden litr roztoku pro peritoneální dialýzu obsahuje:
sp.zn. sukls199052/2012
 sp.zn. sukls199052/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ringerův roztok Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: natrii chloridum kalii
sp.zn. sukls199052/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ringerův roztok Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: natrii chloridum kalii
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 l obsahuje : tyrosinum 300 mg/l tryptophanum 270
1. NÁZEV PŘÍPRAVKU NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 l obsahuje : tyrosinum 300 mg/l tryptophanum 270
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 k opravě rozhodnutí o prodloužení registrace sp. zn. sukls125313/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 1 k opravě rozhodnutí o prodloužení registrace sp. zn. sukls125313/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
2. Čemu musíte věnovat pozornost, než začnete přípravek PHYSIONEAL 40 používat. Při prvním použití přípravku musíte být pod dozorem Vašeho lékaře.
 sp.zn. sukls162155/2014 Příbalová informace: informace pro uživatele PHYSIONEAL 40 Glucose 1,36 % w/v/13,6 mg/ml, roztok pro peritoneální dialýzu PHYSIONEAL 40 Glucose 2,27 % w/v/22,7 mg/ml, roztok pro
sp.zn. sukls162155/2014 Příbalová informace: informace pro uživatele PHYSIONEAL 40 Glucose 1,36 % w/v/13,6 mg/ml, roztok pro peritoneální dialýzu PHYSIONEAL 40 Glucose 2,27 % w/v/22,7 mg/ml, roztok pro
Reaquon prášek pro přípravu perorálního roztoku
 Příloha č. 3 k rozhodnutí o nové registraci sp.zn.sukls239371/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Reaquon prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
Příloha č. 3 k rozhodnutí o nové registraci sp.zn.sukls239371/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Reaquon prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
sp.zn. sukls270988/2012
 sp.zn. sukls270988/2012 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml obsahuje: Léčivé látky: Natrii chloridum
sp.zn. sukls270988/2012 1. NÁZEV PŘÍPRAVKU Hartmann s solution BP Fresenius Infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml obsahuje: Léčivé látky: Natrii chloridum
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Resical prášek pro přípravu perorální nebo rektální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ prášku obsahuje: 1 g prášku obsahuje: Calcii polystyrensulfonas
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Resical prášek pro přípravu perorální nebo rektální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ prášku obsahuje: 1 g prášku obsahuje: Calcii polystyrensulfonas
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Příbalová informace: Informace pro pacienta. Glukóza 10 Braun infuzní roztok. Glucosum monohydricum
 sp.zn. sukls93177/2014 Příbalová informace: Informace pro pacienta Glukóza 10 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně tuto příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn. sukls93177/2014 Příbalová informace: Informace pro pacienta Glukóza 10 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně tuto příbalovou informaci dříve, než Vám tento přípravek bude
Příbalová informace: Informace pro uživatele. PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 38,6 MG/ML, roztok pro peritoneální dialýzu
 Příbalová informace: Informace pro uživatele PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 13,6 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 22,7 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL
Příbalová informace: Informace pro uživatele PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 13,6 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 22,7 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXTRANEAL Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Sterilní roztok pro peritoneální dialýzu obsahující icodextrinum v koncentraci
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXTRANEAL Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Sterilní roztok pro peritoneální dialýzu obsahující icodextrinum v koncentraci
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
Edukační materiál. Accusol 35 Accusol 35 Potassium 2 mmol / l Accusol 35 Potassium 4 mmol / l
 Edukační materiál Accusol 35 Accusol 35 Potassium 2 mmol / l Accusol 35 Potassium 4 mmol / l Distributor NIKKISO* Substituční roztok pro terapie kontinuální náhrady funkce ledvin (CRRT) - Školící příručka
Edukační materiál Accusol 35 Accusol 35 Potassium 2 mmol / l Accusol 35 Potassium 4 mmol / l Distributor NIKKISO* Substituční roztok pro terapie kontinuální náhrady funkce ledvin (CRRT) - Školící příručka
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol EL 1/3 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol EL 2/3 infuzní roztok Ardeaelytosol EL 1/3 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ardeaelytosol EL 2/3 EL
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol EL 2/3 infuzní roztok Ardeaelytosol EL 1/3 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ardeaelytosol EL 2/3 EL
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Biphozyl roztok pro hemodialýzu/hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek Biphozyl se dodává ve dvoukomorovém vaku. Konečný rekonstituovaný
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Biphozyl roztok pro hemodialýzu/hemofiltraci 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek Biphozyl se dodává ve dvoukomorovém vaku. Konečný rekonstituovaný
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp. zn. sukls159044/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 ke sdělení sp. zn. sukls159044/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ
Souhrn údajů o přípravku. 100 ml roztoku obsahuje: glucosum monohydricum 5,5 g ekv.glucosum anhydricum 5,0 g voda na injekci q.s. ad 100 ml ph 3,5 6,5
 Příloha č. 3 ke sdělení sp.zn. sukls24458/2011 a sukls24200/2011 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 5% Glucose in Water for Injection Fresenius 10% Glucose in Water for Injection Fresenius
Příloha č. 3 ke sdělení sp.zn. sukls24458/2011 a sukls24200/2011 Souhrn údajů o přípravku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 5% Glucose in Water for Injection Fresenius 10% Glucose in Water for Injection Fresenius
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Lipoplus 20% infuzní emulze 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml emulze obsahuje:
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Lipoplus 20% infuzní emulze 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml emulze obsahuje:
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU. Tříkomorový vak ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. OLIMEL N7E Infuzní emulze 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Tříkomorový vak 1 000 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU OLIMEL N7E Infuzní emulze 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 000 ml 35% roztok glukózy 400 ml 11,1% roztok aminokyselin
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Tříkomorový vak 1 000 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU OLIMEL N7E Infuzní emulze 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 000 ml 35% roztok glukózy 400 ml 11,1% roztok aminokyselin
Jedna 10 ml ampulka obsahuje glucosi dinatrii 1-phosphas tetrahydricus 3,762 g.
 sp.zn. sukls52850/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glucose-1-phosphat Fresenius 1 molar koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna 10 ml ampulka obsahuje
sp.zn. sukls52850/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glucose-1-phosphat Fresenius 1 molar koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna 10 ml ampulka obsahuje
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls142216/2011 a příloha ke sp.zn. sukls142336/2011 a sukls142334/2011
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls142216/2011 a příloha ke sp.zn. sukls142336/2011 a sukls142334/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls142216/2011 a příloha ke sp.zn. sukls142336/2011 a sukls142334/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ
Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012
 Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeanutrisol G 5 Ardeanutrisol G 10 Ardeanutrisol G 20 Ardeanutrisol
Příloha č. 1 ke sdělení sp.zn. sukls15871/2012, sukls15908/2012, sukls15852/2012 a sukls15817/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeanutrisol G 5 Ardeanutrisol G 10 Ardeanutrisol G 20 Ardeanutrisol
Příbalová informace: Informace pro uživatele. PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 38,6 MG/ML, roztok pro peritoneální dialýzu
 Příbalová informace: Informace pro uživatele PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 13,6 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 22,7 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL
Příbalová informace: Informace pro uživatele PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 13,6 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 22,7 MG/ML, roztok pro peritoneální dialýzu PHYSIONEAL
Příbalová informace: Informace pro uživatele. Hemosol B0 roztok pro hemodialýzu/hemofiltraci
 sp.zn. sukls7559/2014 Příbalová informace: Informace pro uživatele Hemosol B0 roztok pro hemodialýzu/hemofiltraci Natrii chloridum, calcii chloridum dihydricum, magnesii chloridum hexahydricum, acidum
sp.zn. sukls7559/2014 Příbalová informace: Informace pro uživatele Hemosol B0 roztok pro hemodialýzu/hemofiltraci Natrii chloridum, calcii chloridum dihydricum, magnesii chloridum hexahydricum, acidum
PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 22,7 MG/ML Roztok pro peritoneální dialýzu.
 Sp.zn.sukls59876/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 22,7 MG/ML Roztok pro peritoneální dialýzu. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000
Sp.zn.sukls59876/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 22,7 MG/ML Roztok pro peritoneální dialýzu. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol F 1/1 9 g/l infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol F 1/1 9 g/l infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: Natrii chloridum
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol F 1/1 9 g/l infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: Natrii chloridum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum)
 sp.zn. sukls166874/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum) Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls166874/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Biphozyl roztok pro hemodialýzu/hemofiltraci magnesii chloridum hexahydricum, natrii chloridum, natrii hydrogenocarbonas, kalii chloridum, natrii hydrogenophosphas
Příbalová informace: informace pro uživatele Biphozyl roztok pro hemodialýzu/hemofiltraci magnesii chloridum hexahydricum, natrii chloridum, natrii hydrogenocarbonas, kalii chloridum, natrii hydrogenophosphas
Příbalová informace: Informace pro uživatele. NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu
 Příbalová informace: Informace pro uživatele NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: Informace pro uživatele NUTRINEAL PD4 WITH 1,1% AMINOACIDS Roztok pro peritoneální dialýzu Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls49271/2012 a sp.zn. sukls255463/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Glukóza 40 Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku
sp.zn. sukls49271/2012 a sp.zn. sukls255463/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Glukóza 40 Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku
Příbalová informace: informace pro uživatele
 Sp.zn.sukls271968/2016 Příbalová informace: informace pro uživatele Biphozyl roztok pro hemodialýzu/hemofiltraci magnesii chloridum hexahydricum, natrii chloridum, natrii hydrogenocarbonas, kalii chloridum,
Sp.zn.sukls271968/2016 Příbalová informace: informace pro uživatele Biphozyl roztok pro hemodialýzu/hemofiltraci magnesii chloridum hexahydricum, natrii chloridum, natrii hydrogenocarbonas, kalii chloridum,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Dianeal PD4 Glucose 2,27 % w/v / 22,7 mg/ml Dianeal PD4 Glucose 3,86 % w/v / 38,6 mg/ml Roztok pro peritoneální
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dianeal PD4 Glucose 1,36 % w/v / 13,6 mg/ml Dianeal PD4 Glucose 2,27 % w/v / 22,7 mg/ml Dianeal PD4 Glucose 3,86 % w/v / 38,6 mg/ml Roztok pro peritoneální
Příbalová informace: informace pro uživatele. Chlorid sodný 0,9% Braun infuzní roztok Natrii chloridum
 sp.zn. sukls212686/2012 Příbalová informace: informace pro uživatele Chlorid sodný 0,9% Braun infuzní roztok Natrii chloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls212686/2012 Příbalová informace: informace pro uživatele Chlorid sodný 0,9% Braun infuzní roztok Natrii chloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls143336/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal Hepa - 10% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: isoleucinum 8,80 g leucinum
sp.zn. sukls143336/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal Hepa - 10% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: isoleucinum 8,80 g leucinum
(nebo 0,17 g calcii chloridum dihydricum) 25,00 g 33,33 g
 sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol R 1/2 infuzní roztok Ardeaelytosol R 1/3 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ardeaelytosol R 1/2 R 1/3
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol R 1/2 infuzní roztok Ardeaelytosol R 1/3 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ardeaelytosol R 1/2 R 1/3
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Hemosol B0 roztok pro hemodialýzu/hemofiltraci Natrii chloridum, calcii chloridum dihydricum, magnesii chloridum hexahydricum, acidum lacticum, natrii hydrogenocarbonas.
Příbalová informace: informace pro uživatele Hemosol B0 roztok pro hemodialýzu/hemofiltraci Natrii chloridum, calcii chloridum dihydricum, magnesii chloridum hexahydricum, acidum lacticum, natrii hydrogenocarbonas.
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls143647/2008
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls143647/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hartmannův roztok Braun BP, infuzní roztok Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls143647/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Hartmannův roztok Braun BP, infuzní roztok Přečtěte si pozorně celou příbalovou
natrii lactatis S solutio
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 Glucose 1,36% w/v/13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000 ml elektrolytového roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 Glucose 1,36% w/v/13,6 mg/ml Roztok pro peritoneální dialýzu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000 ml elektrolytového roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls126426/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5 Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 50 mg glucosum jako glucosum monohydricum 1000 ml
sp.zn.sukls126426/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5 Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 50 mg glucosum jako glucosum monohydricum 1000 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls181040/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal B. Braun 10% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Infuzní roztok obsahuje Aminokyseliny: na 1 ml na 250
sp. zn. sukls181040/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal B. Braun 10% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Infuzní roztok obsahuje Aminokyseliny: na 1 ml na 250
PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 38,6 MG/ML Roztok pro peritoneální dialýzu.
 Sp.zn.sukls88971/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 38,6 MG/ML Roztok pro peritoneální dialýzu. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000
Sp.zn.sukls88971/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 40 CLEAR-FLEX GLUCOSE 38,6 MG/ML Roztok pro peritoneální dialýzu. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Před smísením 1000
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls203655/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal - 15% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: isoleucinum leucinum lysinum monohydricum
sp.zn. sukls203655/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminoplasmal - 15% infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku obsahuje: isoleucinum leucinum lysinum monohydricum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.: sukls8213/2006 PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.: sukls8213/200 PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CLINIMIX N17G35E, infuzní roztok Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.: sukls8213/200 PŘÍBALOVÁ INFORMACE PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CLINIMIX N17G35E, infuzní roztok Přečtěte si pozorně celou příbalovou
SOUHRN ÚDAJU O PŘÍPRAVKU
 sp.zn.sukls132607/2015 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GELOPLASMA infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ GELATINA SUCCINATA* odpovídá gelatina NATRII CHLORIDUM MAGNESII CHLORIDUM
sp.zn.sukls132607/2015 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GELOPLASMA infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ GELATINA SUCCINATA* odpovídá gelatina NATRII CHLORIDUM MAGNESII CHLORIDUM
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 200 mg (= 82,0 mg alaninum; 134,6 mg glutaminum)
 sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol D 1/1 infuzní roztok
 sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol D 1/1 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: Natrii chloridum 4,00 g
sp.zn. sukls62825/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ardeaelytosol D 1/1 infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml infuzního roztoku obsahuje: Natrii chloridum 4,00 g
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5% Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glucosum (ve formě glucosum monohydricum): 50,0 g/l Jeden ml roztoku obsahuje 50 mg glukózy (ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5% Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glucosum (ve formě glucosum monohydricum): 50,0 g/l Jeden ml roztoku obsahuje 50 mg glukózy (ve formě
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
1. Glucosum 13%: Glucosum (monohydricum) 85 g,
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Vak a karton (Excel) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU SmofKabiven Peripheral infuzní emulze 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Tříkomorový vak (1206 ml) obsahuje:
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Vak a karton (Excel) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU SmofKabiven Peripheral infuzní emulze 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Tříkomorový vak (1206 ml) obsahuje:
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1,12 g. 9,29 g. 4,48 g. 13,6 mg/ml 22,7 mg/ml 38,6 mg/ml. 25,0 g 22,7 g. 5,67 g 0,257 g 0,051 g. 2,10 g
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 13,6 MG/ML PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 22,7 MG/ML PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 38,6 MG/ML Roztok pro peritoneální dialýzu.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 13,6 MG/ML PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 22,7 MG/ML PHYSIONEAL 35 CLEAR-FLEX GLUCOSE 38,6 MG/ML Roztok pro peritoneální dialýzu.
