Edukační materiály. Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Návod pro zdravotnické pracovníky (ZP)
|
|
|
- Ladislava Kubíčková
- před 7 lety
- Počet zobrazení:
Transkript
1 Edukační materiály Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Návod pro zdravotnické pracovníky (ZP) Při předepisování přípravku Kineret u kryopyrin-asociovaných periodických syndromů (CAPS) sdělte pacientovi/pečovateli informace uvedené v tomto návodu. Jsou nutné pro správné dávkování a aplikaci přípravku injekční stříkačkou se stupnicí. Poskytováno v rámci služeb pro zdravotnictví Zkrácenou informaci o přípravku najdete na zadní straně
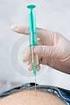
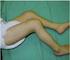
2 Tyčka pístu Jehla Co bude uživatel Kineretu potřebovat: 1. Proškolení v aplikaci podkožních (s.c.) injekcí způsobilým zdravotnickým pracovníkem Přestože pacienti i pečovatelé mohou získat potřebnou jistotu v domácí aplikaci injekcí, na začátku mohou mít obavy. Při zahájení používání musí být uživatel dostatečně proškolen ve správné aplikaci přípravku s.c. injekcí. Je důležité sdělit pacientovi/pečovateli, že injekce přípravku mohou někdy způsobit kožní reakci (viz strana 7). 2. Příručku pro pacienty/pečovatele (schválený edukační materiál) K zajištění správného používání léčivého přípravku Kineret vydala společnost Sobi pro pacienty/pečovatele aplikující přípravek souhrnnou příručku. Tato příručka, požadovaná a schválená dozorujícími orgány, musí být pacientovi/pečovateli předána při zahájení používání přípravku. Otočte stříkačku tak, aby jehla směřovala dolů. Položte sterilní gázu nebo tampón na rovnou plochu. Držte nad ním jehlu tak, aby směřovala ke gáze nebo tampónu, jak je vidět na obrázku. Položte palec na píst a jemně tlačte, dokud přední konec pístu nedosáhne na stupnici značky požadované dávky. Jak je vidět na obrázku, nadbytečná kapalina se vsákne do gázy nebo hadříku. Nyní je k injekci připravena správná dávka. Ujistěte se, že se jehla nedotýká gázy nebo hadříku. Pokud se Vám nepodařilo nastavit správnou dávku, nebo Vám stříkačka upadla, zlikvidujte ji a vezměte si novou. Použijte další stříkačku z krabičky, ale pamatujte, že si budete muset nechat předepsat další injekce Kineret dříve Aplikace injekce Jak budete postupovat při vpichu injekce? Dezinfikujte kůži alkoholovým ubrouskem a nechte ji uschnout přirozeně na vzduchu (trvá to jen několik sekund). Pak uchopte kůži mezi palec a ukazovák, vytvořte kožní řasu, kůži silně neštípejte. Proveďte vpich jehlou do kůže tak, jak vám to ukázala sestra nebo lékař. Tekutinu vstřikujte pomalu a rovnoměrně; záhyb kůže stále držte. Po dokončení injekce vytáhněte jehlu z kůže a kožní řasu uvolněte. K místu vpichu můžete přiložit tampónek z bavlny nebo buničité vaty. Edukační materiály Jednu injekční stříkačku můžete použít pouze k jedné injekci. Nepoužívejte stříkačku opakovaně, může to způsobit infekci. Veškeré nepoužité léčivo se musí zlikvidovat v souladu s bezpečnostními doporučeními. Co dělat s použitými jehlami a dalšími věcmi? Nevracejte kryt na jehlu stříkačky. Použité injekční stříkačky uchovávejte mimo dosah a dohled dětí. Nikdy nevyhazujte použité předplněné injekční stříkačky do běžného domácího koše na odpadky. Po aplikaci injekce zlikvidujte vlhkou gázu nebo hadřík se svou stříkačkou a očistěte povrch čistým hadříkem. Použitá předplněná stříkačka a veškerá gáza nebo hadřík s roztokem Kineretu se musí zlikvidovat v souladu s místními předpisy. Použijte místa určená k odkládání nebezpečných složek komunálního odpadu v místě Vašeho bydliště. Pokud již nepoužité léčivo nepotřebujete, vraťte přípravek do lékárny - pomáháte chránit životní prostředí. Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Příručka pro pacienty/pečovatele Poskytováno v rámci služeb pro zdravotnictví Co by měli pacienti a pečovatelé vědět o přípravku Kineret Po diskusi o přípravku Kineret a souhlasu pacienta/pečovatele s jeho používáním proberte následující praktické informace. Jak a kam podávat s.c. injekce Pacient/pečovatel bude potřebovat pokyny k aplikaci podkožní injekce. Kam aplikovat injekci Kineretu Nejvhodnějšími místy k aplikaci jsou: u břicho (kromě oblasti v okolí pupku) u horní část stehen (zvláště vhodné pro děti do jednoho roku věku, pokud mají faldíky ) u horní vnější oblast hýždí* a u vnější oblast paží*. * Vhodné jen tehdy, pokud podává injekci pečovatel Dospělý Dítě 3. Pokyny k použití stříkačky se stupnicí Pro zajištění podání správné dávky je nutné pacienta důkladně poučit o správném použití stříkačky se stupnicí (viz strana 5). Chránič jehly (kryt) Jehla Komora stříkačky Tyčka pístu Zepředu Zezadu Zepředu Zezadu Pacientovi/pečovateli je nutné poradit střídat při každé aplikaci místa vpichu, aby se oblast nestala bolestivá. Nepodávejte injekci do kůže, která je citlivá, zarudlá, zhmožděná nebo tvrdá Vyhněte se jizvám a striím Nepodávejte injekci přímo do žil 2 3
3 Ujistěte se, že je předepsána a podávána správná dávka Zajištění podání vhodné dávky Dávka přípravku Kineret se vypočítá a upraví dle doporučení uvedených v Souhrnu údajů o přípravku. Je důležité, aby pacient nebo pečovatel plně porozuměli dávkování v miligramech a stupnici na stříkačce. Pro více informací o podání příslušné dávky viz strana 5. Kineret CAPS - počáteční dávka 1-2 mg/kg/den Kineret CAPS - udržovací dávka FCAS/ mírná forma často není nutné zvýšit dávku závažná forma 3-4 mg/kg/den až 8 mg/kg/den Kineret se dodává v předplněné injekční stříkačce se stupnicí připravené k přímému použití. Stupnice na boku stříkačky udává dávku v miligramech. Stříkačka se stupnicí se používá k zajištění přesného dávkování pro pacienty s CAPS. Předplněná stříkačka se stupnicí umožňuje dávkování v rozmezí 20 až 100 mg. Protože je minimální dávka 20 mg, není Kineret schválen pro použití u pediatrických pacientů s tělesnou hmotností menší než 10 kg. Počáteční dávka: Doporučená počáteční dávka pro všechny subtypy CAPS je 1-2 mg/kg/den aplikovaná s.c. injekcí. Udržovací dávka u mírných forem CAPS (FCAS, mírný MWS): Pacienti jsou obvykle dobře stabilizovaní při užívání doporučené počáteční dávky (1-2 mg/ kg/den). Udržovací dávka u závažné formy CAPS (MWS a NOMID/CINCA): V závislosti na terapeutické odpovědi může být v průběhu 1-2 měsíců nezbytné navýšení dávky. Obvyklá udržovací dávka u těžkých CAPS je 3-4 mg/kg/den a může být upravena až na maximální dávku 8 mg/kg/den. Kromě hodnocení klinických symptomů a zánětlivých markerů u těžkých forem CAPS se doporučuje po počátečních 3 měsících léčby a poté každých 6 měsíců, dokud není stanovena účinná léčebná dávka, důsledná kontrola možných zánětů CNS, včetně kontroly vnitřního ucha (MRI nebo CT, lumbální punkce a audiologie) a očí (oftalmologické vyšetření). Poté co jsou pacienti dobře klinicky stabilizováni, lze provádět neurologická a oftalmologická vyšetření ročně. Podrobnosti o dávkování a následném sledování, včetně detailů pro různé populace pacientů, viz Souhrn údajů o přípravku (SPC). Při podávaní dávky menší než 100 mg je nevyhnutné část přípravku odstříknout a zlikvidovat. Pokyny pro pacienta, jak to provést, jsou v Příručce pro pacienty/pečovatele. Dávku, která bude aplikována, vypočítáte nejprve na základě pacientovy hmotnosti, později ji upravíte podle terapeutické odpovědi. Dávku je třeba také upravit na nejbližší možný objem, který lze podat jednou nebo více injekčními stříkačkami se stupnicí. Pomocí injekce lze podat pouze mg přípravku v krocích po 10 mg, proto je důležité předepsat dávku, která takové dávkování umožní. Příklad výpočtu dávky: Jindřich trpí závažnou formou Muckle-Wellsova syndromu a potřebuje dávku 4-5 mg/kg/ den. Jindřich váží 45 kg. Denní dávka = 45 kg x 4-5 mg/kg/den = mg/den. Nejpraktičtější je předepsat 200 mg za den, podávaných denně přibližně ve stejnou dobu. Lucii byl nedávno diagnostikován syndrom NOMID/CINCA a přestala reagovat na svou počáteční dávku 1-2 mg/kg/den. Nyní potřebuje dávku zvýšit na 2-3 mg/kg/den. Lucie váží 12 kg. Denní dávka = 12 kg x 2-3 mg/kg/den = mg/den. Můžete předepsat dávku 30 mg jednou denně přibližně ve stejnou denní dobu (nejlépe ráno, pro dosažení co nejvyšší koncentrace v průběhu dne). 4 5
4 Bezpečnostní upozornění Při léčbě přípravkem Kineret se mohou objevit nežádoucí účinky. Nejzávažnější časté nežádoucí účinky jsou: u Závažné infekce u Neutropenie Infekce Léčbu přípravkem Kineret není doporučeno zahajovat u pacientů s probíhající infekcí. Při přerušení léčby existuje u pacientů s CAPS riziko exacerbace nemoci. Při rozhodování o přerušení léčby během závažné infekce je třeba tuto skutečnost vzít do úvahy. Neutropenie Léčba přípravkem Kineret nesmí být zahájena u pacientů s neutropenií. Protože u pacientů léčených přípravkem může dojít k neutropenii, je důležité sledovat počty neutrofilů před zahájením léčby, po zahájení léčby po dobu šesti měsíců každý měsíc a poté kvartálně. Vyvine-li se u pacienta neutropenie, přerušte léčbu a pečlivě sledujte počty neutrofilů. Nejčastějšími nežádoucími účinky jsou reakce v místě vpichu Obecné rady pro pacienty a pečovatele Vysvětlete, že aplikace přípravku může někdy způsobit kožní reakci. Reakce se obvykle objevují do 2 týdnů od počátku léčby a během 4-6 týdnů zmizí. Reakce jsou obvykle mírné až střední intenzity a projevují se jako zarudnutí, modřiny, zánět, bolest či nepříjemný pocit. Pokud se nevyskytly během prvního měsíce léčby, jsou kožní reakce nepravděpodobné. Rady, které mohou pomoci zmírnit příznaky a symptomy reakcí v místě vpichu, jsou obsaženy v Příručce pro pacienty/pečovatele. Rady pro zmírnění reakcí v místě vpichu Poraďte pacientům, aby před a po aplikaci injekce chladili místo vpichu, např. pomocí chladicích polštářků. Před aplikací injekce by měla být stříkačka vyjmuta přibližně na 30 minut z chladničky, aby se zahřála na pokojovou teplotu, nebo ji lze ohřát v ruce. Pacienti by měli být jasně poučeni, aby NEOHŘÍVALI stříkačku v horké vodě, mikrovlnné troubě nebo jakýmkoliv jiným způsobem, než je uvedeno výše. Pokud to celkový stav pacienta umožňuje, můžete k dalšímu zmírnění reakcí v místě vpichu doporučit krém nebo mast s antihistaminiky nebo hydrokortizonem. Krém s hydrokortizonem se používá nejlépe minut před injekcí, po dobu prvních 3-6 měsíců léčby. Shrnutí: pro optimální užívání přípravku Kineret pacienty a pečovateli je nutné provést následující kroky: u Proškolit ve správné technice aplikace podkožní injekce a obměně místa vpichu u Poskytnout všem pacientům a pečovatelům schválenou Příručku pro pacienty/ pečovatele u Proškolit ve správném postupu odměření dávky na stříkačce se stupnicí Pokud máte kontaktní linku na zdravotnické pracovníky, kteří mohou pacientovi poskytnout další rady při používání přípravku Kineret, předejte ji pacientovi/pečovateli. Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeny Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. Pokud se hlášení týká biologického léčiva, je třeba doplnit i přesný obchodní název a číslo šarže. Tato informace může být také hlášena společnosti Swedish Orphan Biovitrum AB. 6 7
5 ZKRÁCENÁ INFORMACE O PŘÍPRAVKU Kineret (anakinra) zkrácená informace o přípravku. Před předepsáním se prosím seznamte s úplnou informací o přípravku (SPC). Složení: Kineret 100 mg/0.67 ml (150 mg/ml) anakinrum * injekční roztok v předplněné injekční stříkačce. *Antagonista humánního receptoru pro interleukin-1 (r-methuil-1ra) produkovaný v buňkách Escherichia coli pomocí rekombinantní DNA technologie. Indikace: Kineret je indikován dospělým, dospívajícím, dětem a kojencům ve věku 8 měsíců a starším s hmotností 10 kg nebo větší k léčbě kryopyrinasociovaných periodických syndromů (CAPS). Dávkování a způsob podání: Léčbu Kineretem mají zahajovat a sledovat specializovaní lékaři se zkušenostmi v diagnostice a léčbě CAPS. Kineret se dodává připravený k okamžitému použití v předplněné injekční stříkačce se stupnicí. Počáteční dávka: Doporučená počáteční dávka pro všechny subtypy CAPS je 1-2 mg/kg/den podkožní injekcí. Udržovací dávka u mírných CAPS (FCAS, mírný MWS): Pacienti jsou obvykle dobře kontrolováni udržováním doporučené počáteční dávky (1-2 mg/kg/den). Udržovací dávka u závažných CAPS (MWS a NOMID/CINCA): Zvyšování dávek může být na základě terapeutické odpovědi během 1-2 měsíců nezbytné. Obvyklá udržovací dávka u těžkých CAPS je 3-4 mg/kg/den, a může být upravena až na maximálně 8 mg/kg/den. Hodnocení klinických symptomů a zánětlivých markerů u těžkých CAPS se doporučuje po počátečních 3 měsících léčby a poté každých 6 měsíců. Podrobné informace naleznete v úplné informaci o přípravku. Starší populace ( 65 let) Údaje o starších pacientech s CAPS jsou omezené. Nepředpokládá se, že by byla nutná úprava dávek. Pediatrická populace (< 18 let) Dávkování a způsob podání u dětí a kojenců ve věku 8 měsíců a starších s hmotností 10 kg nebo větší jsou stejné jako pro dospělé pacienty s CAPS, na základě tělesné hmotnosti. Pro děti mladší 8 měsíců nejsou k dispozici žádné údaje. Porucha funkce jater U pacientů s vážnou poruchou funkce jater by měl být Kineret používán s opatrností. Porucha funkce ledvin Pacientům s těžkou poruchou funkce ledvin (CL cr < 30 ml/min) nesmí být Kineret podáván. U pacientů s mírnou poruchou funkce ledvin (CL cr 50 až 80 ml/min) není nutná žádná úprava dávek. Pacientům se středně závažnou poruchou funkce ledvin (CL cr 30 až 50 ml/min) by měl být Kineret podáván s nezbytnou opatrností. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku nebo na proteiny pocházející z E. coli. Pacientům s vážnou poruchou funkce ledvin (CL cr < 30 ml/min) nesmí být Kineret podáván. Zvláštní upozornění a opatření pro použití: Podrobné informace naleznete v úplné informaci o přípravku. Alergické reakce, včetně anafylaktických reakcí či angioedému, byly hlášeny méně často. Ve většině případů se jednalo o makulopapulární nebo urtikariální kožní exantém.v případě výskytu těžké alergické reakce by mělo být podávání Kineretu přerušeno a měla by být zahájena odpovídající léčba. Vnitřní kryt jehly předplněné injekční stříkačky obsahuje suchou přírodní gumu (derivát latexu), která může způsobovat závažné alergické reakce. Byl hlášen ojedinělý případ indikující neinfekční hepatitidu. Jaterní příhody byly hlavně hlášeny u pacientů s predispozicí. Podávání Kineretu bylo provázeno zvýšením incidence vážných infekcí v porovnání s placebem. U pacientů s CAPS léčených Kineretem existuje riziko vzplanutí nemoci, když ukončí léčbu Kineretem. To je třeba to vzít v úvahu při rozhodování o ukončení léčby Kineretem během závažné infekce. U pacientů s neutropenií (absolutní počet neutrofilů < 1,5 x 10 9 /l) by léčba Kineretem neměla být zahajována. Počet neutrofilů se doporučuje vyšetřit před zahájením terapie pomocí Kineretu, jednou za měsíc během prvních 6 měsíců léčby a dále čtvrtletně. U pacientů, u kterých se neutropenie objeví (absolutní počet neutrofilů < 1,5 x 10 9 /l), by měla být léčba Kineretem přerušena a absolutní počet neutrofilů by měl být pečlivě sledován. Účinky léčby Kineretem na preexistující maligní nádorové onemocnění nebyly studovány. Podávání Kineretu pacientům s preexistujícím maligním nádorovým onemocněním se proto nedoporučuje. Nebyl zjištěn žádný rozdíl v protilátkové odpovědi na podání antitetanového séra mezi skupinami pacientů léčených Kineretem a placebem, kdy byla vakcína obsahující tetanový/difterický toxoid aplikována současně s Kineretem. Nejsou k dispozici žádné údaje o účinnosti očkování pacientů užívajících Kineret jinými inaktivovanými antigeny. Pacienti užívající Kineret by proto neměli být současně očkováni živou vakcínou. S léčbou starších pacientů ( 65 let) s CAPS jsou omezené zkušenosti. Vzhledem k tomu, že u starší populace je incidence infekčních onemocnění obecně vyšší, je třeba léčbu starších pacientů provádět s nezbytnou opatrností. Současná léčba Kineretem a etanerceptem je spojena se zvýšeným rizikem vážných infekcí a s rizikem neutropenie. Současné podávání Kineretu a etanerceptu nebo dalších TNF antagonistů se nedoporučuje. V klinických studiích nebyly pozorovány interakce mezi Kineretem a ostatními léčivými přípravky (včetně nesteroidních protizánětlivých, léčivých přípravků, kortikosteroidů a DMARD). Tvorba enzymů CYP450 je při chronickém zánětu potlačena zvýšenými hladinami cytokinů (např. IL-1). To by bylo klinicky relevantní pro substráty CYP450 s úzkým terapeutickým indexem (např. warfarin a fenytoin), může být relevantní zvážit terapeutické sledování účinku nebo koncentrace těchto přípravků na začátku nebo konci léčby a může být zapotřebí upravit individuální dávku léčivého přípravku. Fertilita, těhotenství a kojení: Údaje týkající se užívání látky anakinra u těhotných žen jsou omezené. Podávání Kineretu se v těhotenství a u žen v reprodukčním věku, které nepoužívají antikoncepci, nedoporučuje. Kojení má být během léčby Kineretem přerušeno. Nežádoucí účinky: Podrobné informace o četnosti a závažnosti nežádoucích účinků naleznete v úplné informaci o přípravku. Údaje o nežádoucích účincích u pacientů s CAPS jsou založeny na otevřené studii 43 pacientů s NOMID/ CINCA léčených Kineretem až 5 let. Žádný pacient z důvodu nežádoucích účinků z léčby Kineretem neodstoupil. Ani z této studie, ani z hlášení postmarketingových nežádoucích účinků neexistují žádné náznaky, že se celkový profil pacientů s CAPS liší od pacientů s RA. U 43 pacientů s CAPS sledovaných až 5 let byla frekvence závažných infekcí 0,1/rok, nejčastější byly zápal plic a gastroenteritida. U jednoho pacienta bylo užívání Kineretu dočasně přerušeno, všichni ostatní pacienti během infekcí pokračovali v jeho užívání. Infekce byly zjištěny u všech orgánových systémů a byly zaznamenány u pacientů užívajících Kineret v monoterapii i v kombinaci s imunosupresivy. Neutropenie byla hlášena u 2 pacientů. Obě epizody neutropenie byly v průběhu času vyřešeny při pokračující léčbě Kineretem. Nejčastěji a nejdůsledněji hlášeným nežádoucím účinkem spojeným s léčbou Kineretem byla reakce v místě vpichu injekce (ISR). U pacientů s CAPS neukončil ani dočasně nepřerušil léčbu Kineretem z důvodu reakce v místě vpichu žádný pacient. ISR se obvykle objeví během 2. týdne léčby a během 4-6 týdnů zmizí. Výskyt reakce po uplynutí prvního měsíce léčby u pacientů, u kterých se tato reakce neobjevila ani v minulosti, nebyl častý. Bezpečnostní profil byl u pediatrických pacientů podobný tomu v dospělých populacích. Velmi časté ( 1/10): bolesti hlavy, reakce v místě vpichu; Časté ( 1/100 až < 1/10): závažné infekce a neutropenie. Doba použitelnostia uchovávání: 3 roky, uchovávejte v chladničce (2 C 8 C). Výdej léčivého přípravku je vázán na lékařský předpis Registrační číslo: EU/1/02/203/005 1 balení, EU/1/02/203/006 7 balení, EU/1/02/203/ balení. Držitel rozhodnutí o registraci: Swedish Orphan Biovitrum AB (publ), SE Stockholm, Švédsko Další informace o přípravku získáte na adrese: Swedish Orphan Biovitrum s.r.o., Na Strži 65/1702, Praha 4, tel: , mail.cz@sobi.com. Přípravek není hrazen z prostředků veřejného zdravotního pojištění. Datum poslední revize textu: 06/2014 Kineret je ochranná známka společnosti Swedish Orphan Biovitrum AB (publ) Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Formuláře pro hlášení najdete na Swedish Orphan Biovitrum AB SE Stockholm, Švédsko Kineret je registrovaná ochranná známka společnosti Swedish Orphan Biovitrum AB (publ). 001KIN-CZ-2014 Datum přípravy:
Edukační materiály. Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Příručka pro pacienty/pečovatele
 Edukační materiály Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Příručka pro pacienty/pečovatele Poskytováno v rámci služeb pro zdravotnictví Obsah Úvod Úvod... 3 Co je Kineret?...
Edukační materiály Anakinrum, Kineret 100 mg, injekční roztok v předplněné injekční stříkačce Příručka pro pacienty/pečovatele Poskytováno v rámci služeb pro zdravotnictví Obsah Úvod Úvod... 3 Co je Kineret?...
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
Příloha III Pozměňovací návrh příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tento souhrn údajů o přípravku a příbalová informace mohou být následně dle potřeby aktualizovány
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Kineret 100 mg/0,67 ml injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Kineret 100 mg/0,67 ml injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
RÁDCE PACIENTA. Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu
 RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B?
 pozvánka na satelitní sympozium společnosti Sobi Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom Vás
pozvánka na satelitní sympozium společnosti Sobi Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom Vás
dnavou artritidou (GA)
 EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA)
 Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
NÁVOD NA PODÁNÍ INJEKCE
 NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
Příprava a podání injekce
 Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
NÁVOD NA SAMOPODÁNÍ INJEKCE
 NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
POKYNY PRO POUŽITÍ. Budete potřebovat následující položky, které jsou obsaženy v balení:
 POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Ecoporc SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
Hlášení těhotenství (formulář) RO-GNE: HLÁŠENÍ TĚHOTENSTVÍ
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Zároveň žádáme
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
INSTRUKCE PRO INTRAVENÓZNÍ A SUBKUTÁNNÍ PODÁNÍ KROK ZA KROKEM
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) pro revmatoidní artritidu INSTRUKCE PRO INTRAVENÓZNÍ A SUBKUTÁNNÍ PODÁNÍ KROK ZA KROKEM Návod určený zdravotnickým odborníkům jako pomoc s přípravou a podáním
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) pro revmatoidní artritidu INSTRUKCE PRO INTRAVENÓZNÍ A SUBKUTÁNNÍ PODÁNÍ KROK ZA KROKEM Návod určený zdravotnickým odborníkům jako pomoc s přípravou a podáním
NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU ENBREL 50 MG V PŘEDPLNĚNÉM AUTOINJEKČNÍM PERU MYCLIC
 NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU ENBREL 50 MG V PŘEDPLNĚNÉM AUTOINJEKČNÍM PERU MYCLIC Tento tištěný materiál může lékař poskytnout pouze pacientùm, kterým předepsal přípravek ENBREL 50 mg injekční
NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU ENBREL 50 MG V PŘEDPLNĚNÉM AUTOINJEKČNÍM PERU MYCLIC Tento tištěný materiál může lékař poskytnout pouze pacientùm, kterým předepsal přípravek ENBREL 50 mg injekční
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
 ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU. ENBREL 25 mg a 50 mg v PŘEDPLNĚNÝCH PERECH MYCLIC
 NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU ENBREL 25 mg a 50 mg v PŘEDPLNĚNÝCH PERECH MYCLIC Tento tištěný materiál může lékař poskytnout pouze pacientům, kterým předepsal přípravek ENBREL 25 mg nebo 50 mg
NÁVOD K SAMOSTATNÉ APLIKACI PŘÍPRAVKU ENBREL 25 mg a 50 mg v PŘEDPLNĚNÝCH PERECH MYCLIC Tento tištěný materiál může lékař poskytnout pouze pacientům, kterým předepsal přípravek ENBREL 25 mg nebo 50 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Souhrn údajů o přípravku
 sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml
 OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls173597/2012 a příloha ke sp. zn. sukls173628/2012 Příbalová informace: Informace pro pacienta Yttrium ( 90 Y) colloid suspension for local injection
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK
 PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
PNEUMOKOKOVÉ INFEKCE A MOŽNOSTI PREVENCE aneb CO MŮŽE ZPŮSOBIT PNEUMOKOK Očkování! Nejvýznamnější možnost prevence infekčních chorob! Lepší infekční chorobě předcházet než ji léčit! Významný objev v medicíně,
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Deficit antagonisty IL-1 receptoru (DIRA)
 www.printo.it/pediatric-rheumatology/cz/intro Deficit antagonisty IL-1 receptoru (DIRA) Verze č 2016 1. CO JE DIRA? 1.1 O co se jedná? Deficit antagonisty IL-1Receptoru (DIRA) je vzácné vrozené onemocnění.
www.printo.it/pediatric-rheumatology/cz/intro Deficit antagonisty IL-1 receptoru (DIRA) Verze č 2016 1. CO JE DIRA? 1.1 O co se jedná? Deficit antagonisty IL-1Receptoru (DIRA) je vzácné vrozené onemocnění.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae typus b polysaccharidum konjugovaný s tetanickým toxoidem jako bílkovinným nosičem
 sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Astma a alergie v roce 2010 a novinky pro rok 2011
 Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
Dne 30. 11. 2010 od 17:30 hodin Restaurace Větruše Fibichova 392 Ústí nad Labem Moderuje: Doc. MUDr. Vít Petrů, CSc. 17:30 Úvodní slovo Doc. MUDr. Vít Petrů, CSc. 17:45 Astma kazuistiky a novinky v léčbě
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls120097/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Program prevence početí při léčbě přípravkem Erivedge: Důležité informace o prevenci početí a antikoncepci pro pacienta užívajícího přípravek Erivedge
 Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí účinky, které se u Vás vyskytnou. Program prevence
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
