PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Zdenka Svobodová
- před 6 lety
- Počet zobrazení:
Transkript
1 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1
2 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocné látky: benzalkonium-chlorid 0,05 mg Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Oční kapky, suspenze (oční kapky) Světle žlutá až světle oranžová stejnorodá suspenze, ph 7,4 (přibližně) 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Nevanac je indikován pro: - Prevenci a léčbu pooperačních bolesti a zánětu souvisejících s operacemi katarakty - Snižování rizika pooperačního makulárního edému spojeného s operací katarakty u pacientů s diabetem. (viz bod 5.1) 4.2 Dávkování a způsob podání Použití u dospělých včetně starších pacientů Při prevenci a léčbě bolesti a zánětu je dávkou 1 kapka přípravku NEVANAC do spojivkového vaku postiženého oka (očí) třikrát denně, počínaje 1. den před operací katarakty,totéž v den operace, a s podáváním se pokračuje po dobu až 21dnů po operaci, dle pokynů lékaře. Jedna další kapka má být aplikována 30 až 120 minut před operací. Pro snižování rizika pooperačního makulárního edému spojeného s operací katarakty u diabetických pacientů je dávkou 1 kapka přípravku NEVENAC do spojivkového vaku postiženého oka (očí) třikrát denně, počínaje 1 den před operací katarakty, poté v den operace, a s podáváním se pokračuje po dobu až 60 dnů po operaci dle pokynů lékaře. Jedna další kapka má být aplikována 30 až 120 minut před operací. Pediatričtí pacienti Bezpečnost a účinnost přípravku NEVENAC u dětí nebyla stanovena. Nejsou dostupné žádné údaje. V indikacích není uvedeno relevantní použití přípravku NEVENAC u pediatrických pacientů. Použití při zhoršené funkci jater a ledvin Studie s podáváním přípravku NEVANAC nebyly u pacientů s jaterním onemocněním nebo zhoršenou funkcí ledvin prováděny. Nepafenak se vylučuje především biotransformací a systémová expozice je po topickém podání do oka velmi nízká. U těchto pacientů není úprava dávky odůvodněná. Způsob podání Pro oční podání. 2
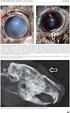
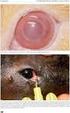
3 Instruujte pacienta, aby lahvičku před použitím dobře protřepal. Používá-li se více než jeden topický oční léčivý přípravek, musí se léčivé přípravky podávat s časovým odstupem minimálně 5 minut. Aby se zamezilo kontaminaci hrotu kapátka a roztoku, je potřeba je třeba dbát na to, aby se hrot kapátka lahvičky nedotkl očního víčka, přilehlých oblastí nebo jiných povrchů. Instruujte pacienta, aby uchovával lahvičku mezi jednotlivými aplikacemi pevně uzavřenou. 4.3 Kontraindikace Přecitlivělost na léčivou látku, některou z pomocných látek tohoto přípravku nebo na jiná nesteroidní protizánětlivá léčiva (NSAID). Jako u ostatních NSAID, je NEVANAC kontraindikován i u pacientů, u kterých kyselina acetylsalicylová nebo jiné NSAID vyvolávají astmatický záchvat, kopřivku nebo akutní rinitidu. 4.4 Zvláštní upozornění a zvláštní opatření pro použití Neaplikujte injekčně. Instruujte pacienta, aby přípravek NEVANAC nepolykal. Instruujte pacienta, aby se během léčby přípravkem NEVANAC vyhýbal slunečnímu záření. Používání topických NSAID může mít za následek keratitidu. U některých citlivých pacientů může delší používání topických NSAID vyústit v narušení epitelu, zeslabení rohovky, erozi rohovky, k vytvoření vředů na rohovce nebo perforaci rohovky. Tyto příhody mohou ohrozit zrak. Pacienti s projevy rozpadu epitelu by měli ihned používání přípravku NEVANAC přerušit a stav jejich rohovky by měl být pečlivě monitorován. Topicky podávaná NSAID mohou zpomalovat nebo prodlužovat hojení. Hojení zpomalují nebo prodlužují také topicky podávané kortikosteroidy. Současné podávání topických NSAID a topických steroidů může komplikovat proces hojení. Zkušenosti s topicky podávanými NSAID po jejich uvedení na trh naznačují, že u pacientů s komplikovanými operacemi očí, denervací rohovky, defekty epitelu rohovky, cukrovkou, onemocněními povrchu oka (např. syndromem suchého oka), revmatoidní artritidou nebo opakovanými očními operacemi během krátkého období může být zvýšené riziko nežádoucích účinků na rohovku, jež mohou ohrozit zrak. Topická NSAID se u těchto pacientů má používat s opatrností. Dlouhodobé používání topických NSAID může u pacienta zvyšovat riziko výskytu a závažnost nežádoucích účinků na rohovku. Bylo hlášeno, že oční NSAIDs mohou způsobit zvýšenou krvácivost očních tkání (včetně hyfémy) v souvislosti soperací oka. U pacientů se známým sklonem ke zvýšené krvácivosti nebo u těch, kteří dostávají ještě i jiné přípravky, jež mohou prodloužit dobu krvácení, je třeba používat přípravek NEVANAC s opatrností. Údaje o souběžném podávání analogů prostaglandinu a přípravku NEVANAC jsou k dispozici jen ve velmi omezené míře. S přihlédnutím k mechanizmu účinku není souběžné podávání těchto léčivých přípravků doporučováno. NEVANAC obsahuje benzalkonium-chlorid, který může způsobit podráždění a je známo, že měkké kontaktní čočky zbarvuje. Navíc se nošení kontaktních čoček v pooperační době po operaci katarakty nedoporučuje. Proto mají být pacienti poučeni, aby kontaktní čočky v průběhu léčby přípravkem NEVANAC nenosili. V souvislosti s používáním benzalkonium-chloridu, běžně používaného jako konzervační přísada do očních přípravků, byly hlášeny případy tečkovité keratopatie a/nebo toxické ulcerativní keratopatie. 3
4 Protože NEVANAC benzalkonium-chlorid obsahuje, je nezbytné pečlivé monitorování tam, kde dochází k častému nebo dlouhodobému používání. Používání topických protizánětlivých léčivých přípravků může maskovat akutní oční infekci. NSAID nemají antimikrobiální vlastnosti. V případě oční infekce musí být jejich použití spolu s protiinfekčními přípravky pečlivě zváženo. Zkřížená reakce přecitlivělosti Existuje možnost zkřížené reakce přecitlivělosti mezi nepafenakem a kyselinou acetylsalicylovou, deriváty kyseliny fenyloctové a dalšími NSAID. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Studie in vitro prokázaly velmi nízký potenciál pro interakce s jinými léčivými přípravky a interakce vazbou na bílkoviny (viz bod 5.2). 4.6 Fertilita, těhotenství a kojení Fertilita O účinku přípravku Nevanac na lidskou fertilitu nejsou k dispozici žádná data. Těhotenství Adekvátní údaje o podávání nepafenacu těhotným ženám nejsou k dispozici. Studie na zvířatech prokázaly reprodukční toxicitu (viz bod 5.3). Potenciální riziko pro člověka není známé. Vzhledem k tomu, že systémová expozice u žen, které nejsou těhotné, je po léčbě přípravkem NEVANAC zanedbatelná, lze riziko při podávání během těhotenství považovat za malé. Protože však inhibice syntézy prostaglandinu může mít negativní vliv na těhotenství a/nebo na vývoj embrya/plodu a/nebo na porod a/nebo na postnatální vývoj, nedoporučuje se podávání přípravku NEVANAC během těhotenství a u žen s možností otěhotnění, které neužívají antikoncepci. Kojení Není známo, zda se nepafenak vylučuje do mateřského mléka. Studie na zvířatech prokázaly vylučování nepafenaku do mléka u potkanů. Nicméně, vzhledem k tomu, že systémové hladiny nepafenaku jsou u kojících žen zanedbatelné, žádný vliv na kojence není předpokládán. NEVANAC může být během kojení používán. 4.7 Účinky na schopnost řídit a obsluhovat stroje Stejně jako u jiných očních kapek může dočasně rozmazané vidění nebo jiné poruchy vidění ovlivnit schopnost řídit nebo obsluhovat stroje. Pokud dojde po nakapání k rozmazanému vidění, musí pacient vyčkat, dokud se vidění neupraví a teprve poté může řídit nebo obsluhovat stroje. 4.8 Nežádoucí účinky Shrnutí bezpečnostního profilu V klinických studiích, jichž se účastnilo více než 800 pacientů, kteří dostávali NEVANAC, se u zhruba3 % pacientů vyskytly nežádoucí účinky. Tyto příhody vedly k přerušení léčby u 0,6% pacientů, což bylo méně, než u pacientů léčených ve stejných studiích placebem (1, 3 %). V těchto studiích nebyly v souvislosti s podáváním přípravku NEVANAC hlášeny žádné závažné nežádoucí účinky. Shrnutí nežádoucích účinků v tabulce Následující nežádoucí účinky byly vyhodnoceny jako účinky spojené s léčbou a byly roztříděny podle následujících kritérií: velmi časté ( 1/10), časté ( 1/100 až <1/10), méně časté ( 1/1000 až <1/100), vzácné ( 1/10000 až <1/1000), velmi vzácné (<1/10000) nebo není známo (z dostupných údajů nelze určit). V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Nežádoucí reakce byly získány z klinických studií nebo hlášení po uvedení přípravku na trh. 4
5 Klasifikace orgánu a systému Poruchy imunitního systému Poruchy nervového systému Poruchy oka Gastrointestinální poruchy Poruchy kůže a podkožní tkáně Vyšetření Termín preferovaným MedDRA (v.13.0) Méně časté: hypersenzitivita Méně časté: bolesti hlavy Není známo: závratě Méně časté: keratitida, iritida, efuze cévnatky, rohovková depozita, bolest oka, fotofobie, oční diskomfort, rozmazané vidění, suché oko, sekrece z oka, alergická konjunktivitida, svědění oka, pocit cizího tělesa v očích, krusty na okraji víčka, zvýšené slzení, hyperemie spojivky Není známo: narušení hojivosti (rohovka), defekt rohovkového epitelu, zkalení rohovky, jizva rohovky, snížená ostrost vidění, iritace oka, otok oka Méně časté: nauzea Méně časté: cutis laxa (dermatochalaze) Není známo: zvýšený krevní tlak Diabetičtí pacienti Omezený počet pacientů s diabetem (N = 126), v jediné studii, používal přípravek NEVANAC po dobu 60 dní nebo déle z důvodu prevence makulárního edému po operaci očního zákalu. Cca 2 % těchto pacientů zaznamenalo negativní reakce na lék, a tyto skutečnosti vedly k přerušení léčby u 0,8 % pacientů, což je stejný poměr jako při podání placeba (0,8 %). Tato studie neprokázala žádné vážné nežádoucí účinku přípravku NEVANAC. V této studii byly v souvislosti s léčbou zjištěny následující nežádoucí účinky, které byly klasifikovány podle následující úmluvy: velmi časté ( 1/10), časté ( 1/100 až <1/10), méně časté ( 1/1000 až <1/100), vzácné ( 1/10000 až <1/1000) nebo velmi vzácné (<1/10000). V rámci každé frekvenční skupiny jsou předkládány nežádoucí účinky v pořadí klesající závažnosti. Klasifikace orgánu a systému Poruchy oka Termín preferovaný MedDRA (v.13.0) Časté: keratitis punctata Méně časté: poškození epitelu rohovky Popis vybraných nežádoucích účinků Zkušenosti z klinických testů s dlouhodobým používáním přípravku NEVANAC pro prevenci makulárního edému po operaci katarakty u pacientů s diabetem jsou omezené. Nežádoucí účinky na oči u pacientů s diabetem se mohou vyskytnout ve vyšší frekvenci, než s jaká je pozorována u široké veřejnosti (viz bod 4.4). Pacienti s projevy rozpadu epitelu rohovky musí ihned používání přípravku NEVANAC přerušit a stav jejich rohovky má být pečlivě monitorován (viz bod 4.4). Ze zkušeností s přípravkem NEVANAC po jeho uvedení na trh jsou známy případy udávající poškození/poruchy epitelu rohovky. Závažnost těchto případů se různí od zanedbatelných účinků na stav epitelu rohovky až po vážnější stavy, při kterých je k navrácení jasného zraku nutný chirurgický zásah a/nebo lékařská léčba. Zkušenosti s topicky podávanými NSAID po jejich uvedení na trh naznačují, že u pacientů s komplikovanými operacemi očí, denervací rohovky, defekty epitelu rohovky, cukrovkou, onemocněními povrchu oka (např. syndromem suchého oka), revmatoidní artritidou nebo opakovanými očními operacemi během krátkého období může být zvýšené riziko nežádoucích účinků na rohovku, jež mohou ohrozit zrak. Když je nepafenak předepisován diabetickým pacientům po operaci katarakty na prevenci makulárního edému, má přítomnost dalšího rizikového faktoru vést k přehodnocení předpokládaného poměru přínosu/rizika a k zintenzivnění monitorování pacienta. Pediatričtí pacienti Bezpečnost a účinnost přípravku NEVANAC u dětí nebyla určena. 5
6 4.9 Předávkování Nejsou žádné zkušenosti s předávkováním při očním podání. Není pravděpodobné, že by podání více než jedné kapky do oka mělo za následek vznik nežádoucích účinků. Při náhodném perorálním požití neexistuje prakticky žádné riziko nežádoucích účinků. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: protizánětlivé látky, nesteroidní. ATC-kód: S01BC10 Mechanismus účinku Nepafenak je nesteroidní protizánětlivé a analgeticky působící pro léčivo. Po topickém očním podání pronikne nepafenak rohovkou a působením hydroláz očních tkání se přemění na amfenak, nesteroidní protizánětlivé léčivo. Amfenak inhibuje účinek prostaglandin H syntázy (cyklooxygenázy), enzymu nezbytného pro tvorbu prostaglandinu. Sekundární farmakologie U králíků bylo prokázáno, že nepafenak inhibuje rozpad hematoretinální bariéry současně s potlačením syntézy PGE 2. Ex vivo bylo prokázáno, že jediná topicky podaná dávka nepafenaku do oka inhibuje syntézu prostaglandinu v duhovce/řasnatém tělísku (85 % až 95 %) až po dobu 6 hodin a v sítnici/cévnatce (55 %) až po dobu 4 hodin. Farmakodynamické účinky Většina hydrolytické konverze probíhá v sítnici/cévnatce, méně v duhovce/řasnatém tělísku a pak v rohovce, což odpovídá stupni vaskularizace těchto tkání. Výsledky klinických studií naznačují, že přípravek NEVANAC oční kapky nemá žádné významné účinky na nitrooční tlak. Klinické účinky Prevence a léčba pooperační bolesti a zánětu, souvisejících s operací katarakty. Byly provedeny tři pivotní/klíčové studie k zhodnocení účinnosti a bezpečnosti přípravku NEVANAC podávaného třikrát denně v porovnání s vehikulem a/nebo s ketorolak- trometamolem při prevenci a léčbě pooperační bolesti a zánětu u pacientů po operaci katarakty. V těchto studiích se započalo s podáváním studovaného léčivého přípravku den před operací, pokračovalo se v den operace, a následně další 2-4 týdny po operaci. Dále, téměř všichni pacienti dostávali profylaktickou léčbu antibiotiky podle klinické praxe každého centra, v kterém klinická zkouška probíhala. Ve dvou dvojitě zaslepených randomizovaných, vehikulem kontrolovaných studiích vykazovali pacienti léčení přípravkem NEVANAC od časného pooperačního období až do konce léčby významně menší projevy zánětu (vodnaté buňky a zarudnutí) než pacienti léčení vehikulem. V jedné dvojitě zaslepené randomizované studii, kontrolované aktivně vehikulem, měli pacienti léčení přípravkem NEVANAC významně menší projevy zánětu než pacienti léčení vehikulem. NEVANAC kromě toho působil při potlačování zánětu a bolesti oka stejně nebo i lépe než ketorolak 5 mg/ml a jeho aplikace byla o trochu příjemnější. Významně vyšší procento pacientů ve skupině léčených přípravkem NEVANAC hlásilo, že jsou po operaci šedého zákalu bez bolesti, než kolik jich bylo ve skupině léčené vehikulem. 6
7 Snížení rizika pooperačního makulárního edému souvisejícího s operací katarakty u diabetických pacientů. Pro zhodnocení účinnosti a bezpečnosti přípravku NEVANAC k prevenci pooperačního makulárního edému spojeného s operací katarakty byly provedeny tři studie (jedna s pacienty s diabetem, dvě s pacienty bez diabetu). V těchto studiích byla studijní medikace zahájena den před operací, pokračovala v den operace, a dále pak až 90 dnů po operaci. V jedné dvojitě zaslepené randomizované studii kontrolované vehikulem, provedené s pacienty s diabetickou retinopatií, se makulární edém objevil u podstatně většího procenta pacientů léčených vehikulem (16,7 %) v porovnání s pacienty léčenými přípravkem NEVANAC (3,2 %). Větší procento pacientů léčených vehikulem zaznamenalo snížení ostrosti vidění o více než 5 písmen v období od 7. do 90. dne nebo při časném ukončení (11,5 %) ve srovnání s pacienty léčenými přípravkem Nepafenak (5,6 %). Další pacienti léčení přípravkem NEVANAC dosáhli zlepšení ostrosti vidění o 15 písmen v porovnání s pacienty léčenými vehikulem; bylo jich 56,8 % oproti 41,9 %, v uvedeném pořadí; p=0, Farmakokinetické vlastnosti Absorpce Po podávání přípravku NEVANAC, oční kapky do obou očí třikrát denně byly u většiny subjektů zaznamenány 2 nebo 3 hodiny po podání nízké, ale kvantifikovatelné koncentrace nepafenaku a amfenaku v plazmě. Po očním podání byla průměrná C max v plazmě v ustáleném stavu 0,310 ± 0,104 ng/ml pro nepafenak a 0,422 ± 0,121 ng/ml pro amfenak. Distribuce Amfenak má vysokou afinitu k albuminům v séru. In vitro dosahovalo procento vazby na potkaní albumin, lidský albumin a lidské sérum 98,4 %, 95,4 % resp. 99,1 %. Studie na potkanech ukázaly, že po jednorázovém i opakovaném perorálním podání 14 C-nepafenaku se metabolity radioaktivně značené látky distribuují rozsáhle v celém těle. Biotransformace Nepafenak podléhá relativně rychlé bioaktivaci na amfenak prostřednictvím očních hydroláz. Následně je amfenak rozsáhle metabolizován na polárnější metabolity, kdy dochází také k hydroxylaci aromatického kruhu, což vede ke tvorbě glukuronidového konjugátu. Radiochromatografické analýzy před hydrolýzou a po hydrolýze β-glukuronidázou naznačily, že všechny metabolity, s výjimkou amfenaku, jsou ve formě glukuronidových konjugátů. Amfenak byl hlavním metabolitem v plazmě a představoval zhruba 13 % celkové radioaktivity v plazmě. Druhý nejčastěji zastoupený metabolit v plazmě byl identifikován jako 5-hydroxy-nepafenak, představující přibližně 9 % celkové radioaktivity v C max. Interakce s jinými léčivými přípravky: Ani nepafenak ani amfenak neinhibují in vitro při koncentracích do 300 ng/ml žádnou hlavní metabolickou aktivitu lidského cytochromu P450 (CYP1A2, 2C9, 2C19, 2D6, 2E1 a 3A4). Proto jsou lékové interakce se současně podávanými přípravky související s metabolismem zprostředkovaným CYP izoenzymy nepravděpodobné. Interakce zprostředkované vazbou na bílkoviny jsou také nepravděpodobné. Vylučování Po perorálním podání 14 C-nepafenaku zdravým dobrovolníkům se zjistilo, že hlavní cestou vylučování radioaktivních metabolitů byla exkrece močí, jež se podílela na zhruba 85 % vyloučené dávky, zatímco exkrece stolicí představovala přibližně 6 % dávky. Nepafenak a amfenak nebyly v moči kvantifikovatelné. Po jednorázové dávce přípravku NEVANAC 25 pacientům po operaci katarakty se měřily koncentrace v komorové vodě 15, 30, 45 a 60 minut po podání. Maximální průměrné koncentrace v komorové vodě byly zjištěny jednu hodinu po podání (nepafenak 177 ng/ml, amfenak 44,8 ng/ml). Tyto hodnoty indikují rychlé pronikání rohovkou. 7
8 5.3 Předklinické údaje vztahující se k bezpečnosti přípravku Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti, toxicity po opakovaném podávání a genotoxicity neodhalily žádné zvláštní riziko pro člověka. Nepafenak nebyl hodnocen v dlouhodobých studiích karcinogenicity. Ve studiích reprodukční toxicity provedených s látkou nepafenak u potkanů, byly dávky toxické pro matku 10 mg/kg spojeny s těžkými/abnormálními porody, zvýšenými postimplantačními ztrátami, sníženou hmotností plodu a zpomalením jeho růstu a nižším mírou přežití. U březích králíků docházelo po podání dávky 30 mg/kg k projevům lehké toxicity u matek a statisticky významnému zvýšení výskytu malformací vrhu. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Mannitol (E421) Karbomer Chlorid sodný Tyloxapol Dihydrát dinatrium-edetátu Benzalkonium chlorid Hydroxid sodný a/nebo kyselina chlorovodíková (pro úpravu ph) Čištěná voda 6.2 Inkompatibility Neuplatňuje se. 6.3 Doba použitelnosti 2 roky Zlikvidujte 4 týdny po prvním otevření. 6.4 Zvláštní opatření pro uchovávání Neuchovávejte při teplotě nad 30 C. 6.5 Druh obalu a velikost balení Kulatá lahvička z polyethylenu o objemu 5 ml a o nízké hustotě s dávkovací zátkou a bílým polypropylenovým šroubovacím uzávěrem obsahující 5 ml suspenze. Krabička obsahující 1 lahvičku. 6.6 Zvláštní opatření pro likvidaci přípravku Žádné zvláštní požadavky. 8
9 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts HP2 7UD Velká Británie 8. REGISTRAČNÍ ČÍSLO (ČÍSLA) EU/1/07/433/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 11/12/ DATUM REVIZE TEXTU Podrobné informace o tomto přípravku jsou uveřejněny na webových stránkách Evropské agentury pro léčivé přípravky: 9
10 PŘÍLOHA II A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ B. PODMÍNKY REGISTRACE 10
11 A. VÝROBCE ODPOVĚDNÝ ZA PROPOUŠTĚNÍ ŠARŽÍ Název a adresa výrobce odpovědného za propouštění šarží S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870 Puurs Belgie B. PODMÍNKY REGISTRACE PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ KLADENÉ NA DRŽITELE ROZHODNUTÍ O REGISTRACI Výdej léčivého přípravku je vázán na lékařský předpis. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPEČNÉ A ÚČINNÉ POUŽÍVÁNÍ LÉČIVÉHO PŘÍPRAVKU Neuplatňují se. DALŠÍ PODMÍNKY Systém farmakovigilance Držitel rozhodnutí o registraci musí zajistit, aby byl zaveden funkční systém farmakovigilance, tak jak je popsán v Modulu předtím, než bude přípravek uveden na trh, a dále po celou dobu, kdy bude přípravek na trhu. Plán řízení rizik Držitel rozhodnutí o registraci se zavazuje, že uskuteční studie a další činnosti v oblasti farmakovigilance podrobně uvedené v Plánu farmakovigilance, tak jak bylo schváleno ve verzi 2.0 Plánu řízení rizik (RMP) uvedeném v Modulu Žádosti o registraci a v příštích aktualizacích RMP schválených CHMP. V souladu se směrnicí Výboru pro humánní léčivé přípravky (CHMP) k systémům řízení rizik pro humánní léčivé přípravky má být aktualizovaný plán řízení rizik předložen současně s příští Periodicky aktualizovanou zprávou o bezpečnosti (PSUR). Dále má být aktualizovaný Plán řízení rizik předložen: Jestliže byly obdrženy nové informace, které mohou mít dopad na současné specifikace bezpečnosti, plán farmakovigilance nebo na činnosti k minimalizaci rizik Do 60 dní po dosažení důležitého milníku (farmakovigilance nebo minimalizace rizik) Na žádost Evropské agentury pro léčivé přípravky 11
12 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 12
13 A. OZNAČENÍ NA OBALU 13
14 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA PRO JEDNU LAHVIČKU 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze Nepafenacum 2. OBSAH LÉČIVÉ LÁTKY 1 ml suspenze obsahuje nepafenacum 1 mg. 3. SEZNAM POMOCNÝCH LÁTEK Manitol E421, karbomer, chlorid sodný, tyloxapol, dihydrát dinatrium-edetátu), benzalkonium chlorid, hydroxid sodný a/nebo kyselina chlorovodíková (pro úpravu ph) a čištěná voda. Další informace jsou uvedeny v příbalové informaci. 4. LÉKOVÁ FORMA A VELIKOST BALENÍ Oční kapky, suspenze 1 x 5 ml 5. ZPŮSOB A CESTA / CESTY PODÁNÍ Oční podání. Před použitím dobře protřepat. Před použitím si přečtěte příbalovou informaci. 6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ Uchovávejte mimo dosah a dohled dětí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ 8. POUŽITELNOST Exp.: Zlikvidujte 4 týdny po prvním otevření. Otevřeno: 14
15 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Neuchovávejte při teplotě nad 30 C. 10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts HP2 7UD Velká Británie 12. REGISTRAČNÍ ČÍSLO/ČÍSLA EU/1/07/433/001 1 x 5 ml 13. ČÍSLO ŠARŽE Č.š.: 14. KLASIFIKACE PRO VÝDEJ Výdej léčivého přípravku vázán na lékařský předpis. 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOVĚ PÍSMU nevanac 15
16 ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU ŠTÍTEK NA LAHVIČCE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A ZPŮSOB PODÁNÍ NEVANAC 1 mg/ml oční kapky Nepafenacum Oční podání 2. ZPŮSOB PODÁNÍ Před použitím si přečtěte příbalovou informaci. 3. POUŽITELNOST Exp.: Zlikvidujte 4 týdny po prvním otevření. Otevřeno: 4. ČÍSLO ŠARŽE Č.š.: 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO POČET 5 ml 6. JINÉ 16
17 B. PŘÍBALOVÁ INFORMACE 17
18 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE NEVANAC 1 mg/ml oční kapky, suspenze Nepafenacum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechejte si příbalovou informaci pro případ, že si ji budete potřebovat přečíst znovu. Máte-li jakékoli další otázky, zeptejte se svého lékaře nebo lékárníka. Tento přípravek byl předepsán Vám. Nedávejte jej žádné další osobě. Mohl by jí ublížit, a to i tehdy, má-li stejné příznaky jako Vy. Pokud se kterýkoliv z nežádoucích účinků vyskytne v závažné míře nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, prosím, sdělte to svému lékaři nebo lékárníkovi. V příbalové informaci naleznete: 1. Co je přípravek NEVANAC a k čemu se používá 2. Čemu musíte věnovat pozornost, než začnete NEVANAC používat 3. Jak se přípravek NEVANAC používá 4. Možné nežádoucí účinky 5. Jak přípravek NEVANAC uchovávat 6. Další informace 1. CO JE TO NEVANAC A K ČEMU SE POUŽÍVÁ NEVANAC se používá: - k prevenci a zmírňění bolesti a zánětu očí po operaci očního zákalu - ke snižování rizika vzniku makulárního edému (otok v zadní části oka) po operaci šedého očního zákalu u diabetiků. NEVANAC patří do skupiny léčivých přípravků nazývaných nesteroidní protizánětlivá léčiva (NSAID). 2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE NEVANAC POUŽÍVAT Nepoužívejte NEVANAC jestliže jste alergický(-á) (přecitlivělý/á) na nepafenak nebo na kteroukoli další složku přípravku NEVANAC nebo na jiná nesteroidní protizánětlivá léčiva. jestliže se u Vás již někdy objevily příznaky astmatu, kožní alergie, nebo intenzivní zánětlivé zduření nosní sliznice během užívání jiného nesteroidního protizánětlivého přípravku, například: acetylsalicylové kyseliny, ibuprofenu, ketoprofenu, piroxicamu, diclofenacu. Zvláštní opatrnosti při použití přípravku Nevanac je zapotřebí U dětí. Jestliže se Vám snadno tvoří modřiny nebo máte problémy s krvácivostí, nebo jste tím trpěli v minulosti, Jestliže máte nějaké oční onemocnění (např. oční infekci) nebo používáte jiný oční léčivý přípravek (zvláště topické steroidy). Jestliže máte cukrovku. Jestliže máte revmatickou artritidu. Jestliže jste podstoupili opakované oční operace v krátkém časovém úseku. 18
19 Vyhněte se slunečnímu záření během léčby přípravkem NEVANAC Pokud se Vás týká cokoliv z toho, co bylo uvedeno výše, oznamte to svému lékaři. Možná i přesto budete moci přípravek NEVANAC používat, nejdříve se však poraďte se svým lékařem. Používání jiných léčivých přípravků Informujte prosím svého lékaře nebo lékárníka o všech lécích, které užíváte nebo jste užíval(a) v nedávné době, a to i o lécích, které jsou dostupné bez lékařského předpisu. Těhotenství a kojení Jste-li těhotná nebo můžete-li otěhotnět, pak se před používáním přípravku NEVANAC poraďte se svým lékařem. Pokud kojíte, může se NEVANAC dostat do mateřského mléka. Dříve, než začnete užívat jakýkoliv lék, se vždy poraďte se svým lékařem. Řízení dopravních prostředků a obsluha strojů Neřiďte dopravní prostředek ani neobsluhujte stroje, dokud není vaše vidění jasné. Po určitou dobu po použití přípravku NEVANAC může být Vaše vidění rozmazané. Důležité informace o některých složkách přípravku Nevanac NEVANAC obsahuje konzervační látku (benzalkonium-chlorid), která může způsobit podráždění oka a zabarvit měkké kontaktní čočky. Navíc se nošení kontaktních čoček po operaci šedého zákalu nedoporučuje. Proto v průběhu léčby přípravkem NEVANAC kontaktní čočky nenoste. 3. JAK SE PŘÍPRAVEK NEVANAC POUŽÍVÁ Vždy používejte přípravek NEVANAC přesně podle pokynů svého lékaře. Pokud si nejste jistý(á), měl(a) byste se poradit se svým lékařem nebo lékárníkem. Přípravek NEVANAC používejte do obou očí, pouze pokud Vám to řekne Váš lékař. Přípravek NEVANAC používejte pouze pro nakapání do očí. Obvyklá dávka Dospělí: Jedna kapka do postiženého oka nebo očí třikrát denně-ráno, v poledne a večer. Přípravek používejte každý den ve stejnou dobu. Kdy se přípravek používá a jak dlouho Začněte 1 den před operací šedého zákalu. Pokračujte v den operace. Poté přípravek používejte tak dlouho, jak Vám doporučí Váš lékař. Může to být až po dobu 21 dní (k prevenci a zmírnění bolesti a zánětu očí) nebo až na 60 dnů (k prevenci vzniku makulárního edému) po operaci. Jak se přípravek používá Dříve než začnete, umyjte si ruce. 19
20 1 2 Před použitím dobře protřepejte. Odšroubujte uzávěr lahvičky. Lahvičku držte směrem dolů mezi palcem a dalšími prsty. Zakloňte hlavu. Stáhněte čistým prstem spodní víčko směrem dolů tak, aby se mezi očním víčkem a okem vytvořila jakási kapsa. Tam se umístí kapka (viz obrázek 1). Přibližte hrot lahvičky k oku. Pokud Vám to pomůže, provádějte toto před zrcadlem. Nedotýkejte se kapátkem oka ani víčka, okolních partií či jiných povrchů. Oční kapky by se tím mohly infikovat. Jemně stiskněte dno lahvičky tak, aby se tím uvolnila vždy jen jedna kapka přípravku NEVANAC. Lahvičku nestlačujte; je vyrobena tak, aby k uvolnění kapky stačil lehký tlak na dno (obrázek 2). Používáte-li kapky do obou očí, opakujte postup i pro druhé oko. Po použití uzávěr lahvičky pevně uzavřete. Otočte> Jak se přípravek používá: viz také strana 1 Když se Vám nepodaří umístit kapku do oka, zkuste to znovu. Jestliže jste do oka nakapal(a) více přípravku NEVANAC, než jste měl(a), vypláchněte oko teplou vodou. Další kapky již nekapejte a počkejte do okamžiku, kdy máte brát další pravidelnou dávku. Pokud zapomenete přípravek NEVANAC použít, vezměte si jednu dávku, jakmile si vzpomenete. Je-li již téměř čas na další dávku, zapomenutou dávku vynechte a pokračujte další dávkou v pravidelnou dobu. Nezdvojujte následující dávku, abyste vynechanou dávku nahradil (a). Nekapejte více než jednu kapku do postiženého oka (očí) třikrát denně. Používáte-li jiné oční kapky, vyčkejte mezi aplikací přípravku NEVANAC a dalších kapek nejméně pět minut. Máte-li jakékoli další otázky, týkající se užívání tohoto přípravku, zeptejte se svého lékaře nebo lékárníka. 4. MOŽNÉ NEŽÁDOUCÍ ÚČINKY Podobně jako všechny léky, i přípravek NEVANAC může mít nežádoucí účinky, které se ale nemusí vyskytnout u každého. Nepřestávejte přípravek NEVANAC používat bez porady s lékařem. Obvykle můžete kapky používat i nadále, pokud nejsou účinky závažné. Máte-li nějaké obavy, sdělte to svému lékaři nebo lékárníkovi. 20
21 Pokud Vaše oči zčervenají nebo jsou více bolestivé, když používáte kapky: Poraďte se ihned se svým lékařem. U přípravku Nevanac byly pozorovány následující nežádoucí účinky: Méně časté nežádoucí účinky ( může se projevit až u 1 ze 100 lidí) Účinky na oko: zánět povrchu oka se ztrátou nebo poškozením buněk nebo bez něj, zánět zbarvené části oka (iritida), tekutina nebo otok v zadní části oka, usazeniny na povrchu oka, bolest oka, citlivost na světlo, nepříjemný pocit v očích, rozmazané vidění, suché oko, výtok z očí, alergický zánět spojivek (oční alergie), svědění oka, pocit cizího tělíska v očích, krusty na víčkách, klesání víček, zvýšené slzení, zarudnutí očí. Celkové nežádoucí účinky: příznaky alergie, bolest hlavy, nevolnost Nežádoucí účinky, jejichž frekvence výskytu není známa (z dostupných dat ji nelze odhadnout) Účinky na oko: zhoršené hojení oka, poškození povrchu oka se ztrátou buněk, jizva na povrchu oka, zamlžení, snížené vidění, podráždění oka, otok oka. Celkové nežádoucí účinky: závratě, zvýšený krevní tlak Diabetičtí pacienti Během klinických testů se u pacientů s diabetem, kteří používali přípravek NEVANAC 60 dní nebo déle pro prevenci otoku v zadní části oka, k němuž může občas dojít po operaci šedého zákalu, vyskytly následující nežádoucí účinky Časté nežádoucí účinky (může se projevit až u 1 z 10 lidí) Účinky na oko: zánět povrchu oka Méně časté nežádoucí účinky (může se projevit až u 1 ze 100 lidí) Účinky na oko: poškození povrchu oka se ztrátou buněk Může se projevit vyšší riziko vzniku nežádoucích reakcí v oblasti rohovky (problémy na povrchu oka), pokud jste měli: komplikovanou oční operaci opakovanou oční operaci v krátkém časovém úseku určité poškození povrchu oka jako je zánět nebo suché oko určité celkové onemocnění, jako je cukrovka nebo revmatická artritida Pokud se kterýkoli z nežádoucích účinků vyskytne v závažné míře nebo pokud si všimnete jakýchkoli nežádoucích účinků, které nejsou uvedeny v této příbalové informaci, sdělte to prosím svému lékaři nebo lékárníkovi. 5. JAK PŘÍPRAVEK NEVANAC UCHOVÁVAT Uchovávejte mimo dosah a dohled dětí. Přípravek NEVANAC nepoužívejte po uplynutí doby použitelnosti uvedené na lahvičce a krabičce za slovy EXP. Doba použitelnosti se vztahuje k poslednímu dni uvedeného měsíce. Neuchovávejte při teplotě nad 30 C. Lahvičku zlikvidujte 4 týdny po prvním otevření, aby se zabránilo infekcím. Datum otevření zapište na lahvičku do vymezeného prostoru. 21
22 Léčivé přípravky se nesmí vyhazovat do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak máte likvidovat přípravky, které již nepotřebujete. Tato opatření pomáhají chránit životní prostředí. 6. DALŠÍ INFORMACE Co přípravek NEVANAC obsahuje Léčivou látkou je nepafenak. Jeden ml suspenze obsahuje 1 mg nepafenaku. Pomocnými látkami jsou: benzalkonium chlorid, karbomer, dihydrát dinatrium-edetátu mannitol, čištěná voda, chlorid sodný a tyloxapol Pro udržení kyselosti (hodnot ph) na normální hodnotě se přidávají malá množství hydroxidu sodného a/nebo kyseliny chlorovodíkové. Jak přípravek NEVANAC vypadá a co obsahuje toto balení NEVANAC je tekutina (světle žlutá až světle oranžová suspenze), dodávaná v balení obsahujícím jednu 5 ml plastovou lahvičku se šroubovacím uzávěrem. Držitel rozhodnutí o registraci: Alcon Laboratories (UK) Ltd. Boundary Way Hemel Hempstead Herts, HP2 7UD Velká Británie Výrobce: S.A. Alcon-Couvreur N.V. Rijksweg 14 B-2870 Puurs Belgie 22
23 Další informace o tomto přípravku získáte u místního zástupce držitele rozhodnutí o registraci: België/Belgique/Belgien Luxembourg/Luxemburg SA Alcon-Couvreur NV + 32 (0) (België/Belgique/Belgien) България Алкон България ЕООД Česká republika Alcon Pharmaceuticals (Czech Republic) s.r.o Danmark Alcon Danmark A/S Deutschland Alcon Pharma GmbH + 49 (0) Ελλάδα Κύπρος Άλκον Λαμποράτορις Ελλάς ΑΕΒΕ (Ελλάδα) Eesti Alcon Eesti España Alcon Cusí, S.A France Laboratoires Alcon + 33 (0) Ireland Malta United Kingdom Alcon Laboratories (UK) Ltd (0) (United Kingdom) Ísland Alcon Danmark A/S Italia Alcon Italia S.p.A Lietuva Alcon Pharmaceuticals Ltd. atstovybė Magyarország Alcon Hungária Gyógyszerkereskedelmi Kft Nederland Alcon Nederland BV + 31 (0) Norge Alcon Norge AS Österreich Alcon Ophthalmika GmbH + 43 (0) Polska Alcon Polska Sp. z o.o Portugal Alcon Portugal Produtos e Equipamentos Oftalmológicos, Lda România S.C. Alcon Romania S.R.L.. : Slovenija Alcon d.o.o Slovenská republika Alcon Pharmaceuticals Ltd oz Suomi/Finland Alcon Finland Oy Sverige Alcon Sverige AB + 46 (0) E-post: receptionen@alconlabs.com 23
24 Latvija Alcon Pharmaceuticals Ltd Tato příbalová informace byla naposledy schválena Podrobné informace o tomto přípravku jsou uvedeny na webových stránkách Evropské lékové agentury: 24
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. 1 ml suspenze obsahuje nepafenacum 1 mg.
 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocné látky: benzalkonium-chlorid 0,05 mg Úplný seznam
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocné látky: benzalkonium-chlorid 0,05 mg Úplný seznam
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE. TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum
 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte
Příbalová informace: informace pro pacienta. NEVANAC 1 mg/ml oční kapky, suspenze Nepafenacum
 Příbalová informace: informace pro pacienta NEVANAC 1 mg/ml oční kapky, suspenze Nepafenacum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro pacienta NEVANAC 1 mg/ml oční kapky, suspenze Nepafenacum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. OPATANOL 1 mg/ml oční kapky, roztok. Olopatadinum.
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE OPATANOL 1 mg/ml oční kapky, roztok. Olopatadinum. Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE OPATANOL 1 mg/ml oční kapky, roztok. Olopatadinum. Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE. EMADINE 0,5 mg/ml, Oční Kapky, roztok. Emedastinum
 PŘÍBALOVÁ INFORMACE EMADINE 0,5 mg/ml, Oční Kapky, roztok. Emedastinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou informaci.pro případ,
PŘÍBALOVÁ INFORMACE EMADINE 0,5 mg/ml, Oční Kapky, roztok. Emedastinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. Ponechte si příbalovou informaci.pro případ,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje nepafenacum 1 mg. Pomocná látka se známým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje nepafenacum 1 mg. Pomocná látka se známým
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE. AZOPT 10 mg/ml oční kapky, suspenze Brinzolamid
 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE AZOPT 10 mg/ml oční kapky, suspenze Brinzolamid Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE AZOPT 10 mg/ml oční kapky, suspenze Brinzolamid Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocná látka se známým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocná látka se známým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje 1 mg nepafenacum. Pomocné látky: benzalkonium-chlorid
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje 1 mg nepafenacum. Pomocné látky: benzalkonium-chlorid
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls /2011
 Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls1519211/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Flarex 1 mg/ml oční kapky, suspenze fluorometholoni
Příloha č. 1 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls1519211/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Flarex 1 mg/ml oční kapky, suspenze fluorometholoni
Co je Voltaren Ophtha CD Léčivou látkou přípravku Voltaren Ophtha CD je diklofenak sodný (diclofenacum natricum).
 Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. OPATANOL 1 mg/ml oční kapky, roztok Olopatadinum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE OPATANOL 1 mg/ml oční kapky, roztok Olopatadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE OPATANOL 1 mg/ml oční kapky, roztok Olopatadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: Informace pro pacienta VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum)
 sp.zn.sukls193773/2014 Příbalová informace: Informace pro pacienta VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls193773/2014 Příbalová informace: Informace pro pacienta VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. FLAREX 1 mg/ml oční kapky, suspenze. fluorometholoni acetas
 sp.zn.sukls53205/2014 Příbalová informace: informace pro uživatele FLAREX 1 mg/ml oční kapky, suspenze fluorometholoni acetas Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls53205/2014 Příbalová informace: informace pro uživatele FLAREX 1 mg/ml oční kapky, suspenze fluorometholoni acetas Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienty. EMADINE 0,5 mg/ml, oční kapky, roztok Emedastinum
 Příbalová informace: informace pro pacienty EMADINE 0,5 mg/ml, oční kapky, roztok Emedastinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro pacienty EMADINE 0,5 mg/ml, oční kapky, roztok Emedastinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok Moxifloxacinum HYDROCHLORIDUM
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok Moxifloxacinum HYDROCHLORIDUM Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok Moxifloxacinum HYDROCHLORIDUM Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. IZBA 30 mikrogramů/ml oční kapky, roztok travoprostum
 Příbalová informace: informace pro uživatele IZBA 30 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele IZBA 30 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA. EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum
 PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EMADINE 0,5 mg/ml, Oční Kapky, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje emedastinum 0,5 mg (jako difumarát) Pomocné látky: Benzalkonium-chloride
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EMADINE 0,5 mg/ml, Oční Kapky, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje emedastinum 0,5 mg (jako difumarát) Pomocné látky: Benzalkonium-chloride
Příbalová informace: Informace pro uživatele. Nolodon 1 mg/ml oční kapky, roztok. Olopatadini hydrochloridum
 Sp.zn. sukls17707/2015 Příbalová informace: Informace pro uživatele Nolodon 1 mg/ml oční kapky, roztok Olopatadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls17707/2015 Příbalová informace: Informace pro uživatele Nolodon 1 mg/ml oční kapky, roztok Olopatadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.:sukls234057/2011 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm oční kapky, suspenze Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.:sukls234057/2011 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm oční kapky, suspenze Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje
Příbalová informace: informace pro pacienta. Tears Naturale II oční kapky, roztok dextranum 70, hypromelosum
 sp.zn.sukls103625/2017 Příbalová informace: informace pro pacienta Tears Naturale II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls103625/2017 Příbalová informace: informace pro pacienta Tears Naturale II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. FLUCON 1 mg/ml, oční kapky, suspenze. fluorometholonum
 Příbalová informace: informace pro uživatele FLUCON 1 mg/ml, oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele FLUCON 1 mg/ml, oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek používat, protože obsahuje
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele. TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum
 sp.zn.sukls29736/2015 Příbalová informace: informace pro uživatele TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls29736/2015 Příbalová informace: informace pro uživatele TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE 2. ČEMU MUSÍTE VĚNOVAT POZORNOST, NEŽ ZAČNETE TOBRADEX POUŽÍVAT
 PŘÍBALOVÁ INFORMACE TOBRADEX, 3mg/ml + 1mg/ml, oční kapky, suspenze (tobramycinum/dexamethasonum ) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE TOBRADEX, 3mg/ml + 1mg/ml, oční kapky, suspenze (tobramycinum/dexamethasonum ) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
sp.zn.: sukls17654/2011 a sp.zn.: sukls92536/2011
 sp.zn.: sukls17654/2011 a sp.zn.: sukls92536/2011 Příbalová informace: informace pro uživatele MAXITROL, oční kapky, suspenze Neomycini sulfas, polymyxini B sulfas, dexamethasonum Přečtěte si pozorně celou
sp.zn.: sukls17654/2011 a sp.zn.: sukls92536/2011 Příbalová informace: informace pro uživatele MAXITROL, oční kapky, suspenze Neomycini sulfas, polymyxini B sulfas, dexamethasonum Přečtěte si pozorně celou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DICLOABAK 1 mg/ml, oční kapky, roztok Diclofenacum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DICLOABAK 1 mg/ml, oční kapky, roztok Diclofenacum
Použití a dětí a dospívajících OPATANOL lze použít u dětských pacientů (ve věku tří let a starších) se stejným dávkováním jako u dospělých.
 1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné látky viz. 6.1. 3. LÉKOVÁ FORMA Oční kapky, roztok.
1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné látky viz. 6.1. 3. LÉKOVÁ FORMA Oční kapky, roztok.
Příbalová informace: informace pro pacienta. Fredomat 40 mikrogramů/ml oční kapky, roztok. travoprostum
 sp.zn.sukls190238/2015 Příbalová informace: informace pro pacienta Fredomat 40 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls190238/2015 Příbalová informace: informace pro pacienta Fredomat 40 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
TOBRADEX oční kapky, suspenze (tobramycinum / dexamethasonum)
 sp.zn. sukls179785/2013 Příbalová informace: informace pro uživatele TOBRADEX oční kapky, suspenze (tobramycinum / dexamethasonum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn. sukls179785/2013 Příbalová informace: informace pro uživatele TOBRADEX oční kapky, suspenze (tobramycinum / dexamethasonum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls57081/2014
 sp.zn.sukls57081/2014 Příbalová informace: informace pro uživatele tobramycinum 0,3% Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás
sp.zn.sukls57081/2014 Příbalová informace: informace pro uživatele tobramycinum 0,3% Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro Vás
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE. Galvus 50 mg tablety Vildagliptinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŢIVATELE Galvus 50 mg tablety Vildagliptinum Přečtěte si pozorně celou příbalovou informaci dříve, neţ začnete tento přípravek uţívat. - Ponechte si příbalovou informaci
INDOCOLLYRE 1 mg/ml oční kapky, roztok indometacinum
 sp.zn. sukls181838/2018 Příbalová informace: informace pro pacienta INDOCOLLYRE 1 mg/ml oční kapky, roztok indometacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls181838/2018 Příbalová informace: informace pro pacienta INDOCOLLYRE 1 mg/ml oční kapky, roztok indometacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls10153/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls10153/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro pacienta. Zurampic 200 mg potahované tablety lesinuradum
 Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
Příbalová informace: informace pro pacienta Zurampic 200 mg potahované tablety lesinuradum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok Kalii iodidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok Kalii iodidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat tento přípravek
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE. - Léčivá látka je tobramycin 3 mg/ml (oční kapky, roztok) nebo 3 mg/g (oční mast). - Další pomocné látky jsou:
 sp.zn.sukls60106/2013 PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat
sp.zn.sukls60106/2013 PŘÍBALOVÁ INFORMACE Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou informaci pro případ, že si ji budete potřebovat
1. NÁZEV PŘÍPRAVKU. AZOPT 10 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Brinzolamidum 10 mg/ml. Pomocné látky viz bod 6.1.
 1. NÁZEV PŘÍPRAVKU AZOPT 10 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Brinzolamidum 10 mg/ml. Pomocné látky viz bod 6.1. 3. LÉKOVÁ FORMA Oční kapky, suspenze. Azopt je bílá až
1. NÁZEV PŘÍPRAVKU AZOPT 10 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Brinzolamidum 10 mg/ml. Pomocné látky viz bod 6.1. 3. LÉKOVÁ FORMA Oční kapky, suspenze. Azopt je bílá až
Příbalová informace: informace pro uživatele. AZOPT 10 mg/ml oční kapky, suspenze Brinzolamidum
 Příbalová informace: informace pro uživatele AZOPT 10 mg/ml oční kapky, suspenze Brinzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele AZOPT 10 mg/ml oční kapky, suspenze Brinzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele. Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum
 Sp. zn. sukls203996/2015 Příbalová informace: informace pro uživatele Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls203996/2015 Příbalová informace: informace pro uživatele Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum
 Příbalová informace: informace pro uživatele TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele TRAVATAN 40 mikrogramů/ml oční kapky, roztok Travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta. Maltofer, 10 mg/ml sirup. polymaltosum ferricum
 sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls65847/2017 Příbalová informace: informace pro pacienta Maltofer, 10 mg/ml sirup polymaltosum ferricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn.sukls78453/2015
 sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn.sukls78453/2015 Příbalová informace: informace pro uživatele Viru-Merz, 10 mg/g, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Příbalová informace: informace pro uživatele. Ofloxacin-POS 3 mg/ml oční kapky, roztok. Ofloxacinum
 Příloha č. 1 k rozhodnutí o registraci sp. zn. sukls222894/2011 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o registraci sp. zn. sukls222894/2011 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls73712/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimican 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jedna kapka
Sp.zn. sukls73712/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimican 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jedna kapka
Příbalová informace: informace pro uživatele. MAXITROL, oční mast neomycini sulfas, polymyxini B sulfas, dexamethasonum
 Příbalová informace: informace pro uživatele MAXITROL, oční mast neomycini sulfas, polymyxini B sulfas, dexamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele MAXITROL, oční mast neomycini sulfas, polymyxini B sulfas, dexamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Souhrn údajů o přípravku
 sp. zn.: sukls35258/2013 a sp. zn.: sukls151801/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml očních
sp. zn.: sukls35258/2013 a sp. zn.: sukls151801/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml očních
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Bronchostop sirup. Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt
 Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Sp.zn.sukls391511/2017 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Bronchostop sirup Léčivé látky: suchý tymiánový extrakt, tekutý proskurníkový extrakt Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro pacienta. Azomyr 0,5 mg/ml perorální roztok desloratadinum
 Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: informace pro pacienta Azomyr 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90
 Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn.sukls118606/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OMACOR 1000 mg měkké tobolky Omega-3 acidorum esteri ethylici 90 Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele. TOBRADEX oční mast 3 mg/g + 1 mg/g tobramycinum / dexamethanosum
 Příbalová informace: informace pro uživatele TOBRADEX oční mast 3 mg/g + 1 mg/g tobramycinum / dexamethanosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele TOBRADEX oční mast 3 mg/g + 1 mg/g tobramycinum / dexamethanosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele. VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok moxifloxacinum hydrochloridum
 Příbalová informace: informace pro uživatele VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok moxifloxacinum hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele VIGAMOX 5 mg/ml OČNÍ KAPKY oční kapky, roztok moxifloxacinum hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Yellox 0,9 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje 0,9 mg bromfenacum (jako sodná sůl seskvihydrátu).
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Yellox 0,9 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje 0,9 mg bromfenacum (jako sodná sůl seskvihydrátu).
Příbalová informace: informace pro pacienta. EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze fluorometholonum
 sp.zn. sukls256067/2017 Příbalová informace: informace pro pacienta EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn. sukls256067/2017 Příbalová informace: informace pro pacienta EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 B. PŘÍBALOVÁ INFORMACE 2 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dasselta 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 B. PŘÍBALOVÁ INFORMACE 2 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dasselta 5 mg potahované tablety desloratadinum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp.zn.sukls95864/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gentadex 5 mg/ml + 1 mg/ml oční kapky, roztok Gentamicini sulfas/ dexamethasoni natrii phosphas Přečtěte si pozorně celou příbalovou informaci
sp.zn.sukls95864/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gentadex 5 mg/ml + 1 mg/ml oční kapky, roztok Gentamicini sulfas/ dexamethasoni natrii phosphas Přečtěte si pozorně celou příbalovou informaci
tobramycinum / dexamethasonum
 sp.zn.sukls57168/2014 Příbalová informace: informace pro pacienta TOBRADEX 3mg/ml + 1mg/ml, oční kapky, suspenze tobramycinum / dexamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn.sukls57168/2014 Příbalová informace: informace pro pacienta TOBRADEX 3mg/ml + 1mg/ml, oční kapky, suspenze tobramycinum / dexamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než
BETOPTIC S oční kapky, suspenze betaxololum
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:98089/2009 a příloha k sp.zn.: sukls98117/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE BETOPTIC S oční kapky, suspenze betaxololum Přečtěte
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:98089/2009 a příloha k sp.zn.: sukls98117/2010 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE BETOPTIC S oční kapky, suspenze betaxololum Přečtěte
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls101534/2012 Příbalová informace: informace pro pacienta GLABRILUX 0,3 mg/ml oční kapky, roztok bimatoprostum
 sp.zn. sukls101534/2012 Příbalová informace: informace pro pacienta GLABRILUX 0,3 mg/ml oční kapky, roztok bimatoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls101534/2012 Příbalová informace: informace pro pacienta GLABRILUX 0,3 mg/ml oční kapky, roztok bimatoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. Ofloxacin-POS 3 mg/ml oční kapky, roztok. Ofloxacinum
 Sp. zn. sukls201848/2013 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls201848/2013 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJU O PŘÍPRAVKU. 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá 0,436 mg epinastinum)
 Příloha č. 1. NÁZEV PŘÍPRAVKU PURIVIST 0,5 mg/ml oční kapky, roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá
Příloha č. 1. NÁZEV PŘÍPRAVKU PURIVIST 0,5 mg/ml oční kapky, roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ 1 ml očních kapek obsahuje epinastini hydrochloridum 0,5 mg (odpovídá
PŘÍBALOVÁ INFORMACE : INFORMACE PRO UŽIVATELE. OSSEOR 2 g - zrněný prášek pro přípravu perorální suspenze Strontii ranelas
 PŘÍBALOVÁ INFORMACE : INFORMACE PRO UŽIVATELE OSSEOR 2 g - zrněný prášek pro přípravu perorální suspenze Strontii ranelas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE : INFORMACE PRO UŽIVATELE OSSEOR 2 g - zrněný prášek pro přípravu perorální suspenze Strontii ranelas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURIVIST 0,5 mg/ml oční kapky, roztok Epinastini hydrochloridum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURIVIST 0,5 mg/ml oční kapky, roztok Epinastini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURIVIST 0,5 mg/ml oční kapky, roztok Epinastini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls100905/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 1. NÁZEV PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 1. NÁZEV PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné
Příbalová informace: informace pro pacienta OFLOXACIN 0,3% UNIMED PHARMA, oční/ušní kapky, roztok ofloxacinum
 sp.zn.: sukls36587/2011 a sp.zn.: sukls256531/2012, sukls88267/2014 Příbalová informace: informace pro pacienta OFLOXACIN 0,3% UNIMED PHARMA oční/ušní kapky, roztok ofloxacinum Přečtěte si pozorně celou
sp.zn.: sukls36587/2011 a sp.zn.: sukls256531/2012, sukls88267/2014 Příbalová informace: informace pro pacienta OFLOXACIN 0,3% UNIMED PHARMA oční/ušní kapky, roztok ofloxacinum Přečtěte si pozorně celou
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls53205/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLAREX 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje fluorometholoni acetas 1 mg. 1 ml suspenze
sp.zn.sukls53205/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLAREX 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje fluorometholoni acetas 1 mg. 1 ml suspenze
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OPATANOL 1 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje 1 mg olopatadinum (jako hydrochlorid). Pomocné
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TAFLOTAN 15 mikrogramů/ml OČNÍ KAPKY, ROZTOK, JEDNODÁVKOVÝ OBAL Tafluprostum
 Příloha č.1 k rozhodnutí o změně registrace k sp.zn. sukls10881/2011 a přílohy k sp. zn.; sukls56095/2010 ; sukls104565/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TAFLOTAN 15 mikrogramů/ml OČNÍ
Příloha č.1 k rozhodnutí o změně registrace k sp.zn. sukls10881/2011 a přílohy k sp. zn.; sukls56095/2010 ; sukls104565/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TAFLOTAN 15 mikrogramů/ml OČNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. TRUSOPT free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRUSOPT free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRUSOPT free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Mycosten 10 mg/g Shampoo Ciclopiroxum šampon Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls229950/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Mycosten 10 mg/g Shampoo Ciclopiroxum šampon Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. Trusopt free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum
 Příbalová informace: informace pro uživatele Trusopt free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Trusopt free bez konzervačních přísad 20 mg/ml, oční kapky, roztok, v jednodávkovém obalu Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls91999/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls91999/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRUSOPT free bez konzervačních přísad 20 mg/ml, oční kapky, roztok v jednodávkovém
Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn. sukls91999/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRUSOPT free bez konzervačních přísad 20 mg/ml, oční kapky, roztok v jednodávkovém
Příbalová informace: informace pro pacienta. Integrilin 0,75 mg/ml infuzní roztok eptifibatidum
 Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: informace pro pacienta Integrilin 0,75 mg/ml infuzní roztok eptifibatidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Dexamethasone sodium phosphate mibe 1,0 mg/ml oční kapky, roztok. dexamethasoni natrii phosphas
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls88670/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dexamethasone sodium phosphate mibe 1,0 mg/ml oční kapky, roztok dexamethasoni natrii phosphas
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls88670/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Dexamethasone sodium phosphate mibe 1,0 mg/ml oční kapky, roztok dexamethasoni natrii phosphas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls /2011
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls1519211/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLAREX 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls152570/2010 a příloha k sp.zn.: sukls1519211/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLAREX 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA
 sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
sp.zn.sukls49563/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Kaloba Perorální kapky, roztok Pelargonii sidoidis extractum fluidum (1 : 8 10) (EPs 7630) extrahováno 11% ethanolem (m/m) Přečtěte si
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Azelastin-POS 0,5 mg/ml oční kapky, roztok. Azelastini hydrochloridum
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls195317/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Azelastin-POS 0,5 mg/ml oční kapky, roztok Azelastini hydrochloridum Přečtěte si pozorně tuto
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls195317/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Azelastin-POS 0,5 mg/ml oční kapky, roztok Azelastini hydrochloridum Přečtěte si pozorně tuto
Příbalová informace: informace pro pacienta
 sp.zn.sukls186703/2016 a sukls186708/2016 Predni-POS oční kapky, suspenze prednisoloni acetas 5,0 mg/ml Příbalová informace: informace pro pacienta Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn.sukls186703/2016 a sukls186708/2016 Predni-POS oční kapky, suspenze prednisoloni acetas 5,0 mg/ml Příbalová informace: informace pro pacienta Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Příbalová informace: informace pro uživatele. Bondulc 40 mikrogramů/ml oční kapky, roztok. travoprostum
 Sp.zn.sukls262569/2012 Příbalová informace: informace pro uživatele Bondulc 40 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls262569/2012 Příbalová informace: informace pro uživatele Bondulc 40 mikrogramů/ml oční kapky, roztok travoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
