Infliximab. Profil lieku. Doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc. Infliximab. Mechanismus účinku.
|
|
|
- Sabina Blažková
- před 6 lety
- Počet zobrazení:
Transkript
1 190 Doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc je první monoklonální protilátkou cílenou na TNFα. Používá se v léčbě revmatoidní artritidy a dalších artritid, idio patických střevních zánětů a psoriázy. Podává se pomalou intravenózní infuzí, obvykle v dávkách 3 5 mg/kg v intervalech 1 8 týdnů. Z organismu je pomalu eliminován s poločasem 7 12 dnů. Pro svou vysokou účinnost a bezpečnost představuje cílenou léčbu první volby těchto onemocnění. Mezi jeho nežádoucí účinky patří především infuzní reakce a riziko oportunních infekcí, ostatní nežádoucí účinky jsou obvykle málo časté nebo nezávažné. Klíčová slova: infliximab, farmakodynamika, farmakokinetika, indikace, nežádoucí účinky is the first monoclonal antibody directed to TNFα. Used in the treatment of rheumatoid arthritis or other arthritis, inflammatory bowel diseases and psoriasis. is administered by slow intravenous infusion, typically at doses of 3 5 mg / kg at intervals of 1-8 weeks. It is slowly eliminated from the body with a half-life of 7 12 days. For its high effectiveness and safety is a targeted first-line treatment of these diseases. Its side effects include especially infusion reactions and the risk of opportunistic infections, other adverse reactions are generally mild or infrequent. Key words: infliximab, pharmacodynamics, pharmacokinetics, clinical use, adverse effects Tumor nekrotizující faktor alfa (TNFα) je v současné době jednou z nejdůležitějších cílových molekul pro léčiva používaná u řady autoimunitních onemocnění. Prvním lékem inhibujícím TNFα, který byl zaveden do klinické praxe, byl infliximab. Zároveň šlo o první registrované biotechnologicky připravené léčivo charakteru monoklonální protilátky. Přestože od jeho registrace už uplynulo téměř 20 let, je stále prototypem tohoto způsobu léčby používaným jako lék první volby. TNF byl před rokem 1983 znám jako důležitý obranný cytokin s významem u stresových reakcí včetně intracelulárních infekcí. Na základě hypotézy, kterou spolu s kolegy zformulovali G. F. Botazzo a M. Feldmann (1), záhy potvrzené na tkáních štítné žlázy postižené Graves-Basedowovou thyreoitidou, byl v roce 1985 zahájen výzkum role cytokinů u revmatoidní artritidy a dalších autoimunitních onemocnění (2). První klinická studie proof-of-principle s monoklonální protilátkou ca2 firmy Centocor (pozdější infliximab) na 10 pacientech s revmatoidní artritidou byla zahájena v roce 1992 (3). V srpnu 1998 byl infliximab registrován americkou FDA pro léčbu Crohnovy nemoci a v roce 2002 pro léčbu refrakterní revmatoidní artritidy. je chimérická monoklonální protilátka. To znamená, že se ze 75 % skládá z lidské bílkoviny (IgG1) a 25 % (vazebné místo pro TNFα) tvoří bílkovina myší. Mechanismus účinku se selektivně váže s vysokou afinitou na rozpustné a transmembránové formy TNFα. TNF je důležitá obranná molekula lidského organismu, která funguje jako jeden z detekčních systémů poškození. Je to první cytokin, který se objevuje v oběhu při poškození nebo stresu během několika minut. Ostatní prozánětlivé mediátory, jako je Il-1 a Il-6, se objevují později a jejich vyplavení je zřejmě závislé na předchozím vyplavení TNF (2). TNFα je produkován především makrofágy, i když může být tvořen řadou jiných buněk, jako jsou CD4+ lymfocyty, NK buňky, neutrofily, mastocyty, eozinofily a zřejmě i neurony. Aktivuje dva typy vlastních receptorů, TNFR1, přítomný ve většině tkání, a TNFR2, který se nachází především v buňkách imunitního systému. TNF plní v organismu řadu funkcí, z nichž nejvýznamnější jsou stimulace exprese adhezních molekul na endotelu a migrace neutrofilů, stimulace fagocytózy, zvýšení tvorby C-reaktivního proteinu v játrech a stimulace produkce Il-1 a prostaglandinu E2 (4). blokuje expresi adhezivních buněčných molekul, chemotaxi a tkáňovou degradaci a produkci Il-6 a CRP. Aplikace infliximabu vede k inhibici průniku zánětlivých buněk do kloubů postižených revmatoidní artritidou (5) a do postižených oblastí střeva u Crohnovy nemoci (6). U psoriázy bylo popsáno snížení zánětlivé tkáňové odpovědi downregulací intercelulární signální cesty Il-12 / Il-23 (7). Farmakokinetika je látka proteinového charakteru s velkou molekulovou hmotností (149.1 kda), což určuje i charakter jeho farmakokinetiky. Podává se intravenózní infuzí, opakovanou co 1 8 týdnů. Aplikace se standardně provádí v dvouhodinové infuzi, u pacientů, kteří dobře tolerovali podání prvních tří dávek, je možno použít podání zkrácené na 1 hodinu. Vztah mezi dávkou a maximální plazmatickou koncentrací nebo plochou pod křivkou plazmatických koncentrací je v obvyklém rozmezí dávek lineární. Distribuční objem infliximabu se pohybuje v rozmezí 3,0 4,1 litru, což odpovídá distribuci v intravaskulárním kompartmentu. Eliminační mechanismus není detailně popsán, předpokládá se degradace nespecifickými proteázami. Tomu odpovídá velmi nízká systémová clearance (11 15 ml/hod) dlouhý biologický poločas eliminace 7 12 dnů a střední rezidenční čas dnů (8). Dlouholetá debata o možném přínosu terapeutického monitorování plazmatických koncentrací infliximabu s případnou individualizací dávkování se v současné době kloní ve prospěch tohoto postupu, avšak zatím rozhodně není používán rutinně. Není ani jednoznačně stanoveno terapeutické rozmezí, nicméně za všeobecně přijímaný cíl lze považovat minimální údolní plazmatickou koncentraci 1 mcg/ml (8). Registrované indikace je registrován pro léčbu autoimunitních onemocnění v revmatologii, gastroen-
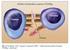
2 191 Obr. 1. Přehled hlavních funkcí tumor nekrotizujícího faktoru Aberantní aktivace tvorby osteoklastů Interference s metabolismem Adipocyt Osteoklast Stimuly Monocyt/makrofág T-lymfocyt B-lymfocyt Proliferace T-lymfocytů Protilátky se obvykle infliximab podává v monoterapii (studie INFAST u časné axiální spondylartritidy). Předpokládá se o něco menší výskyt nežádoucích účinků než při léčbě revmatoidní artritidy (10). Výhodou je i prokázaná účinnost infliximabu u extraartikulárních projevů ankylozující spondylitidy. V případě uveitidy významně vyšší ve srovnání s účinností etanerceptu a současně terapie infliximabem umožnila významně omezit potřebu podávání glukokortikoidů. Zvýšená angiogeneze Monocyt Zvýšená buněčná infiltrace Endotelové buňky Obr. 2. Struktura infliximabu Lidský (IgG1) TNF Kardiomyocyt Myokardiální dysfunkce a smrt kardiomyocytů terologii a dermatologii. Jedná se níže uvedené choroby, přičemž z důvodu rozsahu jsou uvedena pouze zjednodušená dávkovací schémata. Revmatoidní artritida Používá se k redukci známek a příznaků, jakož i zlepšení fyzické funkce u dospělých pacientů s aktivní chorobou, jestliže odpověď na antirevmatická léčiva modifikující chorobu (DMARD), včetně methotrexátu, není postačující, i dospělých pacientů s těžkou, aktivní a progresivní chorobou, dříve neléčených methotrexátem nebo ostatními DMARD. V této indikaci se infliximab podává vždy současně s methotrexátem, v dávce 3 mg/kg v 1., 2. a 6. týdnu a potom každý 8. týden. Klinické odpovědi by mělo být dosaženo během 12 týdnů léčby. Pokud odpověď není dostatečná, je možno jednotlivou dávku navyšovat až na 7,5 mg/ Glie Myší Zvýšení odpovědi akutní fáze Hepatocyt Fibroblast Apoptóza Modifikace synaptické transmise Vazebné místo pro TNFα kg. Řadou klinických studií (především studie ATTRACT a ASPIRE) byla potvrzena významně vyšší účinnost kombinované terapie s methotrexátem oproti monoterapii (9) a zpomalení až zástava destruktivních kloubních změn v RTG nálezu u významné části pacientů. Současná imunosupresivní terapie methotrexátem výrazně inhibuje tvorbu protilátek proti infliximabu, a proto je léčba infliximabem v této indikaci schválena pouze v této kombinaci. Ankylozující spondylitida Je indikován k léčbě závažné aktivní ankylozující spondylitidy u dospělých pacientů, kteří nereagovali adekvátně na konvenční léčbu (Studie ASSERT). Používá se dávka 5 mg/kg v intervalech jako u revmatoidní artritidy. Pokud není dosaženo léčebné odpovědi po 4. dávce, nesmí se v léčbě pokračovat. V této indikaci Psoriatická artritida se také používá v léčbě aktivní a progresivní psoriatické artritidy u dospělých pacientů v případě, že u nich nebyla předchozí odpověď na léčbu DMARD adekvátní. Přípravek by měl být podáván v kombinaci s methotrexátem nebo samotný u pacientů s nesnášenlivostí methotrexátu nebo pacientů s kontraindikací podávání methotrexátu. Dávkování je shodné s dávkováním u ankylozující spondylitidy. Postupný nástup léčebné odpovědi byl prokázán (studie IMPACT) při monoterapii infliximabem již po dvou týdnech. U této choroby dochází při léčbě infliximabem k regresi jak kloubního, tak kožního nálezu i k příznivému ovlivnění entezitid a daktylitid (9). Crohnova choroba K léčbě středně závažné až závažné aktivní Crohnovy choroby u pacientů nereagujících na plný a adekvátní léčebný režim glukokortikoidy nebo imunosupresivy nebo kteří tuto léčbu V této indikaci se používá dávka 5 mg/kg v 1., 2. a 6. týdnu. Jestliže pacient nereaguje po 2 dávkách na léčbu, nesmí se v léčbě pokračovat. Pokud je přítomna léčebná odpověď, existují dva možné další postupy: udržovací fáze podávání 5 mg/kg každý 8. týden nebo opětovné podání infuze 5 mg/kg až objeví- -li se znovu známky a symptomy nemoci, následovaná infuzemi 5 mg/kg každý 8. týden. Dále se používá k léčbě dospělých pacientů s aktivní Crohnovou chorobou s píštělemi, nereagujících na plný a adekvátní léčebný režim konvenční léčby (včetně antibiotik, drenáže a imunosupresivní léčby). Dávkování je shodné jako u předchozí formy, jen s vyhodnocením léčebné odpovědi až po 3. dávce. U Crohnovy nemoci je infliximab biologickou léčbou první volby, přičemž je efektivní i na extraintestinální projevy tohoto onemocnění (11) ; 7(4) Praktické lekárnictvo
3 192 je registrován také k léčbě těžké aktivní Crohnovy choroby u dětí a dospívajících ve věku 6 17 let, kteří nereagovali na konvenční léčbu zahrnující kortikosteroid, imunomodulátor a primární nutriční terapii nebo kteří tuto léčbu se stal nedílnou součástí léčby idiopatických střevních zánětů u dětí, přičemž se zdá, že výsledky léčby jsou ještě lepší než u dospělých pacientů (12). Obr. 3. Mechanismus účinku infliximabu Makrofág Aktivace komplementu (in vitro) TNFα Solubilní TNFα Ulcerózní kolitida K léčbě středně závažné až závažné aktivní ulcerózní kolitidy u dospělých pacientů adekvátně nereagujících na konvenční léčbu, včetně systémově podávaných glukokortikoidů a 6 merkaptopurinu nebo azathioprinu, nebo kteří tuto léčbu Dávkovací schéma je shodné s dávkováním u CD, efekt se vyhodnocuje po 3. dávce. I v této indikaci je biologickou léčbou první volby, účinnou i na extraintestinální zánětlivé komplikace (11). Také se používá k léčbě dětí a dospívajících ve věku 6 17 let za stejných podmínek jako u dospělých. Psoriáza V dermatologii je infliximab indikován k léčbě středně až velmi závažné psoriázy s plaky u dospělých pacientů, u nichž selhala, byla kontraindikována či nebyla tolerována jiná systémová léčba, včetně cyklosporinu, methotrexátu nebo psoralenu s ultrafialovým zářením A (PUVA). Úvodní dávka je 5 mg/kg, léčba pokračuje stejnou dávkou v 2. a 6. týdnu po první infuzi a poté každý 8. týden. Jestliže pacient nereaguje na léčbu do 14 týdnů (tj. po 4 dávkách), nesmí se další léčba infliximabem podávat. Léčba infliximabem vede k ústupu kožní i systémové symptomatologie tohoto onemocnění i k významnému zlepšení celkové kvality života (13). Další možné využití je využíván i k léčbě závažných forem sarkoidózy refrakterních na léčbu glukokortikoidy (14). S určitým úspěchem je využíván i v léčbě hidradenitis suppurativa (15). Je také doporučován jako lék volby u očních manifestací Behçetovy choroby a v druhé linii léčby ostatních autoimunitních uveitid (16). Efektivita jeho použití v léčbě vaskulitid, zejména Takayasuovy arteriitidy a Kawasakiho nemoci zůstává předmětem výzkumu (17). Použití u specifických skupin pacientů je zatím jediným biologickým lékem cíleným na TNF, který je registrován Membránově vázaný TNFα pro použití u dětí, a to v indikaci idiopatických střevních zánětů. Proto je u nich z celé této skupiny lékem první volby. Pro použití v jiných indikacích nejsou k dispozici dostatečně validní údaje. U pacientů starších 65 let byl popsán vyšší výskyt závažných infekcí než u pacientů mladších, přičemž některé případy byly fatální. Proto je u nich doporučeno věnovat zvláštní pozornost riziku infekcí. Ženám ve fertilním věku je doporučeno užívat adekvátní antikoncepci během léčby a nejméně 6 měsíců po jejím ukončení. U těhotných žen není podávání infliximabu doporučeno, nicméně existují údaje o několika stovkách těhotných žen léčených infliximabem (včetně období 1. trimestru) bez vlivu na průběh a výsledek těhotenství. V prospektivní kohortové studii byl pouze zjištěn vyšší výskyt předčasných porodů a novorozenců s nízkou porodní hmotností při léčbě anti-tnf léčivy, ale kauzalita není zcela prokázána (18). prochází placentou a byl detekován v séru kojenců po dobu až 6 měsíců od narození. Může proto ovlivnit vývoj imunitních funkcí novorozenců a kojenců. U kojenců vystavených in utero infliximabu může být zvýšené riziko infekce, včetně závažných až fatálních diseminovaných infekcí. Byly u nich také hlášeny případy agranulocytózy. Není doporučeno podávání živých vakcín (např. BCG vakcína) dětem vystaveným in utero infliximabu po dobu alespoň 6 měsíců po narození. Vzhledem k tomu, že lidské imunoglobuliny se vylučují do mateřského mléka, nesmějí ženy kojit během léčby infliximabem a minimálně po dobu 6 měsíců po jejím ukončení. TNF receptor Cílová buňka Kontraindikace je kontraindikován v případě známé přecitlivělosti pacienta na účinnou látku, na jiné myší proteiny nebo na kteroukoli pomocnou látku v léčivém přípravku. Kontraindikováni pro jeho použití jsou též pacienti s tuberkulózou nebo s ostatními závažnými infekcemi, jako jsou sepse, abscesy a oportunní infekce a pacienti se středně závažným nebo závažným srdečním selháním (NYHA III a IV). Nežádoucí účinky je obecně dobře snášený lék a přínos léčby touto monoklonální protilátkou v registrovaných indikacích vysoce převyšuje rizika. Jako velmi časté (tedy s incidencí 10 a více) se vyskytují obvykle nezávažné nežádoucí účinky, jako jsou bolesti hlavy, virové infekce, nauzea a bolesti břicha. Nicméně stejně jako u všech vysoce účinných léčiv může vyvolávat řadu dalších nežádoucích účinků, které vzácně mohou být i velmi závažné. Infuzní reakce Časná reakce bezprostředně následuje aplikaci infuze s monoklonální protilátkou. Příznaky zahrnují horečku, zimnici a třesavku, svědění kůže, výsev kopřivky, dušnost a někdy bolesti na hrudi, hypo- nebo hypertenzi. U mírných projevů může k ústupu postačovat zpomalení infuze, u závažnějších je nutné infuzi přerušit. Symptomatická léčba zahrnuje paracetamol, antihistaminika a systémově aplikované glukokortikoidy. Stejné léky lze použít i profylakticky. Pozdní infuzní reakce nastupuje obvykle mezi 3. a 12. dnem po aplikaci a zahrnuje horečku, vyrážku, myalgie a artralgie. Riziko výskytu infuz-
4 193 ní reakce snižuje nejen profylaktické podávání glukokortikoidů, ale i konkomitantní terapie imunosupresivy. Naopak současná antibiotická léčba zřejmě riziko naopak zvyšuje až trojnásobně. Infekční komplikace Všechny léky s významným imunosupresivním účinkem zvyšují riziko infekcí. Inhibice TNF také zvyšuje riziko infekcí především respiračního a urogenitálního traktu. Vzácně se mohou vyskytovat i závažné život ohrožující oportunní infekce, především mykobakteriózy, listeriózy a nokardiózy a systémové invazivní mykotické infekce. Zvláštní pozornost je věnována riziku reaktivace latentní TBC infekce při léčbě infliximabem. Ve většině hlášených případů se jednalo o extrapulmonální tuberkulózu. Signifikantně zvýšené riziko TBC potvrdila i recentní metaanalýza 24 randomizovaných placebem kontrolovaných klinických studií (19). Proto musí být u všech pacientů před zahájením léčby odebrána podrobná anamnéza ohledně prodělané tuberkulózy nebo možného dřívějšího kontaktu s tuberkulózou a dřívější nebo aktuální současné imunosupresivní léčby. Musí být též proveden tuberkulinový kožní test a RTG snímek plic. Stejně tak je považováno za nezbytné vyšetření na přítomnost infekce virem hepatitidy B, neboť byly popsány případy reaktivace infekce u chronických nosičů tohoto viru. Malignity O zvýšeném riziku malignit, především lymfatických leukemií a lymfomů, při léčbě vysoce účinnými inhibitory TNFα se diskutuje od prvních případů popsaných při léčbě infliximabem. Kauzální souvislost s léčbou však nebyla prokázána a ani recentní metaanalýzy (20) či data z registrů (21) takovou souvislost nepotvrzují. Další nežádoucí účinky Při léčbě inhibitory TNFα se vzácně vyskytují hematologické poruchy, především granulocytopenie, leukopenie, trombocytopenie i pancytopenie. Podávání infliximabu, zejména ve vysokých dávkách, může podle údajů z klinických studií zhoršit, nebo dokonce nově vyvolat srdeční selhání. Vyskytují se i jaterní poruchy obvykle nezávažného charakteru. Při léčbě infliximabem byla také vzácně popsána vzplanutí autoimunitních onemocnění, jako je psoriáza nebo demyelinizační procesy v CNS. Jednou z nich je i polékový lupus erytematosus, přičemž jeho charakteristiky jsou podle všeho bližší klasickému SLE než polékovému lupus-like syndromu vyvolanému běžnými nízkomolekulárními léčivy (22). Navíc se během léčby vytvoří nově až u poloviny všech pacientů pozitivita antinukleárních protilátek a u 17 pozitivita anti-dsdna. Imunogenicita U všech léčiv charakteru monoklonálních protilátek dochází u některých pacientů k produkci protilátek proti těmto léčivům. V případě léčiv cílených proti TNFα se obvykle označují Anti-Drug Antibody (ADA). Celkový výskyt těchto protilátek proti infliximabu v klinických studiích je 25,3 (15), nicméně u pacientů léčených současně imunosupresivy je přibližně 14. Pacienti, u kterých se vyvinuly protilátky na infliximab, měli 2 3krát vyšší riziko infuzních reakcí než pacienti bez těchto protilátek. Navíc bylo zjištěno, že pacienti s vysokými titry protilátek proti infliximabu mají vyšší riziko jeho neúčinnosti. Lékové interakce Vzhledem k charakteru infliximabu jako mono klonální protilátky nejsou pravděpodobné významné klasické farmakokinetické interakce s jinými léčivy. Na pomezí farmakokinetické a farmakodynamické interakce stojí zjištěné snížení protilátek proti infliximabu u pacientů léčených současně metotrexátem nebo jinými imunosupresivy. Tento jev vede k prodloužení poločasu eliminace infliximabu. Naopak závažné mohou být interakce farmakodynamické, zejména snížení imunitních schopností organismu při kombinaci s imunosupresivními léky. Obecně se nedoporučuje kombinace s jinými biologickými léčivy používanými ve stejných indikacích. Nedoporučuje se současné podání živých vakcín, neboť může dojít k rozvoji diseminované infekce. U kojenců vystavených in utero infliximabu byly popsány i ojedinělé případy úmrtí způsobených diseminovanou infekcí Bacillus Calmette-Guérin po aplikaci BCG vakcíny (23). Biosimilars je první monoklonální protilátkou, které vypršela v některých zemích EU patentová ochrana. Jako jeho první biologicky podobný léčivý přípravek (biosimilar) byl Evropskou lékovou agenturou (European Medicines Agency, EMA) registrován přípravek s označením CT-P13, který vyvinula korejská firma Celltrion (24). Díky tomuto vstupu konkurence na trh však došlo k razantnímu poklesu cen biologických léčiv používaných v revmatologii, gastroenterologii a dermatologii. To umožňuje využít tuto vysoce účinnou léčbu i u většího počtu pacientů. Hlavním principem kategorie biologicky podobných léčiv je extrapolace indikací. Znamená to, že u biosimilar se provádí klinické hodnocení u omezeného počtu indikací (u infliximabu to byla ankylozujicí spondylitida a revmatoidní artritida) a na základě výsledků pak může být povolena registrace i pro léčbu jiných onemocnění, u kterých se předpokládá podobný mechanismus terapeutického účinku. Registrace biosimilárního infliximabu byla první, u které byl princip extrapolace použit pro léčivo charakteru monoklonální protilátky. Všechna dosavadní dostupná data potvrzují správnost tohoto principu a ekonomický přínos zavedení biosimilars monoklonálních protilátek. Proto je v současné době renomovanými výrobci vyvíjena celá řada dalších biosimilars infliximabu, která budou zaváděna do běžné praxe v blízké budoucnosti. Závěr je prototypovou látkou skupiny monoklonálních protilátek cílených proti TNFα. Jeho zavedení přineslo zásadní převrat v léčbě řady autoimunitních onemocnění v revmatologii, gastroenterologii a dermatologii. Přestože se používá už téměř 20 let, v účinnosti a bezpečnosti nebyl zásadně překonán a všechny ostatní látky této skupiny jsou me-too drugs, které přinášejí pouze určitá vylepšení a doplnění léčby bez převratného přínosu k farmakoterapii těchto nemocí. Snížení cen v souvislosti se zavedením biosimilárních infliximabů do praxe dává naději na zlepšení dostupnosti této léčby pro ekonomicky slabší země i pro řadu pacientů ve vyspělých zemích, pro které tato léčba nebyla dostupná z ekonomických důvodů. Dá se tedy předpokládat rozsáhlé používání této látky i v blízké budoucnosti. Podpořeno grantem IGA_LF_2017_012. Literatura 1. Bottazzo GF, Pujol-Borrell R, Hanafusa T, Feldmann M. Role of aberrant HLA-DR expression and antigen presentation in induction of endocrine autoimmunity. Lancet. 1983; 2(8359): Monaco C, Nanchahal J, Taylor P, Feldmann M. Anti-TNF therapy: past, present and future. Int Immunol. 2015; 27(1): Elliott MJ, Maini RN, Feldmann M, et al. Treatment of rheumatoid arthritis with chimeric monoclonal antibodies to tumor necrosis factor alpha. Arthritis Rheum. 1993; 36(12): Bradley JR. TNF-mediated inflammatory dinase. J Pathol. 2008; 214(2): Taylor PC, Peters AM, Paleolog E, Chapman PT, Elliott MJ, McCloskey R, Feldmann M, Maini RN. Reduction of chemokine levels and leukocyte traffic to joints by tumor necrosis factor alpha blockade in patients with rheumatoid arthritis. Arthritis Rheum. 2000; 43(1): ; 7(4) Praktické lekárnictvo
5 Levin AD, Wildenberg ME, van den Brink GR. Mechanism of Action of Anti-TNF Therapy in Inflammatory Bowel Disease. J Crohns Colitis. 2016; 10(8): Brunner PM, Koszik F, Reininger B, et al. induces downregulation of the IL-12/IL-23 axis in 6-sulfo-LacNac (slan) + dendritic cells and macrophages. J Allergy Clin Immunol. 2013; 132(5): Klotz U, Teml A, Schwab M. Clinical pharmacokinetics and use of infliximab. Clin Pharmacokinet. 2007; 46(8): Ciferská H, Horák P, Strojil J, Skácelová M. Biologická terapie v revmatologii. Klin Farmakol Farm 2010; 24(4): Elalouf O, Elkayam O. Long-term safety and efficacy of infliximab for the treatment of ankylosing spondylitis. Ther Clin Risk Manag. 2015; 11: Peyrin-Biroulet L, Van Assche G, Gómez-Ulloa D, et al. Systematic Review of Tumor Necrosis Factor Antagonists in Extraintestinal Manifestations in Inflammatory Bowel Disease. Clin Gastroenterol Hepatol. 2017; 15(1): e Yang LS, Alex G, Catto-Smith AG. The use of biologic agents in pediatric inflammatory bowel disease. Curr Opin Pediatr. 2012; 24(5): Wang J, Zhan Q, Zhang L. A systematic review on the efficacy and safety of in patients with psoriasis. Hum Vaccin Immunother. 2016; 12(2): Korsten P, Strohmayer K, Baughman RP, Sweiss NJ. Refractory pulmonary sarcoidosis proposal of a definition and recommendations for the diagnostic and therapeutic approach. Clin Pulm Med. 2016; 23(2): Ingram JR, Woo PN, Chua SL, et al. Interventions for hidradenitis suppurativa: a Cochrane systematic review incorporating GRADE assessment of evidence quality. Br J Dermatol. 2016; 174(5): Schwartzman S. Advancements in the management of uveitis. Best Pract Res Clin Rheumatol. 2016; 30(2): Zhu FH, Ang JY. The Clinical Diagnosis and Management of Kawasaki Disease: a Review and Update. Curr Infect Dis Rep. 2016; 18(10): Weber-Schoendorfer C, Oppermann M, el al. Pregnancy outcome after TNF-α inhibitor therapy during the first trimester: a prospective multicentre cohort study. Br J Clin Pharmacol. 2015; 80(4): Wang Q, Wen Z, Cao Q. Risk of tuberculosis during infliximab therapy for inflammatory bowel disease, rheumatoid arthritis, and spondyloarthropathy: A meta-analysis. Exp Ther Med. 2016; 12(3): Chen Y, Sun J, Yang Y, Huang Y, Liu G. Malignancy risk of anti-tumor necrosis factor alpha blockers: an overview of systematic reviews and meta-analyses. Clin Rheumatol. 2016; 35(1): D Haens G, Reinisch W, Colombel JF, et al. Five-year Safety Data From ENCORE, a European Observational Safety Registry for Adults With Crohn s Disease Treated With [Remicade ] or Conventional Therapy. 22. Vedove CD, Del Giglio M, Schena D, Girolomoni G. Drug- -induced lupus erythematosus. Arch Dermatol Res. 2009; 301(1): Thomas SS, Borazan N, Barroso N, et al. Comparative Immunogenicity of TNF Inhibitors: Impact on Clinical Efficacy and Tolerability in the Management of Autoimmune Diseases. A Systematic Review and Meta-Analysis. BioDrugs. 2015; 29(4): Heller MM, Wu JJ, Murase JE. Fatal case of disseminated BCG infection after vaccination of an infant with in utero exposure to infliximab. J Am Acad Dermatol. 2011; 65(4): Urbánek K. První biosimilární monoklonální protilátka infliximab. Klin Farmakol Farm 2014; 28(1): Článok je prevzatý z: Interní Med. 2017; 19(1): Doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc Hněvotínská 3, Olomouc urbanek@fnol.cz
Infliximab. Mechanismus účinku. doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc FARMAKOLOGICKÝ PROFIL
 doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc je první monoklonální protilátkou cílenou na TNFα. Používá se v léčbě revmatoidní artritidy a dalších artritid, idiopatických střevních
doc. MUDr. Karel Urbánek, Ph.D. Ústav farmakologie LF UP a FN Olomouc je první monoklonální protilátkou cílenou na TNFα. Používá se v léčbě revmatoidní artritidy a dalších artritid, idiopatických střevních
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Co přináší biologická léčba nespecifických zánětů střevních. Keil R.
 Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ. T. Vaňásek (Hradec Králové)
 Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
Přínos farmakokinetického monitorování pro optimalizaci biologické léčby ISZ T. Vaňásek (Hradec Králové) Farmakokinetické monitorování BL Biologická léčba Cílená modifikace imunitní reakce spojené s patogenezí
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100
Atestační otázky z oboru alergologie a klinická imunologie
 Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
Publikováno z 2. lékařská fakulta Univerzity Karlovy v Praze ( https://www.lf2.cuni.cz) Atestační otázky z oboru alergologie a klinická imunologie Okruh základy imunologie 1. Buňky, tkáně a orgány imunitního
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Protinádorová imunita. Jiří Jelínek
 Protinádorová imunita Jiří Jelínek Imunitní systém vs. nádor l imunitní systém je poslední přirozený nástroj organismu jak eliminovat vlastní buňky které se vymkly kontrole l do boje proti nádorovým buňkám
Protinádorová imunita Jiří Jelínek Imunitní systém vs. nádor l imunitní systém je poslední přirozený nástroj organismu jak eliminovat vlastní buňky které se vymkly kontrole l do boje proti nádorovým buňkám
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remsima 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 100 mg infliximabum*.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remsima 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 100 mg infliximabum*.
Jedna injekční lahvička obsahuje infliximabum 100 mg*. Po rekonstituci obsahuje jeden ml infliximabum 10 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100
 www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
1. NÁZEV PŘÍPRAVKU. Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100 mg. Infliximab je chimérická lidská-myší
1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro koncentrát pro infuzní roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje infliximabum 100 mg. Infliximab je chimérická lidská-myší
Imunopatologie. Viz také video: 15-Imunopatologie.mov. -nepřiměřené imunitní reakce. - na cizorodé netoxické antigeny (alergie)
 Imunopatologie -nepřiměřené imunitní reakce - na cizorodé netoxické antigeny (alergie) - na vlastní antigeny (autoimunita) Viz také video: 15-Imunopatologie.mov Imunopatologické reakce Reakce I.S. podobné
Imunopatologie -nepřiměřené imunitní reakce - na cizorodé netoxické antigeny (alergie) - na vlastní antigeny (autoimunita) Viz také video: 15-Imunopatologie.mov Imunopatologické reakce Reakce I.S. podobné
Farmakokinetika antibiotik v perioperačním období
 Farmakokinetika antibiotik v perioperačním období K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Antibiotická profylaxe Aplikace antibiotik s cílem snížit
Farmakokinetika antibiotik v perioperačním období K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Antibiotická profylaxe Aplikace antibiotik s cílem snížit
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Mechanismy a působení alergenové imunoterapie
 Mechanismy a působení alergenové imunoterapie Petr Panzner Ústav imunologie a alergologie LF UK a FN Plzeň Zavedení termínu alergie - rozlišení imunity a přecitlivělosti Pasivní přenos alergenspecifické
Mechanismy a působení alergenové imunoterapie Petr Panzner Ústav imunologie a alergologie LF UK a FN Plzeň Zavedení termínu alergie - rozlišení imunity a přecitlivělosti Pasivní přenos alergenspecifické
Imunopatologie. Luděk Bláha
 Imunopatologie Luděk Bláha blaha@recetox.muni.cz Imunopatologie nepřiměřené imunitní reakce na cizorodé netoxické antigeny (alergie) na vlastní antigeny (autoimunita) Viz také video: 15-Imunopatologie.mov
Imunopatologie Luděk Bláha blaha@recetox.muni.cz Imunopatologie nepřiměřené imunitní reakce na cizorodé netoxické antigeny (alergie) na vlastní antigeny (autoimunita) Viz také video: 15-Imunopatologie.mov
Karbapenemy v intenzivní péči K. Urbánek
 Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
Karbapenemy v intenzivní péči K. Urbánek Ústav farmakologie Lékařská fakulta Univerzity Palackého a Fakultní nemocnice Olomouc Rozdělení Skupina I Skupina II ertapenem, panipenem, tebipenem omezený účinek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro přípravu koncentrátu pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 100
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Remicade 100 mg prášek pro přípravu koncentrátu pro přípravu infuzního roztoku. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 100
Specifická imunitní odpověd. Veřejné zdravotnictví
 Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Možnosti využití hematologické léčby u MG
 Možnosti využití hematologické léčby u MG Tomáš Kozák 3. lékařská fakulta UK v Praze a FN Královské Vinohrady Autoimunitní choroby (AID) Ehrlich a Morgenroth, 1901: horror autotoxicus Shoenfeld, 1999,
Možnosti využití hematologické léčby u MG Tomáš Kozák 3. lékařská fakulta UK v Praze a FN Královské Vinohrady Autoimunitní choroby (AID) Ehrlich a Morgenroth, 1901: horror autotoxicus Shoenfeld, 1999,
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Jedna předplněná injekční stříkačka na jedno použití o objemu 0,8 ml obsahuje adalimumabum 40 mg.
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti
Nově na revmatoidní artritidu? Jiří Vencovský
 Nově na revmatoidní artritidu? Jiří Vencovský Normální kloub Kost Chrupavka Revmatoidní artritida Proliferace synoviálních buněk Infiltrace T a B lymfocyty, PB, Mø, F, NK, DC, EC... Zvýšená propustnost
Nově na revmatoidní artritidu? Jiří Vencovský Normální kloub Kost Chrupavka Revmatoidní artritida Proliferace synoviálních buněk Infiltrace T a B lymfocyty, PB, Mø, F, NK, DC, EC... Zvýšená propustnost
Příloha č.4 Seznam imunologických vyšetření. Obsah. Seznam imunologických vyšetření
 Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
Příloha č.4 Seznam imunologických vyšetření Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6 Název: IgA Zkratka: IgA Typ: kvantitativní Princip: turbidimetrie Jednotky:
Příloha č.4 Seznam imunologických vyšetření
 Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
Příloha č.6 Laboratorní příručka Laboratoří MeDiLa, v05 - Seznam imunologických Příloha č.4 Seznam imunologických Obsah IgA... 2 IgG... 3 IgM... 4 IgE celkové... 5 Informační zdroje:... 6 Stránka 1 z 6
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
EDUKAČNÍ MATERIÁL. Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid)
 EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
EDUKAČNÍ MATERIÁL Informace pro zdravotnické pracovníky k bezpečnému užívání léčivého přípravku Leflunopharm (leflunomid) Leflunopharm (leflunomid), jako chorobu modifikující antirevmatikum (Disease-Modifying
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
SIMPONI (golimumab) Edukační program
 Edukační materiál SIMPONI (golimumab) Edukační program Brožura A5 /148x210mm) 16 stran Přípravek SIMPONI, lidská IgG1κ monoklonální protilátka proti tumor nekrotizujícímu faktoru alfa (TNFα), je indikován
Edukační materiál SIMPONI (golimumab) Edukační program Brožura A5 /148x210mm) 16 stran Přípravek SIMPONI, lidská IgG1κ monoklonální protilátka proti tumor nekrotizujícímu faktoru alfa (TNFα), je indikován
Biologická léčba revmatických onemocnění
 Biologická léčba revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha CERGE 2010 infliximab etanercept adalimumab rituximab abatacept Biologická léčba revmatických onemocnění
Biologická léčba revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha CERGE 2010 infliximab etanercept adalimumab rituximab abatacept Biologická léčba revmatických onemocnění
Játra a imunitní systém
 Ústav klinické imunologie a alergologie LF MU, RECETOX, PřF Masarykovy univerzity, FN u sv. Anny v Brně, Pekařská 53, 656 91 Brno Játra a imunitní systém Vojtěch Thon vojtech.thon@fnusa.cz Výběr 5. Fórum
Ústav klinické imunologie a alergologie LF MU, RECETOX, PřF Masarykovy univerzity, FN u sv. Anny v Brně, Pekařská 53, 656 91 Brno Játra a imunitní systém Vojtěch Thon vojtech.thon@fnusa.cz Výběr 5. Fórum
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
HIV (z klinického pohledu)
 HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
HIV (z klinického pohledu) David Jilich HIV centrum, Nemocnice Na Bulovce, Praha 11.12. 2014 Vývoj situace ve světě Changes in incidance rate 2001 to 2009 zdroj: UNAIDS Zákadní charakteristika virová infekce
Biologická terapie. Jan Krejsek. Ústav klinické imunologie a alergologie, FN a LF UK v Hradci Králové
 Biologická terapie Jan Krejsek Ústav klinické imunologie a alergologie, FN a LF UK v Hradci Králové ochrana zánět poškození vnitřní příčiny vnější příčiny narušení homeostáza obnova odstranění odstranění
Biologická terapie Jan Krejsek Ústav klinické imunologie a alergologie, FN a LF UK v Hradci Králové ochrana zánět poškození vnitřní příčiny vnější příčiny narušení homeostáza obnova odstranění odstranění
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
VZTAH DÁRCE A PŘÍJEMCE
 TRANSPLANTAČNÍ IMUNITA Transplantace je přenos buněk, tkáně nebo orgánu z jedné části těla na jinou nebo z jednoho jedince na jiného. Transplantační reakce je dána genetickými rozdíly mezi dárcem a příjemcem.
TRANSPLANTAČNÍ IMUNITA Transplantace je přenos buněk, tkáně nebo orgánu z jedné části těla na jinou nebo z jednoho jedince na jiného. Transplantační reakce je dána genetickými rozdíly mezi dárcem a příjemcem.
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Je možné zvýšit současnou účinnost biologické léčby IBD?
 Je možné zvýšit současnou účinnost biologické léčby IBD? Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE a Interní klinika UVN a 1. LF UK Praha Obsah přednášky Jaká je současná situace?
Je možné zvýšit současnou účinnost biologické léčby IBD? Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE a Interní klinika UVN a 1. LF UK Praha Obsah přednášky Jaká je současná situace?
*Lidská IgG1κ monoklonální protilátka produkovaná linií hybridomových buněk myší technologií rekombinance DNA.
 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím
 Imunodeficience. Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím Základní rozdělení imunodeficiencí Primární (obvykle vrozené) Poruchy genů kódujících
Imunodeficience. Co jsou imunodeficience? Imunodeficience jsou stavy charakterizované zvýšenou náchylností k infekcím Základní rozdělení imunodeficiencí Primární (obvykle vrozené) Poruchy genů kódujících
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Léčba juvenilní idiopatické artritidy u dětí preparáty biologické léčby v České republice
 Analytická zpráva registru k datu 25. 4. 2017 Léčba juvenilní idiopatické artritidy u dětí preparáty biologické léčby v České republice Základní přehled a hodnocení účinnosti a bezpečnosti léčby z dat
Analytická zpráva registru k datu 25. 4. 2017 Léčba juvenilní idiopatické artritidy u dětí preparáty biologické léčby v České republice Základní přehled a hodnocení účinnosti a bezpečnosti léčby z dat
Ribomunyl: mechanismus účinku(1) ZÍSKANÁ IMUNITNÍ ODPOVĚĎ PROTI VIRŮM A BAKTERIÍM. Dny
 RIBOMUNYL JE RIBOZOM-KOMPONENTNÍ TERAPEUTICKÝ PŘÍSTUP K PREVENCI OPAKOVANÝCH KTERÉ MAJÍ VYŠŠÍ POČET EPIZOD NEŽ SE OČEKÁVÁ KLINICKOU ÚČINNOSTÍ A DOBRÝM PROFILEM : mechanismus účinku(1) MEMBRÁNOVÁ FRAKCE
RIBOMUNYL JE RIBOZOM-KOMPONENTNÍ TERAPEUTICKÝ PŘÍSTUP K PREVENCI OPAKOVANÝCH KTERÉ MAJÍ VYŠŠÍ POČET EPIZOD NEŽ SE OČEKÁVÁ KLINICKOU ÚČINNOSTÍ A DOBRÝM PROFILEM : mechanismus účinku(1) MEMBRÁNOVÁ FRAKCE
Farmakokinetika. Farmakokinetika (pharmacon + kinetikos) Farmakodynamika. 26. února Popisuje osud léčiva v těle Co dělá tělo s lékem
 Ústav farmakologie LF UP v Olomouc 26. února 29 Základní pojmy (pharmacon + kinetikos) Popisuje osud léčiva v těle Co dělá tělo s lékem Základní pojmy Farmakodynamika Popisuje účinek léku na organismus
Ústav farmakologie LF UP v Olomouc 26. února 29 Základní pojmy (pharmacon + kinetikos) Popisuje osud léčiva v těle Co dělá tělo s lékem Základní pojmy Farmakodynamika Popisuje účinek léku na organismus
Diabetes mellitus 1. typu a přidružené autoimunitní choroby
 Diabetes mellitus 1. typu a přidružené autoimunitní choroby Venháčová J., Venháčová P. Diabetologické centrum Dětská klinika FN a LF UP Olomouc SRPDD červen 2011 Nejčastější přidružené autoimunitní choroby
Diabetes mellitus 1. typu a přidružené autoimunitní choroby Venháčová J., Venháčová P. Diabetologické centrum Dětská klinika FN a LF UP Olomouc SRPDD červen 2011 Nejčastější přidružené autoimunitní choroby
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida
 Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida Vstupní údaje... 1 Identifikační údaje pacienta... 1 Identifikační údaje centra... 1 Vstupní vyšetření... 2 Vstupní
Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida Vstupní údaje... 1 Identifikační údaje pacienta... 1 Identifikační údaje centra... 1 Vstupní vyšetření... 2 Vstupní
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls49563/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Kaloba Perorální kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 g (= 9,75 ml) roztoku obsahuje 8,0 g Pelargonii
sp.zn.sukls49563/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Kaloba Perorální kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 10 g (= 9,75 ml) roztoku obsahuje 8,0 g Pelargonii
Nejasnosti (omyly) v interpretaci farmakokinetiky anti-tnfa terapie
 Nejasnosti (omyly) v interpretaci farmakokinetiky anti-tnfa terapie Dana Ďuricová; ISCARE, Praha 8-9.3.2018; Hořovice Nejasnosti (omyly) v interpretaci farmakokinetiky anti-tnf Terapeutické hladiny anti-tnfa
Nejasnosti (omyly) v interpretaci farmakokinetiky anti-tnfa terapie Dana Ďuricová; ISCARE, Praha 8-9.3.2018; Hořovice Nejasnosti (omyly) v interpretaci farmakokinetiky anti-tnf Terapeutické hladiny anti-tnfa
Léčba astma bronchiale
 Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
Léčba astma bronchiale Karel Urbánek, Ústav farmakologie LF UP v Olomouc 26. října 2011 Astma Úvod 2 agonisté Xantiny Antimuskarinika Kortikoidy Stabilizátory mastocytů a antileukotrieny Astma Chronické
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE. Kateřina Kopečková FN Motol, Praha
 ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
ŽIVOTNÍ CYKLUS LÉKŮ KLINICKÉ HODNOCENÍ STUDIE Kateřina Kopečková FN Motol, Praha Klinická hodnocení LP Nedílnou součásti vývoje léčiva Navazují na preklinický výzkum Pacienti jsou subjekty hodnocení V
dnavou artritidou (GA)
 EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
EDUKAČNÍ MATERIÁLY ILARIS (kanakinumab) Průvodce pro lékaře k používání přípravku Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet. Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha
 5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
5 omylů (problémů) center BL dle revizí VZP a jak jim předcházet Martin Bortlík Klinické a výzkumné centrum pro střevní záněty ISCARE, Praha Úvod Provádění revizí je zákonnou povinností ZP ( 4 zákona č.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Sirup Kaloba 20 mg / 7,5 ml sirup je oranžový až světle hnědý viskózní sirup. Symptomatická léčba akutní bronchitidy nevyžadující antibiotickou léčbu.
 sp.zn. sukls272513/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Kaloba 20 mg / 7,5 ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 g (= 93,985 ml) sirupu obsahuje Pelargonii sidoidis
sp.zn. sukls272513/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Kaloba 20 mg / 7,5 ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 g (= 93,985 ml) sirupu obsahuje Pelargonii sidoidis
Patogeneze infekcí herpetickými viry u imunodeficientních pacientů. K.Roubalová, NRL pro herpetické viry, SZÚ, Praha
 Patogeneze infekcí herpetickými viry u imunodeficientních pacientů K.Roubalová, NRL pro herpetické viry, SZÚ, Praha Herpetické viry u imunokompetentních hostitelů Rovnovážný stav mezi virem a hostitelem
Patogeneze infekcí herpetickými viry u imunodeficientních pacientů K.Roubalová, NRL pro herpetické viry, SZÚ, Praha Herpetické viry u imunokompetentních hostitelů Rovnovážný stav mezi virem a hostitelem
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
VNL. Onemocnění bílé krevní řady
 VNL Onemocnění bílé krevní řady Změny leukocytů V počtu leukocytů Ve vzájemném zastoupení morfologických typů leukocytů Ve funkci leukocytů Reaktivní změny leukocytů Leukocytóza: při bakteriální infekci
VNL Onemocnění bílé krevní řady Změny leukocytů V počtu leukocytů Ve vzájemném zastoupení morfologických typů leukocytů Ve funkci leukocytů Reaktivní změny leukocytů Leukocytóza: při bakteriální infekci
Léčba hypertenze v těhotenství
 Léčba hypertenze v těhotenství Zelinka Tomáš III. interní klinika - klinika endokrinologie a metabolismu, 1. LF UK a VFN, Praha Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze Komplexní kardiovaskulární
Léčba hypertenze v těhotenství Zelinka Tomáš III. interní klinika - klinika endokrinologie a metabolismu, 1. LF UK a VFN, Praha Centrum pro výzkum, diagnostiku a léčbu arteriální hypertenze Komplexní kardiovaskulární
ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE
 ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE Základní funkce imunitního systému Chrání integritu organizmu proti škodlivinám zevního a vnitřního původu: chrání organizmus proti patogenním mikroorganizmům a jejich
ÚVOD DO TRANSPLANTAČNÍ IMUNOLOGIE Základní funkce imunitního systému Chrání integritu organizmu proti škodlivinám zevního a vnitřního původu: chrání organizmus proti patogenním mikroorganizmům a jejich
Přehled novinek v medikamentózní léčbě UC. Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha
 Přehled novinek v medikamentózní léčbě UC Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha JAK inhibitory (tofacitinib) Ustekinumab Obsah Anti-trafficking agents ovlivnění
Přehled novinek v medikamentózní léčbě UC Dana Ďuricová Klinické a výzkumné centrum pro střevní záněty, ISCARE IVF, a.s., Praha JAK inhibitory (tofacitinib) Ustekinumab Obsah Anti-trafficking agents ovlivnění
Kapitola III. Poruchy mechanizmů imunity. buňka imunitního systému a infekce
 Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
Kapitola III Poruchy mechanizmů imunity buňka imunitního systému a infekce Imunitní systém Zásadně nutný pro přežití Nezastupitelná úloha v obraně proti infekcím Poruchy imunitního systému při rozvoji
Příloha III. Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
Příloha III Doplnění do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto dodatky příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referral
PŘEDČASNĚ NAROZENÝCH DĚTÍ
 OČKOVÁNÍ PŘEDČASNĚ NAROZENÝCH DĚTÍ Jitka Škovránková Dětské očkovací centrum FN Motol Ve světě se doporučuje stejně očkovat nezralé jako zralé děti, přestože existují kvalitativní i kvantitativní rozdíly
OČKOVÁNÍ PŘEDČASNĚ NAROZENÝCH DĚTÍ Jitka Škovránková Dětské očkovací centrum FN Motol Ve světě se doporučuje stejně očkovat nezralé jako zralé děti, přestože existují kvalitativní i kvantitativní rozdíly
Vedolizumab v léčbě Crohnovy nemoci a ulcerózní kolitidy
 Vedolizumab v léčbě Crohnovy nemoci a ulcerózní kolitidy Prof. MUDr. Milan Lukáš, CSc. Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE Lighthouse a 1. LF UK, Praha Souhrn Lukáš M.. Remedia
Vedolizumab v léčbě Crohnovy nemoci a ulcerózní kolitidy Prof. MUDr. Milan Lukáš, CSc. Klinické a výzkumné centrum pro idiopatické střevní záněty ISCARE Lighthouse a 1. LF UK, Praha Souhrn Lukáš M.. Remedia
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
závažné revmatoidní artritidy (onemocnění, které způsobuje zánět kloubů), kdy je přípravek MabThera podáván intravenózně spolu s methotrexátem;
 EMA/614203/2010 EMEA/H/C/000165 Souhrn zprávy EPAR určený pro veřejnost rituximabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/614203/2010 EMEA/H/C/000165 Souhrn zprávy EPAR určený pro veřejnost rituximabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
Obsah 1 Úvod 2 Variabilita lékové odpovědi 3 Klinické využití určování koncentrace léčiv
 Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg.
*Lidská IgG1κ monoklonální protilátka produkovaná myší hybridomovou buněčnou linií s užitím technologie rekombinantní DNA.
 1. NÁZEV PŘÍPRAVKU Simponi 100 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 1 ml obsahuje golimumabum* 100 mg. *Lidská
1. NÁZEV PŘÍPRAVKU Simponi 100 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 1 ml obsahuje golimumabum* 100 mg. *Lidská
Zvláštní bezpečnostní informace
 Zvláštní bezpečnostní informace Edukační materiál pro lékaře Součást Plánu řízení rizik léčivého přípravku Arava Schváleno Státním ústavem pro kontrolu léčiv Zvláštní bezpečnostní informace Arava (leflunomid),
Zvláštní bezpečnostní informace Edukační materiál pro lékaře Součást Plánu řízení rizik léčivého přípravku Arava Schváleno Státním ústavem pro kontrolu léčiv Zvláštní bezpečnostní informace Arava (leflunomid),
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Humira 20 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka na jedno
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Humira 20 mg injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka na jedno
Indikace přípravku Zetamac v ordinaci praktického lékaře
 Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
Indikace přípravku Zetamac v ordinaci praktického lékaře MUDr. Igor Karen 13.10. 2009 Zetamac léková forma azithromycinum 2g granule s prodlouženým uvolňováním pro přípravu perorální suspenze s příchutí
PŘÍLOHA I. Page 1 of 5
 PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SEZNAM NÁZVŮ, LÉKOVÁ FORMA, KONCENTRACE VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU, ŽIVOČIŠNÉ DRUHY, ZPŮSOB(Y) PODÁNÍ, DRŽITEL ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH Page 1 of 5 Členský stát Žadatel
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
U pacientů s revmatoidní artritidou se po selhání léčby inhibitorem TNF-α jeví jako nejvhodnější postup podávání non-tnf biologického léku
 U pacientů s revmatoidní artritidou se po selhání léčby inhibitorem TNF-α jeví jako nejvhodnější postup podávání non-tnf biologického léku Mudr. David Suchý FN Plzeň, Oddělení klinické farmakologie Mudr.
U pacientů s revmatoidní artritidou se po selhání léčby inhibitorem TNF-α jeví jako nejvhodnější postup podávání non-tnf biologického léku Mudr. David Suchý FN Plzeň, Oddělení klinické farmakologie Mudr.
Souhrn údajů o přípravku
 Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU
 EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
Klinické hodnocení léčiv Mgr. Pavlína Štrbová, doc.mudr. Karel Urbánek, Ph.D.
 Název studijního předmětu Téma Název kapitoly Autor - autoři Klinická farmakologie pro všeobecné sestry Klinické hodnocení léčiv Mgr. Pavlína Štrbová, doc.mudr. Karel Urbánek, Ph.D. Vlastní opora: 1. Motivační
Název studijního předmětu Téma Název kapitoly Autor - autoři Klinická farmakologie pro všeobecné sestry Klinické hodnocení léčiv Mgr. Pavlína Štrbová, doc.mudr. Karel Urbánek, Ph.D. Vlastní opora: 1. Motivační
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE
 LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
LEFLUNOMID SANDOZ 20 MG INFORMAČNÍ LETÁK PRO LÉKAŘE Léčba by měla být zahájena a sledována specialistou se zkušenostmi v léčbě revmatoidní artritidy a psoriatické artritidy. Lékař by měl poučit pacienty
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
