2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
|
|
|
- Barbora Lenka Matějková
- před 6 lety
- Počet zobrazení:
Transkript
1
2 2 POKYN REG-96 PRO PŘEDKLÁDÁNÍ MOCK-UPŮ V PRAXI PharmDr. František Pavlík Oddělení koordinace registračních procedur
3 3 Obsah 1) REG-96 obecně 2) Důvody pro vydání pokynu 3) Právní předpisy 4) Kdy předkládat mock-upy 5) Jak předkládat mock-upy 6) Kritéria posuzování mock-upů 7) Předběžné posouzení mock-upů 8) Správná implementace textů obalu na mock-up
4 4 Definice mock-upu Mock-up je plnobarevný grafický návrh designu vnějšího a vnitřního obalu, ze kterého je patrná trojrozměrná prezentace textů na obalech. = artwork = MU
5 5 REG-96 obecně platnost od pro všechna podání obsahující mock-upy REG-96 verze 0 vydáno REG-96 verze 1 vydáno EN překlad vydání plánováno v průběhu roku 2019
6 6 REG-96 platí pro všechny přípravky registrované národní a MR/DC procedurou bez ohledu na způsob výdeje
7 7 REG-96 neplatí pro přípravky registrované centralizovanou procedurou souběžně dovážené přípravky cizojazyčné šarže vzorky - 33 odst. 3, písmeno h) zákona o léčivech mock-up příbalové informace není potřeba předkládat (pokud neobsahuje žádné grafické prvky)
8 8 Důvody pro vydání pokynu návod pro držitele rozhodnutí o registraci ulehčení orientace v problematice předkládání a v pravidlech posuzování mock-upů mock-upy jsou součástí registrační dokumentace zaměření na ochranu veřejného zdraví, bezpečnost pacientů a legislativní požadavky zajištění snadné a jednoznačné identifikace přípravků (předcházení medication errors)
9 9 Právní předpisy Zákon č. 378/2007 Sb., zákon o léčivech Vyhláška č. 228/2008 Sb., registrační vyhláška Guideline on the Readability of the Labelling and Package Leaflet of medicinal products for human use a další Pokyn má doporučující charakter. Obsah pokynu vychází mimo jiné z požadavků legislativy a pokynů EMA, které jsou právně závazné.
10 10 KDY PŘEDKLÁDAT MOCK-UPY?
11 11 Nová registrace 1) Národní procedura součást předložené dokumentace (modul 1.3.2) lze předložit až v hodnotící fázi (závazek ve validační fázi) připomínky součástí přílohy výzvy k odstranění nedostatků žádosti (hodnotící zpráva)
12 12 2) MR/DC procedura: Common mock-upy součást předložené dokumentace (modul 1.3.2) lze předložit až v hodnotící fázi (závazek ve validační fázi) CZ mock-upy do 5 dnů po EoP Pokud nejsou k dispozici: Ústav již neakceptuje závazek o předložení mock-upů 3 měsíce před uvedením přípravku na trh posouzení common MU
13 13 Po zaregistrování Ústav již neakceptuje předložení mock-upů em v rámci dříve poskytnutých závazků v národní fázi registrace. Varianta 1: CZ mock-upy přesně odpovídají common MU po grafické stránce (grafika, velikost, typ a umístění textu) s CZ textem odpovídajícím schválenému obalu tyto MU nutno zaslat na mock-upy@sukl.cz nejpozději 3 měsíce před uvedením na trh
14 14 Po zaregistrování Varianta 2: CZ mock-upy se budou po grafické stránce lišit od common MU (např.: grafické prvky, barva písma, velikost, typ a umístění textu) nutno předložit změnu designu mock-upů
15 15 Převod registrace v AF je nutno zaškrtnout jednu z následujících možností: a) prohlášení, že mock-upy se ke dni schválení převodu registrace nemění MU nejsou předloženy v rámci dokumentace
16 16 Převod registrace Po převodu: MU nutno předložit 3 měsíce před uvedením LP na trh, a to buď em na mock-upy@sukl.cz (pokud se oproti původním MU nemění design), nebo změnou designu MU Ústav již neakceptuje předložení mock-upů em v rámci dříve poskytnutých závazků při převodu registrace.
17 17 Převod registrace v AF je nutno zaškrtnout jednu z následujících možností: b) předložení mock-upů v podobě, ve které má být přípravek po uskutečnění převodu registrace uváděn na trh MU jsou předloženy a podléhají hodnocení (připomínky zasílány em, případně výzvou)
18 18 Prodloužení platnosti registrace MU nemusí být součástí předložené dokumentace pokud budou předloženy podléhají standardnímu hodnocení
19 19 Změny registrace MU je nutné předkládat v rámci běžícího řízení, nikoliv až po jeho ukončení MU jsou předkládány v modulu pokud je v dokumentaci předkládán mock-up, musí být zaškrtnuta příslušná část formuláře žádosti
20 20
21 21 1) Změna designu mock-upů vždy při změně designu obalu oproti předchozí schválené verzi např. změna barvy, změna velikosti písma, přidání/odebrání symbolů a piktogramů, přeskupení textu apod. národní změna v označení na obalu nebo příbalové informaci, která nesouvisí s SmPC, tzv. změna typu P dle čl. 61(3) směrnice 2001/83/ES popřípadě IB, klasifikace A.z present (doporučeno) a proposed verze na nutnost předložení změny se lze dotázat na ové adrese: mock-upy@sukl.cz
22 22 2) Změna MU v důsledku jiných změn v registraci Změny při kterých lze předložit MU: změna velikosti balení přidání multipacku změna názvu LP výrazná úprava plného označení LP např. nově či jinak vyjádřená síla nebo LF, úprava názvu změna většího rozsahu v textech obalu pozn.: MU může být vyžádán
23 23 2) Změna MU v důsledku jiných změn v registraci Změny při kterých je předložení MU vyžadováno: přidání nového druhu obalu změna způsobu výdeje změna z homeopatika bez indikací na homeopatikum s indikacemi přidání upozornění/varování na obal (např. warning box ) změna počtu jazyků na obalu
24 24 JAK PŘEDKLÁDAT MOCK-UPY?
25 25 formát:.pdf (.jpg;.doc) z MU je zřejmá velikost obalu a písma MU je předkládán pro každý schválený typ (vnější, vnitřní obal) a druh (např. lahvička, blistr) obalu, který bude obchodován tj. vnější obal včetně multipacků a všechny druhy vnitřního obalu
26 26 MU je předkládán pro každé registrační číslo, a to pro nejmenší velikost balení, která bude obchodována Následné uvádění menší velikosti balení: změna typu P pouze v případě ovlivnění čitelnosti textových údajů na obalu Následné uvádění větší velikosti balení: není potřeba mock-upy předkládat Výjimka: přípravky, kdy je síla vyjádřena jako koncentrace, ale jednotlivá balení se liší celkovým obsahem léčivé látky je potřeba předložit MU pro každou velikost balení, která bude obchodována
27 27 KRITÉRIA POSUZOVÁNÍ MOCK-UPŮ
28 28 Plné označení léčivého přípravku je zásadní pro snadnou a jednoznačnou identifikaci přípravku název léčivého přípravku (běžný/smyšlený) včetně případných přívlastků vyjádření síly včetně jednotek léková forma
29 29 Požadavky na prezentaci plného označení LP: 1) všude kompletní (název je vždy následován silou a LF) nemusí být uvedeno na jednom řádku 2) ve správném pořadí (není mezi nimi vložen žádný jiný text) v souladu s bodem 1 obalu
30 30 Požadavky na prezentaci plného označení LP: 3) dostatečné velikosti (výrazněji než ostatní údaje) musí zaujímat na MU prominentní pozici - tzn. takovou, na které bude toto označení jasně viditelné
31 31 Požadavky na prezentaci plného označení LP: 4) dostatečně čitelné grafické prvky nesmí zasahovat do plného označení, pokud nepříznivě ovlivní viditelnost, čitelnost, nebo je navzájem opticky oddělí
32 32 Požadavky na prezentaci plného označení LP: 4) dostatečně čitelné zvýrazňování některých písmen názvu velkým nebo jinak barevným písmem NE pokud zhorší čitelnosti, nebo je evidentně prvek reklamního charakteru název LP má být uveden celý velkými písmeny (MEDICIN) nebo s velkým písmenem jen na začátku (Medicin) LZE: Medicin NELZE: MediCin MEDICIN
33 33 Požadavky na prezentaci plného označení LP: 4) dostatečně čitelné NE ozdobné písmo font musí být snadno čitelný
34 34 Požadavky na prezentaci plného označení LP: 5) shodně orientované v jednom zorném poli jsou orientovány buď horizontálně nebo vertikálně není možné například uvádět název vertikálně a současně sílu s LF horizontálně je možné například na jednu stranu krabičky uvést plné označení LP horizontálně a na druhou stranu vertikálně
35 35 Doporučení na prezentaci plného označení LP: 6) mělo by být uvedeno na třech neprotilehlých stranách
36 36 Ostatní důležité údaje Léčivá látka v případě smyšleného názvu má být uvedena přímo za plným označením přípravku minimálně jednou (na přední straně)
37 37 Ostatní důležité údaje Léčivá látka v případě běžného názvu není potřeba uvádět přímo za plným označením přípravku
38 38 Ostatní důležité údaje Celkový obsah balení zvláště u přípravků, kdy je síla vyjádřena jako koncentrace (odlišení jednotlivých velikostí balení)
39 39 Ostatní důležité údaje Zásadní bezpečnostní informace výrazněji, než ostatní údaje na prominentní pozici např.: warning box, jiná textová upozornění
40 40 Ostatní důležité údaje Pomocné látky s vlivem na organismus pouze při změnách složení zvýraznění konkrétní látky na obalu minimálně po dobu souběhu
41 41 Velikost a čitelnost písma minimálně 7 bodů, nebo takové, kde má písmeno x výšku alespoň 1,4 mm dostatečně čitelná a kontrastní oproti pozadí musí být ponechán prostor pro čitelný záznam o předepsaném dávkování
42 42 Odlišení přípravků Odlišení sil barvou/velikostí fontu/ zejména u rizikových přípravků
43 43 Odlišení přípravků Odlišení lékových forem Příklady: nosní kapky/nosní sprej infuzní roztok/koncentrát
44 44 Odlišení přípravků Odlišení velikostí balení zejména u přípravků, kdy je síla vyjádřena jako koncentrace
45 45 Odlišení přípravků Odlišení velikostí balení zejména u přípravků, kdy je síla vyjádřena jako koncentrace
46 46 Velikost balení optické oddělení od ostatních údajů
47 47 Velikost balení Doporučení: možné zvýraznit pouze číslovku na 3 neprotilehlých stranách
48 48 Grafické prvky, symboly, piktogramy Mohou být na obalu uvedeny za následujících podmínek: musí být v souladu s SmPC musí být užitečné pro pacienta nesmí být reklamního charakteru nesmí být zavádějící, nesrozumitelné, klamavé nesmí narušovat čitelnost povinně uváděných údajů
49 49 Akceptovatelné grafické prvky - příklady Léková forma musí odpovídat bodu 3 SmPC schematicky nebo formou reálného vzhledu SmPC bod 3: čirý bezbarvý až slabě nažloutlý roztok
50 50 Akceptovatelné grafické prvky - příklady Léková forma musí odpovídat bodu 3 SmPC schematicky nebo formou reálného vzhledu SmPC bod 3: bílé tablety ve tvaru tobolky, na jedné straně s půlicí rýhou
51 51 Akceptovatelné grafické prvky - příklady Aplikační pomůcky pouze pokud jsou přímo součástí balení musí odpovídat bodu 6.5 SmPC Vnitřní obal může být zobrazen druh vnitřního obalu
52 52 Akceptovatelné grafické prvky - příklady Návod pro správné a bezpečné používání přípravku např. vyjímání tablet z blistrů musí být zcela jednoznačné a srozumitelné pokud jsou uvedeny v textech obalů, použijí se na MU v identickém vyobrazení
53 53 Akceptovatelné grafické prvky - příklady Ilustrace indikace a místa podání musí přesně odpovídat informacím o přípravku musí být jednoznačné a srozumitelné není možné graficky zobrazovat pouze vybrané indikace (místa podání) Indikace: krátkodobá symptomatická léčba mírných až středně silných bolestí, jako je bolest zubů, bolest hlavy, nebo v důsledku menších zranění a/nebo horečky
54 54 Akceptovatelné grafické prvky - příklady Příchuť LP musí být v souladu s SmPC Symboly pro dobu podání musí odpovídat indikacím a dávkování v SmPC
55 55 Akceptovatelné grafické prvky - příklady Recyklační symboly řídí se zákonem o obalech, uvádění je dobrovolné legislativní povinnost uvádění jiných symbolů (např. symbol pro radioaktivitu) neuvádět symbol postavy s odpadkovým košem
56 56 Akceptovatelné grafické prvky - příklady Logo MAH musí odpovídat skutečnému držiteli rozhodnutí o registraci, popř. nadřazené skupině či lokálnímu zástupci držitele (NE distributor) nenarušuje viditelnost a čitelnost jiných údajů nelze ho zaměnit za název přípravku
57 57 Akceptovatelné grafické prvky - příklady Ochranné známky, TM plně v kompetenci a odpovědnosti žadatele/držitele rozhodnutí o registraci neuvádí se v textech obalu
58 58 Akceptovatelné grafické prvky - příklady Nekonkrétní grafické prvky nemají konkrétní význam nesmí negativně ovlivňovat viditelnost a čitelnost textových údajů mohou sloužit k odlišení sil nebo lékových forem
59 59 Neakceptovatelné grafické prvky - příklady 1) nemají souvislost s informacemi o přípravku 2) jsou reklamního charakteru
60 60 Neakceptovatelné grafické prvky - příklady 3) jsou zavádějící, klamavé např.: selektivní zdůrazňování indikací, státní vlajky, atd. 4) jsou nesrozumitelné 5) narušující čitelnost
61 61 Braillovo písmo na MU je třeba zobrazit umístění i konkrétní znaky Braillova písma zápis dle bodu 16 textu obalu
62 62 Použitelnost + číslo šarže uvozovací výrazy dle přílohy č. IV QRD šablony uvozovací výrazy se musí použít vždy, a to i v případě malých vnitřních obalů či blistrů uvozovací výrazy musí být umístěny tak, aby bylo zcela zřejmé, ke kterému údaji se vztahují
63 63 Použitelnost + číslo šarže v případě, že jsou uvozovací výrazy na obal doplněny až při výrobě, musí být na MU vyznačeno, kde se budou údaje nacházet a v jakém konkrétním znění
64 64 Kódy na MU Mezinárodně uznávaný identifikační standard odpovídá mu EAN kód či 2D kód na MU postačuje, aby bylo zobrazeno pouze umístění daného kódu samotný kód by neměl být narušován jinými čárami (například ohraničením rámečkem)
65 65 Kódy na MU Ochranné prvky na MU postačuje, aby bylo zobrazeno pouze umístění ochranných prvků
66 66 Kódy na MU QR kódy na MU musí být patrné umístění QR kódu v jeho reálné velikosti QR kód lze umístit i na vnitřní straně víčka/klopy obalu vedle samotného QR kódu musí být zobrazena také URL adresa
67 67 Kódy na MU SÚKL kód na obalu přípravku musí být uveden SÚKL kód doporučujeme před číselný kód uvádět uvozovací výraz SÚKL kód SÚKL kód ani uvozovací výraz se neuvádí v textech obalu SÚKL kód není součástí jedinečného identifikátoru (UI)
68 68 Blistry údaje na blistrech mají být tištěny vícenásobně a nepravidelně až do vyjmutí poslední dávky musí údaje zůstat čitelné a dostupné pacientovi
69 69 Blistry jednodávkové blistry - všechny údaje musí být uvedeny na každém jednotlivém dílku Jak poznat jednodávkový blistr? bod 4 obalu: 20 x 1 tableta bod 6.5 SmPC: 20 x 1 tableta v Al/PVC perforovaném jednodávkovém blistru
70 70 Vícejazyčné obaly Údaje ve všech jazycích musí být: dostatečně čitelné shodné (u národně registrovaných přípravků nutno předložit prohlášení) Zavedení při registraci nebo národní změnou typu P Změna počtu jazyků národní změna typu P Změna jazyka (CZ, SK CZ, PL) informace na mock-upy@sukl.cz
71 71 Předběžné posouzení MU pouze formou žádosti o konzultaci poskytnutou Sekcí registrací SÚKL (Scientific Advice) lze posoudit až 3 různé návrhy pro 1 přípravek žádosti se zasílají na adresu posta@sukl.cz vyřízení zpravidla do 30 dní (platí pro písemnou SA)
72 72 Soulad s texty na obalu musí být vždy plně v souladu s aktuálními schválenými texty obalu plně v zodpovědnosti držitele rozhodnutí o registraci SÚKL se zaměřuje pouze na kontrolu základních textových údajů uvedených na MU
73 73 SPRÁVNÁ IMPLEMENTACE TEXTŮ OBALU NA MOCK-UP
74 74 Implementace textů obalu na MU obecně nadpisy jednotlivých bodů QRD šablony: o pokud jsou na MU uvedeny, je nutné nadpis podle QRD šablony použít celý a nezkrácený o v případě uvedení zkráceného nadpisu na MU je nutné tento zkrácený text uvést také přímo do příslušného bodu textu obalu některé body obalu je vhodné na MU uvádět vícenásobně (např. bod 1 název léčivého přípravku a bod 4 obsah balení ) ostatní údaje obvykle stačí uvést na MU pouze jednou
75 75 název je vždy následován silou a lékovou formou nemusí vždy následovat na plným označením LP
76 76
77 77 nemusí být uvedeno, pokud je již v bodě 1 (musí ale být zvýrazněné šedivě) opticky oddělené od ostatního textu, uvádět na více stranách
78 78 body doplněny pouze pro úplnost, obvykle se na MU uvádí pouze jednou
79 79 Možné varianty (s dvojtečkou či bez): EXP: Použitelné do Použitelné do:
80 80 body doplněny pouze pro úplnost, obvykle se na MU uvádí pouze jednou
81 81
82 82
83 83 Možné varianty (s dvojtečkou či bez): LOT č.š. Č. šarže
84 84 na MU nelze uvádět pouze některé z indikací
85 85 kompletní text může být uveden buď ve větě, nebo v odrážkách
86 86 plné znění indikace musí být ponecháno jak v textech obalu, tak na MU zkrácené znění musí být uvedeno i v textech obalu, pokud je použito na MU
87 87 postačuje zobrazit umístění
88 88 postačuje zobrazit umístění
89 89 DOTAZY
90 90 Děkuji za pozornost STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, Praha 10 tel.: fax:
NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ
 1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ
 1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
1 NÁVRH POKYNU PRO PŘEDKLÁDÁNÍ MOCK-UPŮ PharmDr. František Pavlík 2 Obsah 1) Důvody pro vydání pokynu 2) Právní předpisy 3) Kdy a jak předkládat mock-upy 4) Kritéria posuzování mock-upů 5) Předběžné posouzení
Obaly léčivých přípravků a co na nich SÚKL posuzuje
 1 Obaly léčivých přípravků a co na nich SÚKL posuzuje PharmDr. František Pavlík 2 Právní předpisy Zákon č. 378/2007 Sb., zákon o léčivech Vyhláška č. 228/2008 Sb., registrační vyhláška Pokyny Evropské
1 Obaly léčivých přípravků a co na nich SÚKL posuzuje PharmDr. František Pavlík 2 Právní předpisy Zákon č. 378/2007 Sb., zákon o léčivech Vyhláška č. 228/2008 Sb., registrační vyhláška Pokyny Evropské
REG XX verze 1. Požadavky na předkládání grafických návrhů obalů (mock-upů) léčivých přípravků
 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 REG XX verze 1 Požadavky na předkládání grafických návrhů
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 REG XX verze 1 Požadavky na předkládání grafických návrhů
Pokyn k předkládání mock-upů platí pro všechny léčivé přípravky registrované národní a MR/DC procedurou, a to bez ohledu na způsob výdeje.
 REG-96 verze 0 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
REG-96 verze 0 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
Pokyn k předkládání mock-upů platí pro všechny léčivé přípravky registrované národní a MR/DC procedurou, a to bez ohledu na způsob výdeje.
 REG-96 verze 1 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
REG-96 verze 1 Požadavky na předkládání grafických návrhů obalů léčivých přípravků (mock-upů) Tento pokyn je platný od 1.4.2019 pro všechna podání obsahující mock-upy. Obsah: 1. Právní předpisy a související
Příprava artworků pro obaly a PIL v registračním řízení
 Příprava artworků pro obaly a PIL v registračním řízení MUDr. Jana Doksanská, MCO Regulatory Affairs Head CZ&SK, sanofi-aventis, s.r.o., Praha 1 Agenda Legislativní rámec a lokální požadavky Terminologie,
Příprava artworků pro obaly a PIL v registračním řízení MUDr. Jana Doksanská, MCO Regulatory Affairs Head CZ&SK, sanofi-aventis, s.r.o., Praha 1 Agenda Legislativní rámec a lokální požadavky Terminologie,
2015 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 16.6./
 1 Změny v označení na obalu a v PIL, které nesouvisí s SmPC (oznámení dle čl. 61(3) Směrnice) 2 ZMĚNY V OZNAČENÍ NA OBALU A V PIL, KTERÉ NESOUVISEJÍ S SmPC (OZNÁMENÍ DLE ČL. 61(3) SMĚRNICE) Bc. Tereza
1 Změny v označení na obalu a v PIL, které nesouvisí s SmPC (oznámení dle čl. 61(3) Směrnice) 2 ZMĚNY V OZNAČENÍ NA OBALU A V PIL, KTERÉ NESOUVISEJÍ S SmPC (OZNÁMENÍ DLE ČL. 61(3) SMĚRNICE) Bc. Tereza
STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY
 1 STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY Ing. Anna Ondruchová Sekce registrací Struktura názvů LP dle REG-29 verze 4 a její praktické dopady 2 Obsah: REG-29 verze 4 Nové registrace
1 STRUKTURA NÁZVŮ LP DLE REG-29 VERZE 4 A JEJÍ PRAKTICKÉ DOPADY Ing. Anna Ondruchová Sekce registrací Struktura názvů LP dle REG-29 verze 4 a její praktické dopady 2 Obsah: REG-29 verze 4 Nové registrace
Registrační dokumentace
 Registrační dokumentace Ing. Alena Pýchová 1 Úvod registrační dokumentace se předkládá ve formátu CTD povinný pro všechny typy procedur v rámci EU CTD určuje formát, v jakém májí být předložená data, ale
Registrační dokumentace Ing. Alena Pýchová 1 Úvod registrační dokumentace se předkládá ve formátu CTD povinný pro všechny typy procedur v rámci EU CTD určuje formát, v jakém májí být předložená data, ale
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Implementace ochranných prvků MUDr. Jitka Vokrouhlická Sekce registrací 3 Ochranné prvky Ochranné prvky (OP) = safety features (SF) Jedinečný identifikátor = unique identifier (UI) Prostředek k ověření
2 Implementace ochranných prvků MUDr. Jitka Vokrouhlická Sekce registrací 3 Ochranné prvky Ochranné prvky (OP) = safety features (SF) Jedinečný identifikátor = unique identifier (UI) Prostředek k ověření
Ochranné prvky z pohledu registrace a časté dotazy
 1 Ochranné prvky z pohledu registrace a časté dotazy Ing. Marcela Beková 2 Obsah Legislativa kde jsme nyní Pro jaké LP jsou ochranné prvky (UI/ATD) povinné Implementace UI Implementace ATD Obal přípravku
1 Ochranné prvky z pohledu registrace a časté dotazy Ing. Marcela Beková 2 Obsah Legislativa kde jsme nyní Pro jaké LP jsou ochranné prvky (UI/ATD) povinné Implementace UI Implementace ATD Obal přípravku
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM A VNITŘNÍM OBALU VNĚJŠÍ OBAL - KRABIČKA NA BLISTRY/NA LAHVIČKU VNITŘNÍ OBAL ŠTÍTEK NA LAHVIČKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU EFECTIN ER 37,5 mg 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM A VNITŘNÍM OBALU VNĚJŠÍ OBAL - KRABIČKA NA BLISTRY/NA LAHVIČKU VNITŘNÍ OBAL ŠTÍTEK NA LAHVIČKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU EFECTIN ER 37,5 mg 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna
Obsahuje monohydrát laktózy. Pro více informací čtěte příbalovou informaci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička GLYMEXAN 1 mg 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje glimepiridum1 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje monohydrát laktózy. Pro více informací
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička GLYMEXAN 1 mg 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tableta obsahuje glimepiridum1 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje monohydrát laktózy. Pro více informací
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 potahovaná tableta obsahuje: bromelaina 90 mg (odp.: 450 F.I.P.-j.) trypsinum 48 mg (odp.: 24 µkat) rutosidum trihydricum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 potahovaná tableta obsahuje: bromelaina 90 mg (odp.: 450 F.I.P.-j.) trypsinum 48 mg (odp.: 24 µkat) rutosidum trihydricum
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 QR KÓDY Ing. Marcela Poláková Oddělení koordinace registrací CMDh POSITION PAPER ON THE USE OF QR CODES TO PROVIDE INFORMATION ABOUT THE MEDICINAL PRODUCT (CMDh/313/2014, Rev0) minimální požadavky (možnosti
QR KÓDY Ing. Marcela Poláková Oddělení koordinace registrací CMDh POSITION PAPER ON THE USE OF QR CODES TO PROVIDE INFORMATION ABOUT THE MEDICINAL PRODUCT (CMDh/313/2014, Rev0) minimální požadavky (možnosti
Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
 ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
ÚDAJE ÚVÁDĚNÉ NA VNĚJŠÍM A VNITŘNÍM OBALU Krabička na blistry 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol Actavis 250 mg Paracetamol Actavis 500 mg Paracetamol Actavis 1000 mg potahované tablety paracetamolum
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 12./
 1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
1 2 MARKET REPORT a ČINNOSTI K ZAJIŠTĚNÍ DOSTUPNOSTI LÉČIVÝCH PŘÍPRAVKŮ PharmDr. Jakub Velík / Ing. Michaela Kosová, Ph.D. oddělení koordinace odborných činností 3 Obsah Agenda KOČ Role SÚKL při zajišťování
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Omeprazol Dr.Max 10 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 20 mg enterosolventní tvrdé tobolky Omeprazol Dr.Max 40 mg enterosolventní
Jedna tableta s prodlouženým uvolňováním obsahuje quetiapinum 50 mg (ve formě quetiapini fumaras).
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU papírová krabička pro blistry 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna tableta s prodlouženým uvolňováním obsahuje 50 mg (ve formě quetiapini fumaras). 3. SEZNAM POMOCNÝCH LÁTEK
Texty SmPC a PIL jak s nimi po novu
 Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
Státní ústav pro kontrolu léčiv [ 1 ] Texty SmPC a PIL jak s nimi po novu Jitka Vokrouhlická [ 2 ] Obsah Novela ZoL Co se mění v souvislosti s texty? Nová QRD šablona a její implementace Nejčastější problémy
Uchovávejte při teplotě do 25 C v dobře uzavřené lahvičce, lahvičku uchovávejte v krabičce, aby byl přípravek chráněn před světlem a vlhkostí.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička (lahvička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibalgin 400 potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Ibuprofenum 400 mg v 1 potahované tabletě.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička (lahvička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibalgin 400 potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Ibuprofenum 400 mg v 1 potahované tabletě.
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 GROUPING ZMĚN WORKSHARING ZMĚN Ing. Pavla Rakušanová Oddělení koordinace registrací 3 OSNOVA: Grouping změn IA (IA IN ) Grouping změn IB, II Grouping změn IB, II - pro více LP Worksharing Grouping vs.
2 GROUPING ZMĚN WORKSHARING ZMĚN Ing. Pavla Rakušanová Oddělení koordinace registrací 3 OSNOVA: Grouping změn IA (IA IN ) Grouping změn IB, II Grouping změn IB, II - pro více LP Worksharing Grouping vs.
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 9.6.2016 KONZULTACE POSKYTOVANÉ SEKCÍ REGISTRACÍ MUDr. Radka Montoniová Sekce registrací 3 Obsah: Odborné konzultace vs. Clarification meeting Odborné konzultace Jak
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 9.6.2016 KONZULTACE POSKYTOVANÉ SEKCÍ REGISTRACÍ MUDr. Radka Montoniová Sekce registrací 3 Obsah: Odborné konzultace vs. Clarification meeting Odborné konzultace Jak
IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ
 1 IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ Ing. Irena Lukáčová Oddělení administrativní podpory 2 Obsah Implementace jednotného hodnocení PSUR Základní pojmy Legislativa
1 IMPLEMENTACE JEDNOTNÉHO HODNOCENÍ PSUR A DALŠÍ AKTUALITY VE ZMĚNÁCH REGISTRACÍ Ing. Irena Lukáčová Oddělení administrativní podpory 2 Obsah Implementace jednotného hodnocení PSUR Základní pojmy Legislativa
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obaly na tablety se 400 mg potahovanými tabletami 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 400 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ FORMA
Požadavky na farmaceutickou dokumentaci
 1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
1 Požadavky na farmaceutickou dokumentaci Druhá část Ing. Lucie Zmatlíková Oddělení posuzování farmaceutické dokumentace 2 Obsah prezentace Žádost o klinické hodnocení (Clinical Trial Application Form)
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ACC LONG šumivá tableta acetylcysteinum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (PRO TUBU) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá látka: 600 mg v jedné šumivé tabletě. 3. SEZNAM POMOCNÝCH LÁTEK Pomocné látky:
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (PRO TUBU) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá látka: 600 mg v jedné šumivé tabletě. 3. SEZNAM POMOCNÝCH LÁTEK Pomocné látky:
Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace
 Státní ústav pro kontrolu léčiv [ 1 ] Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace Jitka Vokrouhlická Obsah [ 2 ] Referral procedura Referraly podle článku 107i,
Státní ústav pro kontrolu léčiv [ 1 ] Referraly podle článků 30, 31 a 107i Směrnice 2001/83/EC a jejich národní implementace Jitka Vokrouhlická Obsah [ 2 ] Referral procedura Referraly podle článku 107i,
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Papírová krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 enterosolventmí tableta obsahuje: pancreatinum trypsinum chymotrypsinum bromelaina papainum amylasum lipasum rutosidum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Papírová krabička 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1 enterosolventmí tableta obsahuje: pancreatinum trypsinum chymotrypsinum bromelaina papainum amylasum lipasum rutosidum
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
Jak vyhledávat v databázi léků.
 Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
Jak vyhledávat v databázi léků www.sukl.cz Kde najít databázi léků? Databázi léků naleznete na webové stránce Státního ústavu pro kontrolu léčiv www.sukl.cz na titulní straně v levém sloupci (viz obr.
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 3.12.2013/5.12.2013 Žádosti o změny v registraci podané po 4. 8. 2013 u národně registrovaných léčivých přípravků 2 JAK PŘIPRAVIT KVALITNÍ TEXTY PRO PŘEDKLÁDANOU ŽÁDOST
2013 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 3.12.2013/5.12.2013 Žádosti o změny v registraci podané po 4. 8. 2013 u národně registrovaných léčivých přípravků 2 JAK PŘIPRAVIT KVALITNÍ TEXTY PRO PŘEDKLÁDANOU ŽÁDOST
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obal na tablety se 400 mg potahovanými tabletami 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibuprofen Dr.Max 400 mg potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Obal na tablety se 400 mg potahovanými tabletami 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ibuprofen Dr.Max 400 mg potahované tablety ibuprofenum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Kartonová krabice (skleněné/polyethylenové lahve) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabice (skleněné/polyethylenové lahve) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 1000 ml infuzního roztoku obsahuje: 55,0 g (odpovídá Glucosum 50,0 g) Energetická hodnota
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠNÍM OBALU A VNITŘNÍM OBALU Obal na tablety 15, 30, 40, 60 a 90 tablet 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna žvýkací tableta obsahuje: Calcium 1000 mg (jako calcii carbonas) Vitamin
ÚDAJE UVÁDĚNÉ NA VNĚJŠNÍM OBALU A VNITŘNÍM OBALU Obal na tablety 15, 30, 40, 60 a 90 tablet 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna žvýkací tableta obsahuje: Calcium 1000 mg (jako calcii carbonas) Vitamin
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 DOKUMENTACE V ectd FORMÁTU A JEJÍ VYUŽITÍ PRO REGISTRAČNÍ SŘ Ing. Petr Drbohlav Business analytik PROGRAM PREZENTACE Program přednášky Formát ectd dokumentace a jeho využití pro registrační SŘ Obecné informace
DOKUMENTACE V ectd FORMÁTU A JEJÍ VYUŽITÍ PRO REGISTRAČNÍ SŘ Ing. Petr Drbohlav Business analytik PROGRAM PREZENTACE Program přednášky Formát ectd dokumentace a jeho využití pro registrační SŘ Obecné informace
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA Pro dospělé a dospívající od 14 let 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna šumivá tableta obsahuje acetylcysteinum 600 mg. 3. SEZNAM POMOCNÝCH LÁTEK Obsahuje
Datum předložení návrhu skupině odborníků z GS1 ČR, SÚKL Červen a srpen 2017
 Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum 1,2 I.U a. proteasum 0,24 I.U)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU IRUXOL Mono mast Collagenasum 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU IRUXOL Mono mast Collagenasum 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: 1 g masti obsahuje collagenasum 0,48-3,00 mg (to odp.. collagenasum
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
2018 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 2 Hlášení závad v jakosti léčivých přípravků u distributorů Mgr. Eva Komrsková SÚKL 3 OBSAH I. Hlášení závad v jakosti léčivých přípravků u distributorů Závada v jakosti Legislativa Jak nahlásit závadu
1 2 Hlášení závad v jakosti léčivých přípravků u distributorů Mgr. Eva Komrsková SÚKL 3 OBSAH I. Hlášení závad v jakosti léčivých přípravků u distributorů Závada v jakosti Legislativa Jak nahlásit závadu
FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ
 1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
1 FARMACEUTICKÁ DOKUMENTACE VÝROBA A DOVOZ LÉČIVÝCH PŘÍPRAVKŮ ZNAČENÍ OBALŮ Ing. Lucie Zmatlíková Ing. Dagmar Pospíšilová FARMACEUTICKÁ DOKUMENTACE 2 Kapitola IV Dokumentace k žádosti Dokumentace k žádosti
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
Jak vyhledávat v databázi léků. www.olecich.cz
 Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní nabídka
Značení hodnocených léčivých přípravků první zkušenosti s praxí
 Státní ústav pro kontrolu léčiv [ 1 ] Značení hodnocených léčivých přípravků první zkušenosti s praxí Oddělení posuzování farmaceutické dokumentace [ 2 ] Obsah prezentace Legislativní základ Požadavky
Státní ústav pro kontrolu léčiv [ 1 ] Značení hodnocených léčivých přípravků první zkušenosti s praxí Oddělení posuzování farmaceutické dokumentace [ 2 ] Obsah prezentace Legislativní základ Požadavky
Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU
 Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU Praha, 26.dubna 2017 MUDr. Jaroslava Rezková 1 Obsah Legislativní rámec v ČR a EU Implementace povinností ze zákona Pozice,
Aktuální informace z oblasti registrace léčiv a přehled legislativy v ČR a EU Praha, 26.dubna 2017 MUDr. Jaroslava Rezková 1 Obsah Legislativní rámec v ČR a EU Implementace povinností ze zákona Pozice,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna potahovaná tableta obsahuje atorvastatinum 40 mg (jako atorvastatinum calcicum trihydricum).
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na obal na tablety 2. OBSAH LÉČIVÉ LÁTKY Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg (jako calcicum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na obal na tablety 2. OBSAH LÉČIVÉ LÁTKY Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg (jako calcicum
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 16.6./
 1 2 INFORMACE O VÝVOJI NOVÉHO NASTAVENÍ V POSUZOVÁNÍ NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ A SOUČASNÁ PRAXE Mgr. Martina Wagenknechtová, Ing. Anna Ondruchová Oddělení koordinace registrací Kontaktní adresa: nazvy@sukl.cz
1 2 INFORMACE O VÝVOJI NOVÉHO NASTAVENÍ V POSUZOVÁNÍ NÁZVŮ LÉČIVÝCH PŘÍPRAVKŮ A SOUČASNÁ PRAXE Mgr. Martina Wagenknechtová, Ing. Anna Ondruchová Oddělení koordinace registrací Kontaktní adresa: nazvy@sukl.cz
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV X. konference Rizika v činnostech farmaceutické společnosti 2 AKTUALITY ZE SEKCE REGISTRACÍ PharmDr. Zdeněk Blahuta Špindlerův Mlýn 18.5.2015 2012 STÁTNÍ ÚSTAV PRO
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV X. konference Rizika v činnostech farmaceutické společnosti 2 AKTUALITY ZE SEKCE REGISTRACÍ PharmDr. Zdeněk Blahuta Špindlerův Mlýn 18.5.2015 2012 STÁTNÍ ÚSTAV PRO
ZNAČENÍ HODNOCENÝCH LÉČIVÝCH PŘÍPRAVKŮ
 1 ZNAČENÍ HODNOCENÝCH LÉČIVÝCH PŘÍPRAVKŮ Ing. Tereza Stefflová, Ing. Ivana Pravdová Seminář SÚKL, Praha ZNAČENÍ HODNOCENÝCH LÉČIVÝCH PŘÍPRAVKŮ / Obsah 2 Obsah: Legislativní základ Požadavky na značení
1 ZNAČENÍ HODNOCENÝCH LÉČIVÝCH PŘÍPRAVKŮ Ing. Tereza Stefflová, Ing. Ivana Pravdová Seminář SÚKL, Praha ZNAČENÍ HODNOCENÝCH LÉČIVÝCH PŘÍPRAVKŮ / Obsah 2 Obsah: Legislativní základ Požadavky na značení
2016 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Závady v jakosti a padělky 2 Závady v jakosti a padělky Mgr. Eva Komrsková SÚKL Závady v jakosti a padělky 3 OBSAH PREZENTACE Stahování z důvodu závady v jakosti Definice závady v jakosti Legislativa Klasifikace
Závady v jakosti a padělky 2 Závady v jakosti a padělky Mgr. Eva Komrsková SÚKL Závady v jakosti a padělky 3 OBSAH PREZENTACE Stahování z důvodu závady v jakosti Definice závady v jakosti Legislativa Klasifikace
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 Padělky léčivých přípravků Kde jsme a kam směřujeme MUDr. Jana Mladá Sekce registrací 3 Obsah: Základní informace Padělková směrnice (Falsified Medicines Directive) Časový průběh Cíle a rozsah Ochranné
2 Padělky léčivých přípravků Kde jsme a kam směřujeme MUDr. Jana Mladá Sekce registrací 3 Obsah: Základní informace Padělková směrnice (Falsified Medicines Directive) Časový průběh Cíle a rozsah Ochranné
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. BALENÍ 30 mg/ 5 ml
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU BALENÍ 30 mg/ 5 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Jedna 5 ml lahvička obsahuje 30 mg 3. SEZNAM POMOCNÝCH LÁTEK Také obsahuje: Glyceromakrogol-ricinoleát
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ 7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTON 50 x 50 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Voda na injekci Viaflo 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Aqua pro injectione 100% w/v 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTON 50 x 50 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Voda na injekci Viaflo 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Aqua pro injectione 100% w/v 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml
 OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
Jak vyhledávat v databázi léků
 Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Obr. 1 Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní
Jak vyhledávat v databázi léků www.olecich.cz Kde najít databázi léků? Obr. 1 Databázi léků naleznete na webové adrese Informačního portálu pro veřejnost www.olecich.cz. První rychlou volbou je hlavní
Léčivé látky: sojae oleum raffinatum 82,95 g, lauromacrogolum 400 15,00 g ve 100 g roztoku
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU (Sojae oleum raffinatum, Lauromacrogolum 400) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivé látky: sojae oleum raffinatum 82,95 g, lauromacrogolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU (Sojae oleum raffinatum, Lauromacrogolum 400) 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivé látky: sojae oleum raffinatum 82,95 g, lauromacrogolum
Datum předložení návrhu skupině odborníků z GS1 ČR, SÚKL Červen a srpen 2017 verze 1 Listopad 2017 verze 2
 Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Ochranné prvky pro humánní léčivé přípravky Otázky a odpovědi Tento dokument obsahuje často kladené otázky a odpovědi týkající se implementace pravidel o ochranných prvcích pro humánní léčivé přípravky,
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv
![[ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv [ 1 ] MUDr. Ivana Koblihová 2009 Státní ústav pro kontrolu léčiv](/thumbs/92/109768502.jpg) [ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
[ 1 ] [ 2 ] OTC s omezením nová kategorie léčivých přípravků Ivana Koblihová, MUDr. Náměstek ředitele pro odborné činnosti Obsah prezentace [ 3 ] Co znamená OTC s omezením? Obecné možnosti omezení a z
Jak vylepšit předkládanou farmaceutickou dokumentaci
 Státní ústav pro kontrolu léčiv [ 1 ] Jak vylepšit předkládanou farmaceutickou dokumentaci Oddělení posuzování farmaceutické dokumentace [ 2 ] Nejčastější nedostatky Formulář žádosti Srovnávací tabulky
Státní ústav pro kontrolu léčiv [ 1 ] Jak vylepšit předkládanou farmaceutickou dokumentaci Oddělení posuzování farmaceutické dokumentace [ 2 ] Nejčastější nedostatky Formulář žádosti Srovnávací tabulky
5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK 5 ml připravené suspenze obsahuje azithromycinum 200 mg ve formě azithromycinum dihydricum 3. SEZNAM
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
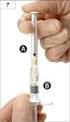 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTONOVÁ KRABICE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna transdermální náplast 5 cm 2 o obsahu rivastigminum 9 mg, ze které se uvolní 4,6
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KARTONOVÁ KRABICE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna transdermální náplast 5 cm 2 o obsahu rivastigminum 9 mg, ze které se uvolní 4,6
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
Edukační materiály EDUKAČNÍ MATERIÁLY NOVÁ VERZE POKYNU PHV-7 VERZE 1 MVDr. Kristýna Králová Seminář Aktuality ve farmakovigilanci, SÚKL Edukační materiály Aktualizace pokynu PHV-7 zjednodušení spolupráce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 10 ML. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Sativex oromucosal spray Orální sprej
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 10 ML 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Sativex oromucosal spray 2. OBSAH LÉČIVÝCH LÁTEK Jeden mililitr obsahuje: 38-44 mg Cannabinis sativae folii cum flore extractum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 10 ML 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Sativex oromucosal spray 2. OBSAH LÉČIVÝCH LÁTEK Jeden mililitr obsahuje: 38-44 mg Cannabinis sativae folii cum flore extractum
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 2 ZMĚNOVÝ WORKSHARING Ing. Pavla Rakušanová Oddělení koordinace registrací 16.6 / 17.6.2015 Není Worksharing jako Worksharing Worksharing = dělba práce ASMF WS PSUR WS Pediatrický WS Změnový WS OSNOVA:
2 ZMĚNOVÝ WORKSHARING Ing. Pavla Rakušanová Oddělení koordinace registrací 16.6 / 17.6.2015 Není Worksharing jako Worksharing Worksharing = dělba práce ASMF WS PSUR WS Pediatrický WS Změnový WS OSNOVA:
Jedna potahovaná tableta obsahuje metformini hydrochloridum 850 mg, což odpovídá metforminum 662,9 mg.
 ÚDAJE UVÁDÉNÉ NA VNÉJŚÍM OBALU KRABIČKA PRO BLISTER 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 850 mg, což odpovídá metforminum 662,9 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
ÚDAJE UVÁDÉNÉ NA VNÉJŚÍM OBALU KRABIČKA PRO BLISTER 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 850 mg, což odpovídá metforminum 662,9 mg. 3. SEZNAM POMOCNÝCH LÁTEK 4. LÉKOVÁ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
Nemocniční výjimka pokyn UST-37
 1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
1 Nemocniční výjimka pokyn UST-37 2 Právní rámec Zákon č. 378/2007 Sb., o léčivech a změnách některých souvisejících zákonů (zákon o léčivech), ve znění pozdějších předpisů Vyhláška č. 228/2008 Sb., o
ÚSKVBL/INS 01/2017. Pokyn Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv. Datum vydání: Platnost od: 1.12.
 Stránka 1 z 7 ÚSKVBL/INS 01/2017 Pokyn Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv Požadavky na provádění přebalování veterinárních léčivých Datum vydání: 20.11.2017 Platnost od: 1.12.2017
Stránka 1 z 7 ÚSKVBL/INS 01/2017 Pokyn Ústavu pro státní kontrolu veterinárních biopreparátů a léčiv Požadavky na provádění přebalování veterinárních léčivých Datum vydání: 20.11.2017 Platnost od: 1.12.2017
Trihydrát octanu sodného Kyselina octová Chlorid sodný Hydroxid sodný a/nebo kyselina chlorovodíková pro úpravu ph Voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU VAK 250 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Brevibloc 10 mg/ml infuzní roztok Esmololi hydrochloridum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml obsahuje 10 mg esmololi hydrochloridum
ŽÁDOST O ZMĚNU REGISTRACE. Bc. Tereza Havelková Oddělení administrativní podpory
 2 ŽÁDOST O ZMĚNU REGISTRACE Bc. Tereza Havelková Oddělení administrativní podpory 3 OSNOVA: Nový formulář žádosti a požadavky na formát dokumentace První strana žádosti druh registrace a změny Typ změny
2 ŽÁDOST O ZMĚNU REGISTRACE Bc. Tereza Havelková Oddělení administrativní podpory 3 OSNOVA: Nový formulář žádosti a požadavky na formát dokumentace První strana žádosti druh registrace a změny Typ změny
Jeden sáček obsahuje 5 g sacharosy a 118 mg sodíku. Obsahuje zdroj fenylalaninu. Obsahuje oranžovou žluť (E110) a azorubin (E122).
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro perorální roztok Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro perorální roztok Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum
REGISTRAČNÍ AKTUALITY
 1 REGISTRAČNÍ AKTUALITY PRODLOUŽENÍ, DUPLIKÁTY, DCP SLOTY, SUNSET CLAUSE, DOPRODEJ PO ZMĚNĚ REGISTRACE Ing. Irena Lukáčová 2 Obsah Nové postupy pro prodloužení platnosti registrace Termín předložení Případy
1 REGISTRAČNÍ AKTUALITY PRODLOUŽENÍ, DUPLIKÁTY, DCP SLOTY, SUNSET CLAUSE, DOPRODEJ PO ZMĚNĚ REGISTRACE Ing. Irena Lukáčová 2 Obsah Nové postupy pro prodloužení platnosti registrace Termín předložení Případy
Návrhy textů a údajů na obalech v češtině
 Návrhy textů a údajů na obalech v češtině Údaje uváděné na vnějším obalu nebo na vnitřním obalu, pokud vnější obal neexistuje 10 litrů 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Medicinální oxid dusný SIAD, medicinální
Návrhy textů a údajů na obalech v češtině Údaje uváděné na vnějším obalu nebo na vnitřním obalu, pokud vnější obal neexistuje 10 litrů 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Medicinální oxid dusný SIAD, medicinální
2012 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 10.6./
 1 2 POVINNOSTI DRŽITELE A POZNÁMKY K MODULU 3 Mgr. Iva STRNADOVÁ Oddělení posuzování farmaceutické dokumentace 3 Kapitoly 1. Povinnosti držitele a nedostatky v předkládané dokumentaci 2. Modul 3 3.2.S
1 2 POVINNOSTI DRŽITELE A POZNÁMKY K MODULU 3 Mgr. Iva STRNADOVÁ Oddělení posuzování farmaceutické dokumentace 3 Kapitoly 1. Povinnosti držitele a nedostatky v předkládané dokumentaci 2. Modul 3 3.2.S
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky
 PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky Platnost od: 3.7.2014 Pokyn blíže vymezuje pojmy, definuje obsah a upravuje podmínky poskytování informací
PHV-8 Požadavky SÚKL k vytváření, obsahu a distribuci Informačních dopisů pro zdravotnické pracovníky Platnost od: 3.7.2014 Pokyn blíže vymezuje pojmy, definuje obsah a upravuje podmínky poskytování informací
POŽADAVKY NA FARMACEUTICKOU
 POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI 1 POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI Ing. Ivana Pravdová, Ing. Tereza Stefflová Seminář SÚKL, Praha POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI / Obsah 2 Obsah:
POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI 1 POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI Ing. Ivana Pravdová, Ing. Tereza Stefflová Seminář SÚKL, Praha POŽADAVKY NA FARMACEUTICKOU DOKUMENTACI / Obsah 2 Obsah:
[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv
![[ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv [ 1 ] RNDr. Olga Hanzlíčková 2012 Státní ústav pro kontrolu léčiv](/thumbs/93/112264798.jpg) [ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
[ 1 ] Státní ústav pro kontrolu léčiv [ 2 ] Návrh novely zákona č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů vedoucí sekce DOZ [ 3 ] Směrnice Evropského parlamentu a Rady 2010/84/EU
Hydroxid sodný, hyetelóza, karbomer, propylenglykol, střední nasycené triacylglyceroly, propylenparaben, methylparaben, čištěná voda.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Diclofenacum natricum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden gram u obsahuje diclofenacum natricum 10 mg (1%). 3. SEZNAM POMOCNÝCH
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Diclofenacum natricum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden gram u obsahuje diclofenacum natricum 10 mg (1%). 3. SEZNAM POMOCNÝCH
2015 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV
 1 PSUR/PSUSA 2 PSUR/PSUSA MUDr. Petra Kaftanová PSUR/PSUSA obsah prezentace 3 Obsah prezentace PSUR/PSUSA EURD list PSUR repository PSUR/PSUSA - legislativní rámec 4 Legislativní rámec Nařízení Evropského
1 PSUR/PSUSA 2 PSUR/PSUSA MUDr. Petra Kaftanová PSUR/PSUSA obsah prezentace 3 Obsah prezentace PSUR/PSUSA EURD list PSUR repository PSUR/PSUSA - legislativní rámec 4 Legislativní rámec Nařízení Evropského
DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ
 1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
1 DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ MUDr. Alice Němcová Oddělení klinického hodnocení, Sekce registrací DISTRIBUCE NEREGISTROVANÝCH LÉČIVÝCH PŘÍPRAVKŮ 2 Obsah prezentace: Pravidla distribuce
VNĚJŠÍ NÁLEPKY NA KARTONECH Obsahuje jednu dávku o dvou sáčcích A a dvou sáčcích B (jedna dávka o čtyřech sáčcích).
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ NÁLEPKY NA KARTONECH Obsahuje jednu dávku o dvou sáčcích A a dvou sáčcích B (jedna dávka o čtyřech sáčcích). 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ NÁLEPKY NA KARTONECH Obsahuje jednu dávku o dvou sáčcích A a dvou sáčcích B (jedna dávka o čtyřech sáčcích). 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
Regulace vstupu, cen a úhrad originálních biologických přípravků a biosimilars
 1 Regulace vstupu, cen a úhrad originálních biologických přípravků a biosimilars Mgr. Irena Storová, MHA 2 Definice biosimilars Biosimilars - biologicky podobný léčivý přípravek, který byl vyvinut tak,
1 Regulace vstupu, cen a úhrad originálních biologických přípravků a biosimilars Mgr. Irena Storová, MHA 2 Definice biosimilars Biosimilars - biologicky podobný léčivý přípravek, který byl vyvinut tak,
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Paracetamol/Guaifenesin/Phenylephrine Hydrochloride Perrigo 500mg/200mg/10mg, prášek pro perorální roztok paracetamolum, guaifenesinum,
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU (BOX) DOLGIT KRÉM, KRABIČKA 50 g
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU (BOX) DOLGIT KRÉM, KRABIČKA 50 g 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK 100 g krému obsahuje 5g ibuprofenu v olejově vodní emulzi. 3. SEZNAM POMOCNÝCH LÁTEK
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU (BOX) DOLGIT KRÉM, KRABIČKA 50 g 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK 100 g krému obsahuje 5g ibuprofenu v olejově vodní emulzi. 3. SEZNAM POMOCNÝCH LÁTEK
PŘED POUŽITÍM SI PŘEČTĚTE PŘÍBALOVOU INFORMACI. COLDREX MAXGRIP CITRON je určený pro perorální podání ve formě teplého nápoje.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro přípravu perorálního roztoku Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (krabička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU prášek pro přípravu perorálního roztoku Paracetamolum, Phenylephrini hydrochloridum, Acidum ascorbicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH
6 ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička,, ext 5 ks 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Léčivé látky: Natrii hyaluronas 2,0 mg, Sulfadiazinum argenteum 40 mg ve 1 g krému. makrogol 4000,
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička,, ext 5 ks 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK Léčivé látky: Natrii hyaluronas 2,0 mg, Sulfadiazinum argenteum 40 mg ve 1 g krému. makrogol 4000,
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE SKLÁDAČKA TEXT 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Humulin R Cartridge, injekční roztok v zásobní vložce Insulinum humanum biosyntheticum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE SKLÁDAČKA TEXT 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Humulin R Cartridge, injekční roztok v zásobní vložce Insulinum humanum biosyntheticum
2019 STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 12.6./
 1 Brexit 2 BREXIT MUDr. Tomáš Boráň Ředitel sekce registrací Brexit 3 Obsah Brexit vývoj situace Lex Brexit Připravenost SÚKL Otázky a odpovědi k Brexitu Informace k Brexitu Výhled do budoucna Brexit 4
1 Brexit 2 BREXIT MUDr. Tomáš Boráň Ředitel sekce registrací Brexit 3 Obsah Brexit vývoj situace Lex Brexit Připravenost SÚKL Otázky a odpovědi k Brexitu Informace k Brexitu Výhled do budoucna Brexit 4
Požadavky státního dozoru na uživatele in vitro diagnostik
 Požadavky státního dozoru na uživatele in vitro diagnostik STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 Ing. Hýbler Jaroslav - Odd. kontroly ZP 14. 2. 2006 - seminář 1 Osnova Legislativní
Požadavky státního dozoru na uživatele in vitro diagnostik STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV Šrobárova 48, 100 41 PRAHA 10 Ing. Hýbler Jaroslav - Odd. kontroly ZP 14. 2. 2006 - seminář 1 Osnova Legislativní
