Sp.zn. sukls68449/2011 a k sukls163114/2012, sukls13116/2012, sukls121125/2012, sukls158173/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Karolína Beranová
- před 9 lety
- Počet zobrazení:
Transkript
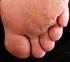
1 Sp.zn. sukls68449/2011 a k sukls163114/2012, sukls13116/2012, sukls121125/2012, sukls158173/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETESIL 2,250 mg léčivá náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna léčivá náplast o rozměru 7,5 cm x 10 cm obsahuje: betamethasoni valeras 2,250 mg (odpovídá betamethasonum 1,845 mg). Pomocné látky se známým účinkem: Methylparaben (2,250 mg), propylparaben (1,125 mg). Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Léčivá náplast. Bezbarvá náplast. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace BETESIL je indikován k léčbě dospělých. Léčba zánětlivých kožních chorob, které nereaguj na léčbu méně účinnými kortikosteroidy, jako je ekzém, lichenifikace, lichen planus, granuloma annulare, palmoplantární pustulózy a mycosis fungoides. Vzhledem k jeho zvláštní lékové formě je BETESIL ideální pro léčbu psoriatických plaků lokalizovaných v obtížně léčitelných oblastech, (např. kolena, lokty a přední strana tibie na oblasti, která nepřesahuje 5 % tělesného povrchu). 4.2 Dávkování a způsob podání Dávkování Léčivá náplast se aplikuje na oblast kůže, která má být léčena, jednou denně. Nepřekračujte maximální denní dávku šesti léčivých náplastí a maximální dobu léčby 30 dnů. Nová léčivá náplast musí být aplikována každých 24 hodin. Je také doporučeno, aby se mezi jednotlivými aplikacemi ponechala doba minimálně 30 minut. Jakmile je dosaženo znatelného zlepšení, je možné přerušit aplikaci a pokračovat v léčbě s možností použití méně účinného kortikosteroidu. Pediatrická populace Bezpečnost a účinnost přípravku BETESIL nebyla prokázána u dětí mladších 18 let. 1
2 Způsob podání Opatření, která mají být přijata před manipulací nebo aplikací léčivého přípravku Před každou aplikací očistěte a pečlivě vysušte oblast, která má být léčena, aby léčivá náplast přilnula dobře ke kůži. Otevřete sáček obsahující léčivou náplast a je-li to nutné, náplast zastřihněte, aby její rozměr odpovídal léčené oblasti. Odtrhněte ochrannou vrstvu a adhezívní léčivou část přiložte na příslušnou oblast. Jakákoli nespotřebovaná část náplasti má být vrácena zpět do sáčku, aby mohla být použita při další aplikaci (viz bod 6.3). Léčivá náplast nesmí být odstraněna a znovu použita. Po aplikaci léčivé náplasti nesmí kůže přijít do styku s vodou. Doporučuje se, aby se pacient mezi jednotlivými aplikacemi vykoupal nebo vysprchoval. Pokud je dále léčivá náplast aplikována na částečně pohyblivé části (např. loket nebo koleno) a její okraje se začnou odlepovat, doporučuje se aplikovat lepicí pásky pro zajištění náplastí, které jsou součástí balení léčivého přípravku. Léčivou náplast nikdy nepřekrývejte celou oklusivním materiálem nebo obvazem. 4.3 Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Kožní forma tuberkulózy a virové kožní infekce (včetně vaccinia pustul, herpes zoster a herpes simplex). Exsudativní léze a primární kožní infekce vyvolané plísněmi nebo bakteriemi. Akné, akné rosacea, periorální dermatitida, vředy na kůži, popáleniny a omrzliny. Neaplikujte přípravek na obličej. Přípravek se nepoužívá u pacientů do 18 let věku. 4.4 Zvláštní upozornění a opatření pro použití Použití lokálních kortikosteroidů na velkých plochách těla a po delší dobu a rovněž použití oklusivního krytí může obecně vyvolat dočasné potlačení hypotalamo-hypofyzární osy, což vede k sekundárnímu hypoadrenalismu a adrenálnímu hyperkortikalismu včetně Cushingova syndromu. V těchto situacích má být léčba postupně a pod přísnou kontrolou lékaře vysazována vzhledem k riziku akutní adrenální insuficience. Náhlé vysazení léčby u pacientů s lupénkou může také vést k příznakům exacerbace nebo generalizované pustulózní formy psoriázy. Prodloužené používání přípravku BETESIL u difúzní formy psoriázy (kromě léčby izolovaných plaků) nebo difuzního ekzému nebo aplikace na léze lokalizované v kožních záhybech nejsou doporučeny, protože tyto stavy mohou zvyšovat systémovou absorpci. Použití okluzívních obvazů, zejména s plastickým materiálem, může tento účinek zvýšit. Symptomy jsou následující: zarudnutí v obličeji, změny v hmotnosti (nárůst tuku na těle a v obličeji a ztráta na nohách a pažích), načervenalé pruhy na břichu, bolest hlavy, změny v menstruaci nebo nežádoucí ochlupení v obličeji a na těle. V této souvislosti je známo, že určité kožní oblasti (obličej, oční víčka, podpažní jamky, kůže hlavy a šourek) absorbují snadněji než ostatní (kůže na kolenou, loktech, dlaních a ploskách nohy). Aplikace lokálních přípravků, zvláště je-li prodloužená, může vyvolat reakce z přecitlivělosti. Po léčbě trvající tři týdny byla také zaznamenána kožní atrofie. V případě nesnášenlivosti léčivého přípravku, když se například v průběhu léčby objeví podráždění kůže nebo kontaktní dermatitida, je nutné ukončit aplikaci léčivé náplasti a zahájit vhodnou léčbu (viz bod 4.8 Nežádoucí účinky). Kortikosteroidy mohou ovlivňovat výsledky testu pomocí nitrotetrazoliové modři (NBT) pro diagnostiku bakteriálních infekcí tak, že budou získány falešně negativní výsledky. Léčivé přípravky obsahující kortikosteroidy musí být používány s opatrností u pacientů s poruchou funkce imunitního systému (T-lymfocyty) nebo u pacientů užívajících imunosupresívní léčbu. Přípravek obsahuje methylparaben a propylparaben, které mohou vyvolat reakce z přecitlivělosti (mohou být zpožděné). 2
3 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nebyly provedeny žádné studie interakcí. Není známo, že lokálně podávaný betamethason valerát vyvolává v doporučených dávkách klinicky významné lékové interakce. Přípravek BETESIL neprokázal významnou systémovou absorpci betamethason valerátu. 4.6 Fertilita, těhotenství a kojení Těhotenství Místní podávání kortikosteroidů březím laboratorním zvířatům může narušit dozrávání plodu. Význam těchto preklinických údajů pro člověka nebyl posuzován: U těhotných žen však steroidy nesmějí být místně aplikovány na velkých plochách kůže, zejména pak ve velkém množství po dlouhé časové období. Tento léčivý přípravek lze proto používat pouze v případě potřeby a pod přímým lékařským dohledem, na základě posouzení skutečného přínosu pro matku a zvážení případných rizik pro plod a po pečlivém stanovení doby léčby a velikosti plochy ošetřované kůže. Kojení Systémové kortikosteroidy jsou vylučovány do mateřského mléka. Není známo, zda do mateřského mléka přechází lokálně podávané kortikosteroidy. Lokální kortikosteroidy mají být tudíž používány s opatrností také u kojících matek a nemají být aplikovány na prsy. 4.7 Účinky na schopnost řídit a obsluhovat stroje Přípravek BETESIL nemá žádný vliv na schopnost řídit nebo obsluhovat stroje. 4.8 Nežádoucí účinky Často hlášenými nežádoucími účinky jsou poruchy kůže a podkožní tkáně, které se vyskytují přibližně u 15 % léčených pacientů. Tyto nežádoucí účinky jsou způsobeny hlavně farmakologickým účinkem léčivého přípravku. V místě aplikace náplasti dochází k místním účinkům na kůži. Nebyly pozorovány žádné systémové účinky. V průběhu kontrolovaných klinických studií byly pozorovány následující nežádoucích reakce: Hlášené nežádoucí reakce byly klasifikovány podle jejich výskytu následujícím způsobem: velmi časté ( 1/10); časté ( 1/100, <1/10); méně časté ( 1/1 000, <1/100); vzácné ( 1/10 000, <1/1 000); velmi vzácné (<1/10 000) včetně výjimečných případů. Všechny zaznamenané případy byly považovány za časté. V každé skupině jsou uvedené nežádoucí účinky seřazeny sestupně podle závažnosti. Poruchy kůže a podkožní tkáně Časté Atrofie kůže Teleangiektázie Pustuly Papuly Furunkl Erytém Pruritus Kožní eroze Mezi další nežádoucí účinky, které nebyly pozorovány u přípravku BETESIL, ale jsou často hlášeny u lokálních kortikosteroidů, patří: kontaktní dermatitida, přecitlivělost, otok, purpura, atrofické strie, suchá 3
4 kůže, odlupování kůže, fragilita kapilár, podráždění kůže, hypertrichóza, hyperestézie, periorální dermatitida, pocit pálení nebo napnutí, folikulitida a hypopigmentace kůže. Použití lokálních kortikosteroidů na velkých plochách těla a po delší dobu a rovněž použití oklusivního krytí může obecně vyvolat dočasné potlačení osy hypotalamus-hypofýza-dřeň nadledvin, což vede k sekundárnímu hypoadrenalismu a adrenálnímu hyperkortikalismu včetně Cushingova syndromu. V těchto situacích má být léčba postupně a pod přísnou kontrolou lékaře vysazována vzhledem k riziku akutní adrenální insuficience. Náhlé přerušení léčby u pacientů s lupénkou může také vést k příznakům exacerbace či generalizované pustulózní psoriázy (viz bod 4.4 Zvláštní upozornění a zvláštní opatření pro použití). Vzácně byly pozorovány reakce z přecitlivělosti na oklusivní plastový materiál. 4.9 Předávkování Žádné případy akutního předávkování nebyly hlášeny. Vzhledem k vlastnostem přípravku a způsobu podání je výskyt příznaků a známek předávkování kortikosteroidy nepravděpodobný. Prodloužené používání lokálních kortikosteroidů však může vyvolat dočasné potlačení osy hypotalamushypofýza-dřeň nadledvin, což vede k sekundárnímu hypoadrenalismu. Příznaky adrenálního hyperkortikalismu spontánně odezní a jejich léčba je symptomatická. Pokud to bude nutné, je třeba obnovit rovnováhu tekutin a elektrolytů. V případě chronické toxicity odstraňte pomalu kortikosteroid z organismu. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Kortikosteroid, dermatologikum: kortikosteroidy (skupina III). ATC kód: D07AC01. Betamethason valerát pro lokální podání je účinný v léčbě dermatózy, která reaguje na kortikosteroidy v důsledku svého protizánětlivého, antipruriginózního a vasokonstrikčního účinku. 5.2 Farmakokinetické vlastnosti Kortikosteroidy aplikované na kůži jsou hlavně zadržovány v epidermis a pouze malá část dosáhne škáry, kde může dojít k jejich absorpci. Vyšší absorpci však může podporovat několik faktorů: lokalizace a plocha kůže, která má být léčena, typ léze, doba trvání léčby a jakékoli oklusivní krytí. Ve srovnávací studii provedené u zdravých dobrovolníků, kterým bylo aplikováno 6 léčebných náplastí nebo odpovídající množství krému během 21 po sobě jdoucích dnů, byly měřené hladiny betametasonu (BM) v krvi po 4 a 21 dnech měřitelné u 11 ze 17 osob ve skupině léčebných náplastí a u 4 z 10 osob ve skupině krému (LOQ=50 pg/ml). Pokud byly měřitelné, byly hladiny BM v krvi u subjektů, které dostaly léčebné náplasti, mírně vyšší ve srovnání se subjekty, kterým byl aplikován krém. Tento rozdíl však neměl ve smyslu systémové expozice žádný dopad na funkci osy HPA, protože jak 24hodinový profil kortizolu tak zvýšení kortizolu po ACTH stimulačním testu, které byly hodnoceny u těchto stejných subjektů, se nezměnily po 4 nebo 21 dnech léčby v porovnání s výchozím stavem. Betamethason valerát je hlavně metabolizován v játrech, kde dochází k jeho inaktivaci. Pak je konjugován v játrech a ledvinách se sulfátem nebo kyselinou glukouronovou a vylučován v močí. 5.3 Předklinické údaje vztahující se k bezpečnosti Neexistují žádné významné údaje z předklinických studií, které by byly klinicky závažné, než ty které již byly uvedeny v jiných částech souhrnu údajů o přípravku. 4
5 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Náplast: netkaná látka (polypropylen/polyethylen a vlákna umělého hedvábí) pokrytá filmem z akrylátového kopolymeru. Adhezívní vrstva: Natrium-hyaluronát, butandiol, glycerol, dinatrium edetát, kyselina vinná, dihydroxyaluminium-glycinát, kyselina polyakrylová, natrium polyakrylát, hyprolosa, sodná sůl karmelosy, methylparaben (E 218), propylparaben (E 216), čištěná voda. Ochranný film: pegoteratová fólie. 6.2 Inkompatibility Neuplatňuje se. 6.3 Doba použitelnosti 3 roky. Po otevření sáčku: 1 měsíc. 6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 C. Léčivou náplast uchovávejte v původním sáčku, aby nedošlo k jejímu poškození. Podmínky uchovávání léčivého přípravku po prvním otevření, viz bod Druh obalu a velikost balení Papírová krabička: 4 léčivé náplasti / 8 léčivých náplastí / 16 léčivých náplastí Každá léčivá náplast je balena jednotlivě v sáčku, který je složen z papíru/polyethylenu/hliníku/akrylátového kopolymeru. Každá krabička obsahuje lepicí pásky pro zajištění náplastí (zdravotnický prostředek). Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku Použité léčivé náplasti nesmí být odhazovány do toalet. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI IBSA Slovakia s.r.o., Bratislava, Slovenská republika 8. REGISTRAČNÍ ČÍSLO 46/439/06-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE / DATUM REVIZE TEXTU 5
6
Každá léčivá náplast o rozměru 7,5 cm x 10 cm obsahuje: 2,250 mg betamethasoni valeras (odpovídá 1,845 mg betamethasonu).
 1. NÁZEV PŘÍPRAVKU BETESIL 2,250 mg léčivá náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá léčivá náplast o rozměru 7,5 cm x 10 cm obsahuje: 2,250 mg betamethasoni valeras (odpovídá 1,845 mg betamethasonu).
1. NÁZEV PŘÍPRAVKU BETESIL 2,250 mg léčivá náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá léčivá náplast o rozměru 7,5 cm x 10 cm obsahuje: 2,250 mg betamethasoni valeras (odpovídá 1,845 mg betamethasonu).
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Alclometasoni dipropionas 0,5 mg (odpovídá 0,392 mg alklometasonu) v 1 g masti.
 sp.zn. sukls104332/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AFLODERM mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Alclometasoni dipropionas 0,5 mg (odpovídá 0,392 mg alklometasonu) v 1 g masti.
sp.zn. sukls104332/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AFLODERM mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Alclometasoni dipropionas 0,5 mg (odpovídá 0,392 mg alklometasonu) v 1 g masti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diprosalic Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Diprosalic obsahuje betamethasoni dipropionas 0,64 mg (odpovídá betamethasonum 0,5
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Diprosalic Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Diprosalic obsahuje betamethasoni dipropionas 0,64 mg (odpovídá betamethasonum 0,5
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls164200/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls164200/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU BELODERM Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Betamethasoni dipropionas
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls164200/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 1. NÁZEV PŘÍPRAVKU BELODERM Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Betamethasoni dipropionas
Jeden gram masti obsahuje mometasoni furoas 1 mg a acidum salicylicum 50 mg.
 1. NÁZEV PŘÍPRAVKU Momesalic 1 mg/g + 50 mg/g mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje mometasoni furoas 1 mg a acidum salicylicum 50 mg. Pomocná látka se známým účinkem:
1. NÁZEV PŘÍPRAVKU Momesalic 1 mg/g + 50 mg/g mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje mometasoni furoas 1 mg a acidum salicylicum 50 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU. BELOGENT mast 0,5 mg/g + 1 mg/g
 sp.zn. sukls145537/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BELOGENT mast 0,5 mg/g + 1 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje betamethasoni dipropionas 0,64 mg (odpovídá
sp.zn. sukls145537/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BELOGENT mast 0,5 mg/g + 1 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram masti obsahuje betamethasoni dipropionas 0,64 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden gram gelu obsahuje calcipotriolum 50 mikrogramů (jako monohydrát) a betamethasonum 0,5 mg (jako dipropionát).
 Sp.zn.sukls13650/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Xamiol 50 mikrogramů/g + 0,5 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje calcipotriolum 50 mikrogramů (jako
Sp.zn.sukls13650/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Xamiol 50 mikrogramů/g + 0,5 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje calcipotriolum 50 mikrogramů (jako
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls167886/2014 a k sp.zn. sukls13649/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Daivobet gel 50 mikrogramů/g + 0,5 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje calcipotriolum
Sp.zn. sukls167886/2014 a k sp.zn. sukls13649/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Daivobet gel 50 mikrogramů/g + 0,5 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje calcipotriolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls103137/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole Grindeks 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
sp.zn. sukls103137/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ketoconazole Grindeks 20 mg/g šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls56804/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DETRALEX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Flavonoidorum fractio purificata micronisata 500 mg: Diosminum 450 mg,
sp.zn. sukls56804/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DETRALEX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Flavonoidorum fractio purificata micronisata 500 mg: Diosminum 450 mg,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta Agnucastonu obsahuje:
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta Agnucastonu obsahuje:
sp.zn. sukls176806/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Alpicort 2 mg/ml + 4 mg/ml Kožní roztok
 sp.zn. sukls176806/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Alpicort 2 mg/ml + 4 mg/ml Kožní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: prednisolon a kyselina salicylová 100 ml
sp.zn. sukls176806/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Alpicort 2 mg/ml + 4 mg/ml Kožní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: prednisolon a kyselina salicylová 100 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls51947/2012 a sp.zn.: sukls80411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 75 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml kožního roztoku obsahuje povidonum
sp.zn.: sukls51947/2012 a sp.zn.: sukls80411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETADINE 75 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml kožního roztoku obsahuje povidonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
sp.zn. sukls171755/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VIKLAREN 10 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g gelu obsahuje10 mg diclofenacum natricum. Úplný seznam pomocných látek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls235526/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Skinoren krém 200 mg/g 2. Kvalitativní a kvantitativní složení Jeden gram krému obsahuje acidum azelaicum 200 mg. Pomocné látky se známým
sp.zn. sukls235526/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku Skinoren krém 200 mg/g 2. Kvalitativní a kvantitativní složení Jeden gram krému obsahuje acidum azelaicum 200 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls221245/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INDOCOLLYRE 0,1% oční kapky Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Jeden ml obsahuje indometacinum
sp.zn.: sukls221245/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INDOCOLLYRE 0,1% oční kapky Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Jeden ml obsahuje indometacinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls97487/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 1,0 g ve 100 g gelu (1%) Úplný seznam pomocných
sp.zn.sukls97487/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum 1,0 g ve 100 g gelu (1%) Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls179582/2010 a sp.zn. sukls251297/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocné látky
sp.zn. sukls179582/2010 a sp.zn. sukls251297/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rozex krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g krému obsahuje metronidazolum 0,75 g. Pomocné látky
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Picato, 150 mikrogramů/g gel 2. KVALITATIVNÍ A KVANITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje ingenoli mebutas 150 μg. Jedna tuba obsahuje ingenoli
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Picato, 150 mikrogramů/g gel 2. KVALITATIVNÍ A KVANITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje ingenoli mebutas 150 μg. Jedna tuba obsahuje ingenoli
Aciclovir AL krém 50 mg/g
 sp.zn. sukls88130/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aciclovir AL krém 50 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje aciclovirum 50mg. Pomocné látky se známým
sp.zn. sukls88130/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aciclovir AL krém 50 mg/g 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje aciclovirum 50mg. Pomocné látky se známým
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Léčivá látka: 100 ml roztoku obsahuje chlorhexidini digluconas 0,2 g, jako chlorhexidini digluconatis solutio 1 ml ve 100 ml roztoku.
 sp.zn. sukls108682/2012 a sp.zn. sukls64237/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Corsodyl 2 mg/ml Roztok pro ústní výplach 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 ml roztoku
sp.zn. sukls108682/2012 a sp.zn. sukls64237/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Corsodyl 2 mg/ml Roztok pro ústní výplach 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 100 ml roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 3. LÉKOVÁ FORMA Kožní sprej, roztok. Čirá, bezbarvá tekutina bez viditelných částeček, zapáchající po isopropylalkoholu.
 sp.zn. :sukls129584/2012 a sp.zn.:sukls 130459/2012 Strana: 1 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canifug-Lösung 1% kožní sprej, roztok clotrimazolum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
sp.zn. :sukls129584/2012 a sp.zn.:sukls 130459/2012 Strana: 1 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canifug-Lösung 1% kožní sprej, roztok clotrimazolum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna odměřená dávka obsahuje beclometasoni dipropionas 200 mikrogramů, odpovídá podané dávce 180 mikrogramů.
 sp.zn.: sukls82311/2009 a sp.zn.: sukls83302/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Beclomet Easyhaler 200 mikrogramů Prášek k inhalaci 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna odměřená
sp.zn.: sukls82311/2009 a sp.zn.: sukls83302/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Beclomet Easyhaler 200 mikrogramů Prášek k inhalaci 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jedna odměřená
Souhrn údajů o přípravku
 sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
sp.zn. sukls22891/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 500, čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: jeden čípek obsahuje mesalazinum 500 mg Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 500 mg oxerutinum (O-beta-hydroxyetyl-rutosidy).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 500 mg oxerutinum (O-beta-hydroxyetyl-rutosidy). Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VENORUTON FORTE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 500 mg oxerutinum (O-beta-hydroxyetyl-rutosidy). Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls133539/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORTRANS, prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Macrogolum
sp.zn. sukls133539/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FORTRANS, prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Macrogolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls212715/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duphalac se švestkovou příchutí, 667 mg/ml, perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn. sukls212715/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duphalac se švestkovou příchutí, 667 mg/ml, perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls18973/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bisacodyl-K 5 mg, obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje bisacodylum 5 mg. Pomocné látky
sp.zn. sukls18973/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bisacodyl-K 5 mg, obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje bisacodylum 5 mg. Pomocné látky
Pomocné látky se známým účinkem: propylenglykol, cetylstearylalkohol.
 sp.zn. sukls154494/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zovirax 50 mg/g, krém 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje aciclovirum 50 mg. Pomocné látky se známým účinkem:
sp.zn. sukls154494/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zovirax 50 mg/g, krém 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje aciclovirum 50 mg. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls59002/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminolevulinic acid Regiomedica 8 mg léčivá náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá léčivá náplast o velikosti 4 cm 2 obsahuje
Sp. zn. sukls59002/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aminolevulinic acid Regiomedica 8 mg léčivá náplast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá léčivá náplast o velikosti 4 cm 2 obsahuje
Sp.zn.sukls256317/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. Garganta 1,5 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 Sp.zn.sukls256317/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Garganta 1,5 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje obsahuje benzydamini hydrochloridum
Sp.zn.sukls256317/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Garganta 1,5 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje obsahuje benzydamini hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NASONEX 50 mikrogramů/dávka nosní sprej, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mometasoni furoas (jako monohydrát) 50 mikrogramů/dávka. Pomocná látka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NASONEX 50 mikrogramů/dávka nosní sprej, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mometasoni furoas (jako monohydrát) 50 mikrogramů/dávka. Pomocná látka
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
sp.zn. sukls228670/2012 Souhrn údajů o přípravku 1. Název přípravku FASTUM gel
 sp.zn. sukls228670/2012 Souhrn údajů o přípravku 1. Název přípravku FASTUM gel 2. Kvalitativní a kvantitativní složení Ketoprofenum 25 mg (2,5%) v 1 g gelu. Úplný seznam pomocných látek viz bod 6.1. 3.
sp.zn. sukls228670/2012 Souhrn údajů o přípravku 1. Název přípravku FASTUM gel 2. Kvalitativní a kvantitativní složení Ketoprofenum 25 mg (2,5%) v 1 g gelu. Úplný seznam pomocných látek viz bod 6.1. 3.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIFLONID 200 MIFLONID 400 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek k inhalaci v tvrdých tobolkách užívaný v kombinaci s Aerolizerem. Jedna tobolka obsahuje
1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6 mg.
 sp.zn. sukls65458/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Otrivin Rhinostop 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6
sp.zn. sukls65458/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Otrivin Rhinostop 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje xylometazolini hydrochloridum 0,5 mg a ipratropii bromidum 0,6
1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Undestor 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tobolka obsahuje 40 mg testosteroni undecanoas, což odpovídá 25,3 mg testosteronum. Přípravek obsahuje oranžovou
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VISTAGAN Liquifilm 0,5 % Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levobunololi
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls208364/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VISTAGAN Liquifilm 0,5 % Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Levobunololi
sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014
 sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, 7 mg, tvrdé tobolky, 3,5 mg, tvrdé tobolky 3,5 mg, perorální prášek
sp.zn.: sukls219632/2013, sukls219655/2013 a sp.zn.: sukls184216/2014, sukls184239/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU, 7 mg, tvrdé tobolky, 3,5 mg, tvrdé tobolky 3,5 mg, perorální prášek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Injekční suspenze, adsorbovaná vakcína proti tetanu, bez konzervačních prosředků
 Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Žvýkací tablety Bílé, kulaté, bikonvexní nepotažené tablety o průměru 18 mm, které mohou mít malé skvrny.
 Sp.zn. sukls213693/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D 3 Lemon 800 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas odpovídá
Sp.zn. sukls213693/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D 3 Lemon 800 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas odpovídá
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014
 sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
Souhrn údajů o přípravku
 sp.zn. sukls207942/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 4 g, rektální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesalazinum (acidum 5-aminosalicylicum) 4,0 g v
sp.zn. sukls207942/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Salofalk 4 g, rektální suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesalazinum (acidum 5-aminosalicylicum) 4,0 g v
Souhrn údajů přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls46172/2008 Souhrn údajů přípravku 1. Název přípravku Alpicort F Kožní roztok 2. Složení kvalitativní a kvantitativní Účinné látky: estradiol-benzoas,
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls46172/2008 Souhrn údajů přípravku 1. Název přípravku Alpicort F Kožní roztok 2. Složení kvalitativní a kvantitativní Účinné látky: estradiol-benzoas,
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
Sp.zn.sukls185381/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MINOXIDIL LAVINELI 5% kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Minoxidilum 50 mg/ml (5% w/v). Jeden střik spreje MINOXIDIL
SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009
![SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009](/thumbs/29/13769956.jpg) Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I SCHVÁLENO] 1. NÁZEV PŘÍPRAVKU Braunovidon gáza s mastí Impregnované
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I SCHVÁLENO] 1. NÁZEV PŘÍPRAVKU Braunovidon gáza s mastí Impregnované
Souhrn údajů o přípravku
 sp.zn. sukls151090/2013 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Zovirax Oční mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aciclovirum 3 g ve 100 g masti. Úplný seznam pomocných látek viz bod 6.1. 3.
sp.zn. sukls151090/2013 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Zovirax Oční mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aciclovirum 3 g ve 100 g masti. Úplný seznam pomocných látek viz bod 6.1. 3.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls229281/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Maltofer 10 mg/ml, sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sirupu obsahuje polymaltosum ferricum 35,7 mg, což odpovídá ferrum
sp.zn.: sukls229281/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Maltofer 10 mg/ml, sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sirupu obsahuje polymaltosum ferricum 35,7 mg, což odpovídá ferrum
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
BETESIL 2,250 mg léčivá náplast Betamethasoni valeras
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BETESIL 2,250 mg léčivá náplast Betamethasoni valeras PŘEČTĚTE SI POZORNĚ CELOU PŘÍBALOVOU INFORMACI DŘÍVE, NEŢ ZAČNETE TENTO PŘÍPRAVEK UŢÍVAT. - Ponechte si
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA BETESIL 2,250 mg léčivá náplast Betamethasoni valeras PŘEČTĚTE SI POZORNĚ CELOU PŘÍBALOVOU INFORMACI DŘÍVE, NEŢ ZAČNETE TENTO PŘÍPRAVEK UŢÍVAT. - Ponechte si
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls226447/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Jodid draselný G.L. Pharma 65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls226447/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Jodid draselný G.L. Pharma 65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ramonna 1500 mikrogramů, tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum1500 mikrogramů. Pomocné látky se známým účinkem:
Reaquon prášek pro přípravu perorálního roztoku
 Příloha č. 3 k rozhodnutí o nové registraci sp.zn.sukls239371/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Reaquon prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
Příloha č. 3 k rozhodnutí o nové registraci sp.zn.sukls239371/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Reaquon prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Léčivá látka: amorolfini hydrochloridum 5,574 g (odpovídá amorolfinum 5,000 g) ve 100 ml.
 sp.zn. sukls154670/2013 1. NÁZEV PŘÍPRAVKU Loceryl 5% léčivý lak na nehty SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: amorolfini hydrochloridum 5,574 g (odpovídá amorolfinum
sp.zn. sukls154670/2013 1. NÁZEV PŘÍPRAVKU Loceryl 5% léčivý lak na nehty SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: amorolfini hydrochloridum 5,574 g (odpovídá amorolfinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls78218/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RETIN-A 0,05 % krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Retin-A 0,05 %: tretinoinum 0,50
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls78218/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RETIN-A 0,05 % krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Retin-A 0,05 %: tretinoinum 0,50
Colecalciferoli pulvis odpovídá Colecalciferolum (vitamin D3) 200 IU/5mikrogramů
 sp.zn. sukls117792/2010 a sukls46226/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D 3 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcium
sp.zn. sukls117792/2010 a sukls46226/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CALCICHEW D 3 200 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcium
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
sp.zn.sukls73103/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAMISIL 1% krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram přípravku Lamisil 1% krém obsahuje terbinafini hydrochloridum 10 mg,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls139320/2010, sukls139321/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls139320/2010, sukls139321/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten GYN 3 dny Canesten GYN 6 dní vaginální krém 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.: sukls139320/2010, sukls139321/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten GYN 3 dny Canesten GYN 6 dní vaginální krém 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls10590/2013 a sukls10592/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten GYN 3 dny Canesten GYN 6 dní vaginální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Canesten GYN 3 dny Clotrimazolum
sp. zn. sukls10590/2013 a sukls10592/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten GYN 3 dny Canesten GYN 6 dní vaginální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Canesten GYN 3 dny Clotrimazolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls90149/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUTTALAX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje Natrii picosulfas 5 mg Pomocná látka se známým účinkem: monohydrát
sp.zn.sukls90149/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUTTALAX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje Natrii picosulfas 5 mg Pomocná látka se známým účinkem: monohydrát
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
BELODERM 0,05 % kožní roztok. 1 gram roztoku obsahuje betamethasoni dipropionas 0,64 mg (odpovídá betamethasonum 0,5 mg).
 Příloha č.2 k rozhodnutí o registraci sp.zn. sukls26251/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BELODERM 0,05 % kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 gram roztoku obsahuje betamethasoni
Příloha č.2 k rozhodnutí o registraci sp.zn. sukls26251/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BELODERM 0,05 % kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 gram roztoku obsahuje betamethasoni
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls127841/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten krém 10 mg/g 2. KVALITATIVNÍ A KVANTITAVNÍ SLOŽENÍ Léčivá látka: clotrimazolum 200 mg ve 20 g krému. Pomocné látky se známým
sp.zn.sukls127841/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Canesten krém 10 mg/g 2. KVALITATIVNÍ A KVANTITAVNÍ SLOŽENÍ Léčivá látka: clotrimazolum 200 mg ve 20 g krému. Pomocné látky se známým
4.3. Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
 sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden sáček obsahuje macrogolum 4000 4 g (LaxBalance jablko) nebo 10 g (LaxBalance grapefruit, LaxBalance citrón).
 Sp.zn.sukls85836/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LaxBalance jablko 4 g LaxBalance grapefruit 10 g LaxBalance citrόn 10 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Sp.zn.sukls85836/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LaxBalance jablko 4 g LaxBalance grapefruit 10 g LaxBalance citrόn 10 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC)
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls124244/2007 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 11,25 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek: 1
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls124244/2007 1. NÁZEV PŘÍPRAVKU DIPHERELINE S.R. 11,25 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU (SPC) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Prášek: 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 3. LÉKOVÁ FORMA Tvrdé tobolky Tvrdé, bílé, želatinové tobolky obsahující bílý, homogenní prášek.
 sp.zn.sukls123276/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACC 200, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acetylcysteinum 200 mg v jedné tobolce. Úplný seznam pomocných látek viz
sp.zn.sukls123276/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACC 200, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acetylcysteinum 200 mg v jedné tobolce. Úplný seznam pomocných látek viz
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
Jeden ml obsahuje: Proteinum plasmatis humani... 200 mg (čistota minimálně 98% IgG)
 1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls103444/2011 a sukls103455/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium-Sandoz forte 500 mg Calcium-Sandoz FF 1000 mg calcii lactogluconas
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls103444/2011 a sukls103455/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcium-Sandoz forte 500 mg Calcium-Sandoz FF 1000 mg calcii lactogluconas
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls136451/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls136451/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CRINONE 8% 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka 1,125g vaginálního
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls136451/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CRINONE 8% 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka 1,125g vaginálního
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
SOURHN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls191580/2013 SOURHN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aktiferrin compositum měkká tobolka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ferrosi sulfas hydricus 113,85 mg (odpovídá 34,5 mg Fe 2+
sp.zn. sukls191580/2013 SOURHN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Aktiferrin compositum měkká tobolka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ferrosi sulfas hydricus 113,85 mg (odpovídá 34,5 mg Fe 2+
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 3. LÉKOVÁ FORMA Léčivý čaj Popis přípravku: nálevové sáčky, směs uvnitř hrubě práškované drogy a tmavozeleného komprimátu.
 sp.zn. sukls36227/2011 a sp.zn. sukls216271/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Čaj z listu senny 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 nálevový sáček obsahuje Sennae folium 1,0 g 3. LÉKOVÁ
sp.zn. sukls36227/2011 a sp.zn. sukls216271/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Čaj z listu senny 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 nálevový sáček obsahuje Sennae folium 1,0 g 3. LÉKOVÁ
sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012
 sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAALOX citron suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Algedratum 460 mg, což odpovídá 230mg aluminii
sp.zn. sukls275213/2012 a sp.zn. sukls10671/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAALOX citron suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Algedratum 460 mg, což odpovídá 230mg aluminii
Příbalová informace: informace pro pacienta. Dermovate 0,5 mg/g krém. Clobetasoli propionas
 Příbalová informace: informace pro pacienta Dermovate 0,5 mg/g krém Clobetasoli propionas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro
Příbalová informace: informace pro pacienta Dermovate 0,5 mg/g krém Clobetasoli propionas Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje pro
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Dávkování Léčbu Elidelem mohou zahájit pouze lékaři, kteří mají zkušenosti v diagnostice a léčbě atopické dermatitidy.
 sp.zn.sukls155461/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Elidel 10 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje pimecrolimusum 10 mg. Úplný seznam pomocných látek
sp.zn.sukls155461/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Elidel 10 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje pimecrolimusum 10 mg. Úplný seznam pomocných látek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Neomycini sulfas 3500 m.j.,, Polymyxini B sulfas 6000 m.j., Dexamethasonum 1 mg (0,1%) v 1 g
 Příloha č. 3 k rozhodnutí o změně registrace č.j. 7943/03, 7945/03 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAXITROL 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Neomycini sulfas 3500 m.j.,, Polymyxini B
Příloha č. 3 k rozhodnutí o změně registrace č.j. 7943/03, 7945/03 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MAXITROL 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Neomycini sulfas 3500 m.j.,, Polymyxini B
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRACETAM AL 800 PIRACETAM AL 1200 potahované tablety piracetamum Přečtěte si
Příloha č.1 ke sdělení o změně registrace sp.zn.sukls7816/2013 a sukls7818/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PIRACETAM AL 800 PIRACETAM AL 1200 potahované tablety piracetamum Přečtěte si
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
sp.zn.: sukls15507/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ENTIZOL vaginální tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metronidazolum 500 mg v 1 vaginální tabletě. 3. LÉKOVÁ FORMA Vaginální
Mast také obsahuje 36 mg propylenglykolu a 140 mg lanolinu v 1 gramu rektální masti.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls41675/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rectogesic 4 mg/g rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glyceroli trinitras:
