Prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C
|
|
|
- Drahomíra Novotná
- před 9 lety
- Počet zobrazení:
Transkript
1 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENJUGATE Prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml rozpuštěné vakcíny) obsahuje: Neisseriae meningitidis C (kmen C11) oligosacharidum 10 mikrogramů konjugováno na Corynebacterii diphtheriae CRM-197 proteinum 12,5 až 25,0 mikrogramů adsorbováno na hydroxid hlinitý 0,3 až 0,4 mg Al 3+ Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek a rozpouštědlo pro injekční suspenzi. Popis přípravku: bělavý až bílý lyofilizovaný prášek v lahvičce. bílá zakalená suspenze v předplněné injekční stříkačce. 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Aktivní imunizace dětí od 2 měsíců věku, dospívajících a dospělých jako prevence invazivní formy nemoci způsobené bakterií Neisseria meningitidis skupiny C. Očkování vakcínou Menjugate se má provádět na základě oficiálních doporučení Dávkování a způsob podání Dávkování Pediatrická populace Bezpečnost a účinnost přípravku Menjugate u dětí mladších 2 měsíců nebyla stanovena. Základní očkování Kojenci od 2 do 12 měsíců věku: podávají se dvě dávky, každá po 0,5 ml. Dávky by měly být podány v intervalu alespoň dvou měsíců. (Současné použití s jinými vakcínami viz bod 4.5.) Děti starší 12 měsíců: podává se jedna dávka (0,5 ml). Posilovací (booster) dávka Po dokončení základního očkování kojenců je doporučeno podat jim posilovací dávku vakcíny, tzv. booster. Doba podání posilovací dávky má být v souladu s oficiálním doporučením. Informace o odpovědi na podání posilovací dávky a o současném podání jiných dětských vakcín naleznete v bodech 5.1 a 4.5. Strana 1 (celkem 9)
2 Potřeba podání posilovací dávky subjektům, kterým byla podána v rámci základního očkování 1 dávka vakcíny (to je dětem starším než 12 měsíců, dospívajícím a dospělým), nebyla stanovena (viz bod 5.1). Dospívající a dospělí Přípravek Menjugate by měl být podán ve formě jedné 0,5ml injekce. Osoby pokročilejšího věku Pro dospělé pacienty od 65 let výše nejsou k dispozici žádné údaje (viz bod 5.1). O použití různých konjugovaných vakcín proti meningitidě typu C v průběhu základního očkování nebo jako boosterů nejsou k dispozici žádné údaje. Pokud je to možné, měla by se používat stejná vakcína. Způsob podání Opatření, která je nutno učinit před zacházením s léčivým přípravkem nebo před jeho podáním Intramuskulární podání. Vakcína (0,5 ml) je určena pro hlubokou intramuskulární aplikaci. Nejvhodnější místo aplikace je anterolaterální strana stehna u dětí do 1 roku a oblast deltového svalu u starších dětí, dospívajících a dospělých. Vakcína nesmí být aplikována intravenózně, subkutánně ani intradermálně. Menjugate nesmí být mísen s jinými vakcínami v jedné injekční stříkačce. Pokud jsou aplikovány dvě různé vakcíny nebo více, musí být aplikovány do různých míst (viz bod 4.5). Návod k rekonstituci tohoto léčivého přípravku před jeho podáním je uveden v bodě Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1, včetně difterického toxoidu. Osoby, u kterých se vyskytly jakékoli známky přecitlivělosti po předchozí aplikaci přípravku Menjugate. Podání přípravku Menjugate, stejně jako jiných vakcín, musí být odloženo u osob s akutním závažným horečnatým onemocněním Zvláštní upozornění a opatření pro použití Před injekční aplikací jakékoli vakcíny musí osoba, zodpovědná za aplikaci, učinit všechna možná preventivní opatření, aby se zabránilo alergickým a jiným reakcím. Stejně jako u jiných vakcín podávaných injekčně musí být, pro případ vzácných anafylaktických reakcí po podání vakcíny, vždy snadno dosažitelná odpovídající lékařská péče a dohled. Před podáním jakékoli dávky přípravku Menjugate musí být rodiče nebo doprovázející osoby požádáni o osobní anamnézu, rodinnou anamnézu a o informace o zdravotním stavu osoby podstupující vakcinaci, včetně informací o prodělaných očkováních, o okamžitém zdravotním stavu a jakýchkoli nežádoucích účincích po předchozích očkováních. Prospěch, vyplývající z očkování vakcínou obsahující konjugovaný meningokokový oligosacharid skupiny C, musí být zvážen z hlediska incidence infekce způsobené bakterií N. meningitidis skupiny C v dané skupině osob, a to před tím, než se přistoupí k rozsáhlé imunizační kampani. Menjugate neposkytuje ochranu proti meningokokovému onemocnění způsobenému jinými typy meningokoků (A, B, 29-E, H, I, K, L, W-135, X, Y nebo Z, a jiných neurčeného typu). Úplná ochrana proti infekci způsobené meningokokem skupiny C nemůže být zaručena. Strana 2 (celkem 9)
3 Nejsou dosud dostupné žádné údaje o použití této vakcíny jako post-expoziční ochrany před onemocněním. Nejsou dostupné žádné údaje o vhodnosti použití vakcíny po expozici N. meningitidis skupiny C. Vakcinace u osob s poruchou tvorby protilátek nemusí vyvolat odpovídající protilátkovou odpověď. Přestože HIV infekce není kontraindikace, Menjugate nebyl specificky vyhodnocen u pacientů s nedostatečnou funkcí imunitního systému. Jedinci s poruchou komplementového systému a pacienti s nefunkční slezinou nebo po odnětí sleziny jsou schopni imunitní odpovědi po podání této vakcíny, avšak stupeň dosažené ochrany není znám. Přestože byly zaznamenány příznaky meningismu jako je bolest/ztuhlost šíje či světloplachost, není žádný důkaz o tom, že tato vakcína vyvolává meningitidu způsobenou meningokokem skupiny C. Klinicky je třeba věnovat pozornost možnosti souběžně probíhající meningitis. Konjugované vakcíny obsahující "Cross Reacting Material 197 CRM 197" (zkříženě reagující látka) nemohou být považovány za imunizační agens proti záškrtu. Žádné změny ve vakcinačním schématu vakcín obsahujících difterický toxoid nejsou doporučeny. Jakákoli akutní infekce či horečnaté onemocnění by měly být důvodem pro odložení aplikace přípravku Menjugate s výjimkou případu, kdy podle lékařova názoru odložení aplikace vakcíny je větším rizikem než její podání. Mírně zvýšená teplota, jako například při nekomplikovaném zánětu horních cest dýchacích, obvykle není překážkou pro aplikaci vakcíny. Možné riziko apnoe a nutnost monitorování dýchání po dobu hodin by se měly zvážit když se podávají dávky základního očkování velmi předčasně narozeným dětem (narozené v 28. týdnu těhotenství) a zvláště těm, v jejichž předchozí anamnéze byla respirační nezralost. Protože prospěch očkování je u této skupiny dětí vysoký, neměla by se vakcinace odmítat ani oddalovat. Vakcína nesmí být podána intravenózně, subkutánně nebo intradermálně. Přípravek Menjugate ještě nebyl testován u pacientů s trombocytopenií nebo s jinými poruchami srážlivosti krve. Poměr rizika a prospěšnosti pro takového pacienta z důvodů možného krvácení po intramuskulární injekci musí být pečlivě zvážen. Rodiče musí být informováni o imunizačním schématu této vakcíny. Rodiče nebo doprovázející osoby musí být poučeni o opatřeních jako je účinná antipyretická léčba po aplikaci vakcíny, také potřeba hlásit jakékoli nežádoucí účinky musí být zdůrazněna. Čepička konusu injekční stříkačky může obsahovat asi 10 % suchého přírodního kaučuku. Suchý přírodní kaučuk je ve srovnání s přírodním latexem považován za menší alergen. I když je riziko, že se vyvine alergická reakce na latex malé, očkující zdravotnický personál by měl zvážit přínos a možné riziko v případě, že podává vakcínu osobě se známou přecitlivělostí na latex. Nejsou dostupné žádné údaje u dospělých ve věku 65 let a starších Interakce s jinými léčivými přípravky a jiné formy interakce Menjugate nesmí být mísen s jinými vakcínami v jedné injekční stříkačce. Pokud jsou zároveň aplikovány dvě různé vakcíny či více, musí být aplikovány do různých injekčních míst, pokud možno na jiné končetině. Současné podání přípravku Menjugate (v případě injekčně aplikovaných vakcín samozřejmě do různých míst) s následujícími vakcínami nemá vliv na sílu imunitní odpovědi na žádnou z nich: - vakcína proti poliomyelitidě (inaktivovaná [IPV] a perorální vakcína [OPV]); - vakcína proti záškrtu [D] a proti tetanu [T] samostatně nebo v kombinaci s celobuněčnou [wp] či acelulární vakcínou [ap] proti černému kašli; Strana 3 (celkem 9)
4 - konjugovaná vakcína proti onemocnění způsobenému Haemophilus influenzae typu B [Hib]; - vakcína proti hepatitidě B [HBV] podaná samostatně nebo ve stejnou dobu jako kombinovaná vakcína obsahující složky záškrtu, tetanu, Hib, inaktivované poliomyelitidy a acelulárního černého kašle; - kombinovaná vakcína proti spalničkám, příušnicím a zarděnkám; - sedmivalentní pneumokoková konjugovaná vakcína (Prevenar). Účinek současného podávání vakcíny Menjugate se sedmivalentní pneumokokovou konjugovanou vakcínou (Prevenar) a hexavalentní vakcínou [DTaP-HBV-IPV-Hib] na imunitní odpovědi byl hodnocen na dětech ve věku přibližně 2, 4,5 a 6,5 měsíců. V jiných schématech základního očkování nebyl potenciál imunitní interference hodnocen. V různých studiích byly zjištěny malé změny v dosažených hladinách protilátek GMT, ale nebylo stanoveno, zda zjištěné změny mají klinický význam. V různých studiích bylo prokázáno, že při současném podávání konjugovaných vakcín proti meningokoku skupiny C s vakcínami obsahujícími Pa složku (s nebo bez polio, hepb nebo Hib komponent) došlo ve srovnání se samostatnou aplikací těchto vakcín nebo se současným podáváním vakcín obsahujícím Pw složku ke snížení hodnot BCA GMT. Poměry dosahující BCA titrů nejméně 1:8 až 1:128 nejsou ovlivněny. Důsledky těchto pozorování na délku ochrany nejsou v současné době známy. 4.6 Fertilita, těhotenství a kojení Těhotenství Nejsou k dispozici žádné údaje o použití této vakcíny u těhotných žen. Studie s králíky v různých stádiích březosti neprokázaly riziko poškození plodu po aplikaci přípravku Menjugate. Vzhledem k závažnosti onemocnění způsobeného meningokokem typu C by těhotenství nemělo být důvodem k odmítnutí očkování v případě, kdy riziko nákazy je jasně prokázáno. Kojení Nejsou k dispozici žádné údaje o bezpečnosti použití této vakcíny během kojení. Dříve, než se přistoupí k vakcinaci během kojení, musí být pečlivě zvážen poměr mezi rizikem a prospěšností takové vakcinace. Fertilita Negativní vliv tohoto přípravku na fertilitu nebyl hodnocen u lidí ani u zvířat Účinky na schopnost řídit a obsluhovat stroje Nebyly provedeny žádné studie o vlivu očkování na schopnost řídit a obsluhovat stroje. Po vakcinaci byla velice vzácně hlášena závrať. Toto by mohlo dočasně ovlivnit schopnost řídit vozidlo nebo obsluhovat stroje Nežádoucí účinky Seznam nežádoucích účinků uspořádaný do tabulky V rámci každé skupiny četnosti jsou nežádoucí účinky uvedeny se snižující se závažností. Používané termíny četnosti výskytu jsou definovány takto: Velmi časté ( 1/10) Časté ( 1/100 až <1/10) Méně časté ( 1/1000 až <1/100) Vzácné ( 1/10000 až <1/1000) Velmi vzácné (<1/10000) Není známo (z dostupných údajů nelze určit) Strana 4 (celkem 9)
5 Nežádoucí účinky během klinických studií V této kapitole jsou uvedeny nežádoucí účinky zaznamenané u všech věkových skupin. Nežádoucí účinky byly sledovány od podání první dávky očkování a každý následující den, nejméně po dobu 3 dnů, nejdéle po dobu 6 dnů. Většina nežádoucích účinků byla mírná a samovolně vymizela během krátké doby. Ve všech věkových skupinách byly lokální reakce (včetně zarudnutí, otoku a citlivosti/bolesti) velmi časté (v rozmezí: od 1 ze 3 starších dětí do 1 z 10 předškolních dětí). Tyto reakce nebyly většinou klinicky významné. Zčervenání a otok nejméně 3 cm a citlivost při pohybu po dobu více než 48 hodin se vyskytly ve studiích vzácně. Horečka přesahující 38,0 C je častá (v rozmezí: od 1 z 20 kojenců a batolat do 1 z 10 předškolních dětí), většinou nepřekročí 39,1 C, zvláště u starších věkových skupin. U kojenců a batolat se po vakcinaci často vyskytl pláč a zvracení (batolata). Podrážděnost, ospalost, poruchy spánku, nechutenství, průjem a zvracení (kojenci) byly po vakcinaci velmi časté. Nejsou ale žádné důkazy, že by tyto reakce měly být spojovány s podáním vakcíny Menjugate více, než s ostatními současně podanými vakcínami, zvláště DTP. Velmi často se vyskytující nežádoucí účinky u dospělých zahrnují myalgie a artralgie. Ospalost byla často hlášena u mladších dětí. Bolest hlavy byla velmi častá u dětí na střední škole a častá u dětí na základní škole. Nežádoucí účinky, které byly zaznamenány ve všech věkových skupinách Celkové poruchy a reakce v místě aplikace Reakce v místě injekce (zčervenání, otok a citlivost/bolest) Časté: Horečka 38,0 C Jiné reakce zaznamenané u kojenců (do jednoho roku věku) a batolat (druhý rok života) Gastrointestinální poruchy Časté: Průjem, nechutenství, zvracení (kojenci) Zvracení (batolata) Celkové poruchy a reakce v místě aplikace Podrážděnost, ospalost a poruchy spánku Časté: Pláč Další reakce zaznamenané u starších dětí a u dospělých Gastrointestinální poruchy Nauzea (dospělí) Poruchy svalové a kosterní soustavy a pojivové tkáně Myalgie a artralgie Celkové poruchy a reakce v místě aplikace Malátnost Bolest hlavy (děti na střední škole) Časté: Bolest hlavy (děti na základní škole) Nežádoucí účinky hlášené během post-marketingového sledování (pro všechny věkové skupiny) Nejčastější nežádoucí účinky, pravděpodobně vyvolané vakcínou, zaznamenané během postmarketingového sledování zahrnují závrať, horečnatý stav, bolesti hlavy, nauzeu, zvracení a mdloby. Strana 5 (celkem 9)
6 Procentuální četnosti uvedené níže jsou vypočteny na základě dobrovolně ohlášených reakcí na tuto a jiné konjugované vakcíny proti meningokokové infekci sérotypu C. Pravděpodobnost je vypočítána tak, že jako čitatel je brán počet všech nahlášených reakcí a jako jmenovatel celkový počet distribuovaných dávek. Poruchy imunitního systému: Velmi vzácné: Lymfadenopatie, anafylaxe včetně anafylaktického šoku, reakce přecitlivělosti včetně bronchospasmu, faciálního edému a angioedému. Poruchy nervového systému: Velmi vzácné: Závrať, křeče včetně horečnatých křečí, mdloby, snížená citlivost a poruchy citlivosti, hypotonie. Po podání přípravku Menjugate byly zaznamenány velmi vzácné případy záchvatů; tito pacienti se obvykle velmi rychle zotavili. Některé z těchto zaznamenaných záchvatů se mohou projevit jako mdloby. Hlášená četnost záchvatů je nižší než průměrná četnost epileptického záchvatu u dětí. U kojenců byly záchvaty obyčejně spojeny s horečkou a pravděpodobně se jednalo o křeče z horečky. Po očkování konjugovanou meningokokovou vakcínou (skupina C) byly velmi vzácně zaznamenány případy poruchy zraku a fotofobie, obvykle ve spojení s jinými neurologickými symptomy jako je bolest hlavy a závrať. Respirační, hrudní a mediastinální poruchy: Apnoe u velmi předčasně narozených dětí (narozených v 28. týdnu těhotenství) (viz bod 4.4). Gastrointestinální poruchy: Velmi vzácné: nauzea, zvracení, průjem. Poruchy kůže a podkožní tkáně: Velmi vzácné: vyrážka, kopřivka, svědění, zarudnutí, erythema multiforme a Stevens-Johnsonův syndrom. Poruchy svalové a kosterní soustavy a pojivové tkáně: Velmi vzácné: myalgie a artralgie. V souvislosti s očkováním konjugovanými vakcínami proti meningokokům typu C byl hlášen relaps nefrotického syndromu. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na níže uvedenou adresu: Česká republika Státní ústav pro kontrolu léčiv Šrobárova Praha 10 Webové stránky: Předávkování Není zaznamenán žádný případ předávkování přípravkem Menjugate. Vzhledem k tomu, že každá injekce obsahuje jednu dávku o objemu 0,5 ml, je předávkování nepravděpodobné. Strana 6 (celkem 9)
7 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1. Farmakodynamické vlastnosti Farmakoterapeutická skupina: Meningokoková vakcína. ATC kód: J07AH07. Imunogenicita Nebyly provedeny prospektivní studie účinnosti vakcíny. Zkouška baktericidní aktivity séra (BCA), uváděná níže v textu, je test používající lidské sérum jako zdroj komplementu. Výsledky zkoušky baktericidní aktivity séra (BCA) dosažené při použití lidského séra jako zdroje komplementu nelze přímo srovnávat s testy používajícími jako zdroj komplementu králičí sérum. Z klinických studií srovnávajících základní očkovací schéma měsíce se schématem 2-4 měsíce (t.j. třídávkové a dvoudávkové schéma) jsou k dispozici údaje o použití dvoudávkového schématu základního očkování získané od 241 dětí. Jeden měsíc po ukončení základního očkování dosáhly téměř všechny subjekty hbca titrů nejméně 1:8 (100 % a 98 % v daných skupinách). 28 dní po podání provokační dávky nekonjugované MenC vakcíny dětem ve věku 12 měsíců dosáhlo všech 50 dětí očkovaných podle třídávkového schématu a 54 z 56 dětí (96 %) očkovaných podle dvoudávkového schématu hbca titrů nejméně 1:8. Imunitní odpověď navozená přípravkem Menjugate během klinických studií byla ve srovnání s registrovanými nekonjugovanými polysacharidovými vakcínami proti meningokokům vyšší u batolat, dětí a dospívajících a byla srovnatelná u dospělých (viz. tabulka). Navíc, oproti nekonjugovaným polysacharidovým vakcínám, navozuje Menjugate po očkování imunologickou paměť, ale doba trvání navozené ochrany není ještě určena. Nejsou k dispozici údaje pro dospělé ve věku 65 let a starší. Procentuální porovnání podílu osob s antimeningokokovým C baktericidním titrem protilátek v séru 1:8 (lidský komplement) jeden měsíc po jedné imunizaci přípravkem Menjugate a registrovanou nekonjugovanou meningokokovou polysacharidovou vakcínou, porovnání podle věkových skupin. BCA % 1:8 (95% CI) Lidský komplement Věk 1-2 roky Věk 3-5 let Věk let Věk let Menjugate n=237 MenPS (1) n=153 Menjugate n=80 MenPS (1) n=80 Menjugate n=90 MenPS (2) n=90 Menjugate n=136 MenPS (2) n=130 78% (72-83) 19% (13-26) 79% (68-87) 28% (18-39) 84% (75-91) 68% (57-77) 90% (84-95) 88% (82-93) MenPS = registrovaná nekonjugovaná polysacharidová vakcína proti meningokokům (1) = typ A, C, W-135 a Y, obsahující 50 μg polysacharidu typu C v 1 dávce. (2) = typ A a C, obsahující 50 μg polysacharidu typu C v 1 dávce. Protože přípravek Menjugate patří mezi vakcíny, nebyly provedeny žádné studie zabývající se farmakodynamikou. Zkušenosti z post-marketingového sledování vakcinační kampaně ve Velké Británii Odhady účinnosti vakcíny pocházející z rutinního imunizačního programu ve Velké Británii (za použití různého množství tří konjugovaných vakcín proti meningokoku skupiny C) z období od konce Strana 7 (celkem 9)
8 roku 1999 do března 2004 prokázaly nutnost podání posilovací dávky po ukončení základního očkování (tři dávky podané ve 2, 3 a 4 měsících). Během jednoho roku po ukončení základního očkování byla účinnost vakcíny u skupiny dětí odhadnuta na 93 % (95 % interval spolehlivosti 67, 99). Více než jeden rok po ukončení základního očkování došlo ke zjevnému poklesu ochrany. Do roku 2007 byly ve věkové skupině 1 až 18 let, která dostala v rámci vakcinačního programu jednu dávku konjugované vakcíny proti meningokoku skupiny C, celkové odhady účinnosti 83 až 100 %. Tato data ukazují, že v této věkové skupině, ve srovnání s obdobím méně než rok až jeden rok a více od očkování, nedochází k signifikantnímu snížení účinnosti Farmakokinetické vlastnosti Protože přípravek Menjugate patří mezi vakcíny, nebyly provedeny žádné studie zabývající se farmakokinetikou Předklinické údaje vztahující se k bezpečnosti Neklinické údaje získané na základě konvenčních studií toxicity po opakovaném podávání a reprodukční toxicity neodhalily žádné zvláštní riziko pro člověka (embryofetální studie). 6. FARMACEUTICKÉ ÚDAJE 6.1. Seznam pomocných látek Lahvička obsahující MenC - CRM197 konjugát Mannitol, monohydrát dihydrogenfosforečnanu sodného, heptahydrát hydrogenfosforečnanu sodného Lahvička nebo injekční stříkačka obsahující rozpouštědlo s hydroxidem hlinitým Chlorid sodný, voda na injekci 6.2. Inkompatibility Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě Doba použitelnosti 3 roky Po rozpuštění se přípravek musí okamžitě použít. Přípravek má dvě složky a každá z nich může mít jinou dobu použitelnosti. Na obalu je uvedena doba použitelnosti té složky, která má tuto dobu kratší a toto datum musí být bráno jako doba použitelnosti celého přípravku. Krabička a celý její obsah musí být zlikvidovány po ukončení této doby použitelnosti Zvláštní opatření pro uchovávání Uchovávejte v chladničce (2 C 8 C). Chraňte před mrazem. Uchovávejte injekční lahvičku i stříkačku v krabičce, aby byl přípravek chráněn před světlem. Uchovávejte mimo dohled a dosah dětí Druh obalu a obsah balení Přípravek Menjugate obsahuje: Strana 8 (celkem 9)
9 Balení lahvička/lahvička: lahvička s práškem (sklo třídy I), bromobutylový pryžový uzávěr a 0,6 ml rozpouštědla v lahvičce (sklo třídy I), bromobutylový pryžový uzávěr velikost balení 1, 5 a 10 jednotlivých dávek. Balení lahvička/injekční stříkačka se 2 jehlami: lahvička s práškem (sklo třídy I), bromobutylový pryžový uzávěr a 0,6 ml rozpouštědla v předplněné injekční stříkačce (sklo typu I), bromobutylový pryžový píst a chlorobutylová nebo styrenbutadienová pryžová čepička konusu inj. stříkačky velikost balení 1, 5 a 10 jednotlivých dávek. Na trhu nemusí být všechny velikosti balení Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Lyofilizovaná vakcína se musí před použitím rekonstituovat v rozpouštědle obsahujícím hydroxid hlinitý. Balení lahvička/lahvička: Jemně protřepejte lahvičku s rozpouštědlem s hydroxidem hlinitým. Odeberte 0,6 ml suspenze a přidejte ji do lahvičky s meningokokovým konjugátem. Balení lahvička/injekční stříkačka: Jemně protřepejte injekční stříkačku s rozpouštědlem s hydroxidem hlinitým. Sejměte kryt ze stříkačky a nasaďte vhodnou jehlu. Použijte celý obsah stříkačky (0,6 ml suspenze) a přidejte jej do lahvičky s meningokokovým konjugátem. Jemně protřepávejte, dokud se vakcína nerozpustí (tím je zajištěno, že antigen je navázán na adjuvans). Odeberte celý obsah lahvičky do injekční stříkačky. Mějte na paměti, že je normální to, že malé množství tekutiny zůstává v lahvičce po odebrání dávky. Ujistěte se před aplikací, že ve stříkačce nejsou přítomny žádné vzduchové bublinky. Vakcína po rekonstituci by měla být mírně opalescentní bezbarvá až lehce žlutá suspenze, bez jakýchkoli viditelných cizorodých částic. V případě, že jsou ve vakcíně jakékoli cizorodé částice, nebo má jiný vzhled než bylo popsáno, vakcínu nepoužívejte a zlikvidujte ji. Veškerý nepoužitý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI GSK Vaccines S.r.l., Via Fiorentina 1, IT Siena, Itálie 8. REGISTRAČNÍ ČÍSLO(A) 59/160/03-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: Datum posledního prodloužení registrace: DATUM REVIZE TEXTU Strana 9 (celkem 9)
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku
 Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující adjuvans MF59C.1 (Sezóna 2013/2014)
 sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
Příbalová informace. GlaxoSmithKline Biologicals S.A., Rue de l Institut 89, 1330 Rixensart, Belgie
 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls200771/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INFANRIX-IPV+Hib, prášek a suspenze pro injekční suspenzi Vakcína proti difterii, tetanu, pertusi (acelulární komponenta), poliomyelitidě
sp. zn. sukls200771/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INFANRIX-IPV+Hib, prášek a suspenze pro injekční suspenzi Vakcína proti difterii, tetanu, pertusi (acelulární komponenta), poliomyelitidě
Příbalová informace: informace pro uživatele
 sp.zn.: sukls236606/2012 Příbalová informace: informace pro uživatele MENJUGATE, prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C Přečtěte si pozorně
sp.zn.: sukls236606/2012 Příbalová informace: informace pro uživatele MENJUGATE, prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná).
 1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Přípavek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Quintanrix, prášek a suspenze pro přípravu injekční suspenze Vakcína proti záškrtu, tetanu, dávivému kašli (celobuněčná), hepatitidě B (rdna) a konjugovaná
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Quintanrix, prášek a suspenze pro přípravu injekční suspenze Vakcína proti záškrtu, tetanu, dávivému kašli (celobuněčná), hepatitidě B (rdna) a konjugovaná
A/California/7/2009 (H1N1)pdm09, použitá varianta A/Brisbane/10/2010, divoký typ
 1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls53114/2008
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls53114/2008 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Hib Prášek a suspenze pro přípravu injekční suspenze. Vakcína
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn. sukls53114/2008 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Hib Prášek a suspenze pro přípravu injekční suspenze. Vakcína
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU Prevenar 13 injek ní suspenze Pneumokoková polysacharidová konjugovaná vakcína (13-valentní, adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU Prevenar 13 injek ní suspenze Pneumokoková polysacharidová konjugovaná vakcína (13-valentní, adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)
![Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)](/thumbs/33/16328748.jpg) 1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
Rotavirus RIX4414 humanum vivum attenuatum* ne mén než 10 6,0 CCID 50
 1. NÁZEV P ÍPRAVKU Rotarix perorální suspenze v p edpln ném perorálním aplikátoru Živá rotavirová vakcína 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1,5 ml) obsahuje: Rotavirus RIX4414 humanum vivum
1. NÁZEV P ÍPRAVKU Rotarix perorální suspenze v p edpln ném perorálním aplikátoru Živá rotavirová vakcína 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1,5 ml) obsahuje: Rotavirus RIX4414 humanum vivum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Priorix inj. stříkačka, prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce
 sp. zn. sukls6997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Priorix inj. stříkačka, prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Živá atenuovaná vakcína proti spalničkám,
sp. zn. sukls6997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Priorix inj. stříkačka, prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Živá atenuovaná vakcína proti spalničkám,
Příbalová informace: informace pro uživatele. Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa)
 Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls1054422009 a příloha k sp.zn.: sukls106417/2009, sukls196543/2010
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls1054422009 a příloha k sp.zn.: sukls106417/2009, sukls196543/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU VERORAB, prášek pro přípravu
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls1054422009 a příloha k sp.zn.: sukls106417/2009, sukls196543/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU VERORAB, prášek pro přípravu
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml
 Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
Kelacyl 100 mg/ml injekční roztok pro skot a prasata 100 ml Popis zboží: 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Kelacyl 100 mg/ml injekční roztok pro skot a prasata Přípravek s indikačním omezením 2.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
sp.zn. sukls176277/2011 a sp.zn. sukls129930/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 10% Braun koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu
3. LÉKOVÁ FORMA Prášek pro perorální roztok MOVICOL je sypký bílý prášek s charakteristickou limetkovou a citronovou příchutí.
 sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
sp.zn.sukls267108/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MOVICOL 6,9 g prášek pro perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden 6,9 g sáček obsahuje: Léčivé látky: Macrogolum
S O UH R N Ú D AJ Ů O P ŘÍPR AVK U
 sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Použití homeopatického léčivého přípravku v uvedených terapeutických indikacích je založeno výhradně na homeopatických zkušenostech.
 sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
sp.zn. sukls17122/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Herbapax Sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 g (což odpovídá 94,34 ml ml) sirupu obsahuje: Drosera MT (matečná tinktura)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
Sp.zn. sukls95214/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ovixan 1 mg/g krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram krému obsahuje mometasoni furoas 1 mg. Pomocné látky se známým účinkem:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
PŘÍBALOVÁ INFORMACE K PŘÍPRAVKU CANVAC DHP inj. sicc. ad us. vet.
 PŘÍBALOVÁ INFORMACE K PŘÍPRAVKU CANVAC DHP inj. sicc. ad us. vet. PI Název přípravku CANVAC DHP inj. sicc. ad us. vet. Trivalentní vakcína proti psince, infekční hepatitidě, infekční laryngotracheitidě
PŘÍBALOVÁ INFORMACE K PŘÍPRAVKU CANVAC DHP inj. sicc. ad us. vet. PI Název přípravku CANVAC DHP inj. sicc. ad us. vet. Trivalentní vakcína proti psince, infekční hepatitidě, infekční laryngotracheitidě
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SPERSALLERG Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: antazolini hydrochloridum 0,5 mg a tetryzolini hydrochloridum 0,4 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
Psi: Snížení mortality a klinických příznaků parvovirózy (enterické formy) psů od 1 měsíce věku.
 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Virbagen Omega 5 MU pro psy a kočky Virbagen Omega 10 MU pro psy a kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lahvička s lyofilizátem : Léčivá látka Balení
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. FLECTOR EP GEL gel (diclofenacum epolaminum)
 sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
P íbalová informace: informace pro uživatele
 P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls18109/2008 a příloha k sp.zn.: sukls88889/2010 1. Název přípravku Skinoren krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
sp.zn. sukls13937/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SONGHA NIGHT Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje: Valerianae extractum siccum (3-6:1),
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Nobilis IB 4-91, lyofilizát pro suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá injekční lahvička obsahuje na dávku:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Nobilis IB 4-91, lyofilizát pro suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá injekční lahvička obsahuje na dávku:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Priorix-Tetra inj. stříkačka, prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Vakcína proti spalničkám, příušnicím, zarděnkám a planým
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Priorix-Tetra inj. stříkačka, prášek a rozpouštědlo pro injekční roztok v předplněné injekční stříkačce Vakcína proti spalničkám, příušnicím, zarděnkám a planým
DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: Informace pro uživatele. Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná)
 Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls1508897/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin Krka 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5
sp.zn.sukls1508897/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin Krka 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
sp. zn. sukls92805/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paramax Combi 500 mg/65 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg a coffeinum 65
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Trachisan 8 mg proti bolesti v krku, pastilky. Lidocaini hydrochloridum monohydricum
 Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
Sp.zn. sukls134657/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Trachisan 8 mg proti bolesti v krku, pastilky Lidocaini hydrochloridum monohydricum Přečtěte si pozorně tuto příbalovou informaci, protože
ANALERGIN NEO Potahované tablety 20 x 5 mg
 ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 0,5 mg/ml perorální suspenze pro kočky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 0,5 mg/ml perorální suspenze pro kočky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum Pomocné
SOUHRN ÚDAJŮ O PŘĺPRAVKU
 sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
sp.zn.sukls109929/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘĺPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna vaginální tableta obsahuje 100 mg clotrimazolum Jedna vaginální tableta obsahuje 200 mg
Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y
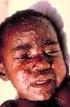 Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Příbalová informace: informace pro uživatele. PAMBA tablety (acidum aminomethylbenzoicum)
 sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prevenar, injekční suspenze Pneumokoková sacharidová konjugovaná vakcína, adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna 0,5 ml dávka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prevenar, injekční suspenze Pneumokoková sacharidová konjugovaná vakcína, adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna 0,5 ml dávka
Merck Santé, 2, rue du Pressoir Vert, 45400 Semoy, Francie Merck, SL, Poligono Merck, 08100 Mollet Del Valles (Barcelona), Španělsko Složení
 U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
U léčby závislosti na alkoholu platí, že na ni přímý lék neexistuje. Léčbu řídí psychiatr, který stanoví léčebný plán s psychoterapií a doporučí podpůrnou lékovou léčbu dle svých zkušeností. Článek pojednává
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
Zkušenosti z klinického hodnocení účinnosti s použitím desloratadinu u mladistvých ve věku 12 až 17 let jsou omezené (viz.bod 4.8 a 5.1).
 1. NÁZEV PŘÍPRAVKU Azomyr 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA
1. NÁZEV PŘÍPRAVKU Azomyr 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA
Synflorix injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
 1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje: Pneumococcale polysaccharidum
1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje: Pneumococcale polysaccharidum
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE. Aminoplasmal Hepa - 10% infuzní roztok
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽÍVATELE Aminoplasmal Hepa - 10% infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou informaci
PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum)
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls4100/2008, sukls4101/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PURINOL 100 mg PURINOL 300 mg tablety (allopurinolum) Přečtěte si pozorně
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Rovamycine 1,5 M.I.U: Jedna potahovaná tableta obsahuje spiramycinum 1,50 mil. m.j. (dále jen M.I.U.)
 sp.zn. sukls243841/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
sp.zn. sukls243841/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rovamycine 1,5 M.I.U. Rovamycine 3 M.I.U. potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ: Rovamycine 1,5 M.I.U: Jedna potahovaná
Příbalová informace: informace pro uživatele. FINEX 5 mg potahované tablety (finasteridum)
 sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Clotrimazol AL 200 vaginální tablety clotrimazolum
 sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
sp. zn. sukls29510/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 200 vaginální tablety clotrimazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta. Betnovate 1 mg/g krém betamethasonum
 sp.zn.: sukls57199/2013 a sp.zn.: sukls121553/2015 Příbalová informace: informace pro pacienta Betnovate 1 mg/g krém betamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.: sukls57199/2013 a sp.zn.: sukls121553/2015 Příbalová informace: informace pro pacienta Betnovate 1 mg/g krém betamethasonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE. Canespor 1x denně sada na nehty mast bifonazolum
 sp.zn.: sukls219557/2011 a sp.zn.: sukls46172/2014 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE Canespor 1x denně sada na nehty mast bifonazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než
sp.zn.: sukls219557/2011 a sp.zn.: sukls46172/2014 PŘÍBALOVÁ INFORMACE-INFORMACE PRO UŽIVATELE Canespor 1x denně sada na nehty mast bifonazolum Přečtěte si pozorně tuto příbalovou informaci dříve, než
Žvýkací tableta Bílé, kulaté, bikonvexní nepotahované tablety o průměru 16 mm, které mohou mít malé skvrny.
 Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
Sp.zn. sukls117303/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Calcichew D3 Jahoda 500 mg/400 IU žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje: Calcii carbonas
sp. zn. sukls82959/2013
 sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
sp.zn. sukls220171/2015 1. NÁZEV PŘÍPRAVKU Alpicort F 0,05 mg/ml+2 mg/ml+4 mg/ml Kožní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: estradioli benzoas, prednisolonum,
K použití od 18 let. Léčivá látka ciklopirox zabraňuje růstu hub a ničí je. Díky tomu se zlepší stav Vašich nehtů.
 sp. zn. sukls91894/2013 Příbalová informace: Informace pro uživatele Polinail 80 mg/g léčivý lak na nehty ciclopiroxum K použití od 18 let Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp. zn. sukls91894/2013 Příbalová informace: Informace pro uživatele Polinail 80 mg/g léčivý lak na nehty ciclopiroxum K použití od 18 let Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Tablety. Egianti 0,75 mg jsou kulaté, bílé tablety, o průměru přibližně 6 mm, na jedné straně vyraženo C a na druhé straně 2.
 Sp.zn. sukls199092/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Egianti 0,75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 0,75 mg. Pomocná látka se známým
Sp.zn. sukls199092/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Egianti 0,75 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 0,75 mg. Pomocná látka se známým
Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum
 Příbalová informace: informace pro uživatele Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele Vistaprep prášek pro perorální roztok macrogolum 3350, natrii chloridum, natrii hydrogencarbonas a kalii chloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele. Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum
 Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
SOUHRN ÚDAJU O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls42299/2007, sukls42300/2007 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU APO-MOCLOB 150 APO-MOCLOB 300 potahované tablety 2. KVALITATIVNÍ A
HYPERTENZE VYSOKÝ KREVNÍ TLAK
 HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
HYPERTENZE VYSOKÝ KREVNÍ TLAK Arteriální hypertenze (vysoký krevní tlak) patří v dnešní době k nejčastějším poruchám zdravotního stavu populace, jak v rozvojových, tak i ve vysoce vyspělých zemích. Arteriální
Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu)
 sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
Příbalová informace: informace pro uživatele. Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum
 Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011
 Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
Příloha č. 1 ke sdělení sp.zn.sukls139835/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU RHINO-STAS Galmed dávkovací nosní sprej 0,1% nosní sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy
 PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
PŘÍBALOVÁ INFORMACE Narcostart 1 mg/ml injekční roztok pro kočky a psy 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ ŠARŽE, POKUD SE NESHODUJE
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Amizolmet 500 mg/ml injekční roztok. Metamizolum natricum monohydricum
 Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn.sukls195561/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Amizolmet 500 mg/ml injekční roztok Metamizolum natricum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 Pregnyl 5 000 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného prášku pro přípravu injekčního roztoku a rozpouštědla
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pregnyl 1 500 Pregnyl 5 000 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Pregnyl se skládá z lyofilizovaného prášku pro přípravu injekčního roztoku a rozpouštědla
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Clotrimazol AL 1% krém (clotrimazolum)
 sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn.: sukls197645/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Clotrimazol AL 1% krém (clotrimazolum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
NEREGISTROVANÝ PŘÍPRAVEK použití povoleno v rámci specifického léčebného programu SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
Nulsora 1,5 mg tableta je kulatá, bílá, o průměru přibližně 6 mm, na jedné straně vyraženo C, na druhé straně vyraženo 1.
 Sp.zn.sukls173628/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nulsora 1,5 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 1,5 mg. Pomocná látka se známým
Sp.zn.sukls173628/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nulsora 1,5 mg tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje levonorgestrelum 1,5 mg. Pomocná látka se známým
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Synflorix injekční suspenze v předplněné injekční stříkačce Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg.
 1. NÁZEV PŘÍPRAVKU Aerius 5 mg perorální lyofilizát 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg. Úplný seznam pomocných látek
1. NÁZEV PŘÍPRAVKU Aerius 5 mg perorální lyofilizát 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Aerius perorální lyofilizát obsahuje desloratadinum 5 mg. Úplný seznam pomocných látek
Příbalová informace: informace pro uživatele. APO-FINAS potahované tablety (finasteridum)
 Příbalová informace: informace pro uživatele APO-FINAS potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele APO-FINAS potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Legislativa k lékárničce pro práci s dětmi a mládeží
 LÉKÁRNIČKA Legislativa k lékárničce pro práci s dětmi a mládeží Nařízení vlády č. 101/2005 Sb. stanovuje, že prostředky první pomoci musí být dostupné na všech místech, kde to vyžadují pracovní podmínky.
LÉKÁRNIČKA Legislativa k lékárničce pro práci s dětmi a mládeží Nařízení vlády č. 101/2005 Sb. stanovuje, že prostředky první pomoci musí být dostupné na všech místech, kde to vyžadují pracovní podmínky.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Oligosacharidová vakcína proti meningitidě C konjugovaná (adsorbovaná) adsorbováno na hydroxid hlinitý 0,3 až 0,4 mg Al 3+
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENJUGATE Prášek pro přípravu injekční suspenze s rozpouštědlem Oligosacharidová vakcína proti meningitidě C konjugovaná (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENJUGATE Prášek pro přípravu injekční suspenze s rozpouštědlem Oligosacharidová vakcína proti meningitidě C konjugovaná (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls18558/2015
 sp.zn.sukls18558/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN flurbiprofenum pastilky Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje. Tento přípravek
sp.zn.sukls18558/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPFEN flurbiprofenum pastilky Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro Vás důležité údaje. Tento přípravek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 < PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
< PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls240936/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram obsahuje diclofenacum natricum 10 mg. Pomocné látky: propylenglykol,
sp.zn. sukls240936/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DICLOFENAC GALMED 1% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram obsahuje diclofenacum natricum 10 mg. Pomocné látky: propylenglykol,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/25 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Previcox 57 mg žvýkací tablety pro psy Previcox 227 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1/25 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Previcox 57 mg žvýkací tablety pro psy Previcox 227 mg žvýkací tablety pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls98459/2009 a k sp.zn. sukls79456/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls98459/2009 a k sp.zn. sukls79456/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENJUGATE Prášek pro přípravu injekční suspenze s rozpouštědlem
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls98459/2009 a k sp.zn. sukls79456/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENJUGATE Prášek pro přípravu injekční suspenze s rozpouštědlem
Příbalová informace: informace pro pacienta. Lutinus 100 mg vaginální tablety Progesteronum
 Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
Příloha č. 3 ke sdělení sp.zn. sukls26205/2012 1. NÁZEV PŘÍPRAVKU DULCOLAX čípky SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 čípek obsahuje: Bisacodylum 10 mg Úplný seznam pomocných
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná)
 1. Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje : Pneumococcale polysaccharidum serotypus 1 1,2 Pneumococcale polysaccharidum
1. Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje : Pneumococcale polysaccharidum serotypus 1 1,2 Pneumococcale polysaccharidum
