SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Naděžda Radka Havlová
- před 7 lety
- Počet zobrazení:
Transkript
1 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FACTOR VII BAXTER 600 IU Prášek pro přípravu injekčního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ FACTOR VII BAXTER je dodáván ve formě lyofilizovaného prášku a obsahuje factor VII coagulationis humanus 600 IU* v jedné lahvičce. Po rozpuštění v 10 ml vody na injekci obsahuje přípravek přibližně 60 IU/ml lidského koagulačního faktoru VII. Síla je stanovena za použití chromogenního testu podle Evropského lékopisu (European Pharmacopoeia). Specifická aktivita přípravku FACTOR VII BAXTER je 2 IU faktoru VII/mg proteinu. *Síla FVII byla stanovena vůči mezinárodní standardě pro koncentráty faktoru VII Světové zdravotnické organizace (WHO). Pomocné látky viz kapitola LÉKOVÁ FORMA Prášek pro přípravu injekčního roztoku s rozpouštědlem. 4. KLINICKÉ ÚDAJE 4.1. Terapeutické indikace Léčba a profylaxe krvácivých poruch způsobených nedostatkem faktoru VII nebo spojených s nedostatkem faktoru VII: Akutní krvácení a profylaxe peroperačního krvácení v případech vrozeného nedostatku faktoru VII (hypo- nebo aprokonvertinémie). Akutní krvácení a profylaxe peroperačního krvácení v případech získaného nedostatku faktoru VII: - perorální antikoagulační léčba - nedostatek vitaminu K (poruchy vstřebávání, dlouhodobá parenterální výživa atd.) - poškození jaterního parenchymu (hepatitida, jaterní cirhóza, těžké toxické poškození jater atd.) 4.2 Dávkování a způsob podání Léčba by měla být zahájena pod dohledem lékaře, který má zkušenosti se substituční léčbou koagulačními faktory. Dávkování Dávkování a doba substituční léčby závisí na závažnosti nedostatku faktoru VII, na místě a rozsahu krvácení a na klinickém stavu pacienta. Počet podaných jednotek faktoru VII se vyjadřuje v mezinárodních jednotkách (IU), které jsou vztaženy k současnému WHO standardu pro přípravky faktoru VII. Aktivita faktoru VII v plazmě se 1/6
2 vyjadřuje buď v procentech (ve vztahu k normální lidské plazmě) nebo v mezinárodních jednotkách (ve vztahu k mezinárodnímu standardu pro koncentráty faktoru VII). Jedna mezinárodní jednotka (IU) aktivity faktoru VII se rovná množství faktoru VII v 1 ml normální lidské plazmy. Výpočet potřebné dávky faktoru VII, jak je níže specifikován, je založen na empirickém zjištění, že 1 mezinárodní jednotka (IU) faktoru VII na kg tělesné hmotnosti zvyšuje aktivitu faktoru VII v plazmě přibližně o 1,7% normální aktivity. Potřebná dávka se určuje pomocí následujícího vzorce: Potřebný počet jednotek = tělesná hmotnost (kg) x požadované zvýšení faktoru VII (%) x 0,6 Množství, které má být podáno, a četnost podání se musí vždy řídit podle klinické účinnosti v konkrétním případě. Krvácivý stav Menší krvácení a menší chirurgické výkony. Těžké krvácení a větší chirurgické výkony. Terapeuticky nutná hladina plazmatické aktivity faktoru VII Doba, po kterou je nutné udržovat terapeutickou hladinu plazmatické aktivity faktoru VII 10 % - 20 % Jedna dávka (menší krvácení) nebo do úplného zhojení rány (menší chirurgický zákrok). 20 % - 25 % Po dobu 8 až 10 dnů nebo do úplného zhojení rány. Intervaly mezi dávkami se musí přizpůsobit krátkému poločasu faktoru VII v krevním oběhu, který je přibližně 3 až 5 hodin. Je-li nutno udržovat hladiny faktoru VII dlouhodobě, jsou potřebné dávky každých 8 až 12 hodin. Není dostatek údajů o podávání faktoru VII dětem do 6 let. Způsob podání Rozpusťte přípravek podle popisu v kapitole 6.6. Přípravek má být aplikován pomalu intravenózně. Doporučuje se nepřekračovat rychlost podání 2 ml za 1 minutu. 4.3 Kontraindikace Přecitlivělost na léčivou látku nebo na některou pomocnou látku Diseminovaná intravaskulární koagulace (DIC) nebo hyperfibrinolýza bez předchozího zvládnutí základní konzumpční poruchy Heparinem navozená trombocytopenie v anamnéze 4.4 Zvláštní upozornění a zvláštní opatření pro použití Jako u všech intravenózních proteinových přípravků, i zde je možný výskyt reakcí z přecitlivělosti alergického typu. Pacienti by měli být informováni o časných příznacích alergických reakcí včetně kopřivky, generalizované kopřivky, tísně na hrudníku, sípání, hypotenze a anafylaxe. Pacienti musí být poučeni o tom, že musí ihned přerušit používání přípravku a spojit se se svým lékařem, jestliže se tyto příznaky objeví. V případě šoku musí být dodrženy současné lékařské standardy pro léčbu šoku. Podle zkušeností s přípravky faktorů protrombinového komplexu existuje u pacientů při léčbě koncentráty koagulačního faktoru VII z lidské plazmy potenciální riziko trombózy a diseminované intravaskulární koagulace. Vzhledem k možnému riziku tromboembolických komplikací musí být při podávání vyšších dávek koncentrátů lidského koagulačního faktoru VII zvýšená opatrnost u pacientů s anamnézou onemocnění koronárních tepen nebo akutního infarktu myokardu, pacientů s jaterními chorobami, pooperačních stavů, u novorozenců či u pacientů s rizikem tromboembolických projevů nebo diseminované intravaskulární koagulace. Ve všech těchto situacích je nutno zvážit možný 2/6
3 pozitivní účinek léčby koncentrátem lidského koagulačního faktoru VII vzhledem k riziku těchto komplikací. Teoreticky může substituční léčba přípravkem FACTOR VII BAXTER vést k tvorbě cirkulujících protilátek inhibujících faktor VII. V klinické praxi však zatím takový případ nebyl hlášen. Protože množství sodíku při maximální denní dávce může překročit 200 mg, může mít škodlivé účinky u jedinců na dietě s nízkým obsahem sodíku. FACTOR VII BAXTER je vyroben z lidské plazmy. Při podávání přípravků z lidské krve či plazmy není možno zcela vyloučit výskyt infekčních nemocí způsobených přenosem infekčního agens. To platí i pro patogeny dosud neznámé povahy. Riziko přenosu infekčních agens je však sníženo pomocí: výběru dárců při rozhovoru s lékařem a pomocí screeningového vyšetření jednotlivých odběrů a poolů plazmy na HbsAg a protilátky proti virům HIV a HCV. vyšetření poolů plazmy na genomový materiál HIV-1, HIV-2, HAV, HBV, HCV a parvoviru B 19. metod virové inaktivace/odstranění virů, které jsou zařazeny ve výrobním postupu a byly validovány za použití cílových a/nebo modelových virů. Tyto postupy jsou považovány za účinné proti HIV-1, HIV-2, HAV, HBV a HCV. Postupy virové inaktivace/odstranění virů mohou mít omezenou účinnost vůči virům bez obalu, např. parvoviru B19. Infekce parvovirem B19 může být závažná pro těhotné ženy (infekce plodu) a pro jedince s imunodeficitem nebo se zvýšenou tvorbou červených krvinek (např. při hemolytické anémii). U pacientů, kteří dostávají koncentráty faktoru VII získaného z plazmy, se doporučuje vhodné očkování (proti hepatitidě A a B). V zájmu pacientů se doporučuje, pokud je to možné, vždy při podání přípravku FACTOR VII BAXTER zaznamenat název a číslo šarže přípravku. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Nejsou známy žádné interakce přípravků lidského koagulačního faktoru VII s jinými léčivými přípravky. Interference se sérologickými testy: Při vyšetřování hemokoagulace v testech, jež jsou citlivé na heparin, u pacientů, kteří dostávají vysoké dávky přípravku FACTOR VII BAXTER, se musí vzít v úvahu obsah heparinu podaného s přípravkem. Pokud je to nutné, je možno účinek heparinu neutralizovat přidáním protaminu k vyšetřovanému vzorku. 4.6 Těhotenství a kojení Bezpečnost přípravku FACTOR VII BAXTER při používání u těhotných žen nebyla v kontrolovaných klinických studiích u člověka stanovena. Experimentální studie na zvířatech nejsou ke stanovení bezpečnosti s ohledem na reprodukci, vývoj embrya a plodu, průběh těhotenství a peri- a postnatální vývoj vhodné. FACTOR VII BAXTER se proto smí používat během těhotenství a kojení pouze v případech, kdy je to zcela jasně potřebné. 4.7 Účinky na schopnost řídit a obsluhovat stroje Nebyly pozorovány žádné účinky na schopnost řídit a obsluhovat stroje. 4.8 Nežádoucí účinky Zřídka byly pozorovány přecitlivělost či alergické reakce (což může zahrnovat kopřivku, nevolnost, zvracení, dušnost, pokles krevního tlaku). V některých případech mohou progredovat až do těžké anafylaxe (včetně šoku). Ve vzácných případech byla pozorována horečka. 3/6
4 V průběhu léčby faktory protrombinového komplexu, k nimž koagulační faktor VII patří, se mohou vyskytnout tromboembolické příhody, zejména po podání vysokých dávek a/nebo u pacientů s rizikovými faktory pro vznik trombózy. 4.9 Předávkování Podávání vysokých dávek přípravků obsahujících faktor VII bylo spojeno s případy infarktu myokardu, diseminované intravaskulární koagulace, žilní trombózy a plicní embolie. Při předávkování je tedy vyšší pravděpodobnost rozvoje tromboembolických komplikací či diseminované intravaskulární koagulace u pacientů s rizikem těchto komplikací. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Koagulační faktory: koagulační faktor VII ATC kód: B02BD05 Lidský koagulační faktor VII je jedním z faktorů krevního srážení závislých na vitaminu K přítomných v lidské plazmě. Zevní cesta krevního srážení je iniciována právě zymogenem aktivní serinové proteázy, faktoru VIIa. Podávání koncentrátu lidského koagulačního faktoru VII vede ke zvýšení plazmatických hladin faktoru VII a může dočasně upravit poruchu koagulace u pacientů s nedostatkem faktoru VII. 5.2 Farmakokinetické vlastnosti Po intravenózním podání přípravku FACTOR VII BAXTER je odhadovaná in vivo recovery přibližně % s průměrným poločasem asi 3 až 5 hodin. 5.3 Předklinické údaje vztahující se k bezpečnosti Lidský koagulační faktor VII (obsažený v přípravku FACTOR VII BAXTER) je normální složkou lidské plazmy a účinkuje jako endogenní faktor VII. Testování toxicity jedné dávky není relevantní, protože vyšší dávky vedou k oběhovému přetížení. Testování toxicity opakovaných dávek u zvířat je neproveditelné vzhledem k interferenci s vytvářenými protilátkami proti heterolognímu proteinu. Protože klinická zkušenost nenasvědčuje žádným karcinogenním či mutagenním účinkům lidského koagulačního faktoru VII, nejsou považovány experimentální studie, zejména u heterologních druhů, za nezbytné. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Prášek: Dihydrát citronanu sodného Chlorid sodný Sodná sůl heparinu 0,5 IU/IU FVII Rozpouštědlo: Voda na injekci 6.2 Inkompatibility Tento léčivý přípravek nesmí být před podáním mísen s žádnými dalšími léčivými přípravky. Doporučuje se propláchnout žilní vstup fyziologickým roztokem před a po infuzi přípravku FACTOR VII BAXTER. 4/6
5 6.3 Doba použitelnosti Lyofilizovaný FACTOR VII BAXTER má dobu použitelnosti 3 roky. Po rozpuštění musí být FACTOR VII BAXTER ihned použit, protože přípravek neobsahuje konzervační látky. 6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě +2 C až +8 C (v chladničce). Nezmrazujte. Uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem. Nepoužívejte po uplynutí doby použitelnosti uvedené na obalu. Uchovávejte mimo dosah a dohled dětí. 6.5 Druh obalu a velikost balení FACTOR VII BAXTER je dodáván v lahvičce s lyofilizovaným práškem 600 IU, který se má rozpustit v 10 ml vody na injekci. FACTOR VII BAXTER je dodáván v lahvičkách ze skla typu II opatřených pryžovou zátkou, kovovým uzávěrem a plastikovým krytem (s obsahem jedné dávky). Rozpouštědlo se dodává v lahvičkách ze skla typu I opatřených pryžovou zátkou, kovovým uzávěrem a plastikovým krytem (s obsahem pro jednu dávku). Každé balení obsahuje také set pro rozpuštění a injekci, který se skládá z: 1 injekční stříkačky k jednorázovému použití, 1 jehly k jednorázovému použití, 1 převodní jehly, 1 filtrační jehly, 1 zavzdušňovací jehly a 1 infuzního setu s křidélky. 6.6 Návod k použití přípravku a zacházení s ním Rozpuštění přípravku FACTOR VII BAXTER se provádí bezprostředně před podáním. Měl by se použít pouze infuzní set dodávaný s přípravkem. Roztok musí být čirý nebo lehce opalescentní. Nepoužívejte roztoky, které jsou zakalené nebo obsahují usazeniny. Veškerý nespotřebovaný přípravek nebo odpad musí být znehodnocen v souladu s místními požadavky. Rozpuštění lyofilizátu 1. Ještě uzavřenou lahvičku obsahující rozpouštědlo zahřejte na pokojovou teplotu (max. 37 C). 2. Odstraňte víčko z lahvičky s koncentrátem a z lahvičky s rozpouštědlem (obr. A) a proveďte dezinfekci pryžových zátek na obou lahvičkách. 3. Pootočením a povytažením sejměte ochranný kryt z jednoho konce přiložené přepouštěcí jehly (obr. B). Touto odkrytou jehlou propíchněte pryžovou zátku lahvičky s rozpouštědlem (obr. C). 4. Sejměte ochranný kryt z druhého konce přepouštěcí jehly. Dbejte přitom, abyste se odkrytého konce nedotkli. 5. Lahvičku s rozpouštědlem obraťte vzhůru dnem nad lahvičkou s koncentrátem a volným koncem přepouštěcí jehly propíchněte pryžovou zátku lahvičky s koncentrátem (obr. D). Rozpouštědlo je vtaženo vakuem do lahvičky s koncentrátem. 6. Lahvičky odpojte vytažením jehly z lahvičky s koncentrátem (obr. E). Rozpouštění urychlete protřepáním nebo kroužením lahvičkou s koncentrátem. 7. Po úplném rozpuštění koncentrátu zapíchněte do lahvičky přiloženou zavzdušňovací jehlu (obr. F) a veškerá pěna opadne. Odstraňte zavzdušňovací jehlu. Injekce 1. Pootočením a povytažením sejměte ochranný kryt z přiložené filtrační jehly a jehlu napojte na sterilní injekční stříkačku k jednorázovému použití. Do injekční stříkačky natáhněte roztok (Obr. G). 2. Odpojte filtrační jehlu od stříkačky a roztok podávejte pomalu intravenózně (maximální rychlost injekce: 2 ml/min.) pomocí přiloženého infuzního setu s křidélky (nebo pomocí přiložené jehly k jednorázovému použití). 3. Při domácí léčbě zajistěte, aby byly použité jehly a stříkačky vloženy zpět do krabičky soupravy pro rozpuštění a aby tato krabička byla vrácena zpět do hemofilického centra. 5/6
6 Infuze Pokud se podává v infuzi, je třeba použít infuzní soupravu k jednorázovému použití s odpovídajícím filtrem. obr.. A B C D E F G 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Baxter AG Industriestrasse 67 A-1221 Vídeň Rakousko 8. REGISTRAČNÍ ČÍSLO 16/118/81-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE / DATUM REVIZE TEXTU /6
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROTHROMPLEX TOTAL NF Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Prothrombinum multiplex humanum PROTHROMPLEX
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROTHROMPLEX TOTAL NF Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Prothrombinum multiplex humanum PROTHROMPLEX
Pomocné látky: natrium-kalcium-edetát trometamol-hydrochlorid trometamol roztok hydroxidu sodného 1mol/l kyselina chlorovodíková 25% voda na injekci
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější obal 20ml/ 50ml/ 60ml/ 100ml/ 150ml/ 200ml/ 500ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU XENETIX 300 300 mgi/ml Iobitridolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Iobitridolum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější obal 20ml/ 50ml/ 60ml/ 100ml/ 150ml/ 200ml/ 500ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU XENETIX 300 300 mgi/ml Iobitridolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Iobitridolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem
 sp.zn. sukls143762/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Atenativ je ve formě
sp.zn. sukls143762/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Atenativ, 50 IU/mL, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Atenativ je ve formě
Voda na injekci, hydrogenuhličitan sodný, hydroxid sodný, kyselina chlorovodíková
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (KARTONOVÁ KRABICE) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU balance 2,3% glucose, 1,75 mmol/l calcium 2. OBSAH LÉČIVÝCH LÁTEK 1 litr roztoku připraveného k použití obsahuje: Natrii chloridum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU (KARTONOVÁ KRABICE) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU balance 2,3% glucose, 1,75 mmol/l calcium 2. OBSAH LÉČIVÝCH LÁTEK 1 litr roztoku připraveného k použití obsahuje: Natrii chloridum
Jedna předplněná injekční stříkačka obsahuje immunoglobulinum humanum anti-d 1500 IU (300 mikrogramů).
 sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
 Příloha č. 2 k opravě rozhodnutí o změně registrace sp.zn. sukls141465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
Příloha č. 2 k opravě rozhodnutí o změně registrace sp.zn. sukls141465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mononine 500 IU, prášek pro přípravu injekčního nebo infuzního roztoku s rozpouštědlem.
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU. Krabička pro PVC-Al blistry a HDPE lahvičky 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. Pregabalin Archie Samuel 150 mg tvrdé tobolky
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička pro PVC-Al blistry a 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Pregabalin Archie Samuel 25 mg tvrdé tobolky Pregabalin Archie Samuel 50 mg tvrdé tobolky Pregabalin Archie Samuel
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na HDPE lahvičky 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA na HDPE lahvičky 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna potahovaná tableta obsahuje 10 mg (jako calcicum trihydricum). Jedna potahovaná tableta obsahuje 20 mg
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Obsah anti-d imunoglobulinu obsaženého v přípravku PARTOBULIN SDF je stanoven metodou dle Evropského lékopisu.
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls215609/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PARTOBULIN SDF Lidský anti-d imunoglobulin k intramuskulárnímu podání. 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls215609/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PARTOBULIN SDF Lidský anti-d imunoglobulin k intramuskulárnímu podání. 2. KVALITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III
 sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
BIOVISC ORTHO SINGLE
 Česky BIOVISC ORTHO SINGLE Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová 30 mg Fosfátem pufrovaný fyziologický
Česky BIOVISC ORTHO SINGLE Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová 30 mg Fosfátem pufrovaný fyziologický
Příbalová informace: Informace pro uživatele
 Příbalová informace: Informace pro uživatele Immunate Stim Plus 1000 IU FVIII/750 IU VWF Prášek a rozpouštědlo pro injekční roztok Léčivé látky: Factor VIII coagulationis humanus/ Factor von Willebrand
Příbalová informace: Informace pro uživatele Immunate Stim Plus 1000 IU FVIII/750 IU VWF Prášek a rozpouštědlo pro injekční roztok Léčivé látky: Factor VIII coagulationis humanus/ Factor von Willebrand
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Rhesonativ 625 IU/ml, injekční
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls12350/2006 a příloha k sp zn. sukls41484/2007, sukls49174/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Rhesonativ 625 IU/ml, injekční
Příloha č. 2 k rozhodnutí o nové registraci sp.zn.sukls219594/2010, sukls219596/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o nové registraci sp.zn.sukls219594/2010, sukls219596/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Wilate 500, 500 IU FVIII/500 IU VWF, prášek pro přípravu injekčního roztoku
Příloha č. 2 k rozhodnutí o nové registraci sp.zn.sukls219594/2010, sukls219596/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Wilate 500, 500 IU FVIII/500 IU VWF, prášek pro přípravu injekčního roztoku
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010 l. NÁZEV PŘÍPRAVKU OCTANINE F 500 OCTANINE F 1000 Prášek a rozpouštědlo pro injekční roztok Souhrn údajů o přípravku 2. KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls136749/2010 l. NÁZEV PŘÍPRAVKU OCTANINE F 500 OCTANINE F 1000 Prášek a rozpouštědlo pro injekční roztok Souhrn údajů o přípravku 2. KVANTITATIVNÍ
Jeden ml obsahuje: Proteinum plasmatis humani... 200 mg (čistota minimálně 98% IgG)
 1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
1. NÁZEV PŘÍPRAVKU Hizentra 200 mg/ml injekční roztok k subkutánnímu podání 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SCIg) Jeden ml obsahuje: Proteinum plasmatis humani...
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls37818/2011, sukls37843/2011, sukls37850/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FANHDI 25 IU/ml, prášek a rozpouštědlo pro injekční roztok FANHDI 50 IU/ml, prášek a rozpouštědlo pro
sp.zn.: sukls37818/2011, sukls37843/2011, sukls37850/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FANHDI 25 IU/ml, prášek a rozpouštědlo pro injekční roztok FANHDI 50 IU/ml, prášek a rozpouštědlo pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls211052/2011 a příloha k sp.zn. sukls134986/2011, sukls108195/2012 1. NÁZEV PŘÍPRAVKU Octanate 50 IU/ml SOUHRN ÚDAJŮ O PŘÍPRAVKU Prášek a rozpouštědlo
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls211052/2011 a příloha k sp.zn. sukls134986/2011, sukls108195/2012 1. NÁZEV PŘÍPRAVKU Octanate 50 IU/ml SOUHRN ÚDAJŮ O PŘÍPRAVKU Prášek a rozpouštědlo
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HUMAN ALBUMIN 50 g/l BAXTER Infuzní roztok Albuminum humanum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HUMAN ALBUMIN 50 g/l BAXTER Infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HUMAN ALBUMIN 50 g/l BAXTER Infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) rivastigminu, dospěl
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Haemate P
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls76361/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Haemate P Prášek pro přípravu injekčního roztoku s rozpouštědlem. (lidský koagulační faktor
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls76361/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Haemate P Prášek pro přípravu injekčního roztoku s rozpouštědlem. (lidský koagulační faktor
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Lipoplus 20% infuzní emulze 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml emulze obsahuje:
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls48002/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Lipoplus 20% infuzní emulze 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml emulze obsahuje:
Příbalová informace: Informace pro uživatele
 Příbalová informace: Informace pro uživatele Flolan 0,5 mg, prášek a rozpouštědlo pro infuzní roztok Flolan 1,5 mg, prášek a rozpouštědlo pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Příbalová informace: Informace pro uživatele Flolan 0,5 mg, prášek a rozpouštědlo pro infuzní roztok Flolan 1,5 mg, prášek a rozpouštědlo pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Infuzní roztok. Roztok je čirý, bezbarvý až slabě narůžověle-oranžový. Vnímání zabarvení se může lišit. Teoretická osmolarita: 305 mosm/l ph: 4,5 5,5
 Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
Sp.zn.sukls176520/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Paracetamol B. Braun 10 mg/ml infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml infuzního roztoku obsahuje paracetamolum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Nepoužívat v případě přecitlivělosti na léčivou látku, nebo na některou z pomocných látek.
 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU CaniLeish lyofilizát pro přípravu injekční suspenze s rozpouštědlem pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 1 ml obsahuje: Lyofilizát: Léčivé
1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU CaniLeish lyofilizát pro přípravu injekční suspenze s rozpouštědlem pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 1 ml obsahuje: Lyofilizát: Léčivé
Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas 133,5 mg a calcii carbonas 80 mg.
 Sp.zn.sukls222111/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gaviscon žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas
Sp.zn.sukls222111/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Gaviscon žvýkací tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna žvýkací tableta obsahuje natrii alginas 250 mg, natrii hydrogenocarbonas
Co naleznete v této příbalové informaci
 Příbalová informace: informace pro uživatele GAMMAGARD S/D Prášek a rozpouštědlo pro infuzní roztok Immunoglobulinum humanum normale ad usum intravenosum (IVIg) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele GAMMAGARD S/D Prášek a rozpouštědlo pro infuzní roztok Immunoglobulinum humanum normale ad usum intravenosum (IVIg) Přečtěte si pozorně celou příbalovou informaci
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009. PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum
 Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 1 k opravě sdělení sp.zn. sukls226519/2009 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE PARALEN 500 tablety Paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls15612/2008. Souhrn údajů o přípravku
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls15612/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TechneScan LyoMAA Katalogové číslo Mallinckrodt Medical: DRN 4378 Kit pro přípravu
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls15612/2008 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TechneScan LyoMAA Katalogové číslo Mallinckrodt Medical: DRN 4378 Kit pro přípravu
DIAGNOSTIKA A LÉČBA STREPTOKOKŮ SKUPINY B V TĚHOTENSTVÍ A ZA PORODU REVIZE DOPORUČENÉHO POSTUPU 2013
 DIAGNOSTIKA A LÉČBA STREPTOKOKŮ SKUPINY B V TĚHOTENSTVÍ A ZA PORODU REVIZE DOPORUČENÉHO POSTUPU 2013 A. Měchurová, J. Mašata, V. Unzeitig, P. Švihovec Screening: kultivační vyšetření ve 35. 37. týdnu grav.
DIAGNOSTIKA A LÉČBA STREPTOKOKŮ SKUPINY B V TĚHOTENSTVÍ A ZA PORODU REVIZE DOPORUČENÉHO POSTUPU 2013 A. Měchurová, J. Mašata, V. Unzeitig, P. Švihovec Screening: kultivační vyšetření ve 35. 37. týdnu grav.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls44489/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls44489/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls21416/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lithium Chlorid 0,15 mmol/ml LCO injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje lithii chloridum 6,36
sp.zn. sukls21416/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Lithium Chlorid 0,15 mmol/ml LCO injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje lithii chloridum 6,36
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. INTRATECT 50 g/l infuzní roztok Immunoglobulinum humanum normale ad usum intravenosum (IVIg)
 Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls228408/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INTRATECT 50 g/l infuzní roztok Immunoglobulinum humanum normale ad usum intravenosum (IVIg)
Příloha č. 1 k rozhodnutí o registraci sp.zn. sukls228408/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INTRATECT 50 g/l infuzní roztok Immunoglobulinum humanum normale ad usum intravenosum (IVIg)
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls16744/2009
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls16744/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) Injekční suspenze 2.
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls16744/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) Injekční suspenze 2.
Po naředění rozpouštědlem přípravek obsahuje 1 mg eptakogu alfa (aktivovaného)/ml a 10 mg sacharózy/ml.
 1. NÁZEV PŘÍPRAVKU NovoSeven 5 mg (250 KIU) prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ NovoSeven je dodáván jako prášek pro přípravu injekčního roztoku s rozpouštědlem
1. NÁZEV PŘÍPRAVKU NovoSeven 5 mg (250 KIU) prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ NovoSeven je dodáván jako prášek pro přípravu injekčního roztoku s rozpouštědlem
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ALBUREX 20 200g/l, infuzní roztok Albuminum humanum
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls26988/2010 a příloha k sp. zn. sukls 72113/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUREX 20 200g/l, infuzní roztok Albuminum humanum
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls26988/2010 a příloha k sp. zn. sukls 72113/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ALBUREX 20 200g/l, infuzní roztok Albuminum humanum
Příbalová informace: informace pro pacienta. Panadol Baby čípky paracetamolum čípky
 sp. zn. sukls29099/2016 Příbalová informace: informace pro pacienta Panadol Baby čípky paracetamolum čípky Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp. zn. sukls29099/2016 Příbalová informace: informace pro pacienta Panadol Baby čípky paracetamolum čípky Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele FACTOR VII BAXALTA 600 IU, Prášek a rozpouštědlo pro injekční roztok (Factor VII coagulationis humanus) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele FACTOR VII BAXALTA 600 IU, Prášek a rozpouštědlo pro injekční roztok (Factor VII coagulationis humanus) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Souhrn údajů o přípravku
 Příloha č. 1 ke sdělení sp.zn.: sukls204427/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PRIORIX prášek pro přípravu injekčního roztoku s rozpouštědlem Živá atenuovaná vakcína proti spalničkám, příušnicím
Příloha č. 1 ke sdělení sp.zn.: sukls204427/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PRIORIX prášek pro přípravu injekčního roztoku s rozpouštědlem Živá atenuovaná vakcína proti spalničkám, příušnicím
PŘÍPRAVA PACIENTA : Speciální příprava pacienta ani dieta není nutná, pro obvyklé vyšetřování je vhodný odběr ráno, nalačno.
 SEROLOGIE HEPATITID NÁZEV : Hepatitida A HAV-IgM POUŽITÍ : kvalitativní detekce protilátek proti viru hepatitidy A třídy IgM v lidském séru a plazmě při diagnostice akutní nebo nedávno proběhlé virové
SEROLOGIE HEPATITID NÁZEV : Hepatitida A HAV-IgM POUŽITÍ : kvalitativní detekce protilátek proti viru hepatitidy A třídy IgM v lidském séru a plazmě při diagnostice akutní nebo nedávno proběhlé virové
NAC AL 100 šumivé tablety NAC AL 200 šumivé tablety ( Acetylcysteinum)
 Příbalová informace Milá pacientko, milý paciente, prosím, čtěte pozorně následující informaci, protože obsahuje důležité údaje pro používání tohoto léku. S případnými dalšími otázkami se obracejte, prosím,
Příbalová informace Milá pacientko, milý paciente, prosím, čtěte pozorně následující informaci, protože obsahuje důležité údaje pro používání tohoto léku. S případnými dalšími otázkami se obracejte, prosím,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls97211/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls97211/2010 1. NÁZEV PŘÍPRAVKU Omegaven Infuzní emulze S o u h r n ú d a j ů o p ř í p r a v k u 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml infuzní
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls97211/2010 1. NÁZEV PŘÍPRAVKU Omegaven Infuzní emulze S o u h r n ú d a j ů o p ř í p r a v k u 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml infuzní
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54
1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze Příloha č.1 k rozhodnutí o opravě sp.zn.sukls4014/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls143344/2012 a sp.zn. sukls247623/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 8,4% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku
sp.zn. sukls143344/2012 a sp.zn. sukls247623/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hydrogenuhličitan sodný 8,4% (w/v) - BRAUN infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1000 ml roztoku
NEREGISTROVANÝ PŘÍPRAVEK použití povoleno v rámci specifického léčebného programu SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Loxicom 0,5 mg/ml perorální suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje Účinná látka: Meloxicamum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Loxicom 0,5 mg/ml perorální suspenze pro psy 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje Účinná látka: Meloxicamum
Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen
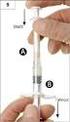 Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen NovoThirteen : rekombinantní léčba vrozeného nedostatku podjednotky A faktoru XIII Před použitím přípravku NovoThirteen je důležité
Vlastnosti přípravku, příprava a podání Návod k přípravku NovoThirteen NovoThirteen : rekombinantní léčba vrozeného nedostatku podjednotky A faktoru XIII Před použitím přípravku NovoThirteen je důležité
MITHON PVB PRŮMYSLOVÝ KONZERVAČNÍ PŘÍPRAVEK
 MITHON PVB PRŮMYSLOVÝ KONZERVAČNÍ PŘÍPRAVEK Mithon PVB je určen ke konzervaci nebo k potlačení nežádoucího mikrobiálního napadení surovin nebo průmyslových výrobků. Je používán především v textilním, kožedělném,
MITHON PVB PRŮMYSLOVÝ KONZERVAČNÍ PŘÍPRAVEK Mithon PVB je určen ke konzervaci nebo k potlačení nežádoucího mikrobiálního napadení surovin nebo průmyslových výrobků. Je používán především v textilním, kožedělném,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls204563/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Engerix-B 10 µg Engerix-B 20 µg Injekční suspenze Rekombinantní (rdna) vakcína proti hepatitidě B, adsorbovaná 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn. sukls204563/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Engerix-B 10 µg Engerix-B 20 µg Injekční suspenze Rekombinantní (rdna) vakcína proti hepatitidě B, adsorbovaná 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií na Saccharomyces cerevisiae).
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Insulatard 100 m.j./ml Injekční suspenze v injekční lahvičce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Insulinum humanum, rdna (vyrobený rekombinantní DNA technologií
Injekční roztok. Tmavě hnědý, neprůhledný roztok s ph 5,0 7,0 a s přibližnou osmolaritou 400 mosm/l.
 sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp.zn. sukls57833/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124912/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124912/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124912/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Souhrn údajů o přípravku
 sp. zn. sukls168363/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU FLECTOR EP GEL gel diclofenacum epolaminum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum epolaminum 1,292 g odpovídá Diclofenacum
sp. zn. sukls168363/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU FLECTOR EP GEL gel diclofenacum epolaminum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum epolaminum 1,292 g odpovídá Diclofenacum
* Vyrobený technologií rekombinatní DNA v ovariálních buňkách čínských křečků.
 87 1. NÁZEV PŘÍPRAVKU NeoRecormon 10 000 IU injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s 0,6 ml injekčního roztoku obsahuje
87 1. NÁZEV PŘÍPRAVKU NeoRecormon 10 000 IU injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka s 0,6 ml injekčního roztoku obsahuje
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010
 Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příbalová informace: informace pro uživatele. Voluven. 6% infuzní roztok
 sp.zn. sukls12104/2014 Příbalová informace: informace pro uživatele Voluven 6% infuzní roztok Hydroxyethylamyla (hydroxyethylškroby, HES 130/0,4) v izotonickém roztoku chloridu sodného Tento přípravek
sp.zn. sukls12104/2014 Příbalová informace: informace pro uživatele Voluven 6% infuzní roztok Hydroxyethylamyla (hydroxyethylškroby, HES 130/0,4) v izotonickém roztoku chloridu sodného Tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Injekční suspenze, adsorbovaná vakcína proti tetanu, bez konzervačních prosředků
 Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Pomocná látka se známým účinkem: 1 g masti obsahuje 2 mg kyseliny sorbové.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum 4 mg a nicoboxilum 25 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finalgon 4 mg/g + 25 mg/g, mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje nonivamidum 4 mg a nicoboxilum 25 mg. Pomocná látka se známým účinkem:
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příprava a podání injekce Průvodce pro pacienty pro přípravu a podání přípravku ILARIS pro léčbu kryopyrin asociovaného periodického syndromu (CAPS)
 Příprava a podání injekce Průvodce pro pacienty pro přípravu a podání přípravku ILARIS pro léčbu kryopyrin asociovaného periodického syndromu (CAPS) ILARIS 150 mg, prášek pro injekční roztok Doporučené
Příprava a podání injekce Průvodce pro pacienty pro přípravu a podání přípravku ILARIS pro léčbu kryopyrin asociovaného periodického syndromu (CAPS) ILARIS 150 mg, prášek pro injekční roztok Doporučené
Fiprex cat 52,2ml 1 x 0,7 ml
 Fiprex cat 52,2ml 1 x 0,7 ml Popis zboží: 1. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fipronil 52.5 mg / 0.7 PHARMACEUTICAL FORM Roztok k aplikaci na kůži. KLINICKÉ ÚDAJE Cílový druh zvířat Kočky Indikace
Fiprex cat 52,2ml 1 x 0,7 ml Popis zboží: 1. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fipronil 52.5 mg / 0.7 PHARMACEUTICAL FORM Roztok k aplikaci na kůži. KLINICKÉ ÚDAJE Cílový druh zvířat Kočky Indikace
Příbalová informace: Informace pro uživatele
 Příbalová informace: Informace pro uživatele ReFacto AF 250 IU prášek a rozpouštědlo pro injekční roztok ReFacto AF 500 IU prášek a rozpouštědlo pro injekční roztok ReFacto AF 1000 IU prášek a rozpouštědlo
Příbalová informace: Informace pro uživatele ReFacto AF 250 IU prášek a rozpouštědlo pro injekční roztok ReFacto AF 500 IU prášek a rozpouštědlo pro injekční roztok ReFacto AF 1000 IU prášek a rozpouštědlo
Tato vakcína může obsahovat stopy neomycinu použitého v průběhu výrobního procesu (viz bod 4.3).
 1. NÁZEV PŘÍPRAVKU Twinrix Paediatric, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV PŘÍPRAVKU Twinrix Paediatric, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ
3. LÉKOVÁ FORMA Injekční suspenze v předplněné injekční stříkačce. Vakcína, po jemném protřepání, je lehce bělavá a opalizující tekutina.
 sp. zn. sukls79480/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vaxigrip, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná, štěpený virion). 2. KVALITATIVNÍ A
sp. zn. sukls79480/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vaxigrip, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná, štěpený virion). 2. KVALITATIVNÍ A
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Metronidazol B. Braun 5 mg/ml, infuzní roztok. metronidazolum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Metronidazol B. Braun 5 mg/ml, infuzní roztok metronidazolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Proviron - 25 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesterolonum 25 mg v 1 tabletě Pomocné látky: monohydrát laktózy, methylparaben, propylparaben
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Proviron - 25 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: mesterolonum 25 mg v 1 tabletě Pomocné látky: monohydrát laktózy, methylparaben, propylparaben
Kontaminované transfuzní přípravky vydané k hemoterapii
 Kontaminované transfuzní přípravky vydané k hemoterapii Hana Lejdarová Transfuzní a tkáňové oddělení 8. STŘEŠOVICKÝ TRANSFUZNÍ DEN 26. LISTOPADU 2014 TRANSFUSION TRANSMITED INFECTIONS Plísně Paraziti Bakterie
Kontaminované transfuzní přípravky vydané k hemoterapii Hana Lejdarová Transfuzní a tkáňové oddělení 8. STŘEŠOVICKÝ TRANSFUZNÍ DEN 26. LISTOPADU 2014 TRANSFUSION TRANSMITED INFECTIONS Plísně Paraziti Bakterie
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn.sukls125832/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROVIRSAN 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje aciclovirum 200 mg. Pomocné látky se známým účinkem:
sp. zn.sukls125832/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROVIRSAN 200 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje aciclovirum 200 mg. Pomocné látky se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CHLORID SODNÝ 0,9% BAXTER 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Natrii chloridum: 9,0 g/l Jeden ml roztoku obsahuje 9 mg natrii chloridum mmol/l: Na + : 154
MITHON NVA KONZERVAČNÍ PŘÍPRAVEK PRO ZDIVO A POVLAKY
 MITHON NVA KONZERVAČNÍ PŘÍPRAVEK PRO ZDIVO A POVLAKY Mithon NVA je určen ke konzervaci nebo k potlačení nežádoucího mikrobiálního napadení zdiva nebo jiných stavebních materiálů. Mithon NVA je dále určen
MITHON NVA KONZERVAČNÍ PŘÍPRAVEK PRO ZDIVO A POVLAKY Mithon NVA je určen ke konzervaci nebo k potlačení nežádoucího mikrobiálního napadení zdiva nebo jiných stavebních materiálů. Mithon NVA je dále určen
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010
 Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Pantoprazol Pliva 40 mg I.V. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtete
Příloha č. 2 k rozhodnutí o převodu registrace sp.zn.sukls156759/2010 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE Pantoprazol Pliva 40 mg I.V. prášek pro přípravu injekčního roztoku Pantoprazolum Přečtete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FACTOR VII BAXALTA 600 IU Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek FACTOR VII BAXALTA je dodáván ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FACTOR VII BAXALTA 600 IU Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek FACTOR VII BAXALTA je dodáván ve formě
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prekurzor radiofarmaka Yttriga, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sterilního roztoku obsahuje 0,1-300 GBq yttria ( 90 Y) (což
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Prekurzor radiofarmaka Yttriga, roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml sterilního roztoku obsahuje 0,1-300 GBq yttria ( 90 Y) (což
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014
 sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
sp.zn sukls14613/2014 a sp.zn. sukls84610/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ambrosan 15 mg/5 ml sirup sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje ambroxoli hydrochloridum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls2006/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PANADOL Rapide potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls153370-72/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gemtex 200 mg, prášek pro přípravu infuzního roztoku Gemtex 1 000 mg, prášek pro přípravu
Příloha č. 2 k rozhodnutí o registraci sp. zn. sukls153370-72/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gemtex 200 mg, prášek pro přípravu infuzního roztoku Gemtex 1 000 mg, prášek pro přípravu
PŘÍBALOVÁ INFORMACE MEDICINÁLNÍ KYSLÍK PLYNNÝ MESSER
 sp.zn. sukls234316/2015 PŘÍBALOVÁ INFORMACE MEDICINÁLNÍ KYSLÍK PLYNNÝ MESSER Medicinální plyn, stlačený Oxygenum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn. sukls234316/2015 PŘÍBALOVÁ INFORMACE MEDICINÁLNÍ KYSLÍK PLYNNÝ MESSER Medicinální plyn, stlačený Oxygenum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls33774/2011 Sp.zn.sukls30163/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Omacor, 1000 mg, měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje Omega-3 acidorum esteri
sp.zn.sukls33774/2011 Sp.zn.sukls30163/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Omacor, 1000 mg, měkké tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje Omega-3 acidorum esteri
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
PARALEN 500 tablety. Doporučené dávkování paracetamolu; VĚK HMOTNOST Jednotlivá dávka Max. denní dávka 21-25 kg
 Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
Příloha č. 2 k opravě sdělení sp.zn. sukls226519/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje paracetamolum 500 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls119411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nanocoll 500 mikrogramů, kit pro radiofarmakum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Koloidní částice lidského albuminu: 500 mikrogramů/lahvička
sp.zn. sukls119411/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nanocoll 500 mikrogramů, kit pro radiofarmakum 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Koloidní částice lidského albuminu: 500 mikrogramů/lahvička
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls148132/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nalbuphin OrPha, 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn. sukls148132/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Nalbuphin OrPha, 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SEROLOGIE HEPATITID. plazmu a skladovat při -20 C
 SEROLOGIE HEPATITID NÁZEV : Hepatitida A HAV-IgM ABBOTT Architect POUŽITÍ : kvalitativní detekce protilátek proti viru hepatitidy A třídy IgM v lidském séru a plazmě při diagnostice akutní nebo nedávno
SEROLOGIE HEPATITID NÁZEV : Hepatitida A HAV-IgM ABBOTT Architect POUŽITÍ : kvalitativní detekce protilátek proti viru hepatitidy A třídy IgM v lidském séru a plazmě při diagnostice akutní nebo nedávno
sp.zn.sukls188553/2014
 sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
sp.zn.sukls188553/2014 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU tablety s prodlouženým uvolňováním. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje pentoxifyllinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SALBUTAMOL WZF POLFA 2 SALBUTAMOL WZF POLFA 4 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls250585/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SALBUTAMOL WZF POLFA 2 SALBUTAMOL WZF POLFA 4 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
4.3. Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
 sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 k opravě rozhodnutí o prodloužení registrace sp. zn. sukls125313/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 1 k opravě rozhodnutí o prodloužení registrace sp. zn. sukls125313/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Ringerfundin B. Braun Infuzní roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010 1. NÁZEV PŘÍPRAVKU MONO MACK DEPOT MONO MACK 50 D tablety s proslouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls74848/2010 1. NÁZEV PŘÍPRAVKU MONO MACK DEPOT MONO MACK 50 D tablety s proslouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
