Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání
|
|
|
- Ludvík Vávra
- před 7 lety
- Počet zobrazení:
Transkript
1 Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování a podávání II. Rekonstituce bortezomibu III. Dávkovací pravítko pomůcka pro stanovení tělesného povrchu IV. Indukční režimy před transplantací V. Graf indukčních režimů před transplantací 1
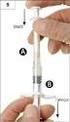
2 I. Důležité informace týkající se REKONSTITUCE, DÁVKOVÁNÍ A PODÁVÁNÍ Správná rekonstituce pro s.c. a i.v. podání Bortezomib 3,5 mg, prášek pro injekční roztok, lze podávat buď intravenózně, nebo subkutánně, avšak rekonstituce se u těchto způsobů podání liší. Byly popsány fatální případy po neúmyslném intratekálním podání bortezomibu. Bortezomib se nesmí podávat intratekálně. Pouze k subkutánnímu nebo intravenóznímu podání. Nepodávejte jinými způsoby. Intratekální podání vedlo k úmrtí. Vezměte, prosím, na vědomí, že bortezomib může být též dostupný v jiných silách než 3,5 mg/lahvičku. Návod ke způsobu podání a další informace naleznete v Souhrnu údajů o přípravku (SPC) příslušného přípravku. Léčba musí být zahájena a prováděna pod dohledem lékaře s kvalifikací a zkušenostmi v používání cytostatik. Bortezomib musí být rekonstituován zdravotnickými pracovníky. Po celou dobu zacházení s bortezomibem musí být striktně dodržovány aseptické postupy, protože přípravek neobsahuje žádné konzervační látky. Jak se vyhnout potenciálnímu riziku chyb při podání Aby se zabránilo chybám v dávkování, je třeba opatrnosti při rekonstituci bortezomibu, protože objem potřebný pro rekonstituci při subkutánním podání je nižší (1,4 ml) než při podání intravenózním (3,5 ml), což vede k vyšší koncentraci naředěného léčiva (detaily jsou uvedeny v tabulkách 1 a 2). Jelikož se koncentrace léčiva po rekonstituci pro s.c. a i.v. podání liší, je třeba zvláštní opatrnosti při výpočtu objemu rekonstituovaného léčiva, které má být podáno pacientovi podle předepsané dávky. Příklady dávkování pro odlišné způsoby podání najdete na stranách 6 a 7. 2
3 Subkutánní způsob podání Příprava 3,5 mg lahvičky 1. Jednu 3,5 mg lahvičku bortezomibu rekonstituujte vstříknutím 1,4 ml sterilního roztoku chloridu sodného 9 mg/ml (0,9%) pro injekci. Lyofilizovaný prášek se úplně rozpustí do dvou minut. 2. Po rekonstituci je v jednom ml obsaženo 2,5 mg bortezomibu. 3. Rekonstituovaný roztok musí být čirý a bezbarvý. Před podáním musí být roztok vizuálně zkontrolován na přítomnost nečistot a změnu barvy. Pokud je zpozorovány změna barvy a/nebo přítomnost částic, musí být rekonstituovaný roztok zlikvidován. Vezměte, prosím, na vědomí: Výsledná koncentrace léčivého přípravku po rekonstituci k s.c. podání (2,5 mg/ml), je 2,5 krát vyšší než pro i.v. podání (1 mg/ml), proto je pro s.c. podání třeba použít menší objem roztoku. Po rozpuštění odeberte příslušné množství rekonstituovaného roztoku podle dávky vypočtené na povrch těla pacienta (BSA). Při výpočtu dávky, která má být podána, je třeba opatrnosti. Aby se zabránilo chybám při podání, označte stříkačku (např. nálepkou) zamýšleným způsobem podání. 3
4 Intravenózní způsob podání Příprava 3,5 mg lahvičky 1. Jednu 3,5 mg lahvičku bortezomibu rekonstituujte vstříknutím 3,5 ml sterilního roztoku chloridu sodného 9 mg/ml (0,9%) pro injekci. Lyofilizovaný prášek se úplně rozpustí do dvou minut. 2. Po rekonstituci je v jednom ml obsažen 1 mg bortezomibu. 3. Rekonstituovaný roztok musí být čirý a bezbarvý. Před podáním musí být roztok vizuálně zkontrolován na přítomnost nečistot a změnu barvy. Pokud je zpozorována změna barvy a/nebo přítomnost částic, musí být rekonstituovaný roztok zlikvidován. Po rozpuštění odeberte příslušné množství rekonstituovaného roztoku podle dávky vypočtené na povrch těla pacienta (BSA). Při výpočtu dávky, která má být podána, je třeba opatrnosti. Aby se zabránilo chybám při podání, označte stříkačku (např. nálepkou) zamýšleným způsobem podání. 4
5 Příklady dávkování pro s.c. a i.v. podání Obecné poznámky: Množství bortezomibu (v mg), které má být podáno, vychází z výpočtu povrchu těla (BSA) za použití standardního nomogramu nebo podle zavedených postupů. Povrch těla může být též vypočítán podle dávkovacího pravítka přiloženého k této příručce. Další příklady dávkování jsou uvedeny na tomto pravítku. Množství léčivého přípravku obsaženého v jedné lahvičce (3,5 mg) může převyšovat požadovanou dávku. Při výpočtu dávky je třeba opatrnosti, aby se předešlo předávkování. Pokud je vypočtený objem pro i.v. podání použit s koncentrací pro s.c. podání, dojde k předávkování pacienta. Pokud je vypočtený objem pro s.c. podání použit s koncentrací pro i.v. podání, dojde k poddávkování pacienta. Příklad 1 BSA: 1,7 m 2, dávka: 1,3 mg/m 2 5
6 Příklad 2 BSA: 1,95 m 2, dávka: 1,3 mg/m 2 Příklad 3 BSA: 1,6 m 2, Dávka: 1,0 mg/m 2 6
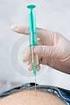
7 OBECNÉ INFORMACE Bortezomib je cytotoxická látka. Při manipulaci a přípravě roztoku je proto potřeba postupovat s opatrností. Doporučuje se používat ochranné rukavice a ochranný oděv, aby se předešlo kontaktu s kůží. Určeno pouze k subkutánnímu nebo intravenóznímu podání. Nepodávejte jinak. Intratekální podání vedlo k úmrtí. Doba použitelnosti: viz SPC příslušného přípravku Rekonstituovaný roztok použití a likvidace Bortezomib je určen pro jednorázové použití. Uchovávání rekonstituovaného roztoku: viz SPC příslušného přípravku Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Subkutánní podání Před použitím zkontrolujte dávku ve stříkačce (zkontrolujte, zda stříkačka nese označení pro s.c. podání). Vstříkněte roztok podkožně v úhlu Rekonstituovaný roztok se má aplikovat subkutánně do stehen nebo břicha, přičemž místa podání by se měla být postupně střídat. Je třeba se vyvarovat aplikaci injekcí do stejného místa. Zvolte mezi: - pravou a levou stranou břicha (horní nebo dolní kvadrant) - pravým nebo levým stehnem (proximální a distální lokalizace) Pokud byla indikována antivirová profylaxe, upozorněte pacienty, aby ji užívali. 7
8 Intravenózní podání Před použitím zkontrolujte dávku a ve stříkačce (zkontrolujte, zda stříkačka nese označení pro intravenózní podání). Aplikujte roztok jako intravenózní bolus po dobu 3-5 sekund za použití periferního nebo centrálního žilního katetru. Mezi jednotlivými dávkami bortezomibu má uplynout doba alespoň 72 hodin. Vypláchněte periferní nebo centrální žilní katetr sterilním, 9 mg/ml (0,9 %) roztokem chloridu sodného. Pokud byla indikována antivirová profylaxe, upozorněte pacienty, aby ji užívali. Kompletní informaci o přípravcích dotčených těmito Edukačními materiály naleznete v příslušném Souhrnu údajů o přípravku. Žádáme zdravotnické pracovníky, aby jakékoliv podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob neodkladně nahlásili na SÚKL: Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance Šrobárova Praha 10 farmakovigilance@sukl.cz Kontakty Máte-li nějaké otázky nebo požadujete-li další informace, použijte prosím následující kontakty: Bortezomib Actavis: Actavis CZ a.s., Radlická 608/2, Praha 5, tel.: , actavis@actavis.cz Bortezomib Teva: Teva Pharmaceuticals CR, s.r.o., Sokolovská 136A, Praha 8. Nežádoucí účinky: MUDr. Petra Kovaříková, tel , Safety.Czech@teva.cz. Medicínské oddělení: MUDr. Petr Jeníček, tel , Petr.Jenicek@teva.cz Bortezomib Accord: Accord Healthcare s.r.o., J.A. Bati 5648, Zlín, Česká republika, tel: , , fax: , safety@lambda-cro.com Bortezomib Zentiva: sanofi-aventis, s.r.o., Evropská 846/176a, , Praha, tel.: , cz-info@sanofi.com Bortega: Heaton k.s., Na Pankráci 14, Praha 4, MUDr. Jaromír Frič, tel , farmakovigilance@heaton.cz, Ing. Alžběta Frýbortová, tel , alzbeta.frybortova@heaton.cz Zegomib: Egis Praha, s.r.o., Ovocný trh 1096/8, Praha 1, tel: , egispraha@egispraha.cz 8
9 II. Rekonstituce bortezomibu Bortezomib 3,5 mg, prášek pro injekční roztok, lze podávat buď intravenózně, nebo subkutánně, avšak rekonstituce se u těchto způsobů podání liší. Subkutánní podání Při rekonstituci přidejte 1,4 ml sterilního 0,9% roztoku chloridu sodného do lahvičky bortezomibu pro dosažení výsledné koncentrace 2,5 mg/ml Intravenózní podání Při rekonstituci přidejte 3,5 ml sterilního 0,9% roztoku chloridu sodného do lahvičky přípravku Bortezomib Actavis 3,5 mg k získání finální koncentrace 1 mg/ml Objem rozpouštědla použitého k rekonstituci bortezomibu k s.c. podání se liší od objemu k i.v. podání. V důsledku přidání odlišného objemu mají roztoky po rekonstituci odlišnou koncentraci léčivé látky. Bortezomib musí být rekonstituován pouze zdravotnickým pracovníkem za použití aseptických technik, protože přípravek neobsahuje žádné konzervační látky. Bortezomib je cytotoxická látka. Proto je během zacházení s přípravkem a přípravy roztoku třeba opatrnosti. Doporučuje se používat rukavice a ochranný oděv, aby se předešlo kontaktu s kůží. Rekonstituovaný roztok se má použít okamžitě po přípravě. Fyzikální a chemická stabilita připraveného roztoku byla prokázána po dobu 8 hodin při 25 C, pokud je uchováván v původní lahvičce a/nebo injekční stříkačce. Uchovávání rekonstituovaného roztoku viz SPC jednotlivých přípravků. Aby se předešlo chybám při podání, měly by být injekční stříkačky pro s.c. a i.v. podání po rekonstituci označeny odlišným způsobem, například nálepkou. Pouze k subkutánnímu nebo intravenóznímu podání. Nepodávejte jinými způsoby. Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. Vezměte, prosím, na vědomí: Bortezomib též může být dostupný v jiných silách, než 3,5 mg/lahvičku. Postup při podání a další informace naleznete v Souhrnu údajů o přípravku (SPC) příslušného přípravku. 9
10 III. Dávkovací pravítko pomůcka pro stanovení plochy tělesného povrchu Přední strana: POKYNY: Nastavte tělesnou hmotnost v kg a výšku v cm a odečtěte tělesný povrch v místě šipky. Pouze k subkutánnímu nebo intravenóznímu podání. Nepodávejte jinými způsoby. Pro úpravu dávkování, prosím, čtěte část Dávkování a způsob podání v SPC. Rekonstituce bortezomibu 3,5 mg pro s.c. injekci Způsob podání Pouze k subkutánnímu podání Velikost balení Rekonstituovaný objem 3,5 mg 1,4 ml 2,5 mg/ml Finální koncentrace Rekonstituce roztoku 3,5 mg pro i.v. injekci Způsob podání Pouze k intravenóznímu podání Velikost balení Rekonstituovaný objem Finální koncentrace 3,5 mg 3,5 ml 1,0 mg/ml 10
11 Zadní strana: Způsob podání i.v. podání Rekonstituovaný roztok se aplikuje do žíly jako intravenózní bolus po dobu 3-5 sekund za použití periferního nebo centrálního žilního katetru a vypláchne sterilním 9 mg/ml (0,9 %) roztokem chloridu sodného. s.c. podání Rekonstituovaný roztok se aplikuje subkutánně do stehen (vpravo nebo vlevo, proximálně nebo distálně) nebo do břicha (vpravo nebo vlevo, horní nebo dolní kvadrant). Pro následné podání se mají místa aplikace střídat. Příklad Povrch těla v m 2 Celková požadovaná dávka (v mg) při dávkování 1,3 mg/m 2 Podaný objem při i.v. podání (v ml) 1,5 1,95 1,95 0,78 1,6 2,08 2,08 0,83 1,7 2,21 2,21 0,88 1,8 2,34 2,34 0,94 1,9 2,47 2,47 0,99 2,0 2,60 2,60 1,04 2,1 2,73 2,73 1,09 Podaný objem při s.c. podání (v ml) Odkazy: Moreau et al, Haematologica 2008; 93(12) Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 10, , farmakovigilance@sukl.cz. 11
12 IV. Indukčnı režimy před transplantacı Dávkování a trvání léčby Bortezomib je v kombinaci s dexamethasonem nebo s dexamethasonem a thalidomidem indikován k indukční léčbě dospělých pacientů s dosud neléčeným mnohočetným myelomem, kteří jsou vhodní pro vysokodávkovou chemoterapii s transplantací hematopoetických kmenových buněk. Dávkování u pacientů s dosud neléčeným mnohočetným myelomem, kteří jsou vhodní pro transplantaci hematopoetických kmenových buněk: 1. Kombinovaná léčba s dexamethasonem Bortezomib 3,5 mg prášek pro přípravu injekčního roztoku se podává intravenózní nebo podkožní (subkutánní) injekcí v doporučené dávce 1,3 mg/m 2 povrchu těla dvakrát týdně po dobu dvou týdnů, 1., 4., 8. a 11. den, pak následuje 10-denní přestávka v léčbě mezi dnem. Toto 3-týdenní období se považuje za jeden terapeutický cyklus. Podávají se čtyři terapeutické cykly s bortezomibem. Mezi po sobě jdoucími dávkami bortezomibu má uplynout alespoň 72 hodin. Dexamethason se podává perorálně v dávce 40 mg v 1., 2., 3., 4. a 8., 9., 10. a 11. den terapeutického cyklu s bortezomibem. Bortezomib + Dexamethason* Cykly 1 až 4** Týden Bortezomib (1,3 mg/m 2 ) 1., 4. den 8., 11. den přestávka Dexamethason 40 mg 1., 2., 3., 4. den 8., 9., 10., 11. den - * Dexamethason se podává perorálně v dávce 40 mg 1., 2., 3., 4., 8., 9., 10. a 11. den terapeutického cyklu s bortezomibem. ** Do 4 cyklů 2. Kombinovaná léčba s dexamethasonem a thalidomidem Bortezomib 3,5 mg prášek pro přípravu injekčního roztoku se podává intravenózní nebo podkožní (subkutánní) injekcí v doporučené dávce 1,3 mg/m 2 povrchu těla dvakrát týdně po dobu dvou týdnů v 1., 4., 8. a 11. den, pak následuje 17-denní přestávka v léčbě během dne. Toto 4-týdenní období se považuje za jeden terapeutický cyklus. Podávají se čtyři terapeutické cykly s bortezomibem. Doporučuje se, aby pacienti s alespoň částečnou odpovědí dostali další 2 cykly. Odstup mezi po sobě jdoucími dávkami bortezomibu musí činit nejméně 72 hodin. Dexamethason se podává perorálně v dávce 40 mg v 1., 2., 3., 4. a v 8., 9., 10. a 11. den terapeutického cyklu s bortezomibem. Thalidomid se podává perorálně v dávce 50 mg denně v den, a pokud ho pacient toleruje, dávka se pak zvýší na 100 mg denně den, a může se pak dále zvýšit na 200 mg denně. 12
13 Bortezomib + Dexamethason* + Thalidomid** Cyklus 1 Týden Bortezomib (1,3 mg/m 2 ) 1., 4. den 8., 11. den přestávka přestávka Thalidomid 50 mg denně denně - - Thalidomid 100 mg - - denně denně Dexamethason 40 mg 1., 2., 3., 4. den 8., 9., 10., 11. den - - Cykly 2 až 4*** Bortezomib (1,3 mg/m 2 ) 1., 4. den 8., 11. den přestávka přestávka Thalidomid 200 mg denně denně denně denně Dexamethason 40 mg 1., 2., 3., 4. den 8., 9., 10., 11. den - - * Dexamethason se podává perorálně v dávce 40 mg 1., 2., 3., 4., 8., 9., 10. a 11. den terapeutického cyklu s bortezomibem ** Dávka thalidomidu se zvyšuje na 100 mg od 3. týdne 1. cyklu, pouze pokud pacient toleruje dávku 50 mg a na 200 mg od 2. cyklu, pokud toleruje dávku 100 mg. *** Pacientům, kteří po 4 cyklech dosáhnou alespoň částečnou odpověď, lze podat až 6 cyklů. Důležitá poznámka: Pacienti užívající bortezomib spolu s thalidomidem se mají řídit programem pro prevenci gravidity u přípravku thalidomid. Pro další informace si přečtěte Souhrn údajů o přípravku thalidomid. Úpravy dávky pro pacienty vhodné k transplantaci U pacientů s periferní neuropatií, by mělo být dávkování bortezomibu upraveno dle níže uvedené tabulky 1. Pokud je bortezomib podáván v kombinaci s jinými léčivými přípravky, je třeba v případě výskytu toxicity zvážit vhodnou úpravu dávkování pro tyto léky dle doporučení v příslušných souhrnech údajů o těchto přípravcích. Tabulka 1: Doporučené* úpravy dávkování bortezomibu v souvislosti s neuropatií Závažnost neuropatie Úprava dávkování Stupeň 1 (asymptomatická, ztráta hlubokých Žádná šlachových reflexů nebo parestezie) bez bolesti nebo ztráty funkce Stupeň 1 s bolestí nebo stupeň 2 [středně závažné příznaky, omezení instrumentálních aktivit denního života (Activities of Daily Living = ADL)**] Stupeň 2 s bolestí nebo stupeň 3 (závažné příznaky, omezení sebeobslužných ADL***) Stupeň 4 (život ohrožující následky, nutná okamžitá intervence) a/nebo závažná autonomní neuropatie Snížit dávku bortezomibu na 1,0 mg/m 2 nebo změnit dávkovací režim bortezomibu na 1,3 mg/m 2 jednou týdně Přerušit léčbu bortezomibem, dokud projevy toxicity neustoupí. Po ústupu toxicity obnovit léčbu bortezomibem a snížit dávku na 0,7 mg/m 2 jednou týdně. Vysadit léčbu bortezomibem * Založeno na úpravě dávkování ve studiích mnohočetného myelomu fáze II a III a na post-marketingové zkušenosti. Stupnice podle NCI Common Toxicity Criteria CTCAE v 4.0; ** Instrumentální ADL: vztahuje se k přípravě pokrmů, nákupu potravin nebo oděvů, používání telefonu, zacházení s penězi apod.; *** Sebeobslužné ADL: vztahuje se ke koupání, oblékání a svlékání, konzumaci potravy, použití toalety, užívání léků, nikoli k upoutání na lůžko. 13
14 V. Graf indukčních režimů před transplantací 14
CAVE! Informační dopis pro zdravotnické pracovníky
 CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
CAVE! Informační dopis pro zdravotnické pracovníky říjen 2017 Výpadek léčivého přípravku Trisenox (oxid arzenitý, koncentrát pro infuzní roztok 1 mg/ml): nahrazení léčivým přípravkem Phenasen (injekční
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cupri tetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cupri tetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
OZNAČENÍ NA OBALU ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Text na krabičku 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU suspenze Paracetamolum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Paracetamolum 120 mg v 5 ml suspenze 3. SEZNAM
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
EDUKAČNÍ MATERIÁL PŘÍRUČKA PRO PŘEDEPISUJÍCÍHO LÉKAŘE Příručka pro předepisujícího lékaře Pokyny pro zdravotnické pracovníky ohledně předepisování přípravku Cerdelga (eliglustat) Tento léčivý přípravek
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA)
 Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z TAKOVÝCH LÉČIVÝCH PŘÍPRAVKŮ, POKUD JE TO VHODNÉ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabičce 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Cuprotetramibi tetrafluoroboras 2. OBSAH LÉČIVÉ LÁTKY Léčivá látka: Cuprotetramibi tetrafluoroboras 0,5 mg v jedné injekční lahvičce
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti Jahoda, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN
Příprava a podání injekce
 Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
sp.zn.sukls49419/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE NUROFEN pro děti, por.sus., papírová krabička (dávkovací zařízení lžička) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU Skleněná lahvička vnitřní obal 20 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Iodixanolum 2. OBSAH LÉČIVÉ LÁTKY 20 ml = 6,4 g I 1 ml injekčního roztoku obsahuje: Iodixanolum 652 mg (odp.
EXELON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY
 XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU, NEBO POKUD NENÍ VNĚJŠÍ OBAL NA VNITŘNÍM OBALU Papírová krabička; 1 injekční lahvička (2 ml) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml roztoku
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (předplněná injekční stříkačka se zasazenou jehlou) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Metoject 50 mg/ml injekční roztok Methotrexatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Příbalová informace: Informace pro uživatele. Bortega 3,5 mg prášek pro injekční roztok bortezomibum
 Sp.zn. sukls77835/2014 Příbalová informace: Informace pro uživatele Bortega 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn. sukls77835/2014 Příbalová informace: Informace pro uživatele Bortega 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
For Internal Use Only
 Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii chloridum
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU VNĚJŠÍ KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Prášky a rozpouštědla pro tkáňové lepidlo Léčivé látky: fibrinogenum humanum, thrombinum humanum, aprotininum (syntetické), calcii
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml
 MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
MINIMÁLNÍ ÚDAJE UVÁDĚNÉ NA MALÉM VNITŘNÍM OBALU Vnitřní obal (štítek): Rozpouštědlo ve skleněné lahvičce, typ I, obsah 10 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA/CESTY PODÁNÍ Voda na injekci 10 ml 2. ZPŮSOB
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
VZDĚLÁVACÍ BROŽURA PRO LÉKÁRNÍKY. Důležité informace o minimalizaci rizik pro zdravotnické pracovníky odpovědné za přípravu a ředění infuzního roztoku
 Edukční mteriály (blintumomb) VZDĚLÁVACÍ BROŽURA PRO LÉKÁRNÍKY Důležité informce o minimlizci rizik pro zdrvotnické prcovníky odpovědné z příprvu ředění infuzního u Tento edukční mteriál obshuje důležité
Edukční mteriály (blintumomb) VZDĚLÁVACÍ BROŽURA PRO LÉKÁRNÍKY Důležité informce o minimlizci rizik pro zdrvotnické prcovníky odpovědné z příprvu ředění infuzního u Tento edukční mteriál obshuje důležité
Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU 3 mg/3 ml 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden ml injekčního roztoku obsahuje granisetronum 1 mg (ve formě hydrochloridu) 3. SEZNAM
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příbalová informace: informace pro uživatele. Bortezomib Zentiva 3,5 mg prášek pro injekční roztok bortezomibum
 Sp.zn. sukls53687/2016 Příbalová informace: informace pro uživatele Bortezomib Zentiva 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls53687/2016 Příbalová informace: informace pro uživatele Bortezomib Zentiva 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE
 Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
Sp.zn.sukls49437/2013 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NUROFEN PRO DĚTI (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK
AKTIVNÍ LÉČEBNÉ PROTOKOLY
 AKTIVNÍ LÉČEBNÉ PROTOKOLY Režim CTD junior se opakuje za dní) onemocnění. Je vhodný pro nemocné do let. Součástí režimu CTD je cyklofosfamid, thalidomid a dexametazon. Pokud je režim ( cykly) použitý před
AKTIVNÍ LÉČEBNÉ PROTOKOLY Režim CTD junior se opakuje za dní) onemocnění. Je vhodný pro nemocné do let. Součástí režimu CTD je cyklofosfamid, thalidomid a dexametazon. Pokud je režim ( cykly) použitý před
Příbalová informace: informace pro uživatele. Bortezomib Hospira 3,5 mg prášek pro injekční roztok Bortezomibum
 Příbalová informace: informace pro uživatele Bortezomib Hospira 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele Bortezomib Hospira 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Propofol MCT Fresenius 10 mg/ml: Jeden ml obsahuje propofolum 10 mg. Propofol MCT Fresenius 20 mg/ml: Jeden ml obsahuje propofolum 20 mg.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
NÁVOD NA PODÁNÍ INJEKCE
 NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
ÚDAJE UVÁDÉNÉ NA VNÉJŠÍM OBALU NEBO NA VNITŘNÍM OBALU, POKUD VNĚJŠÍ OBAL NEEXISTUJE KRABIČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Nurofen pro děti Jahoda (ibuprofenum) 2. OBSAH LÉČIVÉ LÁTKY/LÁTEK SLOŽENÍ: Ibuprofenum
Důležité bezpečnostní informace pro zdravotnické pracovníky
 Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Edukační materiály BAVENCIO (avelumab) 20 mg/ml koncentrát pro infuzní roztok Důležité bezpečnostní informace pro zdravotnické pracovníky Tento dokument obsahuje důležité informace o bezpečnosti, s nimiž
Příbalová informace: informace pro uživatele. Bortezomib PharmaSwiss 3,5 mg prášek pro injekční roztok Bortezomibum
 Sp.zn. sukls76097/2014 Příbalová informace: informace pro uživatele Bortezomib PharmaSwiss 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Sp.zn. sukls76097/2014 Příbalová informace: informace pro uživatele Bortezomib PharmaSwiss 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: informace pro uživatele. Zegomib 3,5 mg prášek pro injekční roztok. bortezomibum
 Sp.zn. sukls76109/2014 Příbalová informace: informace pro uživatele Zegomib 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn. sukls76109/2014 Příbalová informace: informace pro uživatele Zegomib 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
NÁVOD NA SAMOPODÁNÍ INJEKCE
 NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
Příbalová informace: informace pro uživatele. Bortezomib Actavis 3,5 mg prášek pro injekční roztok bortezomibum
 Sp.zn. sukls76101/2014 Příbalová informace: informace pro uživatele Bortezomib Actavis 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls76101/2014 Příbalová informace: informace pro uživatele Bortezomib Actavis 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku)
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Vnější krabice (obsahující 5 nebo 40 krabiček s lahvičkami se 100 ml infuzního roztoku) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Ciprobay 200 Infuzní roztok ciprofloxacinum 2. OBSAH LÉČIVÉ
Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Kartonová krabička obsahující injekční lahvičku s práškem, předplněná injekční stříkačka s rozpouštědlem a příslušenství. 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fanhdi 50 IU/ml Fanhdi
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU SKLÁDAČKA 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Butamirati citras, guaifenesinum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Butamirati citras 4 mg, guaifenesinum 100 mg
Příbalová informace: Informace pro uživatele. NovoThirteen IU prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PERFALGAN 10 mg/ml, infuzní roztok paracetamolum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
INFORMACE: INFORMACE PRO UŽIVATELE. DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum
 INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
INFORMACE: INFORMACE PRO UŽIVATELE DIPIDOLOR, 7,5 mg/ml, injekční roztok Piritramidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte si příbalovou
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Bortezomib Hospira 2,5 mg prášek pro injekční roztok Bortezomib Hospira 3,0 mg prášek pro injekční roztok Bortezomib Hospira 3,5 mg prášek pro injekční roztok
Příbalová informace: informace pro uživatele Bortezomib Hospira 2,5 mg prášek pro injekční roztok Bortezomib Hospira 3,0 mg prášek pro injekční roztok Bortezomib Hospira 3,5 mg prášek pro injekční roztok
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls211402/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Kytril inj/inf koncentrát pro přípravu injekčního nebo infuzního roztoku Granisetroni hydrochloridum
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae type b polysaccharide
 sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEXVIX PRÁŠEK A ROZPOUŠTĚDLO PRO PŘÍPRAVU ROZTOKU DO MOČOVÉHO MĚCHÝŘE hexylis aminolevulinatis Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEXVIX PRÁŠEK A ROZPOUŠTĚDLO PRO PŘÍPRAVU ROZTOKU DO MOČOVÉHO MĚCHÝŘE hexylis aminolevulinatis Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příbalová informace: Informace pro uživatele. NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Hemlibra (emicizumab) Subkutánní injekce. Návod pro zdravotnické pracovníky
 EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Hemlibra (emicizumab) Subkutánní injekce Návod pro zdravotnické pracovníky Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro uživatele. Bortezomib Adamed 3,5 mg prášek pro injekční roztok Bortezomibum
 Sp.zn. sukls171524/2015 Příbalová informace: Informace pro uživatele Bortezomib Adamed 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls171524/2015 Příbalová informace: Informace pro uživatele Bortezomib Adamed 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Příbalová informace: informace pro uživatele. ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III
 Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
RÁDCE PACIENTA. Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu
 RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum
 Příbalová informace: informace pro pacienta Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta Mustophoran 200 mg/4 ml prášek a rozpouštědlo pro infuzní roztok fotemustinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum)
 sp.zn. sukls166874/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum) Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls166874/2016 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Ardeaosmosol Ma 10 Ardeaosmosol Ma 15 Ardeaosmosol Ma 20 Infúzní roztok (Mannitolum) Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná
 satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
satelitní sympozium společnosti Amgen Když ODPOVĚĎ je výjimečná Vážená paní doktorko, vážený pane doktore, rádi bychom Vás pozvali na satelitní sympozium společnosti Amgen, které proběhne u příležitosti
Remifentanil Kabi 1 mg Remifentanil Kabi 2 mg
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls246550/2010 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Remifentanil Kabi 1 mg Remifentanil Kabi 2 mg Prášek pro přípravu injekčního nebo infuzního
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls246550/2010 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE Remifentanil Kabi 1 mg Remifentanil Kabi 2 mg Prášek pro přípravu injekčního nebo infuzního
Příbalová informace: informace pro pacienta. SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum
 Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro pacienta SEFOTAK 1g prášek pro injekční roztok cefotaximum natricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae typus b polysaccharidum konjugovaný s tetanickým toxoidem jako bílkovinným nosičem
 sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls200515/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b Prášek a rozpouštědlo pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
Příbalová informace: informace pro uživatele. Bortezomib Teva 3,5 mg prášek pro injekční roztok Bortezomibum
 Sp.zn. sukls149578/2016 Příbalová informace: informace pro uživatele Bortezomib Teva 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Sp.zn. sukls149578/2016 Příbalová informace: informace pro uživatele Bortezomib Teva 3,5 mg prášek pro injekční roztok Bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU A VNITŘNÍM OBALU Lahev s obsahem 300 ml 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Levetiracetam UCB 100 mg/ml, perorální roztok levetiracetamum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jeden
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta
 sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
sp.zn.sukls195792/2018 a sp.zn.sukls195821/2018 Příbalová informace: informace pro pacienta NEUROMULTIVIT injekční roztok Léčivé látky: Thiamini hydrochloridum (vitamín B1), pyridoxini hydrochloridum (vitamín
Příbalová informace: informace pro uživatele. Zegomib 3,5 mg prášek pro injekční roztok. bortezomibum
 Sp.zn. sukls259946/2016 Příbalová informace: informace pro uživatele Zegomib 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn. sukls259946/2016 Příbalová informace: informace pro uživatele Zegomib 3,5 mg prášek pro injekční roztok bortezomibum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Návod pro pacienta / pečovatele
 Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
