Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis
|
|
|
- Jakub Pospíšil
- před 6 lety
- Počet zobrazení:
Transkript
1 EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo neočekávaný nežádoucí účinek a jiné skutečnosti závažné pro zdraví léčených osob musí být hlášeno Státnímu ústavu pro kontrolu léčiv. Podrobnosti o hlášení najdete na: Adresa pro zasílání je Státní ústav pro kontrolu léčiv, oddělení farmakovigilance, Šrobárova 48, Praha 0, 00 4, farmakovigilance@sukl.cz. Lucentis je biologický léčivý přípravek. V hlášení je pro nutné uvést jeho přesný obchodní název (Lucentis) a číslo šarže. Ta inmace může být také hlášena společnosti Novartis na adresu: Novartis s.r.o., Gemini, budova B, Na Pankráci 724/29, Praha 4, tel: fax: farmakovigilance.cz@novartis.com Dříve než přípravek Lucentis předepíšete, přečtěte si pečlivě souhrn údajů o přípravku (SPC)
2 Úvod Ten leták pro lékaře je součástí edukačních materiálů týkajících se použití přípravku Lucentis (ranibizumab) v jeho schválených indikacích a poskytuje inmace o incidenci a zvládání rizik spojených s intravitreální injekcí. Ten leták není zamýšlen jako náhrada za SPC přípravku Lucentis: v SPC jsou uvedeny kompletní inmace týkající se bezpečnostního profilu, včetně nežádoucích účinků spojených s intravitreální aplikací přípravku Lucentis. Léčba přípravkem Lucentis Úvod Lucentis (ranibizumab) je fragment humanizované protilátky specificky vyvinutý pro intravitreální podání, který váže a inhibuje různé isomy biologicky aktivního vaskulárního endoteliálního růsvého fakru (VEGF-A). Indikace Lucentis je indikován k léčbě: neovaskulární (vlhké) my věkem podmíněné makulární degenerace (VPMD) poškození zraku způsobeného diabetickým makulárním edémem (DME) poškození zraku způsobeného makulárním edémem v důsledku okluze retinální vény [uzávěr větve centrální retinální vény (BRVO) a uzávěr centrální retinální vény (CRVO)] poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k palogické myopii (PM) Kontraindikace Přípravek Lucentis nesmí být podáván pacientům s kterýmkoliv z následujících stavů: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku ho přípravku Aktivní okulární nebo periokulární infekce nebo podezření na takovou infekci Aktivní závažný nitrooční zánět Dávkování Doporučená dávka Lucentisu je 0,5 mg podávaných jako jednorázová injekce do sklivce. To odpovídá injekci o objemu 0,05 ml. Interval mezi dvěma dávkami podávanými do stejného oka má být alespoň čtyři týdny. Intervaly sledování a léčby mají být stanoveny na základě aktivity onemocnění vyhodnocené podle zrakové ostrosti a/nebo anamických parametrů. Podrobnosti jsou uvedeny v SPC v bodě 4.2. Předplněná injekční stříkačka Lucentis je nutno před aplikací vizuálně zkontrolovat, zda neobsahuje cizí částice nebo není změněna jeho barva. Všechny komponenty jsou sterilní a pouze pro jednorázové použití. Jakákoliv komponenta s obalem vykazující známky poškození nebo manipulace nesmí být použita. Sterilita nemůže být zaručena, pokud nezůstane uzavření obalu komponenty neporušené. Opakované použití může vést k infekci nebo jinému onemocnění/poškození. Podrobné pokyny pro přípravu přípravku Lucentis jsou uvedeny na stranách 7 0 té brožury a v SPC v bodě 6.6. Lucentis musí být aplikován za aseptických podmínek, což zahrnuje použití chirurgické desinfekce rukou, sterilních rukavic, sterilního oděvu, sterilního spekula (nebo ekvivalentní náhrady). Pokožka v okolí oka, oční víčko a povrch oka musí být desinfikovány a před aplikací injekce musí být podána adekvátní anestezie a použit širokospektrý lokální antimikrobiální přípravek. Před aplikací injekce do sklivce je nutný pečlivý odběr anamnézy z hlediska hypersenzitivních reakcí. Způsob podání pomocí předplněné injekční stříkačky Předplněná injekční stříkačka je na jedno použití, pouze pro podání do sklivce. Předplněná injekční stříkačka obsahuje více než doporučenou dávku 0,5 mg. Extrahovatelný objem předplněné injekční stříkačky (0, ml) není určen k celkovému podání. Nadbytečný objem je třeba před podáním injekce vytlačit. Při podání celého objemu předplněné injekční stříkačky by mohlo dojít k předávkování. K vytlačení vzduchové bubliny spolu s nadbytečným léčivým přípravkem pomalu tlačte píst, dokud okraj pod vyklenutím pryžové zarážky není vyrovnaný s černou dávkovací linkou na injekční stříkačce (ekvivalentní 0,05 ml, tj. 0,5 mg ranibizumabu). Aplikace přípravku Lucentis: Injekční jehla se zasune 3,5 4,0 posteriorně od limbu do prosru sklivce tak, aby směřovala do centra očního bulbu a nikoli k horizontálnímu meridiánu. Poté se aplikuje objem injekce 0,05 ml. Následující injekci je nutné aplikovat v jiném místě skléry. Po podání injekce nenasazujte zpět kryt jehly ani jehlu neoddělujte od injekční stříkačky. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Použité jehly odložte do nádoby na ostré předměty. Podrobné pokyny pro přípravu oka a podání přípravku Lucentis jsou uvedeny na straně 0 té brožury a v SPC v bodě 6.6. Aplikace přípravku Lucentis Přípravek Lucentis je injekční rozk dostupný ve dvou typech balení: Skleněná injekční lahvička (v balení s jehlou s filtrem, injekční jehlou a stříkačkou) 2 3
3 Profil oční a systémové bezpečnosti přípravku Lucentis Bezpečnostní profil a snášenlivost přípravku Lucentis jsou založeny na údajích z klinických hodnocení a zkušeností po uvedení na trh. Podrobné inmace týkající se bezpečnostního profilu a lerability přípravku Lucentis je možné najít v SPC. Závažné nežádoucí účinky související s postupem podání injekce zahrnují endoftalmitidu, iatrogenní traumatickou kataraktu a zvýšení nitroočního tlaku (IOP). Další závažné oční události pozorované u pacientů léčených přípravkem Lucentis zahrnují nitrooční zánět, rhegmagenní odchlípení sítnice a trhliny sítnice. Přesže se ten leták zabývá hlavními očními riziky, existuje teoretické riziko arteriálních tromboembolických příhod po intravitreálním podání inhibirů VEGF. V klinických studiích přípravku Lucentis napříč indikacemi byla pozorována nízká incidence arteriálních trombembolických příhod a mezi skupinou léčenou přípravkem Lucentis a kontrolní skupinou nebyl velký rozdíl. Prevence a zvládání hlavních rizik spojených s podáním injekce přípravku Lucentis Intravitreální injekce, včetně těch s přípravkem Lucentis, jsou spojeny s: Endoftalmitida Traumatická katarakta Zvýšení nitroočního tlaku Předávkování při podání celého objemu předplněné injekční stříkačky Lucentis musí být aplikován za aseptických podmínek. Během týdne následujícím po injekci by pacienti měli být monirováni, aby byla umožněna včasná léčba v případě, že by se objevila infekce. Lékař by měl poučit pacienty, aby okamžitě kontakvali lékaře v případě, že se u nich objeví příznaky, jako je bolest oka nebo zvýšený oční diskomt, zhoršující se zarudnutí oka, rozmazané nebo snížené vidění, zvýšený počet malých částic v zorném poli nebo zvýšená světloplachost. Inmujte se, jestli pacienti ve své anamnéze nemají cévní mozkovou příhodu nebo tranzientní ischemickou ataku. U těch pacientů je třeba dbát zvýšené opatrnosti (viz SPC bod 4.8) Endoftalmitida Endoftalmitida je závažné postižení oka sestávající ze zánětu sklivce a může teoreticky vést až ke slepotě 2 Endoftalmitida je čas způsobena nitrooční injekcí. Pageny čas vedoucí k té komplikaci zahrnují kožní bakterie, jako jsou koaguláza-negativní stafylokoky, Staphylococcus aureus a strepkoky. 2 Strepcoccus viridans (komensál v oblasti hrdla) byl izolován více jak 3 častěji v případech endoftalmitidy po intravitreální injekci než po nitroočních operacích. 3 Události, jako je penetrující trauma, chirurgické výkony a intravitreální injekce, které narušují integritu očního bulbu, mohou teoreticky vést k endoftalmitidě. 2 Endoftalmitida po podání injekce přípravku Lucentis není častá a hlášená incidence v klinických studiích přípravku Lucentis se pohybovala od /000 do < /00 pacientů ve všech indikacích. Přípravek Lucentis by měl být připraven pro intravitreální injekci a podán dle postupu popsaného v SPC a shrnutého na stranách 7 a 8 ho letáku. Je zcela zásadní provádět podání injekce za aseptických podmínek, aby se zabránilo kontaminaci oka. Doporučuje se použití dezinfekce rukou, sterilních rukavic, sterilní roušky a sterilního očního rozvěrače (nebo ekvivalentu) a dostupnost sterilní paracentézy (v případě potřeby). Lékaři by měli poučit pacienty, aby okamžitě kontakvali lékaře v případě, že se u nich objeví příznaky, jako je bolest oka nebo zvýšený oční diskomt, zhoršující se zarudnutí oka, rozmazané nebo snížené vidění, zvýšený počet malých částic v zorném poli nebo zvýšená světloplachost. Odpovídající management a léčba endoftalmitidy by měly probíhat podle místních klinických zvyklostí. Traumatická katarakta Traumatická katarakta může být způsobena poraněním oční čočky po penetrujícím i nepenetrujícím očním traumatu. Jedná se o času příčinu ztráty zraku. 4 Ke snížení rizika traumatické katarakty je nutné, aby byl přípravek Lucentis pro intravitreální injekci připraven a podán dle postupu popsaného v SPC a shrnutého na stranách 7 0 ho letáku. Injekční jehla se zasune 3,5 4,0 posteriorně od limbu do prosru sklivce tak, aby směřovala do centra očního bulbu a nikoli k horizontálnímu meridiánu. Lékaři by měli poučit pacienty, aby okamžitě kontakvali kliniku, pokud se u nich rozvinou příznaky, jako je náhle rozmazané nebo zhoršené vidění. Odpovídající management a léčba traumatické katarakty by měly probíhat podle místních klinických zvyklostí. Zvýšení nitroočního tlaku Zvýšení IOP do 60 minut od podání injekce přípravku Lucentis je velmi časté, jeho hlášená incidence je /0 pacientů v klinických hodnoceních přípravku Lucentis napříč všemi indikacemi. Zvýšení IOP je způsobeno injekcí tekutiny do oka a je pravděpodobnější, pokud je podáván větší objem. Zvýšení IOP po podání injekce je čas asympmatické a většinou se rychle upraví (např. je přechodné). 4 5
4 Příprava přípravku Lucentis pro intravitreální podání Přípravek Lucentis by měl být podán jako jedna intravitreální injekce s objemem 0,05 ml. Objem injekce by měl být pečlivě zkontrolován, aby se předešlo riziku zvýšení IOP. Pokud dojde k předávkování, IOP by měl být monirován a léčen dle uvážení lékaře. IOP a perfúze papily optického nervu by měly být sledovány a odpovídajícím způsobem léčeny. Léčba zvýšení IOP by měla být v souladu s místními klinickými zvyklostmi. Paracentéza by měla být provedena jen v případech, kdy zvýšení IOP představuje hrozbu pro zrak pacienta. 5 Předávkování z důvodu přeplnění předplněné injekční stříkačky Při přípravě přípravku Lucentis pro intravitreální podání prosím dodržujte následující pokyny:. Před natažením rozku by měla být zevní část gumové zátky lahvičky dezinfikována. 2. Nasaďte jehlu s 5 μm filtrem (součást balení) na ml stříkačku (součást balení) za použití aseptické techniky. Vsuňte tupou filtrovací jehlu do středu zátky lahvičky, až se bude dotýkat jejího dna. 3. Natáhněte všechnu tekutinu z lahvičky, kterou při m držte svisle, případně jemně nakloněnou k usnadnění kompletního natažení obsahu. Předplněná injekční stříkačka obsahuje více rozku přípravku Lucentis než je potřeba pro jednu dávku Objem rozku navíc je přímen pro, aby se pomohlo k připravení jehly a injekční stříkačky k aplikaci 4. Ujistěte se, že je při natahování rozku píst vytažen dostatečně tak, aby se jehla zcela vyprázdnila. Instrukce k použití (shrnuty na str. 8 a v SPC) by měly být důkladně následovány, aby došlo k zajištění přesné dávky ve stříkačce Pokud dojde k předávkování, IOP by měl být monirován a léčen dle uvážení lékaře. IOP a perfúze papily optického nervu by měly být sledovány a odpovídajícím způsobem léčeny. Paracentéza by měla být provedena jen v případech, kdy zvýšení IOP představuje hrozbu pro zrak pacienta. 5. Ponechejte tupou filtrovací jehlu v lahvičce a odpojte od ní stříkačku. Jehla s filtrem by měla být po natažení obsahu lahvičky znehodnocena, není určena pro intravitreální injekci. Literatura. SPC Lucentis 2. Kernt M, Kampik A. Endophthalmitis: pathogenesis, clinical presentation, management, perspectives. Clin Ophthalmol 200;4: Chen E, Lin MY, Cox J, et al. Endophthalmitis after : importance of viridans strepcocci. Retina 20;3: Thyles B. Epidemiological patterns of ocular trauma. Aust N Z J Ophthalmol 992;20: Aiello LP, Brucker AJ, Chang S et al. Evolving intra s. Retina 2004;24:S3 S9 6. Za aseptických podmínek pevně připojte poskytnuu jehlu na stříkačku. 7. Opatrně sejměte kryt jehly bez odpojení jehly od stříkačky. Poznámka: Při snímání krytu uchopte jehlu za žluté hrdlo. 8. Opatrně vytlačte ze stříkačky vzduch a upravte dávku na 0,05 ml dle značky na stříkačce. Stříkačka je připravena k podání. Poznámka: Neotírejte jehlu pro podání injekce. Nevytahujte píst. Injekční jehla by měla být zavedena 3,5 až 4,0 posteriorně od limbu do sklivcového prosru. Měla by směřovat k centru bulbu nikoli k horizontálnímu meridiánu. Poté je podán objem injekce 0,05 ml. Následující injekci je nutné aplikovat v jiném místě skléry. Po podání injekce nenasazujte zpět kryt jehly ani jehlu neoddělujte od injekční stříkačky. Zlikvidujte použiu injekční stříkačku společně s jehlou vyhozením do nádoby na ostré předměty nebo v souladu s místními požadavky. 6 7
5 Příprava přípravku Lucentis pro intravitreální podání pomocí předplněné injekční stříkačky Při přípravě přípravku Lucentis k podání do sklivce dbejte, prosím, pokynů k použití: Úvod Popis předplněné injekční stříkačky Před použitím předplněné injekční stříkačky si pečlivě přečtěte všechny pokyny. Předplněná injekční stříkačka je pouze pro jednorázové použití. Předplněná injekční stříkačka je sterilní. Přípravek nepoužívejte, pokud je balení poškozeno. Otevření zataveného obalu a všechny následující kroky musí být provedeny za aseptických podmínek. Poznámka: dávka musí být nastavena na 0,05 ml. Příprava. Ujistěte se, že balení obsahuje: sterilní předplněnou injekční stříkačku v zataveném obalu. 2. Sloupněte víčko zataveného obalu injekční stříkačky a za použití aseptické techniky opatrně vyjměte injekční stříkačku. Zkontrolujte injekční stříkačku obr. 3. Zkontrolujte, že: čepička injekční stříkačky není oddělena od adaptéru Luer lock. injekční stříkačka není poškozena. injekční rozk je čirý, bezbarvý až světle žlutý a neobsahuje žádné částice. 4. Pokud některý údaj uvedený výše nesouhlasí, znehodnoťte předplněnou injekční stříkačku a použijte novou. Odstraňte čepičku 5. Ulomte (neotáčejte ani nekruťte) čepičku injekční stříkačky (viz Obrázek 2). 6. Zlikvidujte čepičku injekční stříkačky (viz Obrázek 3). Čepička Adaptér Luer lock Označení dávky 0,05 ml Pryžová zarážka Držadlo Písvé táhlo obr. 2 obr. 3 Nasaďte jehlu 7. Pevně nasaďte sterilní injekční jehlu 30G ½, na injekční stříkačku těsným zašroubováním do adaptéru Luer lock (viz Obrázek 4). 8. Opatrně odstraňte kryt jehly jeho přímým vytažením (viz Obrázek 5). Poznámka: Jehlu nikdy neotírejte. obr. 4 obr.5 Uvolněte vzduchové bubliny 9. Držte injekční stříkačku svisle. 0. Pokud jsou přímny vzduchové bubliny, jemně poklepejte injekční stříkačku prstem, dokud bubliny supají nahoru (viz Obrázek 6). obr. 6 Nastavte dávku. Držte injekční stříkačku v úrovni očí a opatrně tlačte píst, dokud není okraj pod vyklenutím pryžové zarážky vyrovnaný s označením dávky (viz Obrázek 7). Tak se vytlačí vzduch a nadbytek injekčního rozku a nastaví se dávka na 0,05 ml. Poznámka: Písvé táhlo není připojeno k pryžové zarážce aby se předešlo natažení vzduchu zpět do injekční stříkačky. obr. 7 Podejte injekci Postup podání injekce má být proveden za aseptických podmínek. 2. Injekční jehla se zasune 3,5 4,0 posteriorně od limbu do prosru sklivce tak, aby směřovala do centra očního bulbu a nikoli k horizontálnímu meridiánu. 3. Injekci podávejte pomalu, dokud pryžová zarážka nedosáhne dna injekční stříkačky, aby byl podán objem 0,05 ml. 4. Následující injekce aplikujte do odlišných míst skléry. 5. Po podání injekce nenasazujte zpět kryt jehly ani jehlu neoddělujte od injekční stříkačky. Zlikvidujte použiu injekční stříkačku společně s jehlou vyhozením do nádoby na ostré předměty nebo v souladu s místními požadavky. 8 9
6 4 4x times 4 4 x 4 pads pads daily 3 days prior 4 x 4 pads agentagent drapedrape Pupillary agent drape Povidone Povidone 0% 0% caliper caliper Povidone 0% caliper Povidone Povidone Povidone Příprava oka a podání přípravku Lucentis gng neovascular neovascularamd: AMD: D: Treating neovascular c AMD: tion aseptic e observed duringduring tray assembly, anaestic preparation, drug administration. This procedure shouldshould be permed by a by a ould be observed tray assembly, anaestic preparation, preparation drug preparation administration. This procedure be permed nd drug preparation administration. This procedure should be permed by a experienced in ing s. In addition outlined below,below, of yourofspecific ogist experienced in ing s. In addition outlined your specific on outlined below, of your specific wed. Aseptic technique should be observed during tray assembly, anaestic preparation, drug preparation administration. This procedure should be permed by a 43 4 qualified ophthalmologist experienced in ing s. In addition outlined below, of your specific clinic should be followed. supplies supplies BeeBee starting, aseptically assemble supplies: starting, aseptically assemble supplies: cally assemble supplies: affected drops affected surgical glovesgloves Antimicrobial Pre- Sterile surgical Antimicrobial supplies es Antimicrobial prior days prior Bee starting, aseptically assemble supplies: 4 x 4 pads 4 Instruct x 4 pads affected Antimicrobial agent Sterile drapedrape surgical gloves agent ent drape 4 times daily 3 days prior 4 x 4 pads Povidone 0% 0% calipercaliper Povidone ution 0% caliper Pupillary agent drape Povidone Povidone 4. Insert 4. Insert lid. lid.. Dilate. Dilate pupil. pupil. 3. Apply 3. Apply 0% 0% drops. Dilatujte zornici. 3. Aplikujte 0% rozk jodpovidonu Povidone 0% caliper. Dilate pupil. 3. Apply 0% 2. Apply 2. Apply picalpical anaessia, anaessia, periocular periocular skin, lids, skin, lids,lashes, lashes, 2. Aplikujte lokální anestetikum kůži kolem očí, na víčka a na řasy 2. Apply pical anaessia, periocular skin, lids, lashes,.. place place drape drape over. over. na Povidone a přes oko položte sterilní roušku.. place drape over. edures rocedures e seconds. 90 seconds look away from n 6. Direct Opláchněte oko fyziologickým 8. saline Slowly 8. Slowly deliver deliver n. saline.. an použití at an remove remove needle needle slowly. slowly. rozkem pro oční Instill area 3.5 scleral 4.0 posterior 5. scleral subsequent subsequent, s wait 90soseconds. so horizontal s that thatsame same aiming repeatedly centre of globe. is not isinjected notward injected repeatedly Post- Post- lookaway look from away from 7. Vyzvěte pacienta, aby seíval 9. Administer. an at an at an. 8. area Slowly deliver.. směrem od místa injekce. Označte n area posterior posterior remove needle slowly. horizontal mís injekce v oblasti 3,5horizontal až 4,0 saline. posteriorně scleral aiming ward centre of globe. aiming ward subsequent centre globe. od limbu, vyhněte seof s so that same horizontálnímu meridiánu a miřte is not injected repeatedly směrem k centru očního bulbu Post- Post- 9Post- 9 Dispose of 8arrange a follow-up 9 7arrange arrange a follow-up a follow-up Dispose of Dispose of intraocular intraocular iediately iediately post- post- Instruct Instruct treated treated 4 times 4 times daily daily 3 days 3 days after after Instruct Instruct report report iediately iediately of inflaation of inflaation such such as aspain or pain or 9. discomt, Administer discomt, redness, redness, look away from. light, light,. an at an Monir Monir during 4.0week area 3.5 during week posterior horizontal permit permit early early if an if an occurs aiming ward centre of globe. occurs 9 arrange a follow-up arrange a follow-up intraocular LUCENTIS LUCENTIS is a registered is a registered trademarktrademark of Genentech, of Genentech, Inc.Inc. iediately post- Instruct treated 4 times daily 3 days after Instruct report iediately n n n njection of inflaation or., such as pain or pectrum.slowly.. ops. discomt, redness, subsequent al subsequent 8. Slowly deliver n light, or vision so thatso same tions that same 8. remove Pomalu objem injekce podejte needle slowly. eatedly ed repeatedly Monir during week poté pomalu vytáhněte jehlu. a scleral subsequent permit early an Střídejte místa pro další s so that ifsame is not injected repeatedly occurs intravitreální injekce tak, aby stejné mís nebylo ng S, Chang et al. Evolving intra s.s. Retina. 2004;24:S3-S9. r AJ, S, et al. Evolving intra Retina. 2004;24:S3-S9. používáno opakovaně econsult full national inmationinmation approved inapproved your country. fullprescribing national prescribing in your country. Bee prescribing LUCENTIS, please consult full national prescribing inmation approved in your country. iediately post- iediately post- LUCENTIS is a registered trademark of Genentech, Inc. Instruct Instruct treated 4 times treated 4 times daily 3 days daily 3 after days after Instruct report iediately Instruct report iediately of inflaation such as aspain of inflaation such or pain or discomt, redness, discomt, redness, light, light, Monir duringduring week Monir week. permit early if an if an permit early occursoccurs 0 Reference:. Aiello LP, Brucker AJ, Chang S, et al. Evolving intra s. Retina. 2004;24:S3-S9. ch, Inc. f Genentech, Inc. Post- Dispose of arrange a follow-up Evaluate light perception, intraocular iediately post- Instruct treated 4 times daily 3 days after Instruct report iediately of inflaation such as pain or discomt, redness, light, Monir during week permit early if an occurs Post- Dispose of arrange a follow-up Evaluate light perception, intraocular iediately post- Instruct treated 4 times daily 3 days after Instruct report iediately of inflaation such as pain or discomt, redness, light, Monir during week permit early if an occurs Trim: 420 Bleed: 430 Safety: 40 look away from. an at an area posterior horizontal aiming ward centre of globe. Reference:. Aiello LP, Brucker AJ, Chang S, et al. Evolving intra s. Retina. 2004;24:S3-S9. Evaluate light perception, Evaluate light perception, Bee Evaluate lightlucentis,perception, please consult, pleaseconsult full national fullprescribing national prescribing inmation inmation approved approved in your country. in your country. prescribing Bee prescribing LUCENTIS intraocular intraocular Bleed: 430 Evaluate Evaluate light light perception, perception, Reference: Reference:. Aiello. LP,Aiello Brucker LP, AJ, Brucker Chang AJ,S,Chang et al. Evolving S, et al. Evolving intra intra s. s. Retina. 2004;24:S3-S9. Retina. 2004;24:S3-S9. Trim: 420 Safety: 40 Bleed: 430 Trim: 420 Dispose Dispose of of Trim: Bleed: look away look away from from.. an an at an at an saline. area 3.5 area posterior posterior 4. Insert lidhorizontal. horizontal aiming aiming ward ward centre centre of ofglobe. globe. Trim: Insert Rinse lid. 4. Rinse Insert lid. 5. saline Instillsaline.. 5. Aplikujte oční rozk jodpovidonu, wait 90 seconds. na a počkejte 90 sekund 3. oko Apply 0% periocular skin, lids, lashes, place drape over. Safety: Apply Instill % 3. Instill Apply 0% 4. Insert lid., wait wait 90 seconds. 90 seconds. periocular skin, lids, lashes, Přiložte periocular skin, lids, lashes, 4., sterilní oční rozvěrač place drape drape over. place over.. Dilate pupil. 2. Apply pical anaessia,. Bleed: Bleed: Trim: 420 Safety: 40 Bleed: 430 Trim: Insert lid. Safety: Safety: 40 e, ssia, ds, lashes, obial. timicrobial. ape over. 4 Safety: 40 on pplies inister 3 3
7 Novartis s.r.o. GEMINI budova B Na Pankráci 724/29, Praha 4, tel.: , fax: CZ /0/205
Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis
 EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd
Informace pro předepisujícího lékaře
 Injekce do sklivce Doporučení pro léčbu přípravkem (aflibercept solution for injection) Informace pro předepisujícího lékaře Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v Souhrnu údajů
Injekce do sklivce Doporučení pro léčbu přípravkem (aflibercept solution for injection) Informace pro předepisujícího lékaře Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v Souhrnu údajů
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA)
 Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis
 Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Příprava a podání injekce
 Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře
 Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře Tento návod obsahuje informace o doporučované injekční technice a významných rizicích spojených s aplikací
Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře Tento návod obsahuje informace o doporučované injekční technice a významných rizicích spojených s aplikací
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
ZNALOST POTENCIÁLNÍCH RIZIK JE PRVNÍM KROKEM K JEJICH PREVENCI OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU
 OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU Tato prezentace přináší přehled: Metod doporučených pro aplikaci IVT injekce založených na zrevidované dohodě odborníků Protokol injekce
OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU Tato prezentace přináší přehled: Metod doporučených pro aplikaci IVT injekce založených na zrevidované dohodě odborníků Protokol injekce
CNV. Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab)
 CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
Oddíl 1 O přípravku Lucentis
 mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
VÁŠ PRŮVODCE PRO PŘÍPRAVEK. (aflibercept solution for injection)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA. EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME) Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME) Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku
JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO
 JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO NEŽ ZAČNETE JEDNORÁZOVÉ PŘEDPLNĚNÉ INJEKČNÍ PERO POUŽÍVAT Umyjte si ruce. Najděte si vhodnou pracovní plochu (čistý stůl nebo pracovní deska linky). Připravte si všechny
JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO NEŽ ZAČNETE JEDNORÁZOVÉ PŘEDPLNĚNÉ INJEKČNÍ PERO POUŽÍVAT Umyjte si ruce. Najděte si vhodnou pracovní plochu (čistý stůl nebo pracovní deska linky). Připravte si všechny
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
EXELON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY
 XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
XLON NÁPLASTI NÁVOD K POUŽITÍ & ZÁZNAMOVÁ KARTA VAŠÍ LÉČBY Než se začnete léčit přípravkem xelon náplasti, přečtěte si pozorně celou příbalovou informaci požádejte někoho, aby Vám ji celou přečetl. Případné
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje ranibizumabum 10 mg*. Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje ranibizumabum 10 mg*. Jedna injekční lahvička obsahuje
Oftalmologie atestační otázky
 Platnost: od 1.1.2015 Oftalmologie atestační otázky Okruh všeobecná oftalmologie 1. Akomodace, presbyopie a její korekce 2. Refrakce oka, způsoby korekce, komplikace (mimo kontaktní čočky) 3. Kontaktní
Platnost: od 1.1.2015 Oftalmologie atestační otázky Okruh všeobecná oftalmologie 1. Akomodace, presbyopie a její korekce 2. Refrakce oka, způsoby korekce, komplikace (mimo kontaktní čočky) 3. Kontaktní
*Ranibizumab je fragment humanizované monoklonální protilátky produkovaný buňkami Escherichia coli rekombinantní DNA technologií.
 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
Eylea. afliberceptum. Co je Eylea? K čemu se přípravek Eylea používá? Souhrn zprávy EPAR určený pro veřejnost
 EMA/677928/2015 EMEA/H/C/002392 Souhrn zprávy EPAR určený pro veřejnost afliberceptum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European public assessment report, EPAR) pro přípravek.
EMA/677928/2015 EMEA/H/C/002392 Souhrn zprávy EPAR určený pro veřejnost afliberceptum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European public assessment report, EPAR) pro přípravek.
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
VÁŠ PRŮVODCE PRO PŘÍPRAVEK
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum. Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum. Jedna injekční lahvička obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
For Internal Use Only
 Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
JETREA 0,375 mg/0,3 ml injekční roztok Ocriplasminum
 Příbalová informace: Informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Příbalová informace: Informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání
 Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
Edukační materiály Bortezomib 3,5 mg, prášek pro injekční roztok k subkutánnímu (s.c.) a intravenóznímu (i.v.) podání Dále jen bortezomib Obsah: I. Důležité informace týkající se rekonstituce, dávkování
Příbalová informace: informace pro pacienta. Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum
 Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
POKYNY PRO POUŽITÍ. Budete potřebovat následující položky, které jsou obsaženy v balení:
 POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
NÁVOD NA SAMOPODÁNÍ INJEKCE
 NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA SAMOPODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
Propofol MCT Fresenius 10 mg/ml: Jeden ml obsahuje propofolum 10 mg. Propofol MCT Fresenius 20 mg/ml: Jeden ml obsahuje propofolum 20 mg.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
NÁVOD NA PODÁNÍ INJEKCE
 NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
NÁVOD NA PODÁNÍ INJEKCE (asfotasum alfa) na injekci 40 mg/ml injekční roztok 18 mg/0,45 ml 28 mg/0,7 ml 40 mg/1 ml 1100 mg/ml injekční roztok 80 mg/0,8 ml asfotasum alfa Tento léčivý přípravek podléhá
XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
 OS ČLK Ústí nad Labem Oční klinika FZS UJEP Krajská zdravotní, a. s. Masarykova nemocnice v Ústí nad Labem, o. z. za organizační spolupráce BOS. org s. r. o. pořádají XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
OS ČLK Ústí nad Labem Oční klinika FZS UJEP Krajská zdravotní, a. s. Masarykova nemocnice v Ústí nad Labem, o. z. za organizační spolupráce BOS. org s. r. o. pořádají XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum)
 sp. zn. sukls55121/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum) Přečtěte si pozorně celou příbalovou informaci
sp. zn. sukls55121/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum) Přečtěte si pozorně celou příbalovou informaci
EDUKAČNÍ MATERIÁLY. KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Informace pro lékaře EU UPOZORNĚNÍ Riziko záměny mezi přípravky Kadcyla
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příbalová informace: Informace pro pacienta. JETREA 0,375 mg/0,3 ml injekční roztok Ocriplasminum
 Příbalová informace: Informace pro pacienta JETREA Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Příbalová informace: Informace pro pacienta JETREA Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil. Informace pro pacienty léčené přípravkem OZURDEX
 OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil Informace pro pacienty léčené přípravkem OZURDEX V případě, že chcete další informace o přípravku OZURDEX, požádejte
OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil Informace pro pacienty léčené přípravkem OZURDEX V případě, že chcete další informace o přípravku OZURDEX, požádejte
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
BELOTERO Intense. Složení Síťovaný hyaluronát sodný: Fosfátový pufr o ph 7 q.s.:
 BELOTERO Intense Popis Přípravek BELOTERO Intense je sterilní, nepyrogenní, viskoelastický, bezbarvý, průhledný gel ze síťovaného hyaluronátu sodného neživočišného původu ve fyziologickém fosfátovém pufru.
BELOTERO Intense Popis Přípravek BELOTERO Intense je sterilní, nepyrogenní, viskoelastický, bezbarvý, průhledný gel ze síťovaného hyaluronátu sodného neživočišného původu ve fyziologickém fosfátovém pufru.
JETREA 0,5 mg/0,2 ml koncentrát pro injekční roztok Ocriplasminum
 Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD)
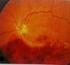
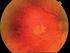
 MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD) Autor: Čarnogurská Ivana, Kohútová Lucia Školitel: MUDr. Barbora Chrapková Výskyt Věkem podmíněná makulární
MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD) Autor: Čarnogurská Ivana, Kohútová Lucia Školitel: MUDr. Barbora Chrapková Výskyt Věkem podmíněná makulární
Příbalová informace: informace pro uživatele
 Sp. zn. sukls113502/2018 a k sp. zn. sukls111628/2018, sukls111940/2018 Příbalová informace: informace pro uživatele Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injekční roztok tropicamidum / phenylephrini
Sp. zn. sukls113502/2018 a k sp. zn. sukls111628/2018, sukls111940/2018 Příbalová informace: informace pro uživatele Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injekční roztok tropicamidum / phenylephrini
Příbalová informace: Informace pro uživatele. NovoThirteen IU prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele. NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
RÁDCE PACIENTA. Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu
 RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
GLAUKOM. Autor: Kateřina Marešová. Školitel: MUDr. Klára Marešová, Ph.D., FEBO. Výskyt
 GLAUKOM Autor: Kateřina Marešová Školitel: MUDr. Klára Marešová, Ph.D., FEBO Výskyt Glaukom, laicky označovaný jako zelený zákal, je skupina očních chorob, které jsou charakterizovány změnami zrakového
GLAUKOM Autor: Kateřina Marešová Školitel: MUDr. Klára Marešová, Ph.D., FEBO Výskyt Glaukom, laicky označovaný jako zelený zákal, je skupina očních chorob, které jsou charakterizovány změnami zrakového
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příbalová informace:informace pro pacienta. JETREA 0,5 mg/0,2 ml koncentrát pro injekční roztok Ocriplasminum
 Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
PRŮKAZ PACIENTA. užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1
 PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PRŮKAZ PACIENTA užívajícího přípravek Imraldi (určeno dospělým i dětským pacientům) verze 1 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě zdravotnického zařízení.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls107109/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIOSTAT INTRAOCULAR SOLUTION Oční inzert 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje carbacholum 100 mikrogramů. 1 lahvička
sp.zn.sukls107109/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIOSTAT INTRAOCULAR SOLUTION Oční inzert 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje carbacholum 100 mikrogramů. 1 lahvička
Návrh výkladu podmínek úhrady centrové léčby
 Návrh výkladu podmínek úhrady centrové léčby Úvod do problematiky: Nákladná terapie anti-vegf přípravky je zabezpečena formou centrálně ustanovených pracovišť (dále jen centra ). Podmínky použití a zejména
Návrh výkladu podmínek úhrady centrové léčby Úvod do problematiky: Nákladná terapie anti-vegf přípravky je zabezpečena formou centrálně ustanovených pracovišť (dále jen centra ). Podmínky použití a zejména
PRŮKAZ PACIENTA. užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019
 PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
PRŮKAZ PACIENTA užívajícího přípravek Amgevita (určeno dospělým i dětským pacientům) Verze 2 Shváleno SÚKL březen 2019 Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi při každé návštěvě
Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis
 Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab). Oddíl 1 O přípravku Lucentis Tato brožura Vám
Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab). Oddíl 1 O přípravku Lucentis Tato brožura Vám
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Co je Voltaren Ophtha CD Léčivou látkou přípravku Voltaren Ophtha CD je diklofenak sodný (diclofenacum natricum).
 Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
OZURDEX injekce: návod
 OZURDEX injekce: návod Dexamethasonum 700 mikrogramů, intravitreální implantát v aplikátoru Makulární edém po uzávěru větve retinální žíly nebo po uzávěru centrální retinální žíly Souhrn údajů o přípravku
OZURDEX injekce: návod Dexamethasonum 700 mikrogramů, intravitreální implantát v aplikátoru Makulární edém po uzávěru větve retinální žíly nebo po uzávěru centrální retinální žíly Souhrn údajů o přípravku
Před použitím si přečtěte přiloženou příbalovou informaci a pokyny pro zavádění. Tělísko je sterilní, pokud není pouzdro poškozené nebo otevřené.
 ÚDAJE UVÁDĚNÉ NA PŘELEPCE VNĚJŠÍHO OBALU / KRABIČKA Mirena 20 mikrogramů /24 hodin, sterilní intrauterinní inzert Levonorgestrelum 1 sterilní intrauterinní inzert obsahuje levonorgestrelum 52 mg Pomocné
ÚDAJE UVÁDĚNÉ NA PŘELEPCE VNĚJŠÍHO OBALU / KRABIČKA Mirena 20 mikrogramů /24 hodin, sterilní intrauterinní inzert Levonorgestrelum 1 sterilní intrauterinní inzert obsahuje levonorgestrelum 52 mg Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU JETREA 0,5 mg / 0,2 ml koncentrát pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje ocriplasminum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU JETREA 0,5 mg / 0,2 ml koncentrát pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje ocriplasminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
EDUKAČNÍ MATERIÁLY. Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce
 EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY Návod pro zdravotnické pracovníky Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
záření gama s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
sp.zn. sukls50264/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a hodině
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5% Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glucosum (ve formě glucosum monohydricum): 50,0 g/l Jeden ml roztoku obsahuje 50 mg glukózy (ve formě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glukóza 5% Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Glucosum (ve formě glucosum monohydricum): 50,0 g/l Jeden ml roztoku obsahuje 50 mg glukózy (ve formě
Rozměr zavřeného průkazu mm
 Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
Přední strana Str. 1 PRŮKAZ PACIENTA užívajícího přípravek Humira (určeno dospělým i dětským pacientům) Rozměr zavřeného průkazu 105 73 mm Je nutné předložit tuto kartičku každému lékaři či zdravotníkovi
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
O nemocné s poruchou zraku zvláštnosti
 Ošetřovatelská péče O nemocné s poruchou zraku zvláštnosti Části oka Oční koule =bulbus Bělima =scléra Rohovka=cornea Živnatka=uvea Čočka=lens Sítnice=retina Duhovka=iris Sklivec=corpus vitreum Přídatné
Ošetřovatelská péče O nemocné s poruchou zraku zvláštnosti Části oka Oční koule =bulbus Bělima =scléra Rohovka=cornea Živnatka=uvea Čočka=lens Sítnice=retina Duhovka=iris Sklivec=corpus vitreum Přídatné
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Macugen 0,3 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka poskytuje využitelné množství pro dodání
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Macugen 0,3 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka poskytuje využitelné množství pro dodání
Použití infuzního systému. Remodulin do žíly. Informace pro pacienty
 Použití infuzního systému k Remodulin do žíly Informace pro pacienty Hlavní body vjejím zvládli sami. v Mohou se s k Zásobník s lékem a Konektor s k v maximální známky infekce. obsahuje bakterie. Vyvarujte
Použití infuzního systému k Remodulin do žíly Informace pro pacienty Hlavní body vjejím zvládli sami. v Mohou se s k Zásobník s lékem a Konektor s k v maximální známky infekce. obsahuje bakterie. Vyvarujte
Florfeni-kel 300mg/ml inj. 100ml
 Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
