Eylea. afliberceptum. Co je Eylea? K čemu se přípravek Eylea používá? Souhrn zprávy EPAR určený pro veřejnost
|
|
|
- Růžena Květa Kovářová
- před 9 lety
- Počet zobrazení:
Transkript
1 EMA/677928/2015 EMEA/H/C/ Souhrn zprávy EPAR určený pro veřejnost afliberceptum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European public assessment report, EPAR) pro přípravek. Objasňuje, jakým způsobem Výbor pro humánní léčivé přípravky (CHMP) vyhodnotil tento přípravek, aby mohl vypracovat své stanovisko k vydání rozhodnutí o registraci a doporučení ohledně podmínek používání přípravku. Co je? je léčivý přípravek, který obsahuje léčivou látku aflibercept. Je dostupný ve formě injekčního roztoku k aplikaci do oka v předplněných injekčních stříkačkách nebo lahvičkách. K čemu se přípravek používá? Přípravek se používá k léčbě dospělých s: vlhkou formou věkem podmíněné makulární degenerace (VPMD), což je onemocnění postihující centrální oblast sítnice (zvanou makula) v zadní části oka. Vlhká forma VPMD je způsobena choroidální neovaskularizací (abnormálním růstem krevních cév pod makulou), ze kterých může unikat tekutina i krev, což může způsobovat otok, poruchou zraku způsobenou makulárním edémem (otokem), k němuž dochází po zablokování buď hlavní žíly přivádějící krev ze sítnice (tzv. okluze centrální retinální žíly, CRVO), nebo menších větví žíly (tzv. okluze větve retinální žíly, BRVO), poruchou zraku způsobenou makulárním edémem vyvolaným diabetem, poruchou zraku způsobenou myopickou choroidální neovaskularizací (závažným typem krátkozrakosti, při němž oční bulva neustále roste a stává se delší, než by měla být). Makula zabezpečuje centrální vidění, které je nutné k rozpoznání detailů u každodenních činností, například řízení, čtení a rozpoznávání obličejů. Tato onemocnění vedou u pacienta k postupné ztrátě centrálního vidění. 30 Churchill Place Canary Wharf London E14 5EU United Kingdom Telephone +44 (0) Facsimile +44 (0) Send a question via our website An agency of the European Union European Medicines Agency, Reproduction is authorised provided the source is acknowledged.
2 Výdej tohoto léčivého přípravku je vázán na lékařský předpis. Jak se přípravek používá? Přípravek musí být podáván ve formě intravitreální injekce (injekce do sklivce, gelovité tekutiny v oku) kvalifikovaným lékařem, který má zkušenosti s podáváním injekcí tohoto typu. V případě vlhké formy VPMD se do postiženého oka podává jedna injekce v dávce 2 mg každý měsíc po dobu tří po sobě následujících měsíců a poté se pokračuje podáváním jedné injekce každé dva měsíce. Po jednom roce léčby mohou být v závislosti na odpovědi pacienta na léčbu podávány injekce méně často. V případě makulárního edému po CRVO nebo BRVO se léčba zahajuje podáváním jedné injekce v dávce 2 mg do postiženého oka každý měsíc, avšak v závislosti na odpovědi pacienta na léčbu mohou být časové odstupy mezi jednotlivými injekcemi prodlouženy. Pacientům, kteří na léčbu nereagují, by neměl být přípravek nadále podáván. V případě diabetického makulárního edému se do postiženého oka podává jedna injekce v dávce 2 mg každý měsíc po dobu pěti po sobě následujících měsíců a poté se pokračuje podáváním jedné injekce každé dva měsíce. Po jednom roce léčby mohou být v závislosti na odpovědi pacienta na léčbu podávány injekce méně často. Pokud pacienti na léčbu nereagují, měla by být ukončena. V případě myopické choroidální neovaskularizace se podává jedna injekce v dávce 2 mg do postiženého oka. Pokud onemocnění přetrvává, lze podat další injekce, ale odstup mezi injekcemi by měl být nejméně jeden měsíc. Výkon je nutné provést za sterilních podmínek. Injekční stříkačka a injekční lahvička jsou určeny pouze pro jedno použití. Předplněná injekční stříkačka má větší obsah než doporučená dávka, proto musí lékař při přípravě injekce vytlačit nadbytečný objem a zajistit podání správné dávky. Po injekci je třeba zkontrolovat nitrooční tlak. Jak přípravek působí? Aflibercept je protein (bílkovina) vyrobený biologickým inženýrstvím, který byl navržen tak, aby se vázal na látku zvanou cévní endoteliální růstový faktor A (VEGF-A) a blokoval její účinky. Váže se také na další proteiny, například na placentární růstový faktor (PIGF). VEGF-A a PIGF se podílejí na podpoře abnormálního růstu krevních cév u pacientů s VPMD, určitými typy makulárního edému a myopickou choroidální neovaskularizací. Blokováním těchto faktorů aflibercept omezuje růst krevních cév a kontroluje prosakování tekutiny a otok. Jak byl přípravek zkoumán? Přípravek byl zkoumán ve dvou hlavních studiích, do kterých bylo zařazeno celkem přibližně pacientů s vlhkou formou VPMD. Tyto studie porovnávaly přípravek (podávaný buď v dávce 0,5 mg každé čtyři týdny, 2 mg každé čtyři týdny, nebo 2 mg každých osm týdnů, vždy po třech počátečních dávkách jednou měsíčně) s ranibizumabem, další léčbou VPMD, která byla podávána ve formě injekce do oka každé čtyři týdny. Hlavním měřítkem účinnosti byl podíl pacientů, u kterých byl udržen zrak po prvním roce léčby (definováno jako zhoršení o méně než 15 znaků při standardním vyšetření zraku). Obě studie hodnotily také zachování účinku ve druhém roce léčby, kdy byl počet injekcí a časový odstup mezi injekcemi přizpůsobován podle stavu zraku a změn uvnitř oka. EMA/677928/2015 strana 2/5
3 Přípravek byl rovněž zkoumán v dalších dvou hlavních studiích, do kterých bylo zařazeno 366 pacientů s makulárním edémem po CRVO. V těchto studiích byla srovnávána injekce přípravku v dávce 2 mg podávaná jednou měsíčně s placebo injekcí za použití injekční stříkačky bez jehly. Další hlavní studie, do které bylo zařazeno 181 pacientů s makulárním edémem po BRVO, srovnávala jednou měsíčně podávané 2mg injekce přípravku s léčbou laserem. Ve všech studiích byl hlavním měřítkem účinnosti podíl pacientů, kteří reagovali na léčbu a jejichž zrak se podle výsledků vyšetření zraku po 24 týdnech léčby zlepšil o 15 či více znaků. Studie na pacientech s makulárním edémem po CRVO zkoumaly rovněž účinky léčby podávané na principu dle potřeby po 24 týdnech. Další dvě studie, do kterých bylo zařazeno 872 pacientů s diabetickým makulárním edémem, se zaměřily na účinek přípravku ve srovnání s léčbou laserem. Přípravek byl podáván buď jednou měsíčně, nebo nejprve jednou měsíčně po dobu pěti měsíců a následně již jen jednou za dva měsíce. Hlavním měřítkem účinnosti byla v obou studiích změna počtu písmen, které byl pacient schopen přečíst v rámci vyšetření zraku po jednom roce léčby. V případě myopické choroidální neovaskularizace byl přípravek zkoumán v jedné hlavní stutii, do které bylo zařazeno 122 pacientů a která porovnávala přípravek s placebo injekcí. Hlavním měřítkem účinnosti byla změna počtu písmen, které byl pacient schopen přečíst v rámci vyšetření zraku po 24 týdnech léčby. Jaký přínos přípravku byl prokázán v průběhu studií? U přípravku byla u pacientů s vlhkou formou VPMD v rámci udržení zraku prokázána stejná účinnost jako u ranibizumabu: při souhrnném posouzení výsledků provedených dvou studií činil podíl pacientů se zachovaným zrakem 96,1 % (517 z 538) při podávání přípravku v dávce 0,5 mg každé čtyři týdny, 95,4 % (533 z 559) při podávání přípravku v dávce 2 mg každé čtyři týdny a 95,3 % (510 z 535) při podávání přípravku v dávce 2 mg každých osm týdnů. Při podávání ranibizumabu každé čtyři týdny se pro srovnání jednalo o 94,4 % pacientů (508 z 538). Ve druhém roce léčby byla účinnost obecně zachována, přičemž většina pacientů dostávala injekce v prodlouženém dávkovacím intervalu 10 týdnů, i když malý počet pacientů potřeboval příležitostně častější injekce (například jednou za měsíc). Léčba přípravkem rovněž vedla k významnému zlepšení zraku u pacientů s makulárním edémem po CRVO a BRVO. Pokud jde o CRVO, zlepšení o 15 či více znaků bylo po 24 týdnech léčby při vyšetření zraku zaznamenáno u celkově přibližně 60 % pacientů, kterým byl podáván přípravek, v porovnání se 17 % pacientů, kterým byly podávány placebo injekce. Tento přínos se z velké části udržoval při pokračování léčby na principu podávání dle potřeby až po dobu 52 týdnů, nicméně při dlouhodobější léčbě pacientů se podle všeho přínos léčby částečně vytrácel. Pokud jde o BRVO, po 24 týdnech léčby bylo zlepšení o 15 či více znaků při vyšetření zraku zaznamenáno u přibližně 53 % pacientů, kterým byl podáván přípravek, v porovnání s 27 % pacientů léčených laserem. V 52. týdnu léčby tento účinek stále přetrvával navzdory méně častému podávání přípravku mezi 24. a 52. týdnem. U pacientů s diabetickým makulárním edémem činil průměrný počet písmen, který dokázali přečíst v rámci vyšetření zraku před zahájením léčby, přibližně 59 až 60. U pacientů, jimž byl přípravek podáván jednou měsíčně, se tento výsledek zlepšil o zhruba 12 písmen a u pacientů, jimž byl přípravek podáván jednou za dva měsíce, se zlepšil o přibližně 11 písmen. Naproti tomu u pacientů léčených laserem bylo po roce pozorováno zlepšení jen zhruba o 1 písmeno. EMA/677928/2015 strana 3/5
4 V rámci studie u myopické choroidální neovaskularizace činil průměrný počet písmen, který pacienti dokázali přečíst v rámci vyšetření zraku před zahájením léčby, přibližně 56. Pacienti, jimž byl podáván přípravek, byli po 24 týdnech léčby v průměru schopni přečíst o 12 písmen více, zatímco u pacientů, jimž byly podávány placebo injekce, se celkový počet písmen, který dokázali přečíst, v průměru snížil o 2 písmena. Jaká rizika jsou spojena s přípravkem? Nejčastějšími nežádoucími účinky zaznamenanými u přípravku (postihujícími nejméně 1 pacienta z 20) jsou spojivkové krvácení (krvácení z malých krevních cév na povrchu oka v místě vpichu injekce), zhoršení vidění, bolest oka, odchlípení sklivce (oddělení gelovité látky uvnitř oka), katarakta (zákal čočky), sklivcové vločky (malé částice nebo tečky ve vidění) a zvýšený nitrooční tlak. Závažné nežádoucí účinky související s podáním injekce (které se objevily u méně než 1 z injekcí) zahrnují slepotu, endoftalmitidu (zánět uvnitř oka), kataraktu, zvýšený nitrooční tlak, sklivcové krvácení (krvácení do gelovitého roztoku v oku způsobující dočasnou ztrátu zraku) a odchlípení sklivce nebo sítnice. Úplný seznam nežádoucích účinků hlášených v souvislosti s přípravkem je uveden v příbalové informaci. Přípravek se nesmí používat u pacientů, kteří trpí očními infekcemi nebo periokulárními infekcemi (infekcemi v oblasti očí nebo jejich okolí) nebo u kterých je na tyto infekce podezření, a dále u pacientů, kteří trpí závažným zánětem uvnitř oka. Úplný seznam omezení přípravku je uveden v příbalové informaci. Na základě čeho byl přípravek schválen? Výbor CHMP je toho názoru, že v případě vlhké formy VPMD je přípravek po prvním roce léčby v rámci udržování zraku pacientů stejně účinný jako ranibizumab. Výbor CHMP navíc usoudil, že přípravek byl přínosný v rámci zlepšení zraku pacientů s makulárním edémem způsobeným CRVO, BRVO nebo diabetem, jakož i u pacientů s myopickou choroidální neovaskularizací. Výbor CHMP dále uvedl, že v souvislosti s přípravkem nebyla zaznamenána žádná závažná nebo nečekaná bezpečnostní rizika. Výbor CHMP rozhodl, že přínosy přípravku převyšují jeho rizika, a proto doporučil, aby mu bylo uděleno rozhodnutí o registraci. Jaká opatření jsou uplatňována k zajištění bezpečného používání přípravku? K zajištění co nejbezpečnějšího používání přípravku byl vypracován plán řízení rizik. Na základě tohoto plánu byly do souhrnu údajů o přípravku a příbalové informace přípravku zahrnuty informace o bezpečnosti, včetně příslušných opatření, která by měli dodržovat zdravotničtí pracovníci i pacienti. Výrobce přípravku rovněž poskytne aktualizované vzdělávací materiály pro lékaře (k minimalizaci rizik spojených s nitrooční injekcí) i pacienty (aby mohli rozpoznat veškeré závažné nežádoucí účinky a věděli, kdy mají okamžitě vyhledat svého lékaře). Výrobce navíc provede studii zaměřenou na prodloužené intervaly léčby pomocí přípravku při léčbě diabetického makulárního edému a studii zkoumající účinky přípravku u léčby vlhké formy VPMD při jeho podávání na principu dle potřeby. EMA/677928/2015 strana 4/5
5 Další informace o přípravku Evropská komise udělila rozhodnutí o registraci přípravku platné v celé Evropské unii dne 22. listopadu Plné znění zprávy EPAR pro přípravek je k dispozici na internetových stránkách agentury na adrese ema.europa.eu/find medicine/human medicines/european public assessment reports. Další informace o léčbě přípravkem naleznete v příbalové informaci (rovněž součástí zprávy EPAR) nebo se obraťte na svého lékaře či lékárníka. Tento souhrn byl naposledy aktualizován v EMA/677928/2015 strana 5/5
Pradaxa je léčivý přípravek, který obsahuje léčivou látku dabigatran-etexilát. Je dostupný ve formě tobolek (75, 110 a 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Souhrn zprávy EPAR určený pro veřejnost dabigatranum etexilatum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro
EMA/47517/2015 EMEA/H/C/000829 Souhrn zprávy EPAR určený pro veřejnost dabigatranum etexilatum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro
pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná)
 EMA/90006/2015 EMEA/H/C/001104 Souhrn zprávy EPAR určený pro veřejnost pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení
EMA/90006/2015 EMEA/H/C/001104 Souhrn zprávy EPAR určený pro veřejnost pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení
Přípravek Avastin se společně s jinými protinádorovými léčivými přípravky používá u dospělých k léčbě těchto typů rakoviny:
 EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/175824/2015 EMEA/H/C/000582 Souhrn zprávy EPAR určený pro veřejnost bevacizumabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
v kombinaci s dexamethasonem u dospělých, jejichž onemocnění bylo alespoň jednou v minulosti léčeno.
 EMA/113870/2017 EMEA/H/C/000717 Souhrn zprávy EPAR určený pro veřejnost lenalidomidum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/113870/2017 EMEA/H/C/000717 Souhrn zprávy EPAR určený pro veřejnost lenalidomidum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
VÁŠ PRŮVODCE PRO PŘÍPRAVEK
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 25 January 2018 EMA/PRAC/35612/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
25 January 2018 EMA/PRAC/35612/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU
 EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
EMA/489091/2018 EMEA/H/C/003985 Přehled pro přípravek Opdivo a proč byl přípravek registrován v EU Co je přípravek Opdivo a k čemu se používá? Opdivo je protinádorový léčivý přípravek, který se používá
Metacam. meloxicamum. Co je Metacam? K čemu se přípravek Metacam používá? Souhrn zprávy EPAR určený pro veřejnost
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Souhrn zprávy EPAR určený pro veřejnost meloxicamum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR). Objasňuje,
EMA/CVMP/259397/2006 EMEA/V/C/000033 Souhrn zprávy EPAR určený pro veřejnost meloxicamum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR). Objasňuje,
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 17 December 2015 EMA/PRAC/835770/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
17 December 2015 EMA/PRAC/835770/2015 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
závažné revmatoidní artritidy (onemocnění, které způsobuje zánět kloubů), kdy je přípravek MabThera podáván intravenózně spolu s methotrexátem;
 EMA/614203/2010 EMEA/H/C/000165 Souhrn zprávy EPAR určený pro veřejnost rituximabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
EMA/614203/2010 EMEA/H/C/000165 Souhrn zprávy EPAR určený pro veřejnost rituximabum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European Public Assessment Report, EPAR) pro přípravek.
Metacam (meloxicamum)
 EMA/CVMP/259397/2006 EMEA/V/C/000033 Přehled informací o přípravku Metacam a proč byl registrován v EU Co je přípravek Metacam a k čemu se používá? Metacam je protizánětlivý léčivý přípravek, který se
EMA/CVMP/259397/2006 EMEA/V/C/000033 Přehled informací o přípravku Metacam a proč byl registrován v EU Co je přípravek Metacam a k čemu se používá? Metacam je protizánětlivý léčivý přípravek, který se
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 15 September 2016 EMA/PRAC/603546/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
15 September 2016 EMA/PRAC/603546/2016 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
Uživatelská příručka pro webové hlášení
 Ochrana zdraví pacientů Tato uživatelská příručka pro webové hlášení obsahuje informace o datových prvcích, rozvržení, interpretaci a funkcích webového hlášení. 1. Datové prvky... 2 2. Další podrobnosti
Ochrana zdraví pacientů Tato uživatelská příručka pro webové hlášení obsahuje informace o datových prvcích, rozvržení, interpretaci a funkcích webového hlášení. 1. Datové prvky... 2 2. Další podrobnosti
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 25 February 2016 EMA/PRAC/137776/2016 Corr 1 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC
25 February 2016 EMA/PRAC/137776/2016 Corr 1 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC
Uveďte co nejvíce souvisejících informací (kontextu), abychom mohli Váš dotaz účinně zodpovědět.
 13. února 2017 EMA/527628/2011 Rev. 1 Ředitelství V tomto dokumentu naleznete odpovědi na často kladené dotazy, které Evropská agentura pro léčivé přípravky (EMA) obdržela. Pokud zde odpověď na Vaši otázku
13. února 2017 EMA/527628/2011 Rev. 1 Ředitelství V tomto dokumentu naleznete odpovědi na často kladené dotazy, které Evropská agentura pro léčivé přípravky (EMA) obdržela. Pokud zde odpověď na Vaši otázku
Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
 22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
22. ledna 2015 EMA/PRAC/63322/2015 Farmakovigilanční výbor pro posuzování rizik léčiv Doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) k signálům pro aktualizaci informací o přípravku
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
*Ranibizumab je fragment humanizované monoklonální protilátky produkovaný buňkami Escherichia coli rekombinantní DNA technologií.
 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
Pravidla pro organizaci a vedení veřejných slyšení ve Farmakovigilančním výboru pro posuzování rizik léčiv (PRAC)
 13. dubna 2016 EMA/363479/2015 Pravidla pro organizaci a vedení veřejných slyšení ve Farmakovigilančním výboru pro posuzování rizik léčiv (PRAC) 1. Hlavní zásady Výbor PRAC má možnost uspořádat veřejná
13. dubna 2016 EMA/363479/2015 Pravidla pro organizaci a vedení veřejných slyšení ve Farmakovigilančním výboru pro posuzování rizik léčiv (PRAC) 1. Hlavní zásady Výbor PRAC má možnost uspořádat veřejná
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
12 October 2017 EMA/PRAC/662563/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas)
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls19458/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas) Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls19458/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DESFERAL prášek pro přípravu injekčního roztoku (deferoxamini mesilas) Přečtěte si pozorně
Keytruda (pembrolizumabum)
 EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
EMA/235911/2019 EMEA/H/C/003820 Přehled pro přípravek Keytruda a proč byl přípravek registrován v EU Co je přípravek Keytruda a k čemu se používá? Keytruda je protinádorový léčivý přípravek používaný k
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Evropská agentura pro léčivé přípravky doporučuje změny použití metoklopramidu
 20. prosince 2013 EMA/13239/2014 Corr. 1 Evropská agentura pro léčivé přípravky doporučuje změny použití metoklopramidu Účelem změn je zejména snížení rizika neurologických nežádoucích účinků Dne 24. října
20. prosince 2013 EMA/13239/2014 Corr. 1 Evropská agentura pro léčivé přípravky doporučuje změny použití metoklopramidu Účelem změn je zejména snížení rizika neurologických nežádoucích účinků Dne 24. října
Pokyny k interpretaci spontánně hlášených případů podezření na nežádoucí účinky léčivých přípravků
 30. ledna 2017 Inspekce, farmakovigilance humánních a výbory EMA/749446/2016 Revize 1* Pokyny k interpretaci spontánně hlášených případů podezření na nežádoucí účinky Schválil Farmakovigilanční tým listopad
30. ledna 2017 Inspekce, farmakovigilance humánních a výbory EMA/749446/2016 Revize 1* Pokyny k interpretaci spontánně hlášených případů podezření na nežádoucí účinky Schválil Farmakovigilanční tým listopad
Příbalová informace: informace pro pacienta. Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum
 Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
VÁŠ PRŮVODCE PRO PŘÍPRAVEK. (aflibercept solution for injection)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
Úvod k pracovnímu programu agentury na rok 2015
 7 srpna 2015 EMA/372780/2015 Zástupce výkonného ředitele zástupce výkonného ředitele Andreas Pott Priority agentury EMA a klíčové vlivy Evropský systém pro regulaci léčivých přípravků se opírá o síť přibližně
7 srpna 2015 EMA/372780/2015 Zástupce výkonného ředitele zástupce výkonného ředitele Andreas Pott Priority agentury EMA a klíčové vlivy Evropský systém pro regulaci léčivých přípravků se opírá o síť přibližně
PŘÍLOHA I SEZNAM NÁZEV LÉČIVÉHOPŘÍPRAVKU, LÉKOVÁ FORMA, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH
 PŘÍLOHA I SEZNAM NÁZEV LÉČIVÉHOPŘÍPRAVKU, LÉKOVÁ FORMA, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
PŘÍLOHA I SEZNAM NÁZEV LÉČIVÉHOPŘÍPRAVKU, LÉKOVÁ FORMA, KONCENTRACE, ZPŮSOB PODÁNÍ, DRŽITELÉ ROZHODNUTÍ O REGISTRACI V ČLENSKÝCH STÁTECH 1 Členský stát Držitel rozhodnutí o registraci Smyšlený název Koncentrace
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
Příbalová informace: informace pro uživatele
 sp.zn.: sukls236606/2012 Příbalová informace: informace pro uživatele MENJUGATE, prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C Přečtěte si pozorně
sp.zn.: sukls236606/2012 Příbalová informace: informace pro uživatele MENJUGATE, prášek a rozpouštědlo pro injekční suspenzi Konjugovaná oligosacharidová vakcína proti meningitidě C Přečtěte si pozorně
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Menveo prášek a roztok pro injekční roztok. Konjugovaná vakcína proti meningokokům skupin A, C, W135 a Y 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje dexamethasonum 700
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden implantát obsahuje dexamethasonum 700
sp.zn.sukls192314/2011
 sp.zn.sukls192314/2011 Příbalová informace: Informace pro uživatele Optipres 20 mg/ml oční kapky, roztok dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
sp.zn.sukls192314/2011 Příbalová informace: Informace pro uživatele Optipres 20 mg/ml oční kapky, roztok dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE SYNAGIS 100 mg prášek pro přípravu injekčního roztoku s rozpouštědlem Palivizumabum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje důležité
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele XGEVA 120 mg injekční roztok denosumabum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příloha II. Vědecké závěry
 Příloha II Vědecké závěry 11 Vědecké závěry Po zvážení revidovaného konečného doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) ze dne 10. července 2014 týkajícího se léčivých přípravků
Příloha II Vědecké závěry 11 Vědecké závěry Po zvážení revidovaného konečného doporučení Farmakovigilančního výboru pro posuzování rizik léčiv (PRAC) ze dne 10. července 2014 týkajícího se léčivých přípravků
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis Pesti injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis Pesti injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivá látka:
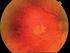
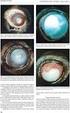
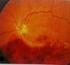
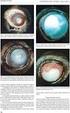
MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD)
 MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD) Autor: Čarnogurská Ivana, Kohútová Lucia Školitel: MUDr. Barbora Chrapková Výskyt Věkem podmíněná makulární
MORFOLOGICKÉ ZMĚNY V MAKULE PŘI LÉČBĚ VLHKÉ FORMY VĚKEM PODMÍNĚNÉ MAKULÁRNÍ DEGENERACE (VPMD) Autor: Čarnogurská Ivana, Kohútová Lucia Školitel: MUDr. Barbora Chrapková Výskyt Věkem podmíněná makulární
sp.zn.: sukls32991/2012 a sp.zn.: sukls148548/2014
 sp.zn.: sukls32991/2012 a sp.zn.: sukls148548/2014 Příbalová informace: Informace pro uživatele TRUSOPT 20 mg/ml, oční kapky, roztok dorzolamidi hydrochloridum Přečtěte si pozorně celou příbalovou informaci
sp.zn.: sukls32991/2012 a sp.zn.: sukls148548/2014 Příbalová informace: Informace pro uživatele TRUSOPT 20 mg/ml, oční kapky, roztok dorzolamidi hydrochloridum Přečtěte si pozorně celou příbalovou informaci
Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI
 Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) bimatoprostu
Příloha I VĚDECKÉ ZÁVĚRY A ZDŮVODNĚNÍ ZMĚNY PODMÍNEK ROZHODNUTÍ O REGISTRACI Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR) bimatoprostu
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Imlygic 10 6 jednotek tvořících plaky (PFU)/ml injekční roztok Imlygic 10 8 jednotek tvořících plaky (PFU)/ml injekční roztok talimogenum
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Imlygic 10 6 jednotek tvořících plaky (PFU)/ml injekční roztok Imlygic 10 8 jednotek tvořících plaky (PFU)/ml injekční roztok talimogenum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Omidria 10 mg/ml + 3 mg/ml, koncentrát pro roztok k nitroočnímu výplachu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čtyři ml roztoku v injekční lahvičce
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Omidria 10 mg/ml + 3 mg/ml, koncentrát pro roztok k nitroočnímu výplachu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čtyři ml roztoku v injekční lahvičce
PŘÍBALOVÁ INFORMACE 22
 PŘÍBALOVÁ INFORMACE 22 Příbalová informace: Informace pro uživatele VELETRI 0,5 mg prášek pro infuzní roztok VELETRI 1,5 mg prášek pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE 22 Příbalová informace: Informace pro uživatele VELETRI 0,5 mg prášek pro infuzní roztok VELETRI 1,5 mg prášek pro infuzní roztok Epoprostenolum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls154079/2012
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls154079/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OPTODROP COMBI 2% + 0,5% oční kapky, roztok (dorzolamidi hydrochloridum, timololi maleas)
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls154079/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE OPTODROP COMBI 2% + 0,5% oční kapky, roztok (dorzolamidi hydrochloridum, timololi maleas)
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Příloha I. Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech
 Příloha I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHS Název společnosti uchazeče, adresa (Smyšlený název) Název Množství
Příloha I Seznam názvů, lékové formy, množství účinné látky v lécích, způsob podávání a uchazeči v členských státech 1 Členský stát EU/EHS Název společnosti uchazeče, adresa (Smyšlený název) Název Množství
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Akistan 50 mikrogramů/ml oční kapky, roztok (latanoprostum)
 Sp. zn. sukls79185/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Akistan 50 mikrogramů/ml oční kapky, roztok (latanoprostum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat
Sp. zn. sukls79185/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Akistan 50 mikrogramů/ml oční kapky, roztok (latanoprostum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat
CNV. Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab)
 CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Injekční suspenze, adsorbovaná vakcína proti tetanu, bez konzervačních prosředků
 Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
Tento dokument je odbornou informací k léčivému přípravku, který je předmětem specifického léčebného programu. Odborná informace byla předložena žadatelem o specifický léčebný program. Nejedná se o dokument
Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis
 Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab). Oddíl 1 O přípravku Lucentis Tato brožura Vám
Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab). Oddíl 1 O přípravku Lucentis Tato brožura Vám
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III
 sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls43174/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Anbinex 50 IU/ml, prášek a rozpouštědlo pro injekční roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE. SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE SonoVue, 8 mikrolitrů/ml, prášek pro přípravu injekční disperze s rozpouštědlem sulfuris hexafluoridum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum
 sp.zn.sukls29736/2015 Příbalová informace: informace pro uživatele TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
sp.zn.sukls29736/2015 Příbalová informace: informace pro uživatele TEARS NATURALE II oční kapky, roztok dextranum 70, hypromelosum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ANTITHROMBIN III NF BAXTER, prášek pro přípravu infuzního roztoku s rozpouštědlem 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ 1 ml rozpuštěného přípravku obsahuje
Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje hexylis aminolevulinas
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hexvix prášek a rozpouštědlo pro přípravu roztoku do močového měchýře 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička s práškem obsahuje hexylis aminolevulinas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
NEREGISTROVANÝ PŘÍPRAVEK použití povoleno v rámci specifického léčebného programu SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU ADACEL POLIO, injekční suspenze v předplněné stříkačce Vakcína (adsorbovaná) proti diftérii (snížený obsah antigenu), tetanu, pertusi (acelulární komponenta)
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.sukls79980/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům
Vědecké závěry a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC
 Příloha IV Vědecké závěry, zdůvodnění změny podmínek rozhodnutí o registraci a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC 1 Vědecké závěry a podrobné vysvětlení vědeckého
Příloha IV Vědecké závěry, zdůvodnění změny podmínek rozhodnutí o registraci a podrobné vysvětlení vědeckého zdůvodnění rozdílů oproti doporučení výboru PRAC 1 Vědecké závěry a podrobné vysvětlení vědeckého
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. Pioglitazon Mylan 15 mg Pioglitazon Mylan 30 mg tablety pioglitazonum
 sp.zn.sukls36269/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Pioglitazon Mylan 15 mg Pioglitazon Mylan 30 mg tablety pioglitazonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.sukls36269/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Pioglitazon Mylan 15 mg Pioglitazon Mylan 30 mg tablety pioglitazonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 1 October 2018 1 EMA/PRAC/621126/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
1 October 2018 1 EMA/PRAC/621126/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU. NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. 1 ml suspenze obsahuje nepafenacum 1 mg.
 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocné látky: benzalkonium-chlorid 0,05 mg Úplný seznam
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU NEVANAC 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml suspenze obsahuje nepafenacum 1 mg. Pomocné látky: benzalkonium-chlorid 0,05 mg Úplný seznam
4.3. Kontraindikace Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
 sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
sp.zn.sukls67500/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ levocabastini hydrochloridum 0,54 mg v 1 ml, ekvivalentní levocabastinum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ECALTA 100 mg, prášek pro koncentrát pro infuzní roztok Anidulafunginum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd
sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok
 sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje moxifloxacini hydrochloridum 5,45
sp. zn. sukls145243/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU XIFLODROP 5 mg/ml Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje moxifloxacini hydrochloridum 5,45
Příbalová informace: informace pro uživatele. Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum
 Příbalová informace: informace pro uživatele Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele Adriblastina CS injekční roztok 2 mg/ml doxorubicini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis
 EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 17 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE QUADRAMET, injekční roztok Samarium [ 1 5 3 Sm] lexidronam pentasodium. Přečtěte si pozorně celou příbalovou informace dříve, než
B. PŘÍBALOVÁ INFORMACE 17 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE QUADRAMET, injekční roztok Samarium [ 1 5 3 Sm] lexidronam pentasodium. Přečtěte si pozorně celou příbalovou informace dříve, než
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5465/2010 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE
 Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5465/2010 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE DYSPORT Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte
Příloha č. 2 k rozhodnutí o povolení souběžného dovozu sp. zn.:sukls5465/2010 PŘÍBALOVÁ INFORMACE- INFORMACE PRO UŽIVATELE DYSPORT Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum
 Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
Sp.zn. sukls194934/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Topotecan medac 1 mg/ml koncentrát pro přípravu infuzního roztoku Topotecanum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok. Latanoprostum
 Sp.zn. sukls116684/2014 Příbalová informace: informace pro uživatele Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete užívat
Sp.zn. sukls116684/2014 Příbalová informace: informace pro uživatele Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete užívat
Informace pro pacienty léčené přípravkem CIMZIA
 Informace pro pacienty léčené přípravkem CIMZIA Informace pro pacienta Cimzia se používá k léčbě středně závažné až závažné revmatoidní artritidy u dospělých pacientů, když jiné další léky nestačí ke
Informace pro pacienty léčené přípravkem CIMZIA Informace pro pacienta Cimzia se používá k léčbě středně závažné až závažné revmatoidní artritidy u dospělých pacientů, když jiné další léky nestačí ke
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls221245/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INDOCOLLYRE 0,1% oční kapky Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Jeden ml obsahuje indometacinum
sp.zn.: sukls221245/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU INDOCOLLYRE 0,1% oční kapky Oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Jeden ml obsahuje indometacinum
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Kyprolis 60 mg prášek pro infuzní roztok carfilzomibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro pacienta Kyprolis 60 mg prášek pro infuzní roztok carfilzomibum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům
 4 January 2019 1 EMA/PRAC/855007/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
4 January 2019 1 EMA/PRAC/855007/2018 Pharmacovigilance Risk Assessment Committee (PRAC) Nové znění informací o přípravku výňatky z doporučení výboru PRAC k signálům Přijato na zasedání výboru PRAC konaném
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls73712/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimican 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jedna kapka
Sp.zn. sukls73712/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bimican 0,3 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje bimatoprostum 0,3 mg. Jedna kapka
Oddíl 1 O přípravku Lucentis
 mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Příbalová informace: informace pro pacienta. Latalux 50 mikrogramů/ml oční kapky, roztok Latanoprostum
 Sp. zn. sukls136408/2014 Příbalová informace: informace pro pacienta Latalux 50 mikrogramů/ml oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls136408/2014 Příbalová informace: informace pro pacienta Latalux 50 mikrogramů/ml oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele. Aripiprazol Alpha 10 mg tablety Aripiprazol Alpha 15 mg tablety aripiprazolum
 sp.zn. sukls98861/2014, sukls98862/2014 Příbalová informace: informace pro uživatele Aripiprazol Alpha 10 mg tablety Aripiprazol Alpha 15 mg tablety aripiprazolum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls98861/2014, sukls98862/2014 Příbalová informace: informace pro uživatele Aripiprazol Alpha 10 mg tablety Aripiprazol Alpha 15 mg tablety aripiprazolum Přečtěte si pozorně celou příbalovou informaci
Příloha I. Vědecké závěry a důvody pro změnu v podmínkách rozhodnutí o registraci
 Příloha I Vědecké závěry a důvody pro změnu v podmínkách rozhodnutí o registraci Vědecké závěry S přihlédnutím k hodnotící zprávě PRAC k PSUR pro anagrelid, vědecké závěry výboru CHMP jsou následující:
Příloha I Vědecké závěry a důvody pro změnu v podmínkách rozhodnutí o registraci Vědecké závěry S přihlédnutím k hodnotící zprávě PRAC k PSUR pro anagrelid, vědecké závěry výboru CHMP jsou následující:
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sukls134304/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CEFTRIAXON MEDOPHARM 1 g prášek pro injekční/infuzní roztok ceftriaxonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis
 Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
PROGRAM. 9. setkání mladých oftalmologů. 29. - 30. května 2009. Hotel Panorama, Blansko Moravský kras. Akce je garantována ČOS
 PROGRAM 9. setkání mladých oftalmologů 29. - 30. května 2009 Hotel Panorama, Blansko Moravský kras Akce je garantována ČOS Na organizačním zajištění se podílí: Galén-Symposion s.r.o. Břežanská 10, 100
PROGRAM 9. setkání mladých oftalmologů 29. - 30. května 2009 Hotel Panorama, Blansko Moravský kras Akce je garantována ČOS Na organizačním zajištění se podílí: Galén-Symposion s.r.o. Břežanská 10, 100
ECRITEN 100 mg potahované tablety. Sildenafilum
 Příbalová informace: Informace pro uživatele ECRITEN 100 mg potahované tablety Sildenafilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
Příbalová informace: Informace pro uživatele ECRITEN 100 mg potahované tablety Sildenafilum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje pro
sp.zn.: sukls59875/2012 a k sp.zn.: sukls58444/2012
 sp.zn.: sukls59875/2012 a k sp.zn.: sukls58444/2012 Příbalová informace: informace pro pacienta BETALMIC 0,5% Oční kapky, roztok Betaxololi hydrochloridum Přečtěte si pozorně celou příbalovou informaci
sp.zn.: sukls59875/2012 a k sp.zn.: sukls58444/2012 Příbalová informace: informace pro pacienta BETALMIC 0,5% Oční kapky, roztok Betaxololi hydrochloridum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace informace pro uživatele. Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku
 Příloha č.2 k rozhodnutí o registraci sp.zn. sukls49585/2008 Příbalová informace informace pro uživatele Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku Irinotecani hydrochloridum
Příloha č.2 k rozhodnutí o registraci sp.zn. sukls49585/2008 Příbalová informace informace pro uživatele Irinotecan Medico Uno 20 mg/ml koncentrát pro přípravu infuzního roztoku Irinotecani hydrochloridum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls38632/2008 a příloha k sp.zn.: sukls112054/2008
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls38632/2008 a příloha k sp.zn.: sukls112054/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HALOPERIDOL DECANOAT-RICHTER injekční roztok
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls38632/2008 a příloha k sp.zn.: sukls112054/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HALOPERIDOL DECANOAT-RICHTER injekční roztok
