Biologická léãba psoriatické artritidy
|
|
|
- Iva Havlová
- před 9 lety
- Počet zobrazení:
Transkript
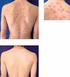
1 Biologická léãba psoriatické artritidy MUDr. Jiří Štolfa Revmatologick ústav, Praha Úvod Psoriatická artritida (PsA) je chronické zánûtlivé kloubní onemocnûní charakterizované pfiítomností artritidy a psoriázy. Psoriáza zpravidla pfiedchází manifestaci kloubního syndromu (asi v 85 %), ménû ãasto se oba syndromy manifestují souãasnû (asi v 15 %), u ãásti pacientû pfiedchází artritida manifestaci koïního syndromu (asi v 5 %). V roce 1964 byla psoriatická artritida vyãlenûna jako samostatná jednotka odli ná od revmatoidní artritidy [1]. Léãebné moïnosti psoriatické artritidy pfiedstavují nesteroidní antiflogistika, chorobu modifikující léky (DMARDs disease modifying antirheumatic drugs), kortikoidy a v poslední dobû tzv. biologická léãba. Nesteroidní antiflogistikum by mûlo b t v období aktivity onemocnûní podáváno v plné dávce odpovídající pfiíslu nému preparátu aï do dosaïení remise. Pfii neúspûchu léãby nesteroidními antiflogistiky je nezbytné zahájit léãbu nûkter m z preparátû ze skupiny chorobu modifikujících farmak. Mezi farmaka s dokumentovan m úãinkem u psoriatické artritidy patfií sulfasalazin, methotrexat, leflunomid a ciclosporin v monoterapii nebo v kombinacích. U ostatních farmak pocházejí doklady o úãinnosti jen z ojedinûl ch, zpravidla nekontrolovan ch studií a jejich úãinek není jednoznaãn nebo je spojen s neïádoucími vedlej ími úãinky na koïní syndrom. procento odpovídajících pacientû dle kritérií ACR 20 PsARC PASI 75 infliximab Biologická léãba Neúãinnost chorobu modifikujících farmak u ãásti pacientû s psoriatickou artritidou a nepfiesvûdãivé v sledky studií sledujících radiologickou progresi urychlily snahu o v voj nov ch úãinnûj ích farmak s cílem ovlivnit nejen klinickou aktivitu, ale i radiologickou progresi. V voj tûchto nov ch farmak vychází ze znalostí klíãové role T lymfocytû a cytokinû produkovan ch aktivovan mi imunokompetentními buàkami v patogenezi psoriatické artritidy. Mezi nejv znamnûj í cytokiny patfií faktor nekrotizující tumory (TNF-α tumor necrosis factor-α) a interleukin-1 (IL-1). Tyto poznatky vedly k v voji látek specificky zamûfien ch na neutralizaci tûchto cytokinû, v prvé fiadû TNF-α. Léãba tûmito farmaky se ukázala b t vysoce úãinná u revmatoidní artritidy rezistentní na léãbu standardními chorobu modifikujícími farmaky, a to pfii sledování prakticky v ech dostupn ch parametrû. Ménû zku eností s touto léãbou je u spondylartritid vãetnû psoriatické artritidy. Zájem o tuto léãbu právû u spondylartritid byl podnícen prûkazem pfiítomnosti TNF-α nejen v psoriatick ch koïních lézích [2], ale i v synovii kloubu postiïeného artritidou [3] a zejména v místû zánûtlivû zmûnûn ch úponû lach a kloubního pouzdra do kosti (entezitis) [4]. Právû entezitida je v souãasné dobû pokládána za primární zánûtlivou afekci v patogenezi jak periferních artritid, tak sakroiliitidy a spondylitidy u spondylartritid. Léãba zamûfiená proti TNF-α by tedy mohla pfiíznivû ovlivnit jak periferní kloubní, tak axiální syndrom u spondylartritid, coï se nepodafiilo Ïádnému z tradiãních chorobu modifikujících farmak. Tento pfiedpoklad byl pozdûji potvrzen v fiadû otevfien ch i randomizovan ch kontrolovan ch studií. Jin pfiístup k biologické léãbû pfiedstavuje snaha ovlivnit aktivaci T bunûk na úrovni receptoru na T lymfocytu (TCR), na úrovni kostimulaãních molekul, inhibicí proliferace T bunûk, resp. jejich destrukcí, nebo tzv. imunomodulátory. Nûkteré z tûchto látek jsou jiï pro léãbu PsA registrované, studie s jin mi probíhají. Mimoto existují látky zkou ené zatím u jin ch onemocnûní, které by se mohly v blízké budoucnosti stát pfiedmûtem v zkumu i u psoriatické artritidy. Pfiehled biologick ch lékû pro léãbu PsA viz tab. 1. placebo ACR 20 kloubní odpověď na léčbu infliximabem, PsARC kloubní odpověď na léčbu infliximabem, PASI 75 kožní odpověď na léčbu infliximabem Graf 1 Odpověď na léčbu infliximabem ve 24. týdnu terapie ve studii IMPACT-2 V souãasné dobû je nejvíce zku eností s anticytokinovou léãbou zamûfienou proti TNF-α, s infliximabem, s etanerceptem a s adalimumabem. V echny tyto látky vykazují intenzivní protizánûtliv úãinek tím, Ïe váïou a inaktivují voln, resp. vázan TNF-α [5]. Infliximab a etanercept jsou v âr registrovány pro léãbu PsA, registrace adalimumabu v âr se pfiipravuje. Preparáty pro biologickou léãbu PsA Infliximab Infliximab je chimérická monoklonální protilátka proti tumor nekrotizujícímu faktoru-α. Molekula infliximabu je tvofiena ze 75 % humánní a z 25 % my í komponentou (variabilní ãást imunoglobulinové molekuly Fab). VáÏe se jak na solubilní, tak na transmembránovou formu TNF-α v pikomolárních koncentracích. Tento komplex váïe komplement a vede k l ze buàky [6]. Infliximab (na rozdíl od etanerceptu) nevá- Ïe TNF-β (lymfotoxin). Farmakodynamika Klinického úãinku infliximabu je kromû blokády TNF-α dosaïeno nûkolika dal ími mechanismy: 1. Ovlivněním některých působků angažovaných v genezi zánětu a) sníïením plazmatick ch hladin cytokinû: 261
2 interleukinu-1β (IL-1β) a interleukinu-6 (IL-6); b) sníïením exprese chemokinû: interleukinu-8 (IL-8) a proteinu pfiitahujícího monocyty (monocyte chemoattractant protein-1 MCP-1) v synoviální tkáni; c) sníïením plazmatické koncentrace metaloproteinázy-3; d) sníïením aktivity syntázy oxidu dusnatého (NOS). 2. Ovlivněním migrace lymfocytů Infliximab sniïuje expresi adhezivních molekul na endotelu synoviálních cév a tím migraci lymfocytû do kloubu s následn m zv ením poãtu lymfocytû v periferní krvi. SníÏená migrace lymfocytû do kloubu sni- Ïuje moïnost interakce lymfocytû s makrofágy v kloubu. 3. Ovlivněním neoangiogeneze Infliximab sniïuje plazmatické koncentrace vaskulárního endoteliálního rûstového faktoru (vascular endothelial growth factor VEGF) s následn m sníïením neoangiogeneze v kloubu. Mimo vzestup poãtu lymfocytû v periferní krvi vede léãba infliximabem k pfiechodnému poklesu poãtu monocytû a neutrofilních granulocytû v periferní krvi a k vzestupu hodnot hemoglobinu. Vzhledem k tomu, Ïe poãty monocytû a neutrofilních granulocytû mohou b t zv eny v rámci základního onemocnûní, mûïe dojít po podání infliximabu k normalizaci jejich poãtu [7]. Farmakokinetika Farmakokinetika infliximabu je závislá na dávce v rozsahu dávek od 1 do 20 mg/kg. Nebyla pozorována Ïádná akumulace infliximabu pfii podávání 1 mg/kg, resp. 10 mg/kg v 8t denních intervalech. Farmakokinetika infliximabu se v znamnû nemûní po opakovaném podání. PrÛmûrné sérové koncentrace infliximabu po kaïdé ze tfií dávek 10 mg/kg podávan ch v 8t denních intervalech kolísaly mezi 7,9 9,9 mg/l. Pfii podávání dávky 3 mg/kg (obvyklé u RA) v t dnech 0, 2, 6 a dále po 8 t dnech se prûmûrné sérové koncentrace infliximabu na konci 8t denního intervalu pohybovaly okolo 1,5 mg/l [8]. Sérové koncentrace infliximabu nezávisí na souãasném podávání MTX, ale pomaleji klesají. Osm t dnû po poslední z 5 dávek infliximabu 3 mg/kg byly sérové koncentrace 2 mg/l pfii souãasném podávání MTX a < 0,1 mg/l bez souãasného podávání MTX [9]. Klinická odpovûì na infliximab se pfiitom signifikantnû zmen uje pfii poklesu sérové koncentrace infliximabu pod 1,0 mg/l [10]. Je moïné, Ïe souãasné podávání MTX sniïuje imunogenní potenciál infliximabu a tím jeho clearance. Je totiï známo, Ïe v prûbûhu léãby infliximabem mûïe docházet k tvorbû protilátek proti my í Tab. 1 P EHLED MOÎN CH CÍLÒ BIOLOGICKÉ LÉâBY PSORIATICKÉ ARTRITIDY A PSORIÁZY skupina (dle úãinná látka cílová molekula mechanismus úãinku mechanismu úãinku) infliximab a TNF-α chimérická monoklonální protilátka proti TNF-α etanercept a TNF-α solubilní receptor pro TNF-α blokáda cytokinû adalimumab a TNF-α humánní monoklonální protilátka proti TNF-α inhibice aktivace T lymfocytû a kostimulace inhibice proliferace T bunûk a indukce destrukce T bunûk onercept b TNF-α rekombinantní humánní TNF vazebn protein ABX-IL8 c IL-8 monoklonální protilátka proti IL-8 b HuOKT3γ1 (ala-ala) mab proti CD3 (navozuje neodpovídavost Th-1 ly na stimulaci TCR) alefacept b CD2 na rekombinovan humánní fúzovan T lymfocytu protein LFA-3/IgG1; brání interakci CD2/LFA3, brání kostimulaci, indukuje apoptózu T-ly abatacept b CD80 a CD86 fúzovaná molekula CTLA4-Ig; na APC brání interakci CD28/CD80 a CD86 efalizumab b CD11 na rekombinantní monoklonální, T lymfocytu humanizovaná protilátka proti CD11a (souãást LFA-1) brání interakci ICAM-1 na APC, endoteliálních bb na aktivovan ch keratinocytech a CD11a T lymfocytech. Inhibice aktivace T-bunûk a migrace leukocytû. siplizumab c CD2 na rekombinantní humanizovaná T lymfocytu monoklonální protilátka proti CD2 na T ly.; brání interakci CD2/LFA-3, brání kostimulaci, stimuluje protilátkami zprostfiedkovanou l zu pamûèov ch T bunûk galiximab c CD80 rekombinantní monoklonální protilátka proti CD80 (IDEC 114) daclizumab c receptor (p55) rekombinantní humanizovaná pro IL-2 na monoklonální protilátka proti T lymfocytu komponentû receptoru pro IL-2 (anti-cd25); inhibice vazby IL-2, inhibice proliferace T bunûk basiliximab c receptor (p55) rekombinantní chimérická pro IL-2 na monoklonální protilátka proti T lymfocytu komponentû receptoru pro IL-2 (anti-cd25); inhibice vazby IL-2, inhibice proliferace T bunûk denileukin difitox c receptor pro IL-2 fúzovan protein IL-2/fragmenty difterického toxinu; specificky niãí aktivované T buàky anakinra c receptor pro IL-1 antagonista receptoru pro interleukin-1 c T H 1 lymfocyt rekombinantní cytokin IL-10 (T H 2); v voj byl zastaven imunomodulátory oprelvekin c T H 1 lymfocyt rekombinantní cytokin, IL-11 (T H 2) indukuje pfiesmyk T H 1 fenotypu T H 2 c T H 1 lymfocyt rekombinantní cytokin IL-4 (T H 2), indukuje pfiesmyk T H 1 fenotypu T H 2 a látky v souãasnosti/v blízké budoucnosti registrované pro léãbu PsA, b látky, u kter ch studie u PsA probíhají, c látky, které by se mohly stát pfiedmûtem v zkumu u PsA v budoucnosti 262
3 komponentû Fab ãásti imunoglobulinové molekuly infliximabu (HACA). Distribuãní volum (Vd) infliximabu v ustáleném stavu nezávisí na dávce, coï naznaãuje jeho intravaskulární distribuci. TkáÀová distribuce infliximabu (vãetnû intraartikulární) není známa. PrÛmûrná hodnota Vd je mezi 3 a 5 litry. Infliximab není metabolizován prostfiednictvím cytochromu P-450. V dûsledku toho je men í pravdûpodobnost lékov ch interakcí a zmûn metabolismu následkem genetického polymorfismu P-450 [11]. Eliminaãní poloãas infliximabu je 8 9,5 dne pfii dávce 3 mg/kg [12]. Pfii vy ích dávkách (5 20 mg/kg) se pohybuje mezi 8,9 aï 12,3 dne [13]. Vliv závaïné hepatopatie, resp. nefropatie na distribuãní volum a clearance infliximabu není v souãasné dobû znám [12]. Etanercept Etanercept je solubilní dimerick fúzovan protein sestávající ze dvou extracelulárních ãástí humánního receptoru pro TNF-α p75 a konstantní ãásti humánního imunoglobulinu IgG1. Po parenterálním podání váïe voln TNF-α, a tím blokuje jeho interakci s membránov m receptorem, a oslabuje tak jeho prozánûtliv úãinek [14]. Komplex TNF-α etanercept neváïe komplement, nevede proto k l ze buàky [6]. Farmakodynamika V my ím modelu kolagenem indukované artritidy sniïoval etanercept tíïi artritidy, pfii preventivním podání sniïoval i incidenci artritidy [14]. U pacientû s revmatoidní artritidou léãba etanerceptem sniïuje plazmatické hladiny interleukinu-6 (IL-6), interleukinu-1β (IL-1β), metaloproteinázy-1 (MMP-1) a metaloproteinázy-3 (MMP-3), sniïuje poãet CD3+ T bunûk (zralé T lymfocyty), CD38 B lymfocytû (plazmatické buàky), sniïuje poãet periferních mononukleárních bunûk produkujících TNF-α a IL-1 (pouze pfii dlouhodobé léãbû), sniïuje expresi vaskulární adhezivní molekuly-1 (VCAM-1). Tyto zmûny jsou asociovány s klinick m zlep ením artritidy. Nev znamnû sniïuje poãet CD68+ makrofágû a koncentraci intercelulární adhezivní molekuly-1 (ICAM-1) [14]. Farmakokinetika Stfiední hodnota maximální plazmatické koncentrace (c max ) etanerceptu po subkutánním podání jednotlivé dávky 25 mg etanerceptu pacientûm s revmatoidní artritidou je 1,1 mg/l a je jí dosaïeno v prûmûru po 69 hod. U pacientû dlouhodobû léãen ch etanerceptem 2x t dnû 25 mg s.c. je dosaïeno vy ích hodnot c max (2,4 mg/l po 6 mûsících léãby). Biologická dostupnost etanerceptu po s.c. podání 25 mg je 58 %. Etanercept je v organismu iroce distribuován vãetnû kloubní synovie. Jeho distribuãní objem u zdrav ch dobrovolníkû byl 17,5 l. Eliminaãní poloãas etanerceptu je 102 hod. a clearance 0,16 l/hod. po podání jedné subkutánní injekce etanerceptu 25 mg. Po vazbû na TNF-α je komplex TNF-α etanercept metabolizován proteolytick mi enzymy stejn m zpûsobem jako jiné proteiny a je buì recyklován, nebo vylouãen do Ïluãe a/nebo moãe. Farmakokinetika etanerceptu je obdobná i u star ích pacientû ( 65 let) i u dûtí (4 17 let), i kdyï v robce udává lehce sní- Ïenou clearance u dûtí ve vûku 4 8 let [14]. RovnûÏ srdeãní selhání neovlivàuje farmakokinetiku etanerceptu. Vliv funkãní poruchy ledvin a jater na farmakokinetiku etanerceptu není v souãasné dobû znám. U zdrav ch dobrovolníkû nebyly prokázány interakce mezi etanerceptem a warfarinem ãi digoxinem [14]. Adalimumab Adalimumab je rekombinantní humánní monoklonální protilátka IgG1 specifická proti TNF-α. VáÏe se na TNF-α s vysokou afinitou a specificitou, a tím neutralizuje biologickou funkci solubilního i membránovû vázaného TNF-α blokádou interakce s obûma bunûãn mi receptory p55 a p75. NeváÏe se na TNF-β (lymfotoxin). Farmakodynamika Po léãbû adalimumabem dochází u pacientû s revmatoidní artritidou k rychlému poklesu reaktantû akutní fáze-raf (C-reaktivní protein CRP a sedimentace erytrocytû FW) a cytokinu IL-6 proti v chozím hodnotám. RovnûÏ byly pozorovány sníïené hodnoty matrixov ch metaloproteináz (MMP-1 a MMP-3). Pokud je v rámci aktivity onemocnûní pfiítomna anémie typu chronick ch onemocnûní, relativní neutrofilie a lymfopenie, dochází pfii léãbû adalimumabem k normalizaci tûchto hodnot [15]. Farmakokinetika Absorpce a distribuce po subkutánní injekci 40 mg adalimumabu je relativnû pomalá a maximální plazmatické koncentrace dosahuje po 5 dnech. Biologick poloãas adalimumabu je obdobn jako u pfiirozenû se vyskytujícího imunoglobulinu IgG1, tj dnû, prûmûrnû 14 dnû. Koncentrace adalimumabu v synoviální tekutinû se pohybuje v rozmezí % sérové koncentrace. Tvorba protilátek proti adalimumabu byla u pacientû s RA uïívajících souãasnû
4 methotrexat (MTX) nízká (< 1%). Podávání adalimubabu v monoterapii (bez MTX) vedlo k vy í tvorbû protilátek a ke zv ené clearance [15]. Klinické studie s anti TNF-α Infliximab U PsA byly provedeny dvû randomizované kontrolované studie, tfii otevfiené studie a jedna studie u pacientû se spondylartritidou, mezi kter mi byla i ãást pacientû s PsA. Ve dvojitû slepé studii kontrolované placebem (IMPACT) participovalo 102 pacientû s aktivní PsA ( 5 aktivních kloubû), infliximab se podával v dávce 5 mg/kg v t dnu 0, 2, 6 a dále po 8 t dnech po dobu 16 t dnû a pak v otevfieném uspofiádání po dobu celkem 50 t dnû. Pacienti uïívali NSA dle potfieby, steroidy byly povoleny v dávce < 10 mg/den, MTX uïívalo souãasnû 55 % pacientû. V 16. t dnu studie odpovûdûlo dle kritérií ACR 20 celkem 69 % pacientû (vs 8 % v placebové skupinû), dle ACR 50 to bylo 49 % Tab. 2 DEFINICE SELHÁNÍ STANDARDNÍ LÉâBY U PSA (vs 0 %) a dle ACR 70 pak 29 % (vs 0 %) pacientû. Dle PsARC odpovûdûlo 78 % pacientû na léãbu (vs 18 % v placebové skupinû). V 50. t dnu studie odpovûdûlo takto 72 %, 54 %, resp. 35 % pacientû. Poklesem indexu rozsahu a tíïe psoriázy (PASI) o > 75 % odpovûdûlo v 16. t dnu v aktivní skupinû 67 % pacientû a hodnota PASI se sníïila v prûmûru o 82 %. Rentgenová progrese se v aktivní skupinû zpomalila z 5,8 Sharpov ch jednotek/rok na -1,52 jednotek/rok. Placebo bylo podáváno pouze 14 t dnû, pak byla tato skupina léãena infliximabem v otevfieném uspofiádání do 50 t dnû [16, 17]. I zde do lo ke zpomalení rentgenové progrese (z 5,8 na 0,05 Sharpov ch jednotek/rok). Vy etfiení pomocí magnetické rezonance (MRI) ukázalo sníïení vychytávání gadolinia v prûmûru o 82 % [18]. Vût í studie fáze III, IMPACT II (graf 1) mûla podobné v sledky [19]. V obou studiích do lo i k pfiíznivému ovlivnûní entezitid. Infliximab byl dobfie tolerován a bezpeãnostní profil byl podobn jako v jin ch indikacích. FDA upozoràuje Selhání léãby je definováno jako pfietrvávající aktivita onemocnûní pfii adekvátní léãbû NSA, lokálními injekcemi kortikosteroidu nebo chorobu modifikujícími farmaky. 1. Adekvátní léčba NSA je definována jako: léãba dvûma konsekutivnû podávan mi nesteroidními antirevmatiky (NSA) trvající minimálnû 3 mûsíce v maximální doporuãené nebo tolerované protizánûtlivé dávce, pokud není kontraindikace; léãba mûïe trvat ménû neï tfii mûsíce, pokud musela b t pfieru ena pro intoleranci, toxicitu nebo kontraindikace. 2. Adekvátní léčba lokálními aplikacemi kortikosteroidu je definována jako: aplikace minimálnû dvou injekcí kortikosteroidu, pokud není kontraindikována. 3. Adekvátní léčba chorobu modifikujícími farmaky je definována jako: podání minimálnû dvou farmak z této skupiny (sulfasalazin, methotrexat, leflunomid, ciclosporin v monoterapii nebo v kombinaci). Jedním z nich musí b t methotrexat pokud je tolerován. Selhání léãby sulfasalazinem je definováno jako: léãba trvající minimálnû 4 mûsíce v maximální doporuãené (3 g/den) nebo tolerované dávce, pokud nejsou kontraindikace; léãba mûïe trvat ménû neï ãtyfii mûsíce, pokud musela b t pfieru ena pro intoleranci, toxicitu nebo kontraindikace. Selhání léãby methotrexatem je definováno jako: léãba trvající minimálnû 4 mûsíce v maximální doporuãené (25 mg/t den) nebo tolerované dávce, pokud nejsou kontraindikace; léãba mûïe trvat ménû neï ãtyfii mûsíce, pokud musela b t pfieru ena pro intoleranci, toxicitu nebo kontraindikace. Selhání léãby leflunomidem je definováno jako: léãba trvající minimálnû 4 mûsíce v maximální doporuãené (20 mg dennû) nebo tolerované dávce, pokud nejsou kontraindikace; léãba mûïe trvat ménû neï ãtyfii mûsíce, pokud musela b t pfieru ena pro intoleranci, toxicitu nebo kontraindikace. Selhání léãby ciclosporinem je definováno jako: léãba trvající minimálnû ãtyfii mûsíce v maximální doporuãené (5 mg/kg/den) nebo tolerované dávce, pokud nejsou kontraindikace; léãba mûïe trvat ménû neï ãtyfii mûsíce, pokud musela b t pfieru ena pro intoleranci, toxicitu nebo kontraindikace. na moïnost zhor ení u pacientû se stfiednû tûïk m a tûïk m srdeãním selháváním a u pacientû s oportunními infekcemi, jako jsou mj. histoplazmóza, listerióza a pneumocystóza [20]. Antoni a spol. provedli otevfienou studii u 10 pacientû s polyartikulární formou PsA, ktefií pokraãovali v léãbû stabilní dávkou NSA, DMARDs (7 pacientû MTX) a kortikosteroidy. Bylo podáno 5 mg/kg infliximabu i.v. v t dnech 0, 2 a 6 a dále 3 mg po 8 t dnech, celkem 54 t dnû s moïností úpravy dávky dle odpovûdi. V ichni pacienti mûli v 54. t dnu odpovûì dle ACR 50 i PsARC. Osm pacientû nemûlo v 54. t dnu Ïádn otekl ãi bolestiv kloub. Vy etfiení pomocí MRI u 8 pacientû ukázalo sníïení vychytávání gadolinia v prûmûru o 82 %. RovnûÏ psoriáza se v znamnû zlep ila. Nevyskytly se Ïádné váïné NÚ, jeden pacient odstoupil ze studie pro mírnou infuzní reakci [18]. Cauza a spol. léãili 9 pacientû s PsA v otevfiené monocentrické nekontrolované 22t denní studii. Léãba DMARDs byla vysazena. Bylo podáno celkem 5 infuzí infliximabu v dávce 3 mg/kg v t dnech 0, 2, 6, 14 a 22. Odpovûdi dle ACR 20/50/70 bylo dosaïeno u 89/56/22 % pacientû [21]. Feletar a spol. léãili 16 pacientû s refrakterní PsA infliximabem v dávce 5 mg/kg ve 3 základních infuzích (0., 2. a 6. t den) a dále po 6 8 t dnech dle odpovûdi, po dobu 54 t dnû. Konkomitantní léãba methotrexatem byla ponechána u 11 pacientû. Odpovûì na léãbu byla definována jako sníïení poãtu aktivních kloubû (kloub bolestiv v krajní flexi a/nebo otekl ) o 30 % a více a pokles hodnoty indexu rozsahu a tíïe psoriázy (PASI) o 30 % a více. Hodnocení bylo provádûno ve 14., 30. a 54. t dnu. Odpovûì na léãbu dle poãtu aktivních kloubû nebyla signifikantní, poãet otekl ch kloubû v 54. t dnu ale poklesl signifikantnû (p = 0,01). Hodnota indexu PASI se signifikantnû sníïila v t dnu 14 (p = 0,001) a v t dnu 30 (p = 0,002), hodnota CRP klesla signifikantnû v t dnu 30 (p = 0,02). Signifikantnû se sníïila i hodnota funkãního indexu HAQ (p = 0,02 v t dnu 30). Celkem 6 pacientû studii nedokonãilo (2 pacienti pro nedostateãnou úãinnost, 5 pacientû pro komplikace alergická reakce, hepatopatie) [22]. Van den Bosch a spol. léãili 21 pacientû se spondyloartropatií v otevfiené monocentrické 12t denní studii, z nichï 9 mûlo PsA. DMARDs byly vysazeny, steroidy byly ponechány v dávce do 10 mg dennû. Infliximab byl podáván v dávce 5 mg/kg v t dnech 0, 2, 6. Statisticky v znamného rozdílu proti v chozí hodnotû bylo dosaïeno v krátké dobû (cca 3 dny) ve v ech sledovan ch parametrech (globální hodnocení lékafiem GHL, globální hodnocení pacientem GHP, poãet otekl ch kloubû SJC, 264
5 Graf 2 Kloubní odpověď na léčbu PsA etanerceptem dle PsARC, ACR 20 a ACR 50 Graf 3 Kožní odpověď na léčbu etanerceptem dle PASI 75 ve 12. týdnu poãet bolestiv ch kloubû TJC, ranní ztuhlost RZ, axiální ukazatele i intenzita a rozsah psoriázy PASI) a pfietrvával aï do 14. dne, kdy byla podána 2. infuze. Tento efekt pfietrvával je tû 6. t den od podání poslední infuze [23]. Závěr Infliximab je perspektivním vysoce úãinn m lékem psoriatické artritidy, kter pfiíznivû ovlivàuje kloubní syndrom, koïní syndrom i entezitidy a zpomaluje rentgenovou progresi. Podává se ve 3 základních infuzích v dávce 5 mg/kg/den v t dnech 0, 2 a 6 a dále v 8t denních intervalech. I kdyï v proveden ch studiích byla jen ãást pacientû souãasnû léãena methotrexatem, doporuãuje se, podobnû jako u revmatoidní artritidy, podávat infliximab spolu s methotrexatem k zabránûní v voje humánních antichimérick ch protilátek proti infliximabu [24, 25]. V âr je pro tuto diagnózu registrován, kategorizace probíhá. Etanercept Úãinnost etanerceptu jak na kloubní, tak na koïní syndrom u psoriatické artritidy byla pfiedbûïnû ovûfiena v nekontrolovan ch studiích. V první placebem kontrolované studii (fáze II) s 60 pacienty (47 % pacientû v obou skupinách uïívalo souãasnû MTX) s aktivní PsA (> 3 aktivní klouby) trvající 12 t dnû odpovûdûlo na léãbu etanerceptem v dávce 25 mg s.c. 2x t dnû dle indexu PsARC 87 % pacientû ve srovnání s 23 % pacientû ve skupinû placebové, dle indexu ACR 20 odpovûdûlo 73 % pacientû ve srovnání s 13 % ve skupinû placebové. Pokud jde o koïní syndrom, 66 % pacientû odpovûdûlo sníïením indexu PASI o 75 % ve srovnání s Ïádn m pacientem ve skupinû placebové, prûmûrné sníïení PASI ve skupinû etanerceptové bylo 46 %, ve skupinû placebové 9 % (graf 2, 3). Nejãastûj ími neïádoucími úãinky byly infekce horních cest
6 Graf 4 Kloubní odpověď na léčbu PsA adalimumabem dle ACR 20, ACR 50, ACR 70 a PsARC. d chacích, jejichï frekvence se neli ila mezi obûma skupinami a nebyly pfiíãinou pfieru ení studie. Mírné reakce v místû injekce byly ãastûj í v aktivní skupinû [26]. V 6mûsíãním otevfieném prodlouïení této studie do lo ve skupinû placebové k rychlému zlep ení podobnû jako v aktivní skupinû, u pacientû v pûvodní aktivní skupinû do lo k dal ímu zlep ení. Tolerance léãby byla nadále dobrá [27]. Ve studii III. fáze [28] byla odpovûì na léãbu dle ACR 20 v aktivní skupinû u 59 % pacientû (vs 15 % v placebové skupinû), dle ACR 50 u 38 % (vs 4 %) a dle ACR 70 u 11 % (vs 0 %). Dle PsARC odpovûdûlo 71 % pacientû (vs 31 % v placebové skupinû). Pokles klinické aktivity byl doprovázen ústupem edému kostní dfienû. V aktivní skupinû do lo po 1 roce rovnûï k zastavení rentgenové progrese hodnocené dle Sharpova skóre (-0,03 jednotek vs + 1 jednotka v placebové skupinû) [29]. V léãené skupinû do lo i k poklesu poãtu cirkulujících prekurzorû osteoklastû [30]. To naznaãuje mechanismus, kter m etanercept inhibuje kostní destrukci u zánûtliv ch artropatií. Klinické zlep ení bylo doprovázeno i v znamn m zlep ením funkãních ukazatelû, jako jsou HAQ, SF-36 a EuroQol. V uvedené studii do lo ke zlep ení HAQ skóre o 53,6 %. NeÏádoucí úãinky jsou obdobné jako ve studiích u revmatoidní artritidy (RA). ZávaÏné neïádoucí úãinky (NÚ) nebyly v klinick ch studiích ãastûj í neï u placeba. V postmarketingovém sledování se ale vyskytly závaïné NÚ neurologické a infekãní vãetnû tuberkulózy. Incidence malignit se neli í od v skytu u pacientû bez biologické léãby [31]. Graf 5 Kožní odpověď na léčbu adalimumabem dle PASI 50, 75 a 90 Tab. 3 KRITÉRIA AKTIVITY ONEMOCNùNÍ PRO INDIKACI BIOLOGICKÉ LÉâBY PSA 3 oteklé* a 3 bolestivé klouby + 1 kritérium ze 3: sedimentace erytrocytû 25 mm/1hod. nebo CRP 15 mg/l ranní ztuhlost 45 min. globální hodnocení onemocnûní pacientem (GHP) na Likertovû kále (0 4) 2 Definice oteklého kloubu: zmnoïení mûkk ch tkání nad kloubem se zmûnou kontury kloubu. Definice bolestivého kloubu: bolestivost nad kloubní tûrbinou vyvolaná palpací (vyvolávající zbûlení nehtového lûïka vy etfiujícího) nad kloubní tûrbinou nebo napínací bolest. Likertova škála pro GHP: 0 Ïádné onemocnûní; 1 mírné onemocnûní; 2 stfiednû tûïké onemocnûní; 3 tûïké onemocnûní; 4 velmi tûïké onemocnûní. * Ekvivalentem oteklého kloubu je tendovaginitida nebo daktylitida. podle [18] Antoni, et al, 2002 Závěr Etanercept je perspektivním vysoce úãinn m lékem psoriatické artritidy a psoriázy. Pfiíznivû ovlivàuje kloubní i koïní syndrom a zpomaluje rentgenovou progresi. Dávkování je 25 mg s.c. 2x t dnû. Lze ho podávat v monoterapii i v kombinaci s methotrexatem. V âr je pro tuto diagnózu registrován, kategorizace probíhá. Adalimumab U psoriatické artritidy je v souãasné dobû k dispozici jedna pilotní nekontrolovaná studie a jedna randomizovaná dvojitû slepá placebem kontrolovaná studie. V první studii bylo léãeno 15 pacientû s PsA s prûmûrn m vûkem 51 rokû po dobu 12 t dnû v dávce 40 mg po 2 t dnech. Kritériem aktivity byla pfiítomnost > 3 bolestiv ch a > 3 otekl ch kloubû pfii vstupu do studie. Primárním cílem sledování byl po-ãet pacientû odpovídajících na léãbu ve 2. a 12. t dnu dle kritérií ACR 20, 50, 70 a PsARC. Sekundárním ukazatelem byl rentgenov obraz a obraz pfii vy etfiení MRI. Byl sledován v voj funkãního dotazníku HAQ. 266
7 Tab. 4 VYLUâUJÍCÍ KRITÉRIA LÉâBY ANTI TNF-α 1. aktivní infekce 2. pacienti s vysok m rizikem infekce vãetnû: a) chronického bércového vfiedu b) pfiedchozí tuberkulózy (dle místních doporuãení pro léãbu a prevenci) c) septické artritidy v prûbûhu uplynul ch 12 mûsícû d) septick ch komplikací kloubní náhrady v posledních 12 mûsících nebo bez ãasového omezení, pokud endoprotéza zûstává in situ e) perzistující nebo rekurující infekce nitrohrudních orgánû f) dlouhodobû zavedeného moãového katétru 3. tûhotné nebo kojící Ïeny, Ïeny ve fertilním vûku bez efektivní antikoncepce 4. systémov lupus erythematodes nebo roztrou ená skleróza v osobní anamnéze 5. malignita nebo prekanceróza s v jimkou: a) bazocelulárního karcinomu b) malignity diagnostikované a léãené pfied déle neï 10 lety (kde pravdûpodobnost úplného vyléãení je velmi vysoká) podle [9] Thu, et al., 2004 Tab. 5 ODPOVùë DLE ACR 20; 50; 70 (MODIFIKACE PRO 68/66 KLOUBÒ) hlavní parametry poãet bolestiv ch kloubû (z 68 kloubû) poãet otekl ch kloubû (z 66 kloubû) ostatní parametry hodnocení bolesti pacientem na VAS 100 mm globální hodnocení onemocnûní pacientem (GHP) na VAS 100 mm globální hodnocení onemocnûní lékafiem (GHL) na VAS 100 mm funkãní dotazník HAQ hodnocení C-reaktivního proteinu v mg/l hodnocené klouby na hlavû a pfiední stûnû hrudní: TM, ACl, SCl, na HK: ramena, lokty, zápûstí, MCP, PIP klouby, DIP klouby na DK: kyãle, kolena, hlezna, MT, MTP a IP klouby hodnocení odpovûdi zlep ení o 20 % (50; 70 %) obou hlavních parametrû a zlep ení o 20 % (50; 70 %) 3 z pûti ostatních parametrû ACR = American College of Rheumatology, VAS = Vizuální analogová kála, HAQ = Health Assessement Questionnaire, TM = temporomandibulární skloubení, ACl = akromioklavikulární skloubení, SCl = sternoklavikulární skloubení MCP = metakarpofalangeální skloubení, PIP = proximální interfalangeální skloubení DIP = distální interfalangeální skloubení, MT = mediotarzální skloubení, MTP = metatarzofalangeální skloubení IP = interfalangeální skloubení, HK horní konãetiny, DK dolní konãetiny podle [22] Feletar et al., 2004 Dle ACR 20 odpovûdûlo ve 2. t dnu, resp.12. t dnu 42 %, resp. 66 % pacientû, dle ACR 50 to bylo 12 %, resp. 32 %, dle ACR 70 odpovûdûlo na léãbu 6 %, resp. 20 % pacientû, dle PsARC 60 %, resp. 67 % pacientû. Poãet otekl ch kloubû na zaãátku sledování byl 32, ve 2. t dnu 13, ve 12. t dnu 10, poãet bolestiv ch kloubû byl 27, resp. 16, resp. 15 kloubû, sedimentace erytrocytû poklesla z 24 na 18, resp. 12 mm Hg/hod. Globální hodnocení psoriázy pokleslo z pûvodních 3,0 na 2,0, resp. 0,1. Poklesem indexu PASI o 50 % odpovûdûlo ve 2., resp. 12. t dnu 33 %, resp. 44 % pacientû, pokles o 75 % byl zaznamenán u 11 %, resp. 11% a pokles o 90 % byl zaznamenán u 0 %, resp. 11 % pacientû. V chozí hodnota
8 Tab. 6 ODPOVùë DLE PSARC parametry: 1. skóre bolestiv ch kloubû (souãet hodnot v ech 68 hodnocen ch kloubû, grading 0 3) 2. skóre otekl ch kloubû (souãet hodnot v ech 66 hodnocen ch kloubû, grading 0 3) 3. globální hodnocení onemocnûní pacientem (GHP) na Likertovû kále (0 4) 1x t dnû u pacientû se stfiednû tûïkou a tûïkou psoriázou. Ke zlep ení do lo do 2 t dnû od zahájení léãby, k relapsu do lo po dnech po ukonãení léãby u ~ 5 % pacientû se zv ením hodnoty PASI > 125 % v chozí hodnoty (rebound). NÚ se vyskytly po 1. a 2. injekci, dále frekvence rychle ub valo [35]. 4. globální hodnocení onemocnûní lékafiem (GHL) na Likertovû kále (0 4) hodnocení odpovûdi: zlep ení 2/4 parametrû, z nichï jeden musí b t kloubní skóre zhor ení v Ïádném parametru hodnocené klouby: pro bolest: na HK: DIP, PIP, MCP, RC, loket, rameno. Na DK: DIP, PIP, MTP, hlezno, koleno, kyãelní kloub) pro otok: dtto, bez kyãelních kloubû definice zlep ení: pro skóre bolestiv ch kloubû: pokles skóre o 30 % pro skóre otekl ch kloubû: pokles skóre o 30 % pro GHP: zlep ení o 1 jednotku pro GHL: zlep ení o 1 jednotku definice zhor ení: pro skóre bolestiv ch kloubû: zhor ení o 30 % pro skóre otekl ch kloubû: zhor ení o 30 % pro GHP: zhor ení o 1 jednotku pro GHL: zhor ení o 1 jednotku MCP metakarpofalangeální skloubení; PIP proximální interfalangeální skloubení; DIP distální interfalangeální skloubení; MTP metatarzofalangeální skloubení; RC radiokarpální skloubení; HK horní konãetiny, DK dolní konãetiny gradování bolestivých kloubů: 0 Ïádná; 1 mírná (pozitivní odpovûì na dotaz); 2 stfiední (spontánní hlá ení bolesti); 3 silná (pohybová odpovûì) gradování oteklých kloubů: 0 Ïádn otok; 1 mírn (synoviální ztlu tûní, bez ztráty kontury); 2 stfiední (ztráta kontury); 3 siln otok (vyklenutí) gradování GHP (Likertova škála): 0 Ïádné onemocnûní; 1 mírné onemocnûní; 2 stfiednû tûïké onemocnûní; 3 tûïké onemocnûní; 4 velmi tûïké onemocnûní gradování GHL (Likertova škála): 0 Ïádné onemocnûní; 1 mírné onemocnûní; 2 stfiednû tûïké onemocnûní; 3 tûïké onemocnûní; 4 velmi tûïké onemocnûní podle [24] Kremer, 2001 Alefacept Plnû humánní fúzovan protein LFA-3 (lymphocyte function associated antigen) /IgG1, blokuje interakci LFA-3 na T lymfocytech a CD2 na antigen prezentující buàce. Byla provedena jedna otevfiená explorativní studie v trvání 12 t dnû. Klinické sledování se provádûlo dle indexu aktivity DAS (disease activity index) na zaãátku, ve 4., 9., 12. a 16. t dnu. Souãasnû bylo provedeno histologické hodnocení synoviální biopsie z indexového kloubu na zaãátku, ve 4. a 12. t dnu léãby. Na léãbu v 16. t dnu odpovûdûlo 55 % pacientû, v kterékoliv ãásti studie 82 % pacientû. V histologickém obraze do lo k statisticky v znamnému poklesu CD4+; CD8+ T lymfocytû a makrofágû ve 12. t dnu proti v chozí hodnotû [36]. Abatacept (fúzovaná molekula CTLA4-Ig) Blokátor kostimulaãních molekul, blokuje interakci CD80/86 s CD28. Pfiirozen CTLA-4 (cytotoxic T-ly associated Ag-4)- CD152 na T lymfocytech inhibuje interakci mezi CD80/86 a CD28 (kostimulaãní signál). Hybrid CTLA4 s imunoglobulinem inhibuje tuto kostimulaãní vazbu. Ve zvífiecím modelu pfiíznivû ovlivàuje kolagenem indukovanou artritidu, v humánních studiích zlep uje psoriázu o > 50 %. Probíhá studie u revmatoidní artritidy, u psoriatické artritidy je studie v plánu [37]. indexu HAQ poklesla z pûvodních 1,6 % o 38 %, resp. 55 % (graf 4, 5) [32]. Ve dvojitû slepé placebem kontrolované studii fáze III v trvání 24 t dnû odpovûdûlo na léãbu v aktivní skupinû dle ACR 20 celkem 57 % pacientû (vs 15 % v placebové skupinû), dle ACR % (vs 6 %) a dle ACR 70 pak 23 % (vs 1 %). Zlep ením koïního syndromu o 75 % > dle PASI odpovûdûlo v aktivní skupinû 59 % pacientû (vs 1 % v placebové skupinû), zlep ením o 90 % odpovûdûl 42 % (vs 0 %) [33]. Závěr Adalimumab je vysoce úãinn v léãbû psoriatické artritidy i psoriázy v dávce 40 mg po 2 t dnech. Podávání je moïné v monoterapii i v kombinaci s MTX. V souãasné dobû není pro léãbu PsA registrován. Dal í biologické léky ve fázi klinického zkou ení Onercept Rekombinantní humánní protein vázající TNF, jehoï úãinnost u PsA byla prokázána ve dvojitû slepé placebem kontrolované studii fáze II pfii podávání 100 mg v podkoïních injekcích 3x t dnû [34]. Jeho úãinnost je tfieba ovûfiit v dal ích studiích. Efalizumab Protilátka, která se váïe na CD11a podjednotku adhezivní molekuly LFA-1 na T lymfocytu, a interaguje tak s jeho vazbou na ICAM-1 na antigen prezentující buàce, endoteliální buàce, resp. na keratinocytu. DÛsledkem je zábrana aktivace T lymfocytû, pfiípadnû keratinocytû a migrace leukocytû. Byla provedena jedna klinická studie s efalizumabem podávan m subkutánnû HuOKT3γ1 (anti-cd3) HuOKT3γ1 (ala-ala) je protilátka proti CD3 (souãást T bunûãného receptoru TCR), která navozuje neodpovídavost Th-1 lymfocytû na stimulaci T bunûãného receptoru, zatímco odpovídavost Th-2 lymfocytû zûstává zachována (tj. proliferují a exprimují IL-4). U sedmi pacientû s PsA byla provedena jedna otevfiená dávková studie fáze I/II se vzestupnou dávkou huokt3γ1 dennû i.v. po dobu t dnû. Byl sledován poãet otekl ch a bolestiv ch kloubû a bolest na VAS na zaãátku, resp. 30. a 90. den od zaãátku studie. Tfiicát den mûlo 6/7 pacientû 75% sníïení poãtu aktivních kloubû a v prûmûru 63 % zlep- ení na kále bolesti. U 2/6 pacientû pfietrvávalo zlep ení je tû 90. den. Hodnota PASI se ale v znamnû nezmûnila. Îádn pacient s dávkou 1 mg nemûl neïádoucí úãinky [38]. 268
9 Strategie léãby psoriatické artritidy U pacientû s axiálním postiïením nebo s minimálními kloubními projevy vystaãíme zpravidla s léãbou nesteroidními antiflogistiky. U pacientû s oligoartikulárním posti- Ïením s cyklick m intermitentním prûbûhem je vhodn m doplàkem této léãby intraartikulární instilace kortikosteroidu. U polyartikulárních forem nebo u pfietrvávající oligoartikulární aktivity je indikováno zavedení nûkterého z chorobu modifikujících farmak. V pfiípadû neúspûchu je moïno zkusit kombinaãní léãbu farmaky z této skupiny podobnû jako u revmatoidní artritidy, i kdyï pro tuto léãbu u PsA není opora v kontrolovan ch studiích. Pfii pfietrvávající aktivitû a rezistenci na dosavadní léãbu bude v dohledné dobû moïno zvá- Ïit zahájení biologické léãby nûkter m z preparátû blokujících cytokin TNF-α. V sledky dosud proveden ch studií svûdãí o vysoké úãinnosti tûchto preparátû, a to nejen na periferní kloubní syndrom, ale i na axiální syndrom a entezitidy, stejnû jako na koïní projevy psoriázy. K ovûfiení úãinnosti tûchto preparátû u rûzn ch subtypû psoriatické artritidy je je tû zapotfiebí dal ích randomizovan ch kontrolovan ch studií. Hlavním rizikem této léãby jsou infekce, zejména moïná reaktivace tuberkulózy. Podobnû je zapotfiebí identifikace nov ch a valorizace znám ch rizikov ch faktorû závaïného prûbûhu PsA, tak aby bylo moïno urãit pacienty, které je tfieba od poãátku léãit agresivnûji i s pouïitím tak nákladn ch prostfiedkû, jako je biologická léãba. Indikace biologické léãby Podávání biologické léãby u pacientû s PsA bude soustfiedûno do tzv. center biologické léãby, indikace se bude fiídit standardami âeské revmatologické spoleãnosti, které budou publikovány v ãasopise âeská revmatologie. PrÛbûh léãby bude centrálnû sledován a v sledky prûbûïnû vyhodnocovány. Pfiedpokladem pro indikaci biologické léãby je (1) správná diagnóza, (2) selhání dosavadní léãby, (3) pfietrvávající aktivita onemocnûní, (4) nepfiítomnost stavû, které obecnû vyluãují zavedení biologické léãby, a (5) zváïení pomûru rizika a prospûchu takové léãby u konkrétního pacienta. 1. Diagnóza psoriatické artritidy Psoriatická artritida je dle Molla a Wrightové v modifikaci z roku 1973 definována jako artritida sdruïená s psoriázou, obvykle séronegativní [39]. Na rozdíl od revmatoidní artritidy (RA) neexistují dosud mezinárodnû pfiijatá diagnostická, resp. klasifikaãní kritéria PsA. Dûlení PsA na 5 podskupin (asymetrická oligoartikulární, polyartikulární podskupina s pfievaïujícím postiïením DIP kloubû, mutilující a axiální forma) je dosud pouïíváno, i kdyï bylo opakovanû podrobeno kritice. V souãasné dobû probíhají práce na pfiípravû validních a mezinárodnû pfiijateln ch diagnostick ch kritérií psoriatické artritidy [40]. 2. Selhání dosavadní léčby Pro v echny formy PsA je základní farmakologickou léãbou podávání NSA v plné doporuãené a tolerované dávce. Tuto léãbu lze kombinovat s intraartikulárním podáváním kortikosteroidu. U oligoartikulárních forem rezistentních na tuto léãbu a u polyartikulárních forem je základem léãby podávání chorobu modifikujících farmak sulfasalazinu, methotrexatu nebo ciclosporinu v monoterapii nebo v kombinaci. Definice selhání léãby je uvedena v tab Přetrvávající aktivita onemocnění Zhodnocení aktivity onemocnûní u PsA zahrnuje periferní kloubní syndrom, axiální syndrom (tj. sakroiliitidu a/nebo spondylitidu jsou-li pfiítomny) a koïní syndrom. Indikací pro zahájení biologické léãby revmatologem bude vïdy pfiítomnost aktivního periferního kloubního nebo axiálního syndromu. Kritéria aktivity pro periferní kloubní syndrom jsou rozvedena dále. Pokud v klinickém obrazu PsA bude dominovat aktivní axiální syndrom (podobn ankylozující spondylitidû AS), bude se indikace biologické léãby fiídit doporuãeními pro léãbu a sledování ankylozující spondylitidy [41]. Ostatnû pfiítomnost HLA B27 pozitivní sakroiliitidy a spondylitidy podobné AS bez periferní artritidy u pacienta s psoriázou je spí e projevem asociace dvou nezávisl ch onemocnûní (psoriázy a ankylozující spondylitidy) neï projevem ãistû axiální formy psoriatické artritidy [42]. Indikace biologické léãby v pfiítomnosti aktivního koïního syndromu pfii málo aktivním nebo neaktivním periferním kloubním syndromu bude pak záleïitostí dermatologa. Kritéria aktivity periferního kloubního syndromu pro indikaci biologické léãby jsou uvedena v tab. 3. Pro indikaci biologické léãby musí b t tato kritéria splnûna pfii dvou konsekutivních vizitách v rozmezí minimálnû 4 t dny. Indikace léãby anti TNF mûïe vycházet kromû posouzení aktivity onemocnûní i z v sledkû zobrazovacích metod jako rtg (prokazující rychlou progresi) nebo MRI (ukazující známky zánûtu) a z pfiítomnosti klinick ch markerû progrese kloubního po kození. 4. Nepřítomnost stavů, které obecně vylučují zavedení biologické léčby KaÏd lékafi indikující léãbu anti TNF u pacienta s PsA by mûl vylouãit pfiítomnost stavû a onemocnûní uveden ch v tab. 4. Monitorace biologické léãby Pro sledování úãinku léãby je zapotfiebí stanovit (1) kritéria odpovûdi na léãbu, (2) dûvody pro ukonãení léãby, (3) dal í sledované parametry a (4) jednotn systém monitorace neïádoucích úãinkû. 1. Kritéria odpovědi na léčbu Léãba farmaky blokujícími TNF-α by mûla vést k v znamnému klinickému zlep- ení. To by mûlo b t dokumentováno odpovûdí na léãbu dle definovan ch kritérií. Tato odpovûì by mûla b t udrïována i pfii kontrolách v prûbûhu dal í léãby. Léãba pacientû, ktefií neodpovídají na léãbu, by mûla b t ukonãena. Pro hodnocení odpovûdi kloubního syndromu na léãbu jsou k dispozici jednak kritéria dle ACR (tab. 5) [43], jednak kritéria speciálnû vyvinutá Cleggem v roce 1996 pro hodnocení odpovûdi na léãbu u psoriatické artritidy PsARC (Psoriatic arthritis Response Criteria) tab. 6 [44]. Kritéria odpovûdi dle ACR (American College of Rheumatology, dfiíve American Rheumatism Association) byla vyvinuta v roce 1949 pûvodnû pro hodnocení revmatoidní artritidy. Kloubní index dle tûchto kritérií dokumentuje poãet kloubû s palpaãní bolestí kloubní tûrbiny, s napínací bolestí (stress pain) a/nebo s kloubním otokem. Kritéria odpovûdi dle PsARC byla vyvinuta Cleggem a kol. v roce 1996 [44]. Byla vyvinuta pro potfiebu hodnocení odpovûdi v klinick ch farmakologick ch studiích spondylartritid je tû pfied zavedením biologické léãby. Byla pouïita pro hodnocení úãinku sulfasalazinu u psoriatické artritidy [44], ankylozující spondylitidy [45] a reaktivních artritid [46]. Hodnotí se zde 68 kloubû pro bolestivost a 66 kloubû pro otok. Obû kvality se gradují stupnûm 1 3. Do hodnocení jsou zahrnuty distální interfalangeální klouby na horních i dolních konãetinách. V sledek se hodnotí jako kloubní skóre bolestivosti (souãet v ech skóre jednotliv ch kloubû, max. 204) a kloubní skóre otoku (souãet v ech skóre jednotliv ch kloubû, max. 198). Globální hodnocení onemocnûní pacientem a lékafiem se provádí na verbální Likertovû kále (tab. 6). Je nevyfie enou otázkou, kter z obou systémû hodnocení odpovûdi na léãbu psoriatické artritidy je vhodnûj í. Oba obsahují stejn poãet hodnocen ch kloubû, jejich struktura se v ak ponûkud li í. V systému hodnocení dle ACR jsou navíc (proti PsARC) hodnoceny klouby temporomandibulární (TM), akromioklavikulární (ACl) a sternoklavikulární (SCl). V systému PsARC jsou na rozdíl od ACR hodnoceny separátnû PIP a DIP klouby na dolních konãetinách DK (v systému ACR jsou na DK hodnoceny pouze interfalangeální klouby IP, tj. PIP a DIP jako jeden kloub). Oba 269
10 systémy se li í dále ve zpûsobu globálního hodnocení onemocnûní pacientem a lékafiem. ACR pouïívá hodnocení na vizuální analogové kále 100 mm, navíc takto hodnotí separátnû kloubní bolest. PsARC pouïívá ke globálnímu hodnocení Likertovu verbální kálu (0 4) ACR navíc do hodnocení odpovûdi zahrnuje i funkãní dotazník HAQ (Health Assessment Questionnaire) tab. 5, 6. Hodnocení funkčního poškození a disability Health assessment questionnaire (HAQ) byl vyvinut Friesem a kol. pro hodnocení disability pacientû s revmatoidní artritidou [47]. Hodnotí dvû dimenze zdravotního stavu: tûlesnou disabilitu (8 otázek) a bolest. Laboratorní kritéria zánětu Sedimentace erytrocytû (FW) je zv - ena pouze u cca 50 % pacientû s PsA [48]. Na druhé stranû ale byla zv ená sedimentace erytrocytû pfii vstupním vy etfiení asociována s rychlej í progresí kloubního postiïení a s ãasnou mortalitou ve studii Gladmanové a kol. [49]. U axiálního postiïení nekoreluje v e sedimentace ani hodnota CRP s aktivitou onemocnûní hodnocenou dle indexu BASDAI [50]. Hodnota CRP je zahrnuta do hodnocení odpovûdi dle ACR tab. 5 (nikoliv dle PsARC tab. 6). Hodnoty CRP nebo sedimentace erytrocytû jsou zahrnuty do kritérií aktivity pro indikaci biologické léãby (tab. 3). 2. Důvody pro ukončení léčby I. absence odpovûdi na léãbu pfii dvou konsekutivních kontrolách (tj. ve 12. a 24. t dnu soustavné léãby); II. ztráta odpovûdi kdykoliv v prûbûhu léãby pfii dvou konsekutivních kontrolách (tj. po 12 t dnech ); III. pfiítomnost kontraindikací; IV. intolerance. Závûr Biologická léãba psoriatické artritidy pfiiná í zásadní obrat v léãbû tohoto onemocnûní tím spí e, Ïe v echny preparáty, které pfiíznivû ovlivàují kloubní syndrom, zároveà pfiíznivû ovlivàují i koïní syndrom, entezitidy a zejména zpomalují, nebo dokonce zastavují rentgenovou progresi. Na druhé stranû je i u této léãby nutno poãítat s potenciálnû závaïn mi neïádoucími úãinky, kter mi jsou zejména infekce vãetnû specifické, otevfiená zûstává otázka v voje lymfomu. Tûmito neïádoucími vedlej ími úãinky jsme se podrobnû zab vali v pfiedchozím ãísle tohoto ãasopisu [51]. Souãasnû je nutno si uvûdomit, Ïe ani biologická léãba není úãinná u v ech pacientû a Ïe ani biologická léãba neodstraní pfiíãinu onemocnûní, která navíc není do v ech podrobností dosud známa. V blízké budoucnosti lze oãekávat v voj nov ch biologick ch lékû, které zasahují o etáï v e v imunopatogenetickém fietûzci, tj. na úrovnû interakce antigen prezentující buàky s T lymfocytem (tab. 1). Literatura [1] BS, Bunim JJ, Calkins E, et al. ARA nomenclature and classification of arthritis and rheumatism (tentative). Arthritis Rheum 1964; 7: [2] Ettehadi P, Greaves MW, Wallach D, et al. Elevated tumour necrosis factor-alpha (TNF-alpha) biological activity in psoriatic skin lesions. Clin Exp Immunol 1994; 96: [3] Ritchlin C, Haas-Smith SA, Hicks D, et al. Patterns of cytokine production in psoriatic synovium. J Rheumatol 1998; 25: [4] Marzo-Ortega H, McGonagle D, O Connor P, Emery P. Efficacy of etanercept in the treatment of the enthesial pathology in resistant spondylarthropathy: a clinical and magnetic resonance imaging study. Arthritis Rheum 2001; 44: [5] Braun J, Sieper J. anti TNF-alpha: a new dimension in the pharmacotherapy of the spondyloarthropathies? Ann Rheum Dis 2000; 59: [6] Braun J, Sieper J. Role of novel biological therapies in psoriatic arthritis. Therapy review. Biodrugs 2003; 17 (3): [7] Haraoui B. Differentiating the efficacy of the tumour necrosis factor inhibitors. Semin Arthritis Rheum 2005; 34 (Suppl.1): [8] Nestotov I. Clinical pharmacocinetics of TNF antagonists: How do they differ? Semin Arthritis Rheum 2005; 34 (Suppl.1): [9] Thu YW, Graham MA, Menter A, Gottlieb AB. Pharmacokinetics of infliximab (REMICADE ) in patients with severe, plaque-type psoriasis. 62nd. AAD Annual meeting; February 6 11, Washington DC Poster abstracts. J Am Acad Dermatol 2004; 50: poster P. [10] DiNoto D, Mace K, de Ritta R, et al. Pharmacokinetics of infliximab, a chimeric monoclonal antibody specific to tumour necrosis factor: clinical studies in rheumatoid arthritis patients. AAPS annual meeting; November Abstract [11] St. Clair EW, Wagner C, Wang B, Schaible T, Fasanmade A, Kavanaugh AF. Pharmacokinetics of infliximab therapy for rheumatoid arthritis. ACR Annual meeting; November Abstract 970. [12] Gottlieb AB, Masud S, Ramamurthi R, Abdulghani A, Romano P, Chaudhari U, et al. Pharmacodynamic and pharmacokinetic response to anti-tumour necrosis factor d monoclonal antibody (infliximab) treatment of moderate to severe psoriasis vulgaris. J Am Acad Dermatol 2003; 48: [13] Markham A, Lamb HM. Infliximab: A review of its use in the management of rheumatoid arthritis. Drugs 2000; 59: [14] Culy ChR, Keating MG. Etanercept. An updated review of its use in Rheumatoid arthritis, psoriatic arthritis and juvenile arthritis. Drugs 2002; 62 (17): [15] Baker DE. Adalimumab: Human recombinant imunoglobulin G1 anti-tumour necrosis factor monoclonal antibody. Rev Gastroenterol Disord 2004; 4 (4): [16] Antoni C, Kavanaugh A, Kirkham B, Burmester G, Weisman M, Keystone E, et al. The infliximab multinational psoriatic arthritis controlled trial (IMPACT) [abstract]. Arthritis Rheum 2002; 46 (suppl 9): S 985. [17] Antoni C, Kavanaugh A, Gladman DD, et al. The infliximab multinational psoriatic arthritis controlled trial (IMPACT): results of radiographic analyses after one year. Arthritis Rheum 2004; 50: S450. [18] Antoni C, Dechant C, Lorenz HM Wendler J, Olgivie A, Lueftl M, Kalden-Nemeth D, Kalden JR, Manger B. Open-label study of infliximab treatment for psoriatic arthritis: Clinical and magnetic resonance imaging measurements of reduction of inflammation. Arthritis Rheum 2002; 47 (5): [19] Kavanaugh A, Krueger G, de Vlam K, et al. Infliximab improves arthritis and psoriasis in patients with active polyarticular psoriatic arthritis: results of the IMPACT II trial. Ann Rheum Dis 2004; 63 (suppl 1): 402. [20] Remicade [package insert]. Malvern PA. Centocor, Inc; [21] Cauza E, Spak M, Cauza K, Hanusch-Enserer U, Dunky A, Wagner E. Treatment of psoriatic arthritis and psoriasis vulgaris with tumour necrosis factor inhibitor infliximab. Rheumatol Int 2002; 22 (6): [22] Feletar M, Brockbank JE, Schentag CE, Lapp V, Gladman DD. Treatment of refractory psoriatic arthritis with infliximab: a 12 month observational study of 16 patients. Ann Rheum Dis 2004; 63: [23] Van den Bosch F, Kruithof E, Baeten D, De Keyser F, Mielants H, Veys EM. Effects of a loading dose regimen of three infusions of chimeric monoclonal antibody to tumour necrosis alfa (infliximab) in spondyloarthropathy: an open pilot study. Ann Rheum Dis 2000; 59: [24] Kremer JM. Rational use of new and existing disease-modifying agents in rheumatoid arthritis. Ann Intern Med 2001; 134: [25] Maini RN, Breedveld FC, Kalden JR, et al. Therapeutic efficacy of multiple intravenous infusions of anti-tumour necrosis factor alfa monoclonal antibody combined with low dose weekly methotrexate in rheumatoid arthritis. Arthritis Rheum 1998; 41: [26] Mease PJ, Goffe BS, Metz J, Vanderstoep P, Finck B, Burge DJ. Etanercept in the treatment of psoriatic arthritis and psoriasis: A randomized trial. Lancet 2000; 356: [27] Mease PJ, Goffe BS, Metz J, Vanderstoep P, Burge DJ. Enbrel (etanercept) in patiens with psoriatic arthritis and psoriasis [poster]. Presented at: EULAR, June 13 16, 2001; Prague, Czech Republic. [28] Mease PJ, Kivitz A, Burch F, et al. Improvement in disease activity in patients with psoriatic arthritis receiving etanercept. Results of a phase 3 multicenter trial. Arthritis Rheum 2001; 44 (Suppl.): S90. [29] Ory P, Sharp JT, Salonen D, et al. Etanercept (ENBREL) inhibits radiographic progression in patients with psoriatic arthritis. Arthritis Rheum 2002; 46 (Suppl. 442): S196. [30] Ritchlin CT, Haas-Smith SA, Shao T, et al. Etanercept lowers the frequency of circulating osteoclasts precursors (OCP) and improves bone marrow edema in patients with erosive psoriatic arthritis [abstract]. Presented at 67th. Annual Scientific Meeting of the American College of Rheumatology; October 23 28, 2003; Orlando (FL). [31] Enbrel (etanercept) [packege insert]. Thousand Oaks (CA): Amgen Inc. and Wyeth Pharmaceuticals; [32] Ritchlin C, et al. poster SAT0054; EULAR Berlin [33] Mease PJ, et al. Poster presentation 521 (L6), Ann Scientific Meeting ACR, San Antonio
11 [34] Nikas SN, Drosos AA. Onercept Serono. Curr Opin Investig Drugs 2003; 4: [35] Gottlieb A, Kreuger JG, Bright R, et al. Effects of administration of a single dose of humanized monoclonal antibody to CD11a on the immunobiology and clinical activity of psoriasis. J Am Acad Dermatol 2000; 42: [36] Kraan MC, van Kuijk AW, Dinant HJ, et al. Alefacept treatment in psoriatic arthritis: reduction of the effector T cell population in peripheral blood and synovial tissue is associated with improvement of clinical signs of arthritis. Arthritis Rheum 2002; 46: [37] Abrams JR, Lebwohl MG, Guzzo CA, et al. CTLA4Ig-mediated blockade of T-cell co-stimulation in patients with psoriasis vulgaris. J Clin Invest 1999; 9: [38] Utset TO, Auger JA, Peace D, et al. Modified anti- CD3 therapy in psoriatic arthritis: a phase I/II clinical trial. Arthritis Rheum 2001; 44 (9S): S92. [39] Moll JMH, Wright V. Psoriatic arthritis. Semin Arthritis Rheum 1973; 3: [40] Gladman DD, Helliwell P, Mease PJ, Nash P, Ritchlin C, Taylor W. Assessment of patients with psoriatic arthritis. A review of currently available measures. Arthritis Rheum 2004; 50: [41] Pavelka K, tolfa J, Vencovsk J. Doplnûk standardních léãebn ch postupû u ankylozující spondylitidy. âes Revmatol 2004; [42] Suarez-Almazor ME, Russel AS. Sacroiliitis in psoriasis: Relationship to peripheral arthritis and HLA-B27. J Rheumatol 1990; 17: [43] Cooperating Clinics Committee of the American Rheumatism Association. A seven-day variability study of 488 patients with peripheral rheumatoid arthritis. Arthritis Rheum 1965; 8: [44] Clegg DO, Reda DJ, Mejias J, et al. Comparison of sulphasalazine and placebo in the treatment of psoriatic arthritis. Arthritis Rheum 1996; 39: [45] Clegg DO, Reda DJ, Weisman MH, et al. Comparison of sulfasalazine and placebo in the treatment of ankylosing spondylitis. Arthritis Rheum 1996; 39: [46] Clegg DO, Reda DJ, Weisman MH, et al. Comparison of sulfasalazine and placebo in the treatment of reactive arthritis (Reiter s syndrome) Arthritis Rheum 1996; 39: [47] Fries JF, Spitz P, Kraines RG, Holman HH. Measurement of patient outcome in arthritis. Arthritis Rheum 1980; 23: [48] Gladman DD, Cook RJ, Schentag C, Feletar M, Inman R, Hitchon C, et al. The clinical assessment of patients with psoriatic arthritis: results of a validation study of the Spondyloarthritis Research Consortium of Canada [abstract]. Arthritis Rheum 2003; 48 (Suppl. 9): S168. [49] Gladman DD, Farewell VT, Wong K, Husted J. Mortality studies in psoriatic arthritis: results from a single outpatient center. II. Prognostic indicators of death. Arthritis Rheum 1998; 41: [50] Spoorenberg A, van der Heijde D, de Klerk E, Dougados M, de Vlam K, Mielants H, et al. Relative value of erythrocyte sedimentation rate and C-reactive protein in assessment of disease activity in ankylosing spondylitis. J Rheumatol 1999; 26: [51] Pavelka K. Biologická léãba revmatoidní artritidy a dal ích revmatick ch onemocnûní. Remedia 2005; 1:
Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA)
 www.printo.it/pediatric-rheumatology/cz/intro Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA) Verze č 2016 1. CO JE JUVENILNÍ SPONDYLARTRITIDA/ARTRITIDA S ENTEZITIDOU (SpA-ERA) 1.1 Co je to?
www.printo.it/pediatric-rheumatology/cz/intro Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA) Verze č 2016 1. CO JE JUVENILNÍ SPONDYLARTRITIDA/ARTRITIDA S ENTEZITIDOU (SpA-ERA) 1.1 Co je to?
Juvenilní idiopatická artritida
 www.printo.it/pediatric-rheumatology/cz/intro Juvenilní idiopatická artritida Verze č 2016 1. CO JE JIA 1.1 Co je to? Juvenilní idiopatická artritida (JIA) je chronické onemocnění charakterizované přetrvávajícím
www.printo.it/pediatric-rheumatology/cz/intro Juvenilní idiopatická artritida Verze č 2016 1. CO JE JIA 1.1 Co je to? Juvenilní idiopatická artritida (JIA) je chronické onemocnění charakterizované přetrvávajícím
Nově na revmatoidní artritidu? Jiří Vencovský
 Nově na revmatoidní artritidu? Jiří Vencovský Normální kloub Kost Chrupavka Revmatoidní artritida Proliferace synoviálních buněk Infiltrace T a B lymfocyty, PB, Mø, F, NK, DC, EC... Zvýšená propustnost
Nově na revmatoidní artritidu? Jiří Vencovský Normální kloub Kost Chrupavka Revmatoidní artritida Proliferace synoviálních buněk Infiltrace T a B lymfocyty, PB, Mø, F, NK, DC, EC... Zvýšená propustnost
U pacientů, jejichž tělesná hmotnost je vyšší než 100 kg, se dávky přesahující 800 mg/infuzi nedoporučují.
 EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
EDUKAČNÍ MATERIÁLY RoActemra (tocilizumab) Kapesní dávkovací karta pro revmatoidní artritidu Přípravek RoActemra v kombinaci s metotrexátem (MTX) je indikován k léčbě středně těžké až těžké aktivní revmatoidní
Struktura parametrické dokumentace registru ATTRA Diagnóza: Ankylozující spondylitida
 Struktura parametrické dokumentace registru ATTRA Diagnóza: Ankylozující spondylitida Ukončení léčby - Switch - Zahájení dalšího cyklu léčby... 12 Ukončení léčby... 12 Zahájení léčby novým přípravkem...
Struktura parametrické dokumentace registru ATTRA Diagnóza: Ankylozující spondylitida Ukončení léčby - Switch - Zahájení dalšího cyklu léčby... 12 Ukončení léčby... 12 Zahájení léčby novým přípravkem...
Biologická léčba revmatických onemocnění
 Biologická léčba revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha CERGE 2010 infliximab etanercept adalimumab rituximab abatacept Biologická léčba revmatických onemocnění
Biologická léčba revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav Praha CERGE 2010 infliximab etanercept adalimumab rituximab abatacept Biologická léčba revmatických onemocnění
PŘÍLOHY Příloha č. 1: Žádost a vyjádření etické komise UK FTVS
 PŘÍLOHY Příloha č. 1: Žádost a vyjádření etické komise UK FTVS Příloha č. 2: Vzor informovaného souhlasu INFORMOVANÝ SOUHLAS V souladu se Zákonem o péči o zdraví lidu ( 28 odst. 1 zákona č. 372/2011 Sb.)
PŘÍLOHY Příloha č. 1: Žádost a vyjádření etické komise UK FTVS Příloha č. 2: Vzor informovaného souhlasu INFORMOVANÝ SOUHLAS V souladu se Zákonem o péči o zdraví lidu ( 28 odst. 1 zákona č. 372/2011 Sb.)
SOUHRN ÚDAJŮ O PŘÍPRAVKU SIMPONI
 SOUHRN ÚDAJŮ O PŘÍPRAVKU SIMPONI 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
SOUHRN ÚDAJŮ O PŘÍPRAVKU SIMPONI 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
Co byste měli vědět o přípravku
 Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Co byste měli vědět o přípravku Co byste měli vědět o přípravku RoActemra Nalezení té pravé léčby revmatoidní artritidy (RA) je velmi důležité. S dnešními léky na RA najde mnoho lidí úlevu, kterou potřebují.
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp. zn.:sukls167009/2008 a příloha k sp.zn. sukls80895/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety 2. KVALITATIVNÍ
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU STELARA 45 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 45 mg ustekinumabum v 0,5 ml. Ustekinumabum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls157416/2011 1. NÁZEV PŘÍPRAVKU Aspirin 100 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje léčivou látku:
Souhrn údajů o přípravku
 sp.zn. sukls219612/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU BONEFOS koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje: dinatrii clodronas tetrahydricus
sp.zn. sukls219612/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU BONEFOS koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu obsahuje: dinatrii clodronas tetrahydricus
Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida
 Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida Vstupní údaje... 1 Identifikační údaje pacienta... 1 Identifikační údaje centra... 1 Vstupní vyšetření... 2 Vstupní
Struktura parametrické dokumentace registru ATTRA Diagnóza: Juvenilní idiopatická artritida Vstupní údaje... 1 Identifikační údaje pacienta... 1 Identifikační údaje centra... 1 Vstupní vyšetření... 2 Vstupní
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
H. Mann. Revmatologický ústav, Praha. Things we knew, things we did Things we have learnt, things we should do
 H. Mann Revmatologický ústav, Praha Things we knew, things we did Things we have learnt, things we should do Když do mé ambulance přichází nemocný s artritidou, mám chuť utéct zadním vchodem. Sir William
H. Mann Revmatologický ústav, Praha Things we knew, things we did Things we have learnt, things we should do Když do mé ambulance přichází nemocný s artritidou, mám chuť utéct zadním vchodem. Sir William
Struktura parametrické dokumentace registru ATTRA Diagnóza: Psoriatická artritida
 Struktura parametrické dokumentace registru ATTRA Diagnóza: Psoriatická artritida Ukončení léčby - Switch - Zahájení dalšího cyklu léčby... 10 Ukončení léčby... 10 Zahájení léčby novým přípravkem... 10
Struktura parametrické dokumentace registru ATTRA Diagnóza: Psoriatická artritida Ukončení léčby - Switch - Zahájení dalšího cyklu léčby... 10 Ukončení léčby... 10 Zahájení léčby novým přípravkem... 10
Adalimumabum je rekombinantní lidská monoklonální protilátka produkovaná ovariálními buňkami čínských křečků.
 1. NÁZEV PŘÍPRAVKU Humira 40 mg injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněné pero na jedno použití o objemu 0,8 ml obsahuje adalimumabum 40 mg. Adalimumabum
1. NÁZEV PŘÍPRAVKU Humira 40 mg injekční roztok v předplněném peru 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněné pero na jedno použití o objemu 0,8 ml obsahuje adalimumabum 40 mg. Adalimumabum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Souhrn údajů o přípravku
 Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
Příloha č. 3 ke sdělení sp.zn. sukls93024/2010 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Isoprinosine tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: inosinum pranobexum 500 mg v 1 tabletě
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls20675/2011 a příloha ke sp. zn. sukls155771/2011 1. NÁZEV PŘÍPRAVKU LODRONAT 520 potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
Deficit mevalonátkinázy (MKD) (nebo hyper IgD syndrom)
 www.printo.it/pediatric-rheumatology/cz/intro Deficit mevalonátkinázy (MKD) (nebo hyper IgD syndrom) Verze č 2016 1. CO JE MKD? 1.1 Co je to? Deficit mevalonákinázy patří mezi dědičná onemocnění. Jedná
www.printo.it/pediatric-rheumatology/cz/intro Deficit mevalonátkinázy (MKD) (nebo hyper IgD syndrom) Verze č 2016 1. CO JE MKD? 1.1 Co je to? Deficit mevalonákinázy patří mezi dědičná onemocnění. Jedná
*Lidská IgG1κ monoklonální protilátka produkovaná linií hybridomových buněk myší technologií rekombinance DNA.
 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněné injekční stříkačce. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka 0,5 ml obsahuje golimumabum* 50 mg. *Lidská
 www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
www.printo.it/pediatric-rheumatology/cz/intro Terapie Verze č 2016 13. Biologická léčba Nové perspektivy v léčbě se rozvinuly v posledních letech s nástupem tzv. biologických léků. Tento název je používán
Účinnost tocilizumabu v léčbě nemocných s revmatoidní artritidou po selhání léčby blokátory TNFα studie RADIATE
 Účinnost tocilizumabu v léčbě nemocných s revmatoidní artritidou po selhání léčby blokátory TNFα studie RADIATE MUDr. Heřman Mann Revmatologický ústav Praha Otázka: Je léčba tocilizumabem (TCZ) účinná
Účinnost tocilizumabu v léčbě nemocných s revmatoidní artritidou po selhání léčby blokátory TNFα studie RADIATE MUDr. Heřman Mann Revmatologický ústav Praha Otázka: Je léčba tocilizumabem (TCZ) účinná
Rekombinantní lidský keratinocyty stimulující faktor - palifermin ( Kepivance, Amgen )
 Rekombinantní lidský keratinocyty stimulující faktor - palifermin ( Kepivance, Amgen ) Návrh Co - trialu CMG 2006 Palifermin -prevence orální mukositidy MUDr. Evžen Gregora OKH FNKV Praha PALIFERMIN (
Rekombinantní lidský keratinocyty stimulující faktor - palifermin ( Kepivance, Amgen ) Návrh Co - trialu CMG 2006 Palifermin -prevence orální mukositidy MUDr. Evžen Gregora OKH FNKV Praha PALIFERMIN (
INFORMACE PRO PACIENTY
 INFORMACE PRO PACIENTY Technologie prizpusobená ˇ pacientovi technologie od Artrotické zmûny Pfiesné fiezací bloãky Technologie Visionaire Optimálnû usazen implantát O spoleãnosti Smith&Nephew je celosvûtovû
INFORMACE PRO PACIENTY Technologie prizpusobená ˇ pacientovi technologie od Artrotické zmûny Pfiesné fiezací bloãky Technologie Visionaire Optimálnû usazen implantát O spoleãnosti Smith&Nephew je celosvûtovû
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Příloha č.2 k rozhodnutí o změně registrace sp.zn. sukls 145753/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Betaserc 16 tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 16 mg
Juvenilní idiopatická artritida
 www.printo.it/pediatric-rheumatology/cz/intro Juvenilní idiopatická artritida Verze č 2016 3. DIAGNÓZA A TERAPIE 3.1 Jaká laboratorní vyšetření jsou potřeba? Ke stanovení typu JIA a odhalení pacientů s
www.printo.it/pediatric-rheumatology/cz/intro Juvenilní idiopatická artritida Verze č 2016 3. DIAGNÓZA A TERAPIE 3.1 Jaká laboratorní vyšetření jsou potřeba? Ke stanovení typu JIA a odhalení pacientů s
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 ke sdělení sp.zn.sukls38824/2012 1. NÁZEV PŘÍPRAVKU ANASTAR 1 MG Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje anastrozolum
Příloha č. 1 ke sdělení sp.zn.sukls38824/2012 1. NÁZEV PŘÍPRAVKU ANASTAR 1 MG Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje anastrozolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
sp.zn. sukls144430/2014 1. Název přípravku Ebrantil 30 retard Ebrantil 60 retard Tvrdé tobolky s prodlouženým uvolňováním SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. Kvalitativní a kvantitativní složení Jedna tobolka
Vyšetření imunoglobulinů
 Vyšetření imunoglobulinů Celkové mn. Ig elektroforéza bílkovin jako procentuální zastoupení gamafrakce, vyšetřením ke zjištění možného paraproteinu. velmi hrubé vyšetření, odhalení pouze výrazných změn
Vyšetření imunoglobulinů Celkové mn. Ig elektroforéza bílkovin jako procentuální zastoupení gamafrakce, vyšetřením ke zjištění možného paraproteinu. velmi hrubé vyšetření, odhalení pouze výrazných změn
PROGRAM Pracovní verze aktualizace k 30.11.2012 s výhradou dalších změn a úprav
 PROGRAM Pracovní verze aktualizace k 30.11.2012 s výhradou dalších změn a úprav Sekce lékařů 8. ledna 18.00 22.00 Stavba doprovodné výstavy I (Foyer recepce, foyer kongresového sálu) 9. ledna 07.30 11.00
PROGRAM Pracovní verze aktualizace k 30.11.2012 s výhradou dalších změn a úprav Sekce lékařů 8. ledna 18.00 22.00 Stavba doprovodné výstavy I (Foyer recepce, foyer kongresového sálu) 9. ledna 07.30 11.00
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls10679/2012 1. NÁZEV PŘÍPRAVKU THYMOGLOBULINE 5 mg/ml, prášek pro infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Specifická imunitní odpověd. Veřejné zdravotnictví
 Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
Specifická imunitní odpověd Veřejné zdravotnictví MHC molekuly glykoproteiny exprimovány na všech jaderných buňkách (MHC I) nebo jenom na antigen prezentujících buňkách (MHC II) u lidí označovány jako
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 1 ke sdělení sp.zn. sukls238164/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CORVATON retard tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: molsidominum
Příloha č. 1 ke sdělení sp.zn. sukls238164/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CORVATON retard tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: molsidominum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Protinádorová imunita. Jiří Jelínek
 Protinádorová imunita Jiří Jelínek Imunitní systém vs. nádor l imunitní systém je poslední přirozený nástroj organismu jak eliminovat vlastní buňky které se vymkly kontrole l do boje proti nádorovým buňkám
Protinádorová imunita Jiří Jelínek Imunitní systém vs. nádor l imunitní systém je poslední přirozený nástroj organismu jak eliminovat vlastní buňky které se vymkly kontrole l do boje proti nádorovým buňkám
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. *Lidská IgG1κ monoklonální protilátka produkovaná linií hybridomových buněk myší technologií rekombinance DNA.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg. *Lidská IgG1κ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Simponi 50 mg injekční roztok v předplněném peru. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedno předplněné pero 0,5 ml obsahuje golimumabum* 50 mg. *Lidská IgG1κ
Jedna předplněná injekční stříkačka obsahuje immunoglobulinum humanum anti-d 1500 IU (300 mikrogramů).
 sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
sp. zn. sukls262204/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Igamad 1500 IU, injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU VPRIV 200 U prášek pro přípravu infuzního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje 200 jednotek* (U) velaglucerasum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls 212259/2010, sukls212261/2010 a příloha k sp. zn. sukls170374/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ondansetron Arrow 4 mg Ondansetron
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU SOMAVERT 10 mg prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje pegvisomantum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU SOMAVERT 10 mg prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje pegvisomantum
Funkce imunitního systému
 Téma: 22.11.2010 Imunita specifická nespecifická,, humoráln lní a buněč ěčná Mgr. Michaela Karafiátová IMUNITA je soubor vrozených a získaných mechanismů, které zajišťují obranyschopnost (rezistenci) jedince
Téma: 22.11.2010 Imunita specifická nespecifická,, humoráln lní a buněč ěčná Mgr. Michaela Karafiátová IMUNITA je soubor vrozených a získaných mechanismů, které zajišťují obranyschopnost (rezistenci) jedince
Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA)
 https://www.printo.it/pediatric-rheumatology/cz/intro Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1. Jak je onemocnění diagnostikováno? Lékaři stanoví
https://www.printo.it/pediatric-rheumatology/cz/intro Juvenilní spondylartritida/artritida s entezitidou (SPA/ERA) Verze č 2016 2. DIAGNÓZA A LÉČBA 2.1. Jak je onemocnění diagnostikováno? Lékaři stanoví
www.printo.it/pediatric-rheumatology/cz/intro
 www.printo.it/pediatric-rheumatology/cz/intro Candle Verze č 2016 1. CO JE CANDLE 1.1 Co je to? Chronická atypická neutrofilní dermatóza s lipodystrofií a zvýšenou teplotou (CANDLE) patří mezi vzácná dědičná
www.printo.it/pediatric-rheumatology/cz/intro Candle Verze č 2016 1. CO JE CANDLE 1.1 Co je to? Chronická atypická neutrofilní dermatóza s lipodystrofií a zvýšenou teplotou (CANDLE) patří mezi vzácná dědičná
Co přináší biologická léčba nespecifických zánětů střevních. Keil R.
 Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
Co přináší biologická léčba nespecifických zánětů střevních Keil R. Příčiny vzniku nespecifických střevních zánětů Vzniká u geneticky disponovaných osob Je důsledkem abnormální imunitní odpovědi na faktory
Psoriatická artritida novější poznatky o patogenezi, prognóze, hodnocení a terapii
 395 Psoriatická artritida novější poznatky o patogenezi, prognóze, hodnocení a terapii MUDr. Jiří Štolfa Revmatologický ústav, Praha V poslední době nebývale pokročil výzkum v oblasti psoriatické artritidy
395 Psoriatická artritida novější poznatky o patogenezi, prognóze, hodnocení a terapii MUDr. Jiří Štolfa Revmatologický ústav, Praha V poslední době nebývale pokročil výzkum v oblasti psoriatické artritidy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls170515/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Risedronat Mylan 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls170515/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Risedronat Mylan 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU CYSAXAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cyproteroni acetas 100 mg. Pomocné látky: monohydrát laktosy 167,0
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU CYSAXAL 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cyproteroni acetas 100 mg. Pomocné látky: monohydrát laktosy 167,0
Norifaz 35 mg potahované tablety
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls18991/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Norifaz 35 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls52815/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LEVOPRONT sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: levodropropizinum
Intracelulární detekce Foxp3
 Intracelulární detekce Foxp3 Ústav imunologie 2.LFUK a FN Motol Daniela Rožková, Jan Laštovička T regulační lymfocyty (Treg) Jsou definovány funkčně svou schopností potlačovat aktivaci a proliferaci CD4+
Intracelulární detekce Foxp3 Ústav imunologie 2.LFUK a FN Motol Daniela Rožková, Jan Laštovička T regulační lymfocyty (Treg) Jsou definovány funkčně svou schopností potlačovat aktivaci a proliferaci CD4+
Tvrdá tobolka se světle modrým víčkem a světle modrým tělem.
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls127013/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
sp.zn.sukls105812/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin PMCS 5 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Úplný seznam pomocných
Revoluční pomoc pro vaše klouby
 Revoluční pomoc pro vaše klouby 7 hodnotných a účinných látek, které regenerují poškozené klouby Vysoce úãinn produkt se specifickou kombinací 7 látek: v taïek ze zázvoru (Zingiber officinale) + glucosamin
Revoluční pomoc pro vaše klouby 7 hodnotných a účinných látek, které regenerují poškozené klouby Vysoce úãinn produkt se specifickou kombinací 7 látek: v taïek ze zázvoru (Zingiber officinale) + glucosamin
Diagnostika a příznaky mnohočetného myelomu. J.Minařík, V.Ščudla
 Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
Diagnostika a příznaky mnohočetného myelomu J.Minařík, V.Ščudla Mnohočetný myelom Nekontrolované zmnožení nádorově změněných plasmatických buněk v kostní dřeni Mnohočetný = obvykle více oblastí kostní
Golimumab v léčbě psoriatické artritidy obtížné případy z klinické praxe
 Golimumab v léčbě psoriatické artritidy obtížné případy z klinické praxe MUDr. Marta Olejárová, CSc. Revmatologický ústav, Praha Souhrn Olejárová M.. Remedia 2015; 25: 444 448. Psoriatická artritida (PsA)
Golimumab v léčbě psoriatické artritidy obtížné případy z klinické praxe MUDr. Marta Olejárová, CSc. Revmatologický ústav, Praha Souhrn Olejárová M.. Remedia 2015; 25: 444 448. Psoriatická artritida (PsA)
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls167902/2010 a příloha k sp. zn. sukls16927/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Rhophylac 300 mikrogramů/2 ml, injekční roztok
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
SKANÁ imunita. VROZENÁ imunita. kladní znalosti z biochemie, stavby membrán n a fyziologie krve. Prezentace navazuje na základnz
 RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie, PřF UP Olomouc Prezentace navazuje na základnz kladní znalosti z biochemie, stavby membrán n a fyziologie krve Rozšiřuje témata: Proteiny přehled pro fyziologii
RNDr. Ivana Fellnerová, Ph.D. Katedra zoologie, PřF UP Olomouc Prezentace navazuje na základnz kladní znalosti z biochemie, stavby membrán n a fyziologie krve Rozšiřuje témata: Proteiny přehled pro fyziologii
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6044/2010 1. NÁZEV PŘÍPRAVKU Mucosolvan pro dospělé sirup SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 5 ml sirupu obsahuje
Jedna tableta s prodlouženým uvolňováním obsahuje 0,4 mg tamsulosini hydrochloridum, což odpovídá 0,367 mg tamsulosinum.
 sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
sp.zn.sukls48957/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Tamsulosin HCl Teva 0,4 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Resolor 1 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje 1 mg prucalopridum (ve formě prucalopridi
Význam včasné intervence. prof. MUDr. Karel Pavelka, DrSc Revmatologický ústav
 Význam včasné intervence prof. MUDr. Karel Pavelka, DrSc Revmatologický ústav PROČ VČASNÁ INTERVENCE Nemoci pohybového systému (NPS) jsou druhou nejčastější příčinou dočasné pracovní neschopnosti (DPN)
Význam včasné intervence prof. MUDr. Karel Pavelka, DrSc Revmatologický ústav PROČ VČASNÁ INTERVENCE Nemoci pohybového systému (NPS) jsou druhou nejčastější příčinou dočasné pracovní neschopnosti (DPN)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls6046/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucosolvan long effect Tvrdé tobolky s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ
obálka zvût ená 22.9.2005 17:38 Stránka 1 ÎENY &MUÎI v datech ISBN 80-250-1092-9 Vydalo v záfií 2005 KÓD PUBLIKACE: 1415-05
 obálka zvût ená 22.9.2005 17:38 Stránka 1 2005 ÎENY &MUÎI v datech ISBN 80-250-1092-9 Vydalo v záfií 2005 KÓD PUBLIKACE: 1415-05 R_obálka âsú 2005 28.9.2005 23:00 Stránka a ublikace Îeny a muïi v datech
obálka zvût ená 22.9.2005 17:38 Stránka 1 2005 ÎENY &MUÎI v datech ISBN 80-250-1092-9 Vydalo v záfií 2005 KÓD PUBLIKACE: 1415-05 R_obálka âsú 2005 28.9.2005 23:00 Stránka a ublikace Îeny a muïi v datech
Lidský herpesvirus 6 biologie, diagnostika, patogeneze. K.Roubalová Vidia spol.s r.o.
 Lidský herpesvirus 6 biologie, diagnostika, patogeneze K.Roubalová Vidia spol.s r.o. Zařazení, genetika HHV6B vs. HHV6A: 75% shoda genů, 62% shoda proteinů Epidemiologie Dospělá populace promořena z >
Lidský herpesvirus 6 biologie, diagnostika, patogeneze K.Roubalová Vidia spol.s r.o. Zařazení, genetika HHV6B vs. HHV6A: 75% shoda genů, 62% shoda proteinů Epidemiologie Dospělá populace promořena z >
Enzymy v diagnostice Enzymy v plazm Bun né enzymy a sekre ní enzymy iny zvýšené aktivity bun ných enzym v plazm asový pr h nár
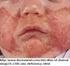 Enzymy v diagnostice Enzymy v plazmě Enzymy nalézané v plazmě lze rozdělit do dvou typů. Jsou to jednak enzymy normálně přítomné v plazmě a mající zde svou úlohu (např. enzymy kaskády krevního srážení
Enzymy v diagnostice Enzymy v plazmě Enzymy nalézané v plazmě lze rozdělit do dvou typů. Jsou to jednak enzymy normálně přítomné v plazmě a mající zde svou úlohu (např. enzymy kaskády krevního srážení
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
Farmakoterapie. Biologická léčba revmatoidní artritidy a dalších revmatických onemocnění
 15 1 2005 Biologická léčba revmatoidní artritidy a dalších revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav, Praha Souhrn Pavelka K. Biologická léčba revmatoidní artritidy
15 1 2005 Biologická léčba revmatoidní artritidy a dalších revmatických onemocnění Prof. MUDr. Karel Pavelka, DrSc. Revmatologický ústav, Praha Souhrn Pavelka K. Biologická léčba revmatoidní artritidy
SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ. Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Angizidine 35 mg, tablety s řízeným uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Trimetazidini dihydrochloridum 35 mg v jedné tabletě s řízeným uvolňováním.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
sp.zn.sukls204047/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VOLTAREN FORTE 2,32% gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g přípravku Voltaren Forte 2,32% obsahuje diclofenacum diethylaminum
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009
 Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.3 k rozhodnutí o registraci sp.zn. sukls48796/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLUCOPHAGE XR 750 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls102421/2010 a příloha k sp. zn. sukls102423/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Boostrix Polio inj. stříkačka Boostrix Polio inj.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1 NÁZEV PŘÍPRAVKU Orfadin 2 mg tvrdé tobolky. 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 2 mg nitisinonu. Pomocné látky viz bod 6.1. 3 LÉKOVÁ FORMA
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1 NÁZEV PŘÍPRAVKU Orfadin 2 mg tvrdé tobolky. 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje 2 mg nitisinonu. Pomocné látky viz bod 6.1. 3 LÉKOVÁ FORMA
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Sp.zn.sukls113275/2013, sukls113277/2013, sukls113278/2013, sukls113279/2013 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vitamin D 3 Radaydrug 800 IU potahované tablety Vitamin D 3 Radaydrug 1 000 IU potahované
Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat.
 sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls88228/2014 Příbalová informace: Informace pro uživatele BONEFOS koncentrát pro infuzní roztok (Dinatrii clodronas) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o změně registrace sp. zn. sukls159867/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rismyl 35 mg potahované tablety natrii risedronas 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o změně registrace sp. zn. sukls159867/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Rismyl 35 mg potahované tablety natrii risedronas 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok
 sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
sp.zn.sukls103802/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ANDROCUR DEPOT 300 mg, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule o obsahu 3 ml obsahuje cyproteroni acetas
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls59521/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finasterid Orion 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje finasteridum 5 mg. Pomocná
Sp.zn.sukls59521/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Finasterid Orion 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje finasteridum 5 mg. Pomocná
SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009
![SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SCHVÁLENO] STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I. Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009](/thumbs/29/13769956.jpg) Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I SCHVÁLENO] 1. NÁZEV PŘÍPRAVKU Braunovidon gáza s mastí Impregnované
Příloha č.3 k rozhodnutí o prodloužení registrace sp.zn. suk1s22527/2008 5-08- 2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU STÁTNÍ ÚSTAV PRO KONTROLU LEČIV I SCHVÁLENO] 1. NÁZEV PŘÍPRAVKU Braunovidon gáza s mastí Impregnované
artritida a systémové vaskulitidy [6].
![artritida a systémové vaskulitidy [6]. artritida a systémové vaskulitidy [6].](/thumbs/36/17333575.jpg) Prof. MUDr. Karel Pavelka, DrSc. Revmatologick ústav, Praha Souhrn Pavelka K. Leflunomidum. Remedia 2005; 15: 338 344. Leflunomid patří mezi tzv. chorobu modifikující léky revmatoidní artritidy (DMARDs).
Prof. MUDr. Karel Pavelka, DrSc. Revmatologick ústav, Praha Souhrn Pavelka K. Leflunomidum. Remedia 2005; 15: 338 344. Leflunomid patří mezi tzv. chorobu modifikující léky revmatoidní artritidy (DMARDs).
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum
 sp.zn.sukls153805/2014 Souhrn údajů o přípravku 1. Název přípravku Acylcoffin 2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum Coffeinum Pomocné látky viz 6.1. 450 mg 50 mg
sp.zn.sukls153805/2014 Souhrn údajů o přípravku 1. Název přípravku Acylcoffin 2. Kvalitativní a kvantitativní složení Léčivé látky: Acidum acetylsalicylicum Coffeinum Pomocné látky viz 6.1. 450 mg 50 mg
XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY
 NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
NÁDORY PROSTATY 63 XOFIGO (RADIUM-223 DICHLORID) V LÉČBĚ METASTATICKÉHO KASTRAČNĚ REZISTENTNÍHO KARCINOMU PROSTATY Kolektiv autorů Úvod Léčivý přípravek (radium-223 dichlorid) byl 13. listopadu 2013 schválen
Děti a mladiství Pro podávání přípravku Urorec u dětí a mladistvých neexistuje žádná relevantní indikace.
 1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
1. NÁZEV PŘÍPRAVKU Urorec 4 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 4 mg silodosinum. Úplný seznam pomocných látek viz bod 6.1. 3. LÉKOVÁ FORMA Tvrdá tobolka.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DELESIT 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum5 mg. Pomocná látka se známým účinkem:
