Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.:sukls9703/2007
|
|
|
- Rudolf Kovář
- před 10 lety
- Počet zobrazení:
Transkript
1 Příloha č. 2 k rozhodnutí o prodloužení registrace sp. zn.:sukls9703/2007 Informace pro použití, čtěte pozorně! ACTILYSE Prášek pro přípravu injekčního a infuzního roztoku s rozpouštědlem. Složení 1 lahvička obsahuje: Léčivá látka: Alteplasum 10 nebo 20 nebo 50 mg Pomocné látky: Prášek k přípravě roztoku: Arginin, kyselina fosforečná 85%, polysorbát 80 1 lahvička s rozpouštědlem obsahuje: Voda na injekci 10 nebo 20 nebo 50 ml Indikační skupina Antikoagulancia (fibrinolytika) Charakteristika Léčivá látka alteplasa je glykoprotein, který aktivuje plazminogen přímo na plazmin. Při nitrožilním podání zůstává v krevním oběhu alteplasa relativně inaktivní. Po vazbě na fibrin je však aktivována, indukuje přeměnu plazminogenu na plazmin, mající za následek rozpuštění fibrinové sraženiny. Systémový účinek na součásti koagulačního systému krve je malý. Farmakokinetické údaje Alteplasa je rychle odstraňována z cirkulující krve a metabolizována hlavně v játrech (plazmatická clearance ml/min.). Plazmatický poločas T 1/2 alfa je 4 5 minut. To znamená, že po 20 minutách je v plazmě přítomno méně než 10% počátečního množství přípravku. Pro druhou, pomalejší fázi eliminace byl naměřen beta-poločas okolo 40 minut. Indikace ACTILYSE se používá: Při trombolytické léčbě akutního infarktu myokardu pro pacienty s infarktem myokardu, u kterých lze léčbu zahájit do 6 hodin od vzniku prvních příznaků (zrychlený dávkovací režim) nebo pro pacienty, u kterých lze léčbu zahájit mezi 6 12 hodinami od vzniku prvních příznaků (3hodinový dávkovací režim). Při trombolytické terapii akutní masivní plicní embolie doprovázené porušenou hemodynamickou stabilitou. Pokud stav dovoluje, je vždy vhodné diagnózu ověřit objektivními metodami, t.j. angiografií nebo neinvazivními metodami, např. plicní scintigrafií. Při fibrinolytické léčbě akutních ischemických centrálních mozkových příhod (CMP) je léčbu nutno zahájit do 3 hodin od vzniku příznaků ischemické centrální mozkové příhody a po předchozím vyloučení intrakraniálního krvácení vhodnou zobrazovací metodou. Kontraindikace ACTILYSE se nesmí podat pacientům se známou přecitlivělostí na léčivou nebo některou z pomocných látek. ACTILYSE není určena k léčbě CMP u dětí a dospívajících do 18 let a u dospělých nad 80 let věku. ACTILYSE se nesmí podávat v případech jako: známá hemorhagická diatéza; při podávání perorálních antikoagulačních přípravků, např. warfarinu; 1/7
2 manifestní nebo nedávné silné nebo nebezpečné krvácení; v minulosti prodělané intrakraniální krvácení nebo při podezření na něj; podezření na subarachnoidální krvácení nebo stavy po subarachnoidálním krvácení z aneurysmatu; postižení CNS v anamnéze (např. tumor, aneurysma, chirurgický intrakraniální nebo spinální výkon); nedávná (méně než 10 dnů) traumatická zevní srdeční masáž, porod, punkce velkých, manuálně nekomprimovatelných cév (např. punkce v. subclavia a v. jugularis); těžká nekontrolovaná arteriální hypertenze; bakteriální endokarditida, perikarditida; akutní pankreatitida; prokázaná gastroduodenální vředová choroba v posledních 3 měsících, jícnové varixy, tepenná aneurysmata, tepenné/žilní malformace; nádor se zvýšeným rizikem krvácení; závažné jaterní onemocnění včetně jaterního selhání, cirhózy, portální hypertenze (jícnové varixy) a aktivní hepatitidy; velký chirurgický výkon nebo významné trauma v posledních 3 měsících. Další kontraindikace pro akutní infarkt myokardu CMP prodělaná v minulosti Další kontraindikace pro akutní plicní embolii CMP prodělaná v minulosti Další kontraindikace pro akutní ischemickou CMP příznaky ischemické ataky, které započaly před více než 3 hodinami nebo jestliže doba začátku nástupu příznaků není známa; neurologický deficit menšího rozsahu nebo rychle se zlepšující příznaky před začátkem infuze; závažná CMP vyhodnocená klinicky (např. NIHSS25) a/nebo pomocí příslušné zobrazovací techniky; epileptický záchvat na počátku CMP; prokázané intrakraniální krvácení na CT snímku; příznaky naznačující subarachnoidální krvácení, dokonce i v případě, že CT snímek je v normě; podávání heparinu během předchozích 48 hodin a tromboplastinový čas převyšující horní hranici normálních laboratorních hodnot; předchozí CMP v anamnéze a současně se vyskytující diabetes; nedávná CMP během posledních 3 měsíců; počet krevních destiček pod /mm 3 ; systolický krevní tlak (TK) 185 nebo diastolický TK 110 mm Hg, nebo útočná léčba (medikace IV) nezbytná k redukci krevního tlaku (TK) k těmto hodnotám; krevní glukóza 50 nebo 400 mg/100 ml. Při podávání ACTILYSE v těhotenství a v období kojení se musí pečlivě zvážit pozitivní účinek léčby oproti možným rizikům. Nežádoucí účinky Frekvence nežádoucích účinků je popsána pomocí vyjadřování frekvence podle MedDRA*. *Vyjadřování frekvence podle MedDRA: velmi časté > 1/10 časté > 1/100 a 1/10 méně časté > 1/1 000 a 1/100 vzácné > 1/ a 1/1 000 velmi vzácené 1/ včetně jednotlivých hlášených případů 2/7
3 S výjimkou intrakraniálního krvácení jako nežádoucího účinku při indikaci CMP a reperfuzní arytmie při indikaci infarkt myokardu není žádný medicínský důvod předpokládat, že kvalitativní a kvantitativní profil nežádoucích účinků přípravku Actilyse při indikaci plicní embolie a CMP bude rozdílný od profilu při indikaci infarkt myokardu. Krvácení Nejčastějším nežádoucím účinkem při podávání přípravku Actilyse je krvácení vedoucí ke snížení hodnot hematokritu a/nebo hemoglobinu: velmi časté: krvácení v místě injekce nebo poškozených krevních cév (např. hematom) časté: - symptomatické intracerebrální krvácení při léčbě CMP (až 10 % pacientů bez zvýšení celkové mortality nebo morbidity), - gingivální nebo genitourinární krvácení - krevní transfuze (nezbytná) - intracerebrální krvácení při léčbě akutního infarktu myokardu a akutní plicní embolie, - gastrointestinální krvácení zahrnující hematemezu, melénu, - hemoperikard, retroperitoneální krvácení, epistaxe, hemoptýza, ekchymóza vzácné: krvácení do parenchymatózních orgánů velmi vzácné: krvácení do sítnice u pacientů s diabetickou retinopatií, oční krvácení Smrt a trvalá invalidita byly hlášeny u pacientů, kteří prodělali CMP (včetně intrakraniálního krvácení) a jiné závažné příhody spojené s krvácením. Pokud se objeví potenciálně nebezpečné krvácení, zejména mozkové krvácení, musí být fibrinolytická terapie přerušena. Obecně ale není nutné nahrazovat koagulační faktory z důvodu krátkého poločasu a minimálního účinku na systémové koagulační faktory. Většina pacientů, u kterých vznikne krvácení, může být léčena přerušením trombolytické a antikoagulační léčby, doplněním objemu krve a manuální kompresí krvácejících cév. Pokud byl podáván heparin během 4 hodin před začátkem krvácení, je třeba zvážit podání protaminu. U menšiny pacientů, u kterých tato opatření nejsou dostatečná, je třeba rozhodnout o použití transfuzních přípravků. Transfuze kryoprecipitátu, čerstvé mražené plazmy a krevních destiček je třeba zvážit po klinickém a laboratorním přehodnocení situace po jejich každém podání. Je vhodné dosáhnout cílové hladiny fibrinogenu 1 g/l infuzí kryoprecipitátu. Poslední možností je užití antifibrinolytik. Poruchy imunitního systému hypersenzitivní reakce / anafylaktoidní reakce (např. alergické reakce zahrnující kožní vyrážku, kopřivku, bronchospasmus, angioedém, hypotenzi, šok nebo jiné symptomy spojené s alergickými reakcemi) velmi vzácné: závažná anafylaxe Ve vzácných případech a v nízkých titrech byla zjištěna přechodná tvorba protilátek proti přípravku Actilyse, ale klinický význam tohoto zjištění nebyl stanoven. Poruchy nervového systému velmi vzácné: příhody mající vztah k nervovému systému (např. epileptický záchvat, křeče, afázie, porucha řeči, delirium, akutní mozkový syndrom, vzrušení, zmatenost, deprese, psychóza) často spojené se současnými ischemickými nebo hemoragickými cerebrovaskulárními příhodami Srdeční poruchy Jako u jiných trombolytických látek byly hlášeny následující příhody jako následky infarktu myokardu a/nebo trombolytické léčby. velmi časté: rekurentní ischemie/angina, hypotenze a srdeční selhání/plicní edém 3/7
4 časté: reperfuzní arytmie (např. AV block, fibrilace síní/flutter, ventrikulární tachykardie/fibrilace, elektromechanická disociace [EMD]), zástava srdce, kardiogenní šok a reinfarkt mitrální regurgitace, plicní embolie, jiná systémová embolie/cerebrální embolie, ventrikulární septální defekt Tyto srdeční příhody mohou být život ohrožující a mohou vést ke smrti. Cévní poruchy vzácné: trombotická embolizace, která může vést k odpovídajícím důsledkům v postižených orgánech embolizace krystalů cholesterolu, která může vést k odpovídajícím důsledkům v postižených orgánech Gastrointestinální poruchy vzácné: nauzea, zvracení Abnormální klinické a laboratorní nálezy nezařazené jinde velmi časté: pokles krevního tlaku časté: zvýšená tělesná teplota Interakce Riziko krvácení může být zvýšeno při současném podávání kumarinových derivátů, perorálních antikoagulancií, inhibitorů agregace krevních destiček, nefrakcionovaného heparinu nebo nízkomolekulárního heparinu a ostatních přípravků ovlivňujících krevní srážlivost (před nebo během prvních 24 hodin po léčbě přípravkem ACTILYSE). Současná léčba ACE inhibitory může zvyšovat riziko vzniku anafylaktoidních reakcí, v případech popisujících tyto reakce je relativně větší podíl pacientů současně užívajících ACE inhibitory. Dávkování a způsob použití ACTILYSE by měla být podávána co nejdříve po nástupu příznaků. Infarkt myokardu a) 90minutový (zrychlený) dávkovací režim pro pacienty s infarktem myokardu, u nichž lze léčbu zahájit do 6 hodin od vzniku prvních příznaků: Koncentrace alteplasy 15 mg jako intravenózní bolus 15 ml 7,5 ml 50 mg v infuzi během 30 minut 50 ml 25 ml následná infuze 35 mg během 60 minut do maximální dávky 100 mg 35 ml 17,5 ml U osob s tělesnou hmotností (t.h.) do 65 kg musí být dávka upravena dle následující tabulky: Koncentrace alteplasy 15 mg jako intravenózní bolus 15 ml 7,5 ml 0,75 mg/kg t.h. v infuzi během 30 minut (maximálně 50 mg) 0,75 ml/kg t. h. 0,375 ml/kg t. h. následná infuze 0,5 mg/kg t. h. během 60 minut (maximálně 35 mg) 0,5 ml/kg t. h. 0,25 ml/kg t. h. b) Dávkovací režim trvající 3 hodiny pro pacienty, u nichž lze léčbu zahájit za 6-12 hodin od vzniku příznaků: 4/7
5 Koncentrace alteplasy 10 mg jako intravenózní bolus 10 ml 5 ml 50 mg v infuzi během první hodiny 50 ml 25 ml následná infuze 10 mg během dalších 30 minut až do celkové maximální dávky 100 mg během 3 hodin 10 ml/30 min 5 ml/30 min U osob s tělesnou hmotností do 65 kg nesmí celková dávka přesáhnout 1,5 mg/kg. Maximální dávka alteplasy je 100 mg. Pomocná terapie: Podání kyseliny acetylsalicylové by mělo být zahájeno co nejdříve po začátku příznaků s pokračováním po dobu prvních měsíců po infarktu myokardu. Doporučená dávka je mg/den. Současně by měl být podáván heparin, a to po dobu přinejmenším 24 hodin či déle (nejméně 48 hodin ve zrychleném dávkovacím režimu). Na počátku se podává jednotek heparinu jako i.v. bolus a pokračuje se nitrožilní infuzí v dávce jednotek/hod, upravenou podle výsledků aptt (1,5 2,5 násobek výchozí hodnoty). Plicní embolie Celková dávka 100 mg by měla být podána během 2 hodin. Nejlepší výsledky jsou dosahovány při následujícím režimu dávkování: 10 mg jako intravenózní bolus během 1 2 minut následně 90 mg v nitrožilní infuzi během 2 hodin Koncentrace alteplasy 10 ml 5 ml 90 ml 45 ml U pacientů do 65 kg tělesné hmotnosti nesmí celková dávka přesáhnout 1,5 mg/kg. Pomocná terapie: Podávání heparinu je zahajováno (nebo opakovaně zahajováno), dosáhnou-li hodnoty aptt po aplikaci přípravku ACTILYSE méně než dvojnásobku horní hranice normálu. Infuze musí být upravena podle výsledků aptt na 1,5 2,5 násobek výchozí hranice. Akutní ischemická cévní mozková příhoda (dále CMP) Léčba musí být prováděna lékařem, neurologem - specialistou. Doporučená dávka je 0,9 mg alteplasy /kg tělesné hmotnosti (max. 90 mg) podaná v intravenózní infuzi během 60 minut, přičemž 10% celkového množství je podáno jako iniciální intravenózní bolus. ACTILYSE musí být podána do 3 hodin od začátku příznaků. Pomocná terapie: Bezpečnost a účinnost tohoto režimu se současným podáním heparinu a kyseliny acetylsalicylové během prvních 24 hodin po vzniku prvních příznaků nebyla dostatečně hodnocena. V průběhu prvních 24 hodin po skončení léčby přípravkem ACTILYSE nesmí být podána kyselina acetylsalicylová nebo intravenózně heparin. Pokud je podání heparinu nutné v jiné indikaci (např. jako prevence hluboké žilní trombózy), nesmí jeho dávka, podávaná subkutánně, překročit jednotek/den. Způsob podávání Za aseptických podmínek se obsah lahvičky ACTILYSE (10, 20 nebo 50 mg) rozpustí ve vodě na injekci dle následující tabulky tak, aby bylo dosaženo výsledné koncentrace 1 mg alteplasy/ml nebo 2 mg alteplasy/ml: 5/7
6 K přeplnění vody na injekci do lahvičky s lyofilizátem na konečnou koncentraci 1mg alteplasy/ml je používána přeplňovací kanyla, která je součástí balení přípravku ACTILYSE 20 mg a 50 mg. V případě rekonstituce na konečnou koncentraci 2 mg alteplasy/ml a v případě Actilyse 10 mg se musí použít injekční stříkačka. Actilyse 10 mg 20 mg 50 mg Množství vody na injekci, které je nutno doplnit k lyofilizátu: Výsledná koncentrace: (a) 1 mg alteplasy/ml (ml) (b) 2 mg alteplasy/ml (ml) Rekonstituovaný roztok by měl být poté podáván intravenózně. Tento roztok může být také dále naředěn sterilním fyziologickým roztokem (0,9%) až do minimální koncentrace 0,2 mg/ml. Roztok může být dále ředěn sterilním fyziologickým roztokem (0,9%) v poměru až 1:5. K ředění nesmí být použita voda na injekce nebo roztoky obsahující karbohydráty (např. glukosu). ACTILYSE se nesmí mísit s jinými léky ve stejné infuzní láhvi a nesmí být s jinými léky podávána stejným katétrem (ani s heparinem). Rekonstituovaný přípravek je čirý a bezbarvý až bledě žlutý roztok. Před podáním musí být vizuálně zkontrolována nepřítomnost částic a barva roztoku. Rekonstituovaný roztok je jen pro jedno použití. Nespotřebovaný roztok musí být zlikvidován. Upozornění Jako u všech trombolytik musí být předem zvážen terapeutický prospěch oproti možnému riziku, zejména v případech: nedávných menších traumat, jako jsou biopsie, punkce větších cév, nitrosvalové injekce a srdeční masáž při resuscitaci, ve všech případech, kde je zvýšeno riziko krvácení. Je třeba se vyhnout použití rigidních katétrů. Zvláštní upozornění pro akutní infarkt myokardu a akutní plicní embolii Nesmí se podávat dávky převyšující 100 mg alteplasy, protože mohou být spojeny se zvýšeným výskytem intrakraniálního krvácení. Musí být zajištěn výše uvedený způsob podání. V případě anafylaktické reakce nebo nebezpečného krvácení, je nutno podávání ACTILYSE přerušit a zahájit příslušnou léčbu. Jako u jiných trombolytik musí být zvážen očekávaný terapeutický prospěch ve srovnání s možným rizikem, zvláště v případech pacientů se systolickým krevním tlakem 160 mm Hg. Zvláštní upozornění/podmínky u CMP v případech se sníženým poměrem terapeutický přínos/riziko Ve srovnání s ostatními indikacemi mají pacienti s CMP léčení přípravkem ACTILYSE zvýšené riziko intrakraniálního krvácení, protože krvácení se vyskytuje převážně v infarzované oblasti. Toto platí zejména v následujících případech: - obecně všechny stavy s vyšším rizikem krvácení; - malá, asymptomatická aneurysmata mozkových cév; - pacienti předem léčení ASA mohou mít vyšší riziko intrakraniálního krvácení, zvláště pokud je v léčbě přípravkem ACTILYSE časová prodleva. V případech hrozícího mozkového krvácení nesmí být podáváno více než 0,9 mg alteplasy/kg t.h. (max. 90 mg). Léčba pacientů s CMP by měla být započata nejpozději do 3 hodin po nástupu příznaků, protože poměr terapeutického přínosu oproti možným rizikům je založen na následujícím: - kladný léčebný účinek klesá s časem; - u pacientů s předešlou léčbou ASA je částečně zvýšena úmrtnost; - riziko se zvyšuje vzhledem symptomatickému krvácení. Monitorování krevního tlaku (TK) během léčebné aplikace a až 24 hodin dále poté se zdá být oprávněné; i.v. antihypertenzní léčba je také doporučena pro systolický TK180 mm Hg nebo diastolický TK105 mm Hg. 6/7
7 Předávkování Při předávkování se může vyskytnout krvácení. Při obzvlášť těžkém a trvalém krvácení je doporučeno podání plazmy nebo čerstvé krve, případně i syntetického antifibrinolytika. Uchovávání Uchovávejte při teplotě do 25 C, uchovávejte vnitřní obal v krabičce, aby byl přípravek chráněn před světlem. Chemická a fyzikální stabilita po rozpuštění přípravku je 24 hodin při teplotě 2 8 C a 8 hodin při teplotě do 25 C. Varování Nepoužívejte po uplynutí doby použitelnosti uvedené na obalu. Uchovávejte mimo dosah a dohled dětí. Balení 10 mg 1 lahvička s 467 mg prášku pro přípravu injekčního a infúzního roztoku 1 lahvička s10 ml vody na injekci 20 mg 1 lahvička s 933 mg prášku pro přípravu injekčního a infúzního roztoku 1 lahvička s 20 ml vody na injekci přeplňovací kanyla 50 mg 1 lahvička s 2333 mg prášku pro přípravu injekčního a infúzního roztoku 1 lahvička s 50 ml vody na injekci přeplňovací kanyla Datum poslední revize Výrobce Boehringer Ingelheim Pharma GmbH & Co. KG, Biberach, Německo Držitel rozhodnutí o registraci Boehringer Ingelheim International GmbH Ingelheim am Rhein, Německo 7/7
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ACTILYSE Prášek pro přípravu injekčního a infuzního roztoku s rozpouštědlem Alteplasum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ACTILYSE Prášek pro přípravu injekčního a infuzního roztoku s rozpouštědlem Alteplasum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls20129/2012
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls20129/2012 1. NÁZEV PŘÍPRAVKU ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls20129/2012 1. NÁZEV PŘÍPRAVKU ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum
 sp.zn. sukls167003/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn. sukls167003/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls167003/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička s práškem obsahuje: Alteplasum
sp.zn. sukls167003/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACTILYSE Prášek a rozpouštědlo pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička s práškem obsahuje: Alteplasum
Příbalová informace: informace pro pacienta. ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum
 Příbalová informace: informace pro pacienta ACTILYSE 1 mg/ prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta ACTILYSE 1 mg/ prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička s práškem obsahuje: Alteplasum 10 mg (odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 lahvička s práškem obsahuje: Alteplasum 10 mg (odpovídá
Příloha č.2 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009
 Příloha č.2 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ACTILYSE Prášek pro přípravu injekčního a infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Příloha č.2 k rozhodnutí o změně registrace sp.zn.: sukls204806/2009 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU ACTILYSE Prášek pro přípravu injekčního a infuzního roztoku s rozpouštědlem 2. KVALITATIVNÍ
Příbalová informace: informace pro pacienta. ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum
 Příbalová informace: informace pro pacienta ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro pacienta ACTILYSE 1 mg/ml prášek a rozpouštědlo pro injekční/infuzní roztok Alteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Jedna lahvička s práškem také obsahuje arginin, kyselinu fosforečnou 85% a polysorbát 80. Rozpouštědlo: voda na injekci.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA (VELIKOST BALENÍ 10 MG) 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Actilyse 10 mg Alteplasum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna lahvička obsahuje 10 mg alteplasy (což odpovídá
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Metalyse 8 000 jednotek. Prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metalyse 8 000 jednotek 1 injekční lahvička
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Metalyse 8 000 jednotek. Prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metalyse 8 000 jednotek 1 injekční lahvička
Zvažte oddálení podání regadenosonu u pacientů s nekontrolovanou hypertenzí.
 CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
CAVE! Informační dopis pro zdravotníky Rapiscan (regadenoson) - Nové důležité doporučení pro minimalizaci rizika cévní mozkové příhody a prodloužení křečí vyvolaných přípravkem Rapiscan po podání aminofylinu.
Tenekteplasa je fibrin-specifický aktivátor plazminogenu, vyráběný rekombinantní DNA technologií za použití ovariálních buněk čínského křečka.
 1. NÁZEV PŘÍPRAVKU Metalyse 10 000 jednotek. Prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metalyse 10 000 jednotek 1 injekční lahvička obsahuje tenecteplasum 10 000
1. NÁZEV PŘÍPRAVKU Metalyse 10 000 jednotek. Prášek a rozpouštědlo pro injekční roztok. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Metalyse 10 000 jednotek 1 injekční lahvička obsahuje tenecteplasum 10 000
Rapilysin 10 U prášek pro přípravu injekčního roztoku s rozpouštědlem.
 1. NÁZEV PŘÍPRAVKU Rapilysin 10 U prášek pro přípravu injekčního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 10* U reteplasum** v 0,56 g prášku 1 předplněná
1. NÁZEV PŘÍPRAVKU Rapilysin 10 U prášek pro přípravu injekčního roztoku s rozpouštědlem. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 injekční lahvička obsahuje 10* U reteplasum** v 0,56 g prášku 1 předplněná
Příručka pro předepisující lékaře
 Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
Příbalová informace: informace pro uživatele
 sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
sp.zn. sukls55434/2017 Příbalová informace: informace pro uživatele Kybernin P 500 IU prášek a rozpouštědlo pro injekční/infuzní roztok Kybernin P 1000 IU prášek a rozpouštědlo pro injekční/infuzní roztok
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Krvácivé komplikace při léčbě warfarinem
 Krvácivé komplikace při léčbě warfarinem Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně J.Gumulec, P.Kessler*,
Krvácivé komplikace při léčbě warfarinem Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně J.Gumulec, P.Kessler*,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Glucosum monohydricum
 sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
sp.zn.sukls126426/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Glukóza 5 Braun infuzní roztok Glucosum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám tento přípravek bude
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPTASE 750 000 IU. STREPTASE 1 500 000 IU prášek pro přípravu injekčního roztoku (streptokinasum)
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPTASE 250 000 IU STREPTASE 750 000 IU STREPTASE 1 500 000 IU prášek pro přípravu injekčního roztoku (streptokinasum) Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE STREPTASE 250 000 IU STREPTASE 750 000 IU STREPTASE 1 500 000 IU prášek pro přípravu injekčního roztoku (streptokinasum) Přečtěte si pozorně celou příbalovou
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
PŘÍBALOVÁ INFORMACE. Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok somatostatinum
 sp.zn.sukls207834/2015 Příbalová informace: informace pro uživatele PŘÍBALOVÁ INFORMACE Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok somatostatinum Přečtěte si pozorně celou příbalovou
sp.zn.sukls207834/2015 Příbalová informace: informace pro uživatele PŘÍBALOVÁ INFORMACE Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok somatostatinum Přečtěte si pozorně celou příbalovou
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna ampulka přípravku Somatostatin Eumedica 3 mg obsahuje somatostatinum 3 mg.
 sp.zn.sukls207834/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampulka přípravku Somatostatin
sp.zn.sukls207834/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Somatostatin Eumedica 3 mg prášek a rozpouštědlo pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampulka přípravku Somatostatin
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE)
 PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
R A P I D EARLY ADMINISTRATION OF ACTIVATED FACTOR VII IN PATIENTS WITH SEVERE BLEEDING ZÁZNAM SUBJEKTU HODNOCENÍ (CRF) Číslo centra.
 R A P I D EARLY ADMINISTRATION OF ACTIVATED FACTOR VII IN PATIENTS WITH SEVERE BLEEDING ZÁZNAM SUBJEKTU HODNOCENÍ (CRF) Číslo centra Číslo pacienta Iniciály pacienta VÝBĚR A VYŘAZENÍ PACIENTŮ Kritéria
R A P I D EARLY ADMINISTRATION OF ACTIVATED FACTOR VII IN PATIENTS WITH SEVERE BLEEDING ZÁZNAM SUBJEKTU HODNOCENÍ (CRF) Číslo centra Číslo pacienta Iniciály pacienta VÝBĚR A VYŘAZENÍ PACIENTŮ Kritéria
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls223368/2013 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
MUDr. Lukáš Klečka Neurologické oddělení. Za spolupráce:
 MUDr. Lukáš Klečka Neurologické oddělení Za spolupráce: Přednemocniční: test tvář-ruka-řeč Nemocniční: Časná diagnostika Časná stabilizace Definitivní diagnostika Definitivní terapie Jednoduchými dotazy
MUDr. Lukáš Klečka Neurologické oddělení Za spolupráce: Přednemocniční: test tvář-ruka-řeč Nemocniční: Časná diagnostika Časná stabilizace Definitivní diagnostika Definitivní terapie Jednoduchými dotazy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příbalová informace: informace pro uživatele. Metalyse jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum
 Příbalová informace: informace pro uživatele Metalyse 8 000 jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příbalová informace: informace pro uživatele Metalyse 8 000 jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B?
 pozvánka na satelitní sympozium společnosti Sobi Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom Vás
pozvánka na satelitní sympozium společnosti Sobi Jakou změnu přináší přípravky s prodlouženým účinkem v profylaxi pacientů s hemofilií A/B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom Vás
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. PERFALGAN 10 mg/ml, infuzní roztok paracetamolum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE PERFALGAN 10 mg/ml, infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
1/5. Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. EXACYL Injekční roztok
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls234467/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU EXACYL Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum tranexamicum 100
prášek pro infuzní roztok
 sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
sp.zn. sukls52667/2015 Příbalová informace: informace pro uživatele Soluvit N prášek pro infuzní roztok Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 134-176 mg lyofilizovaného prášku obsahuje 250 000 IU stabilizované čisté streptokinázy.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Streptase 250 000 IU Streptase 750 000 IU Streptase 1 500 000 IU Prášek pro přípravu injekčního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Streptase 250
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Streptase 250 000 IU Streptase 750 000 IU Streptase 1 500 000 IU Prášek pro přípravu injekčního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Streptase 250
Stabilita při pokojové teplotě činí léčbu pohodlnou a okamžitě dostupnou - doma stejně jako mimo domov.
 NovoSeven stabilní při pokojové teplotě: Léčba vždy při ruce Edukační brožura pro lékaře Cíle: Poskytnout informace, které budou shrnuty v edukační brožuře
NovoSeven stabilní při pokojové teplotě: Léčba vždy při ruce Edukační brožura pro lékaře Cíle: Poskytnout informace, které budou shrnuty v edukační brožuře
Příbalová informace: informace pro uživatele. Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok. (fibrinogenum humanum)
 sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
sp.zn. sukls169431/2015 Příbalová informace: informace pro uživatele Haemocomplettan P 2 g Prášek pro injekční/infuzní roztok (fibrinogenum humanum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Edukační materiál. Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera
 Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Edukační materiál Strattera (atomoxetin) Informace pro lékaře týkající se posouzení a monitorování kardiovaskulárních rizik u přípravku Strattera Přípravek Strattera je indikován k léčbě hyperkinetické
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls26988/2010 a příloha k sp. zn. sukls72113/2010 SOUHRN ÚDAJU O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls26988/2010 a příloha k sp. zn. sukls72113/2010 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Alburex 20 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls26988/2010 a příloha k sp. zn. sukls72113/2010 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Alburex 20 2. KVALITATIVNÍ A KVANTITATIVNÍ
Škály v cévní neurologii, CMP kontroverze
 Škály v cévní neurologii, CMP kontroverze 25.1.2012 MUDr. Lukáš Klečka Za spolupráce: Proč je třeba mluvit o mrtvicíc h? Rok Počet CMP Muži ženy Ischemie Krvácení+ SAK Trom bolýz a Rekanali zace + LIT.
Škály v cévní neurologii, CMP kontroverze 25.1.2012 MUDr. Lukáš Klečka Za spolupráce: Proč je třeba mluvit o mrtvicíc h? Rok Počet CMP Muži ženy Ischemie Krvácení+ SAK Trom bolýz a Rekanali zace + LIT.
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum
 Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
Příbalová informace: informace pro uživatele Flexbumin 200 g/l infuzní roztok Albuminum humanum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto
 EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto Informace pro předepisování přípravku Xarelto (rivaroxaban) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto Informace pro předepisování přípravku Xarelto (rivaroxaban) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Human Albumin Grifols 5% je vzhledem k normální krevní plazmě mírně hypoonkotický a obsahuje mmol/l celkového sodíku.
 sp.zn.sukls129542/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Human Albumin Grifols 5%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Human Albumin Grifols 5% je roztok, který obsahuje 50g/l
sp.zn.sukls129542/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Human Albumin Grifols 5%, infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Human Albumin Grifols 5% je roztok, který obsahuje 50g/l
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glypressin 1 mg, prášek pro přípravu injekčního roztoku
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glypressin 1 mg, prášek pro přípravu injekčního roztoku
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU HUMAN ALBUMIN 50 g/l BAXTER Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek HUMAN ALBUMIN 50 g/l BAXTER je roztok obsahující 50 g/l celkových
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU HUMAN ALBUMIN 50 g/l BAXTER Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Přípravek HUMAN ALBUMIN 50 g/l BAXTER je roztok obsahující 50 g/l celkových
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls265730/2011 a příloha k sp.zn. sukls120702/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls265730/2011 a příloha k sp.zn. sukls120702/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alburex 20 200 g/l, infuzní roztok 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls265730/2011 a příloha k sp.zn. sukls120702/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alburex 20 200 g/l, infuzní roztok 2. KVALITATIVNÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls8780/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. TRENTAL, infuzní roztok (pentoxifyllinum)
 sp.zn. sukls208263/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRENTAL, infuzní roztok (pentoxifyllinum) Přečtěte si pozorně tuto příbalovou informaci dříve než začnete tento přípravek používat,
sp.zn. sukls208263/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE TRENTAL, infuzní roztok (pentoxifyllinum) Přečtěte si pozorně tuto příbalovou informaci dříve než začnete tento přípravek používat,
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls162880/2008
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls162880/2008 PŘÍBALOVÁ INFORMACE : INFORMACE PRO UŹIVATELE HEPARIN SANDOZ 25 000 IU/ 5 ml Injekční roztok Heparinum natricum Přečtěte si pozorně
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls162880/2008 PŘÍBALOVÁ INFORMACE : INFORMACE PRO UŹIVATELE HEPARIN SANDOZ 25 000 IU/ 5 ml Injekční roztok Heparinum natricum Přečtěte si pozorně
SOUHRN ÚDAJU O PŘÍPRAVKU. Albunorm 5% je roztok obsahující 50 g/l celkové bílkoviny, z níž alespoň 96% je lidský albumin.
 sp. zn. sukls72888/2013 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Albunorm 5%, 50 g/l, infuzní roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ Albunorm 5% je roztok obsahující 50 g/l celkové
sp. zn. sukls72888/2013 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Albunorm 5%, 50 g/l, infuzní roztok SOUHRN ÚDAJU O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŹENÍ Albunorm 5% je roztok obsahující 50 g/l celkové
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Souhrn údajů o přípravku
 sp.zn. sukls260038/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Haemocomplettan P Prášek pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Haemocomplettan je dodáván jako prášek pro
sp.zn. sukls260038/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Haemocomplettan P Prášek pro injekční/infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Haemocomplettan je dodáván jako prášek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls8804/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PAMBA Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum aminomethylbenzoicum 50 mg v 1 ampuli 5 ml. Úplný seznam pomocných
sp.zn. sukls8804/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PAMBA Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum aminomethylbenzoicum 50 mg v 1 ampuli 5 ml. Úplný seznam pomocných
Trombolytická terapie u akutního ischemického CMP
 Trombolytická terapie u akutního ischemického CMP Holek R., Vaňková E., Nagyová G., Kovaříková D. Neurologie JIP, Vítkovická nemocnice a.s., Ostrava CMP CMP akutní neurologická dysfunkce vaskulárního původu
Trombolytická terapie u akutního ischemického CMP Holek R., Vaňková E., Nagyová G., Kovaříková D. Neurologie JIP, Vítkovická nemocnice a.s., Ostrava CMP CMP akutní neurologická dysfunkce vaskulárního původu
JIŘÍ WIDIMSKÝ, JAROSLAV MALÝ A KOLEKTIV / AKUTNÍ PLICNÍ EMBOLIE A ŽILNÍ TROMBÓZA
 1 Výskyt akutní plicní embolie Jiří Widimský, Jaroslav Malý 13 2 Patogeneze žilní trombózy a plieni embolie (tromboembolie) Jaroslav Malý, Jiří Widimský 19 2.1.1 Velké chirurgické výkony, zejména ortopedické
1 Výskyt akutní plicní embolie Jiří Widimský, Jaroslav Malý 13 2 Patogeneze žilní trombózy a plieni embolie (tromboembolie) Jaroslav Malý, Jiří Widimský 19 2.1.1 Velké chirurgické výkony, zejména ortopedické
Návod pro pacienta / pečovatele
 Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
Návod pro pacienta / pečovatele Hemlibra (emicizumab) Subkutánní injekce Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Trombolytická léčba akutních iktů v ČR. Škoda O., Neurologické oddělení, Nemocnice Jihlava, Cerebrovaskulární sekce ČNS JEP
 Trombolytická léčba akutních iktů v ČR Škoda O., Neurologické oddělení, Nemocnice Jihlava, Cerebrovaskulární sekce ČNS JEP Rozdělení CMP dle etiologie CMP (iktus, Stroke ) - heterogenní skupina onemocnění,
Trombolytická léčba akutních iktů v ČR Škoda O., Neurologické oddělení, Nemocnice Jihlava, Cerebrovaskulární sekce ČNS JEP Rozdělení CMP dle etiologie CMP (iktus, Stroke ) - heterogenní skupina onemocnění,
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Haemophilus influenzae type b polysaccharide
 sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
sp. zn. sukls37951/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci jedna dávka (0,5 ml) obsahuje:
Použití albuminu spíše než umělého koloidního roztoku závisí na klinickém stavu daného pacienta a na oficiálních doporučeních.
 sp.zn.sukls104930/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Human Albumin Grifols 20%, infuzní roztok 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Human Albumin Grifols 20% je roztok, který obsahuje
sp.zn.sukls104930/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Human Albumin Grifols 20%, infuzní roztok 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Human Albumin Grifols 20% je roztok, který obsahuje
Informace pro předepisování přípravku Xarelto (rivaroxaban)
 Informace pro předepisování přípravku Xarelto (rivaroxaban) 2 Informace pro předepisování přípravku Xarelto Karta pacienta 4 Doporučení pro dávkování 4 Dávkování u pacientů s fibrilací síní 4 Renální insuficience
Informace pro předepisování přípravku Xarelto (rivaroxaban) 2 Informace pro předepisování přípravku Xarelto Karta pacienta 4 Doporučení pro dávkování 4 Dávkování u pacientů s fibrilací síní 4 Renální insuficience
Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum
 Sp.zn.sukls143439/2015 Příbalová informace: informace pro uživatele Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp.zn.sukls143439/2015 Příbalová informace: informace pro uživatele Paracetamol B. Braun 10 mg/ml infuzní roztok paracetamolum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Obr.1 Žilní splavy. https://s-media-cache-ak0.pinimg.com/564x/c3/91/8c/c3918c00db875bb460cf868b26ee1a0c.jpg
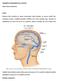 TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
TROMBÓZA NITROLEBNÍCH ŽIL A SPLAVŮ Autor: Barbora Baštinská Výskyt Mozková žilní trombóza je vzácné onemocnění, jehož příznaky se mohou značně lišit. Vyskytuje se spíše u mladších pacientů a většinou (až
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IBUSTRIN 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje indobufenum 200 mg. Přípravek obsahuje monohydrát laktosy. Úplný seznam pomocných látek
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU IBUSTRIN 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje indobufenum 200 mg. Přípravek obsahuje monohydrát laktosy. Úplný seznam pomocných látek
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Příbalová informace: informace pro uživatele Parsabiv 2,5 mg injekční roztok Parsabiv 5 mg injekční roztok Parsabiv 10 mg injekční roztok Etelcalcetidum Tento přípravek podléhá dalšímu sledování. To umožní
Viru-Merz je účinný při léčbě infekce způsobené virem herpes simplex, ale pouze do fáze vzniku puchýřků.
 sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
sp.zn.: sukls106117/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Viru-Merz, gel tromantadini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele. Metalyse jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum
 Příbalová informace: informace pro uživatele Metalyse 8 000 jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příbalová informace: informace pro uživatele Metalyse 8 000 jednotek, prášek a rozpouštědlo pro injekční roztok Tenecteplasum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cyrdanax 20 mg/ml prášek pro infuzní roztok Dexrazoxanum
 Sp.zn.sukls191351/2012 a sp.zn.sukls24833/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyrdanax 20 mg/ml prášek pro infuzní roztok Dexrazoxanum Přečtěte si pozorně celou příbalovou informaci dříve,
Sp.zn.sukls191351/2012 a sp.zn.sukls24833/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cyrdanax 20 mg/ml prášek pro infuzní roztok Dexrazoxanum Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III
 Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
Příbalová informace: informace pro uživatele ANTITHROMBIN III BAXALTA Prášek a rozpouštědlo pro infuzní roztok Antithrombinum III Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
sp.zn. sukls212686/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Chlorid sodný 0,9% Braun Infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 000 ml roztoku obsahuje: natrii chloridum Koncentrace
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Immunoglobulinum humanum normale 165 mg/ml* * odpovídá proteinum humanum jehož obsahem je nejméně z 95 % IgG.
 sp.zn. sukls119969/2013 1. NÁZEV PŘÍPRAVKU GAMMANORM 165 mg/ml, injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SC/IMIg) Immunoglobulinum
sp.zn. sukls119969/2013 1. NÁZEV PŘÍPRAVKU GAMMANORM 165 mg/ml, injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Immunoglobulinum humanum normale (SC/IMIg) Immunoglobulinum
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok. Sulperazonum/sulbactamum
 Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro pacienta Sulperazon 2 g IM/IV Prášek pro injekční roztok Sulperazonum/sulbactamum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls165491/2012 1. NÁZEV PŘÍPRAVKU Haemocomplettan P Prášek pro injekční/infuzní roztok Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls165491/2012 1. NÁZEV PŘÍPRAVKU Haemocomplettan P Prášek pro injekční/infuzní roztok Souhrn údajů o přípravku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta. PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum)
 PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE Příbalová informace: informace pro pacienta PROSTAPHLIN 1000 mg prášek pro injekční roztok (oxacillinum natricum monohydricum) Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexbumin 200 g/l infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flexbumin 200 g/l je roztok obsahující 200 g/l (20%) celkové bílkoviny, z čehož nejméně
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexbumin 200 g/l infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flexbumin 200 g/l je roztok obsahující 200 g/l (20%) celkové bílkoviny, z čehož nejméně
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Ultiva 1 mg Ultiva 2 mg
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls3017/2008, sukls3018/2008, přílohy k sp. zn. sukls237078/2010, sukls229670/2011, sukls237080/2010, sukls229692/2011 PŘÍBALOVÁ INFORMACE: INFORMACE
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls3017/2008, sukls3018/2008, přílohy k sp. zn. sukls237078/2010, sukls229670/2011, sukls237080/2010, sukls229692/2011 PŘÍBALOVÁ INFORMACE: INFORMACE
Příloha č. 2 k rozhodnutí o prodloužení registrace č.j.: sukls7782/2004
 Příloha č. 2 k rozhodnutí o prodloužení registrace č.j.: sukls7782/2004 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEPARIN FORTE LÉČIVA injekční roztok, Heparinum natricum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o prodloužení registrace č.j.: sukls7782/2004 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HEPARIN FORTE LÉČIVA injekční roztok, Heparinum natricum Přečtěte si pozorně celou příbalovou
INFLECTRA SCREENINGOVÝ LIST. a výběru pacientů pro všechny schválené indikace. Obsahuje pokyny ke správnému screeningu
 Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Demyelinizační poruchy U pacientů s preexistujícími nebo nedávno vzniklými demyelinizačními poruchami, je nutné pečlivě zvážit prospěch a riziko anti-tnf terapie před zahájením léčby přípravkem INFLECTRA
Organizace péče o nemocné s CMP v JMK a zkušenosti s provozem iktového centra Nemocnice Břeclav,p.o. Břeclav 7.11.2012
 Organizace péče o nemocné s CMP v JMK a zkušenosti s provozem iktového centra Nemocnice Břeclav,p.o. Zdraví bez hranic Gesundheit ohne grenzen Břeclav 7.11.2012 Hlavní zásady a cíle Cévní mozková příhoda,
Organizace péče o nemocné s CMP v JMK a zkušenosti s provozem iktového centra Nemocnice Břeclav,p.o. Zdraví bez hranic Gesundheit ohne grenzen Břeclav 7.11.2012 Hlavní zásady a cíle Cévní mozková příhoda,
