SOUHRN ÚDAJŮ O PŘÍPRAVKU
|
|
|
- Bohumír Jaroš
- před 8 lety
- Počet zobrazení:
Transkript
1 Sp.zn.sukls95746/2013. sukls95749/ NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU VANCOMYCIN PHARMASWISS 500 mg, prášek pro infuzní roztok VANCOMYCIN PHARMASWISS 1000 mg, prášek pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička 10 ml: obsahuje vancomycini hydrochloridum 512,57 mg (eq. 538,198.5 IU), což odpovídá vancomycinum 500 mg (eq. 525,000 IU). Jedna injekční lahvička 20 ml: obsahuje vancomycini hydrochloridum 1025,14 mg (eq. 1,076,397 IU), což odpovídá vancomycinum 1000 mg (eq. 1,050,000 IU). Jeden ml rekonstituovaného roztoku obsahuje vancomycinum 50 mg. Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Prášek pro infuzní roztok. Popis přípravku: homogenní, bílý až lehce nahnědlý prášek. ph roztoku po rekonstituci je 2,5 4,5. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Vancomycin PharmaSwiss podávaný intravenózně je indikován k léčbě závažných, život ohrožujících infekcí vyvolaných citlivými gram-pozitivními mikroorganizmy u pacientů, kteří nemohou být léčeni jiným antimikrobiálním přípravkem nebo jejichž léčba selhává po podání účinných, méně toxických antimikrobiálních přípravků, jako jsou peniciliny a cefalosporiny. Vankomycin má být vyhrazen jen pro ty případy, u kterých je specificky indikován, s cílem minimalizovat vznik možné rezistence. Vankomycin je indikován k léčbě následujících závažných infekcí vyvolaných citlivými mikroorganizmy (viz bod. 5.1): endokarditida infekce kostí (osteomyelitida) pneumonie infekce měkkých tkání. Endokarditida způsobená Streptococcus viridans nebo S. bovis má být léčena vankomycinem v kombinaci s aminoglykosidy. Vankomycin může být aplikován při peroperační profylaxi bakteriální endokarditidy, u pacientů s vysokým rizikem rozvoje bakteriální endokarditidy, kteří se podrobují velkým chirurgickým výkonům (např. srdečním nebo cévním atd.) a nemohou dostat vhodná betalaktamová antibiotika. 1
2 Vancomycin PharmaSwiss může být také podán perorálně při následujícím onemocnění: závažné případy pseudomembranózní kolitidy, související s léčbou antibiotiky a obvykle vyvolané Clostridium difficile. POZNÁMKA: intravenózně podaný vankomycin není při léčbě pseudomembranózní kolitidy účinný. Mělo by se dbát oficiálních doporučení pro správné používání antibakteriálních látek. 4.2 Dávkování a způsob podání Dávkování Intravenózní podání Dávka má být individuálně upravena podle tělesné hmotnosti, věku a funkce ledvin pacienta. Dospělí a děti starší 12 let: Doporučená intravenózní denní dávka je mg. Podává se rozděleně v dávkách 500 mg každých 6 hodin anebo mg každých 12 hodin. Bakteriální endokarditida: obecně uznávaný dávkovací režim je mg vankomycinu intravenózně každých 12 hodin po dobu 4 týdnů buď samostatně nebo v kombinaci s jinými antibiotiky (gentamicin plus rifampicin, gentamicin, streptomycin). Enterokoková endokarditida se léčí po dobu 6 týdnů vankomycinem v kombinaci s aminoglykosidy - podle národních standardních postupů. Peroperační profylaxe před bakteriální endokarditidou: mg vankomycinu intravenózně před operací (před anestezií) a v závislosti na délce a typu operace může být podána dávka mg vankomycinu IV 12 hodin po operaci. Pediatrická populace Děti od věku 1 měsíce do 12 let: Doporučená intravenózní dávka je 10 mg/kg/den, každých 6 hodin nebo 20 mg/kg každých 12 hodin. Novorozenci a kojenci: Doporučená úvodní dávka je 15 mg/kg, potom 10 mg/kg každých 12 hodin v průběhu prvního týdne života a potom každých 8 hodin do dosažení věku 1 měsíc. Je doporučována pečlivá kontrola hladin vankomycinu v séru (viz níže). Zvláštní populace Starší pacienti: Nižší udržovací dávky mohou být nutné vzhledem ke snížení funkce ledvin související s věkem. Obézní pacienti: Může být potřeba změna obvyklého denního dávkování. Pacienti s jaterní insuficiencí: Neexistuje žádný důkaz o tom, že by dávka měla být u pacientů s jaterní insuficiencí snížena. Pacienti s poruchou funkce ledvin: U těchto pacientů musí být dávka upravena a následující nomogram může posloužit jako vodítko. Doporučuje se pečlivé sledování sérové koncentrace vankomycinu (viz níže). 2
3 Dávkovací nomogram pro dospělé pacienty s poruchou funkce ledvin U pacientů s mírným nebo středně těžkým renálním selháváním nesmí být počáteční dávka nižší než 15 mg/kg. U pacientů se závažným renálním selháváním je vhodnější podávat udržovací dávku mezi 250 mg a mg v odstupu několika dnů, než podávat nižší denní dávky. U pacientů s anurií (prakticky bez renálních funkcí) se podává dávka 15 mg/kg tělesné hmotnosti, dokud není dosaženo terapeutické sérové koncentrace vankomycinu. Udržovací dávky jsou 1,9 mg/kg tělesné hmotnosti/24 hodin. K usnadnění postupu je možné aplikovat dospělým pacientům se závažnou poruchou funkce ledvin udržovací dávku 250 mg až 1000 mg v intervalu několika dnů, spíše než každodenně. Dávkování v případě hemodialýzy: U pacientů s nefunkčními ledvinami, podstupujících pravidelně hemodialýzu, je možné následující dávkování: Saturační dávka mg vankomycinu, udržovací dávka mg podaná každý sedmý až desátý den. Pokud se používají při hemodialýze polysulfonové membrány (dialýza s vysokým průtokem), je poločas vankomycinu snížen. U pravidelně hemodialyzovaných pacientů mohou být proto nutné přídatné udržovací dávky. Monitorování koncentrací vankomycinu v séru: Sérové koncentrace vankomycinu mají být sledovány od druhého dne léčby bezprostředně před další dávkou a jednu hodinu po infuzi. Terapeutická hladina vankomycinu v krvi jednu hodinu po ukončení infuze by měla být mezi 30 a 40 mg/l (maximum 50 mg/l), minimální hladina (krátce před další dávkou) pak mezi 5 a 10 mg/l, nebo podle národních doporučení. Koncentrace vankomycinu v séru má být kontrolována dvakrát nebo třikrát týdně. 3
4 Perorální podání V léčbě pseudomembranózní kolitidy jako jediné indikace pro perorální podání vankomycinu je obvyklá dávka 125 mg (2,5 ml) každých 6 hodin v průběhu 7 až 10 dnů. Celková denní dávka by neměla překročit mg. V terapii dětské pseudomembranózní kolitidy se obvykle podává dávka 40 mg/kg, rozdělená do tří nebo čtyř dávek po dobu 7 až 10 dní. Celková denní dávka nemá překročit 2 g. Způsob podání: Parenterálně se vankomycin může podávat pouze jako pomalá intravenózní infuze, která je dostatečně zředěná (alespoň 100 ml na 500 mg nebo nejméně 200 ml za 1000 mg). Každá dávka má být podána rychlostí nepřesahující 10 mg/min nebo po dobu alespoň 60 minut (co je delší). Pacienti s omezením přívodu tekutin mohou dostat roztok 500 mg/50 ml nebo 1000 mg/100 ml. S těmito vyššími koncentracemi však může stoupat riziko vzniku nežádoucích účinků souvisejících s infuzí. U perorálně podávaného vankomycinu má být dávka naředěna ve 30 ml vody, kterou pacient buď vypije, nebo se může aplikovat nazogastrickou sondou. Návod k rekonstituci a naředění tohoto léčivého přípravku před jeho podáním je uveden v bodě 6.6. Délka léčby: Doba trvání léčby závisí jak na závažnosti infekce, tak na výsledku klinického a bakteriologického vyšetření stavu pacienta. 4.3 Kontraindikace Hypersenzitivita na vankomycin. 4.4 Zvláštní upozornění a opatření pro použití Upozornění: Při akutní anurii a při již poškozeném kochleárním ústrojí se vankomycin může použít jedině ve vitálních indikacích a pokud není k dispozici žádná jiná bezpečnější alternativa. V případě závažných akutních hypersensitivních reakcí (např. anafylaxe) musí být léčba vankomycinem okamžitě přerušena a musí být zahájena opatření obvyklá pro naléhavé případy (např. podání antihistaminik, kortikosteroidů, a pokud je to nezbytné, i umělé dýchání). Rychlé podání ve formě bolusu (tj. po dobu několika minut) může být spojeno s těžkou hypotenzí (včetně šoku a vzácně i srdeční zástavy), s histamin-podobnými reakcemi, jako je makulopapulózní nebo erytematózní vyrážka (tzv. syndrom rudého muže nebo syndrom červeného krku). Vankomycin je třeba infundovat pomalu ve zředěném roztoku (2,5 až 5,0 g/l) rychlostí nejvýše 10 mg/min po dobu nejméně 60 minut nebo i déle, aby se zamezilo reakcím spojeným s rychlou infuzí. Po přerušení infuze tyto reakce obvykle rychle pominou. Vankomycin lze pro riziko nekrózy podávat pouze intravenózně. Riziko iritace žilní stěny je minimalizováno podáním vankomycinu ve formě naředěné infuze a střídáním místa vpichu injekce. Intraperitoneální podání vankomycinu v průběhu kontinuální ambulantní peritoneální dialýzy bylo spojeno se syndromem chemické peritonitidy. Zvláštní populace Pacienti s renálním selháním: Nefrotoxicita: vankomycin musí být u pacientů se selháním ledvin používán s opatrností, protože při dlouhodobě vysoké koncentraci v krvi je riziko rozvoje jeho toxických účinků mnohem vyšší. Při léčbě těchto pacientů a pacientů, kteří užívají současně jiné nefrotoxické látky (např. aminoglykosidy), 4
5 musí být pečlivě monitorována funkce ledvin a je nutné dodržovat vhodné dávkovací schéma, aby se snížilo riziko nefrotoxicity na minimum (viz bod 4.2). Pacienti s preexistující hluchotou: Ototoxicita: ototoxicita, která může být přechodná nebo trvalá (viz bod 4.8), byla hlášena u pacientů s předchozím ohluchnutím po příliš vysokých intravenózních dávkách vankomycinu nebo jako důsledek současně podávaných jiných ototoxických léčivých látek, jako jsou aminoglykosidy. Hluchotě může předcházet tinnitus. Zkušenosti s jinými antibiotiky naznačují, že hluchota může být progresivní i přes ukončení léčby. Pro snížení rizika ototoxicity se doporučuje pravidelně monitorovat hladiny vankomycinu v krvi a periodicky testovat sluchové funkce. Upozornění: Vankomycin silně dráždí tkáně a vyvolává nekrózu v místě vpichu, jestliže je podán intramuskulárně. Bolest a tromboflebitida se může objevit u řady pacientů, kteří dostávají vankomycin, a může být případně i závažná. Četnost a závažnost tromboflebitidy je možné minimalizovat pomalou aplikací látky ve zředěném roztoku (viz bod 6.6) a pravidelným střídáním místa infuze. Četnost s infuzí spojených reakcí (hypotenze, návaly horka, zarudnutí kůže, kopřivka a svědění) se zvyšuje při současném podávání anestetik, což může být redukováno podáním infuze vankomycinu během 60 minut před aplikací anestetika. Vankomycin má být používán s opatrností u pacientů s alergickou reakcí na teikoplanin, protože byly hlášeny zkřížené hypersenzitivní reakce mezi vankomycinem a teikoplaninem. Vankomycin může prohloubit depresi myokardu vyvolanou anestetikem. V průběhu anestezie se musí dávky vankomycinu podávat silně zředěné a pomalu a za pečlivého monitorování srdečních funkcí. Aby se umožnila adaptace na změnu polohy, je třeba změnu polohy odložit na dobu po skončení infuze. U pacientů, kteří dostávají vankomycin dlouhodobě anebo spolu s jinými léčivy, která mohou vyvolat neutropenii nebo agranulocytózu, je třeba monitorovat v pravidelných intervalech počet leukocytů. Všichni pacienti užívající vankomycin mají být pravidelně vyšetřováni z hlediska krevního obrazu, moče, jater a ledvin. Dlouhodobé užívání vankomycinu může vést k superinfekcím rezistentními mikroorganismy. Tito pacienti se mají proto pravidelně monitorovat. Pokud se objeví superinfekce během léčby, mají být přijata vhodná opatření. Pseudomembranózní kolitida je popisována téměř u všech antibakteriálních přípravků včetně vankomycinu a může se vyskytovat v rozsahu od mírného až k život ohrožujícímu postižení. Proto je důležité na tuto diagnózu myslet u pacientů s průjmem, který se objevil po podání vankomycinu. Antiperistaltika jsou kontraindikována. Při dlouhodobém užívání je indikováno pravidelné sledování krevních hladin vankomycinu, zejména u pacientů s dysfunkcí ledvin nebo s poškozením sluchu, stejně jako při současném podávání nefrotoxických nebo ototoxických látek. Vankomycin má být omezen pro případy specifických indikací, aby se minimalizovalo riziko rezistence. Pokud je vankomycin použit pro empirickou léčbu infekcí, u kterých je také předpokládána přítomnost gramnegativních bakterií, má se přidat vhodné antimikrobiální pokrytí. Dávky mají být titrovány na základě stanovení hladin látky v séru, které mají být pravidelně monitorovány spolu s kontrolou funkce ledvin. Obecně se doporučuje sledování koncentrace látky v séru 2-3krát týdně. Starší pacienti nad 60 let jsou zvláště náchylní k poškození sluchového ústrojí, a mají se proto pravidelně vyšetřovat z hlediska sluchových funkcí. Souběžnému nebo sekvenčnímu použití jiné neurotoxické látky je třeba se vyhnout. Rovněž je třeba se u starších pacientů vyhnout souběžnému 5
6 podání vankomycinu a jiných nefrotoxických látek, vzhledem ke zvýšenému riziku rozvoje renální dysfunkce u této věkové skupiny. Pediatrická populace U předčasně narozených dětí a kojenců se má vankomycin používat pouze se zvláštní opatrností, protože jejich ledviny jsou nezralé, což může zvýšit sérové koncentrace vankomycinu. Koncentrace vankomycinu v krvi má být proto u těchto dětí pečlivě monitorována. Současné podávání vankomycinu a anestetik u dětí bylo spojeno se vznikem erytému a anafylaktoidní reakce. Je-li podání vankomycinu nutné pro chirurgickou profylaxi, je vhodné aplikovat anestetika až po dokončení infuze vankomycinu. 4.5 Interakce s jinými léčivými přípravky a jiné formy interakce Jiné potenciálně nefrotoxické nebo ototoxické léčivé látky Souběžné nebo následné podávání vankomycinu s jinými potenciálně neurotoxickými nebo nefrotoxickými látkami, zejména s gentamicinem, amfotericinem B, streptomycinem, neomycinem, kanamycinem, amikacinem, tobramycinem, viomycinem, bacitracinem, polymyxinem B, kolistinem a cisplatinou mohou potencovat nefrotoxicitu nebo ototoxicitu vankomycinu. Proto je třeba pacienta pečlivě kontrolovat. Pro synergické působení (např. s gentamicinem) je v těchto případech třeba maximální dávku vankomycinu snížit na 500 mg každých 8 hodin. Anestetika Současné podávání vankomycinu a anestetik bylo spojeno s erytémem, zčervenáním jako po histaminu a s anafylaktoidními reakcemi. Tyto reakce mohou být redukovány podáním vankomycinu 60 minut před indukcí anestezie. Myorelaxancia Podává-li se vankomycin v průběhu chirurgického výkonu anebo bezprostředně po něm, může být účinek (nervosvalová blokáda) současně použitých myorelaxancií (např. sukcinylcholinu) zesílen nebo prodloužen. 4.6 Fertilita, těhotenství a kojení Fertilita Žádné údaje ohledně fertility nejsou k dispozici. Těhotenství Adekvátní bezpečnostní údaje o podávání vankomycinu těhotným ženám nejsou k dispozici. Studie reprodukční toxicity u zvířat nenaznačují přímé ani nepřímé účinky na embryonální/fetální vývoj nebo na průběh těhotenství (viz bod 5.3). Vankomycin však proniká placentou a nelze vyloučit potenciální riziko ototoxického a nefrotoxického ovlivnění plodu a novorozence. Vankomycin se proto může v průběhu těhotenství podávat, pouze pokud je jednoznačně indikován a po pečlivém zvážení očekávaného prospěchu a možného rizika. Ve studii provedené u novorozenců žen, které byly během těhotenství léčeny vankomycinem, nebyly percepční ztráta sluchu nebo nefrotoxicita hlášeny. Jedno dítě, jehož matka dostala vankomycin ve třetím trimestru těhotenství, bylo postiženo vodivou ztrátou sluchu, ale bez nalezení příčinné souvislosti s léčbou. Kojení Vankomycin se vylučuje do mateřského mléka, a proto by se v období kojení měl podávat pouze tehdy, jestliže jiná antibiotika selhala. Vankomycin je třeba podávat kojícím matkám opatrně, protože je možnost výskytu nežádoucích účinků u novorozenců (poruchy střevní flory a průjmy, osídlení kvasinkami a možná senzibilizace). 6
7 Po dobře uváženém závěru, že tato léčivá látka je pro kojící matku důležitá, je třeba rozhodnout, zda má kojení ukončit. Vankomycin je vylučován do mateřského mléka, a neměl by se proto používat u kojících žen. 4.7 Účinky na schopnost řídit a obsluhovat stroje Vankomycin nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. 4.8 Nežádoucí účinky V každé skupině četností jsou nežádoucí účinky seřazeny podle klesající závažnosti. Nežádoucí účinky, uvedené níže, jsou definovány za použití MedDRA klasifikace a dle systému orgánového třídění: Velmi časté ( 1/10) Časté ( 1/100 až < 1/10) Méně časté ( 1/1000 až < 1/100) Vzácné ( 1/ až < 1/1000) Velmi vzácné (< 1/10 000) Není známo (nelze odhadnout z dostupných údajů) Mezi nejčastější nežádoucí účinky patří zánět žil a pseudo-alergické reakce v souvislosti s příliš rychlým intravenózním podáním vankomycinu. Poruchy krve a lymfatického systému Vzácné ( 1/10 000, < 1/1 000): trombocytopenie, neutropenie, agranulocytosa, eosinofilie Poruchy imunitního systému Vzácné ( 1/10 000, < 1/1 000): anafylaktické reakce, hypersenzitivní reakce Poruchy ucha a labyrintu Méně časté ( 1/1 000, < 1/100): přechodná nebo trvalá ztráta sluchu Vzácné ( 1/10 000, < 1/1 000): tinnitus, závratě Srdeční poruchy Velmi vzácné (< 1/10 000): srdeční zástava Cévní poruchy Časté ( 1/100, < 1/10): pokles krevního tlaku, tromboflebitida Vzácné ( 1/10 000, < 1/1 000): vaskulitida Respirační, hrudní a mediastinální poruchy Časté ( 1/100, < 1/10): dušnost, stridor Gastrointestinální poruchy Vzácné ( 1/10 000, < 1/1 000): nauzea Velmi vzácné (< 1/10 000): pseudomembranózní enterokolitida Poruchy jater a žlučových cest Není známo (nelze určit s dostupných údajů): testy jaterních funkcí mohou být zdvojeny u pacientů vystavených vankomycinu. Poruchy kůže a podkožní tkáně Časté ( 1/100, < 1/10): vyrážka a zánět sliznic, svědění, kopřivka Velmi vzácné (< 1/10 000): exfoliativní dermatitida, Stevens-Johnsonův syndrom, Lyellův syndrom, bulózní dermatitida vyvolaná IgA 7
8 Poruchy ledvin a močových cest Časté ( 1/100, < 1/10): renální insuficience s primárními projevy zvýšené koncentrace kreatininu nebo močoviny v séru Vzácné ( 1/10 000, < 1/1 000): intersticiální nefritida, akutní selhání ledvin Celkové poruchy a reakce v místě aplikace: Časté ( 1/100, < 1/10): zarudnutí horní poloviny těla a obličeje, bolest a křeče hrudních a zádových svalů Vzácné ( 1/10 000, < 1/1 000): léková horečka, svalový třes Během infuze nebo krátce po rychlé infuzi může dojít k anafylaktické reakci. Reakce se zmírní, když je infuze přerušena, a poté obvykle zcela vymizí mezi 20 minutami až 2 hodinami. Ototoxicita byla primárně pozorována u pacientů, kteří dostávali vysoké dávky přípravku nebo byli současně léčeni jinými ototoxickými přípravky nebo pokud měli preexistující poruchu funkce ledvin nebo sluchu. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv Šrobárova Praha 10 Webové stránky: Předávkování Toxicita v důsledku předávkování byla hlášena. Podání dávky 500 mg i.v. dvouletému dítěti mělo za následek smrtelnou intoxikaci. Podání celkem 56 g během 10 dní dospělému pacientovi způsobilo selhání ledvin. V některých vysoce rizikových podmínkách (např. v případě závažné poruchy ledvin) se mohou objevit vysoké hladiny vankomycinu v séru a ototoxické/ nefrotoxické účinky. Opatření při předávkování Specifické antidotum není známo. Je nutná symptomatická terapie a udržování renálních funkcí. Vankomycin se hemodialýzou nebo peritoneální dialýzou odstraňuje špatně. Ke snížení koncentrací vankomycinu v séru byla použita hemofiltrace nebo hemoperfuze polysulfonovými pryskyřicemi. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Antibakteriální léčiva pro systémovou aplikaci, jiná antibakteriální léčiva, glykopeptidová antibiotika, ATC kód: J01XA01. Mechanismus účinku Vankomycin je glykopeptidové antibiotikum. Vankomycin má baktericidní účinek na proliferaci bakterií inhibicí biosyntézy buněčné stěny. Kromě toho narušuje permeabilitu bakteriální buněčné membrány a RNA syntézu. 8
9 Mechanismus vzniku rezistence Získaná rezistence na glykopeptidy je založena na získávání různých van genových komplexů. Van geny byly vzácně nalezeny u Staphylococcus aureus, kde změny ve struktuře buněčné stěny mají za následek "střední" citlivost, což je obvykle nejvíce rozšířené. Neexistuje žádná zkřížená rezistence mezi vankomycinem a jinými antibiotiky, ale dochází ke zkřížené rezistenci s jinými glykopeptidovými antibiotiky, jako je teikoplanin. Rozvoj sekundární rezistence během léčby je vzácný. V některých zemích jsou případy rezistence pozorovány především u enterokoka. Výskyt multirezistentních kmenů Enterococcus faecium je obzvláště alarmující. Synergismus Kombinace vankomycinu s aminoglykosidovým antibiotikem synergicky působí proti četným kmenům Staphylococcus aureus, neenterokokových D-streptokoků, enterokoků a streptokoků skupiny viridans. Kombinace vankomycinu s cefalosporinem synergicky působí proti některým oxacilinrezistentním kmenům Staphylococcus epidermidis a kombinace vankomycinu s rifampicinem působí synergicky na některé kmeny Staphylococcus aureus. Protože kombinace vankomycinu s cefalosporinem při působení proti některým kmenům Staphylococcus epidermidis a kombinace vankomycinu s rifampicinem při působení proti některým kmenům Staphylococcus aureus se může i antagonizovat, je vhodné předem synergismus otestovat. Je třeba získat bakteriální vzorky pro kultivaci s cílem izolace a identifikace vyvolávajících mikrobů a zjištění jejich citlivosti na vankomycin. Hraniční hodnoty Hraniční hodnoty minimální inhibiční koncentrace (MIC) stanovené Evropským výborem pro testování antimikrobiální citlivosti (EUCAST) jsou pro Staphylococcus spp. a Streptococcus spp. : Citlivé Rezistentní Staphylococcus spp. 2 mg/l > 2 mg/l Enterococcus spp 4 mg/l > 4 mg/l Streptococcus spp. 2 mg/l > 2 mg/l Streptococcus penumoniae 2 mg/l > 2 mg/l Gram-pozitivní anaeroby 2 mg/l 2 mg/l Nepříbuzné druhy* 2 mg/l > 4 mg/l *Hraniční hodnoty nepříbuzných druhů byly určeny zejména na základě PK/PD dat a jsou nezávislé na distribuci MIC specifických druhů. Jsou určeny k použití pouze pro druhy, pro které neexistují specifické hraniční hodnoty a ne pro ty druhy, u kterých není testování citlivosti doporučeno. Citlivost Prevalence získané rezistence se může lišit geograficky a v čase pro vybrané kmeny a jsou potřebné i místní informace o rezistenci zejména při léčbě závažných infekcí. Podle potřeby by mělo být k dispozici odborné poradenství, jestliže lokální výskyt rezistence je takový, že prospěšnost léčiva je přinejmenším u některých typů infekce sporná. Vankomycin má úzké spektrum účinku. Třídy Běžně citlivé druhy Grampozitivní aerobní druhy Bacillus spp. Enterococcus spp. Enterococcus faecalis Listeria spp. Rhodococcus equi 9
10 Staphylococcus spp. Staphylococcus aureus Staphylococcus coagulase negative Staphylococcus epidermidis Streptococcus spp. Streptococcus pneumonia Corynebacterium spp. Druhy, pro které může být požadovaná rezistence problém Enterococcus faecium Streptococcus bovis Streptococcus viridans Inherentně rezistentní Gramnegativní aerobní druhy Cocci and bacilli Chlamydia spp. Mycobacteria Mycoplasma spp. Rickettsia spp. Treponema spp. 5.2 Farmakokinetické vlastnosti Distribuce Po intravenózním podání se vankomycin distribuuje téměř do všech tkání a difunduje do pleurální, perikardiální, ascitické a synoviální tekutiny i do srdečního svalu a srdečních chlopní. Dosahuje zde srovnatelných koncentrací jako v krevní plazmě. Údaje o koncentracích v kosti (ve spongióze, v kompaktě) jsou velmi rozdílné. Zdánlivý distribuční objem za rovnovážného stavu je určen jako hodnota 0,43 (až 0,9) l/kg. Skrz nezánětlivé meningy prochází vankomycin hematoencefalickou bariérou jen v nepatrné míře. Vankomycin je z 30 až 55 % a někdy i více vázán na plazmatické bílkoviny. Eliminace Metabolizuje se pouze v malém rozsahu. Po parenterálním podání se vylučuje téměř kompletně jako mikrobiologicky aktivní látka (přibližně % během 24 hodin) glomerulární filtrací ledvinami. Biliární exkrece je nevýznamná (méně než 5 % podané dávky). U pacientů s normální funkcí ledvin je poločas v séru zhruba 4-6 (5-11) hodin, u dětí 2,2-3 hodiny. Při poruše renálních funkcí se poločas vankomycinu může značně prodloužit (až na 7,5 dne). V takových případech je vzhledem k ototoxicitě vankomycinu indikováno monitorování plazmatických koncentrací. Průměrné plazmatické koncentrace po IV infuzi 1 g vankomycinu po dobu 60 minut byly kolem 63 mg/l ke konci infuze, zhruba 23 mg/l za 2 hodiny a asi 8 mg/l po 11 hodinách. Plazmatická clearance vankomycinu úzce koreluje s glomerulární filtrací. Celková systémová a renální clearance vankomycinu mohou být u starších pacientů sníženy. Jak ukazují studie u anefrických pacientů, metabolická clearance se zdá být velmi malá. U člověka dosud nebyly identifikovány žádné metabolity vankomycinu. Podává-li se vankomycin v průběhu peritoneální dialýzy intraperitoneálně, vstoupí do systémové cirkulace v průběhu 6 hodin cca 60 % podaného množství. Po i.p. podání vankomycinu v dávce 30 mg/kg tělesné hmotnosti je dosaženo sérových hladin přibližně 10 mg/l. 10
11 Po perorálním podání se vysoce polární vankomycin prakticky neabsorbuje. Po perorální aplikaci se objeví v aktivní formě ve stolici, a představuje proto vhodné chemoterapeutikum při pseudomembranózní a stafylokokové kolitidě. Vankomycin snadno přestupuje přes placentu a je distribuován do pupečníkové krve. 5.3 Předklinické údaje vztahující se k bezpečnosti Neklinické údaje získané na základě konvenčních farmakologických studií bezpečnosti a toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro člověka. Omezené údaje o mutagenních účincích ukazují negativní výsledky, dlouhodobé studie u zvířat týkající se kancerogenního potenciálu nejsou k dispozici. Ve studiích teratogenity, ve kterých potkani a králíci dostávali dávky přibližně odpovídající dávkám pro člověka v přepočtu na povrchu těla (mg/m2), nebyl pozorován žádný přímý nebo nepřímý teratogenní účinek. Nejsou k dispozici žádné studie na zvířatech týkající se perinatálního/postnatálního období a studie týkající se účinků na fertilitu. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Tento léčivý přípravek neobsahuje žádné pomocné látky. 6.2 Inkompatibility Vankomycin má nízké ph, což může způsobit chemickou nebo fyzikální nestabilitu po smísení s jinými látkami. Proto má být každý parenterální roztok před použitím vizuálně zkontrolován s ohledem na přítomnost sraženin a změnu barvy. Tento léčivý přípravek nesmí být mísen s jinými léčivými přípravky s výjimkou těch, které jsou uvedeny v bodě 6.6. Kombinovaná léčba V případě kombinační léčby vankomycinem s jinými antibiotiky/chemoterapeutiky by přípravky měly být podávány odděleně. Směsi roztoků vankomycinu a beta-laktamových antibiotik se ukázaly být fyzikálně nekompatibilní. Pravděpodobnost vysrážení se zvyšuje se zvyšující se koncentrací vankomycinu. Doporučuje se adekvátně propláchnout intravenózní linky mezi podáním těchto antibiotik. Rovněž se doporučuje naředit roztoky vankomycinu na koncentraci 5 mg/ml nebo nižší. 6.3 Doba použitelnosti Prášek 3 roky Rekonstituovaný roztok Chemická a fyzikální stabilita přípravku po otevření před použitím byla prokázána na dobu 48 hodin při pokojové teplotě ( 25 C) a při teplotě 2º až 8ºC. Z mikrobiologického hlediska má být přípravek použit okamžitě. Pokud není použit okamžitě, doba a podmínky uchovávání přípravku po otevření před použitím jsou v odpovědnosti uživatele a normálně by tato doba neměla být delší než 24 hodin při teplotě 2 až 8 ºC, pokud rekonstituce/ředění neproběhlo za kontrolovaných a validovaných aseptických podmínek. 11
12 6.4 Zvláštní opatření pro uchovávání Uchovávejte při teplotě do 25 C. Uchovávejte injekční lahvičku v krabičce, aby byl přípravek chráněn před světlem. Rekonstituce a stabilita viz bod Druh obalu a obsah balení 10 nebo 20ml injekční lahvička z bezbarvého skla typu I s pryžovou zátkou a hliníkovým víčkem s plastovým flip-off uzávěrem, krabička. Velikost balení: 1 a 10 injekčních lahviček. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním Přípravek musí být rekonstituován a vzniklý koncentrát musí být před podáním dále naředěn. Příprava rekonstituovaného roztoku Vancomycin 500 mg prášek pro infuzní roztok se rozpustí v 10 ml sterilní vody na injekci. Vancomycin 1000 mg prášek pro infuzní roztok se rozpustí ve 20 ml sterilní vody na injekci. Jeden ml rekonstituovaného roztoku obsahuje 50 mg vankomycinu. Vzhled rekonstituovaného roztoku Po rozpuštění je roztok čirý a bezbarvý až slabě hnědě nažloutlý bez viditelných částic. Podmínky uchovávání rekonstituovaného léčivého přípravku, viz bod 6.3. Příprava konečného naředěného infuzního roztoku Rekonstituované roztoky obsahující 50 mg/ml vankomycinu je třeba dále ředit. Vhodná rozpouštědla jsou: 5% glukóza na injekce 0,9% chlorid sodný na injekce Intermitentní infuze: Rekonstituované roztoky, které obsahují 500 mg vankomycinu (50 mg/ml), musí být dále naředěny alespoň 100 ml rozpouštědla (do 5 mg/ml). Rekonstituované roztoky, které obsahují 1000 mg vankomycinu (50 mg/ml), musí být dále naředěny nejméně 200 ml rozpouštědla (do 5 mg/ml). Koncentrace vankomycinu v infuzním roztoku nemá překročit 5 mg/ml. Potřebná dávka má být podávána pomalu intravenózně rychlostí nejvýše 10 mg / minutu po dobu nejméně 60 minut nebo i déle. Kontinuální infuze: Toto podání má být použito pouze v případě, kdy léčba intermitentní infuzi není možná mg až 2000 mg rekonstituovaného vankomycinu se naředí v dostatečném množství výše uvedených vhodných rozpouštědel a aplikuje se v podobě kapací infuze tak, aby pacient dostal předepsanou denní dávku v průběhu 24 hodin. Perorální podání: rekonstituované roztoky, které obsahují 500 mg a 1000 mg vankomycinu, lze naředit 30 ml vody a pacient je buď vypije, nebo mu mohou být podány nazogastrickou sondou. Vzhled zředěného roztoku 12
13 Po naředění je roztok čirý, bez cizích částic. Podmínky uchovávání naředěného léčivého přípravku viz bod 6.3. Před podáním je nutno rekonstituované a naředěné roztoky vizuálně zkontrolovat z hlediska přítomnosti částic a změn barvy. Pouze čiré a bezbarvé roztoky bez částic mohou být použity. Likvidace Lahvičky jsou určeny pouze pro jednorázové použití. Nepoužitý přípravek musí být zlikvidován. Všechen nepoužitý přípravek nebo odpadní materiál musí být zlikvidovány v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI PharmaSwiss Česká republika s.r.o. Praha, Česká republika 8. REGISTRAČNÍ ČÍSLA VANCOMYCIN PHARMASWISS 500 mg: 15/774/10-C VANCOMYCIN PHARMASWISS 1000 mg: 15/775/10-C 9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: Datum posledního prodloužení registrace: DATUM REVIZE TEXTU
Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU VANCOMYCIN PHARMASWISS 500 mg, prášek pro přípravu infuzního roztoku VANCOMYCIN PHARMASWISS
Příloha č. 2 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU VANCOMYCIN PHARMASWISS 500 mg, prášek pro přípravu infuzního roztoku VANCOMYCIN PHARMASWISS
Prášek pro koncentrát pro infuzní roztok Popis přípravku Bílý až téměř bílý prášek.
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls240195/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 500 mg Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls240195/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 500 mg Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 1 NÁZEV PŘÍPRAVKU Vankomycin Pfizer 1 000 mg prášek pro koncentrát pro infuzní roztok SOUHRN
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls238427/2011 a příloha ke sp. zn. sukls175846/2011 1 NÁZEV PŘÍPRAVKU Vankomycin Pfizer 1 000 mg prášek pro koncentrát pro infuzní roztok SOUHRN
Sp. zn. sukls211423/2014, sukls211424/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU. Vancomycin Mylan 1000 mg. Prášek pro infuzní roztok.
 Sp. zn. sukls211423/2014, sukls211424/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro infuzní roztok vancomycini hydrochloridum 2. KVALITATIVNÍ
Sp. zn. sukls211423/2014, sukls211424/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro infuzní roztok vancomycini hydrochloridum 2. KVALITATIVNÍ
Jedna injekční lahvička obsahuje vancomycinum 1000 mg (jako vancomycini hydrochloridum), což odpovídá IU
 Sp. zn. sukls59024/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
Sp. zn. sukls59024/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Actavis 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna injekční lahvička obsahuje
Prášek pro koncentrát pro infuzní roztok. Popis přípravku: bílý až krémový porézní koláč.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls116891/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Kabi 500 mg Vancomycin Kabi 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls116891/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Kabi 500 mg Vancomycin Kabi 1000 mg prášek pro koncentrát pro infuzní roztok
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls158128/2011, sukls158129/2011
 Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls158128/2011, sukls158129/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vancomycin Hikma 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin
Příloha č. 2 k rozhodnutí o registraci sp.zn. sukls158128/2011, sukls158129/2011 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vancomycin Hikma 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls123767/2010 a příloha k sp.zn.sukls77214/2010
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls123767/2010 a příloha k sp.zn.sukls77214/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Sandoz 0,5 g Vancomycin Sandoz 1 g Prášek pro
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls123767/2010 a příloha k sp.zn.sukls77214/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vancomycin Sandoz 0,5 g Vancomycin Sandoz 1 g Prášek pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
sp.zn. sukls71941/2012 a sukls103573/2013, sukls103568/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin Mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Natrii fusidas 20,0 mg v 1 g masti.
Příbalová informace: informace pro uživatele
 Sp.zn.sukls95746/2013, sukls95749/2013 Příbalová informace: informace pro uživatele Vancomycin PharmaSwiss 500 mg, prášek pro infuzní roztok Vancomycin PharmaSwiss 1000 mg, prášek pro infuzní roztok Vancomycini
Sp.zn.sukls95746/2013, sukls95749/2013 Příbalová informace: informace pro uživatele Vancomycin PharmaSwiss 500 mg, prášek pro infuzní roztok Vancomycin PharmaSwiss 1000 mg, prášek pro infuzní roztok Vancomycini
Vankomycin Mylan se může užít i perorálně (ústy) k léčbě závažných infekcí zažívacího taktu způsobených bakteriemi citlivými na vankomycin.
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls30246/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro přípravu infuzního roztoku vancomycini
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls30246/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro přípravu infuzního roztoku vancomycini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 1 k opravě rozhodnutí o registraci sp.zn. sukls /2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin PharmaSwiwss 500 mg, prášek pro přípravu infuzního roztoku Vancomycin PharmaSwiss
Příloha č. 1 k opravě rozhodnutí o registraci sp.zn. sukls50800-1/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin PharmaSwiwss 500 mg, prášek pro přípravu infuzního roztoku Vancomycin PharmaSwiss
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
2. Čemu musíte věnovat pozornost, než začnete přípravek Vancomycin CNP Pharma používat
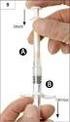 sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
sp.zn. sukls58585/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin CNP Pharma 500 mg Vancomycin CNP Pharma 1000 mg prášek pro infuzní roztok vancomycinum Přečtěte si pozorně celou příbalovou
Sp. zn. sukls211423/2014, sukls211424/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Vancomycin Mylan 1000 mg
 Sp. zn. sukls211423/2014, sukls211424/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro infuzní roztok vancomycini hydrochloridum Přečtěte si
Sp. zn. sukls211423/2014, sukls211424/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vancomycin Mylan 500 mg Vancomycin Mylan 1000 mg prášek pro infuzní roztok vancomycini hydrochloridum Přečtěte si
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010
 Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 ke sdělení sp.zn. sukls165503/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro přípravu injekčního roztoku (cefotaximum natricum) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls2393/2008, sukls2394/2008 a příloha k sp.zn.: sukls185930/2010, sukls185937/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls2393/2008, sukls2394/2008 a příloha k sp.zn.: sukls185930/2010, sukls185937/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Targocid 200
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls2393/2008, sukls2394/2008 a příloha k sp.zn.: sukls185930/2010, sukls185937/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Targocid 200
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DURACEF 250 mg DURACEF 500 mg Tvrdé tobolky. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: cefadroxilum monohydricum, v množství odpovídajícím cefadroxilum
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
sp.zn.: sukls243839/2011 a sp.zn.: sukls113646/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum 10,0 mg (odpovídá
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls135179/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls194588/2016, sukls194590/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vancomycin Olikla 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin Olikla 1000 mg prášek pro koncentrát pro
Sp.zn. sukls194588/2016, sukls194590/2016 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU Vancomycin Olikla 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin Olikla 1000 mg prášek pro koncentrát pro
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vanmicira 500 mg prášek pro koncentrát pro infuzní roztok Vanmicira 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vanmicira 500 mg prášek pro koncentrát pro infuzní roztok Vanmicira 1000 mg prášek pro koncentrát pro infuzní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
sp.zn.sukls209717/2018 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fenistil 1 mg/g gel 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram gelu obsahuje dimetindeni maleas 1 mg. Pomocné látky se známým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DOXIUM 500 500 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tvrdá tobolka obsahuje calcii dobesilas monohydricus 500 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls56216/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septabene 1,5 mg/ml + 5,0 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje, roztoku obsahuje
Sp. zn. sukls56216/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Septabene 1,5 mg/ml + 5,0 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml orálního spreje, roztoku obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls79120/2012 1. NÁZEV PŘÍPRAVKU NIZORAL krém SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ketoconazolum 20,0 mg v 1 g krému Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp. zn. sukls230046/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
sp.zn.: sukls7967/2011
 sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
sp.zn.: sukls7967/2011 Souhrn údajů o přípravku. 1. NÁZEV PŘÍPRAVKU sáčky 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna tobolka obsahuje léčivou látku: Lysatum bacteriale OM 85 cryodesicatum, odpovídá
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
sp. zn. sukls179223/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN BEZ CUKRU 1,2 mg/0,6 mg/5,72 mg Pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje: alcohol dichlorbenzylicus
Granule pro perorální roztok. Bílé až téměř bílé granule v jednodávkovém sáčku.
 Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Sp.zn.sukls70977/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Fosfomycin LadeePharma 3 g Granule pro perorální roztok 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fosfomycinum trometamoli. Jeden jednodávkový
Vanmicira 500 mg prášek pro koncentrát pro infuzní roztok Vanmicira 1000 mg prášek pro koncentrát pro infuzní roztok. vancomycinum
 Příbalová informace: informace pro uživatele Vanmicira 500 mg prášek pro koncentrát pro infuzní roztok Vanmicira 1000 mg prášek pro koncentrát pro infuzní roztok vancomycinum Přečtěte si pozorně celou
Příbalová informace: informace pro uživatele Vanmicira 500 mg prášek pro koncentrát pro infuzní roztok Vanmicira 1000 mg prášek pro koncentrát pro infuzní roztok vancomycinum Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls53327/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Laevolac 10 g/15 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
sp.zn. sukls221497/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucicort Krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Acidum fusidicum 20,0 mg (jako acidum fusidicum hemihydricum) Betamethasonum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
PŘÍLOHA III. Tato doplnění odpovídajících částí informací o přípravku jsou výsledkem referalu (the referral procedure).
 PŘÍLOHA III Doplnění odpovídajících částí souhrnu údajů o přípravku a příbalové informace Poznámka: Tato doplnění odpovídajících částí informací o přípravku jsou výsledkem referalu (the referral procedure).
PŘÍLOHA III Doplnění odpovídajících částí souhrnu údajů o přípravku a příbalové informace Poznámka: Tato doplnění odpovídajících částí informací o přípravku jsou výsledkem referalu (the referral procedure).
sp.zn.: sukls49677/2013
 sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
sp.zn.: sukls49677/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml. Jedna odměřená dávka obsahuje
Přecitlivělost na léčivé látky nebo na kteroukoliv z pomocných látek uvedených v bodě 6.1.
 sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
sp.zn.: sukls50035/2010, sukls106419/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H rektální mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 g Selachiorum
AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok
 www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
www.lekarna-madona.cz zpět na stránku produktu zpět na obdobná léčiva SOUHRN ÚDAJŮ O PŘÍPRAVKU 1.NÁZEV PŘÍPRAVKU: AJATIN PROFARMA tinktura s mechanickým rozprašovačem kožní roztok 2.KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Shotapen injekční suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1ml obsahuje: Léčivé látky: Benzylpenicillinum (ut benzathinum)...
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných látek viz bod 6.1.
 Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
Sp. zn. sukls155368/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Silkis mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 g masti obsahuje calcitriolum 0,003 mg (3 mikrogramy). Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
sp.zn. sukls83386/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NIZORAL šampon 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden gram šamponu obsahuje ketoconazolum 20 mg. Úplný seznam pomocných látek viz
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls8465/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. Název přípravku E-Z-HD 2. Kvalitativní a kvantitativní složení Léčivá látka: Barii sulfas (síran barnatý)
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
sp.zn. sukls69093/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Ibalgin gel 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Ibuprofenum 2,5 g v 50 g gelu nebo 5 g ve 100 g gelu. Pomocná látka se známým účinkem:
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 3. LÉKOVÁ FORMA Tvrdé tobolky Tvrdé, bílé, želatinové tobolky obsahující bílý, homogenní prášek.
 sp.zn.sukls123276/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACC 200, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acetylcysteinum 200 mg v jedné tobolce. Úplný seznam pomocných látek viz
sp.zn.sukls123276/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ACC 200, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acetylcysteinum 200 mg v jedné tobolce. Úplný seznam pomocných látek viz
4.2 Dávkování a způsob podání Dospělí a děti Fucidin H krém se aplikuje na postižená místa na kůži 3 krát denně po dobu maximálně 2 týdnů.
 sp.zn. sukls65852/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin H krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 20,35 mg/g (odpovídá acidum fusidicum 20 mg/g), hydrocortisoni
sp.zn. sukls65852/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin H krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 20,35 mg/g (odpovídá acidum fusidicum 20 mg/g), hydrocortisoni
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
Příbalová informace: informace pro pacienta
 Sp.zn. sukls194588/2016, sukls194590/2016 Příbalová informace: informace pro pacienta Vancomycin Olikla 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin Olikla 1000 mg prášek pro koncentrát pro
Sp.zn. sukls194588/2016, sukls194590/2016 Příbalová informace: informace pro pacienta Vancomycin Olikla 500 mg prášek pro koncentrát pro infuzní roztok Vancomycin Olikla 1000 mg prášek pro koncentrát pro
Souhrn údajů o přípravku
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Luivac 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 tableta obsahuje 3 mg Lysatum bacteriale mixtum ex min. 1x10 9 bakterií z každého následujícího
PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA. AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum
 sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
sp. zn. sukls76225/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA AMPICILIN 0,5 BIOTIKA AMPICILIN 1,0 BIOTIKA Prášek pro injekční roztok ampicillinum Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
Příloha k sp. zn. sukls224939/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Molaxole prášek pro přípravu perorálního roztoku 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden sáček obsahuje následující
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls195317/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin-POS 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini
sp.zn.: sukls76674/2014
 sp.zn.: sukls76674/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX 125 mikrogramů/dávka, nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml roztoku.
sp.zn.: sukls76674/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BIOPAROX 125 mikrogramů/dávka, nosní/orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Fusafunginum 500 mg ve 100 ml roztoku.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
Příloha č. 3 k rozhodnutí o registraci sp. zn. sukls115710/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GLYPRESSIN 1 mg injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna ampule s 8,5 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls66153/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá mupirocinum 0,06
sp.zn.sukls66153/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Mupirocinum calcicum 0,0645 g (což odpovídá mupirocinum 0,06
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
sp.zn.sukls149832/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cefotaxime Lek 1 g prášek pro injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna lahvička obsahuje cefotaximum natricum 1,05
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls3523/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tuba (3 g) obsahuje mupirocinum 0,06 g (jako mupirocinum
sp.zn. sukls3523/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Bactroban Nasal 20 mg/g nosní mast 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tuba (3 g) obsahuje mupirocinum 0,06 g (jako mupirocinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls25846/2010 a sukls25848/2010 a příloha ke sp. zn. sukls156917/2010 a sukls157010/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU Pentasa Sachet
Gynekologie: Metroragie, primární menoragie nebo menoragie související s nitroděložním tělískem bez prokazatelné organické příčiny.
 Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
Sp.zn.sukls81671/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Cyclonamine 500 mg Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg. Léčivý přípravek obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
Florfeni-kel 300mg/ml inj. 100ml
 Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
Florfeni-kel 300mg/ml inj. 100ml Popis zboží: FLORFENIKEL 300 mg/ml injekční roztok pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každý mililitr obsahuje Léčivá látka: Florfenicolum 300 mg Úplný
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele
 sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
sp. zn. sukls93968/2015 Příbalová informace: informace pro uživatele Targocid 200 mg Targocid 400 mg prášek a rozpouštědlo pro injekční/infuzní roztok nebo perorální roztok teicoplaninum Tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 200 mg (= 82,0 mg alaninum; 134,6 mg glutaminum)
 sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
sp.zn. sukls108778/2012 1. NÁZEV PŘÍPRAVKU Dipeptiven Koncentrát pro přípravu infuzního roztoku SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml koncentrátu pro přípravu infuzního
Příbalová informace: informace pro pacienta
 Sp. zn. sukls59023/2013, sukls59024/2013 Příbalová informace: informace pro pacienta Vancomycin Actavis 500 mg Vancomycin Actavis 1 000 mg prášek pro koncentrát pro infuzní roztok vancomycinum Přečtěte
Sp. zn. sukls59023/2013, sukls59024/2013 Příbalová informace: informace pro pacienta Vancomycin Actavis 500 mg Vancomycin Actavis 1 000 mg prášek pro koncentrát pro infuzní roztok vancomycinum Přečtěte
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jeden impregnovaný obvaz o velikosti 10 cm x 10 cm obsahuje natrii fusidas 30 mg.
 Sp.zn.sukls116108/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin impregnovaný obvaz 30 mg/100 cm 2 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden impregnovaný obvaz o velikosti 10 cm x 10 cm obsahuje
Sp.zn.sukls116108/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucidin impregnovaný obvaz 30 mg/100 cm 2 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden impregnovaný obvaz o velikosti 10 cm x 10 cm obsahuje
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp. zn. Sukls121294/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
Sp. zn. Sukls121294/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T 10 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini phosphas je ve vodě rozpustný ester polosyntetického antibiotika vytvářeného
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU DALACIN T 10 mg/ml kožní roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Clindamycini phosphas je ve vodě rozpustný ester polosyntetického antibiotika vytvářeného
Přípravek Neo-angin třešeň je určen pro dospělé, dospívající a děti od 6 let.
 sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
sp.zn. sukls21393/2010 a sp,zn. sukls6362/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NEO-ANGIN TŘEŠEŇ 1,2 mg/0,6 mg/ 5,9 mg pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje
Nepřekračujte doporučené dávkování. Pokud lékař neurčí jinak, léčba nesmí přesáhnout 7 dnů.
 Sp.zn.sukls257866/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Garganta 3 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje benzydamini hydrochloridum 3 mg,
Sp.zn.sukls257866/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Garganta 3 mg/ml orální sprej, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje benzydamini hydrochloridum 3 mg,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls147367/2013 a sp.zn. sukls83349/2015, sukls83357/2015, sukls151866/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duphalac se švestkovou příchutí, 667 mg/ml, perorální roztok 2. KVALITATIVNÍ
Sp.zn.sukls147367/2013 a sp.zn. sukls83349/2015, sukls83357/2015, sukls151866/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Duphalac se švestkovou příchutí, 667 mg/ml, perorální roztok 2. KVALITATIVNÍ
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum
 PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE - INFORMACE PRO UŽIVATELE MAXIPIME 1 g MAXIPIME 2 g prášek pro injekční roztok cefepimi hydrochloridum monohydricum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
sp.zn.: sukls130790/2012
 sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
sp.zn.: sukls130790/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Hiberix Vakcína proti Haemophilus influenzae typu b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Po rekonstituci 1 dávka (0,5 ml) obsahuje:
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum
 sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
sp.zn.sukls149832/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cefotaxime Lek 1 g prášek pro injekční roztok cefotaximum Přečtěte si pozorně celou příbalovou informace dříve, než začnete tento přípravek
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
Přípravek Dicynone 250, injekční roztok je indikován u dospělých, dětí a novorozenců.
 sp.zn. sukls224465/2009 a sp.zn. sukls119748/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 250, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ l ampulka obsahuje etamsylatum 250mg
sp.zn. sukls224465/2009 a sp.zn. sukls119748/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 250, injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ l ampulka obsahuje etamsylatum 250mg
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glypressin 1 mg, prášek pro přípravu injekčního roztoku
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls80267/2010 a příloha k sp.zn. sukls40641/2007 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Glypressin 1 mg, prášek pro přípravu injekčního roztoku
V gynekologii: Metrorhagie, primární nebo nitroděložními tělísky způsobená menorhagie s vyloučením organických příčin.
 sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
sp.zn. sukls131149/2012 a sp.zn. sukls119721/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU l. NÁZEV PŘÍPRAVKU Dicynone 500 Tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje etamsylatum 500 mg.
