Antitrombotická. ochrana, na kterou se můžete spolehnout. Maximalizuje účinnost, minimalizuje obavy
|
|
|
- Radovan Kašpar
- před 8 lety
- Počet zobrazení:
Transkript
1 Antitrombotická ochrana, na kterou se můžete spolehnout Maximalizuje účinnost, minimalizuje obavy
2 Všeobecná chirurgie
3 Žilní tromboembolismus* a krvácení jsou závažnými hrozbami po výkonech ve všeobecné chirurgii Průměrná frekvence hluboké žilní trombózy bez profylaxe: až 30 % pacientů po všeobecném chirurgickém výkonu 1 Všeobecná chirurgie Zvýšené riziko žilního tromboembolismu a krvácení u onkologických pacientů 2 Incidence klinické VTE podle typu operace Incidence závažného krvácení podle typu operace 3 x1, x3 8,1 Incidence (%) 2 1 1,2 1,8 Incidence (%) 6 4 2,7 2 0 Neonkologická operace Hodnoty jsou korigované incidence Onkologická operace 0 Neonkologická operace Hodnoty jsou korigované incidence Onkologická operace Hodnoty převzaty z Mismetti P et al. Br J. Surg 2001; 88: (tabulka 6). Hodnoty převzaty z Mismetti P et al. Br J. Surg 2001; 88: (tabulka 6). Metodologie Mismetti P et al: Data byla získána z meta-analýzy randomizovaných klinických studií ve všeobecné chirurgii, které srovnávaly LMWH oproti UFH (celkem více než pacientů). Incidence klinické VTE a incidence závažného krvácení se týká pacientů léčených UFH. Bezpečnost LMWH ve vztahu k UFH byla podobná u pacientů s nádorovým onemocněním jako u pacientů bez nádorového onemocnění. *Žilní tromboembolismus je defi nován jako hluboká žilní trombóza nebo plicní embolie. VTE: Žilní tromboembolismus DVT: Hluboká žilní trombóza Maximalizuje účinnost, minimalizuje obavy
4 Fraxiparine - optimální rovnováha mezi účinností Účinná ochrana proti hluboké žilní trombóze 2 1,2 1,0 0,8 0,96 Relativní riziko hluboké žilní trombózy 0,90 Ekvivalent UFH Metodologie Mismetti P et al: Údaje jsou získány z meta-analýzy randomizovaných klinických studií všeobecné chirurgie, které srovnávaly LMWH oproti UFH. Uvedené výsledky se vztahují k asymptomatické DVT. Riziko krvácení se ve skupině LMWH oproti skupině UFH nelišilo. RR 0,6 0,4 0,2 0,61 p = 0,70 p = 0,55 p = 0,02 Snížení rizika asymptomatického VTE oproti UFH 0 Enoxaparin n = studií Dalteparin n = studií Fraxiparine n = studií RR = relativní riziko Relativní riziko méně než 1 (s hodnotou p < 0,05) znamená, že LMWH je účinnější než UFH Hodnoty převzaty z Mismetti P et al. Br J. Surg 2001; 88: (tabulka 5). Pouze Fraxiparine významně snížil výskyt hluboké žilní trombózy ve srovnání s UFH. 2
5 a bezpečností Signifi kantně nižší výskyt závažného krvácení u přípravku Fraxiparine v porovnání s enoxaparinem 3 Citováno v Pacienti (%) Incidence závažného krvácení do dne RRR = 37 % ,5 % p = 0,012 7,3 % (72/628) (47/643) Metodologie Simonneau G et al: Prospektivní multicentrická randomizovaná dvojitě zaslepená klinická studie. Randomizováno celkem pacientů plánovaných k elektivní resekci kolorektálního karcinomu. 653 pacientů zařazeno do skupiny s Fraxiparinem (0,3 ml s.c. jednou denně) a 635 do skupiny s enoxaparinem (40 mg s.c. jednou denně) podávaných po dobu 9±2 dnů s první dávkou podanou 2 až 4 hodiny před operací. (Primární výsledný ukazatel účinnosti byl sdružený výskyt DVT při vyšetření bilaterální venografi í nebo doložená symptomatická DVT nebo plicní embolie do 12. dne. Hlavní výsledný ukazatel bezpečnosti bylo závažné krvácení). Enoxaparin 40 mg Fraxiparine 0,3 ml RRR = Snížení relativního rizika Výskyt VTE byl 15,9 % u pacientů léčených Fraxiparinem a 12,6 % u pacientů léčených enoxaparinem (NS) Četnost výskytu proximální DVT byla srovnatelná (3,2 % oproti 2,9 %), ale výskyt symptomatické VTE byl nižší u pacientů léčených Fraxiparinem (0,2 % oproti 1,4 %). Výskyt distální DVT byl nižší u pacientů léčených enoxaparinem. Hodnoty převzaty z Simonneau G al. Journal of Thrombosis and Haemostasis 2006; 4: (tabulka 5). Nutnost pooperační transfuzní léčby byla nižší u Fraxiparinu než u enoxaparinu ve smyslu počtu transfuzí (10,9 % oproti 16 %) a jejich průměrného objemu (600 ml oproti 750 ml). 3 Méně hematomů při Fraxiparinu než u enoxaparinu 4 * ACCP guidelines 2008 (American College of Chest Physicians) Maximalizuje účinnost, minimalizuje obavy
6 Dávkování Fraxiparinu Standardní subkutánní dávka pro všeobecný chirurgický výkon by měla být používána po celou dobu trvání rizika. Standardní dávka 0,3 ml* 5 Evidence-based guidelines pro tromboprofylaxi LMWH po propuštění z nemocnice: 1 U vybraných vysoce rizikových pacientů podstupujících výkon všeobecné chirurgie, včetně některých pacientů, kteří podstoupili rozsáhlou onkologickou operaci nebo kteří mají v anamnéze VTE, navrhujeme po propuštění z nemocnice zvážit pokračování tromboprofylaxe LMWH po dobu až 28 dnů od operace (Stupeň 2A). * Onkologická i neonkologická operace ACCP Guidelines 2008 (American College of Chest Physicians)
7 Předplněná injekční stříkačka Fraxiparinu. Vyrobeno s důrazem na bezpečnost KLAPNUTÍ ZARÁŽKY ZABEZPEČENO Fraxiparine se také dodává v lahvičce k opakovanému použití jako Maximalizuje účinnost, minimalizuje obavy
8 Při antitrombotické ochraně se spoléhejte na důkazy KDY U pacientů, kteří podstupují všeobecný chirurgický výkon, obzvláště u pacientů s nádorovým onemocněním. PROČ účinnost Fraxiparine je jediný LMWH, u kterého je v nejnovější meta-analýze prokázána schopnost významně snižovat výskyt pooperační hluboké žilní trombózy oproti UFH. 2 PROČ bezpečnost Při léčbě Fraxiparinem dochází k významně menšímu výskytu závažného krvácení než u enoxaparinu. 3 JAK Standardní dávka ve všeobecné chirurgii je 0,3 ml v předplněné bezpečnostní injekční stříkačce nebo z lahvičky k opakovanému použití. Maximalizuje účinnost, minimalizuje obavy
9 Literatura: 1. Geerts WH et al. Prevention of venous thromboembolism. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8 th Edition). Chest 2008;133: Mismetti P et al. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery. Br J Surg 2001;88: Simonneau G et al. A randomized study comparing the effi cacy and safety of nadroparin 2850 IU (0.3Ml) vs. enoxaparin 4000 IU (40 mg) in the prevention of venous thromboembolism after colorectal surgery for cancer. Journal of Thrombosis and Haemostasis 2006;4: Albanese C et al. Comparison of the local tolerability of two subcutaneous low molecular weight heparins: CY 216 and enoxaparin. Current Therapeutic Research 1992;51: SPC Fraxiparine Maximalizuje účinnost, minimalizuje obavy
10 Ortopedie
11 Žilní tromboembolismus* je u ortopedických pacientů závažný problém 1 Četnost hluboké žilní trombózy bez profylaxe: 1 např. náhrada kyčelního kloubu např. sádrová fi xace po operaci např. fraktura např. artroskopie Až 60 % po vysoce rizikové ortopedické operaci Až 45 % po izolované zlomenině dolní končetiny Až 16 % po artroskopii kolene Tromboembolismus může vzniknout až 6 týdnů po ortopedické operaci. 2 Ortopedie Pooperační přetrvávání rizika DVT** a PE Vysoce riziková ortopedická operace Až 6 týdnů Středně riziková ortopedická operace Až 5 týdnů Doba v týdnech po operaci Hodnoty převzaty z Monreal M et al J. Thromb Haemost 2004; 2: (tabulka 2). * Žilní tromboembolismus defi nován jako hluboká žilní trombóza nebo plicní embolie PE: Plicní embolie ** DVT: Hluboká žilní trombóza Maximalizuje účinnost, minimalizuje obavy
12 Fraxiparine - optimální rovnováha mezi účinností Fraxiparine poskytuje účinnou ochranu proti hluboké žilní trombóze u středně rizikových ortopedických pacientů. 3,4 Pacienti po artroskopii kolene: 3 incidence celkové VTE* 3,5 3,0 3,2 % Incidence celkové VTE* (%) 2,5 2,0 1,5 1,0 0,5 0,9 % p = 0,005 0 Kompresní punčochy n = 657 7denní profylaxe Fraxiparinem n = 657 *Celková VTE = asymptomatická proximální DVT, symptomatická VTE Hodnoty převzaty z Camporese G et al. Ann Intern Med. 2008;149:73-82 (tabulka 2). Pacienti s poraněním dolních končetin: celková incidence VTE 35 Bez tromboprofylaxe Fraxiparine Hluboká žilní trombóza (%) ,5 % 29,0 % p < 0,01 p < 0,005 p < 0,05 11,3 % 10,3 % 5 0 4,8 % 2,4 % Všechny případy Pacienti s poraněním měkkých tkání Pacienti se zlomeninami Hodnoty převzaty z Kujath P et al. Haemostasis 1993;23:20-6 (tabulka 2).
13 a bezpečností Fraxiparine vykazuje příznivý bezpečnostní profi l. 3,4 Pacienti (%) 2,0 1,5 1,0 0,5 0 Pacienti podstupující artroskopii kolene: výskyt závažného krvácení 0,2 % Kompresní punčochy n = 657 0,3 % 7denní profylaxe Fraxiparinem n = 657 Metodologie Camporese G et al: Vůči hodnotícímu zaslepená randomizovaná kontrolovaná klinická studie u 1761 konsekutivních pacientů podstupujících artroskopii kolene. Pacienti byli randomizováni do skupiny, která užívala stupňované kompresní punčochy v celé délce dolní končetiny po dobu 7 dnů (660 pacientů) nebo jednou denně dostávali nadroparin 0,4 ml po dobu 7 dnů (657 pacientů) nebo 14 dnů (444 pacientů). Primární výsledný ukazatel účinnosti byla 3měsíční kumulativní incidence asymptomatické proximální hluboké žilní trombózy, symptomatické žilní tromboembolie a úmrtnosti ze všech příčin. Primární výsledný ukazatel bezpečnosti (7denní kumulativní výskyt velkého nebo malého klinicky důležitého krvácení) byl hlášen u 0,3 % pacientů ve skupině kompresních punčoch a u 0,9 % pacientů ve skupině nadroparinu. Podskupina hodnotící 14denní podávání LMWH byla předčasně ukončena, protože neprokázala dodatečný klinický přínos. Nebylo hlášeno žádné úmrtí. Hodnoty převzaty z Camporese G et al. Ann Intern Med. 2008;149:73-82 (tabulka 2). Pacienti s poraněním dolních končetin: incidence závažného krvácení V klinické studii srovnávající profylaxi Fraxiparinem proti žádné tromboprofylaxi u pacientů s poraněním dolních končetin nedošlo k žádnému akutnímu krvácení. 4 Metodologie Kujath P et al: Prospektivní randomizovaná studie u 253 ambulantních pacientů. Všichni pacienti měli poranění dolní končetiny imobilizované sádrovou fi xací. Jedna skupina pacientů (n = 126) dostávala Fraxiparin 0,3 ml denně po dobu 16 dnů, zatímco druhá skupina (n = 127) nedostávala v průběhu 16 dnů žádnou tromboprofylaxi. Asymptomatická DVT byla diagnostikována kompresním ultrazvukem a symptomatická DVT konfi rmována kompresním ultrazvukem. Při léčbě Fraxiparinem se vyskytuje méně hematomů než u enoxaparinu. 6 Maximalizuje účinnost, minimalizuje obavy
14 Fraxiparine - optimální vyvážení účinnosti a bezpečnosti Efektivní ochrana Fraxiparinem proti hluboké žilní trombóze u vysoce rizikových ortopedických operací 5 Pacienti (%) Pacienti s totální endoprotézou kyčelního kloubu: incidence celkové DVT ,4 % p = 0,021 RRR = 79 % Metodologie Haentjens P et al: Prospektivní, otevřená, randomizovaná studie hodnotící pacienty s totální náhradou kyčle. Během hospitalizace byl k profylaxi použit Fraxiparine v dávce adjustované podle tělesné hmotnosti. 296 pacientů bez HŽT při propuštění bylo randomizovaně přiřazeno k pokračující profylaxi přípravkem Fraxiparine (n = 155) vs. nefarmakologické profylaxi (n = 141). Mezi oběma skupinami nebyly zjištěny žádné rozdíly z hlediska bezpečnosti. Asymptomatická HŽT detekovaná kompresním ultrazvukem a symptomatická HŽT potvrzená kompresním ultrazvukem. 0 Krátkodobá profylaxe (2 týdny) Fraxiparinem (n = 141) 1,3 % Prodloužená profylaxe (5 týdnů) Fraxiparinem (n = 155) Hodnoty převzaty z Haentjens P et al. Hip International 2001;11:25-36 (tabulka 4). RRR = snížení relativního rizika Příznivý bezpečnostní profi l Fraxiparinu 5 Pacienti s totální náhradou kyčelního kloubu: incidence závažného krvácení V klinické studii srovnávající 2týdenní a 5týdenní profylaxi Fraxiparinem po totální náhradě kyčelního kloubu nedošlo k žádné epizodě závažného krvácení. 5 Při léčbě Fraxiparinem se vyskytuje méně hematomů než u enoxaparinu. 6
15 Flexibilní dávkování Fraxiparinem Pacient se středním rizikem Standardní dávka 0,3 ml 7 Vysoce rizikový pacient 7 Předoperačně a dále až do dne 3 Den 4 a dále < 50 kg 0,2 ml 0,3 ml < 50 kg 50 kg 50 kg 0,3 ml 0,4 ml 69 kg 69 kg 70 kg 0,4 ml 0,6 ml 70 kg Maximalizuje účinnost, minimalizuje obavy
16 Evidence-based guidelines* u rozsáhlých ortopedických operací: 1 U pacientů podstupujících totální náhradu kyčelního kloubu a operaci zlomeniny krčku stehenní kosti se doporučuje a u pacientů podstupujících totální náhradu kolenního kloubu se navrhuje prodloužit tromboprofylaxi na více než 10 dnů po dobu až 35 dnů po operaci (stupeň 1A, resp. 2B). *ACCP Guidelines 2008 Předplněná injekční stříkačka Fraxiparinu. Vyrobeno s důrazem na bezpečnost KLAPNUTÍ ZARÁŽKY ZABEZPEČENO Fraxiparine se také dodává v lahvičce k opakovanému použití jako.
17 Při antitrombotické ochraně se spoléhejte na důkazy. KDY Pacienti podstupující ortopedickou operaci. PROČ účinnost Profylaxe Fraxiparinem zajišťuje ochranu proti hluboké žilní trombóze u ortopedických pacientů s vysokou i střední mírou rizika VTE. 3,4,5 PROČ bezpečnost Fraxiparine má příznivý bezpečnostní profi l. 3,4,5,6 JAK Fraxiparine nabízí fl exibilní dávkování za použití předplněné bezpečnostní injekční stříkačky nebo lahvičky k opakovanému použití. Maximalizuje účinnost, minimalizuje obavy
18 Literatura: 1. Geerts WH et al. Prevention of venous thromboembolism. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8 th Edition). Chest 2008;133: Monreal M et al. The outcome after treatment of venous thromboembolism is different in surgical and acutely ill medical patients. Findings from the RIETE registry. J Thromb Haemost 2004;2: Camporese G et al. Low-Molecular-Weight Heparin versus Compression Stockings for Thromboprophylaxis after Knee Arthroscopy. Ann Intern Med. 2008;149: Kujath P et al. Incidence and prophylaxis of deep venous thrombosis in outpatients with injury of the lower limb. Haemostasis 1993;23: Haentjens P et al. Prevention of venous thromboembolism after hospital discharge. Continued pharmacological prophylaxis versus no prophylaxis in patients undergoing total hip replacement. Hip International 2001;11: Albanese C et al. Comparison of the local tolerability of two subcutaneous low molecular weight heparins: CY 216 and enoxaparin. Current Therapeutic Research 1992;51(3): rt. 7. SPC Fraxiparine
19 Maximalizuje účinnost, minimalizuje obavy
20 Léčba
21 Vysoké riziko plicní embolie u pacientů s hlubokou žilní trombózou U 50 % pacientů s neléčenou hlubokou žilní trombózou dojde do 3 měsíců k plicní embolii. 1 Plicní embolie Léčebná doporučení založená na důkazech: U pacientů s vysokým klinickým podezřením na DVT doporučujeme zahájit antikoagulační léčbu již během čekání na výsledky diagnostických testů (stupeň 1C). 2 6 % 53 % případů trombózy vena saphena je spojeno s výskytem hluboké žilní trombózy. 3 Vena femoralis DVT: Hluboká žilní trombóza PE: Plicní embolie VTE: Žilní tromboembolie Vena saphena magna Vena poplitea Vena saphena parva Léčba Hluboké žíly Povrchové žíly Maximalizuje účinnost, minimalizuje obavy
22 Fraxiparine Forte - optimální rovnováha mezi účinností Účinnost při léčbě hluboké žilní trombózy 4 Incidence (%) 4,5 4,0 3,5 3,0 2,5 2,0 Indidence rekurentního VTE p = ns 4,2 % 3,9 % Metodologie Prandoni P et al: Otevřená multicentrická klinická studie s 720 pacienty s akutním symptomatickým VTE. Pacienti byli léčeni buď subkutánním UFH v korigované dávce (n = 360) nebo subkutánně podávaným nadroparin kalciem ve fi xní dávce (n = 360). Současně byla zahájena perorální antikoagulační léčba, která pokračovala po dobu minimálně 3 měsíců. Byl sledován výskyt závažného krvácení během úvodní léčby heparinem, recidiva VTE a úmrtí. K závažnému krvácení došlo u 1,1 % pacientů léčených UFH a 0,8 % pacientů léčených LMWH. V každé skupině zemřelo během 12 týdnů sledování po 12 pacientech (3,3 %). 1,5 1,0 0 UFH n = 360 Hodnoty převzaty z Prandoni P et al. Arch Intern Med 2004;164: (tabulka 3). nadroparin n = % interval spolehlivosti, -2,5 % až 3,1 % Účinnost a bezpečnost léčby hluboké žilní trombózy přípravkem Fraxiparine Forte jednou denně 5 Pacienti (%) Účinnost: recidiva DVT nebo PE 5,1 Fraxiparine dvakrát denně p = ns 3,4 Fraxiparine Forte jednou denně Hodnoty převzaty z Charbonnier B et al. Thromb Haemost 1998;79: (tabulka 3). Závažné krvácení (%) Bezpečnost: závažné krvácení během léčby nadroparinem Fraxiparine dvakrát denně p = ns 1,2 1,3 Fraxiparine Forte jednou denně Hodnoty převzaty z Charbonnier B et al. Thromb Haemost 1998;79: (tabulka 3). Metodologie Charbonnier B et al: Multicentrická randomizovaná dvojitě zaslepená non-inferioritní studie srovnávající nadroparin podávaný 1 denně (n = 316) s nadroparinem podávaným 2 denně (n = 335) v dávce odvozené od hmotnosti pacienta. LMWH byl podáván alespoň 5 dnů s následným přechodem na perorální antikoagulační terapii. Pacienti byli sledováni po dobu až 3 měsíců. Během tříměsíčního období studie zemřelo 2,8 % pacientů ve skupině s lékem podávaným jednou denně a 3,9 % ve skupině s lékem podávaným dvakrát denně. Primární výsledný ukazatel byla recidiva tromboembolie nebo úmrtí do 3 měsíců. Fraxiparine Forte podávaný jednou denně byl stejně účinný a bezpečný jako dvakrát denně podávaný Fraxiparine. 5
23 a bezpečností Příznivý bezpečnostní profi l nadroparinu 6 RR 1,8 1,6 1,4 1,2 1 1,6 1,34 Indidence závažného krvácení Indidence závažného krvácení Zvýšení rizika závažného krvácení oproti UFH Ekvivalent UFH Metodologie Dolovich et al: Údaje jsou získány z meta-analýzy 13 randomizovaných kontrolovaných klinických studií srovnávajících LMWH s UFH při léčbě VTE (celkem 4447 pacientů). Zobrazené výsledky se týkají závažného krvácení. V ohledu recidivy VTE, PE a celkové úmrtnosti nebyl mezi LMWH a UFH zjištěn žádný rozdíl. 0,8 0,6 0,4 0,2 0,32 0,31 0,29 Snížení rizika závažného krvácení oproti UFH 0 Enoxaparin oproti UFH Reviparin oproti UFH Tinzaparin oproti UFH Dalteparin oproti UFH Nadroparin oproti UFH RR = Relativní riziko Relativní riziko méně než 1 značí, že LMWH má tendenci být bezpečnější než UFH. Hodnoty převzaty z Dolovich et al. Arch Intern Med 2000;160: (tabulka 6). Nadroparin při srovnání s UFH významně snižoval výskyt závažného krvácení. 6 Méně hematomů při aplikaci nadroparinu než enoxaparinu 7 Bolest v místě injekce byla u pacientů léčených nadroparinem méně častá. 7 Maximalizuje účinnost, minimalizuje obavy
24 Flexibilní dávkování přípravku Fraxiparine Forte Přizpůsobeno potřebám pacientů 0,1 ml/10 kg jednou denně 8 70 kg 89 kg 60 kg 90 kg 0,6 ml 0,8 ml 1,0 ml Injekční stříkačka Fraxiparine Forte. Vyrobena s důrazem na bezpečnost Snadné podání Snížené riziko poranění
25 V antitrombotické ochraně se spoléhejte na důkazy KDY U pacientů s hlubokou žilní trombózou. PROČ účinnost Fraxiparine Forte podávaný jednou denně je při léčbě hluboké žilní trombózy stejně účinný jako Fraxiparin dvakrát denně. PROČ bezpečnost Fraxiparine Forte má příznivý bezpečnostní profi l. 5 JAK Flexibilní dávkování Fraxiparinu Forte jednou denně - 0,1 ml/10 kg/den. Maximalizuje účinnost, minimalizuje obavy
26 Literatura: 1. Kearon C. Natural history of venous thromboembolism. Circulation 2003;107:I-22-I Kearon C. et al. Antithrombotic therapy for venous thromboembolic disease: American College of Chest Physicians evidence-based clinical practice guidelines (8 th Edition). Chest 2008;133: S. 3. Leon L et al. Clinical signifi cance of superfi cial vein thrombosis. Eur J Vasc Endovasc Surg 2005;29: Prandoni P et al. Subcutaneous adjusted-dose unfractionated heparin vs fi xed-dose lowmolecular-weight heparin in the initial treatment of venous thromboembolism. Arch Intern Med 2004;164: Charbonnier B et al. Comparison of a once daily with a twice daily subcutaneous low molecular weight heparin regimen in the treatment of deep vein thrombosis. Thromb Haemost 1998;79: Dolovich L et al. A meta analysis comparing low molecular weight heparins with unfractionated heparin in the treatment of venous thromboembolism. Arch Intern Med 2000;160: Albanese C et al. Comparison of the local tolerability of two subcutaneous low molecular weight heparins: CY 216 and enoxaparin. Current Therapeutic Research 1992;51(3): SPC Fraxiparine Forte
27 Maximalizuje účinnost, minimalizuje obavy
28 Zkrácená informace o léčivém přípravku Název přípravku: FRAXIPARIN MULTI; Účinná látka: Nadroparinum calcicum IU anti Xa v 1 ml roztoku. Indikace: Prevence tromboembolické choroby v perioperačním období. Léčba tromboembolické choroby. Prevence krevního srážení během hemodialýzy. Léčba nestabilní anginy pectoris a non-q infarktu myokardu. Přípravek je určen k léčbě dospělých a mladistvých pacientů. U dětí mladších 14ti let nebyla dosud bezpečnost přípravku prokázána. Dávkování: Profylaxe tromboembolické nemoci: všeobecná chirurgie: 0,3 ml 1 denně po dobu nejméně 7 dnů, první dávka 2 4 hod. před operací. Ortopedie: velikost dávky dle hmotnosti pacienta, aplikace s.c. 12 hod. před výkonem, 12 hod. po výkonu a poté 1 denně po dobu nejméně 10 dnů či po dobu trvání rizikového odbobí. Léčba TEN: dávka dle tělesné hmotnosti, s.c. 2 denně po dobu 10 dnů (do nastavení účinné warfarinizace). Ostatní indikace viz SPC. Způsob podání: Přípravek je určen pro podkožní podání (s výjimkou podání při hemodialýze a s výjimkou bolusu při léčbě nestabilní anginy pectoris a non-q infarktu myokardu). Speciální skupiny pacientů: Starší pacienti: není třeba úprava dávkování při normální funkci ledvin. Poruchy funkce ledvin*: Prevence tromboembolické choroby - u pacientů s mírným poškozením funkce ledvin (clearance kreatininu 50 ml/ min) není třeba snižovat dávku.středně těžké až těžké poškození funkce ledvin je spojeno se zvýšenou expozicí nadroparinu. U těchto pacientů existuje zvýšené riziko tromboembolismu a krvácení. Pokud je po zvážení individuálních rizikových faktorů pro vznik krvácení a tromboembolismu u pacientů se středně těžkou poruchou funkce ledvin (clearance kreatininu 30 ml/ min a < 50 ml/ min) považováno snížení dávky za vhodné, doporučuje se snížit dávku o 25 až 33 %. U pacientů s těžkým poškozením funkce ledvin (ClCr < 30 ml/ min) by měla být dávka snížena o 25 až 33 %. Léčba tromboembolické choroby, nestabilní anginy pectoris a non-q infarktu myokardu - u pacientů s mírným poškozením funkce ledvin (clearance kreatininu 50 ml/ min) není třeba snižovat dávku. Středně těžké až těžké poškození funkce ledvin je spojeno se zvýšenou expozicí nadroparinu. U těchto pacientů existuje zvýšené riziko tromboembolismu a krvácení. Pokud je po zvážení individuálních rizikových faktorů pro vznik krvácení a tromboembolismu u pacientů se středně těžkou poruchou funkce ledvin (clearance kreatininu 30 ml/ min a < 50 ml/ min) považováno snížení dávky za vhodné, doporučuje se snížit dávku o 25 až 33 %. Nadroparin je kontraindikován u pacientů s těžkým renálním poškozením. Kontraindikace: Přecitlivělost na nadroparin, trombocytopenie po nadroparinu v anamnéze, aktivní krvácení nebo zvýšené riziko krvácení v souvislosti s organickým poškozením nebo poruchami krevní srážlivosti (s výjimkou diseminované intravaskulární koagulace, která není způsobena heparinem), akutní infekční endocarditis, cévní mozkové příhody s krvácením, těžké poškození ledvin (clearance kreatininu < 30 ml/ min) u pacientů léčených terapeutickou dávkou nadroparinu. Fraxiparin Multi se nesmí podávat u dětí do 3 let. Zvýšené opartnosti je třeba u pacientů s renálním či hepatálním selháváním, závažnou hypertenzí, VCHGD v anamnéze, u stavů s rizikem krvácení, vaskulárních poruch cévnatky a sítnice, po operaci CNS či oka. Interakce: Nedoporučené kombinace: salicyláty, nesteroidní antiflogistika, antiagregancia. Nežádoucí účinky: Krvácivé projevy v různých místech, trombocytopenie, krevní výrony v místě vpichu, zvýšení transamináz (další viz SPC). Upozornění pro použití: Vzhledem k možnosti vzniku trombocytopenie vyvolané heparinem je nezbytná pravidelná kontrola počtu krevních destiček v průběhu celé léčby nadroparinem. Další upozornění viz SPC. Těhotenství a kojení: Studie na zvířatech neprokázaly žádné teratogenní nebo toxické účinky na plod. Informace o vylučování nadroparinu do mateřského mléka jsou pouze omezené. Nedoporučuje se používat nadroparin během kojení. Velikost balení: 10 5 ml, ml. Uchovávání: Uchovávat při teplotě do 25 C. Doba použitelnosti: 3 roky. Doba použitelnosti po prvním otevření: 4 týdny. Registrační číslo: 16/734/99-C. Držitel rozhodnutí o registraci: Glaxo Group Ltd., Greenford, Middlesex, Velká Británie. Datum poslední revize SPC: Datum poslední revize textu: Lék je vázán na lékařský předpis a je hrazen z prostředků zdravotního pojištění. Úplné informace pro předepisování najdete v Souhrnu údajů o přípravku nebo se obraťte na obchodní společnost: GlaxoSmithKline, s.r.o., Na Pankráci 17/1685; Praha 4, Tel.: , fax: ; .: gsk.czmail@gsk.com; Zkrácená informace o přípravku je platná k datu vydání materiálu Zkrácená informace o léčivém přípravku Název přípravku: FRAXIPARINE FORTE. Účinná látka: Nadroparinum calcicum IU anti Xa v 1 ml roztoku. Indikace: Léčba tromboembolické choroby u dospělých pacientů. Dávkování: Dávka dle tělesné hmotnosti (viz SPC), s.c. 1 denně obvykle po dobu 10 dnů (nevysazujeme dříve než je nastavena správná hladina warfarinu). Speciální skupiny pacientů: Starší pacienti: při normální funkci ledvin není nutné upravovat dávku. Poruchy funce ledvin*: U pacientů s mírným poškozením funkce ledvin (clearance kreatininu 50 ml/min) není třeba snižovat dávku. Středně těžké až těžké poškození funkce ledvin je spojeno se zvýšenou expozicí nadroparinu. U těchto pacientů existuje zvýšené riziko tromboembolismu a krvácení. Pokud je po zvážení individuálních rizikových faktorů pro vznik krvácení a tromboembolismu u pacientů se středně těžkou poruchou funkce ledvin (clearance kreatininu 30 ml/ min a < 50 ml/min) považováno snížení dávky za vhodné, doporučuje se snížit dávku o 25 až 33 %. Nadroparin je kontraindikován u pacientů s těžkým renálním poškozením (clearance kreatininu < 30 ml/ min). Kontraindikace: přecitlivělost na nadroparin nebo některou z pomocných látek, trombocytopenie po nadroparinu v anamnéze, aktivní krvácení nebo zvýšené riziko krvácení v souvislosti s poruchami krevní srážlivosti (s výjimkou DIC, která není způsobena heparinem), organická poškození se sklonem ke krvácení, cévní mozkové příhody s krvácením, akutní infekční endocarditis, těžké poškození ledvin (clearance kreatininu 30 ml/ min) u pacientů léčených terapeutickou dávkou nadroparinu. Zvláštní upozornění: vzhledem k možnosti vzniku trombocytopenie vyvolané heparinem je nezbytná pravidelná kontrola počtu krevních destiček v průběhu celé léčby nadroparinem. Zvýšené opatrnosti je třeba u pacientů s hepatální či renální nedostatečností, závažnou hypertenzí, VCHGD v anamnéze nebo se stavy se možným krvácením, u vaskulárních poruch cévnatky a sítnice a stavů po operaci CNS či oka. Heparin může snižovat sekreci aldosteronu a tím vést k hyperkalémii. Ochranný pryžový kryt předplněné injekční stříkačky obsahuje přírodní latex, který může u osob citlivých na latex vyvolat latexovou alergii*. Interakce: nedoporučené kombinace se salicyláty, nesteroidními antifl ogistiky či antiagregancii aj. Těhotenství: Studie na zvířatech neprokázaly žádné teratogenní nebo toxické účinky na plod. K dispozici jsou pouze omezené informace o prostupu nadroparinu placentární bariérou. Kojení: jsou pouze omezené informace o vylučování nadroparinu do mateřškého mléka, z tohoto důvodu se nadroparin během kojení nedoporučuje. Nežádoucí účinky: krvácivé projevy v různých místech, malé krevní výrony či lokální reakce v místě vpichu, trombocytopenie, hypersenzitivní reakce, přechodné zvýšení jaterních transamináz, přechodná hyperkalemie aj. Doba použitelnosti: 3 roky. Uchovávání: při teplotě do 25 C. Velikost balení: 2 nebo 10 inj. stříkaček k jednorázovému použití o objemu 0,6 ml, 0,8 ml, 1 ml. Držitel rozhodnutí o registraci: Glaxo Group Ltd., Greenford, Middlesex, Velká Británie. Registrační číslo: 16/043/00-C. Datum poslední revize SPC: Datum revize textu: Lék je vázán na lékařský předpis a je hrazen z prostředků zdravotního pojištění. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku nebo se obraťte na společnost: GlaxoSmithKline, s.r.o., Na Pankráci 17/1685; Praha 4. Tel.: , fax: ; .: gsk.czmail@gsk.com; Zkrácená informace o přípravku je platná k datu vydání materiálu Zkrácená informace o léčivém přípravku Název přípravku: FRAXIPARINE; Složení: Nadroparinum calcicum IU anti Xa v 1 ml roztoku. Indikace: Prevence tromboembolické choroby (TEN) v perioperačním období. Léčba TEN. Prevence krevního srážení během hemodialýzy. Léčba nestabilní anginy pectoris a non-q infarktu myokardu. Přípravek je určen k léčbě dospělých a mladistvých pacientů. U dětí mladších 14ti let nebyla dosud bezpečnost přípravku prokázána. Dávkování: Profylaxe TEN: všeobecná chirurgie: 0,3 ml 1 za den po dobu nejméně 7 dnů, první dávka 2 4 hod. před operací. Ortopedie: velikost dávky dle hmotnosti pacienta, aplikace s.c. 12 hodin před výkonem, 12 hodin po výkonu a poté 1 denně po dobu nejméně 10 dnů či po dobu trvání rizikového období. LéčbaTEN: dávka dle tělesné hmotnosti, s.c. 2 denně po dobu 10 dnů (do nastavení účinné warfarinizace). Ostatní indikace viz SPC. Způsob podání: subkutánně (krom podání při hemodialýze a s výjimkou bolusu při léčbě nestabilní AP a non-q IM). Speciální skupiny pacientů: Starší pacienti: není třeba žádná úprava dávkování při normální funkci ledvin. Poruchy funkce ledvin*: Prevence tromboembolické choroby - u pacientů s mírným poškozením funkce ledvin (clearance kreatininu 50 ml/ min) není třeba snižovat dávku. Středně těžké až těžké poškození funkce ledvin je spojeno se zvýšenou expozicí nadroparinu. U těchto pacientů existuje zvýšené riziko tromboembolismu a krvácení. Pokud je po zvážení individuálních rizikových faktorů pro vznik krvácení a tromboembolismu u pacientů se středně těžkou poruchou funkce ledvin (clearance kreatininu 30 ml/ min a < 50 ml/ min) považováno snížení dávky za vhodné, doporučuje se snížit dávku o 25 až 33 %. U pacientů s těžkým poškozením funkce ledvin (ClCr < 30 ml/ min) by měla být dávka snížena o 25 až 33 %. Léčba tromboembolické choroby, nestabilní anginy pectoris a non-q infarktu myokardu - u pacientů s mírným poškozením funkce ledvin (clearance kreatininu 50 ml/ min) není třeba snižovat dávku. Středně těžké až těžké poškození funkce ledvin je spojeno se zvýšenou expozicí nadroparinu. U těchto pacientů existuje zvýšené riziko tromboembolismu a krvácení. Pokud je po zvážení individuálních rizikových faktorů pro vznik krvácení a tromboembolismu u pacientů se středně těžkou poruchou funkce ledvin (clearance kreatininu 30 ml/ min a < 50 ml/ min) považováno snížení dávky za vhodné, doporučuje se snížit dávku o 25 až 33 %. Nadroparin je kontraindikován u pacientů s těžkým renálním poškozením. Kontraindikace: Přecitlivělost na nadroparin, trombocytopenie po nadroparinu v anamnéze, aktivní krvácení nebo zvýšené riziko krvácení v souvislosti s organickým poškozením nebo poruchami krevní srážlivosti (s výjimkou diseminované intravaskulární koagulace, která není způsobena heparinem), akutní infekční endocarditis, cévní mozkové příhody s krvácením, těžké poškození ledvin (clearance kreatininu < 30 ml/ min) u pacientů léčených terapeutickou dávkou nadroparinu. Zvýšená opatrnost je třeba u pacientů s renální či hepatální insufi ciencí, se závažnou hypertenzí, anamnézou VCHGD či stavy s rizikem krvácení, poruchy cévnatky a sítnice a stavy po operaci mozku, míchy nebo oka. Ochranný pryžový kryt předplněné injekční stříkačky obsahuje přírodní latex, který může u osob citlivých na latex vyvolat latexovou alergii*. Interakce: Nedoporučené kombinace: salicyláty, nesteroidní antifl ogistika, antiagregancia. Nežádoucí účinky: Krvácivé projevy v různých místech, trombocytopenie, krevní výrony v místě vpichu, zvýšení transamináz, další viz SPC. Upozornění pro použití: Vzhledem k možnosti vzniku trombocytopenie vyvolané heparinem je nezbytná pravidelná kontrola počtu krevních destiček v průběhu celé léčby nadroparinem. Další upozornění viz SPC. Těhotenství a kojení: Studie na zvířatech neprokázaly žádné teratogenní nebo toxické účinky na plod. Informace o vylučování nadroparinu do mateřského mléka jsou pouze omezené. Nedoporučuje se používat nadroparin během kojení. Velikost balení: 2 nebo 10 injekčních stříkaček k jednorázovému použití o objemu 0,2 ml; 0,3 ml; 0,4 ml; 0,6 ml; 0,8 ml; 1,0 ml v balení. Uchovávání: Uchovávat při teplotě do 25 C. Registrační číslo: 16/281/90-C. Držitel rozhodnutí o registraci: Glaxo Group Ltd., Greenford, Middlesex, Velká Británie. Datum poslední revize SPC: Datum revize textu: Lék je vázán na lékařský předpis a je hrazen z prostředků zdravotního pojištění. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku nebo se obraťte na společnost: GlaxoSmithKline, s.r.o., Na Pankráci 17/1685; Praha 4. Tel.: , fax: ; .: gsk.czmail@gsk.com; Zkrácená informace o přípravku je platná k datu vydání materiálu * Všiměte si, prosím, změn v informaci o přípravku. GZF
DIAGNOSTIKA A PREVENCE HLUBOKÉ ŽILNÍ TROMBÓZY V INTENZIVNÍ PÉČI
 DIAGNOSTIKA A PREVENCE HLUBOKÉ ŽILNÍ TROMBÓZY V INTENZIVNÍ PÉČI MUDr. Ing. Jan Beneš Klinika anesteziologie, perioperační a intenzivní medicíny Univerzita J. E. Purkyně v Ústí nad Labem Masarykova nemocnice
DIAGNOSTIKA A PREVENCE HLUBOKÉ ŽILNÍ TROMBÓZY V INTENZIVNÍ PÉČI MUDr. Ing. Jan Beneš Klinika anesteziologie, perioperační a intenzivní medicíny Univerzita J. E. Purkyně v Ústí nad Labem Masarykova nemocnice
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls48212/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls48212/2011 1. NÁZEV PŘÍPRAVKU FRAXIPARIN MULTI Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ SOUHRNÚDAJŮ O PŘÍPRAVKU Nadroparinum calcicum
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls48212/2011 1. NÁZEV PŘÍPRAVKU FRAXIPARIN MULTI Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ SOUHRNÚDAJŮ O PŘÍPRAVKU Nadroparinum calcicum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls132576/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARIN MULTI Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa v 1 ml injekčního roztoku.
sp.zn. sukls132576/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARIN MULTI Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa v 1 ml injekčního roztoku.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls61557/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARINE Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa v 1 ml roztoku. Úplný seznam
sp.zn. sukls61557/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARINE Injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa v 1 ml roztoku. Úplný seznam
Nízkomolekulární hepariny
 Nízkomolekulární hepariny indikace a dávkování ČSTH ČESKÁ SPOLEČNOST PRO TROMBÓZU A HEMOSTÁZU ČESKÉ LÉKAŘSKÉ SPOLEČNOSTI J. E. PURKYNĚ Č. II90 INDIKACE A DÁVKOVÁNÍ Profylaxe tromboembolie Akutní onemocnění
Nízkomolekulární hepariny indikace a dávkování ČSTH ČESKÁ SPOLEČNOST PRO TROMBÓZU A HEMOSTÁZU ČESKÉ LÉKAŘSKÉ SPOLEČNOSTI J. E. PURKYNĚ Č. II90 INDIKACE A DÁVKOVÁNÍ Profylaxe tromboembolie Akutní onemocnění
Prevence tromboembolické nemoci u chirurgického pacienta
 J.Gumulec Klinika hematonkologie FNO a LF OU Prevence tromboembolické nemoci u chirurgického pacienta EARLY RECOVERY AFTER SURGERY 20 th Colours of Sepsis 2018, Ostrava Profylaxe VTE v (obecné) chirurgii
J.Gumulec Klinika hematonkologie FNO a LF OU Prevence tromboembolické nemoci u chirurgického pacienta EARLY RECOVERY AFTER SURGERY 20 th Colours of Sepsis 2018, Ostrava Profylaxe VTE v (obecné) chirurgii
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls150426/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARINE Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa
sp.zn. sukls150426/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAXIPARINE Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Nadroparinum calcicum 9 500 IU anti-xa
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls33556/2011 a příloha ke sp.zn. sukls99496/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls33556/2011 a příloha ke sp.zn. sukls99496/2011 1. NÁZEV PŘÍPRAVKU FRAXIPARINE FORTE Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls33556/2011 a příloha ke sp.zn. sukls99496/2011 1. NÁZEV PŘÍPRAVKU FRAXIPARINE FORTE Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY R O Z H O D N U T Í
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Vyvěšeno dne: 11. 10. 2010 V Praze dne 11. 10. 2010 č. j.: MZDR53095/2010 sp. zn. FAR: L179/2010 k č. j.: SUKLS118067/2009 R O Z H O D N U T Í Ministerstvo zdravotnictví
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Vyvěšeno dne: 11. 10. 2010 V Praze dne 11. 10. 2010 č. j.: MZDR53095/2010 sp. zn. FAR: L179/2010 k č. j.: SUKLS118067/2009 R O Z H O D N U T Í Ministerstvo zdravotnictví
Praxbind doporučení pro podávání (SPC)
 Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Praxbind doporučení pro podávání (SPC) Idarucizumab je indikován pro použití v případech, kde je zapotřebí rychlá antagonizace antagonizačních účinků dabigatranu Idarucizumab je specifický přípravek pro
Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov
 Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov 1995 Six weeks versus six months. 40% provokovaných trombóz Schulman Six weeks versus.
Jak dlouho léčit tromboembolickou nemoc? MUDr. Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov 1995 Six weeks versus six months. 40% provokovaných trombóz Schulman Six weeks versus.
MUDr. Kateřina Menčíková Domácí hospic Cesta domů
 MUDr. Kateřina Menčíková Domácí hospic Cesta domů Opakování matka moudrosti Pacient mobilního hospice TEN u pacientů v paliativní péči TEN je častou komplikací nádorového onemocnění (prokoagulační stav,
MUDr. Kateřina Menčíková Domácí hospic Cesta domů Opakování matka moudrosti Pacient mobilního hospice TEN u pacientů v paliativní péči TEN je častou komplikací nádorového onemocnění (prokoagulační stav,
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Arixtra 1,5 mg/0,3 ml injekční roztok, předplněná injekční stříkačka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Arixtra 1,5 mg/0,3 ml injekční roztok, předplněná injekční stříkačka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Nová nebo stará antikoagulancia v profylaxi a léčbě TEN u pacientů s MM? Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov
 Nová nebo stará antikoagulancia v profylaxi a léčbě TEN u pacientů s MM? Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov Nová nebo stará antikoagulancia? Multiple myeloma +.. počet
Nová nebo stará antikoagulancia v profylaxi a léčbě TEN u pacientů s MM? Petr Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov Nová nebo stará antikoagulancia? Multiple myeloma +.. počet
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Prevence žilní tromboembolické nemoci v ortopedii
 Prevence žilní tromboembolické nemoci v ortopedii Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně P.Kessler
Prevence žilní tromboembolické nemoci v ortopedii Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně P.Kessler
hluboká žilní trombóza u kriticky nemocných
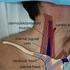 jan.benes@live.com ČSARIM, Praha, 7. října 2016 hluboká žilní trombóza u kriticky nemocných EBM vs klinická praxe zdroje konfliktu 1. epidemiologická evidence chybí, zbývá patofyziologie, anatomie, logika,
jan.benes@live.com ČSARIM, Praha, 7. října 2016 hluboká žilní trombóza u kriticky nemocných EBM vs klinická praxe zdroje konfliktu 1. epidemiologická evidence chybí, zbývá patofyziologie, anatomie, logika,
JIŘÍ WIDIMSKÝ, JAROSLAV MALÝ A KOLEKTIV / AKUTNÍ PLICNÍ EMBOLIE A ŽILNÍ TROMBÓZA
 1 Výskyt akutní plicní embolie Jiří Widimský, Jaroslav Malý 13 2 Patogeneze žilní trombózy a plieni embolie (tromboembolie) Jaroslav Malý, Jiří Widimský 19 2.1.1 Velké chirurgické výkony, zejména ortopedické
1 Výskyt akutní plicní embolie Jiří Widimský, Jaroslav Malý 13 2 Patogeneze žilní trombózy a plieni embolie (tromboembolie) Jaroslav Malý, Jiří Widimský 19 2.1.1 Velké chirurgické výkony, zejména ortopedické
STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.
 STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS98242/2014 Vyřizuje/linka Mgr. Lucie Taschnerová
STÁTNÍ ÚSTAV Šrobárova 48 Telefon:+420 272 185 111 E-mail:posta@sukl.cz PRO KONTROLU LÉČIV 100 41 Praha 10 Fax: +420 271 732 377 Web: www.sukl.cz Sp. zn. SUKLS98242/2014 Vyřizuje/linka Mgr. Lucie Taschnerová
Současná protidestičková léčba a důsledky pro perioperační péči. Jan Bělohlávek Komplexní kardiovaskulární centrum VFN a 1.
 Současná protidestičková léčba a důsledky pro perioperační péči Jan Bělohlávek Komplexní kardiovaskulární centrum VFN a 1. LF UK Praha Fatální koronární trombóza spontánní Koronární trombóza při vysazení
Současná protidestičková léčba a důsledky pro perioperační péči Jan Bělohlávek Komplexní kardiovaskulární centrum VFN a 1. LF UK Praha Fatální koronární trombóza spontánní Koronární trombóza při vysazení
SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI
 Inclusion Definice Zlomenina krčku SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI Diagnostická kritéria Pacient ve věku 65 let a více + splňující následující tři diagnostická kritéria:
Inclusion Definice Zlomenina krčku SBĚR DAT STUDIE DUQUE - ZLOMENINA HORNÍHO KONCE STEHENNÍ KOSTI Diagnostická kritéria Pacient ve věku 65 let a více + splňující následující tři diagnostická kritéria:
Příručka pro předepisující lékaře
 Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
Edukační materiály Příručka pro předepisující lékaře LIXIANA (edoxabanum) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické
P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
 MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze dne 8. prosince 2017 Č.j.: MZDR 57929/2017-3/FAR *MZDRX010WP3B* MZDRX010WP3B P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
MINISTERSTVO ZDRAVOTNICTVÍ ČESKÉ REPUBLIKY Odbor farmacie V Praze dne 8. prosince 2017 Č.j.: MZDR 57929/2017-3/FAR *MZDRX010WP3B* MZDRX010WP3B P Ř E D B Ě Ž N É O P A T Ř E N Í O B E C N É P O V A H Y
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím
 Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Příloha III Dodatky k odpovídajícím částem souhrnu údajů o přípravku a příbalovým informacím Poznámka: Tyto změny příslušných bodů souhrnu údajů o přípravku a příbalové informace jsou výsledkem referralové
Stáza. Poškození žilního endotelu. Změny v krevní koagulaci
 MOŽNOSTI PREVENCE TEN Kateřina Ševčíková KARIM FN BRNO Hluboká žilní trombóza závažnost problému dle studií 1,5 mil. případů TEN ročně v EU PE u pacientů s hlubokou žilní trombózou usmrtí každý rok více
MOŽNOSTI PREVENCE TEN Kateřina Ševčíková KARIM FN BRNO Hluboká žilní trombóza závažnost problému dle studií 1,5 mil. případů TEN ročně v EU PE u pacientů s hlubokou žilní trombózou usmrtí každý rok více
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls101007/2010 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: enoxaparinum
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls101007/2010 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE Injekční roztok SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: enoxaparinum
PROGRAM a ABSTRAKTA. www.coskf.cz 1. KONGRES ČESKÉ ODBORNÉ SPOLEČNOSTI KLINICKÉ FARMACIE PSYCHOTROPNÍ FARMAKOTERAPIE
 1. KONGRES ČESKÉ ODBORNÉ SPOLEČNOSTI KLINICKÉ FARMACIE PSYCHOTROPNÍ FARMAKOTERAPIE PROGRAM a ABSTRAKTA 7. 8. října 2011 Wellness Hotel STEP, Praha www.coskf.cz ODBORNÝ PROGRAM pátek 7. 10. 2011 12.00 18.00
1. KONGRES ČESKÉ ODBORNÉ SPOLEČNOSTI KLINICKÉ FARMACIE PSYCHOTROPNÍ FARMAKOTERAPIE PROGRAM a ABSTRAKTA 7. 8. října 2011 Wellness Hotel STEP, Praha www.coskf.cz ODBORNÝ PROGRAM pátek 7. 10. 2011 12.00 18.00
Monitorování anti-xa aneb proč je dobré konsultovat hematologa
 Monitorování anti-xa aneb proč je dobré konsultovat hematologa Petr Dulíček IV. Interní hematologická klinika FN a LF v Hradci Králové 1/ Úvod - LMWH 2/ Mechanizmus účinku 3/ Monitorování interní medicína
Monitorování anti-xa aneb proč je dobré konsultovat hematologa Petr Dulíček IV. Interní hematologická klinika FN a LF v Hradci Králové 1/ Úvod - LMWH 2/ Mechanizmus účinku 3/ Monitorování interní medicína
Prevence žilního tromboembolismu v ortopedii podle 7. konference American College of Chest Physicians (ACCP)
 126/, p. 126 131 Prevence žilního tromboembolismu v ortopedii podle 7. konference American College of Chest Physicians (ACCP) Prevention of Venous Thromboembolism: the Seventh Conference American College
126/, p. 126 131 Prevence žilního tromboembolismu v ortopedii podle 7. konference American College of Chest Physicians (ACCP) Prevention of Venous Thromboembolism: the Seventh Conference American College
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml
 OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
OZNAČENÍ NA OBALU: Fraxiparine Forte 2x0,6 ml ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU Krabička 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Fraxiparine forte 0,6 ml Nadroparinum calcicum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Léčivá
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Přípavek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Quixidar 1,5 mg/0,3 ml injekční roztok, předplněná injekční stříkačka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Quixidar 1,5 mg/0,3 ml injekční roztok, předplněná injekční stříkačka 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna předplněná injekční stříkačka
Příloha III. Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Příloha III Úpravy odpovídajících bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Úpravy v souhrnu údajů o přípravku a příbalové informaci mohou být dále aktualizovány příslušnými vnitrostátními
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Krvácivé komplikace při léčbě warfarinem
 Krvácivé komplikace při léčbě warfarinem Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně J.Gumulec, P.Kessler*,
Krvácivé komplikace při léčbě warfarinem Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně J.Gumulec, P.Kessler*,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu
 Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Doplněk MM guidelines: Doplněk č. 1 k doporučení z 9/2012 diagnostika a léčba mnohočetného myelomu Marta Krejčí XIII. MM workshop a setkání CMG, Mikulov 11.4.2015 Doplněk č. 1 k doporučení z 9/2012: Diagnostika
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls99502/2011 a sukls33561/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls99502/2011 a sukls33561/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FRAXIPARINE, injekční roztok (Nadroparinum calcicum) Přečtěte si pozorně
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls99502/2011 a sukls33561/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FRAXIPARINE, injekční roztok (Nadroparinum calcicum) Přečtěte si pozorně
Trombóza u onkologicky nemocných pacientů. P. Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov
 Trombóza u onkologicky nemocných pacientů P. Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov Rudolf Virchow (1821 1902) Virchowova trias v patogenezi trombózy Změna cévní stěny Změna složení
Trombóza u onkologicky nemocných pacientů P. Kessler Odd. hematologie a transfuziologie Nemocnice Pelhřimov Rudolf Virchow (1821 1902) Virchowova trias v patogenezi trombózy Změna cévní stěny Změna složení
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
EDUKAČNÍ MATERIÁL - Pioglitazone Accord
 Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
Pioglitazon preskripční informace pro lékaře Výběr pacienta a zvládání rizik Evropská léková agentura přezkoumala možnou spojitost mezi podáním léčivých přípravků s obsahem pioglitazonu a zvýšeným rizikem
MUDr.Jana Bednářová Krajská zdravotní, a.s., Masarykova nemocnice Ústí nad Labem Emergency
 Trombembolická nemoc postrach internistů MUDr.Jana Bednářová Krajská zdravotní, a.s., Masarykova nemocnice Ústí nad Labem Emergency Akutní plicní embolie vzniká nejčastěji důsledkem náhlé trombembolické
Trombembolická nemoc postrach internistů MUDr.Jana Bednářová Krajská zdravotní, a.s., Masarykova nemocnice Ústí nad Labem Emergency Akutní plicní embolie vzniká nejčastěji důsledkem náhlé trombembolické
Kardioembolický iktus. MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava
 Kardioembolický iktus MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava Kardioembolická etiologie icmp! 20% ischemických CMP jsou kardioembolické etiologie! Embolie z levého srdce nebo
Kardioembolický iktus MUDr.Martin Kuliha Komplexní cerebrovaskulární centrum FN Ostrava Kardioembolická etiologie icmp! 20% ischemických CMP jsou kardioembolické etiologie! Embolie z levého srdce nebo
EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto
 EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto Informace pro předepisování přípravku Xarelto (rivaroxaban) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
EDUKAČNÍ MATERIÁLY rivaroxaban/xarelto Informace pro předepisování přípravku Xarelto (rivaroxaban) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAGMIN 10 000 m.j. (anti-xa)/4 ml FRAGMIN 10 000 m.j. (anti-xa)/1 ml Injekční roztok FRAGMIN 2 500 m.j. (anti-xa)/0,2 ml FRAGMIN 5 000 m.j. (anti-xa)/0,2 ml
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FRAGMIN 10 000 m.j. (anti-xa)/4 ml FRAGMIN 10 000 m.j. (anti-xa)/1 ml Injekční roztok FRAGMIN 2 500 m.j. (anti-xa)/0,2 ml FRAGMIN 5 000 m.j. (anti-xa)/0,2 ml
SDĚLENÍ Z PRAXE. II. interní klinika LF UK a FN, Hradec Králové 2. I. interní klinika LF UK a FN, Hradec Králové
 ÚČINNOST A BEZPEČNOST AMBULANTNÍ LÉČBY HLUBOKÉ ŽILNÍ TROMBÓZY NADROPARINEM prof. MUDr. Jaroslav Malý, CSc. 1., doc. MUDr. Petr Dulíček, Ph.D. 1, doc. MUDr. Miroslav Pecka, Ph.D. 1, MUDr. Radovan Malý,
ÚČINNOST A BEZPEČNOST AMBULANTNÍ LÉČBY HLUBOKÉ ŽILNÍ TROMBÓZY NADROPARINEM prof. MUDr. Jaroslav Malý, CSc. 1., doc. MUDr. Petr Dulíček, Ph.D. 1, doc. MUDr. Miroslav Pecka, Ph.D. 1, MUDr. Radovan Malý,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls98285/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE 12 000 IU (120 mg)/0,8 ml injekční roztok v předplněné injekční stříkačce CLEXANE FORTE 15 000 IU (150 mg)/1 ml injekční
sp. zn. sukls98285/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE 12 000 IU (120 mg)/0,8 ml injekční roztok v předplněné injekční stříkačce CLEXANE FORTE 15 000 IU (150 mg)/1 ml injekční
Trombembolie po PŽOK
 Dagmar Seidlová ARO II pracoviště reprodukční medicíny Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařská fakulta Masarykovy Univerzity Brno, Fakultní nemocnice Brno dseidlova@fnbrno.cz
Dagmar Seidlová ARO II pracoviště reprodukční medicíny Klinika anesteziologie, resuscitace a intenzivní medicíny Lékařská fakulta Masarykovy Univerzity Brno, Fakultní nemocnice Brno dseidlova@fnbrno.cz
Jsou tromboembolické komplikace úrazů minulostí? Karel Kudrna I.chirurgická klinika VFN a 1.LF Praha
 Jsou tromboembolické komplikace úrazů minulostí? Karel Kudrna I.chirurgická klinika VFN a 1.LF Praha Hluboká ŽT a PE je jednou z nejčastějších příčin morbidity a mortality pacientů po operaci proximálního
Jsou tromboembolické komplikace úrazů minulostí? Karel Kudrna I.chirurgická klinika VFN a 1.LF Praha Hluboká ŽT a PE je jednou z nejčastějších příčin morbidity a mortality pacientů po operaci proximálního
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls78351/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: enoxaparinum natricum
sp.zn. sukls78351/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLEXANE FORTE Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: enoxaparinum natricum
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PREVENCE ŽILNÍ TROMBOEMBOLICKÉ NEMOCI V PSYCHIATRII
 PREVENCE ŽILNÍ TROMBOEMBOLICKÉ MOCI V PSYCHIATRII Malý R 1, Masopust J 2, Konupčíková K 2 1 I. interní klinika Lékařské fakulty UK a Fakultní nemocnice Hradec Králové, přednosta prof. MUDr. Jan Vojáček,
PREVENCE ŽILNÍ TROMBOEMBOLICKÉ MOCI V PSYCHIATRII Malý R 1, Masopust J 2, Konupčíková K 2 1 I. interní klinika Lékařské fakulty UK a Fakultní nemocnice Hradec Králové, přednosta prof. MUDr. Jan Vojáček,
Edukační materiály. Imnovid (pomalidomid) Informace pro zdravotnické pracovníky. Brožura pokyny pro bezpečné použití přípravku
 Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
Imnovid Edukační materiály, verze 3.0; schváleno SUKL 30/JAN/2017 Brožura pokyny pro bezpečné použití přípravku Edukační materiály Imnovid (pomalidomid) Informace pro zdravotnické pracovníky Brožura pokyny
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Dále je uvedena kategorie metodologické kvality, ze které doporučení vychází, je pak označena písmeny A,B,C a C+.
 Stručný souhrn doporučovaných postupů léčby a prevence žilního tromboembolismu podle The seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy 2004 - jak dál postupovat v naší praxi? Prof.
Stručný souhrn doporučovaných postupů léčby a prevence žilního tromboembolismu podle The seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy 2004 - jak dál postupovat v naší praxi? Prof.
Prevence žilní tromboembolické nemoci ve vnitřním lékařství a v neurologii
 Prevence žilní tromboembolické nemoci ve vnitřním lékařství a v neurologii Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana
Prevence žilní tromboembolické nemoci ve vnitřním lékařství a v neurologii Doporučení pro klinickou praxi Sekce pro trombózu a hemostázu České hematologické společnosti České lékařské společnosti Jana
Edukační materiál. ELIQUIS (apixaban) Pokyny k preskripci
 Edukační materiál Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Edukační materiál Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
anestesie a cévní mozkové příhody
 petr hon neurologická klinika FN Ostrava anestesie a cévní mozková příhoda anestesie a cévní mozkové příhody anestesie a cévní mozková příhoda anestesie u právě probíhajícího iktu anestesie a cévní mozková
petr hon neurologická klinika FN Ostrava anestesie a cévní mozková příhoda anestesie a cévní mozkové příhody anestesie a cévní mozková příhoda anestesie u právě probíhajícího iktu anestesie a cévní mozková
Příloha II. Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC
 Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Příloha II Vědecké závěry a zdůvodnění zrušení či změny podmínek rozhodnutí o registraci a podrobné vysvětlení rozdílů oproti doporučení výboru PRAC 68 Vědecké závěry Koordinační skupina pro vzájemné uznávání
Tab. 1. Výskyt rizikových faktorů TEN ve sledovaném souboru.
 Úprava algoritmu prevence žilního tromboembolizmu. Úpravu algoritmu prevence žilního tromboembolizmu (TEN) jsme provedli na základě klinických zkušeností a nových dat z literatury. Prospektivně jsme sledovali
Úprava algoritmu prevence žilního tromboembolizmu. Úpravu algoritmu prevence žilního tromboembolizmu (TEN) jsme provedli na základě klinických zkušeností a nových dat z literatury. Prospektivně jsme sledovali
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls61251/2015 a k sp. zn. sukls77932/2015 1. NÁZEV PŘÍPRAVKU ZIBOR 25000 IU Injekční roztok v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum
sp. zn. sukls61251/2015 a k sp. zn. sukls77932/2015 1. NÁZEV PŘÍPRAVKU ZIBOR 25000 IU Injekční roztok v předplněné injekční stříkačce SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum
Příbalová informace: Informace pro pacienta
 sp.zn. sukls192747/2017 Příbalová informace: Informace pro pacienta FLUXUM 3200 I.U. axa FLUXUM 4250 I.U. axa FLUXUM 6400 I.U. axa Injekční roztok v předplněné injekční stříkačce Parnaparinum natricum
sp.zn. sukls192747/2017 Příbalová informace: Informace pro pacienta FLUXUM 3200 I.U. axa FLUXUM 4250 I.U. axa FLUXUM 6400 I.U. axa Injekční roztok v předplněné injekční stříkačce Parnaparinum natricum
Prodlou ené podávání nízkomolekulárních heparinù v prevenci pooperaèní trombózy
 Pøehledný referát Prodlou ené podávání nízkomolekulárních heparinù v prevenci pooperaèní trombózy M. Čepelák I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Karel Opatrný jr.,
Pøehledný referát Prodlou ené podávání nízkomolekulárních heparinù v prevenci pooperaèní trombózy M. Čepelák I. interní klinika Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Karel Opatrný jr.,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. FRAXIPARIN MULTI injekční roztok Nadroparinum calcicum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls37823/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FRAXIPARIN MULTI injekční roztok Nadroparinum calcicum Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls37823/2010 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FRAXIPARIN MULTI injekční roztok Nadroparinum calcicum Přečtěte si pozorně celou příbalovou
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC)
 Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
Doporučený postup při řešení krvácivých komplikací u nemocných léčených přímými inhibitory FIIa a FXa (NOAC) Preambule: Dabigatran, rivaroxaban, apixaban jsou nová perorální antikoagulancia (NOAC), jejichž
Fludeoxythymidine ( 18 F) 1 8 GBq k datu a hodině kalibrace voda na injekci, chlorid sodný 9 mg/ml
 Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
Příbalová informace Informace pro použití, čtěte pozorně! Název přípravku 3 -[ 18 F]FLT, INJ Kvalitativní i kvantitativní složení 1 lahvička obsahuje: Léčivá látka: Pomocné látky: Léková forma Injekční
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. Metacam 5 mg/ml injekční roztok pro skot a prasata
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Metacam 5 mg/ml injekční roztok pro skot a prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje: Léčivá látka: Meloxicamum
Prevence ilní tromboembolické nemoci: obecnì platná pravidla
 XII. Paøízkovy dny, Nový Jièín, 16. 17. bøezen 2006 Prevence ilní tromboembolické nemoci: obecnì platná pravidla J. Gumulec 1, M. Penka 2, R. Bezděk 3, M. Wróbel 1, P. Kessler 4, M. Brejcha 1, D. Klodová
XII. Paøízkovy dny, Nový Jièín, 16. 17. bøezen 2006 Prevence ilní tromboembolické nemoci: obecnì platná pravidla J. Gumulec 1, M. Penka 2, R. Bezděk 3, M. Wróbel 1, P. Kessler 4, M. Brejcha 1, D. Klodová
PŘEHLEDOVÉ ČLÁNKY. c) indikace trombolytické léčby u středně závažné plicní embolie.
 OTAZNÍKY KOLEM PREVENCE A LÉČBY TROMBOEMBOLICKÉ NEMOCI V ROCE 2006 prof. MUDr. Jaroslav Malý, CSc., prof. MUDr. Jiří Widimský, DrSc., FESC. II. interní klinika LF a FN, Hradec Králové Subkatedra kardiologie
OTAZNÍKY KOLEM PREVENCE A LÉČBY TROMBOEMBOLICKÉ NEMOCI V ROCE 2006 prof. MUDr. Jaroslav Malý, CSc., prof. MUDr. Jiří Widimský, DrSc., FESC. II. interní klinika LF a FN, Hradec Králové Subkatedra kardiologie
sp.zn. sukls220013/2015
 sp.zn. sukls220013/2015 Příbalová informace: informace pro uživatele FRAXIPARIN MULTI, injekční roztok (Nadroparinum calcicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
sp.zn. sukls220013/2015 Příbalová informace: informace pro uživatele FRAXIPARIN MULTI, injekční roztok (Nadroparinum calcicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls61251/2015 a k sp. zn. sukls77932/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZIBOR 2500 IU Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum
sp. zn. sukls61251/2015 a k sp. zn. sukls77932/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZIBOR 2500 IU Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum
HIT II a alternativní antikoagulace pro vedení MO mezinárodní doporučení a naše praxe
 HIT II a alternativní antikoagulace pro vedení MO mezinárodní doporučení a naše praxe Jan Kunstýř Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty UK a Všeobecné fakultní nemocnice
HIT II a alternativní antikoagulace pro vedení MO mezinárodní doporučení a naše praxe Jan Kunstýř Klinika anesteziologie, resuscitace a intenzivní medicíny 1. lékařské fakulty UK a Všeobecné fakultní nemocnice
RADA A POUČENÍ LÉKAŘE
 RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
RADA A POUČENÍ LÉKAŘE Obsah: Uživatelky kombinované hormonální antikoncepce Léčebné účinky kombinované hormonální antikoncepce Kontraindikace kombinované hormonální antikoncepce Vysvětlivky: COC = z anglického
EDUKAČNÍ MATERIÁLY. Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE
 1 PRADAXA EDUKAČNÍ MATERIÁLY Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO
1 PRADAXA EDUKAČNÍ MATERIÁLY Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II. Vědecké závěry a zdůvodnění změny v registraci
 Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Příloha II Vědecké závěry a zdůvodnění změny v registraci 6 Vědecké závěry Celkové shrnutí vědeckého hodnocení přípravku Cymevene i.v. a souvisejících názvů (viz příloha I) Evropská komise jménem všech
Pro koho nová antikoagulancia?
 Pro koho nová antikoagulancia? Špinar J. FN Brno a LF MU Things we knew, things we did Things we have learnt, things we should do Fibrilace síní Hluboká žilní trombóza Plicní embolie Intrakardiální tromby
Pro koho nová antikoagulancia? Špinar J. FN Brno a LF MU Things we knew, things we did Things we have learnt, things we should do Fibrilace síní Hluboká žilní trombóza Plicní embolie Intrakardiální tromby
Novinky v diagnostice a léčbě akutní plicní embolie v roce 2013
 Novinky v diagnostice a léčbě akutní plicní embolie v roce 2013 Jiří Widimský, Klinika kardiologie IKEM Praha Česká a evropská klasifikace akutní plicní embolie (APE) Masivní plicní embolie stejná klasifikace
Novinky v diagnostice a léčbě akutní plicní embolie v roce 2013 Jiří Widimský, Klinika kardiologie IKEM Praha Česká a evropská klasifikace akutní plicní embolie (APE) Masivní plicní embolie stejná klasifikace
Eliquis (apixaban) Návod k preskripci
 Tento léčivý přípravek podléhá dalšímu sledování. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky prostřednictvím národního systému hlášení. Eliquis (apixaban) Návod
Tento léčivý přípravek podléhá dalšímu sledování. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky prostřednictvím národního systému hlášení. Eliquis (apixaban) Návod
Pioneer in Rare Diseases. Pozvánka na satelitní sympozium společnosti SOBI. Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B?
 Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Pioneer in Rare Diseases Pozvánka na satelitní sympozium společnosti SOBI Co přináší Fc technologie do léčby dětských pacientů s hemofilií A i B? Vážená paní doktorko, vážený pane doktore, dovolte, abychom
Elektronické srdce a plíce CZ.2.17/3.1.00/33276
 21. Otok jedné dolní končetiny (hluboká žilní trombóza) Pacientka L. S., 1973 1. Popis případu a základní anamneza: 30-letá pacientka, v 7. měsící gravidity pozorovala den před přijetím do nemocnice otok
21. Otok jedné dolní končetiny (hluboká žilní trombóza) Pacientka L. S., 1973 1. Popis případu a základní anamneza: 30-letá pacientka, v 7. měsící gravidity pozorovala den před přijetím do nemocnice otok
Bevacizumab u starších pacientů s kolorektálním karcinomem
 Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
Bevacizumab u starších pacientů s kolorektálním karcinomem MUDr. Tomáš Büchler, PhD. Onkologické oddělení Fakultní Thomayerovy nemocnice a Onkologická klinika 1. lékařské fakulty UK a VFN, Praha XIV. Staškovy
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls177328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZIBOR 3500 IU Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum natricum: 3500 IU
sp. zn. sukls177328/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ZIBOR 3500 IU Injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Bemiparinum natricum: 3500 IU
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 75 mg dabigatranum etexilatum báze (ve formě mesylátu)
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Pradaxa 75 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje 75 mg dabigatranum etexilatum báze (ve formě mesylátu)
Executive Summary. American College of Chest Physicians Evidence-Based Clinical Practice Guideline (8th Edition) Česká verze
 Antithrombotic and thrombolytic therapy Executive Summary American College of Chest Physicians Evidence-Based Clinical Practice Guideline (8th Edition) Česká verze ČSTH ČESKÁ SPOLEČNOST PRO TROMBÓZU A
Antithrombotic and thrombolytic therapy Executive Summary American College of Chest Physicians Evidence-Based Clinical Practice Guideline (8th Edition) Česká verze ČSTH ČESKÁ SPOLEČNOST PRO TROMBÓZU A
Tromboprofylaxe urologických a onkourologických výkonů
 203 Tromboprofylaxe urologických a onkourologických výkonů MUDr. Michaela Matoušková, doc. MUDr. Miroslav Hanuš, CSc. Urocentrum Praha Rozšiřující se rozsah a radikalita operačních výkonů především u rizikových
203 Tromboprofylaxe urologických a onkourologických výkonů MUDr. Michaela Matoušková, doc. MUDr. Miroslav Hanuš, CSc. Urocentrum Praha Rozšiřující se rozsah a radikalita operačních výkonů především u rizikových
DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE)
 PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
PŘÍLOHA III 1 DODATKY, KTERÉ MAJÍ BÝT DOPLNĚNY DO PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU LÉČIVÝCH PŘÍPRAVKŮ OBSAHUJÍCÍCH NIMESULID (SYSTÉMOVÉ FORMULACE) Dodatky jsou psány kurzívou a podtrženě, vymazané
Pradaxa (dabigatran-etexilát)
 Edukační materiály Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO KOLENNÍHO
Edukační materiály Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO KOLENNÍHO
Antiagregační zajištění pacienta s koronárním stentem. Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK
 Antiagregační zajištění pacienta s koronárním stentem Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK Antiagregační zajištění pacienta s koronárním stentem Typ stentu Důvod revaskularizace
Antiagregační zajištění pacienta s koronárním stentem Petr Toušek III.Interní-kardiologická klinika FNKV a 3.LF UK Antiagregační zajištění pacienta s koronárním stentem Typ stentu Důvod revaskularizace
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Ladislav Plánka Klinika dětské chirurgie ortopedie a traumatologie Fakultní nemocnice Brno
 Poranění jater u dětí Slavnostní konference k 20. výročí vzniku Traumatologického centra Fakultní nemocnice Ostrava Ladislav Plánka Klinika dětské chirurgie ortopedie a traumatologie Fakultní nemocnice
Poranění jater u dětí Slavnostní konference k 20. výročí vzniku Traumatologického centra Fakultní nemocnice Ostrava Ladislav Plánka Klinika dětské chirurgie ortopedie a traumatologie Fakultní nemocnice
Informace pro předepisování přípravku Xarelto (rivaroxaban)
 Informace pro předepisování přípravku Xarelto (rivaroxaban) 2 Informace pro předepisování přípravku Xarelto Karta pacienta 4 Doporučení pro dávkování 4 Dávkování u pacientů s fibrilací síní 4 Renální insuficience
Informace pro předepisování přípravku Xarelto (rivaroxaban) 2 Informace pro předepisování přípravku Xarelto Karta pacienta 4 Doporučení pro dávkování 4 Dávkování u pacientů s fibrilací síní 4 Renální insuficience
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU ECOPORC SHIGA injekční suspenze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka 1 ml obsahuje: Léčivá látka:
EDUKAČNÍ MATERIÁLY. Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE
 1 PRADAXA EDUKAČNÍ MATERIÁLY Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO
1 PRADAXA EDUKAČNÍ MATERIÁLY Pradaxa (dabigatran-etexilát) DOPORUČENÍ PRO PŘEDEPISUJÍCÍ LÉKAŘE PRO INDIKACI PRIMÁRNÍ PREVENCE ŽILNÍCH TROMBOEMBOLICKÝCH PŘÍHOD U PACIENTŮ PO TOTÁLNÍ NÁHRADĚ KYČELNÍHO NEBO
