ČÍSLO 3, 2008 ÈASOPIS PRO MO DER NÍ PSY CHI AT RII REPRINT NOVÁ PSYCHOFARMAKA V LÉÈBÌ PRIMÁRNÍ INSOMNIE U STARŠÍCH OSOB JAROMÍR ŠVESTKA ROÈNÍK 12
|
|
|
- Jindřich Vopička
- před 9 lety
- Počet zobrazení:
Transkript
1 ČÍSLO 3, 2008 PSY CHI AT RIE ÈASOPIS PRO MO DER NÍ PSY CHI AT RII REPRINT NOVÁ PSYCHOFARMAKA MELATONIN S PRODLOUŽENÝM ÚÈINKEM V LÉÈBÌ PRIMÁRNÍ INSOMNIE U STARŠÍCH OSOB JAROMÍR ŠVESTKA ROÈNÍK ISSN EXCERPOVÁNO V BIBLIOGRAPHIA MEDICA ČECHOSLOVACA INDEXOVÁNO V EMBASE - EXCERPTA MEDICA
2 Fórum Èeské neuropsychofarmakologické spoleènosti PSYCHIATRIE ROÈNÍK ÈÍS LO 3 Rubrika Fórum Èeské neuropsychofarmakologické spoleènosti se zamìøuje na pravidelná sdìlení z oblasti neuropsychofarmakologie. Informuje o aktualitách našeho oboru, pøináší podrobné pøehledy individuálních preparátù nebo charakteristiky skupin psychofarmak a zabývá se neurobiologií úèinku tìchto lékù. Jako platforma Èeské neuropsychofarmakologické spoleènosti (ÈNPS) pøináší také informace z oblasti lékové politiky a informuje o aktuálním dìní v ÈNPS. doc. MUDr. Jiøí Horáèek, Ph.D., pøedseda ÈNPS NOVÁ PSYCHOFARMAKA MELATONIN S PRODLOUŽENÝM ÚÈINKEM V LÉÈBÌ PRIMÁRNÍ INSOMNIE U STARŠÍCH OSOB PROLONGED-RELEASE MELATONIN IN THE TREATMENT OF PRIMARY INSOMNIA IN ELDERLY PEOPLE JAROMÍR ŠVESTKA Psychiatrická klinika FN Brno SOUHRN Insomnie je èastou psychickou poruchou se závažnými dùsledky pro zdraví pacientù. Melatonin navozuje spánek a udržuje spánkový rytmus. Exogenní melatonin pøevážnì ve formì potravinového doplòku úspìšnì ovlivnil nìkteré poruchy spánkového rytmu, ale nebyl dostateènì úèinný v léèbì insomnie s výjimkou starších nemocných. Melatonin s prolongovaným uvolòováním (f. o. Circadin Neurim/ Lundbeck) má delší vyluèovací poloèas a napodobuje sekreci endogenního melatoninu. Melatonin s prolongovaným uvolòováním u starších nemocných s primární insomnií zlepšil kvalitu spánku, ranní bdìlost a aktivitu a zkrátil spánkovou latenci. Klíèová slova: insomnie, poruchy spánkového rytmu, melatonin SUMMARY Insomnia is a frequent psychiatric disorder with severe consequences for patient health. Melatonin induces sleep and retains sleep rhythm. Exogenous melatonin mostly as over-the-counter was effective in some sleep rhythm disorders. Melatonin was not sufficiently effective in the treatment of insomnia except elderly people. Prolonged-release melatonin (Circadin Neurim/Lundbeck) has longer half- -time and imitates endogenous melatonin secretion. Prolonged-release melatonin improved sleep quality, morning alertness and sleep latency in elederly patients with primary insomnia. Key words: insomnia, sleep rhythm disorders, melatonin Švestka J. Melatonin s prodlouženým úèinkem v léèbì primární insomnie u starších osob. Psychiatrie 2008; 12(3): Insomnie je jednou z nejèastìjších psychických poruch u nemocných v primární i psychiatrické péèi. Insomnie patøí mezi spánkové poruchy a znamená nemožnost dosáhnout adekvátní kvantity a kvality spánku. Pro stanovení diagnózy insomnie je nutný výskyt narušených denních funkcí po noci s insomnií. Narušené funkce zahrnují poruchy pozornosti, únavu, ospalost, nevýkonnost, snížení energie, iniciativnosti a motivovanosti, cefalgii a/nebo obavy z nespavosti (MKN-10, DSM- IV TR). Kvantitativní poruchy spánku spoèívají v ztíženém usínání, pøedèasném probouzení, èastém probouzení v noci, zatímco kvalititativní poruchy jsou charakterizovány neo- 160
3 PSYCHIATRIE ROÈNÍK ÈÍS LO 3 Fórum Èeské neuropsychofarmakologické spoleènosti svìžujícím, povrchním a neklidným spánkem. Kvalitativní poruchy spánku naruší obecnou kvalita života nemocných s insomnií více než kvantitativní. Insomnii dìlíme na primární (neorganickou) a sekundární (somatickou, organickou). Primární insomnie není zpùsobena dalšími psychickými nebo somatickými chorobami nebo farmaky èi drogami. Insomnie sekundární (somatická, organická) je doprovodným pøíznakem jiných psychických a/nebo somatických onemocnìní. Výskyt insomnie Dle epidemiologických studií cca 30 % dospìlých osob udávalo jeden a více symptomù insomnie jako ztížené usínání, obtíže s udržením spánku, pøedèasné probouzení èi neosvìžující spánek (Ancoli-Israel et al., 1999). Pokud do epidemiologických studií zahrneme i podmínku zhoršení funkcí èi distres následující den, prevalence insomnie poklesne na 5 10 % populace (NIMH Science Conference Statement, 2005). Jestliže do definice insomnie jsou dle MKN-10 zahrnuta i kritéria délky insomnie, prevalence se dále sníží na 6 %. Pøi použití telefonického strukturovaného interview ve 4 evropských zemích po zaèlenìní i kritéria narušené denní aktivity byla zjištìna insomnie u 19,1 % populace, avšak do diagnózy byla zahrnuta nejen primární, ale i sekundární insomnie; 28 % osob s takto zjištìnou insomnií trpìlo souèasnì psychickými poruchami a u 26 % byla v minulosti diagnostikována psychická porucha (Ohayon et al., 2003). Ve starším vìku dochází k èastìjším poruchám spánku ve smyslu ztíženého usínání, pøedèasného ranního probouzení, vyššího poètu noèních probuzení a pospávání pøes den. Dochází k pøedcházení spánkové fáze. Spánek je zvýšenì fragmentovaný a snižuje se kvalita spánku (Avidan, 2002; 2005). Dochází rovnìž k zmìnì architektury spánku: k redukci hlubokého NREM spánku fáze III a IV, zvýšení zastoupení lehkého NREM spánku fáze I a II, prodloužení REM latence a k snížení procentuálního zastoupení REM spánku. Sekrece melatoninu je snížena a opoždìna (Haimov et al., 1994; Brzezinski et al., 1997 aj.). Insomnie se vyskytuje u % nehospitalizovaných starších osob (Foley et al., 1999). Vysoký výskyt insomnie u starších osob souvisí i s vyšší somatickou komorbiditou (National Sleep Foundation, 2003). V dùsledku insomnie dochází u starších osob k 1,52krát vyššímu výskytu pádù, které nejsou zpùsobeny podáváním benzodiazepinù (Avidan et al., 2005). Cyklus spánku a bdìní Cirkadiánní rytmus spánku a bdìní udržují neurotransmitery navozující bdìlost (noradrenalin, dopamin, histamin, glutamat, acetylcholin) nebo sedaci/spánek (GABA, serotonin, endorfiny a enkefaliny). Dalším endogenním neurohormonem je melatonin (v dalším MLT), jehož sekrece po dobu noci (setmìní) navozuje a udržuje spánek a po skonèení syntézy a uvolòování MLT dojde k dennímu bdìní. Biologické hodiny spánku a bdìní jsou lokalizovány v n. suprachiasmaticus v CNS. Po setmìní se aktivuje retino-hypotalamo-epifyzální dráha, která zahájí a udržuje tvorbu a uvolòování MLT (Illnerová et al., 2000). Dùsledky insomnie Insomnie má závažné dùsledky pro zdraví pacientù. Nemocní s insomnií mají 3,5 4,5krát vyšší riziko nehodovosti (1,5krát vyšší výskyt pracovních a 2,5krát dopravních nehod a jiných zranìní (Leger et al., 2002). Pacienti s insomnií jsou více nemocní než populace bez této poruchy spánku; více navštìvují lékaøe, mají více provedených lékaøských vyšetøení, jsou èastìji hospitalizováni (Novak et al., 2004). U nemocných s insomnií se èastìji vyskytují psychické poruchy (zejména deprese) proti osobám bez insomnie (40 % vs. 16,4 %) (Weissman et al., 1997). U nemocných s insomnií se èastìji vyskytují ze somatických chorob hypertenze, ischemická choroba srdeèní, diabetes mellitus, neurologické poruchy, plicní onemocnìní, urologické a gastrointestinální problémy, chronická bolest a u starších osob pády a následné zlomeniny oproti nemocným bez insomnie (Nevšímalová et al., 2007; Avidan et al., 2005; Mallon et al., 2002; 2005). Platí i opaèná souvislost, tj. u nemocných s psychickými a somatickými poruchami se více vyskytuje insomnie než u psychicky a somaticky zdravých jedincù (Taylor et al., 2007). Pacienti s chronickou insomnií jsou v zamìstnání ménì výkonní, mají více absencí a více pracovních úrazù (Leger et al., 2006). Snížená kvalita spánku vede k snížení kvality života (Leger et al., 2001; Zammit et al., 1999). Insomnie u starších osob Melatonin a spánek Melatonin je neurohormon produkovaný epifýzou. MLT byl poprvé izolován z epifýzy v r (Lerner et al., 1958). Je vytváøen ze serotoninu dvìma enzymy, N-acetyltransferázou a hydroxyindol-o-metyltransferázou (pøehled Šonka, 2008). Exogennì podaný MLT má velmi krátký biologický poloèas t 1/ min. (Mallo et al., 1990). MLT je metabolizován v játrech na 6-hydroxymelatonin s následným vytváøením sulfátù a glukuronidù. Pøi jaterní dysfunkci dochází k signifikantnímu prodloužení vyluèovacího poloèasu MLT. Exogenní MLT je rychle metabolizován pøi prvém prùchodu játry s biologickou dostupností jen z % a ze 70 % se váže na krevní bílkoviny (Claustrat et al., 2005). Rychle prostupuje hematoencefalickou bariérou a dle PET vyšetøení po intravenózní aplikaci dosahuje maximální koncentrace v CNS za 6 8 min. MLT pùsobí jako agonista melatoninových MT-1 a MT-2 receptorù, které jsou spojeny s rùznými G proteiny a jejich sekundárními posly (Dubocovich et al., 2005; Vanìèek, 1998). Melatoninové MT-1 receptory jsou nejvíce zastoupeny v epifýze a MT-2 receptory v epifýze a n. suprachiasmaticus. Melatoninové MT-1 receptory inhibují vzplanutí neuronù v n. suprachiasmaticus a jejich agonizace navozuje spánek; u zvíøat jsou zodpovìdné za vasokonstrikci. Melatoninové MT-2 receptory regulují rytmus spánku/bdìní a inhibují vasokonstrikci u zvíøat (Brzezinski, 1997). MLT se váže i na melatoninové MT-3 receptory, které patøí do skupiny chinon reduktázy. Popsány byly i intracelulární jádrové receptory BZR/ROR (Zlotos et al., 2005; Carlsberg et al., 1995). Funkce melatoninových MT-3 a jádrových melatoninových receptorù není pøíliš objasnìna. MLT má také pøímý vliv na intracelulární proteiny jako je kalmodulin (Benitez-King et al., 2006) 161
4 Fórum Èeské neuropsychofarmakologické spoleènosti PSYCHIATRIE ROÈNÍK ÈÍS LO 3 a má vyjádøené vlastnosti zametaèe volných radikálù (Tan et al., 2007). MLT snad mírnì snižuje tìlesnou teplotu a má imunostimulaèní úèinek (Macchi, Bruce, 2004; Maestroni, 2001). Melatonin v léèbì poruch spánku Melatonin byl ovìøován v léèbì a) poruch rytmu spánku a bdìní a b) v terapii primární i sekundární insomnie pøevážnì ve formì potravinového doplòku. a) Melatonin v terapii poruch spánkového rytmu Melatonin byl podáván u osob s rùznými poruchami spánkového rytmu, a to u jet-lagu, opoždìné spánkové fáze, pøi poruchách spánku u osob s noèními smìnami a pøi volnì plynoucím spánkovém rytmu u slepých osob. Jet-lag Jet lag je desynchronizace rytmu spánek a bdìní pøi pøeletu více èasových pásem. Projevuje se zvýšenou únavou, narušenou psychomotorickou koordinací, noèní nespavostí, nechutenstvím a snížením kognitivních funkcí (Srinivasan et al., 2008). Vznik a intenzita symptomù závisí na délce letu a smìru letu; lety na východ zpùsobují èastìjší a závažnìjší jet-lag syndrom. Možnou léèbou je podávání MLT po dobu 3 5 dnù v dobì spánku dle místního èasu. Pøi pøechodu více než 7 8 èasových pásem je doporuèeno MLT podávat již 2 3 dny pøed letem (Mogenthaler et al., 2007). Léèba MLT se doporuèuje pøi pøekroèení 5 a více èasových pásem a pøi jet lagu v anamnéze. MLT v léèbì jet lagu byl zkoušen ve 12 dvojitì slepých placebem kontrolovaných studiích s cca 730 osobami (American Academy of Sleep Medicine, Sack et al., 2007). V 10/12 studií MLT úèinkoval významnì lépe než placebo a zkracoval spánkovou latenci, zlepšoval kvalitu spánku, snižoval denní únavnost a ospalost. MLT byl podáván v denních dávkách 0,5 10 mg. Dávky 0,5 a 5 mg byly stejnì úèinné, ale spánková latence byla kratší pøi aplikaci 5 mg a dávky nad 5 mg již nebyly úèinnìjší (Cochrane Database System Review, Herxheimer, Petrie 2002). Ve 2 studiích byl MLT podáván ve formì prolongovanì pùsobících tablet po 2 mg a v obou byl úèinnìjší než placebo, stejnì úèinný jako zopiklon a prvou noc ménì úspìšný než zolpidem (Suhner et al., 1998; Paul et al., 2004). Syndrom opoždìné spánkové fáze MLT byl shledán úèinným i u opoždìné spánkové fáze. Ve 3 dvojitì slepých a 2 otevøených studiích s cca 130 pacienty byly výsledky 4 12týdenní léèby MLT v denních dávkách 0,3 5 mg úspìšné (Mundey et al., 2005; Dahlitz et al., 1991; Dagan et al., 1998; Kayumov et al., 2001; Kamei et al., 2000). Posun spánkové fáze do normálního rytmu byl potvrzen i polysomnografickým vyšetøením (zkrácení spánkové latence) a normalizací rytmu vyluèování 6-sulfatoxymelatoninu. Druhý den ráno se pacienti léèení MLT cítili ménì unavení a ménì ospalí než osoby dostávající placebo (Kayumov et al., 2001). Délka léèby MLT èinila vìtšinou 4 až 12 týdnù, ale po ukonèení terapie byl pozorován vysoký výskyt relapsù (Dagan et al., 1998). Posun spánkové fáze pøi práci v noèních smìnách U zamìstnancù pracujících v noèních smìnách byl podáván ráno MLT v dávce 1,8 10 mg v 7 dvojitì slepých placebem kontrolovaných studiích u cca 150 osob (American Academy of Sleep Medicine, Sack et al., 2007). Výsledky bylo velmi problematické hodnotit, protože 1/3 studií byla provedena jen jako laboratorní simulace a byly použity velmi rùzné dávky a èasování aplikace MLT. Jen ve 3/7 studií se MLT významnì lišil od placeba ve zlepšení délky a kvality denního spánku a vyšší noèní bdìlosti. Volnì bìžící spánkový rytmus u slepcù U % slepých osob dochází k volnì bìžícímu spánkovému rytmu, který není korigován støídáním svìtla a tmy. Ve 3 jednoduše slepých a 1 otevøené studii vedla léèba MLT k resynchronizaci cirkadiánního rytmu u malého poètu cca 30 léèených (Sack et al., 2007). Resynchronizace rytmu byla kontrolována vyluèováním 6-sulfatoxymelatoninu a kortizolu v moèi. V jediné studii bylo provedeno i polysomnografické vyšetøení, které prokázalo nižší poèet noèních probuzení a vìtší spánkovou úèinnost MLT proti placebu (Sack et al., 2000). b) Melatonin v léèbì insomnie V r a 2005 byla publikována dosud nejrozsáhlejší meta-analýza terapeutického úèinku MLT u primárních a sekundárních poruch spánku, tj. zejména insomnie, ale i poruch spánkového rytmu (Buscemi et al., 2004). Do analýzy bylo zaøazeno 34 publikovaných studií s 420 osobami léèenými MLT a 390 osobami dostávajícími placebo v letech Podmínkou zaèlenìní do meta-analýzy bylo dvojitì slepé, placebem kontrolované uspoøádání studie. Délka studií èinila 4 týdny a ménì a MLT byl podáván v rozmezí 0,1 75 mg na noc. Velikost jednotlivých souborù byla malá, od 12 do 40 osob nebo pacientù. Pøi podávání zdravým dobrovolníkùm bez poruchy spánku MLT zkrátil spánkovou latenci (p = 0,00001), zvýšil spánkovou úèinnost (p = 0,005), ale nezmìnil REM latenci. Autoøi pøesto zkrácení spánkové latence a zvýšení spánkové úèinnosti pro malou velikost úèinku (effect size) oznaèili za klinicky nesignifikantní. Pøi primárních poruchách spánku (vìtšinou insonie, ale i poruchy rytmu spánku) bylo statisticky signifikantní jen zkrácení spánkové latence po MLT proti placebu (p = 0,003), ale i to autoøi oznaèili za klinicky nesignifikantní výsledky. MLT v léèbì primárních poruch spánku významnì neovlivnil celkovou délku spánku, zastoupení REM spánku, poèet probouzení v noci ani neovlivnil kvalitu života (Buscemi et al., 2004). U sekundárních poruch spánku pøi somatických a neuro-psychiatrických onemocnìních MLT proti placebu zvýšil spánkovou úèinnost (p = 0,007), což autoøi oznaèili za klinicky nevýznamné, a nesignifikantnì prodloužil celkovou dobu spánku, neovlivnil poèet probouzení v noci ani délku zastoupení REM spánku (Buscemi et al., 2004). V této meta-analýze v 6 randomizovaných kontrolovaných studiích s 97 pacienty MLT nezkrátil spánkovou latenci proti placebu. Snášenlivost MLT v této meta-analýze krátkodobých studií byla výborná. Z nežádoucích úèinkù byly nejèastìji pozorovány cefalgie (u 5 % léèených), závratì (1,4 %) a ospalost (4,5 %), ale jejich výskyt nebyl rozdílný od skupiny dostávající placebo. Dùležitým faktorem bylo èasování ( timing ) podání MLT, který navodil spánek u zdravých dobrovolníkù pøi podání v 18 hod., ale neovlivnil insomnii pøi podání v hod. (Stone et al., 2000). Vrchol plazmatické koncentrace MLT po jednorázové aplikaci v dávce 0,1 1 mg v 21 hod. koreloval s navozením spánku (Zhdanova et al., 1996). 162
5 PSYCHIATRIE ROÈNÍK ÈÍS LO 3 Fórum Èeské neuropsychofarmakologické spoleènosti Rovnìž Randall se spoluprac. (2008) se domnívají, že MLT je neúèinný v léèbì primární insomnie v dávkách 0,3 5 mg. MLT se nelišil od placeba v spánkové a REM latenci, celkové dobì spánku, spánkové úèinnosti, poètu probuzení v noci, prùmìrné délce a procentuálním zastoupení NREM a REM spánku, délce jednotlivých spánkových fází, kvalitì spánku, mìøeno polysomnograficky a dotazníky. Autoøi zdùrazòují, že MLT mùže být úèinný u poruch spánkové rytmu a insomnie u starších osob, kde po léèbì MLT dojde k normalizaci plazmatických koncentrací melatoninu. Melatonin a insomnie ve starším vìku V prùbìhu vìku dochází k postupnému snížení sekrece MLT a melatoninová fáze se stává ménì stabilní a více dispersní. Plazmatická koncentrace MLT u starších osob s insomnií dosahuje jen 66 % plazmatických hladin u starších osob bez insomnie a jen 33 % oproti mladším osobám ve vìku let (Leger et al., 2004). Starší osoby s insomnií mají významnì nižší vrchol exkrece 6-sulfatoxymelatoninu (metabolit melatoninu) a jeho pozdìjší nástup než starší osoby bez insomnie (Haimov et al., 1994). Výsledky léèby MLT u starších osob bez somatické komorbidity z 15 studií byly podrobeny meta-analýze (Brzezinski et al., 2005). MLT proti placebu signifikantnì zkrátil spánkovou latenci (v prùmìru o 3,9 min), zvýšil úèinnost spánku (prùmìrnì o 3,1 %) a prodloužil celkovou dobu spánku (prùmìrnì o 13,7 min). Øada autorù zjistila, že léèba MLT u insomnie ve stáøí je úspìšná pøedevším u osob s deficitem MLT (Leger et al., 2004; Zhdanova et al., 2001; Garfinkel et al., 1995, Wurtman et al., 1995), ale jiní autoøi nezjistili korelaci plazmatických koncentrací MLT s úpravou spánku (Hughes et al., 1998; Baskett et al., 2003). Melatonin PR (prolonged release) Melatonin-PR (PR = prolonged release; f.o. Circadin firmy Neurim Pharmaceuticals, zástupce držitele registrace pro ÈR firma Lundbeck) byl uveden na trh v ÈR v r Melatonin-PR (v dalším MLT-PR) zvyšuje plazmatické koncentrace melatoninu, které jsou pøedevším u starších osob nízké. Po MLT-PR se zvyšuje jeho koncentrace v krvi na dobu nìkolika hodin a napodobuje tak køivku koncentrace endogenního melatoninu v lidském organizmu. Absorpce perorálnì podaného MLT-PR je témìø úplná, ale klesá až o 50 % ve starším vìku. Rovnìž jídlo zpomaluje absorpci melatoninu. Pøi prvém prùchodu játry se metabolizuje až 85 % podaného melatoninu, a proto je jeho biologická využitelnost nízká jen %. Maximální koncentrace v plazmì po MLT-PR je dosaženo za 3 hod. Melatonin se z % váže na plazmatické bílkoviny. Hlavním metabolitem je 6-sulfatoxymelatonin (6-SMT), který je biologicky inaktivní a je z % vyluèován moèí. MLT-PR má biologický poloèas t 1/2 3,5 4 hod. MLT-PR je z 90 % metabolizován v játrech CYP1A1 a 1A2, minimálnì pomocí CYP2C9 a 2C19. Melatonin PR (f. o. Circadin) je registrován v ÈR v indikaci krátkodobé léèby primární insomnie charakterizované špatnou kvalitou spánku u pacientù starších 55 let (EMEA/H/C/695, 2007). Výrobce doporuèuje MLT-PR požít 1 2 hod. pøed plánovaným spánkem v dávce 2 mg p.o. po dobu maximálnì 3 týdnù. Klinické studie s melatoninem PR v léèbì primární insomnie MLT-PR byl zkoušen v léèbì primární insomnie u osob starších 55 let v 7 dvojitì slepých a placebem kontrolovaných studiích s celkem 989 pacienty, trvajících 7 21 dnù (viz tab. 1). Údaje z èasové extenze nìkterých studií nebyly dosud publikovány. Prvé 3 malé studie nebyly organizovány výrobcem. Ve vìtšinì studií k hodnocení zmìn spánku byly použity subjektivní stupnice (nejèastìji LSEQ Leeds Sleep Evaluation Qustionnaire, hodnocený metodou VAS (Visual Analog Scale) a dále PSQI Pittsburgh Sleep Quality Index aj.), ve 3 studiích byla provedena aktigrafická vyšetøení, ve 2 vyšetøení melatoninu v krvi nebo metabolitu melatoninu v moèi, v jediné studii bylo využito souèasnì provádìné polysomnografie a baterie testù k sledování pozornosti, bdìlosti a psychomotoriky a v další studii byla mìøena bazální tìlesná teplota. Po zamítnutí registrace MLT-PR EMEA v r byly po konzultacích s experty EMEA (EMEA, 2007) provedeny další studie. V prvé exploratorní studii po úvodním placebo intervalu 20 starších nemocných s insomnií užívalo po dobu 7 dnù melatonin-ir (immediate release, v dalším MLT-IR) 2 mg/noc nebo MLT-PR 2 mg/noc nebo placebo (Haimov et al., 1995). Poté všichni pacienti otevøenì dostávali melatonin-pr 1 mg po dobu 2 mìsícù. Prùbìh spánku byl sledován aktigraficky a sadou dotazníkù. MLT-IR 2 mg zkracoval spánkovou latenci, ale neprodlužoval spánek; MLT-PR 2 mg udržoval spánek (tj. zvyšoval spánkovou úèinnost a úroveò denní aktivity), po vysazení po 2 mìsících užívání došlo k opìtnému zhoršení spánku. V druhé dvojitì slepé zkøížené placebem kontrolované studii byl podáván MLT-PR 2 mg nebo placebo 12 nemocným 2 hod. pøed spaním po dobu 3 týdnù (Garfinkel et al., 1995). Spánkové parametry byly kontrolovány aktigrafií a pomocí vyluèování 6-SMT. Noèní exkrece 6-SMT byla signifikantnì nižší než u starších osob bez insomnie. Pøi léèbì MLT-PR oproti podávání placeba bylo dosaženo vyšší spánkové úèinnosti a probouzení po spánku bylo významnì kratší. Zkrátila se i spánková latence po MLT-PR (statisticky nevýznamnì). Celková doba spánku nebyla zmìnìna ani MLT-PR ani placebem. V tøetí dvojitì slepé zkøížené studii byla porovnána rùzná schémata a formy podávání MLT u starších osob s insomnií (Hughes et al., 1998). MLT-IR 0,5 mg byl podán 30 min. nebo 4 hod. pøed spánkem a srovnán v úèinnosti s MLT-PR požitým 30 min. pøed spánkem a s placebem. Mezi aktivní léky byly vloženy 2 týdny bez terapie. U všech 3 skupin léèených MLT došlo k významnì vyššímu zkrácení spánkové latence než po placebu, ale nebyly nalezeny žádné rozdíly mezi melatoninem a placebem v celkové délce spánku, spánkové úèinnosti èi poètu probuzení v noci. Pacienti s nízkou koncentrací MLT v krvi nebyli preferenèními respondéry. Podání MLT-IR korelovalo s poklesem tìlesné teploty. V jediné polysomnograficky kontrolované dvojitì slepé studii byla ovìøována úèinnost MLT-PR a placeba u 40 pacientù starších 55 rokù a trpících primární insomnií (studie nepublikována samostatnì, ale uvedena v registraèním svazku EMEA, 2007). Spánkové parametry byly sledovány krom polysomnografie také aktigrafií, LSEQ (Leeds Sleep Evaluation Questionnaire) a byla sledována pozornost, bdìlost a psychomotorika bateriemi testù. Primárním cílem bylo sledování celkové doby bdìlosti po usnutí a v tomto parametru se MLT- -PR nelišil od placeba po 3 týdnech léèby. Aktivní lék se nelišil od placeba ani v dalších parametrech jako v poètu probuzení, 163
6 Fórum Èeské neuropsychofarmakologické spoleènosti PSYCHIATRIE ROÈNÍK ÈÍS LO 3 Tabulka 1: Melatonin-PR v léèbì primární insomnie u starších pacientù (všechny studie dvojitì slepé, randomizované a kontrolované placebem). Autor, rok N Délka léčby Léky, denní dávky Výsledky Haimov et al., dnů MLT-PR 2 mg Garfinkel et al., dnů MLT-PR 2 mg Hughes et al., 1998?? MLT-PR 0,5 mg MLT-IR 0,5 mg EMEA, 2007 NEURIM I EMEA, 2007 NEURIM IV Lemoine et al., 2007 NEURIM VII Wade et al., 2007 NEURIM IX dnů MLT-PR 2 mg dnů MLT-PR 2 mg pak MLT-PR 0,2-0,5 5 mg dnů MLT-PR 2 mg dnů MLT-PR 2 mg Celkem: 7 studií dnů MLT-PR 2 mg MLT-PR > spánková latence, udržení spánku MLT-PR > spánková účinnost, probuzení MLT-PR = PL spánková latence, celková doba spánku MLT > spánková latence MLT = PL spánková latence, počet probuzení MLT-PR > spánková latence MLT-PR = PL délka bdělosti po usnutí MLT-PR > Respondéři 57 % v. 43 % (LSEQ zlepšení o 20 %) MLT-PR > kvalita spánku, ranní svěžest MLT-PR > kvalita spánku, ranní svěžest, spánková latence MLT-PR > kvalita spánku, ranní svěžest, spánková latence MLT-PR = melatonin s prolongovaným uvolňováním; PL = placebo; LSEQ = Leeds Sleep Evaluation Questionnaire spánkové úèinnosti, poètu spánkových fází, aktigrafických výsledcích a kvalitì spánku. Jediným významným rozdílem bylo vyšší zkrácení spánkové latence (- 9 min.) po MLT-PR proti placebu (p = 0,011). Zkrácení spánkové latence bylo orientaènì obdobné, jaké bylo dosaženo v jiných studiích se zolpidemem (- 8,1 min), zaleplonem (< 8 min.), zopiklonem a ramelteonem (- 10 min.) (Wade et al., 2008). V další nepublikované studii s kodovým oznaèením NEURIM IV bylo léèeno MLT-PR 2 mg nebo placebem 393 starších nemocných s primární insomnií (EMEA, 2007). Ke zlepšení LSEQ o 20 % došlo u 57 % léèených MLT-PR a 43 % dostávajících placebo. Poté byl vložen 2týdenní interval s podáváním placeba a pak byli nemocní rozdìleni na respondéry èi nonrespondéry dle výsledkù prvých 3 týdnù aktivní léèby. Dávky MLT-PR bylo možné zvýšit až na 5 mg. Nonrespondéøi na prvé podání MLT-PR 2 mg pozitivnì reagovali na zvýšenou dávku MLT-PR 5 mg a na prodloužení terapie. V pøedposlední studii u 170 starších nemocných s primární insomnií byl podáván MLT-PR 2 mg nebo placebo po dobu 3 týdnù v ambulancích praktických lékaøù (Lemoine et al., 2007). Primárním cílem bylo ovìøení zlepšení kvality spánku pomocí LSEQ a sekundárního chování pacientù po probuzení (další položky LSEQ, spánkový diáø, SF-36). Kvalita spánku byla významnì lépe ovlivnìna MLT-PR než placebem (rozdíl v prùmìru 5,97 mm v LSEQ-QOS (Quality of Sleep) ve VAS (Visual Analogue Scale) stupnici; p = 0,047) a rovnìž v chování po probuzení (p = 0,002). Rovnìž dle spánkového diáøe byla kvalita spánku úspìšnìji ovlivnìna MLT-PR než placebem (p = 0,003). Po vysazení MLT-PR nebyla pozorována rebound insomnie ani pøíznaky syndromu z odnìtí. Poslední dvojitì slepá placebem kontrolovaná studie Wadeho se spolupracovníky (2007) byla obdobná pøedposlední studii Lemoina et al. (2007). Bylo do ní zaøazeno 354 starších nemocných s primární insomnií a léèeno za dvojitì slepých podmínek buï MLT-PR 2 mg nebo placebem po dobu 3 týdnù. Primárním cílem bylo zlepšení chování po probuzení (hodnoceno dle LSEQ 10 mm) a sekundárními zlepšení kvality spánku, zkrácení spánkové latence a zlepšení denních aktivit (LSEQ, PSQI, WHO-5 well being index, CGI). MLT-PR zlepšil chování po probuzení více než placebo ( 10 mm 25 % léèených MLT-PR a 14 % pøi aplikaci placeba; p = 0,014) a rovnìž kvalitu spánku, spánkovou latenci a také kvalitu života (WHO-5). MLT-PR signifikantnì zlepšil uvedené spákové parametry jak u lehké, tak støednì tìžké a tìžké insomnie (rozdìlení dle celkového skóre PSQI). U tìchto nemocných byla také iniciálnì stanovena noèní exkrece 6-SMT a u 30 % ze všech nemocných byla zjištìna nízká exkrece 6-SMT 3,5 μg (Leger et al., 2004). Poèet respondérù ( 10 mm LSEQ) pøi nízké exkreci 6-SMT èinil 58 % léèených MLT-PR oproti 47 % pacientù s vyšší exkrecí 6-SMT. Iniciální nízká exkrece 6-SMT predikovala úspìšnost léèby insomnie MLT-PR. Poolovaná analýza výsledkù studií s MLT-PR výrobcem ( firma Neurim) V registraèním protokolu EMEA je uvedena i poolovaná analýza úèinnosti MLT-PR dle jednotlivých použitých kritérií (EMEA, 2007). Ve 3 studiích s 537 pacienty s insomnií dosáhlo zlepšení kvality spánku 48 % léèených MLT-PR a 34,5 % pøi aplikaci placeba (p = 0,0011) a dostateèného ranního zotavení 40,3 % pøi MLT-PR a 30 % pøi placebu (p = 0,012). Pokud byla použita obì kritéria souèasnì (kvalita spánku + ranní aktivita), pak ke zlepšení došlo u 32,4 % pacientù léèených MLT-PR a 18,7 % nemocných po administraci placeba. U 334 léèených 164
7 PSYCHIATRIE ROÈNÍK ÈÍS LO 3 Fórum Èeské neuropsychofarmakologické spoleènosti se spánková latence zkrátila po MLT-PR v prùmìru o 24,3 min. a po placebu prùmìrnì o 12,9 min. (rozdíl - 8,8 min., p = 0,028). Výsledky léèby MLT-PR (2 mg/noc) byly obdobné ve vìkové skupinì rokù a nad 65 let a u nemocných, kteøí døíve užívali benzodiazepinová hypnotika nebo dosud nemìli žádné zkušenosti s benzodiazepinovými hypnotiky. Celková analýza úèinnosti MLT-PR dle zvolených ukazatelù ovlivnìní spánku Léèba MLT-PR významnì zlepšila pocit ranní aktivity (svìžesti) v 3/3 studií, kvalitu spánku v 2/3 studií, zkrátila spánkovou latenci v 3/4 studií a v 2/4 studií byla zlepšena spánková úèinnost. Terapie MLT-PR neprodloužila celkovou dobu spánku (0/2 studií) ani nesnížila poèet probuzení (0/2 studií). Nežádoucí úèinky léèby MLT-PR Snášenlivost a bezpeènost terapie MLT-PR byla prokázána u 1361 pacientù léèených MLT-PR a 1247 nemocných po podávání placeba. Do studie bezpeènosti a snášenlivosti byla zaøazena i další studie, která byla zrušena pro neadekvátní výbìr pacientù, ale bylo možno použít tato data pro pøehled o snášenlivosti MLT-PR. Nežádoucí úèinky se vyskytly u 8,21 % léèených MLT-PR a u 3,17 % pøi aplikaci placeba. Pøi terapii MLT-PR se z nežádoucích úèinkù nejèastìji vyskytly cefalgie, závratì, ospalost, pøedráždìnost, abnormální sny, zácpa, sucho v ústech, pocení, slabost a zvýšení tìlesné hmotnosti; každý z uvedených nežádoucích pøíznakù byl pozorován u ménì než 1 % léèených a žádný z nich se nevyskytl èastìji než pøi podávání placeba. Po vysazení melatoninu PR nebyla pozorována rebound insomnie ani pøíznaky z odnìtí (sledováno ve všech studiích výrobce za pomoci speciálních stupnic jako Chess-84, Tyrer Scales a výskytu nových psychických a somatických pøíznakù s výjimkou studie Wade et al., 2007 a nebyl nalezen žádný rozdíl od skupiny nemocných, dostávajících placebo) (EMEA, 2007). MLT-PR mùže vyvolávat ospalost po dobu 4 5 hod. po požití a po tuto dobu by pacient nemìl øídit motorové vozidlo nebo obsluhovat tìžké stroje (Avery et al., 1998). Interakce MLT-PR Z farmakodynamických interakcí je známo, že MLT-PR potencuje úèinek benzodiazepinových a nebenzodiazepinových hypnotik (zolpidem, zopiklon, zaleplon) a také thioridazinu a imipraminu (EMEA, 2007). Farmakokinetické interakce s jinými léky vychází ze skuteènosti, že melatonin je substrátem CYP1A1 a 1A2. Proto látky inhibující CAP1A izoenzym zpomalují metabolizmus a zvyšují plazmatické koncentrace melatoninu (fluvoxamin, chinolony, psoraleny). Induktory CYP1A snižují plazmatické hladiny melatoninu (karbamazepin, rifampicin, kouøení, kofein, omeprazol). CYP1A2 substráty jako klozapin nebo theofyllin se rovnìž mohou podílet na interakcích s melatoninem. Inhibitor CYP2D cimetidin také zvyšuje plazmatické koncentrace melatoninu. Shrnutí Melatonin je neurohormon navozující spánek a udržující spánkový rytmus. Jeho terapeutické použití (pøevážnì ve formì potravinového doplòku) bylo úspìšné u nìkterých poruch rytmu spánku (jet lag, syndrom opoždìné spánkové fáze a pøi úpravì volnì bìžícího spánkového rytmu u slepcù). Naopak tato forma melatoninu neprokázala dostateènou úèinnost pøi léèbì primární i sekundární insomnie v meta- -analýze Buscemiho a spolupracovníkù (2004). Teprve po vyèlenìní vìkové kategorie starších pacientù nad 55 let vìku s primární insomnií byl melatonin terapeuticky úèinnìjší než placebo ve zkrácení spánkové latence, zvýšení úèinnosti spánku a prodloužení celkové doby spánku (Brzezinski et al., 2005). Melatonin je na trhu v USA jen jako doplnìk stravy a obsah aktivní látky a pøídatných komponent je mìnlivý. Naopak v Evropì bylo doporuèeno použít jen takovou galenickou formu melatoninu, která je registrována jako lék a splòuje všechny požadavky úèinnosti a bezpeènosti farmak pro použití u lidí. V letech byl vyroben a uveden na trh melatonin s prodlouženým uvolòováním (MLT-PR). Vyznaèuje se delším vyluèovacím poloèasem 3,5 4 hod. proti min. melatoninu v normálních rychle se rozpouštìjících tabletách. MLT-PR napodobuje køivku plazmatické koncentrace endogenního melatoninu v lidském organizmu. MLT-PR byl zkoušen v 7 dvojitì slepých placebem kontrolovaných studiích u primární nespavosti u starších nemocných a úspìšnì ovlivnil kvalitu spánku, ranní aktivity a spánkovou latenci. MLT-PR byl úèinný u lehké i tìžší insomnie, ve vìku rokù i pøes 65 let vìku a u nemocných s nebo bez zkušeností s pøedchozím podáváním benzodiazepinových hypnotik. Není dosud dostateènì ovìøìno, zda nízké iniciální koncentrace melatoninu v plazmì nebo jeho metabolitu v moèi predikují vyšší terapeutickou úèinnost. Po vysazení MLT-PR nebyla pozorována rebound insomnie ani pøíznaky z odnìtí. MLT-PR byl výbornì snášen a nežádoucí pøíznaky nebyly èastìjší než pøi podávání placeba. Dosavadní znalosti o úèinnosti a snášenlivosti MLT-PR nejsou zatím dostateèné a vyžadují další studie, zamìøené na efekt rùzných denních dávek a srovnání s jinými bìžnì užívanými hypnotiky. Nezbytnì nutné jsou dlouhodobé studie zamìøené nejen na úèinnost a snášenlivost, ale i vylouèení vzniku pøípadné tolerance k hypnotickému úèinku. MLT-PR v souèasné dobì znamená obohacení léèby insomnie o nový preparát, který nemìní negativnì architekturu spánku ani nepotlaèuje REM spánek, nevyvolává druhý den narušení ranních a denních aktivit ani poškození kognitivních funkcí a je mimoøádnì dobøe tolerován. Pøedností MLT-PR je pozitivní vliv na zlepšení kvality spánku a zlepšení pocitu ranního osvìžení a aktivity. Souèasné poznatky opravòují jeho použití v klinické praxi u starších osob s primární insomnií po dobu 3 týdnù. prof. MUDr. Jaromír Švestka, DrSc. Psychiatrická klinika FN Jihlavská Brno jsvestka@med.muni.cz Do redakce došlo: K publikaci pøijato:
8 dobrou noc, dobré ráno, dobrý den ZKRÁCENÁ INFORMACE O PŘÍPRAVKU CIRCADIN 2 MG TABLETY S PRODLOUŽENÝM UVOLŇOVÁNÍM. SLOŽENÍ: MELATONINUM 2 MG. KLINICKÉ ÚDAJE: TERAPEUTICKÉ INDIKACE: MONOTERAPIE KE KRÁTKODOBÉ LÉČBĚ PRIMÁRNÍ NESPAVOSTI CHARAKTERIZOVANÉ ŠPATNOU KVALITOU SPÁNKU U PACIENTŮ VE VĚKU 55 LET A VYŠŠÍM. DÁVKOVÁNÍ A ZPŮSOB PODÁNÍ: PERORÁLNÍ PODÁNÍ. TABLETY JE ZAPOTŘEBÍ POLYKAT CELÉ. DOPORUČENÁ DÁVKA JE 2 MG JEDNOU DENNĚ, 1 AŽ 2 HODINY PŘED ULEHNUTÍM NA LŮŽKO A PO JÍDLE. TATO LÉČBA MÁ TRVAT TŘI TÝDNY. RENÁLNÍ INSUFICIENCE: VLIV RENÁLNÍ INSUFICIENCE JAKÉHOKOLIV STUPNĚ NA FARMAKOKINETIKU MELATONINU NEBYL STUDOVÁN, JE ZAPOTŘEBÍ ZACHOVÁVAT OPATRNOST. PORUCHA FUNKCE JATER: S POUŽITÍM CIRCADINU U PACIENTŮ S POŠKOZENÍM JATER NEJSOU ŽÁDNÉ ZKUŠENOSTI, POUŽÍVÁNÍ CIRCADINU SE U PACIENTŮ S POŠKOZENÍM JATER NEDOPORUČUJE. KONTRAINDIKACE: HYPERSENSITIVITA NA LÉČIVOU LÁTKU NEBO NA KTEROUKOLI POMOCNOU LÁTKU TOHOTO PŘÍPRAVKU. ZVLÁŠTNÍ UPOZORNĚNÍ A OPATŘENÍ PRO POUŽITÍ: CIRCADIN MŮŽE ZPŮSOBIT OSPALOST. PROTO JE ZAPOTŘEBÍ POUŽÍVAT TENTO PŘÍPRAVEK OPATRNĚ, POKUD JE PRAVDĚPODOBNÉ, ŽE ÚČINKY OSPALOSTI BUDOU SOUVISET S OHROŽENÍM BEZPEČNOSTI. TENTO LÉČIVÝ PŘÍPRAVEK SE NEDOPORUČUJE VZHLEDEM K NEDOSTATKU ZKUŠENOSTÍ U PACIENTŮ S AUTOIMUNITNÍM ONEMOCNĚNÍM. NEMAJÍ HO UŽÍVAT PACIENTI SE VZÁCNOU HEREDITÁRNÍ INTOLERANCÍ GALAKTÓZY, S LAPPOVOU DEFICIENCÍ LAKTÁZY NEBO S MALABSORPCÍ GLUKÓZY A GALAKTÓZY. INTERAKCE S JINÝMI LÉČIVÝMI PŘÍPRAVKY A JINÉ FORMY INTERAKCE: FLUVOXAMIN ZVYŠUJE KONCENTRACI MELATONINU, KOMBINACE NENÍ VHODNÁ. ALKOHOL SNIŽUJE ÚČINNOST CIRCADINU NA SPÁNEK, A PROTO BY SE NEMĚL SPOLEČNĚ S CIRCADINEM POŽÍVAT. CIRCADIN MŮŽE PODPOROVAT SEDATIVNÍ VLASTNOSTI BENZODIAZEPINŮ A NEBENZODIAZEPINOVÝCH HYPNOTIK, JAKO JSOU NAPŘÍKLAD ZALEPLON, ZOLPIDEM A ZOPIKLON. NEŽÁDOUCÍ ÚČINKY: ČASTÉ NEŽÁDOUCÍ ÚČINKY V KLINICKÝCH STUDIÍCH ZAHRNOVALY BOLEST HLAVY, FARYNGITIDU, BOLEST V ZÁDECH A ASTENII, A TO JAK VE SKUPINĚ S CIRCADINEM, TAK I S PLACEBEM. FARMAKOLOGICKÉ VLASTNOSTI: MELATONIN JE SPOJOVÁN S ŘÍZENÍM CIRKADIÁNNÍHO RYTMU A SYNCHRONIZACE S CYKLEM SVĚTLO-TMA. JE ROVNĚŽ SPOJOVÁN S HYPNOTICKÝM ÚČINKEM A ZVYŠUJE SKLON KE SPÁNKU. KVŮLI ÚLOZE MELATONINU V REGULACI SPÁNKU A CIRKADIÁNNÍHO RYTMU A POKLESU ENDOGENNÍ PRODUKCE MELATONINU V SOUVISLOSTI S VĚKEM MŮŽE MELATONIN EFEKTIVNĚ ZLEPŠOVAT KVALITU SPÁNKU U PACIENTŮ S PRIMÁRNÍ NESPAVOSTÍ ZEJMÉNA VE VĚKU NAD 55 LET. FARMACEUTICKÉ ÚDAJE: SEZNAM POMOCNÝCH LÁTEK: METHAKRYLÁTOVÝ KOPOLYMER TYP RS PM, DIHYDRÁT HYDROGENFOSFOREČNANU VÁPENATÉHO, MONOHYDRÁT LAKTÓZY, KOLOIDNÍ BEZVODÝ OXID KŘEMIČITÝ, MASTEK, MAGNESIUM-STEARÁT. DOBA POUŽITELNOSTI: 5 LET. ZVLÁŠTNÍ OPATŘENÍ PRO UCHOVÁVÁNÍ: UCHOVÁVEJTE PŘI TEPLOTĚ DO 25 C, V PŮVODNÍM OBALU, ABY BYL PŘÍPRAVEK CHRÁNĚN PŘED SVĚTLEM. BALENÍ: BALENÍ OBSAHUJE JEDEN BLISTROVÝ STRIP OBSAHUJÍCÍ 21 TABLET. DRŽITEL ROZHODNUTÍ O REGISTRACI: NEURIM PHARMACEUTICALS EEC LIMITED, 6 FORTUNA COURT, CALLEVA PARK, ALDERMASTON, BERKSHIRE RG7 8UB, VELKÁ BRITÁNIE, NEURIM@NEURIM.COM. REGISTRAČNÍ ČÍSLO: EU/1/07/392/001. DATUM PRVNÍ REGISTRACE: 29/6/2007. DATUM REVIZE TEXTU: 29/6/2007. VÝDEJ PŘÍPRAVKU JE VÁZÁN NA LÉKAŘSKÝ PŘEDPIS. PŘÍPRAVEK NENÍ HRAZEN ZDRAVOTNÍMI POJIŠŤOVNAMI. SOUHRN ÚDAJŮ O PŘÍPRAVKU JE DOSTUPNÝ NA LUNDBECK ČESKÁ REPUBLIKA, S. R. O., BOZDĚCHOVA 7, PRAHA 5, TEL.: , LUNDBECK@LUNDBECK.CZ,
Od opia k melatoninu aneb Práce s nespavým pacientem
 Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Soubor pøednášek ze semináøe Od opia k melatoninu aneb Práce s nespavým pacientem Semináøe se konají na 14 místech ÈR v období únor duben 2009 1. Péèe o pacienta s nespavostí Diagnostika a nefarmakologická
Úzkost u seniorů. Stres, úzkost a nespavost ve stáří. Úzkost a poruchy chování ve stáří. Sborník přednášek z Jarního sympozia 2011
 Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
Úzkost u seniorů Stres, úzkost a nespavost ve stáří MUDr. Petr Hrubeš Hradec Králové Úzkost a poruchy chování ve stáří MUDr. Vanda Franková Dobřany Sborník přednášek z Jarního sympozia 2011 Moderní trendy
Deprese u seniorů. Pohled geriatra na depresi u seniorů. Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře
 Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
Deprese u seniorů Pohled geriatra na depresi u seniorů Doc. MUDr. Iva Holmerová, Ph.D. Praha Léčba deprese ve stáří zdroj uspokojení i frustrace lékaře Prim. MUDr. Richard Krombholz Praha Sborník přednášek
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum
Spánek který osvěží. Neptejte se, jak spala, ale jak se cítila po celý den. recept na dobrou noc, dobré ráno, dobrý den
 Spánek který osvěží Neptejte se, jak spala, ale jak se cítila po celý den. recept na dobrou noc, dobré ráno, dobrý den Kazuistika pacientky s nespavostí Zdravotní sestra, 58 let Lékař: MUDr. Petr Hrubeš,
Spánek který osvěží Neptejte se, jak spala, ale jak se cítila po celý den. recept na dobrou noc, dobré ráno, dobrý den Kazuistika pacientky s nespavostí Zdravotní sestra, 58 let Lékař: MUDr. Petr Hrubeš,
Doporučená dávka je 2 mg jednou denně po jídle, 1 až 2 hodiny před ulehnutím na lůžko. Tato dávka může být dále užívána až po dobu třinácti týdnů.
 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum 2 mg. Pomocné látky: jedna tableta
1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum 2 mg. Pomocné látky: jedna tableta
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka:
 PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
PŘÍLOHA III ZMĚNY PŘÍSLUŠNÝCH BODŮ SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Změny v souhrnu údajů o přípravku a příbalové informaci možná bude následně třeba nechat (v případě potřeby
Poruchy spánku ve stáří
 Poruchy spánku ve stáří Obecné charakteristiky charakter spánku se ve stáří mění senioři zapojení do komunity spí lépe spánek zhoršuje zármutek, osamocení, úzkost, potraumatické stavy starší lidé chodí
Poruchy spánku ve stáří Obecné charakteristiky charakter spánku se ve stáří mění senioři zapojení do komunity spí lépe spánek zhoršuje zármutek, osamocení, úzkost, potraumatické stavy starší lidé chodí
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls30500/2010 1. NÁZEV PŘÍPRAVKU Zolsana 10 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Zolpidemi tartras 10 mg v jedné potahované
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls30500/2010 1. NÁZEV PŘÍPRAVKU Zolsana 10 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Zolpidemi tartras 10 mg v jedné potahované
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje 2 mg melatoninum.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje 2 mg melatoninum.
Bezpečnost a účinnost přípravku Neoclarityn 5 mg potahované tablety u dětí mladších 12 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.
 1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
1. NÁZEV PŘÍPRAVKU Neoclarityn 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum 5 mg. Pomocná látka se známým účinkem: Tento přípravek obsahuje laktózu.
 Pøehled úèinnosti intervencí protidrogové léèby v Evropì 6 7 9 10 11 ê á 13 1 Úèinnost, efektivita a nákladová efektivita Tabulka 1: Definice úèinnosti, efektivity a nákladové efektivity 15 1 16 2
Pøehled úèinnosti intervencí protidrogové léèby v Evropì 6 7 9 10 11 ê á 13 1 Úèinnost, efektivita a nákladová efektivita Tabulka 1: Definice úèinnosti, efektivity a nákladové efektivity 15 1 16 2
Světle modré, kulaté, bikonvexní obalené tablety, průměr přibližně 12,4 mm, výška přibližně 7,5 mm.
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Baldriparan obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum 6,0 7,4 : 1, extrahováno ethanolem
CZ PAR. QUETIAPINI FUMARAS Seroquel. NL/W/0004/pdWS/002
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury NL/W/0004/pdWS/002 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA ZMĚNA V SmPC
Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1), extrahováno ethanolem 70% (V/V) 445 mg.
 Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Sp.zn.sukls16435/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU PERSEN mono obalená tableta 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna obalená tableta obsahuje Valerianae extractum siccum (3-6:1),
Pomocná látka se známým účinkem: Jedna tableta obsahuje 75 mg monohydrátu laktosy. Úplný seznam pomocných látek viz bod 6.1.
 sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
sp.zn.: sukls81995/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Loratadin-ratiopharm 10 mg Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
sp.zn.sukls63588/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 10 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje loratadinum 10 mg. Pomocná látka se známým účinkem:
Desloratadin STADA 5 mg jsou modré, kulaté, bikonvexní potahované tablety o průměru přibližně 6,5 mm.
 Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Sp.zn.sukls74932/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin STADA 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje desloratadinum 5 mg.
Hypnotika Benzodiazepiny
 Hypnotika Benzodiazepiny Sedace: mírný stupeň útlumu funkce CNS zklidnění pacienta (motorické i psychické), bez navození spánku Hypnóza: navozený stav více či méně podobný fyziologickému spánku (Hypno)-sedativní
Hypnotika Benzodiazepiny Sedace: mírný stupeň útlumu funkce CNS zklidnění pacienta (motorické i psychické), bez navození spánku Hypnóza: navozený stav více či méně podobný fyziologickému spánku (Hypno)-sedativní
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
sp. zn. sukls111315/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Protradon 100 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje tramadoli hydrochloridum 100 mg. Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn. sukls17735/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU GUAJACURAN 5% injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Guaifenesinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Desloratadin +pharma 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Aerius 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje desloratadinum v množství 5 mg. Úplný seznam pomocných
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Fluoxetini hydrochloridum 22,36 mg (odp. 20 mg fluoxetinu) v 1 tobolce. Pomocné látky viz 6.1. 3. LÉKOVÁ FORMA
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUMIREX 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Fluoxetini hydrochloridum 22,36 mg (odp. 20 mg fluoxetinu) v 1 tobolce. Pomocné látky viz 6.1. 3. LÉKOVÁ FORMA
Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg.
 Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
Sp.zn.sukls97430/2013 1.NÁZEV LÉČIVÉHO PŘÍPRAVKU Tannex 2 mg tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tvrdá tobolka obsahuje loperamidi hydrochloridum 2 mg. Pomocná látka se známým účinkem:
CZ PAR. QUETIAPINI FUMARAS Seroquel. UK/W/0004/pdWS/001 NL/W/0004/pdWS/001
 Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
Název (léčivá látka/přípravek) CZ PAR QUETIAPINI FUMARAS Seroquel Číslo procedury UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZEV INN DRŽITEL SCHVÁLENÉ INDIKACE ATC KÓD LÉKOVÁ FORMA, SÍLA INDIKAČNÍ SKUPINA
3 LÉKOVÁ FORMA Tableta s prodlouženým uvolňováním. Růžové, kulaté bikonvexní tablety s vyraženým '35' na jedné straně, na druhé straně hladké.
 Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o registraci sp.zn.sukls200469/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV LÉČIVÉHO PŘÍPRAVKU Portora 35 mg tablety s prodlouženým uvolňováním 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje 71,3 mg monohydrátu laktosy.
 sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
sp.zn. sukls138016/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 10 mg loratadinum. Jedna 10 mg tableta loratadinu obsahuje
Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg.
 1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
1 NÁZEV PŘÍPRAVKU Neoclarityn 2,5 mg tablety dispergovatelné v ústech 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka přípravku Neoclarityn tableta dispergovatelná v ústech obsahuje desloratadinum 2,5
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum 4,019 mg.
 Sp.zn. sukls19085/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adorma 5 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum
Sp.zn. sukls19085/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Adorma 5 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: 5 mg zolpidemi tartras, což odpovídá zolpidemum
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014
 sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
sp.zn.: sukls132182/2010 a sp.zn.: sukls82396/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MYTELASE tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ambenonii chloridum 10 mg v 1 tabletě. Pomocné látky
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls42544-6/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Pexogies 0,088 mg tablety Pexogies 0,18 mg tablety Pexogies 0,7 mg tablety 2. KVALITATIVNÍ A
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls62363/2011 a sukls62355/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Procto-Glyvenol 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky:Tribenosidum
Světle červené, ploché, kulaté, skvrnité tablety, na jedné straně označené písmenem K.
 1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
1. NÁZEV PŘÍPRAVKU Aerius 2,5 mg tablety dispergovatelné v ústech 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta dispergovatelná v ústech obsahuje desloratadinum 2,5 mg. Pomocné látky se známým
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
sp.zn.sukls40560/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Claritine 1mg/ml sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje loratadinum 1 mg. Pomocná látka se známým účinkem:
CZ PAR QUETIAPINUM. Seroquel. UK/W/0004/pdWS/001. NL/W/0004/pdWS/001
 CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
CZ PAR Název (léčivá látka/ přípravek) Číslo procedury QUETIAPINUM Seroquel UK/W/0004/pdWS/001 NL/W/0004/pdWS/001 ART. NÁZVY PŘÍPRAVKŮ KLINICKÝCH STUDIÍ INN DRŽITELÉ PŘÍPRAVKŮ KLINICKÝCH STUDIÍ SCHVÁLENÉ
Spánek u kriticky nemocných Vliv farmak
 Spánek u kriticky nemocných Vliv farmak Renata Černá Pařízková Klinika anesteziologie, resuscitace a intenzivní medicíny Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové Fakultní nemocnice
Spánek u kriticky nemocných Vliv farmak Renata Černá Pařízková Klinika anesteziologie, resuscitace a intenzivní medicíny Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové Fakultní nemocnice
Spánek v prostředí intenzivní péče. Přednášející: Michal Pospíšil Spoluautor: Adriana Polanská
 Spánek v prostředí intenzivní péče Přednášející: Michal Pospíšil Spoluautor: Adriana Polanská Úvod Existuje mnoho studií poukazujících na rizika spojená s nedostatkem spánku u zdravotníků. Jen málo se
Spánek v prostředí intenzivní péče Přednášející: Michal Pospíšil Spoluautor: Adriana Polanská Úvod Existuje mnoho studií poukazujících na rizika spojená s nedostatkem spánku u zdravotníků. Jen málo se
Světový den spánku a poruchy biologických rytmů
 Světový den spánku a poruchy biologických rytmů Soňa Nevšímalová Neurologická klinika 1. LF UK a VFN Podpořeno společností sanofi-aventis, s. r. o. SACS.CHC.18.02.0208 Tisková konference, 6. března 2018
Světový den spánku a poruchy biologických rytmů Soňa Nevšímalová Neurologická klinika 1. LF UK a VFN Podpořeno společností sanofi-aventis, s. r. o. SACS.CHC.18.02.0208 Tisková konference, 6. března 2018
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
sp.zn.: sukls196586/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SMECTA prášek pro perorální suspenzi 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 sáček obsahuje: Léčivá látka: Diosmectitum 3,000 g Pomocné
DOPORUČENÉ POSTUPY PSYCHIATRICKÉ PÉČE 2018
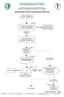 Autoři: Karel Šonka, Kateřina Espa-Červená Garant: Karel Šonka Oponent: Martin Anders Komentář k algoritmu Odkaz č. 1 Spánková hygiena - soubor základních životosprávných opatření k usnadnění spánku (1,2,
Autoři: Karel Šonka, Kateřina Espa-Červená Garant: Karel Šonka Oponent: Martin Anders Komentář k algoritmu Odkaz č. 1 Spánková hygiena - soubor základních životosprávných opatření k usnadnění spánku (1,2,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tablety: Jedna tableta obsahuje 10 mg loratadinum. Sirup: Jeden ml sirupu obsahuje 1 mg loratadinum. Pomocné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tablety: Jedna tableta obsahuje 10 mg loratadinum. Sirup: Jeden ml sirupu obsahuje 1 mg loratadinum. Pomocné
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.:sukls32256/2007, sukls32257/2007 1. NÁZEV PŘÍPRAVKU UNIPRES 10 UNIPRES 20 tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
1. NÁZEV PŘÍPRAVKU Zofran Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls13958/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Ondansetronum, 16 mg v jednom čípku. 3. LÉKOVÁ
PREVENCE PØENOSU plísòových onemocnìní
 PREVENCE PØENOSU plísòových onemocnìní kùže a bradavic v areálech Každý èlovìk prožije bìhem svého života mnoho situací a událostí, v nichž se v souvislosti s ménì èi více závažnými prohrami, zklamáními
PREVENCE PØENOSU plísòových onemocnìní kùže a bradavic v areálech Každý èlovìk prožije bìhem svého života mnoho situací a událostí, v nichž se v souvislosti s ménì èi více závažnými prohrami, zklamáními
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls187009/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU ARTAXIN 625 mg, tvrdé tobolky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tobolka obsahuje glucosaminum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls103375/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zolpidem Vitabalans 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje zolpidemi tartras 10 mg.
Sp.zn. sukls103375/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zolpidem Vitabalans 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje zolpidemi tartras 10 mg.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU RILEXINE 300 tbl. ad us.vet. 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: Cefalexinum (ut monohydricum): V jedné 800 mg tabletě
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls122181/2011 a příloha k sp. zn. sukls91704/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU SANDOMIGRAN 0,5 mg obalené tablety 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Příloha č. 3 k rozhodnutí o převodu registrace sp. zn. sukls198549/2010 1. NÁZEV PŘÍPRAVKU LANBICA 50 mg Potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná
Úplný seznam pomocných látek viz bod 6.1. Čirý žluto-hnědý sirup s charakteristickou příchutí medu a citronu.
 Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Sp.zn.sukls121997/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 NÁZEV PŘÍPRAVKU OlynMuco s příchutí medu a citronu 20 mg/ml 2 KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tento přípravek obsahuje guaifenesinum 20 mg v 1 ml.
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls192364/2010
 Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls192364/2010 1. NÁZEV PŘÍPRAVKU HEMINEVRIN 300 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: clomethiazolum
Příloha č. 3 k rozhodnutí o převodu registrace sp.zn. sukls192364/2010 1. NÁZEV PŘÍPRAVKU HEMINEVRIN 300 mg SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Léčivá látka: clomethiazolum
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
 sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
sp. zn. sukls178963/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FAMOSAN 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje famotidinum 10 mg. Pomocné
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička na blistry a lahvičky z HDPE } 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Sandoz 60mg Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje orlistatum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn.sukls10638/2011 a příloha k sp.zn. sukls246529/2010, sukls242130/2011, sukls46873/2012 1. NÁZEV PŘÍPRAVKU Ewofex 120 mg potahované tablety SOUHRN
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU CLARITINE Sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml sirupu obsahuje 1 mg loratadinum. Jeden ml loratadinového sirupu obsahuje 600 mg sacharosy.
GENvia, s.r.o. ZÁKLADNÍ VYUÈENA STØEDNÍ S MATURITOU VOŠ
 DOTAZNÍK KE GENETICKÉMU VYŠETØENÍ (pro ženy) ŽENA OSOBNÍ DATA KLIENTKY PØÍJMENÍ DATUM NAROZENÍ RODNÉ ÈÍSLO TELEFON (MOBIL) ADRESA UKONÈENÉ ŠKOLNÍ VZDÌLÁNÍ ZAMÌSTNÁNÍ NÁRODNOST DATUM SÒATKU JMÉNO MÍSTO
DOTAZNÍK KE GENETICKÉMU VYŠETØENÍ (pro ženy) ŽENA OSOBNÍ DATA KLIENTKY PØÍJMENÍ DATUM NAROZENÍ RODNÉ ÈÍSLO TELEFON (MOBIL) ADRESA UKONÈENÉ ŠKOLNÍ VZDÌLÁNÍ ZAMÌSTNÁNÍ NÁRODNOST DATUM SÒATKU JMÉNO MÍSTO
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010
 Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 1 k opravě rozhodnutí o změně registrace sp.zn. sukls165529/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUTAMID SANDOZ 250 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Flutamidum
Příloha č. 3 ke sdělení sp.zn.sukls7461/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 ke sdělení sp.zn.sukls7461/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná tableta Agnucastonu obsahuje:
Příloha č. 3 ke sdělení sp.zn.sukls7461/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 potahovaná tableta Agnucastonu obsahuje:
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Poznámka: Tyto úpravy souhrnu údajů o přípravku a
 PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
PŘÍLOHA III RELEVANTNÍ ČÁSTI SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku přijetí rozhodnutí Komisí. Poté,
Obsah 1 Úvod 2 Variabilita lékové odpovědi 3 Klinické využití určování koncentrace léčiv
 Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
Obsah 1 Úvod... 11 2 Variabilita lékové odpovědi... 14 2.1 Faktory variability... 14 2.2 Vliv onemocnění... 17 2.2.1 Chronické srdeční selhání... 17 2.2.2 Snížená funkce ledvin... 18 2.2.3 Snížená funkce
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOSAH A DOHLED DĚTÍ
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička pro blistry a HDPE lahvičky} 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Teva 60 mg, tvrdé tobolky Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tobolka obsahuje
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU {Krabička pro blistry a HDPE lahvičky} 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Teva 60 mg, tvrdé tobolky Orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tobolka obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls174298/2012 1. NÁZEV PŘÍPRAVKU HYPNOGEN 10 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna potahovaná
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls174298/2012 1. NÁZEV PŘÍPRAVKU HYPNOGEN 10 mg potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna potahovaná
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
Vývoj nových léčiv. Preklinický výzkum Klinický výzkum
 Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
Vývoj nových léčiv Preklinický výzkum Klinický výzkum Úvod Léčivo = nejprověřenější potravina vstupující do organismu Ideální léčivo kvalitní, účinné, bezpečné a dostupné Financování výzkumu léčiv souvislost
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum). Úplný seznam
Obecné aspekty lékových interakcí
 Obecné aspekty lékových interakcí výskyt, rozdělení, hlavní mechanismy a důsledky lékových interakcí PharmDr. Josef Suchopár 18. 6. 2014 Lékové interakce: skutečný problém nebo fáma? Velká Británie (Pirmohamed,
Obecné aspekty lékových interakcí výskyt, rozdělení, hlavní mechanismy a důsledky lékových interakcí PharmDr. Josef Suchopár 18. 6. 2014 Lékové interakce: skutečný problém nebo fáma? Velká Británie (Pirmohamed,
LAGOSA 150 mg Obalené tablety
 sp.zn. sukls198252/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAGOSA 150 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Cardui mariae fructus extractum siccum (35-40:1) 204 mg (odpovídá
sp.zn. sukls198252/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LAGOSA 150 mg Obalené tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Cardui mariae fructus extractum siccum (35-40:1) 204 mg (odpovídá
Tableta s prodlouženým uvolňováním. Popis přípravku : bílé, kulaté, nepotahované tablety se zkosenými hranami.
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls37077/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012
 Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ORENZYM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 200 m.j. (36,60 mg)
Příloha č. 3 k rozhodnutí o změně registrace sp.zn. sukls7306/2012 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU ORENZYM 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje 200 m.j. (36,60 mg)
Panthenol 100 mg JENAPHARM tablety
 sp.zn. sukls60789/2015 sukls54658/2015 1. NÁZEV PŘÍPRAVKU Panthenol 100 mg JENAPHARM tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje: Dexpanthenolum 100 mg Pomocné
sp.zn. sukls60789/2015 sukls54658/2015 1. NÁZEV PŘÍPRAVKU Panthenol 100 mg JENAPHARM tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 tableta obsahuje: Dexpanthenolum 100 mg Pomocné
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE. Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise
 PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
PŘÍLOHA III ÚPRAVY SOUHRNU ÚDAJŮ O PŘÍPRAVKU A PŘÍBALOVÉ INFORMACE Tyto změny k SPC a příbalové informace jsou platné v den Rozhodnutí Komise Po Rozhodnutí Komise aktualizuje národní kompetentní autorita
Perorální podání. Před použitím čtěte příbalovou informaci. TEXT NA VNĚJŠÍ OBAL. Krabička pro blistry a lahvičky HDPE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
 TEXT NA VNĚJŠÍ OBAL Krabička pro blistry a lahvičky HDPE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje
TEXT NA VNĚJŠÍ OBAL Krabička pro blistry a lahvičky HDPE 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Orlistat Polpharma 60 mg, tvrdé tobolky orlistatum 2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK Jedna tvrdá tobolka obsahuje
Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg
 Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka
Sp. zn. sukls6920/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU BETAHISTIN ACTAVIS 16 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje betahistini dihydrochloridum 16 mg. Pomocná látka
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta Agnucastonu obsahuje:
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 1. NÁZEV PŘÍPRAVKU Agnucaston potahované tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta Agnucastonu obsahuje:
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
 Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
Sp.zn.sukls137614/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Flexove 625 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje glukosaminum 625 mg (ve formě glukosamini hydrochloridum).
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls6972/2006 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PARALEN 500 SUP čípky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden čípek obsahuje Paracetamolum
Sp.zn.sukls88807/2015
 Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn.sukls88807/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU NORMAGLYC 500 mg, potahované tablety NORMAGLYC 850 mg, potahované tablety NORMAGLYC 1000 mg, potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls70531/2011, sukls70526/2011
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls70531/2011, sukls70526/2011 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls70531/2011, sukls70526/2011 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ
Pomocné látky se známým účinkem: prostý sirup 67%, usušená tekutá glukosa.
 sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
sp.zn. sukls24303/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Strepsils Pomeranč s vitaminem C pastilky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna pastilka obsahuje amylmetacresolum 0,6 mg, alcohol
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
sp. zn. sukls211402/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Alfuzostad 10 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje alfuzosini hydrochloridum10
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls43316/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zolpinox Potahované tablety 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Přípravek obsahuje
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls43316/2008 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Zolpinox Potahované tablety 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Přípravek obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls118322/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU HYPNOGEN 10 mg potahované tablety 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna potahovaná tableta obsahuje zolpidemi tartras 10 mg Pomocné
Sp.zn. sukls118322/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU HYPNOGEN 10 mg potahované tablety 2. SLOŽENÍ KVALITATIVNÍ A KVANTITATIVNÍ Jedna potahovaná tableta obsahuje zolpidemi tartras 10 mg Pomocné
sp.zn. sukls240801/2017
 sp.zn. sukls240801/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU STUGERON tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cinnarizinum 25 mg. Pomocné látky: monohydrát laktosy.
sp.zn. sukls240801/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU STUGERON tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje cinnarizinum 25 mg. Pomocné látky: monohydrát laktosy.
Souhrn údajů o přípravku
 1. NÁZEV PŘÍPRAVKU Cardiket retard 20 tablety s prodlouženým uvolňováním Cardiket retard 40 tablety s prodlouženým uvolňováním Cardiket retard 120 tvrdé tobolky s prodlouženým uvolňováním Souhrn údajů
1. NÁZEV PŘÍPRAVKU Cardiket retard 20 tablety s prodlouženým uvolňováním Cardiket retard 40 tablety s prodlouženým uvolňováním Cardiket retard 120 tvrdé tobolky s prodlouženým uvolňováním Souhrn údajů
Aurorix 150 mg: Jedna potahovaná tableta obsahuje moclobemidum 150 mg. Aurorix 300 mg: Jedna potahovaná tableta obsahuje moclobemidum 300 mg
 sp.zn. sukls76854/2014 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aurorix 150 mg: Jedna potahovaná tableta obsahuje
sp.zn. sukls76854/2014 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU AURORIX 150 mg AURORIX 300 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Aurorix 150 mg: Jedna potahovaná tableta obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 400 mg + 40 mg. čípky PROCTO-GLYVENOL. 50 mg/g + 20 mg/g. rektální krém
 sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
sp.zn. sukls74884/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PROCTO-GLYVENOL 400 mg + 40 mg čípky PROCTO-GLYVENOL 50 mg/g + 20 mg/g rektální krém 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Čípky: Jeden
Příloha II. Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Příloha II Vědecké závěry a zdůvodnění změny podmínek rozhodnutí o registraci 21 Vědecké závěry Celkové závěry vědeckého hodnocení přípravků Oxynal a Targin a souvisejících názvů (viz příloha I) Podkladové
Informace pro zdravotnické odborníky
 EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
EDUKAČNÍ MATERIÁL Agomelatin k léčbě depresivních epizod u dospělých Informace pro zdravotnické odborníky Doporučení ohledně: Monitorování jaterních funkcí Interakce se silnými inhibitory CYP1A2 Souhrnné
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU INCURIN 1 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Estriolum 1 mg/tableta Úplný seznam pomocných
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU INCURIN 1 mg tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá(é) látka(y): Estriolum 1 mg/tableta Úplný seznam pomocných
Jedna potahovaná tableta obsahuje levocetirizini dihydrochloridum 5 mg (což odpovídá 4,2 mg levocetirizinum).
 Sp.zn.sukls82355/2012 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levocetirizin Actavis 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje levocetirizini
Sp.zn.sukls82355/2012 SOUHRN ÚDAJU O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Levocetirizin Actavis 5 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje levocetirizini
Bílé, oválné, bikonvexní, filmem potažené tablety s půlicí rýhou na obou stranách, označené ZIM na jedné straně a 10 na druhé straně.
 Příloha č.2 ke sdělení sp.zn.sukls178080/2012 Souhrn údajů o přípravku - SPC 1. NÁZEV PŘÍPRAVKU Sanval 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
Příloha č.2 ke sdělení sp.zn.sukls178080/2012 Souhrn údajů o přípravku - SPC 1. NÁZEV PŘÍPRAVKU Sanval 10 mg potahované tablety 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna potahovaná tableta obsahuje
PARKINSONOVA NEMOC Z POHLEDU PSYCHIATRA. MUDr.Tereza Uhrová Psychiatrická klinika I.LF UK a VFN Praha
 PARKINSONOVA NEMOC Z POHLEDU PSYCHIATRA MUDr.Tereza Uhrová Psychiatrická klinika I.LF UK a VFN Praha Parkinsonova nemoc = primárně neurologické onemocnění doprovodné psychiatrické příznaky deprese psychiatrické
PARKINSONOVA NEMOC Z POHLEDU PSYCHIATRA MUDr.Tereza Uhrová Psychiatrická klinika I.LF UK a VFN Praha Parkinsonova nemoc = primárně neurologické onemocnění doprovodné psychiatrické příznaky deprese psychiatrické
po 5 letech ... s excelentním kosmetickým výsledkem 2
 ... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
... s excelentním kosmetickým výsledkem 2 pred lécbou 6. týden 12. týden po 1 roku po 3 letech po 5 letech Správný výber pro Vaše pacienty se superficiálními BCC - krátkodobá lécba s velice dobrým kosmetickým
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 100 ml roztoku obsahuje Hederae helicis folii extractum siccum (4 8 : 1), extrahováno ethanolem 30 % (m/m).
 Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
Sp.zn.sukls15900/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Mucoplant břečťanový sirup proti kašli sirup 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 100 ml roztoku obsahuje Hederae helicis folii extractum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Circadin 2 mg tablety s prodlouženým uvolňováním 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta s prodlouženým uvolňováním obsahuje melatoninum
Celkové závěry vědeckého hodnocení přípravku Femara a souvisejících názvů (viz příloha I)
 Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
Příloha II Vědecké závěry a zdůvodnění potřebných úprav v souhrnu údajů o přípravku, označení na obalu a příbalové informaci předkládané Evropskou agenturou pro léčivé přípravky 7 Vědecké závěry Celkové
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
Sp.zn.sukls193313/2014 1. NÁZEV PŘÍPRAVKU TAMALIS 10 mg tablety SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna tableta obsahuje: rupatadinum 10 mg (ve formě fumarátu) Pomocné látky
