Zoonotické viry u volně žijících endotermních obratlovců
|
|
|
- Anna Kadlecová
- před 7 lety
- Počet zobrazení:
Transkript
1 MASARYKOVA UNIVERZITA PŘÍRODOVĚDECKÁ FAKULTA Ústav experimentální biologie Oddělení mikrobiologie a molekulární biotechnologie Zoonotické viry u volně žijících endotermních obratlovců Dizertační práce Brno 2017 Petra Straková
2
3 MASARYKOVA UNIVERZITA PŘÍRODOVĚDECKÁ FAKULTA Ústav experimentální biologie Oddělení mikrobiologie a molekulární biotechnologie Zoonotické viry u volně žijících endotermních obratlovců Dizertační práce Petra Straková Školitel: prof. RNDr. Zdeněk Hubálek, DrSc. Brno 2017
4
5 Bibliografický záznam Autor: Mgr. Petra Straková Ústav biologie obratlovců AV ČR v.v.i., Brno - detašované pracoviště Valtice a Ústav experimentální biologie, PřF MU, Brno Název práce: Zoonotické viry u volně žijících endotermních obratlovců Studijní program: Biologie Studijní obor: Mikrobiologie Školitel: Valtice prof. RNDr. Zdeněk Hubálek, DrSc. Ústav biologie obratlovců AV ČR v.v.i., Brno - detašované pracoviště Valtice a Ústav experimentální biologie, PřF MU, Brno Akademický rok: 2016/2017 Počet stran: publikace Klíčová slova: emergentní zoonózy, hantaviry, flaviviry, virus západonilské horečky, virus Usutu, virus hepatitidy E, Česká republika, Evropa
6
7 Bibliographic entry Author: Mgr. Petra Straková Institute of Vertebrate Biology of the Czech Academy of Sciences, Brno laboratory Valtice, and Department of Experimental Biology, Faculty of Science, Masaryk University, Brno Title of Dissertation: Zoonotic viruses associated with free-living endotherm vertebrates Degree Programme: Biology Field of Study: Microbiology Supervisor: prof. RNDr. Zdeněk Hubálek, DrSc. Institute of Vertebrate Biology of the Czech Academy of Sciences, Brno - laboratory Valtice, and Department of Experimental Biology, Faculty of Science, Masaryk University, Brno Academic Year: 2016/2017 Number of Pages: scientific articles Keywords: emerging zoonoses, hantaviruses, flaviviruses, West Nile virus, Usutu virus, hepatitis E virus, Czech Republic, Europe
8
9 Petra Straková, Masarykova univerzita, 2017
10
11 Abstrakt Předložená dizertační práce je koncipovaná jako soubor komentovaných publikací zabývajících se zoonotickými viry u volně žijících endotermních obratlovců. Z velkého výčtu zoonotických virů vyskytujících se v Evropě byly vybrány ty, které jsou v Evropě dobře popsané, mohou způsobovat onemocnění u lidí se širokou škálou symptomů, a které byly detekované v České republice. Tato práce se věnuje konkrétně detekcí hantavirů u volně žijících hlodavců, flavivirů u volně žijícího vodního ptactva a viru hepatitidy E u divokých prasat a další lovné zvěře. Na tyto viry se stále pohlíží jako na tzv. emergentní (tj. nově se objevující) viry a v některých zemích jsou dlouhodobě monitorovány. Hlavní důvody pro tento monitoring jsou narůstající počet klinických případů u lidí i jejich rostoucí veterinární význam. Jedním z důležitých výsledků této dizertační práce byl popis prvního hantaviru detekovaného u netopýra pestrého (Nyctalus noctula) v Evropě. Dále byla provedena vůbec první studie zabývající se prevalencí hantavirů u hlodavců v Litvě, monitoring Dobrava-Belgrade hantaviru v Německu a screening hlodavců na hantaviry z České republiky. U flavivirů a viru hepatitidy E jsme sledovali přítomnost specifických protilátek u volně žijících ptáků a lovné zvěře. Z výsledků vyplývá, že studované viry cirkulují v určitých oblastech ve volné přírodě a představují možné riziko pro zdraví obyvatel.
12
13 Abstract This Ph.D. thesis is compiled as a collection of commented scientific articles focusing on zoonotic viruses in free-living endotherm vertebrates. From a large number of zoonotic viruses presented in Europe, we selected those that are well described in Europe, can cause diseases in humans with a scale of different symptoms and were also detected in the Czech Republic. This thesis aimed at the detection of hantaviruses in the free-living rodents, flaviviruses in the free-living waterfowl and hepatitis E virus in wild boars and other game animals. These viruses belong to the so-called emerging viruses, and in some countries, they are monitored over a long period. The reasons for these monitoring studies are mainly increasing numbers of clinical cases and their rising veterinary importance. During our research, we detected all selected viruses in free-living animals in the Czech Republic. The most important result was the discovery of the first bat-borne hantavirus in Europe. We carried out the first prevalence study of hantaviruses in the local rodent population in Lithuania, in Germany we monitored the presence of Dobrava-Belgrade virus and we also did a screening for hantaviruses in the rodents from the Czech Republic. In flaviviruses and hepatitis E virus we focused on the detection of specific antibodies in free living waterfowl and game animals and we confirmed their presence in our ecosystem. Presented results indicate that the studied viruses circulate in nature in selected areas and they represent a possible health threat to the human population.
14
15 Poděkování Na tomto místě bych ráda poděkovala mému školiteli prof. RNDr. Zdeňku Hubálkovi, DrSc. a RNDr. Ivo Rudolfovi, Ph.D. za možnost zpracovat svou dizertační práci na detašovaném pracovišti Ústavu biologie obratlovců AV ČR, v.v.i. ve Valticích a za pomoc a pevné nervy při vzniku této práce. Mé díky patří dále Mgr. Hance Blažejové, která mi byla největší oporou ke konci mého studia, Ing. Lence Betášové, Mgr. Kristýně Venclíkové, Ph.D., Juraji Peškovi a Ladislavě Ševčíkové za výborné pracovní podmínky a příjemně strávené chvilky v kuchyňce při kávě. Za poskytnutí odchycených hlodavců a informací ohledně jejich ekologie bych chtěla poděkovat doc. RNDr. Martě Heroldové, Ph.D. z Ústavu biologie obratlovců AV ČR, v.v.i. v Brně. Dále mé poděkování patří doc. RNDr. Danielu Růžkovi, Ph.D. a MVDr. Lucii Dufkové, Ph.D. z Výzkumného ústavu veterinárního lékařství, v. v. i. v Brně za to, že jsem se mohla stát členem jejich týmu a věnovat se tématu virových infekcí netopýrů. Největší dík poputuje do Německa do týmu Dr. Rainera G. Ulricha (Institute of Novel and Emerging Infectious Diseases (INNT) ve Friedrich-Loeffler Institutu), kde jsem strávila 11 měsíců na pracovní stáži ERASMUS+. Začátky nebyly jednoduché, ale jsem velmi vděčná za příležitost a získané zkušenosti díky práci ve světově uznávaném pracovišti, kde spojení že něco nejde, prostě neexistuje. Děkuji všem svým kolegům za jejich pomoc a rady, jmenovitě Stephanu Drewesovi, Stefanu Fisherovi, René Ryllovi, Maysaa Dafalla, Dörte Kaufmann a Anke Mandelkow. Za možnost provést a analyzovat data z NGS testování děkuji Dr. Dirku Höpperovi a Florianu Pfaffovi. Za to, že jsem se v Německu cítila jako doma, děkuji především Dr. Nilsu Kleyovi a jeho rodině a mým přátelům Miriam Andrada Sas, Mahmoud Naguib a Rebece König. V neposlední řadě patří velký dík mé rodině a přátelům za nekončící podporu a pochopení, a především mému příteli Kubovi za to, že mi byl po celou dobu doktorského studia oporou, se vším mi pomáhal a kriticky hodnotil všechny moje nápady.
16
17 Prohlašuji, že jsem tuto dizertační práci vypracovala samostatně s využitím informačních zdrojů, které jsou v práci citovány. V Brně Petra Straková
18
19 Seznam použitých zkratek AI BioEdit BLAST BSL-3 BRNV CDC cdna DEPC DNA DOBV ECDC EFSA ELISA EPIDAT FLI GenBank HFRS HPS HTNV ICTV avian influenza (ptačí chřipka) Biological sequence alignment Editor Basic Local Alignment Search Tool (vyhledávací nástroj sekvenčního přiložení) biosafety level 3 (úroveň zabezpečení) Brno virus Centers for Disease Control and Prevention (Centrum pro kontrolu a prevenci nemocí), U.S.A. complementary cdna (komplementární DNA) diethyl pyrokarbonát deoxyribonucleic acid (deoxyribonukleová kyselina) Dobrava-Belgrade hantavirus European Centre for Disease Prevention and Control (Evropské centrum pro prevenci a kontrolu nemocí), Stockholm European Food Safety Authority (Evropský úřad pro bezpečnost potravin) Enzyme-Linked ImmunoSorbent Assay (enzymová imunoanalýza) databáze epidemiologických dat ČR, Státní zdravotní ústav Friedrich-Loeffler-Institut genetická sekvenční databáze Hemorrhagic Fever with Renal Syndrome (hemoragická horečka s renálním syndromem) Hantavirus Pulmonary Syndrome (hantavirový plicní syndrom) Hantaan virus International Committee on Taxonomy of Viruses (Mezinárodní komise pro taxonomii virů)
20 MEGA7 MERS Molecular Evolutionary Genetics Analysis software Middle East repiratory syndrome (Blízkovýchodní respirační syndrom) MERS-CoV MERS coronavirus (MERS koronavirus) NCBI NE NGS PCR PRNT PROMED PUUV National Center for Biotechnology Information (Národní centrum pro biotechnologické informace), U.S.A. nephropathia epidemica Next Generation Sequencing (sekvenování nové generace) Polymerase Chain Reaction (polymerázová řetězová reakce) Plaque reduction neutralization test (plak redukční neutralizační test) Program for Monitoring Emerging Diseases (program pro monitorování emergentních nákaz) Puumala virus real-time RT-qPCR kvantitativní reverzně transkripční polymerázová řetězová reakce v reálném čase RNA RT-PCR SARS SARS-CoV SEOV SNV ssrna TBEV TMB TULV UN ribonucleic acid (ribonukleová kyselina) reverse transcription polymerase chain reaction (reverzně transkripční polymerázová řetězová reakce) Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom) SARS coronavirus (koronavirus SARS) Seoul virus Sin Nombre virus single stranded ribonucleic acid (jednovláknová ribonukleová kyselina) tick-borne encephalitis virus (virus klíšťové encefalitidy) tetramethylbenzidin Tula virus United Nations (Spojené národy)
21 USUV VERO Usutu virus buněčná linie z ledvin kočkodana zeleného VHE hepatitis E virus (virus hepatitidy E) VTEC VÚVEL WHO WNV verotoxigenic E.coli (verotoxigenní E. coli) Výzkumný ústav veterinárního lékařství World Health Organization (Světová zdravotnická organizace) West Nile virus (virus západonilské horečky)
22
23 Obsah 1 Úvod Literární přehled řešené problematiky Zoonózy Definice zoonóz Historický vhled do problematiky zoonóz Migrace lidí, zvířat a jejich přeprava Přirozená migrace zvířat Změny klimatu Surveillance Virové zoonózy Emergence virových zoonóz Způsoby přenosu virových zoonóz Současný stav vědění Zoonózy v Evropě a v České republice Cíle dizertační práce Komentovaný soubor prací Hantaviry Soubor komentovaných prací týkajících se hantavirů Autorčin podíl na daném výzkumu Flaviviry - virus západonilské horečky a virus Usutu Soubor komentovaných prací týkajících se flavivirů Autorčin podíl na daném výzkumu Virus hepatitidy E Komentovaná práce týkající se viru hepatitidy E Autorčin podíl na daném výzkumu Závěr Literatura Příloha tabulky Hantaviry
24 7.2 Flaviviry Virus hepatitidy E Příloha publikace
25 1 Úvod Předložená dizertační práce je koncipovaná jako soubor komentovaných publikací týkajících se zoonotických virů u volně žijících endotermních obratlovců a je rozdělená na několik kapitol: Kapitola Literární přehled řešené problematiky podává ucelený přehled o problematice zoonóz od historie jejich objevu až po současné trendy výzkumu. Vyzdvihuje důležitost lidského a ekologického faktoru při šíření těchto onemocnění do nových oblastí. Na závěr je uvedeno několik důležitých zoonóz vyskytujících se v Evropě a v České republice. V kapitole Cíle dizertační práce jsou v bodech vypsány hlavní cíle této práce rozdělené do částí dle vybraných zoonotických virů. Po této úvodní části následuje stěžejní část této dizertační práce a to kapitola nazvaná Komentovaný soubor publikací. Je opět rozdělena do tří částí a po obecném popisu vybraných virů následuje rozbor publikací a podíl autorky na výzkumu. Z velkého výčtu zoonotických virů byly vybrány následující hantaviry, flaviviry západonilské horečky a Usutu a virus hepatitidy E. Hantaviry jsou v Evropě známé již velmi dlouho, jsou původci v některých případech velmi závažného hemoragického syndromu s renálním selháním. Hostitelé patogenních druhů hantavirů jsou hlodavci. V současné době dochází k popisu nových hantavirů u hmyzožravců a netopýrů. Patogenní potenciál těchto nových hantavirů není ještě určen. Virus západonilské horečky je přenášen komáry a jedná se o výborný příklad tzv. nákazy s přírodní ohniskovostí. Tento virus ve volné přírodě koluje mezi ornitofilními komáry a vodním ptactvem. Člověk se může nakazit při vstupu do tohoto ohniska a ve vzácných případech může dojít k rozvoji meningitidy či encefalitidy. Virus Usutu a virus hepatitidy E patří mezi nově se vyskytující viry v Evropě. Virus Usutu patří také do flavivirů a jeho ekologie je podobná viru západonilské horečky. Virus hepatitidy E je původcem lidské hepatitidy E získané pozřením nedostatečně tepelně zpracovaného masa. Tento přenos je typický hlavně pro vyspělé státy, v rozvojových státech se tento virus přenáší fekálně-orální cestou. Publikace, které v době přípravy této dizertační práce byly vydány, jsou součástí kapitoly Přílohy. V poslední části, kapitole Závěr, jsou shrnuty výsledky této dizertační práce. 1
26
27 2 Literární přehled řešené problematiky 2.1 Zoonózy Definice zoonóz Jako zoonotická onemocnění (zoonózy) se označují onemocnění přenosná ze zvířat na člověka. Jejich původci mohou být priony, viry, bakterie, houby, prvoci či parazitičtí červi (Hubálek a Rudolf 2007, 2011). Největší počet zoonóz je hlášen z oblastí s velkou druhovou diverzitou živočichů a zároveň vysokou hustotou zalidnění např. z jihovýchodní Asie, Střední Ameriky, subsaharské Afriky a Mediteránu (Obr. 1) (Han a kol. 2016). V těchto oblastech je šance kontaktu člověka se zoonotickým agens vysoká. Taylor a kol. (2001) udávají, že z známých infekčních chorob je 60% zoonotických, z nich je 75% virového původu a pocházejí z volné přírody. Podle informací CDC je u 3 ze 4 tzv. emergentních (tj. nově se objevujících) infekčních chorob zdrojem infekce zvíře (CDC 2016). Obr. 1: Mapa zeměpisného rozšíření zoonóz se savčím rezervoárem. Ty se vyskytují celosvětově, se 4 hlavními oblastmi Amazonie, Evropa, východní Afrika a jihovýchodní Asie. Počet hostitelských druhů (žlutý sloupec), zoonotické patogeny (červený sloupec). Tato mapa zobrazuje volně žijících savců z 27 řádů (Han a kol. 2016) Historický vhled do problematiky zoonóz Kořeny vzájemného přenosu agens mezi zvířaty a lidmi pravděpodobně sahají až k počátku antropogeneze. Je velmi těžké určit dobu, ve které by lidé (či jejich předci) a zvířata 3
28 neexistovali v těsném soužití (Fiennes 1979). Domníváme se, že se první zoonózy objevily v souvislosti s domestikací divokých zvířat a následným přetvářením okolní krajiny. Zvířata nesloužila pouze jako zdroj potravy (drůbež, ovce, kozy, dobytek), ale i k dopravě (koně, velbloudi) nebo jako domácí společník (pes, kočka) (Johnson 2014). Už Virchow, Koch i Pasteur si uvědomovali, že lidé i zvířata sdílejí některé patogeny a navrhovali zavedení pojmu one medicine sjednocení vědomostí ohledně veterinární a lidské medicíny (Atlas 2012). Lidská kultura byla vždy determinována svým geografickým prostředím. Vyvinula se z původních lovců a sběračů na farmáře s cílem chovat zvířata, pěstovat plodiny a následně s nimi dále obchodovat (Galvin a kol. 2001). Domestikace zvířat nebyla jednorázovou událostí, probíhala v době přibližně od do př.n.l. (Diamond 2002). Nejvhodnější zvířata určená pro domestikaci byla ta, která se přirozeně vyskytovala ve skupině (stádo, smečka). Tyto druhy byly speciálně šlechtěny a chovány kvůli daným specifickým kvalitám (maso, mléko, kožešiny) a v současné době se již geneticky liší od svých volně žijících předků. Domestikace vedla k zvětšení produkce určitých druhů zvířat, k zvýšení lidské populace a umožnila rozvoj lidské civilizace (Rose a Lauder 1996). Na druhou stranu to ovšem vedlo i k ničení životního prostředí, jehož důsledkem bylo vymření některých původních zvířecích druhů. Lidská populace rostla a to vyžadovalo větší nárok na půdu a vodní zdroje pro zemědělství. Tato evoluční změna v chování lidí (domestikace, chov zvířat, doprava a obchod) umožnila větší šanci k mezidruhovému přenosu nejen virových nákaz (Bidaisee a kol. 2014) Migrace lidí, zvířat a jejich přeprava Dalším důvodem narůstajícího počtu zoonóz byla/je lidská populační expanze. S tím souvisí rozšiřování měst (urbanizace) a zvyšování podílu zemědělské půdy na úkor lesů/pralesů (Johnson 2014). V současné době světová populace překročila hranici 7 miliard lidí. Můžeme pozorovat dva trendy v rozvinutém světě se lidé začínají stěhovat z velkých měst do jeho okolí (satelitní města), zatímco v rozvojovém světě se lidé stěhují do velkých měst. V roce 1950 byla za megaměsta označena jen New York a Londýn (> 10 miliónů lidí), v roce 2015 se už na světě nacházelo více než 38 megaměst (z toho 23 v Asii) (UN 2010). S lidmi se také stěhují i domácí mazlíčci. To zvyšuje šanci na např. zisk hantavirového syndromu z potkanů chovaných jako domácí mazlíčci (McElhinney a kol. 2016). Lidská migrace je neustále probíhající děj a dochází k ní z různých důvodů (např. stěhování do velkých měst za prací, válečné konflikty, globální oteplování). Hlavními problémy, které sužují migranty, jsou 4
29 nedostatek hygieny, pitné vody a sanitace. Tyto faktory umožňují jednodušší šíření vodou přenosných virových zoonóz. V tropických oblastech je dalším problémem vysoká hustota vektorů, které ve spojení s přelidněním podporují rychlé šíření zoonóz. S rozvojem letecké a lodní dopravy je dnes možné během krátké doby procestovat celý svět. To umožňuje zavlečení agens do nových oblastí a možné rozšíření virových zoonóz po celém světě za velmi krátkou dobu (viry není možné detekovat v jejich inkubační době). Globalizace podporuje produkci, transport a spotřebu divoce žijících a domácích zvířat a produktů z nich. Takto se dováží a vyváží zvířata určená na výstavy, pro vědu a výzkum, ochranu přírody (ZOO), domácí a chovná zvířata (Marano a kol. 2007). Tento způsob dopravy je opět dalším ze zdrojů šíření virových zoonóz. Dle Jenkins a kol. (2007) bylo jen do USA dovezeno v letech kolem 37 miliónů obojživelníků, ptáků, savců a plazů. Bohužel u nelegálního trhu se zvířaty podobná čísla neexistují, ale jsou určitě mnohem vyšší Přirozená migrace zvířat Kromě této lidmi řízené přepravy zvířat je důležité se zmínit i o přirozené migraci zvířat, zvláště pak ptáků. Ptáci jsou dobře popsanými rezervoáry virových zoonóz, které jsou velmi závažné pro lidské zdraví. Berthold (2001) odhadl, že přibližně 50 miliard ptáků každoročně migruje a překonává vzdálenosti od desítek až několik tisíc kilometrů. Z tohoto pohledu se zdá, že ptáci jsou skvělým příkladem pro rozšiřování agens na nová území. Předpokládá se, že každoročně migruje přes Severní Ameriku kolem 5 miliard ptáků (US Fish and Wildlife Services 2010) a je dokázána jejich stěžejní role při šíření např. ptačí chřipky (AI) a viru západonilské horečky (WNV) (Rao a kol. 2009). Tato migrace na krátkou (<1 km) nebo dlouhou (až km) vzdálenost je stimulovaná změnou ročních období, změnou v dostupnosti potravy, teplotou, délkou dne nebo změnou přírodních podmínek (Dingle 1996, Schmidt a kol. 2007, Egevang a kol. 2010). Problematika šíření agens migrací ptáků je však velmi komplexní a závisí na spoustě faktorů např. patogenezi viru k danému ptačímu druhu, imunitnímu systému hostitele, schopnosti hostitele migrovat a hlavně na celkové ekologii hostitele (Prosser a kol. 2014). Mezi virové původce přenášené ptáky patří ptačí paramyxovirus 1 (kormorán) (MacPherson 1956), virus Sindbis (tetřev, drozd, vrána) (Kurkela a kol. 2008), virus západonilské horečky (pěvci, vodní ptactvo) (Hubálek 2004), virus japonské encefalitidy (volavka) (Pfeffer a Dobler 2010), virus Saint Louis (pěvci) (Hubálek 2004), virus Usutu (kos, puštík) (Weissenböck a kol. 2001) nebo virus ptačí chřipky (Alexander 2007). 5
30 Existuje několik možných mechanismů, jak migrace zvířat může přispívat k šíření virových chorob: 1) migrující zvíře se nakazí ještě před cestou, je schopné si uchovat dostatečnou virémii i během migrace a rozšíří dané agens na novém území; 2) latentní nákaza se projeví během migrace nebo po ní a virus je vylučován průběžně; 3) migrující zvíře s sebou nese infikovaného krevsajícího členovce (vektor), kterého zanese na nové území (přímý přenos), nebo se místní krevsající členovec nakazí od infikovaného migrujícího zvířete (nepřímý přenos) (Hubálek 2004, Prosser a kol. 2014). K tomuto přenosu agens na nová území může docházet každoročně (znovuzavedení) hlavně v případě, kdy agens (nebo vektor) nejsou schopni přežít určité období (např. zimu) a nedojde k vertikálnímu přenosu (z dospělce na další generace). Důkazy ukazují, že migrace může virovou prevalenci jak zvýšit (virové agens se rozšíří na nová území a uchytí se tam), tak i snížit (migrující zvířata uniknou danému patogenu) (Altizer a kol. 2011). Ačkoliv hodně druhů hmyzu, savců, ryb a ptáků migruje a má potenciál přenášet a šířit onemocnění, většina studií zabývající se virovými zoonózami se zaměřuje hlavně na ptáky a netopýry (Prosser a kol. 2014). Na rozdíl od ptáků se u savců migrace tolik nevyskytuje. Nicméně ji můžeme pozorovat u některých druhů lichokopytníků a sudokopytníků, mořských savců a u savců schopných létat. Přenos virových zoonóz je nejlépe prostudován u netopýrů. Netopýři jsou známí jako rezervoárová zvířata mnoha virových zoonóz (SARS-podobných koronavirů, Balboni a kol. 2012; henipavirů, Breed a kol. 2006; rhabdovirů, Calisher a kol. 2006; viru Ebola, Leroy a kol. 2005) a mohou je přenášet na další savce včetně lidí, u kterých mohou způsobit závažná onemocnění až smrt. Hlavní cestou přenosu těchto zoonóz na člověka je přímý kontakt s nakaženým netopýrem (lovci, veterináři), kontakt se sekundárním hostitelem (dobytek, koně, prasata), od kterého se člověk může nakazit inhalací infikovaných sekretů (Calisher a kol. 2006). Hlavní příčinou objevu nových netopýřích virových zoonóz je ničení pralesů a vstup lidí do těchto oblastí. Přibližně 3% netopýřích druhů má schopnost migrovat a je schopno uletět až několik tisíc kilometrů a tím přispívat k šíření virů na nová území (Fleming a Eby 2003, Breed a kol. 2010) Změny klimatu V současné době jsme svědky měnícího se klimatu. Jako důsledek můžeme pozorovat zvyšování teploty vzduchu a moří, zvyšování hladiny oceánů a častější výskyt extrémního počasí extrémní horka či sucha, mrazy, povodně a bouře. V některých případech mohou tyto 6
31 změny klimatu ovlivnit i životní cyklus různých přenašečů (arthropod-borne zoonoses, členovci přenášené zoonózy) Surveillance V současné době se epidemiologové zaměřují nejčastěji na surveillanci (dohled, monitoring) těchto nákaz a všech vnějších podmínek, které mohou mít význam pro jejich dynamiku (Hubálek a Rudolf 2007, 2011). Tím se rozumí sběr dat např. ohledně rozšíření vektorů nebo rezervoárů a potvrzených klinických případů s jejich rychlým vyhodnocením, a v případě nebezpečí i implementace postupů k jejich eliminaci. Mnoho různých programů a systémů kontrol probíhá po celém světě s cílem nalézt a co nejrychleji odpovědět na nové zoonózy. Surveillance u lidí spoléhá na data získaná např. protilátkovým screeningem u co nejširšího počtu obyvatel. U zvířat se surveillance opírá nejvíc o sběr různých biologických vzorků (např. u sentinelových zvířat), které jsou následně sérologicky a molekulárně vyšetřeny Virové zoonózy s významným dopadem na lidské zdraví jsou monitorovány ve spolupráci oborů, jako jsou zoologie, epidemiologie, virologie a dalších vědních disciplín. Co nejrychlejší zachycení varovných signálů vyžaduje neustálou surveillanci a zapojení co největšího počtu dat k vyhodnocení. Kromě lékařů a vědců se do surveillance zapojují i sociologové, kteří zkoumají, jaké sociální faktory ovlivňují emergenci zoonotických nákaz. Tento výzkum je ale velmi často problematický (Parkes a kol. 2005). Výsledkem tohoto snažení je tvorba modelů a scénářů vztahů mezi lidmi a zvířaty, které umožňují emergenci zoonóz. Dále navrhují jejich využitelnost v predikci potencionálních rizik objevu nových zoonóz v různých podmínkách. S využitím těchto dat se dají vytvořit přehledné mapy výskytu virových patogenů a jejich vztah k prostředí, identifikovat raná stádia onemocnění a zastavit jejich šíření hned v počátku. Sociální práce umožňuje vzdělávat a zapojit místní komunitu do problematiky surveillance. Pro rychlou, efektivní, jednoduchou a levnou identifikaci a izolaci patogenů by měly být vyvinuty vhodné metody využitelné nejen v diagnostických laboratořích, ale i v terénu. V současné době již existují i mikročipy, s jejichž pomocí je možné provádět PCR metody i jednoduché sekvenování přímo v terénu (Hoenen a kol. 2016). Monitoring reservoárů a vektorů po celém světě patří mezi nejdůležitější pilíře surveillance (Meslin 2008). Na rozdíl od antroponóz (onemocnění přenosná mezi lidmi) se zoonózy nedají jednoduše eradikovat. Je to způsobeno hlavně množstvím různých obratlovčích rezervoárů a velkou škálou bezobratlých přenašečů (Kallio-Kokko a kol. 2005). 7
32 Pro rychlou komunikaci po celém světě dnes slouží řada internetových portálů, např. PROMED, WHO, CDC, ECDC, v České republice třeba EPIDAT Státního zdravotního ústavu. Tyto platformy slouží pro sdílení výsledků, rychlých zpráv, analýz rizik a různých doporučení. Velmi vhodné jsou i kampaně určené pro veřejnost. Vytvoření a provedení těchto kampaní vyžaduje skloubit znalosti dané problematiky se sociálními, kulturními, ekonomickými, antropologickými a etickými aspekty s důrazem na to, aby této kampani porozumělo co nejvíc lidí. Závěrem této kapitoly je nutné dodat, že pro úspěšnou surveillance je nutná spolupráce napříč různými obory v celosvětovém měřítku. Tato spolupráce není jen na poli diagnostiky a lékařství, ale závisí i na řadě intervencí v různých zemích a spolupráci daných vlád (Fidler 2003). Cílem je pak zajistit maximální ochranu před mezinárodním rozšířením nemoci ale s minimálním zásahem do světové dopravy. To vyžaduje například velmi rychlou reakci daného státu, ve které se nákaza vyskytla, a schopnost kontrolovat pohyb osob v rámci země (WHO 1983). Mezinárodní právo také napomáhá kontrolovat výskyt onemocnění a velké množství smluv a dohod specifikuje povinnosti států v případě výskytu některých infekčních onemocnění (Fidler 2001). 2.2 Virové zoonózy Emergence virových zoonóz Většina nových virových zoonóz se objevila v důsledku vstupu lidí do volné přírody (odlesňování pralesů, ničení krajiny), díky blízkému soužití lidí a zvířat (drůbež, prasata a lidé žijící na jednom místě Čína), globálnímu obchodu se zvířaty a cestování po celém světě (turistika). Interakce mezi prostředím a lidským chováním jsou vždy komplexní a ovlivňují emergenci (re-emergenci) zoonotických virů často způsoby, které nejsou vždy úplně jasné. Jako emergentní (re-emergentní) organismy označujeme agens, která jsou nově rozpoznaná nebo nově se šířící (Han a kol. 2016) a patří mezi ně např. viry Nipah, Hendra, SARS-CoV a MERS-CoV, virus ptačí chřipky (H5N1), virus západonilské horečky (USA ptáci) či virus Chikungunya (ostrovy Indického Oceánu, jižní Evropa, Střední Amerika komáři). Emergence je několikastupňový proces a v každém případě vyžaduje kontakt člověka s infekčním agens (ať už přímý nebo nepřímý) pocházejícím z volné přírody (Childs a kol. 2007). Pro úspěšný mezidruhový přenos (cross-species, spill-over infection) je nutné, aby cizí 8
33 virus v novém hostiteli úspěšně dokončil svůj životní cyklus: a) adsorbce, penetrace, odhalení nukleové kyseliny a doputování do místa replikace, b) transkripce a translace, c) sestavení nových virionů a jejich uvolnění z hostitelské buňky (Nayak 2000). Adsorbce a penetrace do hostitelské buňky je podmíněna přítomností vhodných receptorů. V některých případech může tento mezidruhový přenos vyžadovat přítomnost vektorů nebo dalších hostitelů (Nayak 2000, Childs 2004). Průběh infekce u nového hostitele (nahodilého) se může lišit od většinou inaparentního průběhu infekce u rezervoárového zvířete. Příklady mohou být léze (způsobené herpesvirem B) na čelistech makaků, které je nijak neohrožují, ale u člověka může tento virus způsobit až smrtelnou meningoencefalitidu (Huff a Barry 2003), nebo inaparentně probíhající infekce hlodavců hantaviry, které se mohou u člověka projevit od mírných horečnatých příznaků až po hemoragické horečky (Zaki a kol. 1995). Vše závisí na virulenci daného agens a na imunitním systému hostitele. Dalšími kroky, které už ale nejsou nutné pro emergenci, jsou mezilidský přenos a genetická adaptace na lidského hostitele. Tyto poslední kroky jsou nezbytnou podmínkou pro pandemickou emergenci daného patogena (Childs 2004). Probíhající objevy nových zoonóz jen potvrzují teorii, že dosud známé viry jsou pouhým vrcholem ledovce (Murphy 1998), přičemž především RNA viry jsou schopné velmi rychlé adaptace ke stále se měnícím přírodním podmínkám a patří mezi přední emergentní patogeny (Ludwig a kol. 2003) Způsoby přenosu virových zoonóz Jak bylo zmíněno výše, je mnoho různých druhů zoonotických agens. To, zda způsobí onemocnění, záleží na jejich vlastnostech, na stavu hostitele a na vlivu prostředí. Patogenitou rozumíme soubor jevů a procesů, které vedou k onemocnění. Je to složitý proces, který zahrnuje způsob šíření nákazy, cesty vstupu patogenu do organismu člověka a délku inkubační doby. Míru patogenity pak určuje virulence, která je dána schopností patogenu se množit v daném hostiteli za projevů jeho poškození nebo onemocnění. Virulence může být usnadněna invazivitou, schopností agens proniknout do hostitele, a toxigenitou, schopností poškozovat hostitele produkcí toxinů. Vnímavost hostitele je dána např. věkem, stavem imunity, výživou a na molekulární úrovni např. přítomností buněčných receptorů. Cesty průniku virů do organismu nejsou nahodilé, ale jsou výsledkem dlouhého vývoje. K šíření virů mezi hostiteli dochází přímou nebo nepřímou cestou. Nejčastěji se nákazy přenášejí kapénkovou infekcí (respirační viry), střevním traktem (enteroviry) a přímým kontaktem. Lidské tělo od okolí oddělují tří hlavní bariéry kůže, střevní a dýchací trakt. 9
34 Epitel genitálu a oční spojivky jsou menší bariéry. Pro úspěšné zdolání musí být daný virus schopný buď infekce buněk těchto bariér, anebo se po poškození těchto bariér (pokousáním/poškrábáním zvířetem, kousnutí/sání hmyzem) dostane do vnitřního prostředí. Zvláštním způsobem přenosu je vertikální přenos (Růžek 2012, Votava 2005). V těle se pak virus šíří sliznicemi (mezi buňkami), lymfatickou cestou, neurální cestou nebo krevní cestou. Z těla mohou být viry vylučovány již v místně primárního pomnožení nebo v případě generalizované infekce sputem, krví, slinami, močí, stolicí či spermatem. Virové zoonózy přenášené vektory (vector-borne zoonoses) Na začátku 20. století se staly epidemie virových zoonóz přenášených vektory velkým celosvětovým problémem. Největší epidemie byly způsobeny virem žluté zimnice a virem horečky dengue. Následovaly rychlé a efektivní preventivní programy, kontrolní opatření, vývoj a úspěšné použití nových insekticidů, léčiv a vakcín (Gubler 1998). Ke konci 20. století se ale začaly projevovat důsledky změn klimatu a lidského chování, které vedly k reemergenci těchto zoonóz (Gubler 1989). Původně lokální rozšíření vektorů charakteristických pro určitou zoonózu se zvětšilo na širší území. Hnací silou byly i zde hlavně antropogenní faktory (migrace, cestování, doprava). Vektoři přenášející patogeny jsou citliví na změny klimatu. To se projeví hlavně na úrovni jejich přežití a reprodukci, frekvenci sání na hostiteli, inkubační době patogenů a jejich reprodukci, a na efektivitě přenosu patogenů mezi různými hostiteli (NCBI 2008). Z řady vektory přenášených zoonóz jsou nejdůležitějšími původci reemergentních nákaz arboviry (arthropod-borne viruses) z čeledí Togaviridae, Flaviviridae a Bunyaviridae. Příkladem těchto zoonóz mohou být žlutá zimnice, západonilská horečka, klíšťová či japonská encefalitida (Hubálek a Rudolf 2011). Virové zoonózy přenosné vzduchem (air-borne zoonoses) V posledních letech jsme svědky narůstajícího počtu epidemií vyvolaných respiračními zoonotickými viry. Tato vypuknutí ('outbreaks') jsou způsobena skutečnou emergencí nových patogenů. Mohou se vyskytovat na lokální úrovni (virus Hendra, virus Nipah) nebo se mohou rozšířit i po celém světě (virus SARS, viry influenzy (H5N1) (Condon a Sinha 2010). Vzduchem přenosné virové nákazy patří mezi nejzávažnější infekční choroby u lidí a mohou způsobovat až pandemie (virus influenzy H1N1 v době konce 1. světové války). Pandemie v letech měla na svědomí smrt asi 50 miliónů lidí (Mettenleiter 2006). V roce 2009 měl kmen influenzy H1N1 (prasečí chřipka, mexická chřipka neboli nový typ A/H1N1) na 10
35 svědomí světovou pandemii, která vyústila ve velmi přísné restrikce v cestování a obchodu v mnoha zemích světa (WHO 2010). V současné době panují obavy ohledně nově kolujících kmenů ptačí influenzy H5N1 a H7N9. Zdrojem těchto respiračních infekcí jsou zvířata a přenos je uskutečněn skrze respirační trakt. Klinické projevy mohou být lokální na úrovni infekce horních/dolních dýchacích cest nebo se mohou rozvinout do systémové infekce a napadat různé orgány. Přírodní zdroj těchto zoonotických virů zůstává v některých případech stále nejistý, ale většinou se uvažuje o vodních ptácích. Hlavními důvody této emergence jsou opět cestování, světový obchod, změny v zemědělství a změny klimatu (Wang 2011). Pohyb lidí má na šíření těchto patogenů velký vliv. V dnešní době se počet cestovatelů nejen zvyšuje, ale zvyšuje se i frekvence a rychlost s jakou cestují (Condon a Sinha 2010). Vzduchem přenosné virové zoonózy jsou v současné době velkou výzvou a jsou přímým důsledkem problematiky globálního cestování. Virové zoonózy přenosné vodou a potravou (water-borne and food-borne zoonoses) Kontaminace vodních zdrojů viry a jejich přenos orální cestou je dalším ze způsobů šíření zoonotických virů. Ke kontaminaci vody může dojít lidskou činností (nedostatečná úprava pitné vody, poruchy kanalizace, průmysl, přelidnění), zemědělskou činností (splachy) nebo při přírodních katastrofách a změnách klimatu (záplavy, tsunami, bouře) (Sedas 2007). Je statisticky prokázán vztah mezi nadměrnými dešti a nárůstem počtu nákaz způsobených vodou přenosnými viry (Curriero a kol. 2001). Tyto lijáky mohou způsobit povodně, díky kterým dochází ke kontaminaci vodních zdrojů splašky. V přímořských oblastech dochází ke snížení salinity vody a tato změna ph umožňuje virovou replikaci v případech, kdy by to za normálních podmínek nebylo možné (Harvell a kol. 2002, Hunter 2003). Většina velkých epidemií způsobených vodou přenosnými viry jsou spíše antroponózy, ve kterých je zdrojem nakažený člověk. Ale mnoho těchto virových zástupců má i svého zvířecího hostitele a tedy zoonotický potenciál. Lze je tudíž brát i jako zoonózy. Podobně je na tom virus hepatitidy E. U tohoto viru je v současnosti zkoumán hlavně jeho zoonotický potenciál při konzumaci nedostatečně tepelně upraveného masa z domácích i divokých prasat, zvěřiny a mořských plodů (Pavio a kol. 2010). Cestou nákazy u virů přenosných vodou je fekálně-orální přenos. Je tedy možné předpokládat, že v případech, kdy lidé a zvířata žijí v těsném soužití, může dojít ke kontaminaci vody např. bovinními nebo prasečími rotaviry a člověk se může nakazit (Gratacap-Cavallier a kol. 2000, Vašíčková a kol. 2005). 11
36 Virové zoonózy přenášené z volně žijících zvířat (wildlife-associated viral zoonoses) Virové zoonózy mají své zvířecí rezervoáry hlavně ve volné přírodě. Každý krajinný ekosystém obsahuje množství druhů obratlovců a bezobratlých vektorů, a každý z nich v sobě může nést řadu potencionálně zoonotických patogenů včetně virů. Počet těchto virových zoonóz pocházejících z volné přírody v poslední době vzrůstá a s tím stoupá i jejich klinická důležitost. Emergence těchto přírodně-ohniskových zoonóz je velmi ovlivněna globální lidskou činností. Rozpínající se lidská populace a území nutné pro zvířecí produkci zasahují do oblastí, které bývaly předtím výlučně tvořené původní přírodní krajinou ('wildlife area') a tím zvyšují pravděpodobnost styku volně žijících zvířat, domácích zvířat a lidí. Kromě již zmíněných nákaz jako SARS a ptačí chřipka, můžeme do této kategorie zařadit vzteklinu nebo vysoce nakažlivé a nebezpečné hemoragické horečky Ebola a Marburg (Bengis a kol. 2004). Nejvíce ohrožené jsou osoby, které pracují v přírodních ohniscích (lesníci, myslivci, zemědělci, lovci) a ti, kteří se podílejí na produkci a prodeji tzv. bushmeat. Tento obchod s masem zvířat pocházejících z pralesů je další možnou příčinou emergence a šíření nových virových zoonóz. Do tohoto koloběhu jsou zapojení jak lovci, tak i řezníci a spotřebitelé. Nejčastější cestou přenosu jsou pak škrábance, pokousání nakaženým zvířetem v průběhu lovu, a také řezné rány a kontakt s tělními tekutinami mrtvých zvířat během zpracování masa. Tento způsob nákazy byl popsán např. u opičích neštovic, u virových hemoragických horeček Marburg a Ebola a horečky Lassa (Wolfe a kol. 2005, Friant a kol. 2015). Tyto horečky se vyskytují v Africe a přenášejí se přímým stykem s opicemi, kaloni, případně hlodavci, kteří jsou považováni za jejich rezervoár (Feldman a Klenk 1996). Neustávající kácení pralesů a využívání nových ploch k zemědělským účelům nebo pro výstavbu vesnic a silnic vede k potencionálnímu zvyšování rizika přenosu virových zoonóz na lidi (LoGiudice a kol. 2003). Dalšími příklady jsou hemoragické horečky bolivijská (Machupo virus) a argentinská (Junin virus), které se přenášejí na lidi přímým stykem s hlodavci a jejich exkrety (křečci, krysy, potkani, myši) (Bidaisee a Macpherson 2014). Klíšťaty přenosná nebezpečná zoonóza vyskytující se v subsaharské Africe, východní Evropě, střední Asii a na Balkáně je způsobena virem krymsko-konžské hemoragické horečky (Hoch a kol. 1995). Komáry přenášená zoonóza, která se může šířit i kontaktem s nakaženými ovcemi, kozami a dobytkem, se vyskytuje v Africe a je způsobená virem horečky Rift Valley (Lacy a Smego 1996). Samozřejmě existuje mnohem víc příkladů virových zoonóz, jejichž rezervoár se vyskytuje ve volné přírodě. Mají společné to, že u většiny z nich se podaří nalézt jasnou příčinu jejich 12
37 výskytu blízký kontakt lidí a volně žijících živočichů. Dalším problémem je nelegální trh s volně žijícími zvířaty včetně 'pet trade' Současný stav vědění Před zhruba 50 lety se po celém světě začaly objevovat nové virové zoonózy. Většina z nich je ale vázána na subtropické a tropické oblasti (Kallio-Kokko a kol. 2005). V posledních letech byly takovouto hrozbou např. epidemie Eboly v západní Africe nebo epidemie viru Zika v Jižní Americe. Tyto nově se šířící virové nákazy nepředstavovaly v Evropě nijak závažný problém, protože se zde nevyskytovala buď rezervoárová zvířata, nebo jejich přenašeči. Ale vzhledem k velkému rozmachu turistiky, masové migraci osob z tropických a subtropických oblastí a změně klimatu se v Evropě začínáme setkávat i s novými chorobami. Příkladem mohou být importované nákazy např. horečka Lassa z Afriky nebo horečka dengue. Tyto nákazy ale většinou nepředstavují žádné větší riziko dalšího šíření v Evropě. Dalším významným problémem je šíření vektorů na nová území v Evropě, které někdy souvisí se změnou klimatu globálním oteplováním. Nejvýznamnějšími vektory zoonóz jsou v Evropě komáři a klíšťata (arthropod-borne diseases). V nich se agens aktivně množí, což umožňuje jejich udržování v přírodě a biologický přenos mezi vnímavými obratlovci (hostitelé) a krevsajícími členovci (vektoři). Komáři v Evropě Komáři patří mezi obtížný hmyz a jsou přenašeči velkého množství onemocnění. Tyto choroby jsou často endemické v různých částech Afriky, Ameriky nebo Asie. Každoročně způsobí úmrtí až několika milionů lidí po celém světě (ECDC 2016a). Jako invazivní druhy označujeme druhy, které jsou schopny kolonizovat nová území. Mezi ně patří např. Aedes aegypti nebo Aedes albopictus, kteří jsou přenašeči původců významných chorob virů chikungunya, žluté zimnice, Zika nebo dengue. Aedes albopictus se již vyskytuje skoro po celém území jižní Evropy a sleduje se jeho rozšíření dále na sever. Aedes aegypti se vyskytuje na Madeiře a v oblasti Černého moře. Nejrozšířenějším druhem komára v Evropě je Culex pipiens, který je zároveň hlavním přenašečem viru západonilské horečky. Komáři rodu Anopheles nepatří mezi zásadní přenašeče zoonotických virů, ale byly z nich izolovány viry Batai nebo virus západonilské horečky. V tropických oblastech jsou samozřejmě hlavními vektory malárie. Zásadní vliv na rozšíření komárů ve světě má cestování (99% případů malárie v Evropě má souvislost s cestováním), obchod (díky lodní dopravě byl Ae. albopictus 13
38 přenášen z kontinentu na kontinent; více než 5 miliónů turistů z Evropy navštíví ročně oblasti rozšíření horečky dengue) a změna klimatu (předpokládá se, že při současném trendu zvyšování teploty a vlhkosti vzduchu se brzy Ae. albopictus usadí i ve střední nebo dokonce severní Evropě; vzrůstající teplota v období léta může přispívat k zvýšení počtu případů západonilské horečky v nových oblastech Evropy) (ECDC 2016a). Příkladem lokálního přenosu komáry přenášených nákaz může být horečka dengue v Chorvatsku v roce 2010, kde se jednalo o autochtonní nákazu německého turisty s následným průkazem horečky dengue i u místního obyvatelstva (Gjenero-Margan a kol. 2011), epidemie viru chikungunya na severu Itálie u 217 lidí v roce 2007 (Liumbruno a kol. 2008), lokální epidemie chikungunya a dengue ve Francii v letech 2010, 2014 a 2015 (Grandadam a kol. 2011; Succo a kol. 2016) a první ohnisko horečky dengue na Madeiře v letech , kde byl jako vektor určen komár Ae. aegypti (Lourenco a Recker 2014). Všechny tyto nákazy byly do Evropy zavlečeny díky cestování, navíc došlo k úspěšnému zavlečení těchto virů do místní populace komárů. Klíšťata v Evropě Klíšťata jsou malí ektoparazité, kteří ke svému životnímu cyklu potřebují svého hostitele (savce, ptáky). Často také sají na lidech a mohou takto přenášet různé patogeny. Nejrozšířenějším klíštětem je Ixodes ricinus, které se vyskytuje v celé Evropě, vyžaduje vysokou vlhkost a můžeme jej najít v listnatých až smíšených lesích. Je přenašečem lymské borreliózy (nejčastější klíšťaty přenosná choroba v Evropě) a viru klíšťové encefalitidy (je dostupná vakcína). V současné době vzrůstá obava ohledně zavlečení TBEV na nová území díky šíření klíšťat (ECDC 2016b). Životní cyklus klíštěte obecného trvá kolem 2-3 let, ale vlivem počasí se může měnit. Vyšší teplota může životní cyklus urychlit a mírná zima umožní přežití většího množství klíšťat a jejich rychlou aktivitu na jaře. Vývoj klíštěte zahrnuje 4 fáze: vajíčko (uložené v půdě), z něj se vylíhne larva, která saje na myších, ptácích a malých savcích, z ní se vyvine nymfa, která saje na hlodavcích a středně velkých obratlovcích, a konečné stádium dospělce, které saje na velkých savcích např. srny, jeleni. Hostitelé jsou důležitou složkou šíření klíšťat, protože je mohou zanést na nová území. Člověk je náhodným hostitelem a taktéž konečným hostitelem ('dead-end host') (Hubálek a Rudolf 2007, 2011). Dalším důležitým druhem klíštěte je Hyalomma marginatum, které preferuje sušší a teplejší klima Středomoří a vyskytuje se hlavně v jižní a východní Evropě. Je přenašečem viru krymžsko-konžské hemoragické horečky. Tento virus patří mezi emergentní patogeny v Evropě (ECDC 2016b). 14
39 2.2.4 Zoonózy v Evropě a v České republice Dle EFSA jsou nejčastějšími zoonózami v Evropě kampylobakteróza, salmonelóza, yersinióza, infekce VTEC (verotoxigenní E.coli), listerióza, echinokokóza, Q-horečka, brucelóza, tularémie, trichinelóza, západonilská horečka a vzteklina (ECDC EFSA 2015). EFSA se zabývá hlavně potravou přenosnými patogeny, proto tím mohou být data částečně ovlivněna. Mezi původce dalších evropských virových zoonóz můžeme zařadit hantaviry, arenavirus lymfocytární choriomeningitidy, virus ptačí chřipky, hepevirus virové hepatitidy E, nairovirus krymžsko-konžské hemoragické horečky, orthobunyaviry Ťahyňa a Inkoo, fleboviry Toscana a horeček papatači, alfavirus Sindbis, flaviviry klíšťové encefalitidy a louping ill a flavivirus Usutu. Mezi arboviry, občas importované do Evropy, řadíme flaviviry dengue, žluté zimnice a alfavirus chikungunya (Hubálek a Rudolf 2011). V České republice se ze zoonóz vyskytují nejvíce kampylobakteróza, salmonelóza, lymská borrelióza, toxoplazmóza, toxokarózy, zoofilní dermatofytózy, leptospiróza, listerióza, tularémie a klíšťová encefalitida (EPIDAT 2017, Sedlák a Tomšíčková 2006). Samozřejmě se i u nás občas vyskytne několik importovaných případů horečky dengue, malárie nebo žluté zimnice. 15
40
41 3 Cíle dizertační práce Tato předložená dizertační práce se zaměřuje z velkého výčtů virových zoonóz na tři oblasti virové zoonózy přenášené hlodavci - hantaviry, virové zoonózy přenášené komáry virus západonilské horečky a virus Usutu, a virové zoonózy přenášené potravou virus hepatitidy E v souvislosti s jejich volně žijícími rezervoárovými zvířaty. Cílem první části bylo doplnění nejnovějších poznatků ohledně hantavirů detekovaných u hlodavců a nově i u netopýrů na území České republiky. V rámci mé stáže v Německu bylo mým cílem potvrdit/vyvrátit časový a zeměpisný výskyt Dobrava-Belgrade viru u myšice temnopásé, a poprvé provést testování hlodavců z Litvy na hantaviry. Cílem druhé části bylo sérologicky vyšetřit volně žijící divokou zvěř a vodní ptáky na přítomnost protilátek proti dvěma flavivirům, viru západonilské horečky a viru Usutu, což by potvrdilo jejich důležitou roli pro udržování těchto virů v přírodním ohnisku nákazy. Cílem třetí části bylo retrospektivně sérologicky vyšetřit volně žijící divoká prasata a další lovnou zvěř na přítomnost protilátek proti viru hepatitidy E. Pozitivní nálezy by potvrdily, že se tento virus nacházel v České republice mnohem dřív, než se u nás začal sledovat především z pohledu lidských případů. 17
42
43 4 Komentovaný soubor prací 4.1 Hantaviry Dle nejnovější taxonomie ICTV patří hantaviry (rod Orthohantavirus) do čeledi Hantaviridae a řádu Bunyavirales (ICTV proposal 2017). Ve své práci se dále budu držet starší taxonomie a nazývat rod hantavirus namísto Orthohantavirus. Jejich genom je tvořen ssrna s negativní polaritou a je složen ze tří segmentů L ( large ), který kóduje virovou RNAdependentní RNA polymerázu, M ( medium ), který kóduje dva strukturní glykoproteiny G1 a G2, a S ( small ), který kóduje nukleokapsidový protein (Obr. 2) (King a kol. 2011). Obr.2: Schéma virionu bunyavirů. Tři segmenty virového genomu (S, M, L) jsou obaleny nukleokapsidovým proteinem a spolu s funkční RNA dependentní RNA polymerázou tvoří ribonukleový komplex. Celý virion je obalen lipidovým obalem pocházejícím z hostitelské buňky a jsou do něj vnořeny virové glykoproteiny. U bunyavirů se nevyskytuje M protein. Převzato z Schlegel a kol Objev hantavirů je spojen s válkou v Koreji v 50. letech 20. století, kdy onemocnělo několik tisíc vojáků hemoragickou horečkou neznámé etiologie. Až v roce 1978 byl popsán u myšice temnopásé (Apodemus agrarius) původce této korejské hemoragické horečky, byl izolován a pojmenován podle řeky Hantaan Hantaan virus - HTNV (Lee a kol. 1978). Následně byly objeveny i další hantaviry, např. Puumala virus PUUV (Brummer-Korvenkontio a kol. 1980), Dobrava-Belgrade virus - DOBV (Avsic-Zupanc a kol. 1992), Seoul virus SEOV 19
44 (Lee a kol. 1982), Sin Nombre virus - SNV (Elliot a kol 1994) nebo Andes virus - ANDV (Galeno a kol. 2002). Dnes je známo více než 50 hantavirů, ale oficiálně uznaných ICTV je 41 (ICTV 2017). V nejnovější taxonomii z letošního roku jsou již oficiálně uznané i některé netopýří hantaviry. Za hlavní rezervoár hantavirů byli dlouho považováni pouze hlodavci (Rodentia) hlavně z čeledi myšovitých (Muridae) a křečkovitých (Cricetidae Arvicolinae, Neotominae, Sigmodontinae). Dnes se k rezervoárům hantavirů řadí i hmyzožravci (Eulipotyphla rejsci Soricidae a krtci Talpidae) a netopýři (Chiroptera) (Obr. 3). Pořád ale zůstává neobjasněno, jestli jsou tyto nové hantaviry patogenní pro člověka. Mezi hantaviry nalezené u rejsků řadíme například: Seewis virus (Song a kol. 2007a), Thottapalayam virus (Carey a kol. 1971), Asikkala virus (Radosa a kol. 2013) a Cao bang virus (Song a kol. 2007b). U hmyzožravců a hlodavců se často vyskytují spill-over infekce. Jako příklad hantavirů nalezených u krtků lze uvést: Nova virus (Kang a kol. 2009) a Asama virus (Arai a kol. 2008), u netopýrů Mouyassué virus (Sumibcay a kol. 2012), Magboi virus (Weiss a kol. 2012), Xuan Son virus a další asijské hantaviry (Guo a kol. 2013). Obr. 3: Mapa rozšíření hantavirů a jejich hostitelů. Převzato z Guo a kol
45 Hantaviry jsou rozšířeny celosvětově a kdysi se dělily na hantaviry Starého a Nového světa (Obr. 3). Podle tohoto starého dělení patřily do skupiny Starého světa (Evropa, Asie) např. PUUV, DOBV, HTNV a do Nového světa (Severní a Jižní Amerika) např. SNV a ANDV. Dnes se vzhledem k nově popisovaným hantavirům od tohoto dělení upouští. V současné době byly popsány hantaviry i v Africe (Klempa a kol. 2006, Witkowski a kol. 2014), jejich přítomnost v Austrálii však zůstává stále neobjasněna (LeDuc a kol. 1986). Přenos hantavirů je uskutečněn vzdušnou cestou ( air-borne ), kdy člověk vdechne aerosol kontaminované hlodavčí moči, trusu a slin (Obr. 4). Přenos je také možný přímým kontaktem s infikovaným hlodavcem (poškrábání, pokousání) nebo fekálně-orální cestou (Klein a Calisher 2007, Schlegel a kol. 2014). Hlodavci jsou chronicky infikováni bez známek probíhající infekce. U lidí mohou proběhnout dva typy klinického onemocnění v závislosti na druhu hantaviru. V Evropě a Asii se jedná o hemoragickou horečku se selháním ledvin (HFRS hemorrhagic fever with renal syndrome) a její mírnější formu nephropathia epidemica (NE) vyskytující se hlavně ve Skandinávii. V Severní a Jižní Americe se onemocnění nazývá hantavirový (kardio-) plicní syndrom (HPC hantavirus pulmonary syndrome). Závažnost vždy závisí na virulenci daného agens, infekční dávce a stavu imunitního systému člověka. Obecně ale platí, že většina lidských infekcí probíhá inaparentně. Letalita se u HFRS uvádí od 1 % do 20 % (horší průběh bývá u HFRS způsobeným DOBV než u PUUV, kde se při manifestní infekci jedná nejčastěji o NE), zatímco u HPC dosahuje v některých případech až 50 % (Yanagihara a kol. 2015). Obr. 4. Patogeneze hantavirů. Převzato a upraveno z: 21
46 V Evropě se vyskytuje cca 10 hantavirů, z nichž pouze DOBV a PUUV způsobují onemocnění u lidí. TULV se i přes několik zdokumentovaných případů (Zelená a kol. 2013; Reynes a kol. 2015) považuje stále za nepatogenní. Největší počet lidských infekcí je hlášen ze Skandinávie (PUUV většinou mírného průběhu NE) a z oblasti Balkánu (HFRS většinou vážný průběh onemocnění), nicméně střední Evropa je považována také za důležitý hot-spot, protože se zde vyskytují rezervoárová zvířata PUUV a DOBV, byly popsány lidské případy a dochází k popisu nových hantavirů (Obr. 5) (Klempa a kol. 2013a; Olsson a kol. 2010). Obr. 5. Výskyt hantavirů ve střední Evropě. DE - Německo,PL - Polsko, CH - Švýcarsko, AT - Rakousko, CZ - Česká republika,sk - Slovenská republika, HU Maďarsko. Převzato z Klempa a kol. 2013a. V současné době dochází k popisu nových hantavirů u různých zvířat a z různých oblastí světa. Tyto nové výsledky (sekvence, ať už kompletní či částečné) přispívají k celkovému pohledu na evoluci a fylogeografii hantavirů. U již popsaných a dobře známých hantavirů se věda zaměřuje na detailnější popis např. jejich struktury a funkci jejich jednotlivých proteinů, jejich patogenitu, na imunitní reakci hostitele apod. U patogenních hantavirů dnes probíhají různé monitorovací akce na lokální (státní) úrovni (např. odchyty hlodavců a jejich screening, nebo testy séroprevalence u lidí). 22
47 4.1.1 Soubor komentovaných prací týkajících se hantavirů 1. práce rukopisy v přípravě, komentář k současnému stavu práce Hantaviruses in the Czech Republic; Tula virus in the common voles in the Czech Republic. Straková P. (spoluautor) 2. práce souhrnné sdělení, publikováno v Epidemiologie, Mikrobiologie, Imunologie (IF2015-0,268) Vrbovská V., Chalupa P., Straková P., Hubálek Z., Rudolf I. (2015): Onemocnění člověka způsobená hantaviry stále opomíjené zoonózy? Epidemiologie, Mikrobiologie, Imunologie, 64 (4): (Příloha publikace I) 3. práce rukopis v přípravě, komentář k současnému stavu práce Spatial and temporal occurrence of Dobrava-Belgrade virus genotype Kurkino in Apodemus agrarius in Germany. Straková P. (prvoautor) a kol. 4. práce původní práce, publikováno v Zoonoses and Public Health (IF2015 2,574) Drewes S., Turni H., Rosenfeld M., Obiegala A., Straková P., Imholt C., Glatthaar E., Dressel K., Pfeffer M., Jacob J., Wagner-Wiening C., Ulrich R.G. (2016): Reservoir-driven heterogeneous distribution of recorded human Puumala virus cases in south-west Germany. Zoonoses and Public Health. Ahead of print. (Příloha publikace II) 5. práce research letter, publikováno v Emerging Infectious Diseases (IF2015 6,99) Straková P., Jagdmann S., Balčiauskas L, Balčiauskiené L, Drewes S, Ulrich R.G. (2017): Puumala virus in bank voles, Lithuania. Emerging Infectious Diseases. 23: (Příloha publikace III) 6. práce rukopis v přípravě, komentář k současnému stavu práce Novel hantavirus found in the population of the tundra voles (Microtus oeconomus) in Lithuania. Straková P. (prvoautor) a kol. 7. práce krátké sdělení, publikováno v Infection, Genetics and Evolution (IF2015 2,591) Straková P., Dufková L., Širmanová J., Salát J., Bartonička T., Klempa B., Pfaff F., Höper D., Hoffmann B., Ulrich R. G., Růžek D. (2017): Novel hantavirus 23
48 identified in European bat species Nyctalus noctula. Infection, Genetics and Evolution 48: (Příloha publikace IV) Posloupnost předložených prací byla navržena tak, že jsem se chtěla nejprve zmínit o výzkumu hantavirů v České republice se zaměřením na Tula virus, kterým jsme se zabývali nejen u nás (ve spolupráci s doc. Martou Heroldovou, ÚBO AV ČR Brno), ale i v Německu, kde se část vzorků z ČR vyšetřuje (práce 1 a 2). Dále byl mým tématem výskyt Dobrava- Belgrade viru u myšice temnopásé (práce 3) a Puumala viru (práce 4 a nekomentovaná práce Drewes a kol. 2017) v Německu, a vyšetřování vzorků plic hlodavců odchycených v Litvě (práce 5 a 6). Ve spolupráci Výzkumného ústavu veterinárního lékařství, v.v.i. (VÚVEL) v Brně a Friedrich-Loeffler-Institutu (FLI) v Německu jsme se zabývali hantaviry v netopýrech pocházejících z České republiky. Doufám, že čtenář promine rozsáhlost textu u prací 1, 3 a 6. Tyto práce byly podrobně rozpracovány z toho důvodu, že ještě nejsou opublikovány a zdálo se mi vhodné, aby byl čtenář dopodrobna seznámen s tím, jak výzkum probíhal. 24
49 Strany 25 až 47 nejsou součástí veřejné verze práce.
50
51 4. práce Drewes S., Turni H., Rosenfeld M., Obiegala A., Straková P., Imholt C., Glatthaar E., Dressel K., Pfeffer M., Jacob J., Wagner-Wiening C., Ulrich R.G. (2016): Reservoir-driven heterogeneous distribution of recorded human Puumala virus cases in south-west Germany. Zoonoses and Public Health. (Příloha publikace II) Úvod a cíl práce: Puumala virus, čeleď Bunyaviridae, je nejčastěji se vyskytujícím hantavirem v Evropě. Tento hantavirus je zodpovědný za největší počet lidských případů nejen v Německu, ale i v celé Evropě, i když se jedná o velmi heterogenní výskyt (Ulrich a kol. 2004, Linard a kol. 2007, Heyman a kol. 2011, Boone a kol. 2012, Ali a kol. 2014, Clement a kol. 2014, Castel a kol. 2015). Onemocnění, které způsobuje, se označuje jako nephropathia epidemica (NE) a jedná se o mírnější formu HFRS (Brummer-Korvemkontio a kol. 1980). Jeho rezervoárem je norník rudý (Myodes glareolus) (Obr. 18), který se vyskytuje skoro po celé Evropě. Občas můžeme hlavně v Německu a střední Evropě, pozorovat jejich přemnožení, které souvisí s nadprodukcí jejich důležité potravy bukvic (Fagus sylvatica) a žaludů (Quercus spp.) (Tersago a kol. 2009). První lidské případy PUUV byly v Německu popsány už v 80. letech (Pilaski a kol. 1991). Od roku 2001 spadají hantavirové infekce v Německu mezi hlášená onemocnění a do dneška jich bylo popsáno více než (Robert- Koch Institute, SurvStat). V Německu proběhlo několik velkých molekulárních a sérologických studií u pacientů a u norníků, které potvrdily velké sekvenční rozdíly mezi kmeny PUUV (Pilaski a kol. 1994, Heiske a kol. 1999, Essbauer a kol. 2006, Essbauer a kol. 2007, Schilling a kol. 2007, Hofmann a kol. 2008, Ettinger a kol. 2012, Faber a kol. 2013, Ali a kol. 2015, Drewes a kol. 2017) (Obr.19). Obr. 18: Norník rudý (Myodes glareolus). Zdroj: (se souhlasem autora). 49
52 Obr. 19.: Zeměpisná distribuce PUUV pozitivních a negativních norníků (nalevo) a příslušná evoluční linie norníků rudých (napravo). Obrázek převzatý z Drewes a kol. (2017) tato práce navazovala na tento komentovaný článek. Červeně tečkovaná linie ilustruje hypotetickou hranici rozšíření PUUV pozitivních norníků (všichni patřili do centrální linie PUUV, fylogenetický strom neuveden). Taktéž lze z obrázků vyčíst, že většina PUUV-pozitivních norníků patří to západní evoluční linie. Výskyt PUUV se ve spolkových zemích Německa značně liší (Tab. 5). Nejvíce lidských případů bylo popsáno ve spolkové zemi Bádensko-Württembersko (BW), které leží na jihozápadě Německa (Pilaski a kol. 1991, Zoller a kol. 1995, Boone a kol. 2012, Robert-Koch Institut, Survstat) (Obr. 19, 20). Razzauti a kol. (2013) a Weber de Melo a kol. (2015) potvrdili ve svých studií z Německa a Finska, že existuje jakási oscilace v prevalenci PUUV u norníků, ale i dlouhodobá přítomnost daných kmenů PUUV. 50
53 Obr. 20: Mapa BW s vyznačenými odchytovými lokalitami v roce 2012 a Napravo incidence lidských případů PUUV znázorněnou v mapě BW. Tab. 5: Incidence zaznamenaných lidských případů PUUV v osmi krajích BW (na obyvatel). Cílem této studie bylo otestovat hypotézu týkající se vztahu mezi populační hustotou norníků, počtem norníků sérologicky nebo molekulárně PUUV pozitivních, počtem pacientů infikovaných PUUV a nadprodukcí potravy norníků či rozlohou listnatých lesů v okresech s vysokým počtem lidských případů (H high, vysoký) a v okresech s nízkým nebo žádným výskytem PUUV pozitivních pacientů (L low, nízký) ve spolkové zemi Bádensko- Württembersko. 51
54 Materiál a metodika: Norníci byli odchyceni na 4 odchytových H lokalitách (H1 Stuttgart, H2 Tübingen, H3 Göppingen a H4 Heidenheim) a na 4 L lokalitách (L1 Schwäbisch Hall, L2 Emmendingen, L3 Freiburg a L4 Waldshut) (Obr. 20). Na každou lokalitu bylo použito 50 pastí. Odchytávalo se třikrát ročně (květen-červen, červenec-srpen a září-říjen). Byly vybrány lokality s charakterem listnatých lesů s převahou buků. Odchycení jedinci byli druhově určeni, zváženi a změřeni. Po usmrcení dislokací páteře byly kadavery ihned zamraženy. Norníci byli vypitváni dle protokolu vypracovaného v institutu. Pro sérologický screening jsme využili in-house metodu ELISA. Jako antigen sloužil rekombinantní N protein PUUV kmene Bavaria (Mertens a kol. 2011). Molekulárně jsme detekovali virovou RNA pomocí metody RT-PCR navržené dle S segmentu (primery 342F a 1102R) (Essbauer a kol. 2006). Pro srovnání prevalence mezi H a L lokalitami, obdobím odchytu a váhou jedinců byl použit Fisherův exaktní test. K určení faktorů, které mohou ovlivnit přenos PUUV na lidi, byly využity dva regresní modely (backward multiple linear regression models). První test se zaměřil na testování faktorů, které nejlépe korelují s lidskými případy PUUV v roce 2012, kdy se v BW vyskytla epidemie PUUV. Testovanými faktory bylo množství norníků, prevalence protilátek a virové RNA u testovaných norníků. Výsledky metody ELISA se upravily dle váhy jedince (< 16 g) tak, aby se vyloučili jedinci s mateřskými protilátkami (Kallio a kol. 2010). Druhý test se zaměřil na faktory prostředí v 8 sledovaných oblastech, které se mohou podílet na heterogenní distribuci lidských PUUV případů. Hodnoty zalesnění daných oblastí byly získány z dat federálního lesnického úřadu ( Výsledky a diskuze: Během roku 2012 bylo odchyceno 499 norníků rudých v rozsahu zvířat na odchytovou lokalitu. Úspěšnost odchytu byla přepočítána na 100 odchytových nocí (100 TN). Sérologické vyšetření pomocí metody ELISA odhalilo prevalenci protilátek (7-50%) proti PUUV v 7 z 8 okresů a molekulární metodou jsme potvrdili pozitivní zvířata rovněž v 7 z 8 odchytových oblastí (1,8-27,5%) (Tab. 6). V H oblastech se pohybovala sérologická a molekulární prevalence od 17,5 30%, zatímco v L oblastech se tato hodnota pohybovala od 7 50% v séroprevalenci a od 1,8 18,8% při detekci virové RNA. V oblasti L3 nebyl žádný norník pozitivní na PUUV. V roce 2012 byla prevalence PUUV pozitivních zvířat signifikantně vyšší v H oblastech než L oblastech a dospělí jedinci (váha vyšší než 19,5 g) byli častěji pozitivní než juvenilové. V roce 2013 bylo odchyceno 161 norníků rudých. V 7 oblastech bylo odchyceno méně zvířat než v roce 2012 (Tab. 6). Pouze v odchytové oblasti L1 52
55 byli odchycení pozitivní norníci. Ve všech ostatních odchytových oblastech byli chycení norníci negativní. Model lineární regrese odhalil shodu mezi prevalencí PUUV u norníků a počtem lidských PUUV případů. Ale nebyl rozhodující počet norníků na odchytovou oblast, ani přítomnost specifických protilátek. Dále se nepotvrdila hypotéza ohledně procenta zalesnění oblasti, nebo nadprodukce potravy norníků. V případě, kdy jsme ale spojili předchozí dva faktory, procento zalesnění a nadprodukce potravy, už se jednalo o pozitivní korelaci a vedlo to k zvýšení počtu lidských PUUV případů v oblastech s vysokým procentem zalesnění. Závěr: Ve shodě s předchozími studiemi jsme potvrdili výskyt PUUV pozitivních zvířat ve všech H-oblastech a ve 3 ze 4 L-oblastí (Bernshtein a kol. 1999, Olsson a kol. 2002, Augot a kol. 2008). Také jsme potvrdili, že starší jedinci jsou častěji pozitivní než juvenilové. Naše výsledky naznačují, že nerovnoměrnost ve výskytu lidských případů PUUV v těchto odchytových lokalitách může být vysvětlena rozdílnou prevalencí PUUV pozitivních norníků a odlišnými environmentálními faktory (zalesnění a nadbytek potravy). Dalším problémem je nízká informovanost lékařů ohledně této nemoci, řada případů zůstane tudíž nezachycených a k lékařům se dostanou pouze těžší případy (Dressel 2014). Přemnožení norníků způsobených nadbytkem jejich potravy je jedním z hlavních faktorů vysokého počtu lidských případů PUUV v Evropě (Tersago a kol. 2009, Clement a kol. 2010, Reil a kol. 2016). Tímto způsobem může být vysvětleno i velké množství norníků odchycených v roce Toto přemnožení totiž nastalo po nadprodukci žaludů a bukvic ve všech 8 lokalitách BW v roce Dalšími faktory mohly být např. klimatické faktory ovlivňující stabilitu viru mimo hostitele, anebo chování norníků a lidí v zasažených oblastech. Přikláníme se k názoru, že je nutné v takových oblastech zřídit dlouhodobé monitorovací studie. Data získaná z těchto studií o prevalenci PUUV pozitivních norníků a jejich množství mohou sloužit jako systém rychlého upozornění možného výskytu ohnisek PUUV. 53
56 Tab. 6: Tabulka znázorňující abundanci norníků a počet séropozitivních a molekulárně pozitivních zvířat v každé z 8 oblastí. 54
57 5. práce Straková P., Jagdmann S., Balčiauskas L, Balčiauskiené L, Drewes S, Ulrich R.G. (2017). Puumala virus in bank voles, Lithuania. Emerging Infectious Diseases. (Příloha publikace III) Úvod a cíl práce: Na rozdíl od řady publikací týkajících se výskytu Puumala viru (PUUV) v různých částech Evropy, málo se ví o situaci PUUV v Pobaltských státech a Polsku. Lundkvist a kol. (2002) sérologicky potvrdili výskyt hantavirů u lidí v Lotyšsku. Molekulární studie norníků rudých (Myodes glareolus) z Lotyšska potvrdila výskyt dvou PUUV linií ruské (Russian) a lotyšské (Latvian) (Razzauti a kol. 2012). V Estonsku byli molekulárně i sérologicky potvrzeni PUUV pozitivní norníci. I v Estonsku byla jako nejbližší PUUV linie určena ta ruská (Golovljova a kol. 2002). Následně byly popsány i první lidské případy (Golovljova a kol. 2007). Z Polska je známo několik studií o výskytu PUUV u lidí a norníků (Nowakowska a kol. 2009, Wojcik-Fatla a kol. 2013, Ali a kol. 2014, Michalski a kol. 2014, Sadkowska-Todys a kol. 2015, Rosenfeld a kol. 2017). Ali a kol. (2014) popsali na severu a severovýchodě Polska sekvenci nejblíže příbuznou sekvencím kmenů z Lotyšska (Latvian), zatímco Rosenfeld a kol. (2017) vyšetřovali norníky z jižního Polska a jejich výsledky byly nejvíce příbuzné PUUV ruským sekvencím identifikovaným v Lotyšsku. Jediné publikace ohledně hantavirů v Litvě popisují sérologické studie u lidí (Sandmann a kol. 2005, Dargevicius a kol. 2007). Cílem této práce bylo vyšetřit hlodavce odchycené v různých částech Litvy na přítomnost hantavirů. Materiál a metodika: V roce 2015 bylo odchyceno 134 norníků rudých (M. glareolus), 72 myšic temnopásých (A. agrarius), 59 myšic lesních (A. flavicollis), 23 hrabošů mokřadních (Microtus agrestis) a 48 hrabošů hospodárných (M. oeconomus) v 5 oblastech v Litvě (Juodkranté, Elektrénai, Lukštas lesy v okolí hnízdní kolonie kormoránů; Žalgiriai a Rusné lesy a zaplavené louky) (Obr. 21). 55
58 Obr. 21: Mapa Litvy s vyznačenými lokalitami odchytu. Tmavěji jsou zabarveny kraje, ve kterých byly sérologicky potvrzeny lidské případy hantavirových infekcí. Černý čtvereček znázorňuje lokalitu, ve kterých jsme nalezli pozitivní norníky. Černá kolečka znázorňují místa, ze kterých pochází již opublikované sekvence PUUV pozitivních norníků. Pro izolaci celkové RNA jsme využili vzorek plic (protokol s využitím Qiazolu, QIAGEN, Německo) a pro detekci virové RNA metodu RT-PCR pro S segment (primery 342F a 1102R) (Essbauer a kol. 2006). Abychom získali celou kódující oblast S segmentu, využili jsme tzv. procházení primerem (primer-walking) s využitím následujících primerů: PuNCRS (5 -TAG TAG TAG ACT CCT TGA A-3 ) and Pu255R (5 -TGG ACA CAG CAT CTG CCA -3 ); Pu40F (5 -CTG GAA TGA GTG ACT TAA C-3 ) and Pu393R (5 - TAT GGT AAT GTC CTT GAT GT-3 ); Pu1027F (5 - ATG GCA GAG TTA GGT GCA-3 ) and Pu1779R (5 - TCA GCA TGT TGA GGT AGT -3 ). Pro vytvoření fylogenetických stromů jsme použili programy BioEdit, Mega7 a Mr.Bayes
59 Z Litvy jsme obdrželi pouze plíce, takže jsme nemohli odchycená zvířata vyšetřit metodou ELISA na přítomnost specifických protilátek. Pro molekulárně pozitivní zvířata jsme ještě provedli PCR genu pro cytochrom b na určení evoluční linie norníků (CytB fw: 5 - TCA TCM GAT GAA AYT TYG G-3, CytB rev: 5 - ACT GGY TGD CCB CCR ATT CA-3 ) (Schlegel a kol. 2012b). Výsledky a diskuze: Specifický produkt jsme detekovali u 5 ze 45 (11,1%) norníků odchycených v lokalitě Lukštas (Obr. 21). Kompletní kódující segment jsme byli schopni získat u 3 z 5 pozitivních zvířat (LT15/164, LT15/174, LT/201). Dvě zbývající sekvence byly standardní velikosti pro RT-PCR S segment (LT15/165, LT15/166). Kompletní kódující sekvence pro S segment, které jsme získali z 3 norníků rudých z lokality Lukštas, sdílely 98,2 99,8% identitu (nt) a 99,8-100% identitu (aa) (Tab. XVIII v příloze). Dle fylogenetického stromu byla těmto třem kompletním sekvencím nejbližší sekvence z Lotyšska (Jelgava1) (Obr. 22). I pro částečné sekvence je z fylogenetického stromu jasně patrné shlukování se sekvencemi z Polska (Mikolajki) a Lotyšska (Jelgava1) (Obr. 23). Všechny tyto sekvence jsou jasně oddělené od dalších evropských PUUV linií. Pro určení možné spojitosti mezi PUUV linií a evoluční linií norníků jsme určili druh hostitele i molekulárně. Stejně jako Ali a kol. (2014) jsme prokázali karpatskou evoluční linii pro 4 norníky ale jeden norník patřil do východní evoluční linie. Závěr: V naší studii jsme detekovali PUUV u norníků z lokality Lukštas. Jedná se o oblast, ve které už přechozí autoři popsali séropozitivní pacienty (Sandmann a kol. 2005), a která leží na hranicích s Polskem. Tyto výsledky podporují hypotézu heterogenního výskytu PUUV v Evropě. To, že jsme v některých lokalitách PUUV nepotvrdili, neznamená, že se tam nevyskytuje. Jednalo se o první studii hlodavců v Litvě a pracovali jsme s malým počtem odchycených zvířat. Pro přesnější určení výskytu PUUV v Litvě a okolí je nutná dlouhodobější studie na větším počtu odchycených zvířat a z více lokalit. 57
60 Obr. 22: Fylogenetický strom založený na kompletních kódujících sekvencích pro S segment PUUV (1 302 nt), Maximum-Likelihood tree kombinovaný s Mr. Bayes výpočty. Obr. 23: Fylogenetický strom založený na částečných sekvencích pro S segment PUUV (465 nt), Maximum- Likelihood tree kombinovaný s Mr. Bayes výpočty. 58
61 Strany 59 až 69 nejsou součástí veřejné verze práce.
62
63 7. práce Novel hantavirus identified in European bat species Nyctalus noctula (2017): Straková P., Dufková L., Širmanová J., Salát J., Bartonička T., Klempa B., Pfaff F., Höper D., Hoffmann B., Ulrich R. G., Růžek D. Infection, Genetics and Evolution (Příloha publikace IV) Úvod a cíl práce: Netopýři a kaloni jsou rezervoárovými zvířaty mnoha zoonotických virů např. henipavirů (Hendra a Nipah viry), koronaviru SARS podobných virů, lyssavirů nebo Ebola viru (Leroy a kol. 2005, Calisher a kol. 2006, Epstein a kol. 2008, Warrell 2010, Drexler a kol. 2014). Mnoho netopýřích druhů žije v rozsáhlých a početných sociálních skupinách, což umožňuje rychlé šíření viru. Dalšími vlastnostmi, které jsou důležité pro udržení a přenos virů, jsou schopnost létat (u některých druhů i migrace na dlouhé vzdálenosti), dlouhá délka života nebo schopnost osídlit různé habitaty (včetně lidských obydlí) (Brook a Dobson 2015, Witkowski a kol. 2016). S rozmachem nových metod a postupů bylo jen otázkou času, kdy se hantaviry detekují i v nich. V současné době bylo popsáno několik geneticky odlišných netopýřích hantavirů. V Africe byly popsány tyto netopýří hantaviry Mouyassué virus (MOYV) z Pobřeží slonoviny (Sumibcay a kol. 2012, Gu a kol. 2014), Magboi virus (MGBV) v Sierra Leone (Weiss a kol. 2012) a Makokou virus (MAKV) v Gabonu (Witkowski a kol. 2016). V Asii byly popsány Xuan son virus (XSV) z Vietnamu (Arai a kol. 2013, Gu a kol. 2014), Huangpi virus (HUPV), Longquan virus (LQUV) a Laibin virus (LBV) z Číny (Guo a kol. 2013, Xu a kol. 2015). Všechny tyto hantaviry byly detekovány u hmyzožravých netopýrů. Dalším průlomem bylo objevení Quezon viru (QZNV) na Filipínách, který byl popsán u fruktivorního kaloně (Arai a kol. 2016) (Tab. 8). Další autoři popisují nález virové RNA blízké hantavirům u netopýrů z Afriky (Těšíková a kol. 2017), anebo séropozitivní netopýry v Brazílii, u nichž se ale zřejmě jedná o 'spill-over' infekci z místních hlodavců (de Araujo a kol. 2012). Cílem této práce bylo vyšetřit některé druhy netopýrů z České republiky na přítomnost hantavirů. 71
64 Tab. 8: Shrnutí všech dosud publikovaných netopýřích a kaloních hantavirů. Materiál a metodika: Mezi lety bylo shromážděno 53 netopýrů z jižní Moravy. Jednalo se o netopýry, kteří byli nalezeni mrtví. Jako první byly tyto kadavery vypitvány na VÚVELu v Brně a z plic, jater a ledvin (pokud byly dostupné) byla vyizolována RNA (QIAamp viral RNA Mini Kit, QIAGEN, Německo). Tyto orgány byly následně vyšetřeny metodou RT-PCR cílenou na L segment hantavirů (Klempa a kol. 2006). S úmyslem získat celý genom jsme zaslali pozitivní vzorky do Německa (FLI, Insel Riems). Na základě real-time RT-qPCR (qscript XLT 1-step RT-PCR Kit, Quanta/VWR) s primery navrženými dle našich pozitivních sekvencí (data neuvedena), byl vybrán jeden vzorek určený pro vyšetření metodou NGS (Ion Torrent, ThermoFischer). Výsledky a diskuze: Po skríningu našich netopýrů RT-PCR metodou jsme objevili 2 pozitivní netopýry netopýry pestré (Nyctalus noctula) pocházející z Brna (Obr. 33). Výsledné sekvence, získané překvapivě z ledvin a jater, byly dlouhé 369 nt, což bylo velmi málo na označení tohoto výsledku jako nalezení nového viru. Dle fylogenetického stromu (Obr. 34) je jasné, že se naše sekvence shlukují s dalšími netopýřími hantaviry, ale že jsou i mezi sebou velmi rozdílné. Tento virus jsme předběžně pojmenovali jako Brno virus (BRNV). 72
65 Obr. 33: Netopýr pestrý (Nyctalus noctula). Zdroj: (se souhlasem autora) Pro zisk většího množství informací jsme jeden vzorek vyšetřili metodou NGS. Po dvou kolech NGS jsme získali cca 500 sekvencí blízkých hantavirům. Ty byly poskládány do kontigů, které vyjadřovaly kompletní kódující oblasti S, M i L segmentu (1 272 nt/424 aa, 3411 nt/1 137 aa, nt/2 415 aa) (Tab. XX v příloze). Výsledná matice sekvenční podobnosti zjistila podobnost s ostatními netopýřími hantaviry v rozmezí od 54,7 78,3% (nt) a 44,5 81,7% (aa), zatímco s hantaviry popsanými u hlodavců a hmyzožravců byly podobnosti ještě nižší 50,1 64,8% (nt) a 38,9 64,1% (aa) (Tab. XX v příloze). Kde to bylo možné, tak jsme samozřejmě porovnávali kompletní kódující oblasti, ale bohužel u většiny netopýřích hantavirů je k dispozici pouze částečná sekvence, anebo chybí daný segment úplně. Nejbližším příbuzným našeho Brno viru je hantavirus Longquan z Číny (potvrzeno i ve fylogenetických stromech pro S a M segment) (Obr. 35 a 36), se kterým zřejmě sdílí společného předka, který je ale odlišný od ostatních netopýřích hantavirů. Pokus o izolaci Brno hantaviru na VERO buňkách nebo sajících myškách se nezdařil. V současné době vyšetřujeme další netopýry, odchycené v roce 2016, a v případě pozitivního nálezu se o izolaci viru opět pokusíme. Dále jsme obdobně vyšetřili netopýrů odchycených po celém Německu. S využitím real-time RT-qPCR jsme odhalili 3 pozitivní netopýry a opět to byli netopýři pestří (Bernd Hoffmann, osobní sdělení), což ukazuje na možné rozšíření Brno viru nebo příbuzného hantaviru i v sousedních státech. 73
66 Obr. 34: Fylogenetický strom založený na částečné sekvenci L segmentu. Pozice naší sekvence je znázorněna šipkou. 74
67 NC Hantaan virus NC DOBV NC Seoul virus EF Cao Bang virus EU Asama virus NC Sin Nombre virus NC Puumala virus NC Tula virus KU Quezon virus KM Laibin virus KT Nova virus NC Thotta.virus KX Brno virus JX Longquan virus 0.2 Obr. 35: Fylogenetický strom založený na částečné sekvenci S segmentu (1 000 nt), Neighbor-Joining phylogenetic tree, Jukes-Cantor model, bootstrap method EF Cao Bang virus 84 EU Asama EF virus Seewis virus 100 NC Hantaan virus NC Seoul virus 55 NC DOBV NC Sin Nombre virus 90 NC Puumala virus NC Tula virus 100 JX Uluguru virus NC KT Nova Thotta.virus JX Huangpi KX virus Brno virus JX Longquan virus KM Laibin virus KF Xuan son virus KU Quezon virus KM Altai virus 0.10 Obr. 36: Fylogenetický strom založený na částečné sekvenci M segmentu (3 100 nt), Neighbor-Joining phylogenetic tree, Jukes-Cantor model, bootstrap method
68 Na rozdíl od velmi úspěšné detekce hantavirů u hlodavců může být nízký záchyt hantavirů u netopýrů způsoben několika faktory. Výzkum na netopýrech je značně omezen, protože v některých státech patří netopýři mezi chráněné druhy. Ve státech, kde se vyskytují jiná zoonotická virová onemocnění, se netopýři testují pouze na tato agens a většinou se netestují na nic jiného. Genom netopýřích hantavirů se může velmi lišit od genomu hlodavčích hantavirů, takže některé metody, např. panhanta RT-PCR (Klempa a kol. 2006), nemusí netopýří hantavirus zachytit. Na druhou stranu dalšími problémy mohou být vysoká hostitelská specificita hantavirů u netopýrů, omezená náchylnost netopýrů k infekci hantaviry způsobená odpovídající imunitní reakcí, která virovou replikaci nebo virovou perzistenci omezí (Yanagihara a kol. 2015). Někteří autoři poukazují na to, že vzhledem k nízkému poměru počtu popsaných netopýřích hantavirů k počtu testovaných netopýřích druhů je v rozporu hypotéza dlouhotrvajícího vztahu mezi hantavirem a jeho rezervoárem, a přiklání se spíše u netopýrů ke 'spill-over' infekci anebo 'host-switching' události (Gu a kol. 2014). S popisem nových hantavirů u hmyzožravců a netopýrů se mění názory i na celkovou fylogenezi hantavirů. Dle Zhang (2014) se hantaviry dělí do 4 fyloskupin (Obr. 37). První skupina (I) obsahuje hantaviry nalezené u hmyzožravců (Soricidae - rejskovití). Druhá skupina (II) obsahuje nově popsané netopýří hantaviry a Nova virus nalezený u krtka obecného. Do třetí skupiny (III) jsou zařazeny hantaviry ze skupiny Soricomorpha a Murinae (jsou jasně zřetelné dvě hlavní větve). V poslední čtvrté skupině (IV), která taktéž obsahuje dvě monofyletické skupiny, jsou zařazeny hantaviry z hlodavců podčeledí Arvicolinae, Neotominae a Sigmodontinae. Obr. 37. Fylogenetický strom založený na S segmentu všech hantavirů zobrazující 4 fyloskupiny. Převzato z Zhang
69 Závěr: V této práci byl popsán první evropský netopýří hantavirus pojmenovaný Brno virus. Jedná se o důležitý objev, který poukázal na rozšíření netopýřích hantavirů i mimo Asii a Afriku. Netopýří hantaviry jsou i mezi sebou velmi odlišné, ale sdílí společného předka. Jejich nejbližšími příbuznými jsou zřejmě hantaviry nalezené u hmyzožravců. Výzkum by se měl zaměřit na ekologií hostitelů a dynamiku přenosu hantavirů v populaci netopýrů. Dalším krokem by měla být izolace netopýřích hantavirů a zkoumání jejich možné patogenity pro jiné obratlovce včetně člověka. Pro lepší pochopení fylogeneze netopýřích hantavirů bude nutné vyšetřit mnohem větší počet netopýřích druhů z různých částí světa. Nová data nám umožní pochopit členění hantavirů a nalézt jejich evolučního předka. 77
70
71 4.1.2 Autorčin podíl na daném výzkumu 1+2 práce část ČR: odchyty v lokalitách jižní Moravy a pitvy odchycených zvířat ve spolupráci s kolegy z ÚBO AV ČR ve Valticích (Hana Blažejová, Lenka Betášová, Kristýna Venclíková a Juraj Peško), odchyty z jiných lokalit provedla doc. Marta Heroldová z ÚBO AV ČR v Brně, izolace RNA a molekulární detekce RT-PCR samostatně, sekvenaci provedl Dr. Jan Mendel z ÚBO AV ČR v Brně, fylogenetické zpracování samostatně - část Německo: odchyty provedla doc. Marta Heroldová z ÚBO AV ČR v Brně (hraboši z ČR), ostatní hraboši (Německo, Francie) odchyceni partnery z FLI (Friedrich-Loeffler-Institut, Insel Riems), pitvy probíhaly rovněž na FLI ve spolupráci s celým týmem Dr. Rainera Ulricha (Stephan Drewes, Stefan Fisher, René Ryll, Dörte Kaufmann, Anke Mandelkow, Maysaa Dafalla, Dewi Murni, Kornelija Marcinkevičiuté, Christoph Gertler), sérologie, izolace RNA a molekulární detekce ve spolupráci se studenty bakalářského oboru, kterým jsem byla školitelkou (David Kohlhause a Chao Wen), fylogenetické zpracování samostatně 3. práce jelikož se jednalo o úkol dokončit již dlouhodobě probíhající studii, navázala jsem na výsledky svých kolegů (Jens Jacob, Sabrina Schmidt). Ti vyšetřili sérologicky i molekulárně zvířata odchycená v letech Já jsem sérologicky i molekulárně vyšetřila myšice od roku 2011 do roku Pro nová zvířata (2015 a 2016) jsem byla vedoucí pitev, která opět probíhala na FLI. Nezúčastnila jsem se žádných odchytů. Ty byly zprostředkované partnery FLI. Pro NGS studii jsem vzorek připravila ve spolupráci s kolegyní Anke Mandelkow. Analýzu a zpracování výsledků NGS provedl kolega Florian Pfaff z Oddělení virové diagnostiky na FLI. Fylogenetické zpracování všech výsledků už jsem provedla opět samostatně. 4. práce v tomto článku jsem uvedena jako spoluautor, protože jsem se zúčastnila pitev norníků (opět celý tým FLI) a pomohla jsem svému kolegovi Stephanu Drewesovi je molekulárně vyšetřit jak na přítomnost Puumala viru, tak na gen cytochromu b. 5. práce zvířata nám byla doručena z Litvy již vypitvaná - norníci (odchyty provedli Dr. Laima Balčiauskienė a Dr. Linas Balčiauskas). Izolaci RNA a částečnou molekulární detekci PUUV začala kolegyně Sandra Jagdmann, která výsledky částečně použila do své diplomové práce. Já jsem navázala na molekulární vyšetřování 79
72 a následně jsem ve spolupráci se Stephanem Drewes sestavovala komplení kódující oblasti. Fylogenetické zpracování jsem provedla samostatně. 6. práce zvířata nám byla doručena z Litvy již vypitvaná - hraboši (odchyty provedli Dr. Laima Balčiauskienė a Dr. Linas Balčiauskas). V této části jsem již provedla izolaci RNA a molekulární detekci samostatně. Pro NGS jsem vzorek opět pouze připravovala a analýzu NGS dat mi poskytl Florian Pfaff. V současné době navrhuji primery na primer-walking metodu a na dálku spolupracuji s Kathrin Jeske, novou PhD studentkou, která se tomuto tématu částečně věnuje. 7. práce odchycené netopýry a informace o nich nám poskytl Dr. Tomáš Bartonička. Pitva netopýrů probíhala na Výzkumném ústavu veterinárního lékařství (VÚVEL) a provedl ji Dr. Jiří Salát a Dr. Lucie Dufková. Já jsem izolovala RNA a provedla molekulární detekci hantavirové RNA. Sekvenace proběhla komerčně. Fylogenetické zpracování dat proběhlo ve spolupráci s VÚVELem a Dr. Borisem Klempou. Vzorek pro NGS v Německu jsem připravila samostatně a data z NGS mi opět poskytl Florian Pfaff. Následné fylogenetické zpracování jsem prováděla samostatně. 80
73 4.2 Flaviviry - virus západonilské horečky a virus Usutu Virus západonilské horečky (West Nile virus WNV) i virus Usutu (USUV) patří do čeledi Flaviviridae a jsou součástí sérokomplexu Japonské encefalitidy. Genom tvoří +ssrna o velikosti přibližně 11 kb kódující 10 genů u WNV (Chancey a kol. 2015) a 11 genů u USUV (Ashraf a kol. 2015) (Obr. 38). Oba tyto viry pocházejí z Afriky a rozšířily se na další kontinenty pomocí migrujících ptáků. Obr. 38.: Struktura virionu WNV určená kryoelektronovou mikroskopií. Převzato z Mukhopadhya a kol. (2003). Poprvé byl WNV popsán v roce 1937 v Ugandě jako příčina febrilního onemocnění člověka (Smithburn a kol. 1940). Během druhé poloviny 20. století se tento virus rozšířil do dalších zemí např. Izrael, Egypt, Indie a Jihoafrická republika (Bernkopf a kol. 1953, Hubálek a Halouzka 1999, Jupp 2001, Murgue a kol. 2001a, Bondre a kol. 2007) (Obr. 39). Největší emergence WNV byla pozorována na území Severní Ameriky, kde se WNV poprvé vyskytl v roce 1999 (pacienti s encefalitidou v New Yorku) a během následujících let se vlnovitě přenesl z východního na západní pobřeží. Kmen WNV, který byl zodpovědný za tuto emergenci byl označen jako WNV NY99 a byl příbuzný izraelskému kmenu WNV izolovanému během epidemie v roce 1998 (Jia a kol. 1999, Lanciotti a kol. 2002). Mezi lety byla aktivita WNV velmi vysoká s přibližně lidských případů za rok. V dalších letech ( ) došlo k poklesu jeho aktivity, než v roce 2012 vypukla další velká epidemie s více než lidských případů a největším počtem úmrtí. Během let bylo v USA nahlášeno skoro případů lidských infekcí WNV a úmrtí (Mostashari a kol. 2001, Ebel a kol. 2004, Davis a kol. 2005, Komar a kol. 2005, Moudy a kol. 2007, Snapinn a kol. 2007, CDC 2013). WNV je v Evropě známý už od roku 1958, kdy byl sérologicky detekován v Albánii (Hubálek a Halouzka 1999). Od té doby byl tento virus zjištěn v jižní, střední a východní 81
74 Evropě u komárů, ptáků, savců a i u lidských případů (Filipe 1972, Molnár a kol. 1976, Ernek a kol. 1977, Tsai a kol. 1998, Hubálek a kol. 1998, Hubálek a Halouzka 1999, Platonov a kol. 2001, Murgue a kol. 2001a, Murgue a kol. 2001b, Autorino a kol. 2002, Mailles a kol. 2003, Zeller a Schuffenecker 2004, Esteves a kol. 2005, Durand a kol. 2005, Couissinier-Paris 2006, Balanca a kol. 2009, Calistri a kol. 2010, Rizzo a kol. 2012, Jesús-de La Calle a kol. 2012, Barzon a kol. 2013, Napoli a kol. 2013, Merdic a kol. 2013, Popovic a kol. 2013, Bakonyi a kol. 2013). WNV je genomicky velmi rozmanitý virus a nejlépe jsou v současné době popsány jeho tři genomové linie WNV 1, 2 a 3. WNV linie 1 se vyskytuje v Africe, Evropě, Americe a Asii (WNV 1a) a také v Austrálii (WNV 1b Kunjin virus) (Petersen a Roehrig 2001). WNV linie 2 je endemický v subsaharské Africe a na Madagaskaru (McLean a kol. 2002), ale objevuje se už i v Evropě včetně Česka (Rudolf a kol. 2014), a způsobil epidemie např. v Itálii a Řecku (Barzon a kol. 2013, Barzon a kol. 2015), zatímco WNV linie 3 (Rabensburg) byl popsán v České republice a Rakousku (Bakonyi a kol. 2005). U WNV 1 a WNV 2 je prokázána patogenita pro lidi. První lidské případy západonilské horečky byly popsány v Česku na jižní Moravě po záplavách v roce 1997 (Hubálek a kol. 1999). Obr. 39: Zeměpisná mapa rozšíření WNV v 2. pol. 20. století. Převzato z MicrobiologyBytes 2011, staženo dne
75 USUV je považován za emergentní virus v Evropě. Poprvé byl izolován z komára Culex neavei v jižní Africe v roce 1959 (Woodall 1964) a v následujících letech se rozšířil do dalších afrických států např. Středoafrická republika, Senegal, Tunisko (Cornet a kol. 1979, Chevalier a kol. 2009, Nikolay a kol. 2011, Ben Hassine a kol. 2014, Adam a Digoutte databáze afrických virů). USUV byl v Evropě popsán až v roce 2001 v Rakousku v souvislosti s masovým úhynem kosů černých (Turdus merula) (Weissenböck a kol. 2002). Zajímavostí je, že retrospektivní studie provedená v Itálii na archivovaných tkáních uhynulých ptáků odhalila přítomnost USUV již v roce 1996 (Weissenböck a kol. 2013). Od té doby byl popsán v několika evropských zemích (hlavně Itálie, Španělsko, Švýcarsko, Německo, Rakousko i ČR) v komárech, u ptáků i u lidí (Weissenböck a kol. 2003, Chvala a kol. 2004, Buckley a kol. 2006, Chvala a kol. 2007, Bakonyi a kol. 2007, Hubálek a kol. 2008a, Hubálek a kol. 2008b, Vázquez a kol. 2011, Jöst a kol. 2011, Steinmetz a kol. 2011, Savini a kol. 2011, Calzolari a kol. 2012, Becker a kol. 2012, Höfle a kol. 2013, Buchebner a kol. 2013, Garigliany a kol. 2014, Hubálek a kol. 2014, Ziegler a kol. 2016, Moniuszko-Malinowska a kol. 2016, Rijsk a kol. 2016, Lecollinet a kol. 2016, Garigliany a kol. 2017, Cadar a kol. 2017). Kromě volně žijících ptáků byl USUV prokázán i u ptáků v zoologických zahradách (dravců, sov) a u netopýrů (Buchebner a kol. 2013, Cadar a kol. 2014). Jedná se o viry (WNV, USUV) s typickým enzootickým cyklem zajišťujícím cirkulaci mezi ptáky a ornitofilními komáry. Ptáci jsou považováni za hlavního hostitele, ale mezi další hostitele mohou patřit výjimečně savci, ale jen u některých se vyvine virémie dostatečně vysoká pro infekci sajících komárů. Komáři (rod Culex, méně často Aedes) jsou vektory WNV i USUV (Hubálek a Halouzka 1999, Turell a kol. 2005, CDC 2008) (Obr. 40). Komáři, kteří jsou schopni sát jak na ptácích, tak na savcích, jsou označováni jako bridge vektoři, protože slouží jako most mezi infikovaným rezervoárem (pták) a náhodným hostitelem. Zajímavostí je, že na rozdíl od flavivirů horečky dengue nebo žluté zimnice, WNV je přenášen řadou různých druhů komárů (Chancey a kol. 2015), což může zjednodušit jeho šíření do nových oblastí. Šíření jak WNV tak USUV do nových oblastí je uskutečněno pomocí komárů i díky migrujícím ptákům. 83
76 Obr. 40: Komár rodu Culex. Zdroj: Člověk je infikován při sání komára a většina případů je asymptomatických. Pouze zřídka (např. při velkých epidemiích, <1%) se při infekci WNV rozvine encefalitida nebo meningitida (Kramer a kol. 2007). Symptomatické infekce se nejčastěji manifestují jako chřipkovitá onemocnění. Neblahý vliv na rozvoj onemocnění má vysoký věk, snížená imunita nebo chronická onemocnění (Hayes a O Leary 2004, Lindsey a kol. 2009, Lindsey a kol. 2012). Až do roku 2004 patřily evropské izoláty, získané z pacientů, do WNV linie 1. Od té doby se již vyskytly i případy infekce WNV linie 2 (Řecko Papa a kol. 2011, Rumunsko Sirbu a kol. 2011, Itálie Monaco a kol. 2011, Maďarsko Bakonyi a kol. 2013, Španělsko Garcia-Bocanegra a kol. 2011, Hernández-Triana a kol. 2014). Lidské případy USUV byly popsány zatím jen ojediněle. Prvním popsaným případem byl muž s horečkou a vyrážkou ve Středoafrické republice v roce 1981 (Adam a Digoutte - databáze afrických virů). V roce 2009 se jednalo o dva případy z Itálie - žena trpící meningoencefalitidou (Pecorari a kol. 2009) a imunosuprimovaná žena po transplantaci jater (Cavrini a kol. 2009). V obou případech byl USUV potvrzen molekulárně. Sérologicky byly popsány případy v Německu (Allering a kol. 2012), Itálii (Gaibani a kol. 2012) a v Chorvatsku (Vilibic-Cavlek a kol. 2014). V Evropě v současné době probíhají hlavně monitorovací programy těchto flavivirů, v rámci kterých jsou komáři odchytáváni a vyšetřováni na přítomnost virové RNA nebo izolačně. Protože ptáci slouží jako hostitelé, hodně studií se zaměřuje i na jejich sérologické či molekulární testování. Výsledky pak upozorňují kliniky na možný výskyt lidských onemocnění v daných oblastech. 84
77 4.2.1 Soubor komentovaných prací týkajících se flavivirů 1. práce krátké sdělení, publikováno v Research in Veterinary Science (IF2015 1,504) Straková P., Šikutová S., Jedličková P., Sitko J., Rudolf I., Hubálek Z. (2015): The common coot as sentinel species for the presence of West Nile and Usutu flaviviruses in Central Europe. Res. Vet. Sci. 102: (Příloha publikace V) 2. práce rukopis zaslaný do Vector-Borne and Zoonotic Diseases (IF2015 1,956) Serologic survey for West Nile virus in wild artiodactyls in central Europe. Hubálek Z., Juřicová Z., Straková P., Blažejová H., Betášová L., Rudolf I. (Příloha publikace VI) 85
78
79 1. práce Straková P., Šikutová S., Jedličková P., Sitko J., Rudolf I., Hubálek Z. (2015): The common coot as sentinel species for the presence of West Nile and Usutu flaviviruses in Central Europe. Res. Vet. Sci. 102: (Příloha publikace V) Úvod a cíl práce: Usutu virus i virus západonilské horečky (West Nile virus WNV) patří do čeledi Flaviviridae a oba byly prokázány v České republice. Tyto flaviviry kolují v přírodě mezi ptáky a ornitofilními komáry a pro jejich emergenci hrají velkou roli migrující ptáci. Předchozí studie (Hubálek a kol. 2008a) zaměřená na flaviviry u volně žijících ptáků v České republice odhalila přítomnost protilátek proti WNV a USUV u lysek černých (Fulica atra) (Obr. 41). Obr. 41: Lyska černá (Fulica atra). Zdroj: My jsme se v této práci zaměřili za sérologické testování právě těchto lysek černých za účelem zjištění, zda tento druh migrujícího ptáka hraje nějakou roli v koloběhu těchto virů v přírodě. Materiál a metodika: Během září až října 2011 bylo zastřeleno rybáři u rybníků blízko vesnice Záhlinice 146 lysek černých. Byla jim odebrána krev a získané sérum bylo uloženo v 20 C. Před samotným testováním plak redukčním neutralizačním testem (PRNT) byla séra inaktivována 30 min / 56 C a naředěna v poměru 1:5 Leibowitz L-15 médiem. V počátečním skríningovém testování byl použit pouze WNV (kmen Eg-101). U následovného testování lysek, které byly pozitivní na WNV, jsme použili další dva flaviviry (virus klíšťové 87
80 encefalitidy kmen TBEV Hypr a virus Usutu kmen USUV 939), abychom mohli případně vyloučit zkříženou reakci. PRNT probíhal následně: napipetované naředěné sérum v mikrotitrační destičce bylo kultivováno s virem 60 min / 37 C; přidaly se Vero E6 buňky na 4 hod / 37 C; po inkubaci se destička přelila karboxymethylcelulózou a po 3-5 dnech při 37 C se buňky obarvily 0,1 % roztokem naftalenové černi. Pro vyhodnocení PRNT se použila hodnota 90% redukce PFU a jako pozitivní byly hodnoceny vzorky s titry >20. Výsledky a diskuze: Ze 146 vyšetřených lysek černých bylo po prvním testování PRNT90 s WNV odhaleno 18 pozitivních ptáků (12,3%). Tyto pozitivní vzorky byly následně vyšetřeny i s TBEV a USUV. Z 18 WNV pozitivních ptáků mělo 9 lysek specifickou reakci s USUV, 2 s WNV a 7 nemohlo být dle PRNT90 rozlišeno (Tab. 9). Tab. 9: Výsledky PRNT90 testu 18 pozitivních lysek černých. Specifické reakce pro daný virus jsou zvýrazněny tučně. Č. vzorku WNV TBEV USUV < < < < < < < < Výskyt WNV v České republice je znám již od roku 1985 a od té doby bylo napsáno několik článků pojednávajících o WNV u volně žijících ptáků i komárů (Juřicová a Halouzka 1993, Juřicová a kol. 1993, Hubálek a kol. 1998, Hubálek a kol. 2000, Bakonyi a kol. 2005, Hubálek a kol. 2008a, Rudolf a kol. 2014). Specifické protilátky proti WNV byly nalezeny u lysek i v jiných státech Španělsko (Figuerola a kol. 2007), Rusko (Lvov a kol. 2008), Irán (Fereidouni a kol. 2011), Indie (Mishra a kol. 2012). Usutu virus je v Evropě znám zatím pouze krátce a je často dáván do souvislosti s hromadnými úhyny volně žijících ptáků (např. 88
81 kosů černých) (Weissenböck a kol. 2002, Bakonyi a kol. 2007, Steinmetz a kol. 2011, Jost a kol. 2011, Becker a kol. 2012, Hubálek a kol. 2014). Jako důkaz možného usazení USUV v naší volné přírodě je izolace virové USUV RNA z komárů Culex modestus odchycených na jižní Moravě (Rudolf a kol. 2015). Tato sekvence se ideálně shlukovala s dalšími sekvencemi USUV z Itálie, Rakouska, Maďarska a Německa a tato větev byla jasně odlišena od kmenů pocházejících z Afriky (dana neuvedena). Závěr: Vyšetřili jsme 146 lysek černých a u 9 z nich (6,2 %) jsme odhalili specifické protilátky proti USUV a u 2 (1,4 %) specifické protilátky proti WNV. Jednalo se už o druhé testování lysek z této oblasti a to, že jsme potvrdili pozitivní případy, naznačuje, že se může jednat o sentinelový druh, který se účastní koloběhu USUV a WNV v přírodě. Nemůžeme samozřejmě potvrdit, zda se tyto lysky infikovaly u nás nebo v jiných zemích, protože se jedná o migrující druh (Cepák a kol. 2008). Pro další závěry by bylo vhodné pokračovat v sérologickém monitoringu tohoto druhu na komáry přenášené flaviviry. 89
82
83 2. práce Serologic survey for West Nile virus in wild artiodactyls in central Europe. Hubálek Z., Juřicová Z., Straková P., Blažejová H., Betášová L., Rudolf I. Vector-borne and Zoonotic Diseases v redakčním řízení (Příloha publikce VI) Úvod a cíl práce: Virus West Nile (WNV) je původcem zádonilské horečky, která ve většině případů probíhá asymptomaticky (80%), u symptomatických infekcí se objevuje horečka, třes, křeče, svalová bolest, vyrážka a lymfadenopatie, a v těch nejtěžších případech až encefalitida s trvalými neurologickými následky. Podobné symptomy můžeme nalézt i u dalších savců (hlavně koní) či některých druhů ptáků (Kramer a kol. 2007). WNV se přenáší sáním infikovaného komára (nejčastěji rod Culex). Při vyšetřování komárů na různé arboviry během let (Hubálek a kol. 2010) byl WNV-3 izolován taktéž z komára Aedes rossicus, který na rozdíl od ornitofilních komárů rodu Culex, preferuje sání na savcích (včetně člověka) (Becker a kol. 2010). Cílem této práce tedy bylo retrospektivně vyšetřit volně žijící lovné savce z jižní Moravy na přítomnost protilátek proti WNV. Pozitivní výsledky by pak mohly naznačovat alternativní koloběh WNV mezi komáry a lovnou zvěří na jižní Moravě. Materiál a metodika: Všechny oblasti lovu se nacházely na území Břeclavska. Jednalo se o oblast Soutok - rozsáhlá oblast lužních lesů a zaplavovaných luk na soutoku řek Dyje a Moravy s oborou, kde se vyskytuje divoká lovná zvěř (srnec obecný, jelen lesní, daněk evropský, prase divoké), oblast Pálava - chráněná krajinná oblast, ve které se taktéž nachází obora s lovnou zvěří (srnec obecný, jelen lesní, daněk evropský, prase divoké, muflon asijský). Dalšími oblastmi BV-other byly menší revíry různě po Břeclavsku. Všechny tyto oblasti také spadají do oblastí, kde se hojně vyskytují komáři (Šebesta a kol. 2010). Zvířata byla odstřelena během lovných sezón ( ) a krev jim byla odebrána přímo ze srdce nebo hrudní dutiny. Získané sérum bylo uchováno při -20 C. Všech sudokopytníků (105 srnců, 148 jelenů, 287 daňků, 71 muflonů a 412 divokých prasat) (Obr. 42) bylo vyšetřeno plak redukčním neutralizačním testem (PRNT). PRNT ve zkratce: v mikrotitrační destičce byla naředěná inaktivovaná séra (1:10) smíchána s virem (WNV Eg-101) a inkubována 60 min / 37 C, pak byly přidány Vero E6 buňky, po inkubaci 4 hod / 37 C následovalo převrstvení jamek karboxymethylcelulózou a po 4-5 dnech byly buňky obarveny naftalenovou černí. Pro vyhodnocení PRNT se použila hodnota 80% redukce 91
84 PFU a jako pozitivní byly hodnoceny vzorky s titry >20. Podobně jako u lysek byly pozitivní výsledky znovu testovány s viry TBEV a USUV na případné zkřížené reakce s těmito viry. Obr. 42: Jelen lesní (Cervus elaphus). Zdroj: Výsledky a diskuze: Specifické protilátky byly detekovány u 53 z vyšetřených sudokopytníků (5,2%). V Tab. XXI (v příloze) je jasně vidět, že u žádných pozitivních zvířat se neprojevila zkřížená reakce s jiným flavivirem. V Tab. 10 je uvedeno, kolik bylo pozitivních zvířat dle období odstřelu a v Tab. 11 je sumarizováno, kolik bylo pozitivních zvířat dle jednotlivých vyšetřovaných druhů. Tab. 10: WNV séropozitivita zvířat dle let odstřelu (upraveno). Roky: Celkově vyšetřeno No. (%) séropozitivních 5 (3.3%) 12 (10.3%) 18 (6.9%) 1 (0.4%) 17 (6.3%) 92
85 Tab. 11: Podíl pozitivních zvířat jednotlivých druhů (upraveno). Druhy: Srnec obecný Capreolus capreolus Jelen lesní Cervus elaphus Daněk evropský Dama dama Muflon asijský Ovis musimon Prase divoké Sus scrofa Celkově vyšetřeno No. (%) séropozitivních Rozsah reciprokých titrů 5 (4.8%) 6 (4.1%) 18 (6.3%) 7 (9.9%) 17 (4.1%) Průměrný titr, GMT V Evropě se tomuto tématu věnuje pouze několik publikací. Na Slovensku potvrdili specifické protilátky proti WNV u divoké zvěře Kozuch a kol. (1976). V České republice Juřicová (1992) a Juřicová a Hubálek (1999) vyšetřovali lovnou zvěř pomocí hemaglutinačněinhibičního testu, který je však méně specifický než PRNT z důvodu častých zkřížených reakcí, a Halouzka a kol. (2008), kteří se zabývali detekcí specifických PRNT protilátek proti WNV u divokých prasat. Kromě České a Slovenské republiky se studiem WNV u divoké zvěře zabývaly pouze týmy ve Španělsku (Boadella a kol. 2012, Gutiérrez-Guzmán a kol. 2012, Garcia-Bocanegra a kol. 2016) a Srbsku (Escribano-Romero a kol. 2015). Závěr : Vyšetřili jsme retrospektivně volně žijících sudokopytníků z Břeclavska na přítomnost specifických protilátek proti WNV. Protilátky jsme prokázali u 5,9% přežvýkavců a u 4,1% divokých prasat. Tyto výsledky naznačují, že WNV cirkuloval mezi lety ve variabilní frekvenci u volně žijící lovné zvěře a potvrdily jsme, že volně žijící zvěř může hrát roli v koloběhu WNV v naší přírodě. 93
86 94
87 4.2.3 Autorčin podíl na daném výzkumu 1. práce zúčastnila jsem se vyšetřování PRNT s prof. Zdeňkem Hubálkem, Mgr. Petrou Jedličkovou a Ladislavou Ševčíkovou 2. práce archivní kolekci založila RNDr. Zina Juřicová, CSc., já jsem připravila vzorky pro testování odebrání séra, příprava na inaktivaci, samotné vyšetřování PRNT proběhlo opět v týmu s prof. Zdeňkem Hubálkem, Ladislavou Ševčíkovou a Ing. Lenkou Betášovou 95
88
89 4.3 Virus hepatitidy E Původce hepatitidy E - virus hepatitidy E (VHE) byl poprvé popsán v roce 1983 (Khuroo 1980, Balayan a kol. 1983). Jeho genom je tvořen +ssrna o velikosti 7,2 kb (Chandra a kol. 2008). VHE tvoří samostatný rod Orthohepevirus v čeledi Hepeviridae (ICTV 2017). V současné době dochází k popisu nových hepatitis E-like virů, které zapříčinily návrh nové taxonomie (Johne a kol. 2014). HEV se dělí do 4 genotypů, z nichž genotypy 1 a 2 se označují jako antroponotické a genotypy 3 a 4 jako zoonotické (Obr. 43). Obr. 43: Zeměpiské rozšíření hepevirů. A antroponotické genotypy 1+2, B zoonotické genotypy 3+4, C hepatitis-e podobné viry detekované u králíků, slepic, netopýrů, krys, fretek, norků a lišek. Převzato z Johne a kol
90 Antroponotické genotypy se vyskytují hlavně v Africe a Asii (Obr. 43) a souvisejí s nedostatečnou hygienou. Jsou přenášeny fekálně-orální cestou kontaminovanou vodou a mohou způsobovat velké epidemie (např. uprchlické tábory, přírodní katastrofy) (Hazam a kol. 2010). Vyskytují se v tzv. hyperendemických zónách (jižní Asie Indie, Bangladéš, Pakistán; jihovýchodní Asie Kambodža, Indonésie, Vietnam; severní Afrika Maroko, Tunisko, Súdán; východní Afrika Keňa, Uganda; západní Afrika Libérie, Nigérie, Mali a např. Mexiko v Severní Americe), kde jsou epidemie způsobené především genotypem 1, v Mexiku i genotypem 2 (Khuroo 2011). Mezi endemické oblasti patří např. Blízký východ a Jižní Amerika, kde se ale velké epidemie nevyskytují (Ghabrah a kol. 1995, Khuroo a kol. 2016a). Zajímavou oblastí je Egypt, kde se onemocnění, způsobené genotypem 1 se subtypy odlišnými od asijských typů, vyskytuje hlavně u mladých lidí a těhotných žen (Darwish a kol. 1996, Amer a kol. 1996, Navaneethan a kol. 2008). Objev zoonotických genotypů VHE souvisel i s nárůstem výskytu onemocnění v rozvinutých zemích (Obr. 43), které nebyly importovaného, ale autochtonního původu (Mansuy a kol. 2004, Dalton a kol. 2007). Tyto infekce jsou způsobeny genotypy 3 a 4, jsou většinou asymptomatické a vyskytují se především u starších lidí. Zajímavostí je, že nezpůsobují velké epidemie a vážná onemocnění u těhotných žen (Scobie a Dalton 2013, Khuroo a kol. 2016a, Khuroo a kol. 2016b). Genotypy 3 a 4 byly popsány u různých zvířat po celém světě (Tab. 1 v Johne a kol. 2014) a z hlediska rizika přenosu VHE na lidi byl nejvýznamnější jejich potvrzený nález u prasat (Meng a kol. 1997) (Obr. 44). K přenosu zoonotických VHE dochází nejčastěji pozřením nedostatečně tepelně upraveného vepřového masa, vepřových jater nebo výrobků z nich, anebo kontaminovanou zvěřinou a mořskými plody (Tei a kol. 2003, Yazaki a kol. 2003, Matsuda a kol. 2003, Tamada a kol. 2004, Masuda a kol. 2005, Li a kol. 2005, Li a kol. 2007, Colson a kol. 2010, Di Bartolo a kol. 2012, Crossan a kol. 2012, Berto a kol. 2013, Said a kol. 2014, Grodzki a kol. 2014, Gao a kol Di Bartolo a kol. 2015, Riveiro-Barciela a kol. 2015, Guillois a kol. 2016, Mesquita a kol. 2016). 98
91 Obr. 44: Různé způsoby přenosu zoonotických genotypů VHE (převzato a upraveno z Pavio a kol. 2015). Průběh onemocnění velmi připomíná průběh hepatitidy A, ale inkubační doba VHE je delší, cca 6 týdnů, nejčastěji se nakazí spíše dospělí lidé (u genotypů 3 a 4) než děti (u genotypů 1 a 2) (Collier a kol. 2011, Khuroo a kol. 2016a). Mezilidský přenos je diskutován (Teshale a kol. 2010, Aggarwal a Naik 2009, Collier a kol. 2011, Khuroo a kol. 2016a) a byly popsány případy přenosu VHE krevní transfúzí (Khuroo a kol. 2004, Matsubayashi a kol. 2004, Yamamoto a kol. 2004, Matsubayashi a kol. 2008). Z toho důvodu se v některých státech rozhodli provádět screening dárců krve na VHE (Fukuda a kol. 2004, Fukuda a kol. 2007, Vollmer a kol. 2012, Juhl a kol. 2014, Holm a kol. 2015). Dalším způsobem přenosu je vertikální přenos z matky na dítě (Khuroo a kol. 1995, Kumar a kol. 2001, Singh a kol. 2003, Khuroo a kol. 2009, Khuroo a kol. 2016b). S objevem zoonotických genotypů a vývojem rychlých sérologických a molekulárních metod došlo k obrovskému nárůstu literatury na toto téma. Nejčastěji se publikují nově popsané hepatitis E-like viry u různých druhů zvířat (krysy, králíci, netopýři) s cílem osekvenovat celý genom. Tyto informace pak slouží k vývoji lepších metod, k potvrzení/vyvrácení zoonotického potenciálu, míře patogenity, evoluci apod. Nejdůležitější je stanovit tyto informace u těch druhů zvířat, které slouží jako potrava pro lidi. V České republice došlo k nárůstu počtu klinických případů hepatitidy E v období 2005 až 2016 z 35 na přibližně 350 (EPIDAT 2017). Tento nárůst je způsoben nejen rozvojem lepších diagnostických metod, ale 99
92 také zvýšenou pozorností kliniků, kteří jsou dnes schopni toto onemocnění lépe diagnostikovat. 100
93 4.3.1 Komentovaná práce týkající se viru hepatitidy E 1. práce rukopis v přípravě, komentář k současnému stavu práce Retrospective serosurvey of wild boars for hepatitis E virus-specific antibodies from South Moravia, Czech Republic. Straková P. (prvoautor) a kol. 101
94
95 Strany 103 až 107 nejsou součástí veřejné verze práce.
96
97 4.3.2 Autorčin podíl na daném výzkumu 1. práce archivní kolekci založila RNDr. Zina Juřicová, CSc., příprava sér i zpracování metody ELISA včetně hodnocení výsledků jsem provedla samostatně 109
98
99 5 Závěr Potvrdili jsme výskyt Tula viru u hrabošů v České republice. Všechny další druhy hlodavců myšice a norníci - byly při molekulárním testování RT-PCR na přítomnost hantavirů negativní. Náš pozitivní vzorek hraboše mokřadního pochází z Beskyd. Další pozitivní hraboše na této lokalitě jsme v následujících letech neprokázali. Velmi cenným výsledkem bylo popsání nového hantaviru u netopýrů z Brna. Jedná se o první takovýto výsledek v Evropě. V Německu jsme jasně prokázali výskyt Dobrava-Belgrade viru u myšice temnopásé a potvrdili hypotézu ohledně zeměpisného rozšíření tohoto viru. Důležitým bodem byla konstrukce fylogenetického stromu, kde se sekvence kmenů získaných z myšic shlukovaly se sekvencemi kmenů získaných z pacientů. Jako první jsme provedli molekulární testování litevských hlodavců na hantaviry. Prokázali jsme cirkulaci Puumala viru v populaci norníků rudých, a navíc jsme u populace hraboše hospodárného objevili zřejmě nový hantavirus. Dle předchozích výsledků ze screeningu vodního ptactva byly u lysek černých objeveny protilátky proti viru západonilské horečky a také vysoký titr protilátek proti viru Usutu. My jsme se zaměřili pouze na tento ptačí druh a znovu jsme u nich protilátky k viru Usutu detekovali. Je tedy možné, že tento druh vodního ptáka hraje významnou roli v cirkulaci flavivirů ve volné přírodě. V další části jsme se zaměřili na detekci protilátek proti viru západonilské horečky u volně žijících sudokopytníků. I zde jsme u malého procenta zvířat tyto specifické protilátky nalezli. V současné době dochází k nárůstu klinicky potvrzených případů hepatitidy E u obyvatel České republiky. Z důvodu jasně doloženého vztahu mezi pozřením kontaminovaného masa a infekcí hepatitidou E se v České republice testují chovy domácích prasat, divoká prasata i další lovná zvěř. Retrospektivně jsme vyšetřili archivovaná séra divokých prasat na přítomnost specifických protilátek proti viru hepatitidy E. Nejstarší pozitivní sérum získané z prasete divokého bylo z roku Během let jsme detekovali několik pozitivních prasat a retrospektivně tak prokázali koloběh tohoto viru u divokých prasat ve volné přírodě na jižní Moravě. 111
100 Naše výsledky potvrdily výskyt zoonotických virů u volně žijících endotermních obratlovců na území České republiky i v dalších evropských státech. Onemocnění přenášená hlodavci (HRFS, NE), anebo další onemocnění, u kterých hrají hlodavci důležitou ekologickou roli (lymská borrelióza, klíšťová encefalitida), nabývají v posledních letech značně na významu. Virus západonilské horečky se v Evropě šíří do nových oblastí, ve kterých zatím lidské případy nebyly detekovány. Zdá se, že se virus Usutu po úspěšné introdukci pomocí migrujícího ptactva etabloval v oblasti střední Evropy a je hrozbou pro ptačí populace. V posledních 10 letech se výzkumu viru hepatitidy E věnuje velká pozornost. Jedná o virus přenášený kontaminovanou vodou a potravou, a tudíž může být výskyt VHE ovlivněn mj. změnami klimatu. Všechny tyto zoonotické viry jsou RNA viry, pro které je obecně charakteristická vysoká mutační rychlost. Pro dlouhodobé sledování je vhodné založit monitorovací ( surveillance ) programy, které se budou zabývat nejen výskytem jejich rezervoárových zvířat nebo hostitelů, ale i vektorů a séroprevalencí u lidí. Ani pro jedno studované agens neexistuje účinná léčba nebo vakcína. I přes většinou asymptomatický průběh těchto infekcí představují tyto viry hrozbu pro lidské zdraví. Z toho důvodu se klade velký důraz na preventivní opatření. V případě hantavirových infekcí se doporučuje zamezit kontaktu s volně žijícícmi hlodavci, u flavivirů použití komářích repelentů a u viru hepatitidy E je v našich podmínkách nutné dodržovat hygienické postupy (např. při domácích zabíjačkách) a správně tepelně zpracovat masné výrobky pocházející z prasat a zvěřiny. 112
101 6 Literatura Adam F., Digoutte J.P. Centre Collaborateur OMS de Référence et de Recherche Pour les Arbovirus et les Virus de Fièvreshémorrhagiques (CRORA) Institut Pasteur de Dakar; Dakar, Senegal. Virus d Afrique. In: Ashraf a kol. (2015): Usutu virus: an emerging flavivirus in Europe. Viruses. 7: Adlhoch C., Avellon A., Baylis S.A., Ciccaglione A.R., Couturier E., de Sousa R., Epstein J., Ethelberg S., Faber M., Feher A., Ijaz S., Lange H., Mandakova Z., Mellou K., Mozalevskis A., Rimhanen-Finne R., Rizzi V., Said B., Sundqvist L., Thornton L., Tosti M.E., van Pelt W., Aspinall E., Domanovic D., Severi E., Takkinen J., Dalton H.R. (2016): Hepatitis E virus: assessment of the epidemiological situation in humans in Europe, 2014/2015. J. Clin. Virol. 82: Aggarwal R., Naik S. (2009): Epidemiology of hepatitis E: current status. J. Gastroenterol. Hepatol. 24: Alexander D.J. (2007): An overview of the epidemiology of avian influenza. Vaccine. 25: Ali H.S., Drewes S., Sadowska E.T., Mikowska M., Groschup M.H., Heckel G., Koteja P., Ulrich R.G. (2014): First molecular evidence for Puumala hantavirus in Poland. Viruses. 6: Ali H.S., Drewes S., Weber de Mělo V., Scholegel M., Freise J., Groschup M.H., Heckel G., Ulrich R.G. (2015): Complete genome of a Puumala virus strain from Central Europe. Virus Genes. 50: Allering L., Jost H., Emmerich P., Gunther S., Lattwein E., Schmidt M., Seifried E., Sambri V., Hourfar K., Schmidt-Chanasit J. (2012): Detection of Usutu virus infection in a healthy blood donor from south-west Germany, Euro Surveill. 17: pii= Altizer S., Bartel R., Han B.A. (2011): Animal migration and infectious disease risk. Science. 331: Amer A.F., Zaki S.A., Nagati A.M., Darwish M.A. (1996): Hepatitis E antibodies in Egyptian adolescent females: their prevalence and possible relevance. J. Egypt. Public Health Assoc. 71: Anheyer-Behmenburg H.E., Szabo K., Schotte U., Binder A., Klein G., Johne R. (2017): Hepatitis E virus in wild boars and spillover infection in red and roe deer, Germany, Emerg. Infect. Dis. 23: Arai S., Ohdachi S.D., Asakawa M., Kang H.J., Mocz G., Arikawa J., Okabe N., Yanagihara R. (2008): Molecular phylogeny of a newfound hantavirus in the Japanese shrew mole (Urotrichus talpoides). Proc. Natl. Acad. Sci. U. S. A. 105: Arai S., Nguyen S.T., Boldgiv B., Fukui D., Araki K., Dang C.N., Ohdachi S.D., Nguyen N.X., Pham T.D., Boldbaatar B., Satoh H., Yoskihawa Y., Morikawa S., Tanaka-Taya K., Yanagihara R., Oishi K. (2013): Novel bat-borne hantavirus, Vietnam. Emerg. Infect. Dis. 19: Arai S., Taniquichi S., Aoki K., Yoshikawa Y., Kyuwa S., Tanaka-Taya K., Masangkay J.S., Omatsu T., Puentespina R., Watanabe S., Alviola P., Alvarez J., Eres E., Cosico E., Quibod M.N., Morikawa S., Yanagihara R., Oishi K. (2016): Molecular phylogeny of a genetically divergent hantavirus harbored by the Geoffroy s rousette (Rousettus amplexicaudatus), a frugivorous bat species in the Philippines. Infect. Genet. Evol. 45: Ashraf U., Ye J., Ruan X., Wan S., Zhu B., Cao S. (2015): Usutu virus: an emerging flavivirus in Europe. Viruses. 7: Asikainen K., Hanninen T., Henttonen H., Niemimaa J., Laakkonen J., Andersen H.K., Bille N., Leirs H., Vaheri A., Plyusnin A. (2000): Molecular evolution of Puumala hantavirus in Fennoscandia: phylogenetic analysis of strains from two recolonization routes, Karelia and Denmark. J. Gen. Virol. 81: Atlas R.M. (2012): One health: its origins and future. Curr. Top. Microbiol. Immunol. 365: Augot D., Sauvage F., Boue F., Artois M., Demerson J.M., Combers B., Coudrier D., Zeller H., Cliquet F., Pontier D. (2008): Spatial and temporal patterning of bank vole demography and the epidemiology of the Puumala hantavirus in northeastern France. Epidemiol. Infect. 136: Autorino G.L., Battisti A., Deubel V., Ferrari G., Forletta R., Giovannini A., Lelli R., Murri S., Scicluna M.T. (2002): West Nile virus epidemic in horses, Tuscany region, Italy. Emerg. Infect. Dis. 8:
102 Avsic-Zupanc T., Xiao S.Y., Stojanovic R., Gligic A., van der Groen G., LeDuc J.W. (1992): Characterization of Dobrava virus: a hantavirus from Slovenia, Yugoslavia. J. Med. Vir. 38: Avsic-Zupanc T., Nemirov K., Petrovec M., Trilar T., Poljak M., Vaheri A., Plyusnin A. (2000): Genetic analysis of wild-type Dobrava hantavirus in Slovenia: co-existence of two distinct genetic lineages within the same natural focus. J. Gen. Virol. 81: Avsic-Zupanc T., Korva M., Markotic A. (2014): HFRS and hantaviruses in the Balkans/South-East Europe. Virus. Res. 187: Bakonyi T., Hubálek Z., Rudolf I., Nowotny N. (2005): Novel flavivirus or novel lineage of West Nile virus, central Europe. Emerg. Infect. Dis. 11: Bakonyi T., Erdélyi K., Ursu K., Ferenczi E., Csörgo T., Lussy H., Chvala S., Bukovsky C., Meister T., Weissenböck H. (2007): Emergence of Usutu virus in Hungary. J. Clin. Microbiol. 45: Bakonyi T., Ferenczi E., Erdelyi K., Kutasi O., Csörgö T., Seidel B., Weissenböck H., Brugger K., Bán E., Nowotny N. (2013): Explosive spread of a neuroinvasive lineage 2 West Nile virus in Central Europe, 2008/2009. Vet. Microbiol. 165: Balanca G., Gaidet N., Savini G., Vollot B., Foucart A., Reiter P., Boutonnier A., Lelli R., Monicat F. (2009): Low West Nile virus circulation in wild birds in an area of recurring outbreaks in Southern France. Vector Borne Zoonotic Dis. 9: Balayan M.S., Andjaparidze A.G., Savinskaya S.S., Ketiladze E.S., Braginsky D.M., Savinov A.P., Poleschuk V.F. (1983): Evidence for a virus in non-a, non-b hepatitis transmitted via the fecal-oral route. Intervirology. 20: Balboni A.F., Battilani M., Prosperi S. (2012): The SARS-like coronaviruses: the role of bats and evolutionary relationships with SARS coronavirus. New Microbiol. 35: Barzon L., Pacenti M., Franchin E., Lavezzo E., Masi G., Squarzon L., Pagni S., Toppo S., Russo F., Cattai M., Cusinato R., Palu G. (2013): Whole genome sequencing and phylogenetic analysis of West Nile virus lineage 1 and lineage 2 from human cases of infection, Italy, August Euro Surveill. 19: pii= Barzon L., Papa A., Lavezzo E., Franchin E., Pacenti M., Sinigaglia A., Masi G., Trevisan M., Squarzon L., Toppo S., Papadopoulou E., Nowotny N., Ulbert S., Piralla A., Rovida F., Baldanti F., Percivalle E., Palu G. (2015): Phylogenetic characterization of Central/Southern European lineage 2 West Nile virus: analysis of human outbreaks in Italy and Greece, Clin. Microbiol. Infect. 21: 1122.e e10. Becker N., Petric D., Zgomba M., Boase C., Minoo M., Dahl C., Kaiser A. (2010): Mosquitoes and their control. Springer, Germany, 577 s. Becker N., Jöst H., Ziegler U., Eiden M., Höper D., Emmerich P., Fichet-Calvet E., Ehichioya D.U., Czajka C., Gabriel M. (2012): Epizootic emergence of Usutu virus in wild and captive birds in Germany. PLoS One. 7: e Ben Hassine T., de Massis F., Calistri P., Savini G., BelHaj Mohamed B., Ranen A., di Gennaro A., Sghaier S., Hammami S. (2014): First detection of co-circulation of West Nile and Usutu viruses in equids in the south-west of Tunisia. Transbound. Emerg. Dis. 61: Bengis R.G., Leighton L.A., Fischer J.R., Artois M., Mörner T., Tate C.M. (2004): The role of wildlife in emerging and re-emerging zoonoses. Rev. Sci. Tech. 23: Bernkopf H., Levine S., Nerson R. (1953): Isolation of West Nile virus in Israel. J. Infect. Dis. 93: Bernshtein A.D., Apekina N.S., Mikhailova T.V., Myasnikov Y.A., Khlyap L.A., Korotkov Y.S., Gavrilovskaya I.N. (1999): Dynamics of Puumala hantavirus infection in naturally infected bank voles (Clethrinomys glareolus). Arch. Virol. 144: Berthold P. (2001): Bird migration: a general survey. Oxford University Press, USA, 253 s. Berto A., Grierson S., Hakze-van der Honing R., Martelli F., Johne R., Reetz J., Ulrich R.G., Pavio N., Van der Poel W.H., Banks M. (2013): Hepatitis E virus in pork liver sausage, France. Emerg. Infect. Dis. 19: Bidaisee S., Macpherson C.C., Macpherson C.N.L. (2014): Human behavior and the epidemiology of viral zoonoses. In: Viral infections and global change, edited by Singh S.K., 2014, Wiley-Blackwell, 660 s. 114
103 Bidaisee S., Macpherson C.N.L. (2014): Zoonoses and one health: a review of the literature. J. Parasitol. Res. Article ID: Boadella M., Diez-Delgado I., Gutierrez-Guzman A.V., Hofle U., Gortazar C. (2012): Do wild ungulates allow improved monitoring of flavivirus circulation in Spain? Vector Borne Zoonotic Dis. 12: Bondre V.P., Jadi R.S., Mishra A.C., Yergolkar P.N., Arankalle V.A. (2007): West Nile virus isolates from India: evidence for a distinct genetic lineage. J. Gen. Virol. 88: Boone I., Wagner-Wiening C., Reil D., Jacob J., Rosenfeld U.M., Ulrich R.G., Lohr D., Pfaff G. (2012): Rise in the number of notified human hantavirus infections since October 2011 in Baden-Wurttemberg, Germany. Euro Surveill. 17: pii= Bowen M.D., Gelbmann W., Ksiazek T.G., Nichol S.T., Nowotny N. (1997): Puumala virus and two genetic variants of Tula virus are present in Austrian rodents. J. Med. Vir. 53: Breed A.C., Field H.E., Epsterin J.H., Daszak P. (2006): Emerging henipaviruses and flying foxes conservation and management perspectives. Biol. Conserv. 131: Breed A.C., Field H.E., Smith C.S., Edmonston J., Meers J. (2010): Bats without borders: long-distance movements and implications for disease risk management. EcoHealth. 7: Brook C.E., Dobson A.P. (2015): Bats as special reservoirs for emerging zoonotic pathogens. Trends Microbiol. 23: Brummer-Korvenkontio M., Vaheri A., Hovi T., Vonbonsdorff C.H., Vuorimies J., Manni T., Penttinen K., Okerblom N., Lahdevirta J. (1980): Nephropathia epidemica: Detection of antigen in bank voles and serologic diagnosis of human infection. J. Infect. Dis. 141: Buchebner N., Zenker W., Wenker C., Steinmetz H.W., Sós E., Lussy H., Nowotny N. (2013): Low Usutu virus seroprevalence in four zoological gardens in central Europe. BMC Vet. Res. 9: e153. Buckley A., Dawson A., Gould E.A. (2006): Detection of seroconversion to West Nile virus, Usutu virus and Sindbis virus in UK sentinel chickens. Virol. J. 3: e71. Cadar D., Becker N., Campos R.M., Börstler J., Jöst H., Schmidt-Chanasit J. (2014): Usutu virus in bats, Germany, Emerg. Infect. Dis. 20: Cadar D., Luhken R., van der Jeugd H., Garigliany M., Ziegler U., Keller M., Lahoreau J., Lachmann L., Becker N., Kik M., Oude Munnink B.B., Bosch S., Tannich E., Linden A., Schmidt V., Koopmans M.P., Rijks J., Desmecht D., Groschup M.H., Reusken C., Schmidt-Chanasit J. (2017): Widespread activity of multiple lineages of Usutu virus, western Europe, Euro Surveill. 22: pii= Calisher C.H., Childs J.E., Field H.E., Holmes K.V., Schountz T. (2006): Bats: important reservoir hosts of emerging viruses. Clin. Microbiol. Rev. 19: Calistri P., Giovannini A., Savini G., Monaco F., Bonfanti L., Ceolin C., Terregino C., Tamba M., Cordioli P., Lelli R. (2010): West Nile virus transmission in 2008 in north-eastern Italy. Zoonoses Public Health. 57: Calzolari M., Gaibani P., Bellini R., Defilippo F., Pierro A., Albieri A., Mailoli G., Luppi A., Rossini G., Balzani A. (2012): Mosquito, bird, and human surveillance of West Nile and Usutu viruses in Emilia-Romagna region (Italy) in PLoS One. 7: e Carey D.E., Reuben R., Panicker K.N., Shope R.E., Myers R.M. (1971): Thottapalayam virus: a presumptive arbovirus isolated from a shrew in India. Indian J. Med. Res. 59: Castel G., Couteaudier M., Sauvage F., Pons J.B., Murri S., Plyusnina A., Pontier D., Cosson J.F., Plyusnin A., Marianneau P., Tordo N. (2015): Complete genome and phylogeny of Puumala hantavirus isolates circulating in France. Viruses. 7: Cavrini F., Gaibani P., Longo G., Pierro A.M., Rossini G.m Bonilauri P., Gerunda G.E., Di Benedetto F., Pasetto A., Girardis M., Dottori M., Landini M.P., Sambri V. (2009): Usutu virus infection in a patient who underwent orthotropic liver transplantation, Italy, August-September Euro Surveill. 14: pii= CDC (2008): West Nile virus activity United States, Dostupné na:
104 CDC (2013): West Nile virus in the United States: Guidelines for surveillance, prevention and control. Dostupné na: CDC (2016): Information sheet Zoonotic diseases. Dostupné na: Cepák J., Klvaňa P., Škopek J., Schropfer L, Jelínek M., Hořák D., Formánek J., Zárybnický J. (2008): Czech and Slovak bird migration atlas. Aventium, Praha, Czech Republic, 608 s. Chalupa P., Vašíčková P., Pavlík I., Holub M. (2014): Endemic hepatitis E in the Czech Republic. Clin. Infect. Dis. 58: Chancey C., Grinev A., Volkova E., Rios M. (2015): The global ecology and epidemiology of West Nile virus. Biomed. Res. Int. Vol Article ID Chandra V., Taneja S., Kalia M., Jameel S. (2008): Molecular biology and pathogenesis of hepatitis E virus. J. Biosci. 33: Chevalier V., Reynaud P., Lefrancois T., Durand B., Baillon F., Balanca G., Gaidet N., Mondet B., Lancelot R. (2009): Predicting West Nile virus seroprevalence in wild birds in Senegal. Vector Borne Zoonotic Dis. 9: Childs J.E. (2004): Zoonotic viruses of wildlife: hither from yon. Arch. Virol. Suppl. 18: Childs J.E., Richt J.A., Mackenzie J.S. (2007): Introduction: conceptualizing and partitioning in the emergence proces of zoonotic viruses from wildlife to humans. Curr. Top. Microbiol. Immunol. 315: Christova I., Plyusnina A., Gladnishka T., Kalvatchev N., Trifonova I., Dimitrov H., Mitkovska V., Mohareb E., Plyusnin A. (2015): Detection of Dobrava hantavirus RNA in Apodemus mice in Bulgaria. J. Med. Virol. 97: Chvala S., Kolodziejek J., Nowotny N., Weissenböck H. (2004): Pathology and viral distribution in fetal Usutu virus infection of birds from the 2001 and 2002 outbreaks in Austria. J. Comp. Pathol. 131: Chvala S., Bakonyi T., Bukovsky C., Meister T., Brugger K., Rubel F., Nowotny N., Weissenböck H. (2007): Monitoring of Usutu virus activity and spread by using dead bird surveillance in Austria, Vet. Microbiol. 122: Clayson E.T., Innis B.L., Myint KS., Narupiti S., Vaughn D.W., Giri S., Ranabhat P., Shrestha M.P. (1995): Detection of hepatitis E virus infections among domestic swine in the Kathmandu Valley of Nepal. Am. J. Trop. Med. Hyg. 53: Clement J., Frans J., van Ranst M. (2003): Human Tula virus infection or rat-bite fever? Eur. J. Clin. Microbiol. Infect. Dis. 22: Clement J., Maes P., van Ypersele de Strihou C., van der Groen G., Barrios J.M., Verstraeten W.W., van Ranst M. (2010): Beechnuts and outbreaks of nephropathia epidemica (NE): of mast, mice and men. Nephrol. Dial. Transplant. 25: Clement J., Maes P., Van Ranst M. (2014): Hemorrhagic fever with renal syndrome in the new, and hantavirus pulmonary syndrome in the old world: paradi(se)gm lost of regained? Virus. Res. 187: Collier L., Oxford J., Kellam P. (2011): Human virology. Oxford Press, 365 s. Colson P., Borentain P., Queyriaux B., Kaba M., Moal V., Gallian P., Heyries L., Raoult D., Gerolami R. (2010): Pig liver sausage as a source of hepatitis E virus transmission to humans. J. Infect. Dis. 202: Condon B.J., Sintha T. (2010): The effectiveness of pandemic preparations: legal lessons from the 2009 influenza epidemic. Flo. J. Int. Law. 22: Cornet M., Robin Y., Chateau R., Heme G., Adam C., Valade M., Le Gonidec G., Jan C., Renaudet J., Dieng P.Y. (1979): Isolement d arbovirus au Sénégal Oriental a partir de moustiques ( ) et notes surl épidémiologie des virus transmis par les Aedes en particulier du virus amaril. Cahiers ORSTOM. Sér. Entomologieméd. Parasitol. 17: Coussinier-Paris P. (2006): West Nile virus in Europe and Africa: still minor pathogen, or potential threat to public health? Bull. Soc. Pathol. Exot. 99:
105 Crossan C., Baker P.J., Craft J., Takeuchi Y., Dalton H.R., Scobie L. (2012): Hepatitis E virus genotype 3 in shellfish, United Kingdom. Emerg. Infect. Dis. 18: Curriero F.C., Patz J.A., Rose J.B., Lele S. (2001): The association between extreme precipitation and waterborne disease outbreaks in the United States, Am. J. Public. Health. 91: Dalton H.R., Thurairajah P.H., Fellows H.J., Hussaini H.S., Mitchell J., Bendall R., Banks M., Ijaz S., Teo C.G., Levine D.F. (2007): Autochthonous hepatitis E in southwest England. J. Viral. Hepat. 14: Daneš L., Tkachenko E.A., Ivanov A.P., Lím D., Rezapkin G.V., Dzagurova T.K. (1986): Hemorrhagic fever with renal syndrome in Czechoslovakia: detection of antigen in small terrestrial mammals and specific serum antibodies in man. J. Hyg. Epidemiol. Microbiol. Immunol. 30: Daneš L., Pejčoch M., Hubálek Z., Halouzka J., Juřicová Z., Zima J., Tkachenko E.A., Dzagurová T.K., Ivanov A.P., Švandová E. (1991): Hantaviruses in small wild living mammals in Czechoslovakia. Results of a study. J. Hyg. Epidemiol. Microbiol. Immunol. 35: Dargevicius A., Petraityte R., Sribikiene B., Sileikiene E., Razukeviciene L., Ziginskiene E., Vorobjoviene R., Razanskiene A., Sasnauskas K., Bumblyte I.A., Kuzminskis V. (2007): Prevalence of antibodies to hantavirus among hemodialysis patients with end-stage renal failure in Kaunas and its district. Medicina. 43: Darwish M.A., Faris R., Clemens J.D., Rao M.R., Edelman R. (1996): High seroprevalence of hepatitis A, B, C, and E viruses in residents in an Egyptian village in Nile delta: a pilot study. Am. J. Trop. Med. Hyg. 54: Davis C.T., Ebel G.D., Lanciotti R.S., Brault A.C., Guzman H., Siirin M., Lambert A., Parsons R.E., Beasley D.W., Novak R.J., Elizondo-Quiroga D., Green E.N., Young D.S., Stark L.M., Drebot M.A., Artsob H., Tesh R.B., Kramer L.D., Barrett A.D. (2005): Phylogenetic analysis of North American West Nile virus isolates, : evidence for the emergence of a dominant genotype. Virology. 342: De Araujo J., Thomazelli L.M., Henriques D.A., Lautenschalager D., Ometto T., Dutra L.M., Aires C.C., Favorito S., Durigon E.L. (2012): Detection of hantavirus in bats from remaining rain forest in Sao Paulo, Brazil. BMC Res. Notes. 5: Deter J., Chaval Y., Galan M., Gauffre B., Morand S., Henttonen H., Laakkonen J., Voutilainen L., Charbonnel N., Cosson J.F. (2008): Kinship, dispersal and hantavirus transmission in bank and common voles. Arch. Virol. 153: Di Bartolo I., Diez-Valcarce M., Vasickova P., Kralik P., Hernandez M., Angeloni G., Ostanello F., Bouwknegt M., Rodriguez-Lazaro D., Pavlik I., Ruggeri F.M. (2012): Hepatitis E virus in pork production chain in Czech Republic, Italy, and Spain, Emerg. Infect. Dis. 18: Di Bartolo I., Angeloni G., Ponterio E., Ostanello F., Ruggeri F.M. (2015): Detection of hepatitis E virus in pork liver sausages. Int. J. Food Microbiol. 193: Diamond J. (2002): Evolution, consequences, and future of plant and animal domestication. Nature. 418: Dingle H. (1996): Migration: the biology of life on the move. Oxford University Press, USA, 480 s. Doceul V., Bagdassarian E., Demange A., Pavio N. (2016): Zoonotic hepatitis E virus: classification, animal reservoirs and transmission routes. Viruses. 8: pii=e270. Dressel K. (2014): Report of Public Risk Perception. EDENext Project, unpublished. Drewes S., Ali H.S., Saxenhofer M., Rosenfeld U.M., Binder F., Cuypers F., Schlegel M., Rohrs S., Heckel G., Ulrich R.G. (2017): Host-associated absence of human Puumala virus infections in Northern and Eastern Germany. Emerg. Infect. Dis. 23: Drexler J.F., Corman V.M., Drosten C. (2014): Ecology, evolution and classification of bat coronaviruses in the aftermath of SARS. Antiviral. Res. 101: Durand B., Dauphin G., Zeller H., Labie J., Schuffenecker I., Murri S., Moutou F., Zientara S. (2005): Serosurvey for West Nile virus in horses in southern France. Vet. Res. 157:
106 Dušek J., Pejčoch M., Kolský A., Seeman T., Němec V., Stejskal J., Vondrák K., Janda J. (2006): Mild course of Puumala nephropathy in children in an area with sporadic occurrence hantavirus infection. Pediatr. Nephrol. 21: Dzagurova T.K., Klempa B., Tkachenko E.A., Slyusareva G.P., Morozov V.G., Auste B., Kruger D.H. (2009): Molecular diagnostics of hemorrhagic fever with renal syndrome during a Dobrava virus outbreak in the European part of Russia. J. Clin. Microbiol. 47: Ebel G.D., Carricaburu J., Young D., Bernard K.A., Kramer L.D. (2004): Genetic and phenotypic variation of West Nile virus in New York, Am. J. Trop. Med. Hyg. 71: ECDC EFSA (2015): The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in Dostupné na: ECDC (2016a): An emerging threat. Mosquito-borne diseases in Europe. Dostupné na: Europe.aspx, ECDC (2016b): Small bites, big problems. Tick-borne diseases in Europe. Dostupné na: Europe.aspx, Egevang C., Stenhouse I.J., Phillips R.A., Petersen A., Fow J.W., Silk J.R.D. (2010): Tracking of arctic terns Sterna paradisaea reveals longest animal migration. Proc. Natl. Acad. Sci. U. S. A. 107: Elliot L.H., Ksiazek T.G., Rollin P.E., Spiropoulou C.F., Morzunov S., Monroe M., Goldsmith C.S., Humphrey C.D., Zaki S.R., Krebs J.W., Maupin G., Gage K., Chils J.E., Nichol S.T., Peters C.J. (1994): Isolation of the causative agent of hantavirus pulmonary syndrome. Am. J. Trop. Med. Hyg. 51: EPIDAT (2017): Infekce v ČR. Dostupné na: Epstein J.H., Prakash V., Smith C.S., Daszak P., McLaughlin A.B., Meehan G., Field H.E., Cunningham A.A. (2008): Henipavirus infection in fruit bats (Pteropus giganteus), India. Emerg. Infect. Dis. 14: Ernek E., Kozuch O., Nosek J., Teplan J., Folk C. (1977): Arboviruses in birds in Slovakia. J. Hyg. Epidemiol. Microbiol. Immunol. 21: Escribano-Romero E., Lupulovic D., Merino-Ramos T., Blazquez A.B., Lazic G., Lazic S., Saiz J.C., Petrovic T. (2015): West Nile virus serosurveillance in pigs, wild boars, and roe deer in Serbia. Vet. Microbiol. 176: Essbauer S., Schmidt J., Conraths F.J., Friedrich R., Koch J., Hautmann W., Pfeffer M., Wolfel R., Finke J., Dobler G., Ulrich R.G. (2006): A new Puumala hantavirus subtype in rodents associated with an outbreak of Nephropathia epidemica in South-East Germany in Epidemiol. Infect. 134: Essbauer S.S., Schmidt-Chanasit J., Madeja E.L., Wegener W., Friedrich R., Petraityte R., Sasnauskas K., Jacob J., Koch J., Dobler G., Conraths F.J., Pfeffer M., Pitra C., Ulrich R.G. (2007): Nephropathia epidemica in metropolitan area, Germany. Emerg. Infect. Dis. 13: Esteves A., Almeida A.P., Galao R.P., Parreira R., Piedade J., Rodrigues J.C., Sousa C.A., Novo M.T. (2005): West Nile virus in Southern Portugal, Vector Borne Zoonotic Dis. 5: Ettinger J., Hofmann J., Enders M., Tewald F., Oehme R.M., Rosenfeld U.M., Ali H.S., Schlegel M., Essbauer S., Osterberg A., Jacob J., Reild D., Klempa B., Ulrich R.G., Kruger D.H. (2012): Multiple synchronous outbreaks of Puumala virus, Germany, Emerg. Infect. Dis. 18: Faber M., Wollny T., Schlegel M., Wanka K.M., Thiel J., Frank C., Rimek D., Ulrich R.G., Stark K. (2013): Puumala virus outbreak in Western Thuringia, Germany, 2010: epidemiology and strain identification. Zoonoses Public Health. 60: Fedorov V., Goropashnaya A., Jerrell G.H., Fredga K. (1999): Phylogeographic structure and mitochondrial DNA variation in true lemmings (Lemmus) from the Eurasian Arctic. Biol. J. Linn. Soc. 66: Feldmann H., Klenk H.D. (1996): Marburg and Ebola viruses. Adv. Virus. Res. 47:
107 Fereidouni S.R., Ziegler U., Linke S., Niedrig M., Modirrousta H., Hoffmann B., Groschup M.H. (2011): West Nile virus monitoring in migrating and resident water birds in Iran: are common coots the main reservoirs of the virus in wetlands? Vector Borne Zoonotic Dis. 11: Fidler D.P. (2001): International law and global infectious disease control. Commission on Macroeconomics and Health Working Paper No. WG2: 18 (2001). Available from: URL: Fidler D.P. (2003): Emerging trends in international law concerning global infectious disease control. Emerg. Infect. Dis. 9: Fiennes R.N.T.W (1979): Zoonoses and the origins and ecology of human disease. Academic Press, London, 196 s. Figuerola J., Soriguer R., Rojo G., Gomez Tejedor C., Jimenez-Clavero M.A. (2007): Seroconversion in wild birds and local circulation of West Nile virus, Spain. Emerg. Infect. Dis. 13: Filipe A.R. (1972): Isolation in Portugal of West Nile virus from Anopheles maculipennis mosquitoes. Acta. Virol. 16: 361. Fink S., Excoffier L., Heckel G. (2004): Mitochondrial gene diversity in the common voles Microtus arvalis shaped by historical divergence and local adaptations. Mol. Ecol. 13: Fleming T.H., Eby P. (2003): Ecology of bat migration. In: Bat ecology, edited by Kunz T.H. and Fenton M.B., University of Chicago Press, Chicago, 798 s. Friant S., Paige S.B., Goldberg T.L. (2015): Drivers of bushmeat hunting and perceptions of zoonoses in Nigerian hunting communities. PLoS Negl. Trop. Dis. 9: e Fukuda S., Sunaga J., Saito N., Fujimura K., Itoh Y., Sasaki M., Tsuda F., Takahashi M., Nishizawa T., Okamoto H. (2004): Prevalence of antibodies to hepatitis E virus among Japanese blood donors: identification of three blood donors infected with a genotype 3 hepatitis E virus. J. Med. Virol. 73: Fukuda S., Ishikawa M., Ochial N., Suzuki Y., Sunaga J., Nozawa K., Tsuda F., Takahashi M., Okamoto H. (2007): Unchanged high prevalence of antibodies to hepatitis E virus (HEV) and HEV RNA among blood donors with an elevated alanine aminotransferase level in Japan during Arch. Virol. 152: Gaibani P., Pierro A., Alicino R., Rossini G., Cavrini F., Landini M.P., Sambri V. (2012): Detection of Usutu virus-specific IgG in blood donors from northern Italy. Vector Borne Zoonotic Dis. 12: Galeno H., Mora J., Villagra E., Fernandez J., Hernandez J., Mertz G.J., Ramirez E. (2002): First human isolate of hantavirus (Andes virus) in the Americas. Emerg. Infect. Dis. 8: Galvin K.A., Randall B.B., Smith N.M., Lynn S.J. (2001): Impacts of climate variability on East African pastoralists: linking social science and remote sensing. Clim. Res. 19: Gao S., Li D., Zha E., Zhou T., Wang S., Yue X. (2015): Surveillance of hepatitis E virus contamination in shellfish in China. Int. J. Environ. Res. Public Health. 12: Garcia-Bocanegra I., Jaen-Tellez J.A., Napp S., Arenas-Montes A., Fernandez-Morente M., Fernandez- Molera V., Arenas A. (2011): West Nile fever outbreak in horses and humans, Spain, Emerg. Infect. Dis. 17: Garcia-Bocanegra I., Paniagua J., Gutiérrez-Guzmán A.V., Lecollinet S., Boadella M., Arenas-Montes A., Cano-Terriza D., Lowenski S., Gortázar C., Hofle U. (2016): Spatio-temporal trends and risk factors affecting West Nile virus and related flavivirus exposure in Spanish wild ruminants. BMC Vet. Res. 12: 249. Garigliany M.M., Marlier D., Tenner-Racz K., Eiden M., Cassart D., Gandar F., Beer M., Schmidt- Chanasit J., Desmecht D. (2014): Detection of Usutu virus in a bullfinch (Pyrrhula pyrrhula) and a great spotted woodpecker (Dendrocopos major) in north-west Europe. Vet. J. 199: Garigliany M., Linden A., Gilliau G., Levy E., Sarlet M., Franssen M., Benzarti E., Derouaux A., Francis F., Desmecht D. (2017): Usutu virus, Belgium, Infect. Genet. Evol. 48: Ghabrah T.M., Stickland G.T., Tsarev S., Yarbough P., Farci P., Engle R., Emerson S., Purcell R. (1995): Acute viral hepatitis in Saudi Arabia: seroepidemiological analysis, risk factores, clinical manifestations, and evidence for a sixth hepatitis agent. Clin. Infect. Dis. 21:
108 Gjenero-Margan I., Aleraj B., Krajcar D., Lesnikar V., Klobučar A., Pem-Novosel I., Kurečic-Filipovic S., Komparak S., Martic R., Duričic S., Betica-Radic L., Okmadžic J., Vilivic-Čavlek J., Babic-Erceg A., Turkovic B., Avšič-Županc T., Radic I., Ljubic M., Šarac K., Benic N., Mlinaric-Galinovic G. (2011): Autochthonous Dengue fever in Croatia, august-september Euro Surveill. 16: pii= Gledovic Z.B., Jeknic A.S., Grgurevis A.D., Rakocevic B.B., Bozovic B.R., Mugosa B.V. (2008): Hemorrhagic fever with renal syndrome in Montenegro. Jpn. J. Infect. Dis. 61: Gligic A., Obradovic M., Stojanovic R., Hlaca D., Antonijevic B., Arnautovic A., Gaoin J., Frusic M., Lee P., Goldgaber D. (1988): Hemorrhagic fever with renal syndrome in Yugoslavia: detection of hantaviral antigen and antibody in wild rodents and serological diagnosis of human disease. Scand. J. Infect. Dis. 20: Gligic A., Stojanovic R., Obradovic M., Hlaca D., Dimkovic N., Diglisic G., Lukac V., Ler Z., Bogdanovic R., Antonijevic B., Ropac D., Avsic Zupanc T., Leduc J.W., Ksiazek T., Yanagihara R., Gajdusek D.C. (1992): Hemorrhagic fever with renal syndrome in Yugoslavia: epidemiologic and epizootiologic features of a nationwide outbreak in Eur. J. Epidemiol. 8: Golovljova I., Sjolander K.B., Lindegren G., Vene S., Vasilenko V., Plyusnin A., Lundkvist A. (2002): Hantaviruses in Estonia. J. Med. Virol. 68: Golovljova I., Vasilenko V., Mittzenkov V., Prukk T., Seppet E., Vene S., Settergren B., Plyusnin A., Lundkvist A. (2007): Characterization of hemorrhagic fever with renal syndrome caused by hantaviruses, Estonia. Emerg. Infect. Dis. 13: Gozalan A., Kalaycioqlu H., Uyar Y., Sevindi D.F., Turkyilmaz B., Cakir V., Cindemir C., Unal B., Yaqci-Caqlayik D., Korunkluoqlu G., Ertek M., Heyman P., Lundkvist A. (2013): Human Puumala and Dobrava hantavirus infections in the Black Sea region of Turkey: a cross-sectional study. Vector Brone Zoonotic Dis. 13: Grandadam M., Caro V., Plumet S., Thiberge J.M., Souarés Y., Failloux A.B., Budelot M., Cosserat D., Leparc-Goffart I., Despres P. (2011): Chikungunya virus, Southeastern France. Emerg. Inf. Dis. 17: Gratacap-Cavallier B., Genoulaz O., Brengel-Pesce K., Souler H., Innocenti-Francillard P., Bost M., Gofti L., Zmirou D., Seigneurin J.M. (2000): Detection of human and animal rotavirus sequences in drinking water. Appl. Environ. Microbiol. 66: Grešíková M., Rajčáni J., Sekeyová M., Brummer-Korvenkontio M., Kozuch O., Labuda M., Turek R., Weismann P., Nosek J., Lysý J. (1984): Hemorrgahic fever virus with renal syndrome in small rodents in Czechoslovakia. Acta. Virol. 28: Grodzki M., Schaeffer J., Piquet J.C., Le Saux J.C., Chevé J., Olivier J., Le Pendu J., Le Guyader F.S. (2014): Bioaccumulation efficiency, tissue distribution, and environmental occurrence of hepatitis E virus in bivalve shellfish from France. Appl. Environ. Microbiol. 80: Gu S.H., Lim B.K., Kadjo B., Arai S., Kim J.A., Nicolas V., Lalis A., Denys C., Cook J.A., Dominguez S.R., Holmes K.V., Urushadze L., Sidamonidze K., Putkaradze D., Kuzmin I.V., Kosoy M.Y., Song J.W., Yanagihara R. (2014): Molecular phylogeny of hantaviruses harbored by insectivorous bats in Cote d Ivoire and Vietnam. Viruses. 6: Gubler D.J. (1989): Aedes aegypti and Aedea aegypti-borne disease control in the 1990s: top down or bottoom up. Am. J. Trop. Med. Hyg. 40: Gubler D.J. (1998): Resurgent vector-borne diseases as a global helath problem. Emerg. Infect. Dis. 4: Guillois Y., Abravanel F., Miura T., Pavlo N., Vaillant V., Lhomme S., Le Guyader F.S., Rose N., Le Saux J.C., King L.A., Izopet J., Couturier E. (2016): High proportion of asymptomatic infections in an outbreak of hepatitis E associated with a spit-roasted piglet, France, Clin. Infect. Dis. 62: Guo W.P., Lin X.D., Wang W., Tian J.H., Cong M.L., Zhang H.L., Wang M.R., Zhou R.H., Wang J.B., Li M.H., Xu J., Holmes E.C., Zhang Y.Z. (2013): Phylogeny and origins of hantaviruses harbored by bats, insectivores and rodents. PLoS Pathog. 9: e Gutiérrez-Guzmán A.V., Vicente J., Sobrino R., Perez-Ramirez E., Llorente F., Hofle U. (2012): Antibodies to West Nile virus and related falviviruses in wild boar, red foxes and other mesomammals from Spain. Vet. Microbiol. 159:
109 Hall T.A. (1999): BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acid Symp. Series No. 41: Halouzka J., Juricova Z., Jankova J., Hubalek Z. (2008): Serologic survey of wild boars for mosquito-borne viruses in South Moravia (Czech Republic). Ved. Med. 53: Han B.A., Kramer A.M., Drake J.M. (2016): Global patterns of zoonotic disease in mammals. Trends Parasitol. 32: Harvell C.D., Mitchell C.E., Ward J.R. (2002): Climate warming and disease risk for terrestrial and marine biota. Science. 296: Hayes E.B., O Leary D.R. (2004): West Nile virus infection: a pediatric perspective. Pediatrics. 113: Hazam R.K., Singla R., Kishore J., Singh S., Gupta R.K., Kar P. (2010): Surveillance of hepatitis E virus in sewage and drinking water in a resettlement colony of Delhi: what has been the experience? Arch. Virol. 155: Heckel G., Burri R., Fink S., Desmet J.F., Excoffier L. (2005): Genetic structure and colonization processes in European populations of the common vole, Microtus arvalis. Evolution. 59: Heiske A., Anheier B., Pilaski J., Volchkov V.E., Feldmann H. (1999): A new Clethrionomys-derived hantavirus from Germany: evidence for distinct genetic sublineages of Puumala viruses in Western Europe. Virus Res. 61: Henttonen H., Kaikusalo A. (1993): Lemming movements. In: The biology of Lemmings, edited by Stenseth N.C., Academic press, London, 704 s. Hernandez-Triana L.M., Jeffries C.L., Mansfield K.L., Carnell G., Fooks A.R., Johnson N. (2014): Emergence of West Nile virus lineage 2 in europe: a review on the introduction and spread of a mosquito-borne disease. Front. Public Health. 2: Heyman P., Klingstrom J., de Jaegere F., Leclercq G., Rozenfeld F., Escutenaire S., Vandenvedle C., Zizi M., Plyusnin A., Lundkvist A. (2002): Tula hantavirus in Belgium. Epidemiol. Infect. 128: Heyman P., Ceianu C.S., Christova I., Tordo N., Beersma M., Joao Alves M., Lundkvist A., Hukic M., Papa A., Tenorio A., Zelená H., Essbauer S., Visontai I., Golovljova I., Connell J., Nicoletti L., Van Esbroeck M., Gjeruldsen Dudman S., Aberle S.W., Avsic-Zupanc T., Korukluoqlu G., Nowakowska A., Klempa B., Ulrich R.G., Bino S., Engler O., Opp M., Vaheri A. (2011): A five-year perspective on the situation of haemorrhagic fever with renal syndrome and status of the hantavirus reservoirs in Europe, Euro Surveill. 16: pii= Hoch S.P.F., Khan J.K., Rehman S. (1995): Crimean-congo hemorrhagic fever treated with oral ribavirin. Lancet. 346: Hoenen T. (2016): Sequencing of Ebola virus genomes using nanopore technology. Bio. Protoc. 6: e1998. Höfle U., Gamino V., de Mera I.G., Mangold A.J., Ortίz J.A., de la Fuente J. (2013): Usutu virus in migratory song thrushes, Spain. Emerg. Infect. Dis. 19: Hofmann J., Meisel H., Klempa B., Vesenbeckh S.M., Beck R., Michel D., Schmidt-Chanasit J., Ulrich R.G., Grund S., Enders G., Kruger D.H. (2008): Hantavirus outbreak, Germany, Emerg. Infect. Dis. 14: Hofmann J., Meier M., Enders M., Fuhrer A., Ettinger J., Klempa B., Schmidt S., Ulrich R.G., Kruger D.H. (2014): Hantavirus disease in Germany due to infection with Dobrava-Belgrade virus genotype Kurkino. Clin. Microbiol. Infect. 20: O Holm D.K., Moessner B.K., Engle R.E., Zaaijer H.L., Georgsen J., Purcell R.H., Christensen P.B. (2015): Declining prevalence of hepatitis E antibodies among Danish blood donors. Transfusion. 55: Horling J., Chizhikov V., Lundkvist A., Jonsson M., Ivanov L., Dekonenko A., Niklasson B., Dzagurova T., Peters C.J., Tkachenko E., Nichol S. (1996): Khabarovsk virus: a phylogenetically and serologically distinct Hantavirus isolated from Microtus fortis trapped in far-east Russia. J. Gen. Virol. 77: Hubálek Z., Halouzka J., Juricová Z., Sebesta O. (1998): First isolation of mosquito-borne West Nile virus in the Czech Republic. Acta. Virol. 42:
110 Hubálek Z., Halouzka J. (1999): West Nile fever a reemerging mosquito-borne viral disease in Europe. Emerg. Infect. Dis. 5: 643:650. Hubálek Z., Halouzka J., Juricova Z., Prikazsky Z., Zakova J., Sebesta O. (1999): Surveillance of mosquito-borne viruses in Breclav after the flood of Epidemiol. Mikrobiol. Imunol. 48: Hubálek Z., Savage H.M., Halouzka J., Juricova Z., Sanogo Y.O., Lusk S. (2000): West Nile virus investigations in South Moravia, Czechland. Viral Immunol. 13: Hubálek Z. (2004): An annotated checklist of pathogenic microorganisms associated with migratory birds. J. Wildl. Dis. 40: Hubálek Z., Rudolf I. (2007): Mikrobiální zoonózy a sapronózy. Masarykova univerzita, Brno, 176 s. Hubálek Z., Halouzka J., Juricová Z., Sikutová S., Rudolf I., Honza M., Janková J., Chytil J., Marec F., Sitko J. (2008a): Serologic survey of birds for West Nile flavivirus in southern Moravia (Czech Republic) Vector Borne Zoonotic Dis. 8: Hubálek Z., Wegner E., Halouzka J., Tryjanowski P., Jerzak L., Sikutová S., Rudolf I., Kruszewicz A.G., Jaworski Z., Wlodarczky R. (2008b): Serologic survey of potential vertebrate hosts for West Nile virus in Poland. Viral Immunol. 21: Hubálek Z., Rudolf I., Bakonyi T., Kazdová K., Halouzka J., Šebesta O., Šikutová S., Juřicová Z., Nowotny N. (2010): Mosquito (Diptera: Culicidae) surveillance for arboviruses in an area endemic for West Nile (Lineage Rabensburg) and Tahyna viruses in Central Europe. J. Med. Entomol. 47: Hubálek Z., Rudolf I. (2011): Microbial zoonoses and sapronoses. Springer, Netherlands, 457 s. Hubálek Z., Rudolf I., Čapek M., Bakonyi T., Betášová L., Nowotny N. (2014): Usutu virus in blackbirds (Turdus merula), Czech Republic, Transbound. Emerg. Dis. 61: Huff J.L., Barry P.A. (2003): B-virus (Cercopithecine herpesvirus I) infection in humans and macaques: potential for zoonotic disease. Emerg. Infect. Dis. 9: Hukic M., Kurt A., Torstensson S., Lundkvist A., Wiger D., Niklasson B. (1996): Haemorrhagic fever with renal syndrome in north-east Bosnia. Lancet. 347: Hunter P.R. (2003): Climate change and waterborne and vector-borne diseases. J. Appl. Microbiol. 94: 37S- 46S. ICTV (2017): The ICTV Taxonomy. Dostupné na: Jakab F., Horváth G., Freneczi E., Sebok J., Szucs G. (2008): First detection of Tula hantaviruses in Microtus arvalis voles in Hungary. Arch. Virol. 153: Jenkins P.T., Genovese K., Ruffler H. (2007): Broken screens: the regulation of live animal importation in the United States. Defenders of wildlife, Washington. Dostupné na: Jesus de la Calla I., Espinosa-Garcia M.J., Perez-Ramos S., Cruz-Rosales E. (2012): First confirmed cases of human meningoencephalitis due to West Nile virus in Andalusia, Spain. Enferm. Infecc. Microbiol. Clin. 30: Jia X.Y., Briese T., Jordan I., Rambaut A., Chi H.C., Mackenzie J.S., Hall R.A., Scherret J., Lipkin W.I. (1999): Genetic analysis of West Nile New York 1999 encephalitis virus. Lancet. 354: Johne R., Dremsek P., Reetz J., Heckel G., Hess M., Ulrich R.G. (2014): Hepeviridae: an expanding family of vertebrate viruses. Infect. Genet. Evol. 27: Johnson N. (2014): The role of animals in emerging viral diseases. Elsevier, Academic Press, 364 s. Jöst H., Bialonski A., Maus D., Sambri V., Eiden M., Groschup M.H., Günther S., Becker N., Schmidt- Chanasit J. (2011): Isolation of Usutu virus in Germany. Am. J. Trop. Med. Hyg. 85: Juhl D., Baylis S.A., Blumer J., Gorg S., Hennig H. (2014): Seroprevalence and incidence of hepatitis E virus infection in German blood donors. Transfusion. 54: Jupp P.G. (2001): The ecology of West Nile virus in South Africa and the occurrence of outbreaks in humans. Ann. N.Y. Acad. Sci. 951:
111 Juřicová Z. (1992): Arbovirus antibodies in wild game caugh in Moravia. Vet. Med. 37: Juřicová Z., Hubalek Z., Halouzka J., Machacek P. (1993): Virologic detection of arboviruses in greater cormorants. Vet. Med. 38: Juřicová Z., Halouzka J. (1993): Serological examination of domestic ducks in southern Moravia for antibodies against arboviruses of the groups A, B, California and Bunyamwera. Biologia. 48: Juřicová Z., Hubálek Z. (1999): Serological surveys for arboviruses in the game animals of southern Moravia (Czech Republic). Folia. Zool. 48: Kaci S., Nockler K., Johne R. (2008): Detection of hepatitis E virus in archived Germany wild boar serum samples. Vet. Microbiol. 128: Kallio E.R., Begon M., Henttonen H., Koskela E., Mappes T., Vaheri A., Vapalahti O. (2010): Hantavirus infections in fluctuating host populations: the role of maternal antibodies. Pros. Biol. Sci. 277: Kallio-Kokko H., Uzcategui N., Vapalahti O., Vaheri A. (2005): Viral zoonoses in Europe. FEMS Microbiol. Rev. 29: Kang H.J., Bennett S.N., Sumibcay L., Arai S., Hope A.G., Mocz G., Song J.W., Cook J.A., Yanagihara R. (2009): Evolutionary insights from a genetically divergent hantavirus harbored by the European common mole (Talpa europaea). PLoS One. 4: e6149. Khuroo M.S. (1980): Study of an epidemic of non-a, non-b hepatitis. Possibility of another human hepatitis virus distinct from post-transfusion non-a, non-b type. Am. J. Med. 68: Khuroo M.S., Kamili S., Jameel S. (1995): Vertical transmission of hepatitis E virus. Lancet. 345: Khuroo M.S., Kamili S., Yattoo G.N. (2004): Hepatitis E virus infection may be transmitted through blood transfusions in an endemic area. J. Gastroenterol. Hepatol. 19: Khuroo M.S., Kamili S., Khuroo M.S. (2009): Clinical course and duration of viremia in vertically transmitted hepatitis E virus (HEV) infection in babies born to HEV-infected mothers. J. Viral. Hepat. 16: Khuroo M.S. (2011): Discovery of hepatitis E: the epidemic non-a, non-b hepatitis 30 years down the memory lane. Virus. Res. 161: Khuroo M.S., Khuroo M.S., Khuroo N.S. (2016a): Hepatitis E: Discovery, global impact, control and cure. World J. Gastroenterol. 22: Khuroo M.S., Khuroo M.S., Khuroo N.S. (2016b): Transmission of hepatitis E virus in developing countries. Viruses. 8: King A. M., Lefkowitz E., Adams M. J., Carstens E. B. (2011): Virus taxonomy: ninth report of the International Committee on Taxonomy of Viruses. Elsevier, 1338 s. Klein S.L., Calisher C.H. (2007): Emergence and persistence of hantaviruses. Curr. Top. Microbiol. Immunol. 315: Klempa B., Meisel H., Rath S., Bartel J., Ulrich R., Kruger D.H. (2003): Occurrence of renal and pulmonary syndrome in a region of northeast Germany where Tula hantavirus circulates. J. Clin. Microbiol. 41: Klempa B., Schutt M., Auste B., Labuda M., Ulrich R., Meisel H., Kruger D.H. (2004): First molecular identification of human Dobrava virus infection in central Europe. J. Clin. Microbiol. 42: Klempa B., Stanko M., Labuda M., Ulrich R., Meisel H., Kruger D.H. (2005): Central European Dobrava hantavirus isolate from a striped field mouse (Apodemus agrarius). J. Clin. Microbiol. 43: Klempa B., Fichet-Calvet E., Lecompte E., Auste B., Aniskin V., Meisel H., Denys C., Koivogui L., ter Meulen J., Kruger D.H. (2006): Hantavirus in african wood mouse, Guinea. Emerg. Infect. Dis. 12: Klempa B., Radosa L., Kruger D.H. (2013a): The broad spectrum of hantaviruses and their hosts in Central Europe. Acta. Virol. 57: Klempa B., Avsic-Zupanc T., Clement J., Dzagurova T.K., Henttonen H., Heyman P., Jakab F., Kruger D.H., Maes P., Papa A., Tkachenko E.A., Ulrich R.G., Vapalahti O., Vaheri A. (2013b): Complex evolution 123
112 and epidemiology of Dobrava-Belgrade hantavirus: definition of genotypes and their characteristics. Arch. Virol. 158: Klingstrom J., Hardestam J., Lundkvist A. (2006): Dobrava, but not Saaremaa, hantavirus is lethal and induces nitric oxide production in suckling mice. Microbes Infect. 8: Kobzík J., Daneš L. (1992): Laboratory-confirmed cases of hemorrhagic fever with renal syndrome which occurred in Breclav Epidemiol. Mikrobiol. Immunol. 41: Komar N., Panella N.A., Langevin S.A., Brault A.C., Amador M., Edwards E., Owen J.C. (2005): Avian hosts for West Nile virus in St. Tammany Parish, Louisiana, Am. J. Trop. Med. Hyg. 73: Korva M., Duh D., Puterle A., Trilar T., Avšič-Županc T. (2009): First molecular evidence of Tula hantavirus in Microtus voles in Slovenia. Vir. Res. 144: Kozuch O., Nosek J., Gresikova M., Ernek E. (1976): Surveillance of mosquito-borne focus in Záhorská Lowland. In: 2 International Arbeitskolloquium uber die Naturherde von Infektionskrankheiten in Zentraleuropa, edited by Sixl S. Hygiene Institut der Universitat. Graz, Kramer L.D., Li J., Shi P.Y. (2007): West Nile virus. Lancet Neurol. 6: Kubánková M., Němeček V., Chalupa P., Mihalčin M., Vašíčková P. (2016): Hepatitidis E virus. Epidemiol. Mikrobiol. Imunol. 65: Kubánková M., Králík P., Lamka J., Zakovcik V., Dolanský M., Vašíčková P. (2015): Prevalence of hepatitis E virus in populations of wild animals in comparison with animals bred in game enclosures. Food. Environ. Virol. Ahead of print. Kumar R.M., Uduman S., Rana S., Kochiyil J.K., Usmani A., Thomas L. (2001): Sero-prevalence and mother-to-infant transmission of hepatitis E virus among pregnant women in the United Arab Emirates. Eur. J. Obstet. Gynecol. Reprod. Biol. 100: Kumar S., Stecher G., Tamura K. (2016): MEGA7: molecular evolutionary genetics analysus version 7.0. for bigger datasets. Mol. Biol. Evol. 33: Kurkela S., Raetti O., Huhtamo E., Uzcátegui N.Y., Nuorti J.P., Laakkonen J., Manni T., Helle P., Vaheri A., Vapalahti O. (2008): Sindbis virus infection in resident birds, migratory birds, and humans. Emerg. Infect. Dis. 14: Lacy M.D., Smego R.A. (1996): Viral hemorrhagic fevers. Adv. Pediatr. Infect. Dis. 12: Lanciotti R.S., Ebel G.D., Deubel V., Kerst A.J., Murri S., Meyer R., Bowen M., McKinney N., Morrill W.E., Crabtree M.B., Kramer L.D., Roehrig J.T. (2002): Complete genome sequences and phylogenetic analysis of West Nile virus strains isolated from the United States, Europe, and the Middle East. Virology. 298: Lecollinet S., Blanchard Y., Manson C., Lowenski S., Laloy E., Quenault H., Touzain F., Lucas P., Eraud C., Bahuon C., Zientara S., Beck C., Decors A. (2016): Dual emergence of Usutu virus in common blackbirds, eastern France, Emerg. Inf. Dis. 22: LeDuc J.W., Smith G.A., Childs J.E., Pingeiro F.P., Maiztegui J.L., Niklasson B., Antoniafes A., Robinson D.M., Khin M., Shirtridge K.F., Wooster M.T., Elwell M.R., Ilbery P.L.T., Kobch D., Rosa E.S.T., Rosen L. (1986): Global survey of antibody to Hantaan-related viruses among peridomestic rodents. Bull. World Health Organ. 64: Lee H.W., Lee P.W., Johnson K.M. (1978): Isolation of the etiologic agent of Korean hemorrhagic fever. J. Infect. Dis. 137: Lee H.W., Baek L.J., Johnson K.M. (1982): Isolation of Hantaan virus, the etiologic agent of Korean hemorrhagic fever, from wild urban rats. J. Infect. Dis. 146: Lee P.W., Amyx H.L., Yanagihara R., Gajdusek D.C., Goldgaber D., Gibbs C.J. (1985): Partial characterization of Prospect Hill virus isolated from meadow voles in the United States. J. Infect. Dis. 152: Leroy E.M., Kumulungui B., Pourrut X., Rouquet P., Hassanin A., Yaba P., Délicat A., Paweska J.T., Gonzalez J.P., Swanepoel R. (2005): Fruit bats as reservoirs of Ebola virus. Nature. 438:
113 Lhomme S., Top S., Bertahnoli S., Dubois M., Guerin J.L., Izopet J. (2015): Wildlife reservoir for hepatitis E virus, southwestern France. Emerg. Infect. Dis. 21: Li T.C., Chijiwa K., Sera N., Ishibashi T., Etoh Y., Shinohara Y., Kurata Y., Ishida M., Sakamoto S., Takeda N., Miyamura T. (2005): Hepatitis E virus transmission from wild boar meat. Emerg. Infect. Dis. 11: Li T.C., Miyamura T., Takeda N. (2007): Detection of hepatitis E virus RNA from the bivalve Yamato- Shijimi (Corbicula japonica) in Japan. Am. J. Trop. Med. Hyg. 76: Librado P., Rozas J. (2009): DnaSP v5: a software for comprehensive analysis of DNA polymorphism data. Bioinformatics. 25: Linard C., Tersago K., Leirs H., Lambin E.F. (2007): Environmental conditions and Puumala virus transmission in Belgium. Int. J. Health Geogr. 6: 55. Lindsey N.P., Hayes E.B., Staples J.E., Fischer M. (2009): West Nile virus disease in children, United States, Pediatrics. 123: e Lindsey N.P., Staples J.E., Lehman J.A., Fischer M. (2012): Medical risk factors for severe West Nile virus disease, United States, Am. J. Trop. Med. Hyg. 87: Liumbruno G.M., Calteri D., Petropulacos K., Mattivi A., Po C., Maici P., Tomasini I., Zucchelli P., Silvetri A.R., Sambri V., Pupella S., Catalano L., Piccinini V., Calizzani G., Grazzini G. (2008): The Chikungunya epidemic in Italy and its repercussion on the blood systém. Blood Transfus. 6: LoGiudice K., Ostfeld R.S., Schmidt K.A. (2003): The ecology of infectious disease: effects of host diversity and community composition on Lyme disease risk. Proc. Natl. Acad. Sci. U. S. A. 100: Lourenco J., Recker M. (2014): The 2012 Madeira Dengue outbreak: epidemiological determinants and future epidemic potential. PLoS Negl. Trop. Dis. 8: e3083. Ludwig B., Kraus F.B., Allwinn R., Doerr H.W., Preiser W. (2003): Viral zoonoses a threat under control. Interviology. 46: Lundkvist A., Lindegren G., Brus Sjolander K., Mavtchoutko V., Vene S., Plyusnin A., Kalnina V. (2002): Hantavirus infections in Latvia. Eur. J. Clin. Microbiol. Infect. Dis. 21: Lvov D.K., Schelkanov M.L., Kolobukhina L.V., Galkina I.V., Aristova V.A., Morozova T.N., Porshina E.S., Kulikov A.G., Kogdenko N.V., Andronova O.V., Pronin N.I., Shevkoplias V.N., Fontanetskii A.S., Vlasov N.A., Nepoklonov E.A. (2008): Serological monitoring of arbovirus infections in the estuary of the Kuban River (the data). Vopr. Virusol. 53: Maas M., de Vries A., van Roon A., Takumi K., van der Giessen J., Rockx B. (2017): High prevalence of Tula hantavirus in common voles in the Netherlands. Vector Borne Zoonotic Dis. 17: MacPherson L.W. (1956): Some observations on the epizootiology of Newcastle disease. Can. J. Comp. Med. Vet. Sci. 20: Mailles A., Dellamonica P., Zeller H. (2003): Human and equine West Nile virus infections in France, augustseprember Euro Surveill. 7: Mansuy J.M., Peron J.M., Abravanel F., Poirson H., Dubois M., Miedouge M., Vischi F., Alric L., Vinel J.P., Izopet J. (2004): Hepatitis E in the south west of France in individuals who have never visited an endemic area. J. Med. Virol. 74: Marano N., Arguin P.M., Pappaioanou M. (2007): Impact of globalization and animal trade on infectious disease epidemiology. Emerg. Infect. Dis. 13: Masuda J., Yano K., Tamada Y., Takii Y., Ito M., Omagari K., Kohno S. (2005): Acute hepatitis E of a man who consumed wild boar meat prior to the onset of illness in Nagasaki, Japan. Hepatol. Res. 31: Matsubayashi K., Nagaoka Y., Sakata H., Sato S., Fukai K., Kato T., Takahashi K., Mishiro S., Imai M., Takeda N., Ikeda H. (2004): Transfusion-transmitted hepatitis E caused by apparently indigenous hepatitis E virus strain in Hokkaido, Japan. Transfusion. 44: Matsubayashi K., Kang J.H., Sakata H., Takahashi K., Shindo M., Kato M., Sato S., Kato T., Nishimori H., Tsuji K., Maguchi H., Yoshida J., Maekubo H., Mishiro S., Ikeda H. (2008): A case of transfusion- 125
114 transmitted hepatitis E caused by blood from a donor infected with hepatitis E virus via zoonotic food-borne route. Transfusion. 48: Matsuda H., Okada K., Takahashi K., Mishiro S. (2003): Sever hepatitis E virus infection after ingestion of uncooked liver from a wild boar. J. Infect. Dis. 188: 944 Matyášová L. (1998): Sérologický přehled hantavirových nákaz. Zprávy CEM. 7: 37. McElhinney L., Fooks A.R., Featherstone C., Smith R., Morgan D. (2016): Hantavirus (Seoul virus) in pet rats: a zoonotic viral threat. Veterinary Record. 178: McLean R.G., Ubico S.R., Bourne D., Komar N. (2002): West Nile virus in livestock and wildlife. Curr. Top. Microbiol. Immunol. 267: Meisel H., Lundkvist A., Gantzer K., Bar W., Sibold C., Kruger D.H. (1998): First case of infection with hantavirus Dobrava in Germany. Eur. J. Clin. Microbiol. Infect. Dis. 17: Meng X.J., Purcell R.H., Halbur P.G., Lehman J.R., Webb D.M., Tsareva T.S., Haynes J.S., Thacker B.J., Emerson S.U. (1997): A novel virus in swine is closely related to the human hepatitis E virus. Proc. Natl. Acad. Sci. U.S.A. 94: Mentel R., Bordihn N., Wendel H., Niklasson B. (1999): Hantavirus Dobrava infection with pulmonary manifestation. Med. Microbiol. Immunol. 188: Merdic E., Peric N., Pandak N., Kurolt I.C., Turic N., Vignjevic G., Stolfa I., Milas J., Bogojevic M.S., Markotic A. (2013): West Nile virus outbreak in humans in Croatia, Coll. Antropol. 37: Mertens M., Hofmann J., Petraityte-Burneikiene R., Ziller M., Sasnauskas K., Friedrich R., Niederstrasser O., Kruger D.H., Groschup M.H., Petri E., Werdermann S., Ulrich R.G. (2011): Seroprevalence study in forestry workers of a non-endemic region in eastern Germany reveals infections by Tula and Dobrava-Belgrade hantaviruses. Med. Microbiol. Immunol. 200: Meslin F.X. (2008): Public health impact of zoonoses and international approaches for their detection and containment. Vet. Ital. 44: Mesquita J.R., Oliveira D., Rivadulla E., Abreu-Silva J., Varela M.F., Romalde J.L., Nascimento M.S. (2016): Hepatitis E virus genotype 3 in mussels (Mytilus galloprovinciallis), Spain. Food. Microbiol. 58: Mettenleiter T.C. (2006): Zoonotic respiratory diseases caused by viruses. Symposium 1: Respiratory zoonoses. Dostupné na: Michalski A., Niemcewicz M., Bielawska-Drozd A., Nowakowska A., Gawel J., Pitucha G., Joniec J., Zielonka K., Marciniak-Niemcewicz A., Kocik J. (2014): Surveillance of hantaviruses in Poland: a study of animal reservoirs and human hantavirus disease in Subcarpathia. Vector Borne Zoonotic Dis. 14: Mishra N., Kalaiyarasu S., Nagarajan S., Rao M.V., George A., Sridevi R., Behera S.P., Dubey S.C., McCracken T., Newman S.H. (2012): Serological evidence of West Nile virus infection in wild migratory and resident water birds in Eastern and Northern India. Comp. Immunol. Microbiol. Infect. Dis. 35: Molnar E., Gulyas M.S., Kubinyi L., Nosek J., Kozuch O., Ernek E., Labuda M., Grulich I. (1976): Studies on the occurrence of tick-borne encephalitis in Hungary. Acta. Vet. Acad. Sci. Hunga. 26: Monaco F., Savini G., Calistri P., Polci A., Pinoni C., Bruno R., Lelli R. (2011): 2009 West Nile disease epidemic in Italy: first evidence of overwintering in Western Europe? Res. Vet. Sci. 91: Moniuszko-Malinowska A., Czupryna P., Dunaj J., Zajkowska J., Siemieniako A., Pancewicz S. (2016): West Nile virus and Usutu a threat to Poland. Przegl. Epidemiol. 70: Mostashari F., Bunning M.L., Kitsutani P.T., Singer D.A., Nash D., Cooper M.J., Katz N., Lijebjelke K.A., Biggerstaff B.J., Fine A.D., Layton M.C., Mullin S.M., Johnson A.J., Martin D.A., Hayes E.B., Campbell G.L. (2001): Epidemic West Nile encephalitis, New York, 1999: results of a household-based seroepidemiological survey. Lancet. 358: Moudy R.M., Meola M.A., Ebel G.D., Kramer L.D. (2007): A newly emergent genotype of West Nile virus is transmitted earlier and more efficiently by Culex mosquitoes. Am. J. Trop. Med. Hyg. 77:
115 Mukhopadhyay S., Kim B.S., Chipman P.R., Rossmann M.G., Kuhn R.J. (2013): Structure of West Nile virus. Science. 302: 248. Murgue B., Murri S., Triki H., Deubel V., Zeller H.G. (2001a): West Nile in the Mediterranean basin: Ann. N.Y. Acad. Sci. 951: Murgue B., Murri S., Zientara S., Durand B., Durand J.P., Zeller H. (2001b): West Nile outbreak in horses in southern France, 2000: the return after 35 years. Emerg. Infect. Dis. 7: Murphy F.A. (1998): Emerging zoonoses. Emerg. Infect. Dis. 4: Napoli C., Bella A., Declich S., Grazzini G., Lombardini L., Nanni Costa A., Nicoletti L., Pompa M.G., Pupella S., Russo F., Rizzo C. (2013): Integrated human surveillance systems of West Nile virus infections in Italy: the 2012 experience. Int. J. Environ. Res. Public Health. 10: Navaneethan U., Al Mohajer M., Shata M.T. (2008): Hepatitis E and pregnancy: understanding the pathogenesis. 28: Nayak D.P. (2000): Virus morphology, replication, and assembly. In: Viral ecology, edited by Hurst C.J., Academic Press, New York, 639 s. NCBI (2008): Vector-borne diseases: understanding the environmental, human health and ecological connections. Workshop summary, 350 s. Németh V., Madai M., Maraczi A., Berczi B., Horvath G., Oldal M., Kisfali P., Banyai K., Jakab F. (2011): Detection of Dobrava-Belgrade hantavirus using recombinant-nucleocapsid-based enzyme-linked immunosorbent assay and SYBR Green-based real-time reverse transcriptase-polymerase chain reaction. Arch. Virol. 156: Németh V., Oldal M., Madai M., Horváth G., Kemenesi G., Dallos B., Bányai K., Jakab F. (2013): Molecular characterization of Dobrava and Kurkuno genotypes of Dobrava-Belgrade hantavirus detected in Hungary and Northern Croatia. Virus. Genes. 47: Nemirov K., Vapalahti O., Lundkvist A., Vasilenko V., Golovljova I., Pluyusnina A., Niemimaa J., Laakkonen J., Henttonen H., Vaheri A., Plyusnin A. (1999): Isolation and characterization of Dobrava hantavirus carried by the striped field mouse (Apodemus agrarius) in Estonia. J. Gen. Virol. 80: Nemirov K., Vapalahti O., Papa A., Plyusnina A., Lundkvist A., Antoniadis A., Vaheri A., Plyusnin A. (2003): Genetic characterization of new Dobrava hantavirus isolate from Greese. J. Med. Virol. 69: Nemirov K., Andersen H.K., Leirs H., Henttonen H., Vaheri A., Lundkvist A., Plyusnin A. (2004): Saaremaa hantavirus in Denmark. J. Clin. Virol. 30: Nikolay B., Diallo M., Boye C.S., Sall A.A. (2011): Usutu virus in Africa. Vector Borne Zoonotic Dis. 11: Nowakowska A., Heyman P., Knap J.P., Burzynski W., Witas M. (2009): The first established focus of hantavirus infection in Poland, Ann. Agric. Environ. Med. 16: Olsson G.E., White N., Ahlm C., Elgh F., Verlemyr A.C., Juto P., Palo R.T. (2002): Demographic factors associated with hantavirus infection in bank voles (Clethrionomys glareolus). Emerg. Infect. Dis. 8: Olsson G.E., Leirs H., Henttonen H. (2010): Hantaviruses and their hosts in Europe: reservoirs here and there, but not everywhere? Vector Borne Zoonotic Dis. 10: Papa A., Johnson A.M., Stockton P.C., Bowen M.D., Spiropoulou C.F., Alexiou-Daniel S., Ksiazek T.G., Nichol S.T., Antoniadis A. (1998): Retrospective serological and genetic study of the distribution of hantaviruses in Greece. J. Med. Virol. 55: Papa A., Zelená H., Barnetová D., Petroušová L. (2010): Genetic detection of Dobrava/Belgrade virus in a Czech patient with haemorrhagic fever with renal syndrome. Clin. Microbiol. Infect. 16: Papa A. Christova I. (2011): Genetic detection of dobrava/belgrade virus, Bulgaria. Emerg. Infect. Dis. 17: Papa A., Xanthopoulou K., Gewehr S., Mourelatos S. (2011): Detection of West Nile virus lineage 2 in mosquitoes during a human outbreak in Greece. Clin. Microbiol. Infect. 17:
116 Parkes M.W., Bienen L., Breilh J., Hsu L.N., Patz J.A., Rosenthal J.P., Sahani M., Sleigh A., Walthner- Toews D., Yassi A. (2005): All hands on deck: transdisciplinary approaches to emerging infectious disease. EcoHealth. 2: Pavio N., Meng X.J., Renou C. (2010): Zoonotic hepatitis E: animal reservoirs and emerging risks. Vet. Res. 41: Pavio N., Meng X.J., Doceul V. (2015): Zoonotic origin of hepatitis E. Curr. Opin. Virol. 10: Pecorari M., Longo G., Gennari W., Grottola A., Sabbatini A., Tagliazucchi S., Savini G., Monaco F., Simone M., Lelli R., Rumpianesi F. (2009): First human case of Usutu virus neuroinvasive infection, Italy, August-September Euro Surveill. 14: pii= Pejčoch M. (1995): Co to jsou hantaviry? Vesmír. 74: 446. Pejčoch M., Kříž B. (2003): Hantaviruses in the Czech Republic. Emerg. Infect. Dis. 9: Pejčoch M., Unar J., Kříž B., Pauchová E., Rose R. (2010a): Characterization of a natural focus of Puumala hantavirus infection in the Czech Republic. Cent. Eur. J. Public Health. 18: Pejčoch M., Pazdiora P., Eiselt J., Hájek V., Veselá E., Vlasák J., Benešová J., Kubátová A., Kříž B. (2010b): Seroprevalence of hantavirus antibodies among chronic hemodialysis patients in the Czech Republic. Epidemiol. Mikrobiol. Imunol. 59: Pejčoch M., Kříž B., Malý M. (2010c): Promořenost hantaviry ve dvou oblastech s přírodními ohnisky hantavirů. Prakt. Lékař. 90: Petersen L.R., Roehrig J.T. (2001): West Nile virus: a reemerging global pathogen. Emerg. Infect. Dis. 7: Petrů K., Pejčoch M., Monhart V. (1997): Hemorrhagická horečka s renálním syndromem. Čas. Lék. Čes. 136: Pfeffer M., Dobler G. (2010): Emergence of zoonotic arboviruses by animal trade and migration. Parasit. Vectors. 3: Pilaski J., Ellerich C., Kreutzer T., Lang A., Benik W., Pohl-Koppe A., Bode L., Vanek E., Autenrieth I.B., Bigos K. (1991): Haemorrhagic fever with renal syndrome in Germany. Lancet. 337: 111. Pilaski J., Feldmann H., Morzunov S., Rollin P.E., Ruo S.L., Lauer B., Peters C.J., Nichol S.T. (1994): Genetic identification of a new Puumala virus strain causing severe hemorrhagic fever with renal syndrome in Germany. J. Infect. Dis. 170: Platonov A.E., Shipulin G.A., Shipulina O.Y., Tyutyunnik E.N., Frolochkina T.I., Lanciotti R.S., Yazyshina S., Platonova O.V., Obukhov I.L., Zhukov A.N., Vengerov Y.Y., Pokrovskii V.I. (2001): Outbreak of West Nile virus infection, Volgograd Region, Russia, Emerg. Infect. Dis. 7: Plyusnin A., Vapalahti O., Lankinen H., Lehvaslaiho H., Apekina N., Myasnikov Y., Kallio-Kokko H., Henttonen H., Lundkvist A., Brummer-Korvenkontio M., Gavrilovskaya I., Vaheri A. (1994): Tula virus: a newly detected hantavirus carried by European common voles. J. Virol. 68: Plyusnin A., Nemirov K., Apekina N., Plyusnina A., Lundkvist A., Vaheri A. (1999): Dobrava hantavirus in Russia. Lancet. 353: 207. Plyusnin A., Vaheri A., Lundkvist A. (2003): Genetic interaction between Dobrava and Saaremaa hantaviruses: now or million years ago? J. Virol. 77: Plyusnin A., Vaheri A., Lundkvist A. (2006): Saaremaa hantavirus should not be confused with its dangerous relative, Dobrava virus. J. Clin. Microbiol. 44: Plyusnina A., Deter J., Charbonnel N., Cosson J.F., Plyusnin A. (2007): Puumala and Tula hantaviruses in France. Vir. Res. 129: Plyusnina A., Frenczi E., Racz G.R., Nemirov K., Lundkvist A., Vaheri A., Vapalahti O., Plyusnin A. (2009): Co-circulation of three pathogenic hantaviruses: Puumala, Dobrava and Saaremaa in Hungary. J. Med. Virol. 81:
117 Popovic N., Milosevic B., Urosevic A., Poluga J., Lavadinovic L., Nedelijkovic J., Jevtovic D., Dulovic O. (2013): Outbreak of West Nile virus infection among humans in Serbia, August to October Euro Surveill. 18: pii= Popugaeva E., Witkowski P.T., Schlegel M., Ulrich R.G., Auste B., Rang A., Kruger D.H., Klempa B. (2012): Dobrava-Belgrade hantavirus from Germany shows receptor usage and innate immunity induction consistent with the pathogenicity of the virus in humans. PLoS One. 7: e Pounder K.C., Begon M., Sironen T., Henttonen H., Watts P.C., Voutilainen L., Vapalahti O., Klempa B., Fooks A.R., McElhinney L.M. (2013): Novel hantavirus in field vole, United Kingdom. Emerg. Infect. Dis. 19: Prosser D.J., Nagel J., Takekawa J.Y. (2014): Animal migration and risk of spread of viral infections. In: Viral infections and global change, edited by Singh S.K., Wiley-Blackwell, 660 s. Radosa L., Schlegel M., Gebauer P., Ansorge H., Heroldova M., Janova E., Stanko M., Mosansky L., Fricova J., Pejcoch M., Suchomel J., Purchart L., Groschup M.H., Kruger D.H., Ulrich R.G., Klempa B. (2013): Detection of shrew-borne hantavirus in Eurasian pygmy shrew (Sorex minutus) in Central Europe. Infect. Genet. Evol. 19: Rasche F.M., Schmidt S., Kretzschmar C., Mertens M., Thiel J., Groschup M.H., Schlegel M., Mayer C., Lindner T.H., Schiekofer S., Ulrich R.G. (2015): Autochthonous Dobrava-Belgrade virus infection in Eastern Germany. Clin. Nephrol. 83: Rao J.R., Millar B.C., Moore J.E. (2009): Avian influenza, migratory birds and emerging zoonoses: unusual viral RNA, enteropathogens and Cryptosporidium in poultry litter. Biosci. Hypotheses. 2: Razzauti M., Plyusnina A., Niemimaa J., Henttonen H., Plyusnin A. (2012): Co-circulation of two Puumala hantavirus lineages in Latvia: a Russian lineage described previously and a novel Latvian lineage. J. Med. Vriol. 84: Razzauti M., Plyusnina A., Henttonen H., Plyusnin A. (2013): Microevolution of Puumala hantavirus during a complete population cycle of its host, the bank vole (Myodes glareolus). PLoS One. 8: e Reil D., Imholt C., Drewes S., Ulrich R.G., Eccard J.A., Jacob J. (2016): Environmental conditions in favour of a hantavirus outbreak in 2015 in Germany? Zoonoses Public Health. 63: Reynes J.M., Carli D., Boukezia N., Debruyne M., Herti S. (2015): Tula hantavirus infection in a hospitalised patient, France, June Euro Surveill. 20: pii= Rijks J.M., Kik M.L., Slaterus R., Foppen R., Stroo A., Ijzer J., Stahl J., Grone A., Koopmans M., van der Jeugd H.P., Reusken C. (2016): Wudespread Usutu virus outbreak in birds in the Netherlands, Euro Surveill. 21: pii= Riveiro-Barciela M., Minguez B., Girones R., Rodriguez-Frias F., Quer J., Buti M. (2015): Phylogenetic demonstration of hepatitis E infection transmitted by port meat ingestion. J. Clin. Gastroenetrol. 49: Rizzo C., Salcuni P., Nicoletti L., Ciufolini M.G., Russo F., Masala R., Frongia O., Finarelli A.C., Gramegna M., Gallo L., Pompa M.G., Rezza G., Salmaso S., Declich S. (2012): Epidemiological surveillance of West Nile neuroinvasive disease in Italy, 2008 to Euro Surveill. 17: pii= Rose M.R., Lauder G.V. (1996): Adaptation. Academic Press, California, 511 s. Rosenfeld U.M., Drewes S., Ali H.S., Sadowska E.T., Mikowska M., Heckel G., Koteja P., Ulrich R.G. (2017): A highly divergent Puumala virus lineage in southern Poland. Arch. Virol. Ahead of print. Rudolf I., Bakonyi T., Sebesta O., Mendel J., Peško J., Betášová L., Blažejová H., Venclíková K., Straková P., Nowotny N., Hubálek Z. (2014): West Nile virus lineage 2 isolated from Culex modestus mosquitoes in the Czech Republic, 2013: expansion of the European WNV endemic area to the North? Euro Surveill. 17: 2-5. Rudolf I., Bakonyi T., Sebesta O., Mendel J., Pesko J., Betasova L., Blazejova H., Venclikova K., Strakova P., Nowotny N., Hubalek Z. (2015): Co-circulation of Usutu virus and West Nile virus in a reed bed ekosystém. Parasit. Vectors. 8: Růžek D. (2012): Lékařská virologie, 1. část. Učební text, České Budějovice, 56 s. 129
118 Said B., Ijaz S., Chand M.A., Kafatos G., Tedder R., Morgan D. (2014): Hepatitis E virus in England and Wales: indigenous infection is associated with the consumption of processed pork products. Epidemiol. Infect. 142: Sadkowska-Todys M., Dudek-Godeau D., Kaminska S., Baumann-Popczyk A., Czerwinski M., Kucharczyk B., Zielinski A. (2015): Occurence and maintenance of hantavirus infections among rodent populations in their natural habitat results of a field study from Podkarpacike province, Poland Przegl. Epidemiol. 69: Sandmann S., Meisel H., Razanskiene A., Wolbert A., Pohl B., Kruger D.H., Sasnauskas K., Ulrich R.G. (2005): Detection of human hantavirus infections in Lithuania. Infection. 33: Savini G., Monaco F., Terregino C., di Gennaro A., Bano L., Pinoni C., de Nardi R., Bonilauri P., Pecorari M., di Gialleonardo L. (2011): Usutu virus in Italy: An emergence or a silent infection? Vet. Microbiol. 151: Scobie L., Dalton H.R. (2013): Hepatitis E: source and route of infection, clinical manifestations and new developments. J. Viral. Hepat. 20: Sedas V.T. (2007): Influence of environmental factors on the presence of Vibrio cholerae in the marine environment: a climate link. J. Infect. Dev. Ctries. 1: Sedlák K., Tomšíčková M. (2007): Nebezpečné infekce zvířat a člověka. Scientia, 212 s. Scharninghausen J.J., Pfeffer M., Meyer H., Davis D.S., Honeycutt R.L., Faulde M. (2002): Genetic evidence for Tula virus in Microtus arvalis and Microtus agrestis populations in Croatia. Vector Borne Zoonotic Dis. 2: Scheuch M., Hoper D., Beer M. (2015): RIEMS: a software pipeline for sensitive and comprehensive taxonomic classification of reads from metagenomics datasets. BMC Bioinformatics. 16: Schilling S., Emmerich P., Klempa B., Auste B., Schnaith E., Schmitz H., Kruger D.H., Gunther S., Meisel H. (2007): Hantavirus disease outbreak in Germany: limitations of routine serological diagnostics and clustering of virus sequences of human and rodent origin. J. Clin. Microbiol. 45: Schlegel M., Klempa B., Auste B., Bemmann M., Schmidt-Chanasit J., Buchner T., Groschup M.H., Meier M., Balkema-Buschmann A., Zoller H., Kruger D.H., Ulrich R.G. (2009): Dobrava-belgrade virus spillover infections, Germany. Emerg. Infect. Dis. 15: Schlegel M., Kindler E., Essbauer S.S., Wolf R., Thiel J., Groschup M.H., Heckel G., Oehme R.M., Ulrich R.G. (2012a): Tula virus infections in the eurasian water vole in central Europe. Vector Borne Zoonotic Dis. 12: Schlegel M., Ali H.S., Stieger N., Groschup M.H., Wolf R., Ulrich R.G. (2012b): Molecular identification of small mammal species using novel cytochrome B gene-derived degenerated primers. Biochem. Genet. 50: Schlegel M., Jacob J., Kruger D.H., Rang A., Ulrich R.G. (2014): Hantavirus emergence in rodents, insectivores and bats. In: The role of animals in emerging viral diseases, edited by Johnson N., Elsevier, Academic Press, 364 s. Schmidt B., Schaub M., Steinfartz S. (2007): Apparent survival of the salamander Salamandra salamandra is low because of high migratory activity. Frontiers in Zoology. 4: 19. Schmidt S., Essbauer S.S., Mayer-Scholl A., Poppert S., Schmidt-Chanasit J., Klempa B., Henning K., Schares G., Groschup M.H., Spitzenberger F., Richter D., Heckel G., Ulrich R.G. (2014): Multiple infections of rodents with zoonotic pathogens in Austria. Vector Borne Zoonotic Dis. 14: Schmidt S., Saxenhofer M., Drewes S., Schlegel M., Wanka K.M., Frank R., Klimpel S., von Blackenhagen F., Maaz D., Herden C., Freise J., Wolf R., Stubbe M., Borkenhagen P., Ansorge H., Eccard J.A., Lang J., Jourdain E., Jacob J., Marianneau P., Heckel G., Ulrich R.G. (2016): High genetic structuring of Tula hantavirus. Arch. Virol. 161: Schmidt-Chanasit J., Essbauer S., Petraityte R., Yoshimatsu K., Tackmann K., Conraths F.J., Sasnauskas K., Arikawa J., Thomas A., Pfeffer M., Scharninghausen J.J., Splettstoesser W., Wenk M., Heckel G., Ulrich R.G. (2010): Extensive host sharing of central European Tula virus. J. Virol. 84:
119 Schultze D., Lundkvist A., Blauenstein U., Heyman P. (2002): Tula virus infection associated with fever and exanthema after a wild rodent bite. Eur. J. Clin. Microbio. Infect. Dis. 21: Sibold C., Sparr S., Schulz A., Labuda M., Kozuch O., Lysý J., Kruger D.H., Meisel H. (1995): Genetic characterization of a new hantavirus detected in Microtus arvalis from Slovakia. Virus Genes. 10: Sibold C., Ulrich R., Labuda M., Lundkvist A., Martens H., Schutt M., Gerke P., Leitmeyer K., Meisel H., Kruger D.H. (2001): Dobrava hantavirus causes hemorrhagic fever with renal syndrome in central Europe and is carried by two different Apodemus mice species. J. Med. Virol. 63: Singh S., Mohanty A., Joshi Y.K., Deka D., Mohanty S., Panda S.K. (2003): Mother-to-child transmission of hepatitis E virus infection. Indian. J. Pediatr. 70: Sirbu A., Ceianu C.S., Panculescu-Gatej R.I., Vazquez A., Tenorio A., Rebreanu R., Niedrig M., Nicolescu G., Pistol A. (2011): Outbreak of West Nile virus infection in humans, Romania, July to October Euro Surveill. 13: pii= Smithburn K.C., Hughes T.P., Burke A.W., Paul J.H. (1940): A neurotropic virus isolated from the blood of a native of Uganda. Am. J. Trop. Med. Hyg. 20: Snapinn K.W., Holmes E.C., Young D.S., Bernard K.A., Kramer L.D., Ebel G.D. (2007): Declining growth rate of West Nile virus in North America. J. Virol. 81: Song J.W., Gligic A., Yanagihara R. (2002): Identification of Tula hantavirus in Pitymys subterraneus captured in the Cacak region of Serbia-Yugoslavia. Int. J. Infect. Dis. 6: Song J.W., Beak L.J., Song K.J., Skrok A. (2004): Characterization of Tula virus from common voles (Microtus arvalis) in Poland: Evidence for geographic-specific phylogenetic clustering. Virus Genes. 29: Song J.W., Gu S.H., Bennett S.N., Arai S., Puorger M., Hilbe M., Yanagihara R. (2007a): Seewis virus, a genetically distinct hantavirus in the Eurasian common shrew (Sorex araneus). Virol. J. 4: Song J.W., Kang H.J., Song K.J., Truong T.T., Bennett S.N., Arai S., Truong N.U., Yanagihara R. (2007b): Newfound hantavirus in Chinese mole shrew, Vietnam. Emerg. Infect. Dis. 13: Stamenkovic G., Nikolic V., Blagojevic J., Bugarski-Stanojevic V., Adnadevic T., Stanojevic M., Vujosevic M. (2015): Genetic analysis of Dobrava-Belgrade virus from western Serbia a newly detected focus in the Balkan Peninsula. Zoonoses Public Health. 62: Stanojevic M., Nikolic V., Stajkovic N., Stamenkovic G., Bozovic B., Cekanac R., Marusic P., Gligic A. (2015): Genetic detection of Dobrava-Belgrade hantavirus in the edible dormouse (Glis glis) in central Serbia. Epidemiol. Infect. 143: Steinmetz H.W., Bakonyi T., Weissenböck H., Hatt J.M., Eulenberger U., Robert N., Hoop R., Nowotny N. (2011): Emergence and establishment of Usutu virus infection in wild and captive avian species in and around Zurich, Switzerland genomic and pathologic comparison to other central European outbreaks. Vet. Microbiol. 148: Straková P., Kříž B., Rudolf I., Hubálek Z. (2014): Seroprevalence study of hepatitis E virus infection in two districts of the Czech Republic. Epidemiol. Mikrobiol. Imunol. 63: Succo T., Leparc-Goffart I., Ferré J., Roiz D., Broche B., Maquart M., Noel H., Catelinois O., Entezam F., Caire D., Jourdain F., Esteve-Moussion I., Cochet A., Paupy C., Rousseau C., Paty M., Golliot F. (2016): Autochthonous Dengue outbreak in Nimes, South of France, july to september Euro Surveill. 21: pii= Sumibcay L., Kadjo B., Gu S.H., Kang H.J., Lim B.K., Cook J.A., Song J.W., Yanagihara R. (2012): Divergent lineage of a novel hantavirus in the banana pipistrelle (Neoromicia nanus) in Côte d Ivoire. Virol. J. 9: Šebesta O., Halouzka J., Hubálek Z., Juricova Z., Rudolf I., Sikutova S., Svobodova P., Reiter P. (2010): Mosquito (Diptera: Culicidae) fauna in an area endemic for West Nile virus. J. Vector. Ecol. 35: Tamada Y., Yano K., Yatsuhashi H., Inoue O., Mawatari F., Ishibashi H. (2004): Consumption of wild boar linked to cases of hepatitis E. J. Hepatol. 40:
120 Taylor L.H., Latham S.M., Woolhouse M.E. (2001): Risk factors for human disease emergence. Philos. Trans. R. Soc. Lond. B. Biol. Sci. Rev. 84: Tei S., Kitajima N., Takahashi K., Mishiro S. (2003): Zoonotic transmission of hepatitis E virus from deer to human beings. Lancet. 362: Teshale E.H., Grytdal S.P., Howard C., Barry V., Kamili S., Drobeniuc J., Hill V.R., Okware S., Hu D.J., Holmberg S.D. (2010): Evidence of person-to-person transmission of hepatitis E virus during a large outbreak in Northern Uganda. Clin. Infect. Dis. 50: Tersago K., Verhagen R., Servais A., Heyman P., Ducoffre G., Leirs H. (2009): Hantavirus disease (nephropathia epidemica) in Belgium: effects of tree seed production and climate. Epidemiol. Infect. 137: Těšíková J., Bryjová A., Bryja J., Lavrenchenko L.A., Gouy de Bellocq J. (2017): Hantavirus strains in East Africa related to Western african hantaviruses. Vector Borne Zoonotic Dis. 17: Thiry D., Mauroy A., Saegerman C., Licoppe A., Fett T., Thomas I., Brochier B., Thiry E., Linden A. (2015): Belgian wildlife as potential zoonotic reservoir of hepatitis E virus. Transbound. Emerg. Dis. Ahead of print. Tsai T.F., Popovici F., Cernescu C., Campbell G.L., Nedelcu N.L. (1998): West Nile encephalitis epidemic in southeastern Romania. Lancet. 352: Turell M.J., Dohm D.J., Sardelis M.R., Oquinn M.L., Andreadis T.G., Blow J.A. (2005): An update on the potential of north American mosquitoes (Diptera: Culicidae) to transmit West Nile virus. J. Med. Entomol. 42: Ulrich R., Meisel H., Schutt M., Schmidt J., Kunz A., Klempa B., Niedrig M., Pauli G., Kruger D.H., Koch J. (2004): Prevalence of hantavirus infections in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 47: UN (2010): Population division, Concise report on the World population situation in Dostupné na: Van der Poel W.H., Verschoor F., van der Heide R., Herrera M.I., Vivo A., Kooreman M., de Roda Husman A.M. (2001): Hepatitis E virus sequences in swine related to sequences in humans, the Netherlands. Emerg. Infect. Dis. 7: Vapalahti O., Lundkvist A., Kukkonen S.K.J., Cheng Y., Gilljam M., Kanerva M., Manni T., Pejčoch M., Niemimaa J., Kaikusalo A., Hettonen H., Vaheri A., Plyusnin A. (1996): Isolation and characterization of Tula virus, a distinct serotype in the genus Hantavirus, family Bunyaviridae. J. Gen. Virol. 77: Vapalahti O., Lundkvist A., Fedorov V., Conroy C.J., Hirvonen S., Plyusnina A., Nemirov K., Fredga K., Cook J.A., Niemimaa J., Kaikusalo A., Henttonen H., Vaheri A., Plyusnin A. (1999): Isolation and characterization of a hantavirus from Lemmus sibiricus: evidence for host switch during hantavirus evolution. J. Virol. 73: Vašíčková P., Dvorská L., Lorancová A. (2005): Viruses as a cause of foodborne diseases: a review of the literature. Vet. Med. 50: Vašíčková P., Psikal I., Widen F., Smitalova R., Bendova J., Pavlík I., Králík P. (2009): Detection and genetic characterization of hepatitis E virus in Czech pig production herds. Res. Vet. Sci. 87: Vašíčková P., Králík P., Slana I., Pavlík I. (2012): Optimisation of a triplex real time RT-PCR for detection of hepatitis E virus RNA and validation on biological samples. J. Virol. Methods. 180: Vázquez A., Ruiz S., Herrero L., Moreno J., Molero F., Magallanes A., Sánchez-Seco M.P., Figuerola J., Tenorio A. (2011): West Nile and Usutu viruses in mosquitoes in Spain, Am. J. Trop. Med. Hyg. 85: Vollmer T., Diekmann J., Johne R., Eberhardt M., Knabbe C., Dreier J. (2012): Novel approach for detection of hepatitis E virus infection in German blood donors. J. Clin. Microbiol. 50: Vilibic-Cavlek T., Kaic B., Barbic L., Pem-Novosel I., Slavic-Vrzic V., Lesnikar V., Kurecic-Filipovic S., Babic-Erceg A., Listes E., Stevanovic V., Gjenero-Margan I., Savini G. (2014): First evidence of simultaneous occurrence of West Nile virus and Usutu virus neuroinvasive disease in humans in Croatia during the 2013 outbreak. Infection. 42:
121 Votava M. (2005): Lékařská mikrobiologie obecná. Neptun, 351 s. Vrbovská V., Chalupa P., Straková P., Hubálek Z., Rudolf I. (2015): Onemocnění člověka způsobená hantaviry stále opomíjené zoonózy? Epidemiol. Mikrobiol. Imunol. 64: Wang L. F. (2011): Discovering novel zoonotic viruses. N. S. W. Public Health Bull. 22: Warrell M. (2010): Rabies and African bat lyssavirus encephalitis and its prevention. Int. J. Antimicrob. Agents. 36: S Weber de Melo V., Ali H.S., Freise J., Kuhnert D., Essbauer S., Mertens M., Wanka K.M., Drewes S., Ulrich R.G., Heckel G. (2015): Spatiotemporal dynamics of Puumala hantavirus associated with its rodent host, Myodes glareolus. Evol. Appl. 8: Weger S., Elkin B., Lindsay R., Bollinger T., Crichton V., Andonov A. (2016): Hepatitis E virus seroprevalence in free-ranging deer in Canada. Transbound. Emerg. Dis. Ahead of print. Weidmann M., Schmidt P., Vackova M., Krivanec K., Munclinger P., Hufert F.T. (2005): Identification of genetic evidence for dobrava virus spillover in rodents by nested reverse transcription (RT)-PCR and TaqMan RT-PCR. J. Clin. Microb. 43: Weiss S., Witkowski P.T., Auste B., Nowak K., Weber N., Fahr J., Mombouli J.V., Wolfe N.D., Drexler J.F., Drosten C., Klempa B., Leendertz F.H., Kruger D.H. (2012): Hantavirus in bat, Sierra Leone. Emerg. Infect. Dis. 18: Weissenböck J., Kolodziejek J., Url A. (2001): Emergence of Usutu virus, an African mosquito-borne flavivirus of the Japanese ecephalitis virus group, central Europe. Emerg. Infect. Dis. 8: Weissenböck H., Kolodziejek J., Url A., Lussy H., Rebel-Bauder B., Nowotny N. (2002): Emergence of Usutu virus, an African mosquito-borne flavivirus of the Japanese encephalitis virus group, central Europe. Emerg. Infect. Dis. 8: Weissenböck H., Kolodziejek J., Fragner K., Kuhn R., Pfeffer M., Nowotny N. (2003): Usutu virus activity in Austria, Microbes Infect. 5: Weissenböck H., Bakonyi T., Rossi G., Mani P., Nowotny N. (2013): Usutu virus, Italy, Emerg. Infect. Dis. 19: Wenzel J.J., Preiss J., Schemmerer M., Huber B., Plentz A., Jilg W. (2011): Detection of hepatitis E virus (HEV) from porcine livers in Southeastern Germany and high sequence homology to human HEV isolates. J. Clin. Virol. 52: WHO (1983): International health regulations, 3rd ed., Ženeva, WHO. Dostupné na: WHO (2010): Influenza and other emerging zoonotic diseases at the human-animal interface. FAO/OIE/WHO Joint Scientific Consultation, Italy. Dostupné na: Witkowski P.T., Klempa B., Ithete N.L., Auste B., Mfune J.K., Hoveka J., Matthee S., Preiser W., Kruger D.H. (2014): Hantaviruses in Africa. Virus Res. 187: Witkowski P.T., Drexler J.F., Kallies R., Ličková M., Bokorová S., Mananga G.D., Szemes T., Leroy E.M., Kruger D.H., Drosten C., Klempa B. (2016): Phylogenetic analysis of a newfound bat-borne hantavirus supporst a laurasiatherian host association for ancestral mammalian hantaviruses. Infect. Gent. Evol. 41: Wojcik-Fatla A., Zajac V., Knap J.P., Sroka J., Cisak E., Sawczyn A., Dutkiewicz J. (2013): A small-scale survey of hantavirus in mammals from eastern Poland. Ann. Agric. Environ. Med. 20: Wolfe N.D., Daszak P., Kilpatrick A.M., Burke D.S. (2005): Bushmeat hunting, deforestation, and prediction of zoonotic disease emergence. Emerg. Infect. Dis. 11: Woodall J.P. (1964): The viruses isolated from arthropods at the East African virus research institute in the 26 years ending December Proc. E. Afr. Acad. 2: Xu L., Wu J., He B., Qin S., Xia L., Qin M., Li N., Tu C. (2015): Novel hantavirus identified in blackbearded tomb bats, China. Infect. Genet. Evol. 31:
122 Yamamoto T., Suzuki H., Toyota T., Takahashi M., Okamoto H. (2004): Three male patients with sporadic acute hepatitis E in Sendai, Japan, who were domestically infected with hepatitis E virus of genotype III or IV. J. Gastroenterol. 39: Yanagihara R., Gu S.H., Song J.W. (2015): Expanded host diversity and global distribution of hantaviruses: implications for identifying and investigating previously unrecognized hantaviral diseases. In: Global Virology I Identifying and Investigating Viral Diseases, edited by Shapshak et al., Springer New York, 840 s. Yazaki Y., Mizuo H., Takahashi M., Nishizawa T., Sasaki N., Gotanda Y., Okamoto H. (2003): Sporadic acute or fulminant hepatitis E in Hokkaido, Japan, may be food-borne, as suggested by the presence of hepatitis E virus in pig liver as food. J. Gen. Virol. 84: Zaki S.R., Greer P.W., Coffield L.M., Goldsmith C.S., Nolte K.B., Foucar K., Feddersen R.M., Zumwalt R.E., Miller G.L., Khan A.S., Rollin P.E., Ksiazek T.G., Nichol S.T., Mahy B.W.J., Peters C.J. (1995): Hantavirus pulmonary syndrome. Pathogenesis of an emerging infectious disease. Am. J. Pathol. 146: Zelená H., Janouška J. (2009): Serological characteristics of hantaviruses from clinical specimens analyzed in in the Department of Virology, Public Health Institute, Ostrava. Epidemiol. Mikrobiol. Immunol. 58: Zelená H., Zvolánková V., Zuchnická J. (2011): Hantavirus infection during a stay in a mountain hut in northern Slovakia. J. Med. Virol. 83: Zelená H., Mrázek J., Kuhn T. (2013): Tula hantavirus infection in immunocompromised host, Czech Republic. Emerg. Infect. Dis. 19: Zeller H.G., Schuffenecker I. (2004): West Nile virus. An overview of its spread in Europe and the Mediterranean basin in contrast to its spread in the Americas. Eur. J. Clin. Microbiol. Infect. Dis. 23: Zhang Y.Z. (2014): Discovery of hantaviruses in bats and insectivores and the evolution of the genus Hantavirus. Virus. Res. 187: Ziegler U., Fast C., Eiden M., Bock S., Schulze C., Hoeper D., Ochs A., Schlieben P., Keller M., Zielke D.E., Luehken R., Cadar D., Walther D., Schmidt-Chanasit J., Groschup M.H. (2016): Evidence for an independent third Usutu virus introduction into Germany. Vet. Microbiol. 192: Zoller L., Faulde M., Meisel H., Ruh B., Kimmig P., Schelling U., Zeier M., Kulzer P., Becker C., Roggendorf M. (1995): Seroprevalence of hentavirus antibodies in Germany as determined by a new recombinant enzyme immunoassay. Eur. J. Clin. Microbiol. Infect. Dis. 14: Zou Y., Wang J.B., Gaowa H.S., Yao L.S., Hu G.W., Li M.H., Chen H.X., Plyusnin A., Shao R., Zhang Y.Z. (2008): Isolation and genetic characterization of hantaviruses carried by Microtus voles in China. J. Med. Virol. 80:
123 7 Příloha tabulky 7.1 Hantaviry Komentovaná práce 1 +2 Tab. I: Postup metody in-house ELISA. Postup byl shodný při detekci protilátek proti DOBV, PUUV a TULV. Postup in-house ELISA Antigen naředíme v pufru 1 (2 µl/ml), Pufr 1 slouží i jako negativní kontrola 1. potažení pevné fáze Pipetujeme 100 µl do jamky Inkubace 1 hod/ 37 C Destičku oklepeme (nepromývat)! Pipetujeme 200 µl pufru 2 do jamky 2. Blokování Inkubace 1 hod při pokojové teplotě Destičku oklepeme (nepromývat)! Naředíme sérum 1:10 v pufru 3 3. Přidání séra Pipetujeme 100 µl do příslušné jamky Inkubace 1 hod/ 37 C Destičku oklepeme a promyjeme 3x250 µl Anti-myší-IgG-HRP naředíme 1:3000 v pufru 3 4. Přidání konjugátu Pipetujeme 100 µl do jamky Inkubace 1 hod/ 37 C Destičku oklepeme a promyjeme 3x250 µl Připravíme substrát TMB: 9 ml roztoku A + 5. Přidání substrátu 1 ml roztoku B (Bio-Rad) Pipetujeme 100 µl do jamky Inkubace 10 min při pokojové teplotě ve tmě 5. Zastavení reakce Pipetujeme 100 µl kyseliny sírové 6. Měření OD při 450 nm 135
124 Tab. II: Počet vyšetřených hlodavců v roce 2014 (Myodes norník, Microtus hraboš, Sorex rejsek, Apodemus myšice). Dodělávky vzorky dodané později. Tab. III: Počet vyšetřených hlodavců v roce 2015 (Myodes norník, Microtus hraboš, Apodemus myšice). 136
125 Tab. IV: Množství reagencií pro přípravu mastermixu při molekulárním testování hantavirů. Ultra PCR voda 6,8 2xRXN pufr 12,5 HAN-L-F1 1 HAN-L-R1 1 MgSO4 0,2 TaqSSIII 1 22,5 µl + 2,5 µl RNA Tab. V: Obecný program cykleru pro RT-PCR reakci na detekci hantavirů. V případě detekce různých hantavirů se v programu mění pouze annealing teplota. 50 C/ 45 min 94 C/ 2 min 94 C/ 30s 51,2 C/ 30 s 68 C/ 1 min opakovat krok x 68 C/ 10 min 4 C Tab. VI: Matice podobnosti sekvencí pro RT-PCR pozitivní zvířata z Francie. 2 z nich jsou identické (KS16/653 a KS16/654). Vlevo dole pod diagonálou nukleotidová podobnost, vpravo nahoře aminokyselinová podobnost. Sequence identity matrix KS16/652_France KS16/653_France KS16/654_France KS16/655_France KS16/652_France ID 95,3 95,3 96,5 KS16/653_France 95,3 ID 1 98,7 KS16/654_France 95,3 1 ID 98,7 KS16/655_France 97,5 97,7 97,7 ID 137
126 Tab. VII: Matice sekvenční podobnosti sekvencí pro RT-PCR pozitivní hraboše z Německa. Vlevo dole nukleotidová podobnost, vpravo nahoře aminokyselinová podobnost. Sequence identity matrix KS14/367 KS15/96 KS15/102 KS15/135 KS15/144 KS15/150 KS15/151 KS15/159 KS15/161 KS15/164 KS15/165 KS15/166 KS15/167 KS15/170 KS15/255 KS14/367_GER ID 94,8 94,8 94,0 94,0 94,0 94,0 87,3 88,0 87,6 88,0 88,5 87,6 87,6 93,6 KS15/96_GER 93,3 ID 99,1 97,8 97,8 97,8 97,8 91,1 91,9 91,4 91,9 88,5 91,4 91,4 95,3 KS15/102_GER 93,4 99,4 ID 97,4 97,4 97,4 97,4 90,7 91,4 91,0 91,4 88,5 91,0 91,0 95,3 KS15/135_GER 93,4 98,0 97,8 ID 100,0 100,0 100,0 93,2 94,0 93,5 94,0 88,8 93,5 93,5 94,9 KS15/144_GER 85,7 88,9 88,7 90,1 ID 100,0 100,0 93,2 94,0 93,5 94,0 88,8 93,5 93,5 94,9 KS15/150_GER 85,0 88,2 88,0 89,4 99,1 ID 100,0 93,2 94,0 93,5 94,0 88,8 93,5 93,5 94,9 KS15/151_GER 85,6 89,0 88,9 90,3 99,8 99,0 ID 93,2 94,0 93,5 94,0 88,8 93,5 93,5 94,9 KS15/159_GER 77,5 79,5 79,2 80,6 81,6 81,3 81,7 ID 99,1 98,7 99,1 94,0 98,7 98,7 88,3 KS15/161_GER 78,6 80,6 80,6 81,9 83,3 82,7 83,3 97,5 ID 99,5 100,0 94,8 99,5 99,5 89,0 KS15/164_GER 78,4 80,1 80,1 81,4 81,6 81,3 81,6 95,6 95,9 ID 99,5 95,2 100,0 100,0 88,6 KS15/165_GER 78,6 80,6 80,6 81,9 83,3 82,7 83,3 97,4 99,8 95,8 ID 94,8 99,5 99,5 89,0 KS15/166_GER 80,5 78,6 78,6 78,9 79,6 79,0 79,6 92,3 92,8 95,5 92,7 ID 95,2 95,2 86,5 KS15/167_GER 78,4 79,9 79,9 81,3 81,7 81,1 81,7 95,7 96,4 99,1 96,2 96,4 ID 100,0 88,6 KS15/170_GER 78,3 79,8 79,8 81,1 81,6 81,0 81,6 95,6 96,2 98,9 96,1 96,2 99,8 ID 88,6 KS15/255_GER 93,2 96,6 96,7 96,7 87,4 86,7 87,5 77,9 79,1 78,7 79,1 78,2 78,5 78,4 ID 138
127 Komentovaná práce 3 Tab. VIII: Matice podobnosti sekvencí z pozitivních myšic. Sekvenci pro vzorek KS16/851 jsme i přes opakování sekvenace nezískali. Vlevo dole nukleotidová podobnost, vpravo nahoře aminokyselinová podobnost. Sequence Identity Matrix KS10_1206 KS11_1005 KS11_1010 KS11_1020 KS11_1028 KS11_2202 KS11_2215 KS11_2221 KS12_318 KS13_119 KS16_858 KS10_1206_Treben ID 91% 94% 94% 94% 91% 81% 93% 93% 93% 93% KS11_1005_Bendelin 80% ID 94% 96% 96% 88% 78% 94% 92% 94% 98% KS11_1010_Bendelin 82% 94% ID 96% 96% 92% 81% 94% 95% 94% 92% KS11_1020_Bendelin 83% 97% 97% ID 100% 91% 81% 98% 95% 98% 95% KS11_1028_Bendelin 83% 97% 97% 100% ID 91% 81% 98% 95% 98% 95% KS11_2202_Horst 81% 84% 86% 87% 87% ID 83% 93% 92% 93% 88% KS11_2215_Horst 75% 75% 78% 78% 78% 87% ID 83% 81% 83% 78% KS11_2221_Horst 82% 87% 87% 89% 89% 97% 86% ID 96% 100% 94% KS12_318_Jasnitz 82% 83% 86% 86% 86% 87% 79% 89% ID 96% 92% KS13_119_Richtenberg 83% 88% 87% 90% 90% 95% 85% 99% 89% ID 94% KS16_858_Gotha 94% 86% 81% 83% 83% 79% 72% 82% 81% 83% ID 139
128 Tab. IX: Matice podobnosti sekvencí kompletních kódujících sekvencí L segmentu DOBV různých genotypů. I nukleotidová úroveň, II aminokyselinová úroveň. I. II. Treben GRW/Aa SK/Aa DOBV/Ano-Poroia Slo/Af-BER Stamforrad/POR Ap/Sochi/hu Saaremaa-160V TREBEN ID 0,866 0,861 0,855 0,856 0,856 0,829 0,865 JQ Dobrava-Belgrade virus GRW/Aa 0,866 ID 0,867 0,857 0,859 0,859 0,834 0,88 GU Dobrava-Belgrade virus SK/Aa 0,861 0,867 ID 0,859 0,859 0,859 0,83 0,863 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/1999 0,855 0,857 0,859 ID 0,935 0,935 0,836 0,856 GU Dobrava-Belgrade virus Slo/Af-BER 0,856 0,859 0,859 0,935 ID 0,999 0,837 0,854 KT Dobrava-Belgrade virus Stamforrad/POR 0,856 0,859 0,859 0,935 0,999 ID 0,837 0,855 JF Dobrava-Belgrade virus Ap/Sochi/hu 0,829 0,834 0,83 0,836 0,837 0,837 ID 0,84 AJ Saaremaa virus Saaremaa-160V 0,865 0,88 0,863 0,856 0,854 0,855 0,84 ID I. Treben GRW/Aa SK/Aa DOBV/Ano-Poroia Slo/Af-BER Stamforrad/POR Ap/Sochi/hu Saaremaa-160V TREBEN ID 0,972 0,977 0,979 0,979 0,98 0,962 0,974 JQ Dobrava-Belgrade virus GRW/Aa 0,972 ID 0,973 0,975 0,976 0,976 0,959 0,972 GU Dobrava-Belgrade virus SK/Aa 0,977 0,973 ID 0,979 0,979 0,98 0,963 0,973 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/1999 0,979 0,975 0,979 ID 0,991 0,991 0,968 0,976 GU Dobrava-Belgrade virus Slo/Af-BER 0,979 0,976 0,979 0,991 ID 0,999 0,968 0,976 KT Dobrava-Belgrade virus Stamforrad/POR 0,98 0,976 0,98 0,991 0,999 ID 0,969 0,976 JF Dobrava-Belgrade virus Ap/Sochi/hu 0,962 0,959 0,963 0,968 0,968 0,969 ID 0,963 AJ Saaremaa virus Saaremaa-160V 0,974 0,972 0,973 0,976 0,976 0,976 0,963 ID II. 140
129 I. Tab. X: Matice podobnosti sekvencí pro kompletní kódující sekvenci M segmentu DOBV různých genotypů. I nukleotidová úroveň, II aminokyselinová úroveň. Treben GRW/Aa SK/Aa East_Slov akia/862 Aa/97 GER/07/2 93/Aa Aa1854/L ipetsk-02 Treben ID 0,897 0,874 0,874 0,897 0,871 0,834 0,896 0,894 0,901 0,83 0,83 0,83 0,829 0,795 0,793 0,872 JQ _Dobrava-Belgrade_virus_GRW/Aa 0,897 ID 0,867 0,865 0,932 0,873 0,833 0,996 0,916 0,934 0,832 0,822 0,832 0,83 0,8 0,798 0,87 AY _Dobrava_virus_SK/Aa 0,874 0,867 ID 0,982 0,869 0,875 0,825 0,866 0,864 0,873 0,827 0,823 0,827 0,825 0,794 0,792 0,871 AY _Dobrava_virus_East_Slovakia/862Aa/97 0,874 0,865 0,982 ID 0,867 0,873 0,826 0,864 0,864 0,872 0,825 0,824 0,825 0,823 0,793 0,791 0,872 GQ _Dobrava-Belgrade_virus_GER/07/293/Aa 0,897 0,932 0,869 0,867 ID 0,867 0,826 0,932 0,917 0,979 0,829 0,821 0,829 0,828 0,793 0,791 0,868 EU _Dobrava-Belgrade_virus_Aa1854/Lipetsk-02 0,871 0,873 0,875 0,873 0,867 ID 0,836 0,873 0,872 0,871 0,837 0,832 0,837 0,835 0,806 0,804 0,865 AY _Dobrava_virus_East_Slovakia/400Af/98 0,834 0,833 0,825 0,826 0,826 0,836 ID 0,835 0,833 0,832 0,93 0,932 0,93 0,928 0,808 0,806 0,821 GQ _Dobrava-Belgrade_virus_GER/08/131/Af 0,896 0,996 0,866 0,864 0,932 0,873 0,835 ID 0,917 0,935 0,833 0,823 0,833 0,831 0,8 0,799 0,87 GQ _Dobrava-Belgrade_virus_GER/05/477/Af 0,894 0,916 0,864 0,864 0,917 0,872 0,833 0,917 ID 0,919 0,835 0,829 0,835 0,833 0,801 0,799 0,87 GQ _Dobrava-Belgrade_virus_GER/07/607/Af 0,901 0,934 0,873 0,872 0,979 0,871 0,832 0,935 0,919 ID 0,835 0,824 0,835 0,833 0,796 0,795 0,872 GU _Dobrava-Belgrade_virus_Slo/Af-BER 0,83 0,832 0,827 0,825 0,829 0,837 0,93 0,833 0,835 0,835 ID 0, ,997 0,806 0,804 0,823 NC_ _Dobrava_virus_DOBV/Ano-Poroia/Afl9/1999 0,83 0,822 0,823 0,824 0,821 0,832 0,932 0,823 0,829 0,824 0,939 ID 0,939 0,937 0,804 0,802 0,824 KT _Dobrava-Belgrade_virus_Stamforrad/POR_Af 0,83 0,832 0,827 0,825 0,829 0,837 0,93 0,833 0,835 0, ,939 ID 0,997 0,806 0,804 0,823 L33685 HNVDOBMS_Dobrava-Belgrade_virus 0,829 0,83 0,825 0,823 0,828 0,835 0,928 0,831 0,833 0,833 0,997 0,937 0,997 ID 0,804 0,802 0,822 EU _Dobrava-Belgrade_virus_Ap1584/Sochi-01 0,795 0,8 0,794 0,793 0,793 0,806 0,808 0,8 0,801 0,796 0,806 0,804 0,806 0,804 ID 0,994 0,791 JF _Dobrava-Belgrade_virus_Ap/Sochi/hu 0,793 0,798 0,792 0,791 0,791 0,804 0,806 0,799 0,799 0,795 0,804 0,802 0,804 0,802 0,994 ID 0,789 AJ _Dobrava_virus_DOB/Saaremaa/160V 0,872 0,87 0,871 0,872 0,868 0,865 0,821 0,87 0,87 0,872 0,823 0,824 0,823 0,822 0,791 0,789 ID East_Slov akia/400 Af/98 GER/08/1 31/Af GER/05/4 77/Af GER/07/6 07/Af Slo/Af- BER Ano- Poroia/A fl9/1999 Stamforr ad/por_ Af Dobrava Belgrade Ap1584/ Sochi-01 Ap/Sochi /hu DOB/Saa remaa/1 60V 141
130 II. Treben GRW/Aa SK/Aa East_Slov akia/862 Aa/97 GER/07/2 93/Aa Aa1854/L ipetsk-02 Treben ID 0,97 0,96 0,962 0,972 0,967 0,944 0,97 0,971 0,976 0,942 0,94 0,942 0,939 0,909 0,91 0,955 JQ _Dobrava-Belgrade_virus_GRW/Aa 0,97 ID 0,963 0,963 0,98 0,966 0,941 0,996 0,986 0,985 0,941 0,938 0,941 0,938 0,906 0,907 0,959 AY _Dobrava_virus_SK/Aa 0,96 0,963 ID 0,996 0,959 0,969 0,939 0,963 0,961 0,963 0,939 0,935 0,939 0,935 0,904 0,905 0,957 AY _Dobrava_virus_East_Slovakia/862Aa/97 0,962 0,963 0,996 ID 0,961 0,972 0,941 0,963 0,962 0,965 0,941 0,938 0,941 0,938 0,907 0,908 0,961 GQ _Dobrava-Belgrade_virus_GER/07/293/Aa 0,972 0,98 0,959 0,961 ID 0,967 0,94 0,982 0,983 0,991 0,94 0,937 0,94 0,936 0,906 0,907 0,957 EU _Dobrava-Belgrade_virus_Aa1854/Lipetsk-02 0,967 0,966 0,969 0,972 0,967 ID 0,944 0,966 0,967 0,971 0,944 0,941 0,944 0,94 0,914 0,915 0,962 AY _Dobrava_virus_East_Slovakia/400Af/98 0,944 0,941 0,939 0,941 0,94 0,944 ID 0,943 0,945 0,944 0,992 0,99 0,992 0,989 0,938 0,939 0,943 GQ _Dobrava-Belgrade_virus_GER/08/131/Af 0,97 0,996 0,963 0,963 0,982 0,966 0,943 ID 0,988 0,986 0,943 0,94 0,943 0,94 0,908 0,909 0,959 GQ _Dobrava-Belgrade_virus_GER/05/477/Af 0,971 0,986 0,961 0,962 0,983 0,967 0,945 0,988 ID 0,986 0,945 0,942 0,945 0,941 0,909 0,91 0,957 GQ _Dobrava-Belgrade_virus_GER/07/607/Af 0,976 0,985 0,963 0,965 0,991 0,971 0,944 0,986 0,986 ID 0,944 0,941 0,944 0,94 0,91 0,911 0,96 GU _Dobrava-Belgrade_virus_Slo/Af-BER 0,942 0,941 0,939 0,941 0,94 0,944 0,992 0,943 0,945 0,944 ID 0,99 1 0,996 0,937 0,938 0,945 NC_ _Dobrava_virus_DOBV/Ano-Poroia/Afl9/1999 0,94 0,938 0,935 0,938 0,937 0,941 0,99 0,94 0,942 0,941 0,99 ID 0,99 0,986 0,933 0,934 0,941 KT _Dobrava-Belgrade_virus_Stamforrad/POR_Af 0,942 0,941 0,939 0,941 0,94 0,944 0,992 0,943 0,945 0, ,99 ID 0,996 0,937 0,938 0,945 L33685 HNVDOBMS_Dobrava-Belgrade_virus 0,939 0,938 0,935 0,938 0,936 0,94 0,989 0,94 0,941 0,94 0,996 0,986 0,996 ID 0,933 0,934 0,941 EU _Dobrava-Belgrade_virus_Ap1584/Sochi-01 0,909 0,906 0,904 0,907 0,906 0,914 0,938 0,908 0,909 0,91 0,937 0,933 0,937 0,933 ID 0,992 0,903 JF _Dobrava-Belgrade_virus_Ap/Sochi/hu 0,91 0,907 0,905 0,908 0,907 0,915 0,939 0,909 0,91 0,911 0,938 0,934 0,938 0,934 0,992 ID 0,903 AJ _Dobrava_virus_DOB/Saaremaa/160V 0,955 0,959 0,957 0,961 0,957 0,962 0,943 0,959 0,957 0,96 0,945 0,941 0,945 0,941 0,903 0,903 ID East_Slov akia/400 Af/98 GER/08/1 31/Af GER/05/4 77/Af GER/07/6 07/Af Slo/Af- BER Ano- Poroia/A fl9/1999 Stamforr ad/por_ Af Dobrava Belgrade Ap1584/ Sochi-01 Ap/Sochi /hu DOB/Saa remaa/1 60V 142
131 I. Tab. XI: Matice podobnosti sekvencí pro kompletní kódující sekvenci S segmentu DOBV různých genotypů. I nukleotidová úroveň, II aminokyselinová úroveň. Treben GRW/Aa Kurkino/53A a/98 Kurkino/44 Aa/98 Esl/34Aa/0 1 Esl/81Aa/0 1 Esl/29Aa /01 Treben ID 0,917 0,897 0,895 0,891 0,892 0,892 0,89 0,882 0,882 0,894 0,866 0,864 0,864 0,867 0,865 0,863 0,865 0,86 0,86 0,874 0,878 JQ Dobrava-Belgrade virus GRW/Aa 0,917 ID 0,901 0,899 0,894 0,895 0,893 0,893 0,893 0,894 0,896 0,881 0,88 0,882 0,882 0,881 0,884 0,88 0,875 0,877 0,877 0,874 AJ Dobrava virus Kurkino/53Aa/98 0,897 0,901 ID 0,997 0,914 0,915 0,913 0,913 0,904 0,905 0,989 0,876 0,875 0,874 0,881 0,875 0,879 0,879 0,869 0,87 0,877 0,877 AJ Dobrava virus Kurkino/44Aa/98 0,895 0,899 0,997 ID 0,912 0,913 0,911 0,911 0,902 0,903 0,988 0,874 0,873 0,872 0,879 0,873 0,876 0,877 0,867 0,868 0,875 0,875 AY Dobrava virus Esl/34Aa/01 0,891 0,894 0,914 0,912 ID 0,991 0,993 0,999 0,935 0,936 0,914 0,848 0,853 0,86 0,866 0,858 0,864 0,865 0,866 0,865 0,866 0,865 AY Dobrava virus Esl/81Aa/01 0,892 0,895 0,915 0,913 0,991 ID 0,991 0,99 0,933 0,934 0,915 0,851 0,855 0,862 0,869 0,861 0,867 0,868 0,867 0,866 0,867 0,865 AY Dobrava virus Esl/29Aa/01 0,892 0,893 0,913 0,911 0,993 0,991 ID 0,993 0,932 0,933 0,913 0,848 0,853 0,86 0,868 0,859 0,865 0,866 0,867 0,866 0,867 0,865 AY Dobrava virus SK/Aa Slovakia 0,89 0,893 0,913 0,911 0,999 0,99 0,993 ID 0,934 0,935 0,913 0,847 0,852 0,859 0,865 0,857 0,863 0,864 0,865 0,865 0,865 0,864 AJ Dobrava virus East Slovakia-862-Aa 0,882 0,893 0,904 0,902 0,935 0,933 0,932 0,934 ID 0,996 0,902 0,85 0,851 0,857 0,867 0,859 0,865 0,865 0,855 0,857 0,873 0,868 AJ Dobrava virus East Slovakia-856-Aa 0,882 0,894 0,905 0,903 0,936 0,934 0,933 0,935 0,996 ID 0,903 0,851 0,852 0,858 0,867 0,86 0,865 0,865 0,856 0,858 0,874 0,869 EU Dobrava-Belgrade virus Aa1854/Lipetsk-02 0,894 0,896 0,989 0,988 0,914 0,915 0,913 0,913 0,902 0,903 ID 0,871 0,871 0,869 0,877 0,87 0,873 0,875 0,868 0,869 0,871 0,871 AY Dobrava virus East Slovakia/400Af/98 0,866 0,881 0,876 0,874 0,848 0,851 0,848 0,847 0,85 0,851 0,871 ID 0,964 0,957 0,953 0,951 0,95 0,951 0,875 0,875 0,872 0,875 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/1999 0,864 0,88 0,875 0,873 0,853 0,855 0,853 0,852 0,851 0,852 0,871 0,964 ID 0,981 0,962 0,962 0,96 0,96 0,876 0,877 0,876 0,876 AJ Dobrava virus DOBV/Ano-Poroia/13Af/99 0,864 0,882 0,874 0,872 0,86 0,862 0,86 0,859 0,857 0,858 0,869 0,957 0,981 ID 0,964 0,961 0,962 0,962 0,877 0,878 0,871 0,869 KT Dobrava-Belgrade virus Stamforrad/POR 0,867 0,882 0,881 0,879 0,866 0,869 0,868 0,865 0,867 0,867 0,877 0,953 0,962 0,964 ID 0,965 0,987 0,998 0,884 0,884 0,88 0,879 KC Dobrava-Belgrade virus DOBV/Croatia_Zutica/As825/2007 0,865 0,881 0,875 0,873 0,858 0,861 0,859 0,857 0,859 0,86 0,87 0,951 0,962 0,961 0,965 ID 0,965 0,963 0,881 0,882 0,868 0,871 KC Dobrava-Belgrade virus DOBV/Croatia_Gerovo/Af957/2008 0,863 0,884 0,879 0,876 0,864 0,867 0,865 0,863 0,865 0,865 0,873 0,95 0,96 0,962 0,987 0,965 ID 0,986 0,881 0,882 0,876 0,875 L41916 HNVNPSS Dobrava-Belgrade virus 0,865 0,88 0,879 0,877 0,865 0,868 0,866 0,864 0,865 0,865 0,875 0,951 0,96 0,962 0,998 0,963 0,986 ID 0,882 0,882 0,879 0,877 EU Dobrava-Belgrade virus Ap1584/Sochi-01 0,86 0,875 0,869 0,867 0,866 0,867 0,867 0,865 0,855 0,856 0,868 0,875 0,876 0,877 0,884 0,881 0,881 0,882 ID 0,995 0,848 0,848 JF Dobrava-Belgrade virus Ap/Sochi/hu Russia 0,86 0,877 0,87 0,868 0,865 0,866 0,866 0,865 0,857 0,858 0,869 0,875 0,877 0,878 0,884 0,882 0,882 0,882 0,995 ID 0,848 0,848 AJ Dobrava virus Saar/90Aa/97 0,874 0,877 0,877 0,875 0,866 0,867 0,867 0,865 0,873 0,874 0,871 0,872 0,876 0,871 0,88 0,868 0,876 0,879 0,848 0,848 ID 0,982 AJ Dobrava virus DOB/Saaremaa/160V 0,878 0,874 0,877 0,875 0,865 0,865 0,865 0,864 0,868 0,869 0,871 0,875 0,876 0,869 0,879 0,871 0,875 0,877 0,848 0,848 0,982 ID SK/Aa East- Slovakia- 862-Aa East- Slovakia- 856-Aa Aa1854/L ipetsk-02 East- Slovakia/ 400Af/98 Ano- Poroia/A fl9/1999 Ano- Poroia/1 3Af/99 Stamforr ad/por Croatia_Z utica/as8 25/2007 Croatia_ Gerovo/ Af957/20 08 Dobrava- Belgrade Ap1584/ Sochi-01 Ap/Sochi /hu Saar/90A a/97 DOB/Saa remaa/1 60V 143
132 II. Treben GRW/Aa Kurkino/53A a/98 Kurkino/44 Aa/98 Esl/34Aa/0 1 Esl/81Aa/0 1 Esl/29Aa /01 Treben ID 0,983 0,979 0,974 0,988 0,988 0,988 0,986 0,983 0,983 0,979 0,979 0,981 0,981 0,976 0,981 0,981 0,974 0,969 0,972 0,972 0,972 JQ Dobrava-Belgrade virus GRW/Aa 0,983 ID 0,981 0,976 0,99 0,99 0,99 0,988 0,986 0,986 0,981 0,981 0,983 0,983 0,979 0,983 0,983 0,976 0,981 0,983 0,974 0,974 AJ Dobrava virus Kurkino/53Aa/98 0,979 0,981 ID 0,995 0,99 0,99 0,99 0,988 0,986 0,986 0,995 0,972 0,974 0,974 0,969 0,974 0,974 0,967 0,967 0,969 0,96 0,96 AJ Dobrava virus Kurkino/44Aa/98 0,974 0,976 0,995 ID 0,986 0,986 0,986 0,983 0,981 0,981 0,99 0,967 0,969 0,969 0,965 0,969 0,969 0,962 0,962 0,965 0,955 0,955 AY Dobrava virus Esl/34Aa/01 0,988 0,99 0,99 0,986 ID 1 1 0,997 0,995 0,995 0,99 0,981 0,983 0,983 0,979 0,983 0,983 0,976 0,976 0,979 0,969 0,969 AY Dobrava virus Esl/81Aa/01 0,988 0,99 0,99 0,986 1 ID 1 0,997 0,995 0,995 0,99 0,981 0,983 0,983 0,979 0,983 0,983 0,976 0,976 0,979 0,969 0,969 AY Dobrava virus Esl/29Aa/01 0,988 0,99 0,99 0, ID 0,997 0,995 0,995 0,99 0,981 0,983 0,983 0,979 0,983 0,983 0,976 0,976 0,979 0,969 0,969 AY Dobrava virus SK/Aa Slovakia 0,986 0,988 0,988 0,983 0,997 0,997 0,997 ID 0,993 0,993 0,988 0,979 0,981 0,981 0,976 0,981 0,981 0,974 0,974 0,976 0,967 0,967 AJ Dobrava virus East Slovakia-862-Aa 0,983 0,986 0,986 0,981 0,995 0,995 0,995 0,993 ID 0,995 0,986 0,976 0,979 0,979 0,976 0,979 0,979 0,974 0,974 0,974 0,965 0,965 AJ Dobrava virus East Slovakia-856-Aa 0,983 0,986 0,986 0,981 0,995 0,995 0,995 0,993 0,995 ID 0,986 0,976 0,979 0,979 0,976 0,979 0,979 0,974 0,974 0,974 0,965 0,965 EU Dobrava-Belgrade virus Aa1854/Lipetsk-02 0,979 0,981 0,995 0,99 0,99 0,99 0,99 0,988 0,986 0,986 ID 0,972 0,974 0,974 0,969 0,974 0,974 0,967 0,967 0,969 0,96 0,96 AY Dobrava virus East Slovakia/400Af/98 0,979 0,981 0,972 0,967 0,981 0,981 0,981 0,979 0,976 0,976 0,972 ID 0,997 0,997 0,993 0,997 0,997 0,99 0,976 0,979 0,969 0,969 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/1999 0,981 0,983 0,974 0,969 0,983 0,983 0,983 0,981 0,979 0,979 0,974 0,997 ID 1 0, ,993 0,979 0,981 0,972 0,972 AJ Dobrava virus DOBV/Ano-Poroia/13Af/99 0,981 0,983 0,974 0,969 0,983 0,983 0,983 0,981 0,979 0,979 0,974 0,997 1 ID 0, ,993 0,979 0,981 0,972 0,972 KT Dobrava-Belgrade virus Stamforrad/POR 0,976 0,979 0,969 0,965 0,979 0,979 0,979 0,976 0,976 0,976 0,969 0,993 0,995 0,995 ID 0,995 0,995 0,997 0,979 0,976 0,972 0,972 KC Dobrava-Belgrade virus DOBV/Croatia_Zutica/As825/2007 0,981 0,983 0,974 0,969 0,983 0,983 0,983 0,981 0,979 0,979 0,974 0, ,995 ID 1 0,993 0,979 0,981 0,972 0,972 KC Dobrava-Belgrade virus DOBV/Croatia_Gerovo/Af957/2008 0,981 0,983 0,974 0,969 0,983 0,983 0,983 0,981 0,979 0,979 0,974 0, ,995 1 ID 0,993 0,979 0,981 0,972 0,972 L41916 HNVNPSS Dobrava-Belgrade virus 0,974 0,976 0,967 0,962 0,976 0,976 0,976 0,974 0,974 0,974 0,967 0,99 0,993 0,993 0,997 0,993 0,993 ID 0,976 0,974 0,969 0,969 EU Dobrava-Belgrade virus Ap1584/Sochi-01 0,969 0,981 0,967 0,962 0,976 0,976 0,976 0,974 0,974 0,974 0,967 0,976 0,979 0,979 0,979 0,979 0,979 0,976 ID 0,993 0,962 0,962 JF Dobrava-Belgrade virus Ap/Sochi/hu Russia 0,972 0,983 0,969 0,965 0,979 0,979 0,979 0,976 0,974 0,974 0,969 0,979 0,981 0,981 0,976 0,981 0,981 0,974 0,993 ID 0,965 0,965 AJ Dobrava virus Saar/90Aa/97 0,972 0,974 0,96 0,955 0,969 0,969 0,969 0,967 0,965 0,965 0,96 0,969 0,972 0,972 0,972 0,972 0,972 0,969 0,962 0,965 ID 0,995 AJ Dobrava virus DOB/Saaremaa/160V 0,972 0,974 0,96 0,955 0,969 0,969 0,969 0,967 0,965 0,965 0,96 0,969 0,972 0,972 0,972 0,972 0,972 0,969 0,962 0,965 0,995 ID SK/Aa East- Slovakia- 862-Aa East- Slovakia- 856-Aa Aa1854/L ipetsk-02 East- Slovakia/ 400Af/98 Ano- Poroia/A fl9/1999 Ano- Poroia/1 3Af/99 Stamforr ad/por Croatia_Z utica/as8 25/2007 Croatia_ Gerovo/ Af957/20 08 Dobrava- Belgrade Ap1584/ Sochi-01 Ap/Sochi /hu Saar/90A a/97 DOB/Saa remaa/1 60V 144
133 Tab. XII: Párová distanční analýza pro S segment Treben. Vlevo dole aminokyselinová úroveň, vpravo nahoře nukleotidová úroveň. Treben 91,705 89,767 89,535 89,147 89,225 89,225 89,070 88,217 88,295 89,457 86,667 86,434 86,434 86,744 86,589 86,357 86,589 86,047 86,047 87,442 87,829 JQ Dobrava-Belgrade virus GRW/Aa 98,368 90,155 89,922 89,457 89,535 89,380 89,380 89,380 89,457 89,690 88,140 88,062 88,217 88,217 88,140 88,450 88,062 87,597 87,752 87,752 87,442 AJ Dobrava virus Kurkino/53Aa/98 97,902 98,135 99,767 91,473 91,550 91,395 91,395 90,465 90,543 98,915 87,674 87,597 87,442 88,140 87,597 87,907 87,984 86,977 87,054 87,752 87,752 AJ Dobrava virus Kurkino/44Aa/98 97,436 97,669 99,534 91,240 91,318 91,163 91,163 90,233 90,310 98,837 87,442 87,364 87,209 87,907 87,364 87,674 87,752 86,744 86,822 87,519 87,519 AY Dobrava virus Esl/34Aa/01 98,834 99,068 99,068 98,601 99,147 99,380 99,922 93,566 93,643 91,473 84,806 85,349 86,047 86,667 85,814 86,434 86,512 86,667 86,589 86,667 86,512 AY Dobrava virus Esl/81Aa/01 98,834 99,068 99,068 98, ,000 99,147 99,070 93,333 93,411 91,550 85,116 85,504 86,202 86,977 86,124 86,744 86,822 86,744 86,667 86,744 86,589 AY Dobrava virus Esl/29Aa/01 98,834 99,068 99,068 98, , ,000 99,302 93,256 93,333 91,395 84,806 85,349 86,047 86,822 85,969 86,589 86,667 86,744 86,667 86,744 86,589 AY Dobrava virus SK/Aa Slovakia 98,601 98,834 98,834 98,368 99,767 99,767 99,767 93,488 93,566 91,395 84,729 85,271 85,969 86,589 85,736 86,357 86,434 86,589 86,512 86,589 86,434 AJ Dobrava virus East Slovakia-862-Aa 98,368 98,601 98,601 98,135 99,534 99,534 99,534 99,301 99,612 90,233 85,039 85,194 85,736 86,744 85,969 86,589 86,589 85,581 85,736 87,364 86,899 AJ Dobrava virus East Slovakia-856-Aa 98,368 98,601 98,601 98,135 99,534 99,534 99,534 99,301 99,534 90,310 85,116 85,271 85,814 86,744 86,047 86,589 86,589 85,659 85,814 87,442 86,977 EU Dobrava-Belgrade virus Aa1854/Lipetsk-02 97,902 98,135 99,534 99,068 99,068 99,068 99,068 98,834 98,601 98,601 87,132 87,132 86,977 87,752 87,054 87,364 87,597 86,899 86,977 87,132 87,132 AY Dobrava virus East Slovakia/400Af/98 97,902 98,135 97,203 96,737 98,135 98,135 98,135 97,902 97,669 97,669 97,203 96,434 95,736 95,349 95,116 95,039 95,194 87,519 87,597 87,287 87,519 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/ ,135 98,368 97,436 96,970 98,368 98,368 98,368 98,135 97,902 97,902 97,436 99,767 98,140 96,202 96,202 96,047 96,047 87,674 87,752 87,674 87,674 AJ Dobrava virus DOBV/Ano-Poroia/13Af/99 98,135 98,368 97,436 96,970 98,368 98,368 98,368 98,135 97,902 97,902 97,436 99, ,000 96,434 96,124 96,279 96,279 87,752 87,829 87,132 86,977 KT Dobrava-Belgrade virus Stamforrad/POR 97,669 97,902 96,970 96,503 97,902 97,902 97,902 97,669 97,669 97,669 96,970 99,301 99,534 99,534 96,512 98,760 99,845 88,450 88,450 88,062 87,907 KC Dobrava-Belgrade virus DOBV/Croatia_Zutica/As825/ ,135 98,368 97,436 96,970 98,368 98,368 98,368 98,135 97,902 97,902 97,436 99, , ,000 99,534 96,512 96,357 88,140 88,217 86,822 87,132 KC Dobrava-Belgrade virus DOBV/Croatia_Gerovo/Af957/ ,135 98,368 97,436 96,970 98,368 98,368 98,368 98,135 97,902 97,902 97,436 99, , ,000 99, ,000 98,605 88,140 88,217 87,674 87,519 L41916 HNVNPSS Dobrava-Belgrade virus 97,436 97,669 96,737 96,270 97,669 97,669 97,669 97,436 97,436 97,436 96,737 99,068 99,301 99,301 99,767 99,301 99,301 88,295 88,295 87,907 87,752 EU Dobrava-Belgrade virus Ap1584/Sochi-01 96,970 98,135 96,737 96,270 97,669 97,669 97,669 97,436 97,436 97,436 96,737 97,669 97,902 97,902 97,902 97,902 97,902 97,669 99,535 84,806 84,884 JF Dobrava-Belgrade virus Ap/Sochi/hu Russia 97,203 98,368 96,970 96,503 97,902 97,902 97,902 97,669 97,436 97,436 96,970 97,902 98,135 98,135 97,669 98,135 98,135 97,436 99,301 84,806 84,884 AJ Dobrava virus Saar/90Aa/97 97,203 97,436 96,037 95,571 96,970 96,970 96,970 96,737 96,503 96,503 96,037 96,970 97,203 97,203 97,203 97,203 97,203 96,970 96,270 96,503 98,295 AJ Dobrava virus DOB/Saaremaa/160V 97,203 97,436 96,037 95,571 96,970 96,970 96,970 96,737 96,503 96,503 96,037 96,970 97,203 97,203 97,203 97,203 97,203 96,970 96,270 96,503 99,
134 Tab. XIII: Párová distanční analýza pro M segment Treben. Vlevo dole aminokyselinová úroveň, vpravo nahoře nukleotidová úroveň. 146
135 Tab. XIV: Párová distanční analýza pro L segment Treben. Vlevo dole aminokyselinová úroveň, vpravo nahoře nukleotidová úroveň. TREBEN 86,843 86,299 85,679 85,741 85,756 83,010 86,641 JQ Dobrava-Belgrade virus GRW/Aa 97,621 86,843 85,865 86,036 86,082 83,507 88,115 GU Dobrava-Belgrade virus SK/Aa 97,808 97,621 86,005 85,958 86,005 83,088 86,362 NC_ Dobrava virus DOBV/Ano-Poroia/Afl9/ ,041 97,808 97,948 93,530 93,576 83,677 85,694 GU Dobrava-Belgrade virus Slo/Af-BER 98,041 97,901 97,948 99, ,953 83,817 85,508 KT Dobrava-Belgrade virus Stamforrad/POR 98,088 97,948 97,994 99,207 99,953 83,832 85,555 JF Dobrava-Belgrade virus Ap/Sochi/hu 96,315 96,175 96,315 96,922 96,875 96,922 84,034 AJ Saaremaa virus Saaremaa-160V 97,528 97,528 97,388 97,715 97,621 97,668 96,362 Obr. XV: Sliding-window analýza pro kompletní kódující sekvence S segmentu DOBV. 147
136 Obr. XVI: Sliding-window analýza pro kompletní kódující sekvence M segmentu DOBV. Obr. XVII: Sliding-window analýza pro kompletní kódující sekvence L segmentu DOBV. 148
137 Komentovaná práce 5 Tab. XVIII: Párová distanční analýza pro kompletní kódující sekvence S segmentu PUUV z Litvy (LT15/164, 174, 201), Lotyšska (LAT), Ruska (RUS), Finska (FIN), severní Skandinávie (N-SCA), jižní Skandinávie (S-SCA), střední Evropy (CE), Dánska (DAN) a alpinské (ALAD) (označení sekvencí dle Castel a kol. 2015). Vpravo nahoře nukleotidová podobnost, vlevo dole aminokyselinová podobnost. Komentovaná práce 6 Tab. XIX: Matice sekvenční podobnosti pro kompletní kódující sekvenci S segmentu. New náš nově detekovaný hantavirus u hraboše hospodárného. Vpravo nahoře aminokyselinová podobnost, vlevo dole nukleotidová podobnost. New Topografov Khabarovsk Yakeshi Vladivostok Fusong Kamiiso Isla vista Lodz Tula New virus 0,88 0,87 0,59 0,8 0,85 0,86 0,81 0,79 0,79 Topografov virus 0,79 0,95 0,59 0,83 0,86 0,88 0,82 0,8 0,81 Khabarovsk virus 0,77 0,82 0,6 0,82 0,85 0,87 0,81 0,79 0,8 Yakeshi virus 0,62 0,62 0,62 0,53 0,58 0,59 0,57 0,57 0,57 Vladivostok virus 0,71 0,73 0,74 0,55 0,78 0,79 0,76 0,74 0,74 Puumala virus Fusong 0,76 0,79 0,78 0,62 0,7 0,95 0,79 0,78 0,77 Puumala virus Kamiiso 0,78 0,76 0,76 0,62 0,71 0,83 0,81 0,8 0,8 Isla vista virus 0,75 0,75 0,75 0,6 0,69 0,74 0,74 0,84 0,84 Hantavirus Lodz 0,74 0,73 0,74 0,61 0,69 0,73 0,72 0,77 0,97 Tula virus 0,75 0,73 0,74 0,6 0,68 0,72 0,72 0,76 0,85 149
138 Komentovaná práce 7 Tab. XX: Nukleotidová a aminokyselinová sekvenční identita (%) všech tří segment mezi BRNV a dalšími netopýří, kmyzožravčími a hlodavčími hantaviry. S segment/n M segment/gpc L segment/rdrp Hostitel Hantavirus Země 1272 nt 424 aa 3411 nt 1137 aa 6435 nt 2145 aa Longquan virus Čína * 80.5* Laibin virus Čína Huangpi virus Čína 65.6* 64* * 81.7* Xuan Son virus Vietnam * 54.4* 70* 75.1* Netopýři Mouyassue virus Pobřeží slonoviny * 78.9* Magboi virus Sierra Leone * 75.7* Makokou virus Gabon * 67.6* Quezon virus Filipíny Uluguru virus Tanzanie * 42.9* Altai virus Rusko 56.9* 52.6* 54.8* 48.9* Rejsci Cao Bang virus Vietnam Seewis virus Švýcarsko * 46.9* 60.7* 60.3* Thottapalayam virus Čína Krtci Nova virus Belgie Asama virus Japonsko * 40.3* 64.8* 64.1* Puumala virus Finsko Sin Nombre virus USA Seoul virus Korea Hlodavci Hantaan virus Korea Dobrava-Belgrade virus Řecko Tula virus Česká republika
139 7.2 Flaviviry Komentovaná práce 2 Tab. XXI: Výsledky PRNT testu vyšetřovaných sudokopytníků z jižní Moravy. Datum Oblast No. Druh Věk Pohlaví sběru sběru WNV TBEV USUV 24 C. capreolus 7 m BV-other nt 27 C. capreolus 5 m BV-other 40 <20 <20 88 O. musimon ng m Palava nt 161 O. musimon 2 m Palava 40 < D. dama 1 ng Palava nt 297 D. dama 2 ng Palava 20 <20 < D. dama 5 m Palava 20 <20 < O. musimon 1 ng Palava 160 < D. dama 5 m Palava 80 <20 < C. elaphus 7 f Palava 20 <20 < D. dama 1 ng Palava 40 <20 < D. dama 4 f Palava 20 <20 < D. dama 8 f Palava nt 339 D. dama 4 f Palava 80 < D. dama 1 ng Palava 20 <20 < C. capreolus 3 f Palava nt 503 S. scrofa 2 f Soutok 40 <20 < S. scrofa 2 m BV-other 80 <20 < C. elaphus ng m Soutok < C. elaphus 3 m Soutok 40 <20 < C. elaphus ng m Soutok 80 <20 < O. musimon 3 m Palava nt 542 D. dama 7 f Palava 80 <20 < D. dama 7 f Palava 20 <20 < D. dama 8 f Palava 40 < O. musimon 1 ng Palava <20 151
140 638 C. capreolus 1 ng Palava < D. dama 1 ng Palava < D. dama 8 m Palava < S. scrofa 2 f BV-other nt 681 D. dama 5 f Palava 80 < O. musimon 1 ng Palava 80 <20 < O. musimon 1 ng Palava 40 <20 < D. dama 6 f Palava < S. scrofa ng m Soutok 20 <20 < S. scrofa 1 ng Soutok 40 <20 < S. scrofa 1 ng Soutok 40 <20 nt 1101 S. scrofa 1 ng Soutok 40 <20 nt 1104 S. scrofa 3 f Soutok 80 <20 nt 1166 S. scrofa 1 ng Soutok S. scrofa 1 ng Soutok nt 1170 S. scrofa 1 ng Soutok 160 <20 < S. scrofa 1 ng Soutok 40 <20 nt 1196 C. elaphus 2 m Soutok 160 <20 nt 1204 S. scrofa 2 m Soutok 80 <20 < S. scrofa 1 ng Soutok 160 < D. dama 4 f Soutok 40 <20 < C. capreolus ng f Soutok 40 <20 < S. scrofa 1 ng Soutok 160 < S. scrofa 1 ng Soutok < S. scrofa 1 ng Soutok 20 <20 < D. dama 1 ng Soutok <20 152
141 7.3 Virus hepatitidy E Komentovaná práce 1 Tab. XXII: Postup metody ELISA pro detekci specifických protilátek proti viru hepatitidy E. ELISA ID Screen HEV Indirect multi-species (pro detekci Ab proti HEV u divočáků/prasat/lovné zvěře) 1) Přidat do každé jamky 190 µl Dilution buffer 2 2) Do jamek A1+A2 a B1+B2 10 µl Negative control 3) Do jamek C1+C2 a D1+D2-10 µl Positive control 4) Do duplikátu (např. E1+E2) napipetovat 10 µl séra 5) Inkubace 45 min 21 C 6) Oklepat destičku a 3x promýt 300 µl Wash solution 1x (připravit čerstvé!!) 7) Připravit konjugát 1x (1:10 v Dilution buffer 3) a napipetovat všude 100 µl 8) Inkubace 30 min 21 C 9) Oklepat destičku a 3x promýt 300 µl Wash solution 1x 10) Přidat 100 µl substrátu do každé jamky 11) Inkubace 15 min 21 C 12) Přidat 100 µl stop solution do každé jamky - > zástava reakce 13) Měření při OD 450 nm 153
142
143 8 Příloha publikace Příloha I - Vrbovská V., Chalupa P., Straková P., Hubálek Z., Rudolf I. (2015): Onemocnění člověka způsobená hantaviry - stále opomíjené zoonózy? Epidemiol. Mikrobiol. Imunol. 64: Příloha II - Drewes S., Turni H., Rosenfeld U. M., Obiegala A., Straková P., Imholt C., Glatthaar E., Dressel K., Pfeffer M., Jacob J., Wagner-Wiening C., Ulrich R. G. (2016): Reservoir-Driven Heterogeneous Distribution of Recorded Human Puumala virus Cases in South-West Germany. Zoonoses Public Health. Příloha III - Straková P., Jagdmann S., Balčiauskas L., Balčiauskiené L., Drewes S., Ulrich R.G. (2017): Puumala virus in bank voles, Lithuania. Emerg Infect Dis. 23: Příloha IV - Straková P., Dufková L., Širmanová J., Salát J., Bartonička T., Klempa B., Pfaff F., Höper D., Hoffmann B., Ulrich R.G., Růžek D. (2017): Novel hantavirus identified in European bat species Nyctalus noctula. Infection, Genetics and Evolution. 48: Příloha V - Straková P., Šikutová S., Jedličková P., Sitko J., Rudolf I., Hubálek Z. (2015): The common coot as sentinel species for the presence of West Nile and Usutu flaviviruses in Central Europe. Res. Vet. Sci. 102: Příloha VI - Hubálek Z., Juřicová Z., Straková P., Blažejová H., Betášová L., Rudolf I. Retrospective serosurvey of wild ruminants and boars for West Nile virus, Czech Republic, Vector-borne and Zoonotic Diseases rukopis v redakčním řízení. Příloha VII další publikační aktivita uchazečky Příloha VIII účast na konferencích a stážích Příloha IX výuka během studia 155
144
145 1
146
147 stazeno: Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim:
148 stazeno: SOUHRNNÉ SDĚLENÍ hantavirů, z toho 20 v souvislosti s klinickými případy HPS [10]. Více než 500 klinických případů HPS bylo hlášeno v USA od data objevení syndromu [11], a četné další případy z Jižní Ameriky. CHARAKTERISTIKA HANTAVIRŮ (MORFOLOGIE, STRUKTURA, GENOM A ZPŮSOB PŘENOSU) Morfologie hantavirů je typická pro členy čeledi Bunyaviridae [10]: jsou to obalené, většinou sférické nebo ovoidní částice s průměrem nm. Mohou ale tvořit i protáhlé útvary, které se u jiných bunyavirů tak často nevyskytují. Na povrchu mají charakteristický šachovnicový vzor složený ze čtvercových, přibližně 8 x 8 nm velkých morfologických podjednotek. Viriony obsahují husté jádro s ribonukleoproteinovými strukturami a povrchové glykoproteiny uložené v dvojvrstvém lipidovém obalu [12, 13]. Virové částice jsou inaktivovány teplem (30 min/60 C), kyselým ph, detergenty, organickými rozpouštědly a UV zářením [5]. Genomy hantavirů sestávají ze tří jednořetězcových RNA segmentů, které jsou převážně negativní polarity [14]. Velký (L, large ) segment je přibližně nukleotidů dlouhý [10], kóduje protein L, který slouží jako RNA-dependentní-RNA-polymeráza [15, 16]. Střední (M, medium ) segment o velikosti nukleotidů kóduje glykoproteinový prekurzor [12], který se posttranslačně štěpí na dva glykoproteiny, G1 (72 kd) a G2 (54 kd). Proteiny G1 a G2 fungují jako antigeny rozpoznávané neutralizačními protilátkami [17]. Glykoproteiny mají N konec vystavený na povrchu virionu a C konec ukotvený v membráně a pravděpodobně se účastní interakce viru s hostitelskou buňkou při její infekci [13]. Malý (S, small ) segment kóduje nukleokapsidový protein N a je až nukleotidů dlouhý [10]. V rámci zástupců hantavirů se délka a sekvence S segmentu podstatně nemění, což naznačuje, že hraje důležitou funkční úlohu [18]. N protein se syntetizuje v rané fázi infekce [4] a jde o nejhojnější virový protein, který hraje klíčovou roli v některých důležitých procesech životního cyklu viru: zamezuje např. přístupu nukleáz hostitelské buňky k virové RNA a podílí se na replikaci viru a sestavování virionů [10]. Pravděpodobně interaguje s hostitelskou buňkou a ovlivňuje imunitní odpověď na infekci [19]. Konce 3 a 5 hantavirového RNA genomu jsou rodově specifické, vysoce konzervované a reverzně komplementární a jsou tedy schopné tvořit struktury ve tvaru držadla pánvice (znak čeledi Bunyaviridae). Tyto struktury fungují jako promotor a hrají úlohu při regulaci virové replikace a transkripce [12]. Segmentovaný genom relativně snadno podléhá reasortaci a také homologní rekombinaci, což jsou klíčové procesy určující jejich bohatou genetickou diverzitu a odrážející se v evoluci hantavirů [5]. Na rozdíl od hlodavců s celoživotní perzistentní infekcí člověk nehraje zásadní roli při cirkulaci hantavirů v přírodním ohnisku nákazy, jde o tzv. konečného hostitele (dead-end host), který se nakazí náhodně při vstupu do ohniska po kontaktu s infikovaným hlodavcem. Nákaza se přenáší aerosolem obsahujícím infikované exkrety hlodavců (sliny, moč, trus). Ačkoliv inhalační cesta přenosu hantavirů je klíčová, byla popsána i onemocnění po kousnutí infikovaným hlodavcem. U viru Andes je navíc zvažován interhumánní přenos [13, 20, 21]. GEOGRAFICKÉ ROZŠÍŘENÍ HANTAVIRŮ Hlavní geografické rozdělení hantavirů je na hantaviry Starého a Nového světa. Hantaviry Starého světa se vyskytují v mnoha oblastech Evropy a Asie a mezi nejdůležitější patogenní zástupce patří hantaviry Hantaan, Puumala, Dobrava-Belgrade a Seoul [15, 21]. Viry Saaremaa, Kurkino, Dobrava-Belgrade a Sochi, které podle katalogu ICTV (International Committee on Taxonomy of Viruses) byly původně deklarovány jako odlišné viry, jsou nyní na základě konsenzu expertů řazeny pouze jako čtyři odlišné genotypy viru Dobrava-Belgrade [22]. Hantaviry Starého světa jsou přenášeny hlodavci z podčeledi Murinae (řád Rodentia, podřád Myomorpha, čeleď Muridae) [23]. Hantavirus Puumala je členem skupiny hantavirů Starého světa, které jsou přenášeny hlodavci podčeledi Arvicolinae (řád Rodentia, podřád Myomorpha, čeleď Cricetidae). Hantaviry Nového světa se vyskytují v Severní a Jižní Americe a jejich hostiteli jsou křečci podčeledí Neotominae a Sigmodontinae (řád Rodentia, podřád Myomorpha, nadčeleď Muroidea, čeleď Cricetidae) [24, 25]. Přehled významných hantavirů Starého i Nového světa včetně patogenity, hlodavčích hostitelů a geografického rozšíření je uveden v tabulkách 1 a 2 [21]. Tabuľka 1. Přehled patogenních hantavirů Starého světa, včetně rezervoárů a geografického rozšíření [21] Table 1. List of Old World hantaviruses pathogenic for human, including reservoirs and geographic distribution [21] Název viru Rezervoár Geografické rozšíření Hantaan Onemocnění HFRS Apodemus agrarius Čína, Jižní Korea, Rusko, Taiwan Seoul HFRS Rattus norvegicus, R. rattus celosvětové DobravaBelgrade HFRS Apodemus flavicollis, A. agrarius, A. sylvaticus evropská část Ruska, Estonsko, střední a jihovýchodní Evropa (Balkán) Puumala HFRS (NE) Myodes glareolus Evropa (včetně západního Ruska) Evropa (včetně Ruska) Tula HFRS Microtus arvalis Thailand HFRS Bandicota indica, B. savile jihovýchodní Asie: Srí Lanka, Indie, jih Číny, Laos, Taiwan, Thajsko, Vietnam Amur HFRS Apodemus peninsulae Rusko, severovýchod Číny, východní ostrovy Sachalin a Hokkaidó Soochong HFRS Apodemus peninsulae Jižní Korea Sangassou * Holomyscus simus centrální Afrika 2015, 64, č. 4 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim: 189
149 stazeno: SOUHRNNÉ SDĚLENÍ Tabulka 2. Přehled patogenních hantavirů Nového světa, včetně rezervoárů a geografického rozšíření [21]. Table 2. List of New World hantaviruses pathogenic for human, including reservoirs and geographic distribution [21]. Název viru Onemocnění Sin Nombre HPS Rezervoár Geografické rozšíření Peromyscus maniculatus USA (včetně Aljašky), Mexiko, Kanada Bayou HPS Oryzomys palustris jihozápad USA Black Creek Canal HPS Sigmodon hispidus Florida New York HPS Peromyscus leucopus USA, Kanada, Mexiko Monongahela HPS Peromyscus maniculatus západ USA, Kanada Andes HPS Oligoryzomys longicaudatus Jižní Amerika, hlavně Argentina, Chile, Brazílie Araraquara HPS Bolomys lasiurus Brazílie Juquitiba HPS Oligoryzomys nigripes Brazílie, Uruguay Laguna Negra HPS Calomys laucha Brazílie, Paraguay, sever Argentiny, Bolívie Castelo dos Sohos HPS Oligoryzomys moojeni Brazílie Anajatuba HPS Oligoryzomys fornesii Brazílie Choclo HPS Oligoryzomys fulvescens Panama Bermejo HPS Oligoryzomys chacoensis Argentina Lechiguanas HPS Oligoryzomys flavescens Argentina, jihovýchod Brazílie, Uruguay Orán HPS Oligoryzomys longicaudatus Argentina Rio Mamore HPS Oligoryzomys microtis Bolívie, Brazílie, Peru, Argentina, Paraguay Rio Mearim HPS Holochilus sciureus Brazílie Vysvětlivky: HFRS hantavirová horečka s renálním selháním; NE nephropathia epidemica; HPS hantavirový plicní syndrom. * detegovány protilátky u lidí Explanations: HFRS haemorrhagic fever with renal syndrome; NE nephropathia epidemica; HPS hantavius pulmonary syndrome * antibodies detected in humans V poslední době bylo díky progresivním molekulárním technikám (především sekvenování nové generace) objeveno několik nových zástupců hantavirů také u hmyzožravců (Soricomorpha) rejsků, krtků, a u letounů (řád Chiroptera) [26, 27]. Dosud však není nic známo o jejich patogenním potenciálu pro obratlovce včetně člověka. Důležitou roli pro udržování ohnisek hantavirů Starého světa v přírodě hrají místa, kde jsou ideální podmínky pro přemnožení hlodavců (stohy slámy, seníky nebo rozptýlená lidská obydlí). Hantaviry Nového světa, respektive hlodavci, kteří je přenášejí, upřednostňují spíše aridní oblasti [28]. HANTAVIRY V ČESKÉ REPUBLICE Při hloubkové rešerši domácí literatury za posledních třicet jsme kriticky vyhodnotili asi 30 prací zabývajících se hantaviry, na základě kterých analyzujeme výzkum na našem území. První česká přehledná práce o hantavirech byla uveřejněna dokonce až v roce 2003 [29]. Ovšem z historického hlediska pocházejí nejstarší údaje týkající se výskytu hantavirů ve střední Evropě z roku 1984 z východního Slovenska (z oblasti Ruské Poruby, místa první epidemie HFRS v bývalém Československu v 50. letech 20. století), kde byl detegován antigen HFRS u hlodavců Myodes glareolus, Apodemus flavicollis a Apodemus agrarius [30] a následně i u hlodavců z Česka spolu s potvrzeným nálezem protilátek u lidí [31, 32]. Vůbec první tři lidské případy způsobené infekcí virem Puumala a potvrzené 190 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE sérologicky v České republice popsali Kobzík a Daneš u farmářů na Břeclavsku [33]. Jednalo se o pacienty s lehčí až středně těžkou formou onemocnění. Následně bylo v roce 1995 vyšetřeno lidských sér: protilátky k hantavirům se našly jen u 1 % vyšetřených sér. Nejvyšší procento pozitivity dosahovala séra ze skupiny zemědělců z jižní Moravy [34]. Pejčoch a Kříž dále zkoumali přítomnost protilátek v krevních sérech 710 náhodně vybraných osob starších 20 let [35]. Protilátky některých osob reagovaly s antigenem viru Hantaan (7 osob, séropozitivita 1%), u jiných s antigenem viru Puumala (10 osob, prevalence 1,4%), u některých s oběma antigeny. K podobným výsledkům došla ve své starší studii i L. Matyášová u obyvatel Prahy, Severočeského, Východočeského a Západočeského kraje (430 vyšetřených osob, séropozitivita 0,93%) [36]. Přítomnost protilátek v krevním séru v populaci nasvědčuje, že organismus se s virem setkal, avšak infekce mohla mít mírný nebo asymptomatický průběh, nebo byla chybně diagnostikována, což je u hantaviróz bohužel běžný jev. Dále je nutné zmínit, že protilátky detegované v testu ELISA proti viru Hantaan v séru vyšetřovaných osob reagují zkříženě s virem Dobrava-Belgrade. V posledních dvou dekádách bylo u nás publikováno několik důležitých studií zabývajících se séroprevalencí hantavirových protilátek v lidské populaci. V rozsáhlé retrospektivní studii Státního zdravotního ústavu v Praze (séra získaná ze sérologických přehledů z let ) bylo vyšetřeno celkem osob z jižních a jihozápadních Čech (bývalé okresy Klatovy, Strakonice, Prachatice, Český Krumlov, 2015, 64, č. 4 Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim:
150 stazeno: SOUHRNNÉ SDĚLENÍ České Budějovice, Jindřichův Hradec, Tábor) a 423 osob ze Vsetínska, kdy ve 24 vzorcích vyšetřených kitem ELISA byly prokázány protilátky k virům Puumala (23 osob) a Hantaan (1 osoba), tedy průměrná promořenost 1,6%. Vyšší přítomnost IgG protilátek byla zjištěna především v okrajových věkových skupinách, tedy u nejmladších a nejstarších sledovaných osob [37]. Zelená a Januška vyšetřili séra 464 pacientů z Moravskoslezského regionu a zjistili prevalenci 8% (24 osob reagovalo proti viru Hantaan a 13 proti viru Puumala, 4 osoby proti oběma antigenům) [38]. Klinické symptomy kompatibilní s hantavirózou byly zjištěny u 19 z těchto séropozitivních osob. V jiné studii 5 hemodialyzovaných pacientů ze západočeského regionu z celkového počtu 301 vyšetřených (séropozitivita 0,7%) vykazovalo protilátky proti antigenům Puumala a Hantaan, což naznačuje možnou souvislost mezi chronickým postižením ledvin a přítomností patogenních hantavirů [39]. Výskyt protilátek (celková séropozitivita 1,7%) proti virům Hantaan (3 jedinci), Puumala (2 jedinci) a Seoul (4 jedinci) byl zjištěn u 542 zdravých vojáků v letech Vyšší výskyt protilátek k hantavirům u vojáků ve srovnání s běžnou populací lze vysvětlit častým pobytem příslušníků armády ve volné přírodě (především ve výcvikových prostorech) a tedy vyšší expozicí aerosolové infekci [40]. Během let se podle databáze EPIDAT na našem území vyskytlo 55 hlášených případů HFRS [41, 42] a jeden popsaný importovaný případ u vojáka složek UNPROFOR, který se nakazil při misi na Balkáně [43]. Klinická onemocnění způsobená hantaviry byla diagnostikována v Čechách i na Moravě, a to především na Ostravsku (respektive na česko-slovenském pomezí) a v jižních Čechách [44, 45]. V České republice byly popsány lidské infekce hantaviry především u dospělých, ale vyskytlo se i několik případů onemocnění u dětí. V podstatě jde vždy o ojedinělé případy. V roce 2006 byly popsány první tři případy infekce nephropathia epidemica u dětí hospitalizovaných s intersticiální nefritidou [46]. Děti nevykazovaly typické příznaky infekce virem Puumala, kterou pravděpodobně získaly vdechnutím infikovaného aerosolu na víkendové chatě při svých opakovaných návštěvách. V srpnu 2008 byl hlášen případ 15letého chlapce, který se infikoval u obce Ostravice (poblíž hranic se Slovenskem). Vyvinula se u něho těžká forma HFRS způsobená virem Dobrava-Belgrade [44]. Případy těžké formy HFRS (původce opět virus Dobrava-Belgrade) byly dokumentovány u dvou imunokompetentních mužů po pobytu na horské chatě na slovensko-českém pomezí. Rizikovým faktorem zde byl úklid chaty těsně před návštěvou [47]. Jediná popsaná epidemie hantaviry u nás se odehrála na Prachaticku, kde bylo mezi roky 2004 až 2009 popsáno 18 případů nephropatia epidemica, způsobené virem Puumala. Pejčoch et al. zde provedli geobotanický průzkum spojený s odchytem drobných hlodavců a charakterizovali vhodný biotop pro výskyt hantavirů: smíšený les s predominancí buku Fagus sylvatica [45]. Ve střední Evropě v současnosti cirkulují mezi hlodavci a hmyzožravci 4 hantaviry: virus Dobrava-Belgrade je přenášený jak myšicí temnopásou (A. agrarius) genotyp Kurkino (klinicky lehčí průběh infekce), tak myšicí lesní (A. flavicolis) genotyp Dobrava (doprovázený těžším průběhem infekce). Dalším hantavirem je virus Puumala, přenášený norníkem rudým (Myodes glareolus), virus Tula, přenášený hrabošem polním (Microtus arvalis) a také nově popsaný virus Seewis, přenášený rejskem obecným (Sorex araneus) a rejskem malým (S. minutus) [21, 48, 49]. Virus Tula je nejčastěji se vyskytujícím hantavirem u našich hlodavců, s prevalencí pohybující se kolem 10 % [50]. Poprvé byl izolován na jižní Moravě z hraboše M. arvalis a je považován za nepatogenní [51, 52]. V roce 2012 byla však popsána infekce tímto virem u imunokompromitovaného jedince z Ostravska [53]. ONEMOCNĚNÍ U člověka hantaviry primárně infikují buňky endotelu v plicích nebo ledvinách a také makrofágy, i když virový antigen je přítomný i v dalších tkáních [5]. Klinický průběh infekce se liší v závislosti na druhu viru a jeho genotypu (jednotlivé genotypy viru Dobrava-Belgrade mají různě závažný průběh), důležitou roli hraje genetická predispozice (zejména HLA systém), pohlaví, věk, virová nálož anebo imunokompetence člověka, který se s virem setkal [54]. Onemocnění spojené s hantaviry Starého světa, tj. hemoragická horečka s renálním syndromem (HFRS), postihuje hlavně ledviny, zatímco hantavirový plicní syndrom (HPS), jehož původci jsou hantaviry Nového světa, je spojený se selháním kardiopulmonálního systému [15]. V současnosti přibývá důkazů poukazujících na určitou podobnost mezi těmito dvěma syndromy. Jak HFRS tak i HPS mohou vést ke zhoršené funkci ledvin, krvácení a kardiopulmonálnímu postižení v důsledku zvýšené propustnosti kapilár a sníženého počtu krevních destiček (trombocytopenie) [55]. Hemoragická horečka s renálním syndromem (HFRS, Haemorrhagic Fever with Renal Syndrome ) HFRS je akutní horečnaté onemocnění v začátcích připomínající chřipku, které může vést až k závažným krvácivým stavům a k selhání ledvin [14]. Typický průběh HFRS se skládá z pěti stadií: fáze horečky, fáze hypotenze, fáze oligurie, diuretická fáze a fáze rekonvalescence [5]. Jednotlivé fáze se dají zřetelně odlišit v průběhu těžké formy onemocnění způsobeného hantaviry Hantaan nebo Dobrava-Belgrade. Infekce viry Hantaan a Dobrava-Belgrade Viry Hantaan a Dobrava-Belgrade způsobují těžkou formu HFRS [14]. Inkubační doba činí 2 6 týdnů (u viru Dobrava-Belgrade), poté nastupuje febrilní fáze (3 7 dní) s příznaky připomínajícími chřipku (vysoká horečka, zimnice, bolesti hlavy a svalů) a intenzivní bolest zad [54, 56]. Často se vyskytuje bolest v dutině břišní, žaludeční obtíže, nevolnost, zvracení, malátnost a poruchy vizu [13, 57, 58]. Dochází ke zvýšení propustnosti kapilár, která vede k zarudnutí tváří, krku, objevují se petechie a krvácení do spojivek. Po 3 7 dnech vysoká horečka ustoupí a pacient se dostane do fáze hypotenze [5], která může trvat hodiny až dny (většinou 3 dny). Pokles tlaku bývá někdy prudký - může dojít až k šoku, objevuje se trombocytopenie, leukocytóza, zvýšený hematokrit a je výrazná proteinurie. S trombocytopenií souvisí krvácivé projevy po těle se objevují hematomy, může být hematemeza, epistaxe, hematurie, meléna, případně i krvácení do centrálního nervového systému, které je mnohdy smrtelné [13, 54]. Z laboratorních ukazatelů lze zmínit zvýšené hladiny 2015, 64, č. 4 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim: 191
151 stazeno: SOUHRNNÉ SDĚLENÍ transamináz, sérového kreatininu (nad 150 µmol/l), laktátdehydrogenázy, urey, C-reaktivního proteinu či D-dimerů. Většinou kolem osmého dne se krevní tlak normalizuje, ale onemocnění pokračuje oligurgickou fází, v trvání 3 7 dnů [5]. Zhoršuje se funkce ledvin, což vede k oligurii až anurii. Asi polovina úmrtí nastává právě v této fázi. Krvácivé projevy souvisejí nejen s extrémní trombocytopenií, ale také se zvýšenou propustností kapilár a rozvojem DIC (diseminované intravaskulární koagulace). DIC s šokem a multiorgánovým selháním také bývá nejčastější příčinou úmrtí [13, 14]. Průběh této fáze může zhoršit krvácení do gastrointestinálního traktu nebo hemoptýza. Pacienti, kteří přežijí oligurickou fázi, se dostanou do diuretické fáze, která může trvat několik týdnů a nástup této fáze znamená pro pacienta pozitivní prognózu [5, 14, 54]. Ledviny totiž začínají regenerovat, produkce moči stoupá až na několik litrů denně (3 6 litrů za den), a pokud ztráty tekutin nejsou nahrazeny, pacienti jsou ohroženi dehydratací [13]. Rekonvalescence je konečnou fází onemocnění a obvykle trvá týdny až měsíce [14]. Letalita na infekci způsobenou těmito viry se pohybuje od 5 % do 15 % [14, 54]. Infekce virem Seoul Onemocnění způsobené virem Seoul se liší od průběhu předchozí infekce závažností a tím, že může postihnout i játra [13]. U pacienta nelze s jistotou rozlišit pět typických fází pro HFRS [5]. Výzkum ukázal, že onemocnění se vyskytuje převážně u 30 40letých mužů [59] (stejně jako u infekcí způsobených jinými hantaviry) a mezi hlavní příznaky patří zvracení, horečka, bolesti svalů a břicha, postižení spojivek a petechie. Na rozdíl od infekcí způsobených ostatními hantaviry bývá často přítomna hepatitida. Letalita je pod 2 % [5, 14]. Infekce virem Puumala Virus Puumala způsobuje mírnou formu HFRS, která se nazývá nephropathia epidemica (NE) [5]. Podobá se HFRS, ale symptomy tohoto onemocnění jsou mírnější. Jednotlivá stadia nejsou výrazně odlišena a ledviny jsou relativně málo postižené. Při infekci virem Puumala se běžně objevují příznaky jako kašel, přítomnost plicního infiltrátu a snížená funkce plic [14]. Tyto příznaky jsou ale většinou málo závažné a často bývají přehlédnuty. Typicky se u pacientů vyskytuje horečka, bolesti svalů, břicha a zad. V případě postižení ledvin se okolo třetího nebo čtvrtého dne objeví oligurie až anurie. Dialýzu vyžaduje méně než 5 % pacientů. Hemoragické příznaky (petechie, hematurie nebo meléna) se vyskytnou asi u 10 % případů [1, 13]. Často se také objeví mlhavé vidění, akutní myopie a popsán byl i glaukom [13, 58]. Během druhého týdne onemocnění se pacienti začínají zotavovat, ale plná úzdrava vyžaduje vždy delší dobu. Letalita je v rozmezí od 0,1% (Finsko) po 0,4% (Ural). Závažný klinický průběh infekce virem Puumala je silně vázán na přítomnost haplotypu HLA-B8, zatímco u lehkých průběhů je to haplotyp HLA-B27. Hantavirový plicní syndrom (HPS, Hantavirus Pulmonary Syndrome, také označovaný HCPS, Hantavirus Cardio-Pulmonary Syndrome ) HPS představuje mnohem závažnější onemocnění než HFRS letalita dosahuje % [5]. Primární příčinou 192 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE vážného průběhu HPS je zvýšená permeabilita plicních kapilár, která může vyvolat hypoxémii až rychlý rozvoj těžkého respiračního selhání s kardiogenním šokem a selháním srdečním [4, 54]. Nejvíc onemocnění HPS je způsobeno virem Sin Nombre s jasnými klinickými příznaky a minimálními projevy mimo dutinu hrudní [14]. Naopak případy, u kterých nastane porucha funkce ledvin, bývají často spojené s infekcí viry Bayou nebo Black Creek Canal [56]. Klinický průběh HPS je rozdělen do 4 fází s odchylkami v závažnosti a výskytu mezi pacienty: fáze horečky, kardiopulmonální fáze, fáze diuretická a zotavovací fáze [4]. Inkubační doba bývá dní a počáteční příznaky zahrnují náhlý vzestup teploty, bolesti hlavy, svalů a žaludeční obtíže (nauzea, zvracení) [14, 60]. Objevuje se také trombocytopenie. Febrilní stadium trvá přibližně 5 dní a postupně se přidává kašel, dušnost, pocit sevřeného hrudníku, tachykardie a hypotenze, jež jsou prvními příznaky nástupu kardiopulmonální fáze, u které se rozvíjí těžké respirační selhání [4, 56]. Často dojde ke kardiogennímu šoku, laktátové acidóze a srdeční arytmii [49]. Právě prvních hodin po nástupu šoku je pro přežití pacienta kritických. Nezbytná bývá plicní ventilace včetně monitorování a podpory základních životních funkcí, přesto letalita může dosáhnout až 50 % [15, 60]. Pacienti, kteří toto období přežijí, se dostávají do diuretické fáze, ve které dochází ke zvýšení produkce moče a stav se postupně zlepšuje [54]. Poté nastává zdlouhavá rekonvalescence, provázená zvýšenou slabostí a únavou. DIAGNOSTIKA HANTAVIRÓZ Prvotní příznaky infekce hantaviry nejsou specifické, a jejich diagnostika bývá složitá. V diagnostické praxi se nejčastěji využívá kombinace klinických a sérologických nálezů, někdy doplněné o molekulární analýzu [56]. Přímá diagnostika Na přímou izolaci hantavirů lze použít buňky Vero E6, ve kterých viry replikují bez tvorby cytopatického efektu. Hantaviry také infikují linie buněk Huh7 a A549 získané z lidského karcinomu jater a plic [54]. Obecným problémem při izolačních pokusech bývá skutečnost, že virémie je u člověka poměrně krátkodobá. Poslední slovinská studie však překvapivě udává průměrnou délku virémie u člověka 30 dní pro virus Dobrava-Belgrade a 16 dní pro virus Puumala [61]. Izolační pokusy jsou navíc pracné, časově náročné a pro personál rizikové [48]. Molekulární metody založené na amplifikaci nukleových kyselin viru, jako jsou polymerázová řetězová reakce s využitím reverzní transkriptázy (RT-PCR) nebo real-time RT-PCR, které jsou vysoce citlivé, specifické a rychlé, umožňují druhovou identifikaci hantavirů (po sekvenaci vybraných úseků genomu) a dají se použít pro vyšetření ještě před rozvojem onemocnění. Virový materiál (RNA) pro tyto testy bývá purifikován z krve nebo slin pacienta během akutní fáze infekce, případně z autopsie vzorků infikovaných tkání nejlépe ve viremické fázi onemocnění [14]. Úspěšnost molekulární identifikace také závisí na výběru vhodných primerů (primery a sondy se v případě Real-time PCR vážou na vysoce konzervativní oblasti v rámci L segmentu hantavirového genomu nebo vysoce homologní oblasti 2015, 64, č. 4 Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim:
152 stazeno: SOUHRNNÉ SDĚLENÍ S-segmentu) a náloži virové RNA ve vzorku [48, 62]. Pro rozlišení různých kmenů hantavirů lze také využít plak-redukční neutralizační test (PRNT). Nepřímá diagnostika Z imunologických metod se pro diagnostiku hantavirových infekcí využívají ELISA (enzyme-linked immunosorbent assays), imunofluorescenční test (IF), a imunoblotové nebo imunohistochemické testy [48]. V současnosti jsou vyvinuté vysoce citlivé a specifické IgM a IgG ELISA testy (např. diagnostické sety firem Progen, Focus nebo Euroimmun). Jako diagnostické antigeny se využívají přirozené nebo rekombinantní N proteiny viru, které jsou významné svou vlastností vyvolávat brzkou a dlouhotrvající imunitní odpověď. Problémem však může být nízká senzitivita či zkřížená reaktivita [48, 56, 63]. Metoda IF je populární metodou díky jednoduchosti provedení, nevýhodou tohoto testu jsou však problémy se specificitou testu ovlivněnou zkříženými reakcemi protilátek proti různým zástupcům hantavirů, a také nezkušenost uživatelů při mikroskopickém hodnocení [64]. Nedávno byl vyvinut vysoce specifický a citlivý imunofluorescenční test navržený na podkladě biočipu, který dokáže detegovat protilátky ke všem známým hantavirům Starého a Nového světa [65]. Imunoblotové testy využívají také rekombinantní antigen a patří mezi specifické a citlivé metody, které slouží ke konfirmaci pozitivního ELISA testu (např. sety Mikrogen). Imunohistochemické metody umožňují obarvení hantavirových antigenů ve vzorcích tkání, a stávají se tak ideálním nástrojem pro retrospektivní diagnózu infekcí hantaviry v konzervovaných biopsiích [64]. Pro detekci akutních infekcí viry Dobrava-Belgrade, Hantaan a Puumala byl nedávno vyvinut pětiminutový imunochromatografický IgM test [5]. Neutralizační test se využívá i na detekci neutralizačních protilátek vyvolaných infekcí a je díky své vysoké specificitě a senzitivitě považován za zlatý standard sérologické diagnostiky [66, 67]. Test je však časově náročný (trvá dny až týdny) a ne vždy je dostupný živý antigen. Kvůli aerosolům, které mohou vznikat během laboratorních procedur se izolační, molekulární a sérologické metody s živým materiálem provádějí pouze v laboratořích s úrovní zabezpečení BSL-3 nebo BSL-4 [14]. LÉČBA Aktuálně proti hantavirovým nákazám nemáme k dispozici žádnou specifickou terapii [5]. Léčba je proto symptomatická a podpůrná. U těžkých případů je nezbytné umístit pacienta na jednotku intenzivní péče, kde je zajištěno monitorování základních životních funkcí, korekce příjmu a výdeje tekutin, minerálního metabolismu a acidobazické rovnováhy [21, 48, 68]. Taktéž zavedení umělé plicní ventilace anebo mimotělní okysličování v případě HPS a hemodialýza u HFRS jsou u kritických nemocných nezbytné [64]. Velmi důležitá je schopnost lékařů rozpoznat počáteční příznaky hantavirové infekce. V diferenciální diagnostice hantaviróz je nejdůležitější myslet zejména na leptospirózu, při plicním postižení na řadu infekcí, které mohou způsobit postižení dolních cest dýchacích a obdobně i u renálního postižení přichází v úvahu také řada možností [14]. V současné době nemáme žádné účinné antivirové preparáty pro léčbu hantavirových infekcí [48]. Intravenózně podávaný ribavirin má antivirovou aktivitu proti hantavirům způsobujících HFRS v časných fázích, ale jeho podávání zůstává stále na experimentální úrovni. Například u pacientů v Číně se prokázala snížená úmrtnost v případě, kdy byl ribavirin podáván během prvních 5 dní po nástupu prvotních příznaků [56, 60]. Dokáže zabránit i progresi onemocnění do oligurické fáze a zpomaluje selhávání funkce ledvin. Jeho použití je omezené především na těžké a rychle rozpoznané formy onemocnění, např. během epidemie [64, 68]. Bohužel zůstává neúčinný při léčbě HPS, kde vhodné antivirotikum je třeba teprve vyvinout [69]. Imunoterapie je jedna z dalších perspektiv pro léčbu hantavirových infekcí. Podání lidských neutralizačních protilátek během akutní fáze HPS by mohlo vést k poklesu virémie a podpořit rekonvalescenci. Studie na hlodavcích ukázala, že pasivní transfer neutralizačních monoklonálních protilátek nebo polyklonálního séra dokáže ochránit zvířata před infekcí [4]. Imunoterapie se jeví být slibnou metodou, avšak na léčbu hantavirových infekcí by bylo zapotřebí udržovat přiměřené koncentrace protilátek po dostatečně dlouhou dobu, což se dosud nedaří. V současné době se testují také speciální imunoterapeutika, která by inhibovala zvýšenou propustnost kapilár, jež je důsledkem hantavirové infekce [60]. VAKCINACE V Asii se využívají inaktivované monovalentní vakcíny (např. Hantavax v Koreji) byť s krátkodobou protektivní odpovědí a nutností častého dávkování [5, 70]. Žádná z nich se však neosvědčila pro používání v Evropě či USA (neexistuje zkřížená protektivita). Je potřeba vyvinout takovou vakcínu, která by byla bezpečná, účinná a multivalentní, zároveň však adaptovaná na místní podmínky [60]. Zatím byly vyrobeny pouze kandidátní rekombinantní vakcíny na podkladě replikačních komponent viru vakcinie nebo rekombinantních bakterií, které kódují jeden nebo více virových proteinů. V Evropě byla vyvinuta kandidátní vakcína proti viru Puumala, která obsahuje proteinové komplexy s mnoha žádanými vlastnostmi, jako imunogeny prezentující N protein viru, a která vyvolává silnou imunitní odpověď [67, 71]. V současnosti se v USA pracuje na vakcíně, která využívá M segment virů Hantaan a Puumala [5]. Specifickou imunitní odpověď dokáží vyvolat i hantavirové proteiny získané biotechnologickou cestou z transgenních rostlin [72]. Jako užitečný nástroj pro vývoj vakcín se ukázaly např. také kvasinky Sacharomyces cerevisiae poskytující vysoký výtěžek nukleokapsidových proteinů hantaviru [73]. PREVENCE Možnosti léčby hantaviróz jsou nedostatečné, proto je velmi důležitá prevence vzniku onemocnění [67]. Nejefektivnějším způsobem prevence infekcí způsobených hantaviry nebo jinými hlodavci přenosnými viry (např. arenavirus lymfocytární choriomeningitidy) je potlačení kontaktu s hlodavci a jejich exkrety (sliny, moč, trus). Člověk by se měl vyhýbat místům, kde žijí početné populace volně žijících synantropních hlodavců a dochází k hromadění jejich exkretů (např. staré 2015, 64, č. 4 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim: 193
153 stazeno: SOUHRNNÉ SDĚLENÍ budovy, sklepy, půdy). Je důležité aktivně omezovat počet jejich úkrytů a zdrojů potravy v okolí lidských obydlí. Dále je vhodné uzavřít vstupy do domů a budov a zamezit přístup těmto živočichům, popř. vydenzifikovat již potenciálně kontaminované úseky [4, 74, 75]. Prevence ve formě osvěty by také měla směřovat k rizikovým skupinám, kterým hrozí vystavení volně žijícím hlodavcům (pracovníci v lesnictví a zemědělství, zoologové, vojáci, trampové) stejně jako imunokompromitovaným jedincům (těhotné ženy, staří lidé, onkologičtí pacienti, pacienti po transplantaci, chronicky nemocní lidé). Žádoucí by bylo vyšetřovat osoby s akutním či chronickým postižením ledvin na možnou souvislost s výskytem hantavirového onemocnění, mj. za účelem lokalizace přírodních ohnisek nákazy. Relevantní údaje o výskytu hantavirů v hlodavcích, stejně jako o klinických případech, jsou na našem území stále spíše kusé a nedávají opravdový vhled do problematiky rozšíření potažmo emergence této závažné zoonózy v rámci České republiky. Data o klinických případech hantavirových nákaz z poslední doby jsou publikována takřka výlučně ze severní Moravy, kde se nachází virologické pracoviště Zdravotního ústavu se sídlem v Ostravě, které danou problematiku dlouhodobě sleduje a region diagnosticky pokrývá. Na základě distribuce hantavirů např. v sousedním Německu se lze domnívat, že hantaviry se vyskytují ve více přírodních ohniscích i na našem území, avšak jejich přesný výskyt dosud nebyl podrobně zmapován. Nálezy antigenů u hlodavců z jižní Moravy, Krušných hor, jižních Čech anebo Ostravska jsou patrně jen střípky reálné distribuce tohoto agens na našem území. Řada infekcí je asymptomatických anebo zůstává nerozpoznána, takže je v budoucnu třeba zlepšit diagnostiku hantaviróz na všech klinických pracovištích v rámci celé České republiky. Dále bychom měli prozkoumávat a cíleně (podle výskytu onemocnění) vyhledávat nová ohniska hantavirů v populacích drobných hlodavců (především M. glareolus, A. flavicolis, A. agrarius) a propojovat tyto údaje s výskytem klinických případů u člověka. Kvalitní surveillance hantavirových nákaz je dnes dostupná jen v malé části evropských zemí (např. Německo, Finsko, Belgie), a to jen díky integrované spolupráci přírodovědců a lékařů. Hantavirózy jsou sice vzácná, ale svým průběhem a následky velmi nebezpečná onemocnění, a proto by se studiu jejich ekologie a epidemiologie měla věnovat dostatečná pozornost. Z poslední doby lze dokumentovat zajímavý případ infekce virem Seoul u těhotné ženy v Belgii [76] nebo infekci způsobenou zástupcem tzv. nepatogenních hantavirů u imunokompromitovaného jedince dokonce na našem území [53]. Na základě údajů v EPIDAT a při srovnání s ostatními zeměmi středoevropského regionu se lze domnívat, že řada asymptomatických infekcí podobně jako u ostatních zoonóz dnes uniká pozornosti specialistů. Jak ve své knize Přírodní ohniskovost nákaz konstatuje významný český epidemiolog Luděk Daneš: Viry, které jsou dnes málo významné, se mohou stát velkými patogeny, mohou měnit svá působiště, hostitele i přenašeče. Je na místě skromnost a zapotřebí smířit se s tím, že všechny vědecké poznatky mohou platit jen EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE Poděkování Autoři děkují Evropské komisi za podporu projektu 7. rámcového programu EU grant FP EDENext ( který se zabývá biologií a kontrolou infekcí přenášených vektory v Evropě. Publikace je v rámci tohoto programu katalogizována jako EDENext356. Věcný obsah publikace podléhá zodpovědnosti autorů a nereflektuje nutně pohled Evropské komise. Dále děkujeme Operačnímu programu Ministerstva školství (Vzdělání pro konkurenceschopnost) projektu CEB (CZ.1.07/2.3.00/ ) a projektu Specifického výzkumu MU (MUNI/A/0884/2013) a (MUNI/A/1437/2014). LITERATURA ZÁVĚR 194 dočasně, protože příroda a přírodní ohniska se vyvíjejí a mění dál, i když velmi pomalu [77]. 1. Vapalahti O, Mustonen J, Lundkvist A, et al. Hantavirus infections in Europe. Lancet Inf Dis, 2003; 3: Gratz N. Vector- and Rodent-borne Diseases in Europe and North America: Their Distribution and Public Health. Cambridge: Cambridge Univ. Press; Lee HW, Lee PW, Johnson KM. Isolation of etiologic agent of Korean hemorrhagic fever. J Infect Dis, 1978; 137: Jonsson CB, Figueiredo LTM, Vapalahti O. A global perspective on hantavirus ecology, epidemiology, and disease. Clin Microbiol Rev, 2010; 23: Avsic-Zupanc T, Saksida A, Korva M. Hantavirus infections. Clin Microbiol Infect, 2013; doi: / Jenison S, Yamada T, Morris C, et al. Characterization of human antibody responses to Four Corners hantavirus infections among patients with hantavirus pulmonary syndrome. J Virol, 1994; 68: Nichol ST, Spiropoulou CF, Morzunov S, et al. Genetic identification of a hantavirus associated with an outbreak of acute respiratory illness. Science, 1993; 262: Maupin G, Gage K, Childs JE, et al. Isolation of the causative agent of hantavirus pulmonary syndrome. Am J Trop Med Hyg, 1994; 5: Childs JE, Ksiazek TG, Spiropoulou CF, et al. Serologic and genetic identification of Peromyscus maniculatus as the primary rodent reservoir for a new hantavirus in the southwestern United States. J Infect Dis, 1994; 169: Hjelle B, Torres-Perez F. Hantaviruses in the Americas and their role as emerging pathogens. Viruses-Basel, 2010; 2: CDC, MMWR. Annual U.S. HPS Cases and Case-fatality, Dostupné na www: Charrell RN, Coutard B, Baronti C, et al. Arenaviruses and hantaviruses: From epidemiology and genomics to antivirals. Antiviral Res, 2011; 90: Peters CJ, Mills JN, Spiropoulou C, et al. Hantavirus infections. In: Guerrant RL, Walker DH, Weller PF. Tropical Infectious Diseases: Principles, Pathogens & Practice Philadelphia: Elsevier; Lednicky JA. Hantaviruses: A short review. Arch Pathol Lab Med, 2003; 127: Kruger DH, Schonrich G, Klempa B. Human pathogenic hantaviruses and prevention of infection. Hum Vaccines, 2011; 7: Hepojoki J, Strandin T, Lankinen H, Vaheri A. Hantavirus structure-molecular interactions behind the scene. J Gen Virol, 2012; 93: Safronetz D, Zivcec M, LaCasse R, et al. Pathogenesis and host response in Syrian hamsters following intranasal infection with Andes virus. PLoS Pathog, 2011; 7: Plyusnin A, Vapalahti O, Vaheri A. Hantaviruses: Genome structure, expression and evolution. J Gen Virol, 1996; 77: , 64, č. 4 Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim:
154 stazeno: SOUHRNNÉ SDĚLENÍ 19. Taylor SL, Frias-Staheli N, Garcia-Sastre A, Schmaljohn CS. Hantaan virus nucleocapsid protein binds to import in _ proteins and inhibits tumor necrosis factor alpha-induced activation of nuclear factor kappa B. J Virol, 2009; 83: Wells RM, Sosa Estani S, Yadon ZE, et al. An unusual hantavirus outbreak in southern Argentina: Person-to-person transmission? Emerg Infect Dis, 1997; 3: Hubálek Z, Rudolf I. Microbial Zoonoses and Sapronoses. Dordrecht: Springer; Klempa B, Avsic-Zupanc T, Clement J, et al. Complex evolution and epidemiology of Dobrava-Belgrade hantavirus: definition of genotypes and their characteristics. Arch Virol, 2013;158: Maes P, Klempa B, Clement J, et al. A proposal for new criteria for the classification of hantaviruses, based on S and M segment protein sequences. Infect Genet Evol, 2009; 9: Young JC, Mills JN, Enria DA, et al. New World hantaviruses. Brit Med Bull, 1998;54: Kang HJ, Bennett SN, Hope AG, et al. Shared ancestry between a newfound mole-borne hantavirus and hantaviruses harbored by cricetid rodents. J Virol, 2011;85: Guo WP, Lin XD, Wang W, et al. Phylogeny and origins of hantaviruses harbored by bats, insectivores, and rodents. PLoS Pathogens, 2013;9: Ling J, Sironen T, Voutilainen L, et al. Hantaviruses in finnish soricomorphs: evidence for two distinct hantaviruses carried by Sorex araneus suggesting ancient host switch. Infect Genet Evol, 2014;27: Vacková M, Jebavý L, Beran J, et al. Febrilní stavy způsobené hantaviry. Prakt. lékař, 2002; 82: Pejčoch M. Hantaviry a nákazy jimi vyvolané. Klin mikrobiol inf lék 2003,1: Grešíková M, Rajčáni J, Sekeyová M, et al. Hemorrhagic fever virus with renal syndrome in small rodents in Czechoslovakia. Acta Virol, 1984;28: Daneš L, Tkachenko EA, Ivanov AP, et al. Hemorrhagic fever with renal syndrome in Czechoslovakia: detection of antigen in small terrestrial mammals and specific serum antibodies in man. J Hyg Epidemiol Microbiol Immunol, 1986;30: Daneš L, Pejčoch M, Hubálek Z, et al. Hantaviruses in small wild living mammals in Czechoslovakia. J Hyg Epidem 1991;35: Kobzík J, Daneš L. Laboratory confirmed cases of hemorrhagic fever with renal syndrome which occured in Breclav Epidemiol Microbiol Immunol, 1992;41: Pejčoch M. Co to jsou hantaviry. Vesmír, 1995;74: Pejčoch M, Kříž B. Hantaviruses in the Czech Republic. Emerg Infect Dis, 2003;9: Matyášová L. Sérologický přehled hantavirových nákaz. Zprávy CEM, 1998;7: Pejčoch M, Kříž B, Malý M. Promořenost hantaviry ve dvou oblastech s přírodními ohnisky hantavirů. Prakt lékař, 2010; 90: Zelená H, Januška J. Serological characteristics of hantavirus from clinical specimens analyzed in in the Department of Virology, Public Health Institute, Ostrava. Epidemiol Microbiol Imunol, 2009;58: Pejčoch M, Pazdiora P, Eiselt J, et al. Seroprevalence of hantavirus antibodies among chronic hemodialysis atients in the Czech Reublic. Epidemiol Microbiol Imunol, 2010;59: Vacková M, Douda P, Beran J, et al. Serologic detection of hantavirus antibodies. Epidemiol Mikrobiol Imunol, 2002;51: EPIDAT (2014). Vybrané infekční nemoci v ČR v letech Dostupné na www: Heyman P, Ceianu C, ChristovaI, et al. A five-year perspective on the situation of haemorrhagic fever with renal syndrome and status of the hantavirus reservoirs in Europe, Eurosurveillance, 2011;16: Petrů K, Pejčoch M, Monhart V, et al. Hemoragická horečka s renálním selháním. Čas Lék čes, 1997;136: Papa A, Zelená H, Barnetová D, Petroušová L. Genetic detection of Dobrava/Belgrade virus in a Czech patient with haemorrhagic fever with renal syndrome. Clin Microbiol Infect, 2010;16: Pejčoch M, Unar J, Kříž B, et al. Characterization of a natural focus of Puumala hantavirus infection in the Czech Republic, Cent Eur J Publ Health, 2010;18: Dušek J, Pejčoch M, Kolský A, et al. Mild course of Puumala nephropathy in children in an area with sporadic occurrence hantavirus infection. Pediatr Nephrol, 2006, 21; Zelená H, Zvolánková V, Zuchnická J, et al. Hantavirus infection during a stay in a mountain hut in northern Slovakia. J Med Virol, 2011;83: Kruger DH, Figueiredo LTM, Song JW, Klempa B. Hantaviruses globally emerging pathogens. J Clin Virol, 2015;64: Schlegel M, Radosa L, Rosenfeld UM, et al. Broad geographical distribution and high genetic diversity of shrew-borne Seewis hantavirus in Central Europe. Virus Genes, 2012;45: Heroldová M, Pejčoch M, Bryja J, et al. Tula virus in populations of small terrestrial mammals in a rural landscape. Vector-Borne Zoonotic Dis, 2010;10: Plyusnin A, Cheng Y, Vapalahti O, et al. Genetic variation in Tula hantaviruses: Sequence analysis of the S and M segments of strains from Central Europe. Virus Res, 1995;39: Vapalahti O, Lundkvist A, Kukkonen SKJ, et al. Isolation and characterization of Tula virus, a distinct serotype in the genus Hantavirus, family Bunyaviridae. J Gen Virol, 1996;77: Zelená H, Mrázek J, Kuhn T. Tula hantavirus infection in immunocompromised host, Czech Republic. Emerg Infect Dis, 2013;19: Schönrich G, Rang A, Lutteke N, et al. Hantavirus-induced immunity in rodent reservoirs and humans. Immunol Rev, 2008;225: Rasmuson J, Andersson C, Norrman E, et al. Time to revise the paradigm of hantavirus syndromes? Hantavirus pulmonary syndrome caused by European hantavirus. Eur J Clin Microbiol, 2011;30: Chandy S, Abraham, P, Sridharan G. Hantaviruses: an emerging public health threat in India? A review. J Biosciencies, 2008;33: Courouble P, Vanpee D, Delgrange E, et al. Hantavirus infections: clinical presentations in the emergency room. Eur J Emerg Med, 2001;8: Pejčoch M, Kříž B. Hantaviry a jimi vyvolávaná onemocnění v České republice. Prakt lékař, 2007;87: Park SC, Pyo HJ, Soe JB, et al. A clinical study of hemorrhagic fever with renal syndrome caused by Seoul virus infection. Korean J Intern Med, 1989;4: MacNeil A, Nichol ST, Spiropoulou CF. Hantavirus pulmonary syndrome. Virus Res, 2011;162: Korva M, Saksida A, Kejzar N, et al. Viral load and immune response dynamics in patients with haemorrhagic fever with renal syndrome. Clin Microbiol Infect, 2013;19: Aitichou M, Saleh SS, McElroy AK, et al. Identification of Dobrava, Hantaan, Seoul, and Puumala viruses by one-step real-time RT-PCR. J Virol Methods, 2005;124: De Souza WM, Machado AM, Figueiredo LTM, et al. Serosurvey of hantavirus infection in humans in the border region between Brazil and Argentina. Rev Soc Bras Med Trop, 2011;44: Clement J, Maes P, Van Ranst M. Hantaviruses in the Old and New world. In: Tabor E. Emerging Viruses in Human Populations. Amsterdam: Elsevier; Lederer S, Lattwein E, Hanke M, et al. Indirect immunofluorescence assay for the simultaneous detection of antibodies against clinically important old and new world hantaviruses. Plos Neglect Trop Dis, 2013;7:e , 64, č. 4 EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim: 195
155 stazeno: SOUHRNNÉ SDĚLENÍ 65. Maes P, Keyaerts E, Li S, et al. Replication reduction neutralization test, a quantitative RT-PCR-based technique for the detection of neutralizing hantavirus antibodies. J Virol Methods, 2009;159: Bi ZQ, Formenty PBH, Roth CE. Hantavirus Infection: A review and global update. J Infect Dev Ctries, 2008;2: Hartline J, Mierek C, Knutson T, et al. Hantavirus infection in North America: a clinical review. Am J Emerg Med, 2013;31: Dolgin E. Hantavirus treatments advance amidst outbreak in US park. Nat Med, 2012;18: Chu YK, Jennings GB, Schmaljohn CS. A vaccinia-virus vectored Hantaan and Seoul virus but not Puumala virus. J Virol, 1995;69: Ulrich R, Koletzki D, Lachmann S, et al. New chimaeric hepatitis B virus core particles carrying hantavirus (serotype Puumala) epitopes: Immunogenicity and protection against virus challenge. J Biotechnol, 1999;73: Khattak S, Darai G, Sule S, et al. Characterization of expression of Puumala virus nucleocapsid protein in transgenic plants. Intervirology, 2002;45: Razanskiene A, Schmidt J, Geldmacher A, et al. High yields of stable and highly pure nucleocapsid proteins of different hantaviruses can be generated in the yeast Saccharomyces cerevisiae. J Biotechnol, 2004;111: EPIDEMIOLOGIE, MIKROBIOLOGIE, IMUNOLOGIE 73. Maes P, Clement J, Gavrilovskaya I, et al. Hantaviruses: Immunology, treatment, and prevention. Viral Immunol, 2004;17: Vacková M, Beran J, Douda P, et al. Epidemiologická problematika hantavirových nákaz. Epidemiol Mikrobiol Imunol, 2000; 49: Mace G, Feyeux C, Mollard N, et al. Severe Seoul hantavirus infection in a pregnant woman, France, October Eurosurveillance, 2013;18: Daneš L. Přírodně ohniskové nákazy. Praha: Karolinum; Do redakce došlo dne Adresa pro korespondenci: RNDr. Ivo Rudolf, Ph.D. Ústav biologie obratlovců AVČR, v. v. i. Klášterní Valtice rudolf@ivb.cz 2015, 64, č. 4 Tento clanek podleha autorskemu zakonu a jeho vyuziti je mozne v souladu s pravnim prohlasenim:
156
157 2 1
158
159 Zoonoses and Public Health ORIGINAL ARTICLE Reservoir-Driven Heterogeneous Distribution of Recorded Human Puumala virus Cases in South-West Germany S. Drewes 1, H. Turni 2, U. M. Rosenfeld 1, A. Obiegala 3, P. Strakova 1,4,5, C. Imholt 6, E. Glatthaar 7, K. Dressel 8, M. Pfeffer 3, J. Jacob 6, C. Wagner-Wiening 9 and R. G. Ulrich 1 1 Friedrich-Loeffler-Institut, Institute for Novel and Emerging Infectious Diseases, Greifswald Insel Riems, Germany 2 Stauss & Turni Gutachterb uro, T ubingen, Germany 3 Veterin armedizinische Fakult at, Institut f ur Tierhygiene und Offentliches Veterin arwesen, University Leipzig, Leipzig, Germany 4 Institute of Vertebrate Biology v.v.i., Academy of Sciences, Masaryk University, Brno, Czech Republic 5 Department of Experimental Biology, Faculty of Science, Masaryk University, Brno, Czech Republic 6 Julius K uhn-institute, Federal Research Centre for Cultivated Plants, Institute for Plant Protection in Horticulture and Forests, Vertebrate Research, M unster, Germany 7 Forstzoologisches Institut, Arbeitsbereich Wildtier okologie und Wildtiermanagement, Universit at Freiburg, Freiburg, Germany 8 sine-institut ggmbh, Munich, Germany 9 Landesgesundheitsamt Baden-W urttemberg, Referat 95 Epidemiologie und Gesundheitsberichterstattung, Sachgebietsleitung: Infektionsepidemiologische Meldesysteme (SG4), Stuttgart, Germany Impacts The heterogeneous geographical distribution of recorded hantavirus disease cases is related to the abundance of Puumala virus (PUUV)-infected bank voles. The effect of beech mast on human incidences is higher in districts with high proportional coverage of beech/oak woodland. Local early warning modules for PUUV infections should include the prevalence of PUUV in the host which requires multiannual bank vole monitoring as well as information about mast and beech/oak woodland cover. Keywords: Hantavirus; endemic region; incidence; bank vole; prevalence; Germany Correspondence: Rainer G. Ulrich. Friedrich-Loeffler-Institut, Institute for Novel and Emerging Infectious Diseases, Greifswald Insel Riems, Germany. Tel.: ; Fax: ; rainer.ulrich@fli.de Received for publication January 14, 2016 doi: /zph Summary Endemic regions for Puumala virus (PUUV) are located in the most affected federal state Baden-Wuerttemberg, South-West Germany, where high numbers of notified human hantavirus disease cases have been occurring for a long time. The distribution of human cases in Baden-Wuerttemberg is, however, heterogeneous, with a high number of cases recorded during 2012 in four districts (H districts) but a low number or even no cases recorded in four other districts (L districts). Bank vole monitoring during 2012, following a beech (Fagus sylvatica) mast year, resulted in the trapping of 499 bank voles, the host of PUUV. Analyses indicated PUUV prevalences of 7 50% (serological) and % (molecular) in seven of eight districts, but an absence of PUUV in one L district. The PUUV prevalence differed significantly between bank voles in H and L districts. In the following year 2013, 161 bank voles were trapped, with reduced bank vole abundance in almost all investigated districts except one. In 2013, no PUUV infections were detected in voles from seven of eight districts. In conclusion, the linear modelling approach indicated that the heterogeneous distribution of human PUUV cases in South-West Germany was caused by different factors including the abundance of PUUV RNA-positive bank voles, as well as by the interaction of beech mast and the proportional coverage of beech and oak (Quercus spec.) forest per district. These results can aid developing local public health risk management measures and early warning models Blackwell Verlag GmbH 1
160 Heterogeneous Distribution of Puumala virus S. Drewes et al. Introduction Puumala virus (PUUV), genus Hantavirus, family Bunyaviridae, is causing the vast majority of human hantavirus disease cases in Germany and surrounding countries (Ulrich et al., 2004; Heyman et al., 2011). Nephropathia epidemica (NE), the hantavirus disease caused by PUUV, is usually characterized by a mild to moderate course with abrupt onset of fever, headache, myalgia, chills, conjunctivitis, abdominal pain, nausea, vomiting and in severe cases with microhaemorrhages and renal failure (Brummer-Korvenkontio et al., 1980; Kr uger et al., 2013). Mild and unspecific symptoms result in underreporting of human cases (Brummer-Korvenkontio et al., 1999; Clement et al., 2007; Klempa et al., 2013). The reservoir host of PUUV, the bank vole Myodes glareolus, is present in almost entire Europe, but human cases of PUUV infection are heterogeneously distributed there (Linard et al., 2007; Boone et al., 2012; Ali et al., 2014; Clement et al., 2014; Castel et al., 2015). Further, bank vole populations erupt occasionally resulting in a massive increase in abundance in some years. Such outbreaks seem to be driven by mast of beech (Fagus sylvatica) and oak (Quercus spec.) in Germany and other Central European countries; predator-driven processes matter in northern boreal Europe (Hansson, 1985; Hanski et al., 1991; Tersago et al., 2009; Clement et al., 2010; Imholt et al., 2015; Reil et al., 2015). A recent study identified certain landscape and environmental factors, such as forest connectivity, winter and summer temperatures and soil water content, as drivers for the spatial distribution of NE cases in Europe (Zeimes et al., 2015). Climate conditions might not only influence the virus viability and transmission directly, but indirectly by influencing the behaviour of the human population at risk for infection. Further, the awareness of the physicians has been discussed as a reason for apparent disease absence or underreporting. Thus, the detection of a novel PUUV strain in the western part of Thuringia during the outbreak in 2010 indicated that the virus may have been present but unrecognized, suggesting low awareness of physicians due to a very low number of disease cases before the 2010 outbreak (Faber et al., 2013). Human PUUV infections in Germany are known since the 1980s (Pilaski et al., 1991). Since the introduction of the Protection against Infection Act in 2001, in total human hantavirus disease cases were recorded in Germany (Robert Koch-Institute: SurvStat@RKI 2.0, rki.de, accessed: 21 April 2016). A large number of molecular epidemiological studies in bank vole reservoirs and patients resulted in the demonstration of a high level of PUUV sequence divergence (Pilaski et al., 1994; Heiske et al., 1999; Asikainen et al., 2000; Essbauer et al., 2006, 2007; Schilling et al., 2007; Hofmann et al., 2008; Ettinger et al., 2012; Faber et al., 2013; Ali et al., 2015; Castel et al., 2015). Recent studies in the district Osnabr uck, Lower Saxony, North-West Germany, and in Konnevesi, Central Finland, confirmed oscillations in the prevalence of PUUV infections in the bank vole populations, but also a longterm presence of selected PUUV strains (Razzauti et al., 2013; Weber de Melo et al., 2015). The disease incidence varied between the federal states of Germany, with the highest total number of cases recorded in Baden-Wuerttemberg (n = 5351), South-West Germany (Pilaski et al., 1991; Z oller et al., 1995; Boone et al., 2012; Robert Koch-Institute: SurvStat@RKI 2.0, rki.de, accessed: 21 April 2016). During the years 2007, 2010 and 2012, much larger numbers of human hantavirus disease cases were notified with a simultaneous increase in Baden-Wuerttemberg and other regions of Germany (Hofmann et al., 2008; Ettinger et al., 2012). However, even within this highly endemic federal state, a heterogeneous distribution of human PUUV cases has been observed (Fig. 1, Table 1). The objective of this study was to test potential associations of bank vole abundance and serological and molecular PUUV detection in bank voles with the reported frequency of human infections and beech mast intensity as well as beech/oak forest occurrence per district for districts with a historically high number of recorded human cases (H) and for additional districts with no or low numbers of recorded human cases (L) in Baden- Wuerttemberg. Materials and Methods Bank voles were trapped at four H (H1, district Stuttgart site B usnau; H2, T ubingen M ossingen; H3, G oppingen Geislingen; H4, Heidenheim Steinheim) and four L (L1, Schw abisch Hall Crailsheim; L2, Emmendingen Kenzingen; L3, Freiburg im Breisgau Landwasser; L4, Waldshut St uhlingen) locations in 2012 and 2013 using live traps (Fig. 1). Sites were characterized by deciduous broad-leaved forest dominated by beech. Fifty traps were set at each site in suitable habitats for bank voles in order to maximize trapping success. Traps were baited with a mix of nuts, sunflower seed, apples and mealworms and emptied every 12 h for 36 h covering two nights and one day. Hay was provided for bedding and a cotton wool pad soaked with water for moisture. Trapping was conducted three times per year (May/June; July/August; September/October). Rodent individuals were caught alive, their sex and weight determined, killed through cervical dislocation and immediately frozen and stored at 20 C for subsequent laboratory analysis. Data are stated as bank voles trapped per 100 trap nights (TN) reflecting maximum population abundance Blackwell Verlag GmbH
161 S. Drewes et al. Heterogeneous Distribution of Puumala virus Fig. 1. Hantavirus incidences in districts with high incidences (H) and low incidences (L) of Baden-Wuerttemberg, South-West Germany, during 2012 and 2013, and location of the bank vole trapping sites H1 (Stuttgart), H2 (T ubingen), H3 (G oppingen) and H4 (Heidenheim), and L1 (Schw abisch Hall), L2 (Emmendingen), L3 (Freiburg) and L4 (Waldshut). Background maps: Nicole Neumann, Friedrich-Loeffler-Institut; human PUUV incidences: Robert Koch-Institute: 2.0, accessed: 21 April Table 1. Incidences of recorded human Puumala virus cases per inhabitants in eight districts of Baden-Wuerttemberg from 2001 to 2015 Year District SK Stuttgart (H1) LK T ubingen (H2) LK G oppingen (H3) LK Heidenheim (H4) LK Schw abisch Hall (L1) LK Emmendingen (L2) SK Freiburg (L3) LK Waldshut (L4) LK, rural district; SK, urban district. Source: Robert Koch-Institute: SurvStat@RKI 2.0, accessed: 21 April Dissection and sample collection as well as morphological and molecular species determination for shrews, Apodemus spp. and Microtus spp. followed standard protocols (Angermann and Hackethal, 1999; Parson et al., 2000; Schlegel et al., 2012; Nainys et al., 2015). Three age groups of bank voles were defined based on the weight: <15, and >19.5 g (Bajer et al., 2002). PUUV-reactive antibodies were detected in thoracic cavity lavage by IgG ELISA using a recombinant nucleocapsid protein of PUUV strain Bavaria (Mertens et al., 2011). ELISA-positive or equivocal sera were tested again to determine the serological reactivity following a previously published decision tree (Mertens et al., 2009). For molecular detection of PUUV, RNA was isolated from lung tissue by QIAzol â Lysis Reagent (Qiagen, Hilden, Germany) treatment following an in-house protocol (Schmidt et al., 2016). Reverse transcription polymerase chain reaction (RT-PCR) using S segment-specific primers Pu342F and Pu1102R followed a previously described standard protocol (Essbauer et al., 2006). Amplification products of the expected size of ca. 700 bp were sequenced by the usage of BigDye â Terminator version 1.1 Cycle 2016 Blackwell Verlag GmbH 3
162 Heterogeneous Distribution of Puumala virus S. Drewes et al. Sequencing Kit (Applied Biosystems, Darmstadt, Germany). Fisher s exact test with a type I error a of 0.05 and associated odds ratios were used to test the independence of compared prevalences between H and L districts, season and individual weight. To analyse determining factors for human infection, two backward multiple linear regression models were developed. For both models, the ln-transformed number of human cases standardized to inhabitants (PUUV incidence) was the dependent variable (Robert Koch-Institute: SurvStat@RKI 2.0, rki.de). The first model was designed to test which predictor was correlated best to human PUUV cases in the outbreak year of 2012 in all eight districts. The mean bank vole abundance index, the antibody prevalence determined by ELISA and the RNA prevalence detected using RT-PCR were used as potential predictors. ELISA results were corrected for the potential influence of maternal antibodies in young voles. Individuals below the cut-off value of 16 g (Kallio et al., 2010) that carried antibodies but were RT- PCR negative were treated as carrying maternal antibodies and assigned to the negative ELISA category. The second analysis focused on potential environmental factors determining the marked differences in human PUUV incidence among districts (n = 8). Here, the ln-transformed proportional cover of beech and oak forest per district and the categorical variable of beech mast in the previous year (yes/no) were determined for each district for the years Values for forest cover were obtained from the federal forest census ( by calculating average values from the censuses in 2002 and For the city districts H1 and L3, no forest data were available and therefore the districts closest to the trapping sites where forest data were available were chosen (B oblingen and Breisgau im Hochschwarzwald, respectively). All analyses were performed in R (R Core Team, 2015) using the lm function. Model simplification was done using drop1 and the final model was chosen based on lowest corrected Akaike s information criterion (Hurvich and Tsai, 1989). Results During 2012, the number of recorded human hantavirus disease cases and incidences was higher in the districts H1 (n = 118/19.73), H2 (n = 86/40.02), H3 (n = 139/56.09) and H4 (n = 75/58.77) than in the districts L1 (n = 14/ 7.49), L2 (n = 1/0.64), L3 (n = 1/0.46) and L4 (n = 0/0.00) (Table 1, Fig. 1). During 2012, 499 bank voles were trapped with a range of animals per site (Table 2). Mean trap success ranged from 9.5 ind./100tn in L4 to 29 ind./100tn in the city district H1 (Table 3). In addition, bycatches of four Table 2. Numbers of bank voles (Myodes glareolus) and other small mammals collected at the eight trapping sites during 2012 and 2013 Waldshut (L4) Freiburg (L3) Emmendingen (L2) Schw abisch Hall (L1) Heidenheim (H4) G oppingen (H3) T ubingen (H2) Stuttgart (H1) Small mammal species Myodes glareolus Sorex spp.* Microtus spp Apodemus flavicollis Total *Sorex araneus, Sorex coronatus and Sorex minutus. Microtus arvalis and Microtus agrestis Blackwell Verlag GmbH
163 S. Drewes et al. Heterogeneous Distribution of Puumala virus Table 3. Abundance indices and results of serological and RT-PCR investigations of bank voles trapped at the eight districts during 2012 and 2013 Mean Abundance PUUV ELISA PUUV RT-PCR District and trapping site Year Ind./100TN SE Absolute* Per cent Absolute* Per cent Stuttgart (H1) / / / / Total 26/ / T ubingen (H2) / / / / Total 19/ / G oppingen (H3) / / / / Total 24/ / Heidenheim (H4) / / / / Total 13/ / Schw abisch Hall (L1) / / / / Total 15/ / Emmendingen (L2) / / / / Total 16/ / Freiburg (L3) / / / / Total 0/ / Waldshut (L4) / / / / Total 4/ / Ind., individuals; TN, trap nights; SE, standard error. *Number of positive/total number of bank voles tested. One juvenile, antibody-positive animal was excluded. Total number includes one equivocal sample. Total number includes five equivocal samples. Microtus spp., three yellow-necked mice (Apodemus flavicollis) and 20 shrews were collected (Table 2). Serological investigations indicated the presence of PUUV infections in bank voles in seven of eight districts with prevalences of 7 50% (Table 3). RT-PCR investigations confirmed PUUV infections for the same seven districts with prevalences of % (Table 3). In two juvenile voles (weight < 16 g), one each from sites H2 and H4, exclusively PUUV-reactive antibodies, but no viral RNA were detected (Table 3). Therefore, these two animals were regarded as harbouring maternal antibodies. The voles from the four H districts showed serological and molecular prevalences of %. At the districts L1, L2 and L4 seroprevalence reached 23.6%, 50% and 7%, respectively, whereas the molecular prevalence ranged from 1.8% (L4), to 10.9% (L1) and 18.8% (L2). In district L3, none of the bank voles was positive for PUUV. In 2012, the prevalence of PUUV infection in bank voles was significantly higher in districts H1 H4 compared to L1 L4 in IgG ELISA [P = 0.037; two tailed Fisher s exact test with a = 0.05, odds ratio 1.64 ( )] and RT-PCR (P < 0.001, odds ratio 3.77 ( )). That year adult bank voles (weight class 3, >19.5 g) showed significantly higher prevalences compared to juvenile individuals (weight class 1, <15.5 g) (ELISA: odds ratio ( ), Fisher s test P < 0.001; RT-PCR: odds ratio 6.38 ( ), Fisher s test P < 0.008) (see Table S1 in Supporting information). In addition, there was a trend that RNA prevalences decreased in autumn (Season 3) compared to spring (Season 1 versus Season 3; see Table S1 in Supporting information; RT-PCR: odds ratio 2.48 ( ), Fisher s test P = 0.007; ELISA: odds ratio 1.60 ( ), Fisher s test P = 0.08). One field vole (Microtus agrestis) from trapping site H1 was found to be PUUV positive in RT-PCR, but none of the yellow-necked mice (data not shown) Blackwell Verlag GmbH 5
164 Heterogeneous Distribution of Puumala virus S. Drewes et al. Table 4. Results of multiple linear regression analysis for the suitability of methodological and environmental predictors regarding human PUUV cases. Categorical variable Mast [1] indicates differences compared to the reference category Mast [0] representing no beech mast Model B SE B b P-value Adj R 2 AICc Methodological Step 1 Intercept Abundance RNA prevalence Antibody prevalence Step 2 Intercept Abundance RNA prevalence Step 3 (final) Intercept RNA prevalence * Environmental Step 1 Intercept Perc. Woodland Mast [1] Perc. Woodland: Mast [1] * B, regression coefficient; SE B, standard error B; b, standardized coefficient; P-value, significance level; Adj. R 2, adjusted r-squared; AICc, corrected Akaike s information criterion. *Significance level P < In 2013, a total of 161 bank voles were trapped at the eight sites (Table 2). Trap success ranged from 2.0 ind./ 100TN in L2 to 15.3 ind./100tn in the city district L3 (Table 3). At seven sites the number of voles was lower compared to the year 2012, except at site L3 (Table 2). One yellow-necked mouse and 48 shrews were collected as bycatch at seven of the eight sites. There were no PUUV-positive bank voles in seven of eight districts in 2013 (Table 3). Only at site L1, PUUVseropositive and RT-PCR-positive animals were detected with prevalences of 4.6% and 11.4%, respectively (Table 3). There was no statistically significant difference in the PUUV infection rate between L and H districts (P = 1 for ELISA and P = for RT-PCR). The average prevalence in 2012 and 2013 differed significantly between bank voles from trapping sites L1 L4 and H1 H4 (P < 0.001, odds ratio 2.14 ( ) for IgG ELISA and P < 0.001, odds ratio 3.69 ( ) for RT- PCR). Linear regression modelling revealed that the PUUV RNA prevalence in bank voles was closely correlated with the number of human PUUV infections (F 1,4 = 11.5, adj. R 2 = 0.68, P < 0.001; Table 4). The trapping index of bank voles per district as well as the prevalence of PUUV-specific antibodies in the population was not significantly correlated with the number of human PUUV cases. Neither the percentage of beech and oak woodland per district nor beech mast alone predicted the existing gradient in human PUUV cases among districts. However, the interaction term between both predictors was positively correlated with the number of human PUUV cases (F 3,36 = 22.11, adj. R 2 = 0.62, P < 0.001), demonstrating that after beech mast more human PUUV infections occurred in districts with higher cover of woodland than in districts with little beech and oak forest. Discussion We determined the presence of PUUV in bank voles from four H districts with a high number of recorded human cases and further four L districts with no or a low number of recorded human cases during outbreak year 2012 and the following year. The serological and RT-PCR investigations in bank voles trapped during the outbreak year 2012 confirmed the presence of PUUV at all four H districts, but also for three of four L districts. In line with previous investigations (Bernshtein et al., 1999; Olsson et al., 2002; Augot et al., 2008), adult individuals showed a significantly higher RNA and seroprevalence. The average antibody and RNA prevalence was about 12.1% higher in H districts than in L districts. The RNA prevalence in bank voles drove human PUUV infections in South-West Germany at the spatial scale of districts. This was most likely governed by the interaction of beech mast and the forest coverage per district because more human PUUV infections occurred in districts with higher cover of woodland. Such a relation seems plausible as bank vole abundance in temperate Germany is highly dependent on beech mast (Hansson et al., 2000; Clement et al., 2010). The importance of woodland is clearly linked to local human infection risks, as Reil et al. (2015) could not detect any significant influence of woodland on human incidences at the scale of federal states. The finding indicates that variation in human PUUV infection at small spatial district scale can be explained by variation of PUUV presence in host rodents and related environmental factors such as beech mast and presence of forest. This can help to improve forecast systems that help to raise awareness regarding human PUUV infections. Another explanation for small-scale variation in the frequency of human PUUV cases is a reduced awareness of medical personnel where human cases are rare. This assumption is supported by reports of participants of focus groups, which were conducted in PUUV endemic areas of Germany (Dressel, 2014). In these groups, formerly severely affected NE patients described the problem of being one of the first cases in a newly emerging area of the hantavirus Blackwell Verlag GmbH
165 S. Drewes et al. Heterogeneous Distribution of Puumala virus disease, where it took several days before the medical staff was able to diagnose the disease correctly. In addition, it takes cases of an emerging vector-borne infection before it is recognized by the local general practitioners and eventually receives sufficient attention from the public health system (Schmidt et al., 2013). In the district L3, PUUV was not detected in bank voles during the study period. An investigation of 40 bank voles collected during December 2009 at a site in the neighbouring district Breisgau-Hochschwarzwald, approx. 12 km away from the trapping site L3, also failed to detect any PUUV RNA- and antibody-positive bank voles (our unpublished data). The two recorded human PUUV infections in this district may originate from patients who have contracted the disease outside the district, as human cases are recorded by place of residence (Robert Koch-Institut, 2015). The promotion of bank vole populations by beech mast is one of the reasons for increased numbers of human PUUV infections in temperate Europe (Tersago et al., 2009; Clement et al., 2010; Reil et al., 2016). Indeed, the high bank vole abundance in 2012 might be explained by the beech mast reported in 2011 for all eight districts of Baden-Wuerttemberg. Additional factors might be involved, such as habitat or climatic factors enhancing or impairing virus stability outside the reservoir host (Kallio et al., 2006) and/or host and human behaviour. In addition, strong interactions between landscape features, immune gene expression and co-infections of bank voles with the nematode Heligmosomum mixtum have been identified previously (Guivier et al., 2014). Additional pathogens have been detected in bank voles from Germany, such as herpesviruses (Ehlers et al., 2007), paramyxoviruses (Drexler et al., 2012), hepacivirus (Drexler et al., 2013), polyomavirus (Nainys et al., 2015), cowpox virus (Kinnunen et al., 2011), tick-borne encephalitis virus (Achazi et al., 2011) and Leptospira spp. (Mayer-Scholl et al., 2014), that might impact the fitness or susceptibility of the bank vole for PUUV infection. In a previous study, a high proportion of individuals carrying maternal antibodies were found to constrain transmission during cycle peak years of bank voles in Finland (Voutilainen et al., 2016). In our study, the results of the serological and RT-PCR investigations indicated the presence of maternal antibodies only for two juvenile voles. However, the average prevalence of PUUV infections in bank voles detected by serology alone was mostly slightly higher than prevalence detected by RT-PCR, despite the fact that we corrected for maternal antibodies. This discrepancy might be therefore explained by a lower viral load at the time of investigation, a lower sensitivity of the RT-PCR assay or virus clearance. In conclusion, this investigation indicates that the heterogeneous geographical distribution of recorded human PUUV cases in Baden-Wuerttemberg might be caused by reduced presence or even absence of PUUV in local bank vole populations possibly mediated by the interaction of beech mast intensity and the extent of forested area. It remains imperative to establish long-term rodent and PUUV monitoring investigations (Jacob et al., 2014) that provide a solid database to test such hypotheses and may shed light on the stability of PUUV presence/absence, the molecular evolution of PUUV strains and their fitness consequences for bank voles as well as their virulence to humans. Awareness of local physicians should be systematically raised by dedicated information campaigns released by local public health authorities. This is especially important for areas close to endemic regions where human cases have been rare. The findings can help to develop and validate early warning modules for hantavirus outbreaks and associated human infection risk. Acknowledgements The support of Hans-Werner Maternowski, Brigitte Pehlke, Ewa Paliocha, Thomas Kuss, Michael Stauss, Katja Wallmeyer and Jochen Blank in small mammal trapping and the excellent technical assistance of D orte Kaufmann in serological and RT-PCR investigations are kindly acknowledged. We are very grateful to D orte Kaufmann, Kathrin Baumann, Samuel Bernstein, Stefan Fischer, Nastasja Kratzmann, Mathias Schlegel, Sabrina Schmidt, Julia Schneider, Hanan Sheikh Ali, Kerstin Tauscher and Christin Trapp for their help in dissection of the rodents. Beech mast data of the Staatsklenge Nagold, ForstBW, were kindly provided by Thomas Ebinger. The risk perception study in Germany was assisted by Steffen Sch ule. The investigations were funded in part by the German Federal Ministry of Education and Research (BMBF) through the German Research Platform for Zoonoses (projects Monitoring sylvatischer Zoonosen, FKZ 01KI1101, to CWW, and Netzwerk Nagetier- ubertragene Pathogene, FKZ 01KI1018 and 01KI1303, to RGU) and the Deutsche Forschungsgemeinschaft (SPP 1596 Ecology and Species Barriers in Emerging Viral Diseases, UL 405/ 1-1 to RGU). This study was partially funded by EU grant FP EDENext and is catalogued by the EDENext Steering Committee as EDENext461 ( The contents of this publication are the sole responsibility of the authors and do not necessarily reflect the views of the European Commission. Collection of samples in district Breisgau-Hochschwarzwald were done in the frame of the UFOPLAN project granted to Jens Jacob Blackwell Verlag GmbH 7
166 Heterogeneous Distribution of Puumala virus S. Drewes et al. References Achazi, K., D. Ruzek, O. Donoso-Mantke, M. Schlegel, H. S. Ali, M. Wenk, J. Schmidt-Chanasit, L. Ohlmeyer, F. Ruhe, T. Vor, C. Kiffner, R. Kallies, R. G. Ulrich, and M. Niedrig, 2011: Rodents as sentinels for the prevalence of tickborne encephalitis virus. Vector Borne Zoonotic Dis. 11, Ali, H. S., S. Drewes, E. T. Sadowska, M. Mikowska, M. H. Groschup, G. Heckel, P. Koteja, and R. G. Ulrich, 2014: First molecular evidence for Puumala hantavirus in Poland. Viruses 6, Ali, H. S., S. Drewes, V. Weber de Melo, M. Schlegel, J. Freise, M. H. Groschup, G. Heckel, and R. G. Ulrich, 2015: Complete genome of a Puumala virus strain from Central Europe. Virus Genes 50, Angermann, R., and H. Hackethal, 1999: S augetiere Mammalia. In: Senglaub, K., B. Klausnitzer, and H. J. Hannemann (eds), Stresemann Exkursionsfauna von Deutschland. Band 3: Wirbeltiere, pp Springer Spektrum, Heidelberg, Berlin. Asikainen, K., T. H anninen, H. Henttonen, J. Niemimaa, J. Laakkonen, H. K. Andersen, N. Bille, H. Leirs, A. Vaheri, and A. Plyusnin, 2000: Molecular evolution of Puumala hantavirus in Fennoscandia: phylogenetic analysis of strains from two recolonization routes, Karelia and Denmark. J. Gen. Virol. 81, Augot, D., F. Sauvage, F. Boue, M. Bouloy, M. Artois, J. M. Demerson, B. Combes, D. Coudrier, H. Zeller, F. Cliquet, and D. Pontier, 2008: Spatial and temporal patterning of bank vole demography and the epidemiology of the Puumala hantavirus in northeastern France. Epidemiol. Infect. 136, Bajer, A., M. Bednarska, A. Pawelczyk, J. M. Behnke, F. S. Gilbert, and E. Sinski, 2002: Prevalence and abundance of Cryptosporidium parvum and Giardia spp. in wild rural rodents from the Mazury Lake District region of Poland. Parasitology 125, Bernshtein, A. D., N. S. Apekina, T. V. Mikhailova, Y. A. Myasnikov, L. A. Khlyap, Y. S. Korotkov, and I. N. Gavrilovskaya, 1999: Dynamics of Puumala hantavirus infection in naturally infected bank voles (Clethrinomys glareolus). Arch. Virol. 144, Boone, I., C. Wagner-Wiening, D. Reil, J. Jacob, U. M. Rosenfeld, R. G. Ulrich, D. Lohr, and G. Pfaff, 2012: Rise in the number of notified human hantavirus infections since October 2011 in Baden-Wurttemberg, Germany. Euro Surveill. 17, pii Brummer-Korvenkontio, M., A. Vaheri, T. Hovi, C. H. von Bonsdorff, J. Vuorimies, T. Manni, K. Penttinen, N. Oker- Blom, and J. L ahdevirta, 1980: Nephropathia epidemica: detection of antigen in bank voles and serologic diagnosis of human infection. J. Infect. Dis. 141, Brummer-Korvenkontio, M., O. Vapalahti, H. Henttonen, P. Koskela, P. Kuusisto, and A. Vaheri, 1999: Epidemiological study of nephropathia epidemica in Finland Scand. J. Infect. Dis. 31, Castel, G., M. Couteaudier, F. Sauvage, J. B. Pons, S. Murri, A. Plyusnina, D. Pontier, J. F. Cosson, A. Plyusnin, P. Marianneau, and N. Tordo, 2015: Complete genome and phylogeny of Puumala hantavirus isolates circulating in France. Viruses 7, Clement, J., P. Maes, and M. Van Ranst, 2007: Acute kidney injury in emerging, non-tropical infections. Acta Clin. Belg. 62, Clement, J., P. Maes, C. van Ypersele de Strihou, G. van der Groen, J. M. Barrios, W. W. Verstraeten, and M. van Ranst, 2010: Beechnuts and outbreaks of nephropathia epidemica (NE): of mast, mice and men. Nephrol. Dial. Transplant. 25, Clement, J., M. Van Esbroeck, K. Lagrou, J. Verschueren, N. P. Sunil-Chandra, and M. Van Ranst, 2014: Leptospirosis versus hantavirus infections in the Netherlands and in Belgium, 2000 to Euro Surveill. 19, pii Dressel, K., 2014: Deliverable 16.1, Report of Public Risk Perception. EDENext Project, unpublished. Drexler, J. F., V. M. Corman, M. A. M uller, G. D. Maganga, P. Vallo, T. Binger, F. Gloza-Rausch, V. M. Cottontail, A. Rasche, S. Yordanov, A. Seebens, M. Knornschild, S. Oppong, Y. Adu Sarkodie, C. Pongombo, A. N. Lukashev, J. Schmidt-Chanasit, A. St ocker, A. J. Carneiro, S. Erbar, A. Maisner, F. Fronhoffs, R. Buettner, E. K. Kalko, T. Kruppa, C. R. Franke, R. Kallies, E. R. Yandoko, G. Herrler, C. Reusken, A. Hassanin, D. H. Kr uger, S. Matthee, R. G. Ulrich, E. M. Leroy, and C. Drosten, 2012: Bats host major mammalian paramyxoviruses. Nat. Commun. 3, 796. Drexler, J. F., V. M. Corman, M. A. M uller, A. N. Lukashev, A. Gmyl, B. Coutard, A. Adam, D. Ritz, L. M. Leijten, D. van Riel, R. Kallies, S. M. Klose, F. Gloza-Rausch, T. Binger, A. Annan, Y. Adu-Sarkodie, S. Oppong, M. Bourgarel, D. Rupp, B. Hoffmann, M. Schlegel, B. M. K ummerer, D. H. Kr uger, J. Schmidt-Chanasit, A. A. Setien, V. M. Cottontail, T. Hemachudha, S. Wacharapluesadee, K. Osterrieder, R. Bartenschlager, S. Matthee, M. Beer, T. Kuiken, C. Reusken, E. M. Leroy, R. G. Ulrich, and C. Drosten, 2013: Evidence for novel hepaciviruses in rodents. PLoS Pathog. 9, e Ehlers, B., J. K uchler, N. Yasmum, G. Dural, S. Voigt, J. Schmidt-Chanasit, T. J akel, F. R. Matuschka, D. Richter, S. Essbauer, D. J. Hughes, C. Summers, M. Bennett, J. P. Stewart, and R. G. Ulrich, 2007: Identification of novel rodent herpesviruses, including the first gammaherpesvirus of Mus musculus. J. Virol. 81, Essbauer, S., J. Schmidt, F. J. Conraths, R. Friedrich, J. Koch, W. Hautmann, M. Pfeffer, R. W olfel, J. Finke, G. Dobler, and R. Ulrich, 2006: A new Puumala hantavirus subtype in rodents associated with an outbreak of Nephropathia epidemica in South-East Germany in Epidemiol. Infect. 134, Essbauer, S. S., J. Schmidt-Chanasit, E. L. Madeja, W. Wegener, R. Friedrich, R. Petraityte, K. Sasnauskas, J. Jacob, J. Koch, G. Dobler, F. J. Conraths, M. Pfeffer, C. Pitra, and R. G. Ulrich, Blackwell Verlag GmbH
167 S. Drewes et al. Heterogeneous Distribution of Puumala virus 2007: Nephropathia epidemica in metropolitan area. Germany. Emerg. Infect. Dis. 13, Ettinger, J., J. Hofmann, M. Enders, F. Tewald, R. M. Oehme, U. M. Rosenfeld, H. S. Ali, M. Schlegel, S. Essbauer, A. Osterberg, J. Jacob, D. Reil, B. Klempa, R. G. Ulrich, and D. H. Kr uger, 2012: Multiple synchronous outbreaks of Puumala virus, Germany, Emerg. Infect. Dis. 18, Faber, M., T. Wollny, M. Schlegel, K. M. Wanka, J. Thiel, C. Frank, D. Rimek, R. G. Ulrich, and K. Stark, 2013: Puumala virus outbreak in Western Thuringia, Germany, 2010: epidemiology and strain identification. Zoonoses Public Health 60, Guivier, E., M. Galan, H. Henttonen, J. F. Cosson, and N. Charbonnel, 2014: Landscape features and helminth co-infection shape bank vole immunoheterogeneity, with consequences for Puumala virus epidemiology. Heredity (Edinb) 112, Hanski, I., L. Hansson, and H. Henttonen, 1991: Specialist predators, generalist predators, and the microtine rodent cycle. J. Anim. Ecol. 60, Hansson, L., 1985: Clethrionomys food: generic, specific and regional characteristics. Ann. Zool. Fennici 22, Hansson, L., B. Jezdrzejewska, and W. Jezdrzejewski, 2000: Regional differences in dynamics of bank vole populations in Europe. Pol. J. Ecol. 48, Heiske, A., B. Anheier, J. Pilaski, V. E. Volchkov, and H. Feldmann, 1999: A new Clethrionomys-derived hantavirus from Germany: evidence for distinct genetic sublineages of Puumala viruses in Western Europe. Virus Res. 61, Heyman, P., C. S. Ceianu, I. Christova, N. Tordo, M. Beersma, M. Jo~ao Alves, A. Lundkvist, M. Hukic, A. Papa, A. Tenorio, H. Zelena, S. Essbauer, I. Visontai, I. Golovljova, J. Connell, L. Nicoletti, M. Van Esbroeck, S. Gjeruldsen Dudman, S. W. Aberle, T. Avsic-Zupanc, G. Korukluoglu, A. Nowakowska, B. Klempa, R. G. Ulrich, S. Bino, O. Engler, M. Opp, and A. Vaheri, 2011: A five-year perspective on the situation of haemorrhagic fever with renal syndrome and status of the hantavirus reservoirs in Europe, Euro Surveill. 16, Hofmann, J., H. Meisel, B. Klempa, S. M. Vesenbeckh, R. Beck, D. Michel, J. Schmidt-Chanasit, R. G. Ulrich, S. Grund, G. Enders, and D. H. Kr uger, 2008: Hantavirus outbreak, Germany, Emerg. Infect. Dis. 14, Hurvich, C. M., and C. L. Tsai, 1989: Regression and time-series model selection in small samples. Biometrika 76, Imholt, C., D. Reil, J. A. Eccard, D. Jacob, N. Hempelmann, and J. Jacob, 2015: Quantifying the past and future impact of climate on outbreak patterns of bank voles (Myodes glareolus). Pest Manag. Sci. 71, Jacob, J., R. G. Ulrich, J. Freise, and E. Schmolz, 2014: Monitoring von gesundheitsgef ahrdenden Nagetieren, Projekte, Ziele und Ergebnisse. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 57, Kallio, E. R., J. Klingstr om, E. Gustafsson, T. Manni, A. Vaheri, H. Henttonen, O. Vapalahti, and A. Lundkvist, 2006: Prolonged survival of Puumala hantavirus outside the host: evidence for indirect transmission via the environment. J. Gen. Virol. 87, Kallio, E. R., M. Begon, H. Henttonen, E. Koskela, T. Mappes, A. Vaheri, and O. Vapalahti, 2010: Hantavirus infections in fluctuating host populations: the role of maternal antibodies. Proc. Biol. Sci. 277, Kinnunen, P. M., H. Henttonen, B. Hoffmann, E. R. Kallio, C. Korthase, J. Laakkonen, J. Niemimaa, A. Palva, M. Schlegel, H. S. Ali, P. Suominen, R. G. Ulrich, A. Vaheri, and O. Vapalahti, 2011: Orthopox virus infections in Eurasian wild rodents. Vector Borne Zoonotic Dis. 11, Klempa, B., L. Radosa, and D. H. Kr uger, 2013: The broad spectrum of hantaviruses and their hosts in Central Europe. Acta Virol. 57, Kr uger, D. H., R. G. Ulrich, and J. Hofmann, 2013: Hantaviruses as zoonotic pathogens in Germany. Dtsch. Arztebl. Int. 110, Linard, C., P. Lamarque, P. Heyman, G. Ducoffre, V. Luyasu, K. Tersago, S. O. Vanwambeke, and E. F. Lambin, 2007: Determinants of the geographic distribution of Puumala virus and Lyme borreliosis infections in Belgium. Int. J. Health Geogr. 6, 15. Mayer-Scholl, A., J. A. Hammerl, S. Schmidt, R. G. Ulrich, M. Pfeffer, D. Woll, H. C. Scholz, A. Thomas, and K. N ockler, 2014: Leptospira spp. in rodents and shrews in Germany. Int. J. Environ. Res. Public Health 11, Mertens, M., R. W olfel, K. Ullrich, K. Yoshimatsu, J. Blumhardt, I. R omer, J. Esser, J. Schmidt-Chanasit, M. H. Groschup, G. Dobler, S. S. Essbauer, and R. G. Ulrich, 2009: Seroepidemiological study in a Puumala virus outbreak area in South-East Germany. Med. Microbiol. Immunol. 198, Mertens, M., E. Kindler, P. Emmerich, J. Esser, C. Wagner- Wiening, R. W olfel, R. Petraityte-Burneikiene, J. Schmidt- Chanasit, A. Zvirbliene, M. H. Groschup, G. Dobler, M. Pfeffer, G. Heckel, R. G. Ulrich, and S. S. Essbauer, 2011: Phylogenetic analysis of Puumala virus subtype Bavaria, characterization and diagnostic use of its recombinant nucleocapsid protein. Virus Genes 43, Nainys, J., A. Timinskas, J. Schneider, R. G. Ulrich, and A. Gedvilaite, 2015: Identification of two novel members of the tentative genus Wukipolyomavirus in wild rodents. PLoS One 10, e Olsson, G. E., N. White, C. Ahlm, F. Elgh, A. C. Verlemyr, P. Juto, and R. T. Palo, 2002: Demographic factors associated with hantavirus infection in bank voles (Clethrionomys glareolus). Emerg. Infect. Dis. 8, Parson, W., K. Pegoraro, H. Niederst atter, M. F oger, and M. Steinlechner, 2000: Species identification by means of the cytochrome b gene. Int. J. Legal Med. 114, Pilaski, J., C. Ellerich, T. Kreutzer, A. Lang, W. Benik, A. Pohl- Koppe, L. Bode, E. Vanek, I. B. Autenrieth, K. Bigos, and H. W. Lee, 1991: Haemorrhagic fever with renal syndrome in Germany. Lancet 337, Blackwell Verlag GmbH 9
168 Heterogeneous Distribution of Puumala virus S. Drewes et al. Pilaski, J., H. Feldmann, S. Morzunov, P. E. Rollin, S. L. Ruo, B. Lauer, C. J. Peters, and S. T. Nichol, 1994: Genetic identification of a new Puumala virus strain causing severe hemorrhagic fever with renal syndrome in Germany. J. Infect. Dis. 170, R Core Team, 2015: R: A Language and Environment for Statistical Computing. Available at: Razzauti, M., A. Plyusnina, H. Henttonen, and A. Plyusnin, 2013: Microevolution of Puumala hantavirus during a complete population cycle of its host, the bank vole (Myodes glareolus). PLoS One 8, e Reil, D., C. Imholt, J. A. Eccard, and J. Jacob, 2015: Beech fructification and bank vole population dynamics combined analyses of promoters of human Puumala virus infections in Germany. PLoS One 10, e Reil,D.,C.Imholt,S.Drewes,R.G.Ulrich,J.A.Eccard,and J. Jacob, 2016: Environmental conditions in favour of a hantavirus outbreak in 2015 in Germany? Zoonoses Public Health 63, Robert Koch-Institut, 2015: Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten f ur 2014, pp Robert Koch-Institut, Berlin. Schilling, S., P. Emmerich, B. Klempa, B. Auste, E. Schnaith, H. Schmitz, D. H. Kr uger, S. G unther, and H. Meisel, 2007: Hantavirus disease outbreak in Germany: limitations of routine serological diagnostics and clustering of virus sequences of human and rodent origin. J. Clin. Microbiol. 45, Schlegel, M., H. S. Ali, N. Stieger, M. H. Groschup, R. Wolf, and R. G. Ulrich, 2012: Molecular identification of small mammal species using novel cytochrome B gene-derived degenerated primers. Biochem. Genet. 50, Schmidt, K., K. M. Dressel, M. Niedrig, M. Mertens, S. A. Sch ule, and M. H. Groschup, 2013: Public health and vectorborne diseases a new concept for risk governance. Zoonoses Public Health 60, Schmidt, S., M. Saxenhofer, S. Drewes, M. Schlegel, K. M. Wanka, R. Frank, S. Klimpel, F. von Blanckenhagen, D. Maaz, C. Herden, J. Freise, R. Wolf, M. Stubbe, P. Borkenhagen, H. Ansorge, J. A. Eccard, J. Lang, E. Jourdain, J. Jacob, P. Marianneau, G. Heckel, and R. G. Ulrich, 2016: High genetic structuring of Tula hantavirus. Arch. Virol. 161, Tersago, K., R. Verhagen, A. Servais, P. Heyman, G. Ducoffre, and H. Leirs, 2009: Hantavirus disease (nephropathia epidemica) in Belgium: effects of tree seed production and climate. Epidemiol. Infect. 137, Ulrich, R. G., H. Meisel, M. Sch utt, J. Schmidt, A. Kunz, B. Klempa, M. Niedrig, G. Pauli, D. H. Kr uger, and J. Koch, 2004: Prevalence of hantavirus infections in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 47, Voutilainen, L., E. R. Kallio, J. Niemimaa, O. Vapalahti, and H. Henttonen, 2016: Temporal dynamics of Puumala hantavirus infection in cyclic populations of bank voles. Sci. Rep. 6, Weber de Melo, V., H. Sheikh Ali, J. Freise, D. K uhnert, S. Essbauer, M. Mertens, K. M. Wanka, S. Drewes, R. G. Ulrich, and G. Heckel, 2015: Spatiotemporal dynamics of Puumala hantavirus associated with its rodent host, Myodes glareolus. Evol. Appl. 8, Zeimes, C. B., S. Quoilin, H. Henttonen, O. Lyytik ainen, O. Vapalahti, J. M. Reynes, C. Reusken, A. N. Swart, K. Vainio, M. Hjertqvist, and S. O. Vanwambeke, 2015: Landscape and regional environmental analysis of the spatial distribution of hantavirus human cases in Europe. Front. Public Health 3, 54. Z oller, L., M. Faulde, H. Meisel, B. Ruh, P. Kimmig, U. Schelling, M. Zeier, P. Kulzer, C. Becker, M. Roggendorf, E. K. F. Bautz, D. H. Kr uger, and G. Darai, 1995: Seroprevalence of hantavirus antibodies in Germany as determined by a new recombinant enzyme immunoassay. Eur. J. Clin. Microbiol. Infect. Dis. 14, Supporting Information Additional Supporting Information may be found in the online version of this article: Table S1. Abundance indices and results of serological and RT-PCR investigations of bank voles trapped at the eight districts during 2012 and 2013 presented per trapping season and age/maturity groups according to Bajer et al. (2002) Blackwell Verlag GmbH
169 3 1
170
171 RESEARCH LETTERS This case highlights 2 issues: the unknown epidemiology of CHIKV in Africa and the difficulty of diagnosing one arboviral infection during an outbreak of another arboviral infection. Further research is necessary to elucidate the true extent of CHIKV in African countries and to understand the public health implications of co-infection and co-distribution of multiple arboviruses. This work was supported by a grant from the National Center for Global Health and Medicine ( ). Dr. Takaya is a medical doctor at the National Center for Global Health and Medicine, Disease Control and Prevention Center. Her main research interest is tropical infectious diseases. References 1. Filipe AF, Pinto MR. Arbovirus studies in Luanda, Angola. 2. Virological and serological studies during an outbreak of denguelike disease caused by the chikungunya virus. Bull World Health Organ. 1973;49: World Health Organization. Situation report: yellow fever outbreak in Angola W30, 29 July 2016 [cited 2016 Aug 18] World Health Organization. Rift Valley fever in China [cited 2016 Aug 18] Ross RW. The Newala epidemic. III. The virus: isolation, pathogenic properties and relationship to the epidemic. J Hyg (Lond). 1956;54: S Moyen N, Thiberville SD, Pastorino B, Nougairede A, Thirion L, Mombouli JV, et al. First reported chikungunya fever outbreak in the republic of Congo, PLoS One. 2014;9:e Ochieng C, Ahenda P, Vittor AY, Nyoka R, Gikunju S, Wachira C, et al. Seroprevalence of infections with dengue, Rift Valley fever and chikungunya viruses in Kenya, PLoS One. 2015;10:e Gudo ES, Pinto G, Vene S, Mandlaze A, Muianga AF, Cliff J, et al. Serological evidence of chikungunya virus among acute febrile patients in southern Mozambique. PLoS Negl Trop Dis. 2015;9:e Centers for Disease Control and Prevention. Geographic distribution. Where has chikungunya virus been found? [cited 2016 Aug 18] Furuya-Kanamori L, Liang S, Milinovich G, Soares Magalhaes RJ, Clements AC, Hu W, et al. Co-distribution and co-infection of chikungunya and dengue viruses. BMC Infect Dis. 2016;16: Parreira R, Centeno-Lima S, Lopes A, Portugal-Calisto D, Constantino A, Nina J. Dengue virus serotype 4 and chikungunya virus coinfection in a traveller returning from Luanda, Angola, January Euro Surveill. 2014;19: Address for correspondence: Satoshi Kutsuna or Saho Takaya, Disease Control and Prevention Center, National Center for Global Health and Medicine, , Toyama, Shinjuku, Tokyo , Japan; sonare.since1192@gmail.com or takayasaho@gmail.com Puumala Virus in Bank Voles, Lithuania Petra Straková, Sandra Jagdmann, Linas Balčiauskas, Laima Balčiauskienė, Stephan Drewes, Rainer G. Ulrich Author affiliations: Academy of Sciences, Brno, Czech Republic (P. Straková); Masaryk University, Brno (P. Straková); Friedrich-Loeffler-Institut, Greifswald-Insel Riems, Germany (P. Straková, S. Jagdmann, S. Drewes, R.G. Ulrich); Nature Research Centre, Vilnius, Lithuania (L. Balčiauskas, L. Balčiauskienė) DOI: Little is known about the presence of human pathogenic Puumala virus (PUUV) in Lithuania. We detected this virus in bank voles (Myodes glareolus) in a region of this country in which previously PUUV-seropositive humans were identified. Our results are consistent with heterogeneous distributions of PUUV in other countries in Europe. Puumala virus (PUUV) (family Bunyaviridae) is an enveloped hantavirus that contains a single-stranded trisegmented RNA genome of negative polarity (1). PUUV harbored by the bank vole (Myodes glareolus) is the most prevalent human pathogenic hantavirus in Europe (2). A high population density of bank voles can lead to disease clusters and possible outbreaks of nephropathia epidemica, a mild-to-moderate form of hantavirus disease (3). In contrast to the Fennoscandian Peninsula and parts of central Europe (4,5), little is known about the epidemiology of PUUV in Poland and the Baltic States. Recent investigations confirmed the presence of PUUV in certain parts of Poland (5,6). A molecular study of bank voles in Latvia identified 2 PUUV lineages (Russian and Latvian) (7). In Estonia, serologic and molecular screening provided evidence of the Russian PUUV lineage (8). For Lithuania, a previous serosurvey indicated the presence of PUUVspecific antibodies in humans from 3 counties (online Technical Appendix Figure 1, article/23/1/ techapp1.pdf). However, molecular evidence of PUUV in humans or in voles is lacking (9). We report a molecular survey of rodent populations in Lithuania at 5 trapping sites, including 2 sites in counties where PUUV-specific antibodies were previously detected in humans (online Technical Appendix Figure 1). A total of 134 bank voles, 72 striped field mice (Apodemus agrarius), and 59 yellow-necked field mice (A. flavicollis) were captured during Three trapping sites (Juodkrantė, Elektrėnai, and Lukštas) were located in forests at or near 158 Emerging Infectious Diseases Vol. 23, No. 1, January 2017
172 RESEARCH LETTERS a cormorant colony, and 2 trapping sites (Žalgiriai and Rusnė) were located in a wet forest and flooded meadows. All applicable institutional and national guidelines for the care and use of animals were followed. For PUUV detection, we extracted RNA from bank vole lung tissue samples by using the Qiazol Protocol (QIAGEN, Hilden, Germany) and conducting screening by using a small segment RNA specific reverse transcription PCR (RT-PCR) and primers Pu342F and Pu1102R (6). We detected PCR products for 5 (LT15/164, LT15/165, LT15/166, LT15/174, and LT15/201) of 45 bank voles from the Lukštas trapping site. All 9 striped field mice and 2 yellow-necked field mice from Lukštas showed negative results for the PUUV RT-PCR. We amplified the complete nucleocapsid protein encoding region for 3 of the 5 samples positive by RT-PCR with 3 primer pairs: PuNCRS (5 -TAGTAG- TAGACTCCTTGAA-3 )/Pu255R (5 -TGGACACAG- CATCTGCCA-3 ), Pu40F (5 -CTGGAATGAGTGACTTA- AC-3 )/Pu393R (5 -TATGGTAATGTCCTTGATGT-3 ), and Pu1027F (5 -ATGGCAGAGTTAGGTGCA-3 )/Pu1779R (5 -TCAGCATGTTGAGGTAGT-3 ). RT-PCR products were directly sequenced by using the BigDye Terminator Version 1.1 Cycle Sequencing Kit (Applied Biosystems, Darmstadt, Germany). We deposited the sequences of the 5 samples in GenBank under accession nos. KX757839, KY757840, KX , KX751706, and KX (Figure; online Technical Appendix Figure 2). The 3 nucleocapsid protein encoding nucleotide sequences showed identities of 98.2% 99.8%, and the 3 deduced nucleocapsid protein amino acid sequences showed identities of 99.8% 100% (online Technical Appendix Table). We found the highest similarity of the 3 nucleotide and corresponding amino acid sequences for the PUUV strain from Latvia (Jelgava1/Mg149/2008; JN657228): nucleotide sequence 89.8% 90.4% and amino acid sequence 99.8% 100% (online Technical Appendix Table). We generated phylogenetic trees by using MrBayes software ( php) and MEGA6 software ( net/) for complete (1,302 nt; Figure) and partial (465 nt; online Technical Appendix Figure 2) nucleocapsid protein encoding sequences. Phylogenetic analysis confirmed results of pairwise nucleotide sequence divergence analysis, which indicated clustering of PUUV sequences from Lithuania with sequences from northern Poland (online Technical Appendix Figure 2) and the Jelgava 1 strain from Latvia (Figure). These sequences of the Latvian clade are well separated from the Russian and all other European PUUV clades. To evaluate a potential association of PUUV with evolutionary lineages of the bank vole, we determined vole cytochrome b gene sequences, deposited them in GenBank Figure. Phylogenetic tree based on complete nucleocapsid gene sequences of Puumala virus (PUUV) strains from Lithuania (LT), Latvia (Jelgava1), and other PUUV clades. Tula virus (TULV) was used as the outgroup. The tree was generated by Bayesian and maximum-likelihood analysis using MrBayes ( mrbayes.sourceforge.net/download.php) and MEGA6 software ( The optimal substitution model was calculated by using jmodeltest ( google.com/p/jmodeltest2). The Bayesian tree was based on transition model 2 with invariant sites and gamma distribution and 4 million generations. For maximum-likelihood analysis, the Kimura 2-parameter model and 1,000 bootstrap replicates were used. Posterior probabilities are indicated before slashes, and bootstrap values are indicated after slashes. Scale bar indicates nucleotide substitutions per site. ALAD, Alpe-Adrian lineage; CE, Central European lineage; DAN, Danish lineage; FIN, Finnish lineage; HOKV, Hokkaido virus; LAT, Latvian lineage; N-SCA, North-Scandinavian lineage; RUS, Russian linage; S-SCA, South- Scandinavian lineage. under accession nos. KX (LT15/164), KX (LT15/165), KX (LT15/166), KX (LT15/174), and KX (LT15/201), and compared them with cytochrome b prototype sequences of evolutionary lineages. Consistent with results for northern Poland (6), we identified 2 bank vole lineages at Lukštas, and the PUUV sequences were detected in 4 bank voles of the Carpathian phylogroup and in 1 vole of the Eastern lineage. In conclusion, we detected PUUV in bank voles at 1 site (Lukštas) in Lithuania (prevalence of 11.1%). This site is located in a region where PUUV-seropositive persons were identified (9) and near the border with Latvia (online Technical Appendix Figure 1). The absence of PUUV in bank voles at 4 other sites might have been caused by the small number of voles tested. However, our results are consistent with heterogeneous distributions of PUUV in other countries (10). Detection of this novel PUUV strain by using a specific RT-PCR confirms the reliability of this assay for molecular diagnostic and epidemiologic studies of this virus in Lithuania. Future large-scale monitoring studies are needed Emerging Infectious Diseases Vol. 23, No. 1, January
173 RESEARCH LETTERS to evaluate the geographic distribution and temporal fluctuation of PUUV in bank vole populations in Lithuania. Acknowledgment We thank Nicole Reimer for generating Technical Appendix Figure 1. P.S. was supported by a stipend from the Erasmus Programme. Ms. Straková is a doctoral student at Masaryk University, Brno, Czech Republic. Her research interests are zoonotic viruses, vectorborne diseases, and molecular diagnostics. References 1. Plyusnin A, Beaty BJ, Elliot RM, Goldbach R, Kormelink R, Lundkvist A, et al. Family Bunyaviridae. In: King AM, Adams MJ, Carstens EB, Lefkowitz EJ, editors. Virus taxonomy: ninth report of the international committee on taxonomy of viruses. San Diego: Elsevier Academic Press; p Heyman P, Ceianu CS, Christova I, Tordo N, Beersma M, João Alves M, et al. A five-year perspective on the situation of haemorrhagic fever with renal syndrome and status of the hantavirus reservoirs in Europe, Euro Surveill. 2011;16: Clement J, Maes P, van Ypersele de Strihou C, van der Groen G, Barrios JM, Verstraeten WW, et al. Beechnuts and outbreaks of nephropathia epidemica (NE): of mast, mice and men. Nephrol Dial Transplant. 2010;25: gfq Klempa B, Radosa L, Krüger DH. The broad spectrum of hantaviruses and their hosts in central Europe. Acta Virol. 2013;57: Michalski A, Niemcewicz M, Bielawska-Drózd A, Nowakowska A, Gaweł J, Pitucha G, et al. Surveillance of hantaviruses in Poland: a study of animal reservoirs and human hantavirus disease in Subcarpathia. Vector Borne Zoonotic Dis. 2014;14: Ali HS, Drewes S, Sadowska ET, Mikowska M, Groschup MH, Heckel G, et al. First molecular evidence for Puumala hantavirus in Poland. Viruses. 2014;6: v Razzauti M, Plyusnina A, Niemimaa J, Henttonen H, Plyusnin A. Co-circulation of two Puumala hantavirus lineages in Latvia: a Russian lineage described previously and a novel Latvian lineage. J Med Virol. 2012;84: Golovljova I, Sjölander KB, Lindegren G, Vene S, Vasilenko V, Plyusnin A, et al. Hantaviruses in Estonia. J Med Virol. 2002;68: Sandmann S, Meisel H, Razanskiene A, Wolbert A, Pohl B, Krüger DH, et al. Detection of human hantavirus infections in Lithuania. Infection. 2005;33: s Drewes S, Turni H, Rosenfeld UM, Obiegala A, Strakova P, Imholt C, et al. Reservoir-driven heterogeneous distribution of recorded human Puumala virus cases in South-West Germany. Zoonoses and Public Health. In press Address for correspondence: Rainer G. Ulrich, Friedrich-Loeffler- Institut, Federal Research Institute for Animal Health, Institute for Novel and Emerging Infectious Diseases, Südufer 10, Greifswald-Insel Riems, Germany, rainer.ulrich@fli.de Loiasis in US Traveler Returning from Bioko Island, Equatorial Guinea, 2016 David H. Priest, Thomas B. Nutman Author affiliations: Novant Health, Winston-Salem, North Carolina, USA (D.H. Priest); National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, Maryland, USA (T.B. Nutman) DOI: The filarial parasite Loa loa overlaps geographically with Onchocera volvulus and Wuchereria bancrofti filariae in central Africa. Accurate information regarding this overlap is critical to elimination programs targeting O. volvulus and W. bancrofti. We describe a case of loiasis in a traveler returning from Bioko Island, Equatorial Guinea, a location heretofore unknown for L. loa transmission. Loiasis (African eye worm disease) is caused by infection with Loa loa, a parasitic vector-borne filarial worm endemic to 10 countries in central and western Africa, including Equatorial Guinea (1). The worm, spread by the bite of Chrysops dimidiata and C. silacea flies, is of public health concern because of its geographic overlap with Onchocerca volvulus and Wuchereria bancrofti worms, which cause onchocerciasis and lymphatic filariasis, respectively (2). Mass drug administration programs for onchocerciasis and lymphatic filariasis often include ivermectin, which can cause serious and occasionally fatal adverse neurologic reactions in persons with high levels of circulating L. loa microfilariae (3). To avoid such reactions, an accurate picture of the geographic distribution of L. loa infection is needed. Given the importance of epidemiologic data in the management of filarial infections, we report a case of loiasis in a US woman who had traveled to Equatorial Guinea. In May 2016, a 25-year-old woman sought care in Winston-Salem, North Carolina, USA, for fatigue, swelling of her left ankle, right knee pain, and intensely pruritic skin lesions on her lower extremities. She had lived on Bioko Island, Equatorial Guinea, during October 2015 March 2016 while studying local wildlife. On Bioko Island, she frequented local water sources to bathe and wash clothes and consistently took atovaquone/proguanil for malaria prophylaxis. She did not spend time on Equatorial Guinea s mainland or travel to other nations in central or western Africa. Her flight from the United States to Bioko Island connected in Ethiopia; she did not leave the airport. Symptoms developed soon after her return to North Carolina in late March Laboratory evaluations 160 Emerging Infectious Diseases Vol. 23, No. 1, January 2017
174
175 4 1
176
177 Infection, Genetics and Evolution 48 (2017) Contents lists available at ScienceDirect Infection, Genetics and Evolution journal homepage: Short communication Novel hantavirus identified in European bat species Nyctalus noctula Petra Straková a,b,c,d, Lucie Dufkova a,janaširmarová a,jiří Salát a,tomáš Bartonička b,borisklempa e,f, Florian Pfaff g,dirkhöper g, Bernd Hoffmann g,rainerg.ulrich d,danielrůžek a,h, a Department of Virology, Veterinary Research Institute, Brno, Czech Republic b Faculty of Science, Masaryk University, Brno, Czech Republic c Institute of Vertebrate Biology, Czech Academy of Sciences, Brno, Czech Republic d Institute for Novel and Emerging Infectious Diseases, Friedrich-Loeffler-Institut, Greifswald-Insel Riems, Germany e Biomedical Research Center, Slovak Academy of Sciences, Bratislava, Slovakia f Charité Medical School, Berlin, Germany g Institute of Diagnostic Virology, Friedrich-Loeffler-Institut, Greifswald-Insel Riems, Germany h Institute of Parasitology, Biology Centre of the Czech Academy of Sciences, České Budějovice, Czech Republic article info abstract Article history: Received 27 September 2016 Received in revised form 21 December 2016 Accepted 22 December 2016 Available online 23 December 2016 Keywords: Hantavirus Bat Phylogenetic analysis Emerging virus Bat-borne virus Hantaviruses are emerging RNA viruses that cause human diseases predominantly in Asia, Europe, and the Americas. Besides rodents, insectivores and bats serve as hantavirus reservoirs. We report the detection and genome characterization of a novel bat-borne hantavirus isolated from insectivorous common noctule bat. The newfound virus was tentatively named as Brno virus Elsevier B.V. All rights reserved. 1. Introduction Hantaviruses (genus Hantavirus, family Bunyaviridae) are responsible for life-threatening human diseases: hantavirus cardiopulmonary syndrome (HCPS) in the Americas and hemorrhagic fever with renal syndrome (HFRS) in Asia and Europe (Krüger et al., 2011). Rodents are natural reservoirs of hantaviruses; however, recent studies have demonstrated that insectivores and bats also represent hosts for divergent hantaviruses (Xu et al., 2015; Zhang, 2014; Witkowski et al., 2016). Bats are considered the natural reservoir of a large variety of zoonotic viruses causing serious human diseases, such as lyssaviruses, henipaviruses, severe acute respiratory syndrome coronavirus, and Ebola virus (Li et al., 2010). Genetically divergent bat-borne hantaviruses have been identified in Africa Mouyassue virus (MOYV) in Cote d'ivoire (Sumibcay et al., 2012), Magboi virus (MGBV) in Sierra Leone (Weiss et al., 2012), and Makokou virus (MAKV) in Gabon (Witkowski et al., 2016) and in Asia Xuan Son virus (XSV) in Vietnam (Arai et al., 2013), Huangpi virus (HUPV), Longquan virus (LQUV), Laibin virus (LBV) in China (Xu et al., 2015; Guo et al., 2013), and Quezon virus (QZNV) in the Philippines (Arai et al., 2016). Here we Corresponding author at: Veterinary Research Institute, Hudcova 70, CZ Brno, Czech Republic. address: ruzekd@paru.cas.cz (D. Růžek). report the detection of a novel hantavirus, tentatively named Brno virus (BRNV), in the European insectivorous bat species Nyctalus noctula collected in the Czech Republic, Central Europe. For genetic characterization, the three genome segments were sequenced by high-throughput sequencing (HTS). 2. The study A total of 53 bats were collected during the years in the South Moravia region in the Czech Republic. The sample collection contained bats that died accidentally or were found dead in the field. Bats represented 14 different species from two families: Eptesicus nilssonii (n = 1), E. serotinus (n = 1), Hypsugo savii (n = 4), Myotis bechsteinii (n = 1), M. daubentonii (n = 3), M. emarginatus (n = 1), M. mystacinus (n = 1), M. myotis (n = 1), Nyctalus noctula (n = 12), Pipistrellus pipistrellus (n = 15), Plecotus auritus (n = 2), Pl. austriacus (n = 2), Vespertilio murinus (n = 6) of the family Vespertilionidae and Rhinolophus hipposideros (n = 3) of the family Rhinolophidae. Total RNA was extracted from the lungs, kidneys and livers of all animals using QIAamp viral RNA Mini Kit (QIAGEN) or QIAZOL/TRIZOL method and screened for the presence of hantavirus RNA by a broadspectrum RT-PCR targeting the large (L) genome segment of hantaviruses (Klempa et al., 2006). Hantavirus RNA was identified in two noctule bats (N. noctula the species was determined morphologically / 2016 Elsevier B.V. All rights reserved.
178 128 P. Straková et al. / Infection, Genetics and Evolution 48 (2017) and confirmed by HTS-based results of three host genes) collected in the city of Brno. The obtained sequences (369 base pairs, bp) were designated as Brno 7/2012/CZE (amplified from liver tissue) and Brno 11/2013/ CZE (identical sequences were obtained from liver and kidney samples) and deposited in GenBank (accession numbers KR and KR920360, respectively). Attempts to isolate the virus were done in Vero cells and in suckling mice, but were negative. In order to determine the whole genome sequence of BRNV, IonTorrent HTS was conducted. The sample Brno 7/2012/CZE was selected as most suitable for sequencing based on high viral loads in a novel BRNV-specific real-time RT-qPCR (qscript XLT 1-step RT-PCR Kit (Quanta/VWR)). Briefly, RNA was extracted from the liver tissue (QIAamp RNeasy mini Kit, Qiagen) and its concentration was measured with a Nanodrop 1000 photometer (RNA concentrations in the two samples were of ng/μl and ng/μl). A purification and concentration step with RNA clean beads (Beckman Coulter) followed. Synthesis of cdna was performed with a cdna Synthesis kit (Roche) and resulting cdna was fragmented by M220 Focused-ultrasonicator (Corvaris). This fragmented cdna with an average length of about 500 bp was used for library preparation (Gene Read Library Prep Kit, Qiagen). The library was purified and size selected using AMPure XP Beads (Beckman Coulter). Optimal size distribution and quality of the resulting library were verified on a Bioanalyzer in combination with a DNA High Sensitivity Chip (Agilent). The library was quantified with the Ion Library Taqman Quantitation Kit (ThermoFisher). Sequencing was performed on an Ion Personal Genome Machine (ThermoFisher) according to manufacturer's guidelines. A metagenomics analysis of the complete dataset was conducted using RIEMS software (Scheuch et al., 2015). Reads classified as related to the family Bunyaviridae were extracted and de-novo assembled into contigs using 454 Sequencing System Software (version 3.0). Resulting contigs were subsequently analyzed using the BioEdit software (Hall, 1999) and Geneious 9.0.5(Kearse et al., 2012). The lengths of the sequences of S, M and L gene segments were 1441, 3575 and 6528 nt, respectively, encoding nucleocapsid protein (N), glycoprotein precursor (GPC) and viral RNA-dependent RNA polymerase (L) proteins of 423, 1136 and 2145 amino acids in length, respectively (GenBank accession numbers: KX845678, KX845679, KX845680). Sequence comparison revealed that the three genome segments and the encoded proteins of BRNV showed % nucleotide and % amino acid sequence identity with other bat-borne hantaviruses while sequence identity with hantaviruses from rodents, shrews and moles ranged between 50.1 and 64.8%at the nucleotide and between 38.9 and 64.1% at amino acid level (Table 1). The observed amino acid sequence differences clearly exceed one of the current species demarcation criteria of the current International Committee on Taxonomy of Viruses (ICTV) for the genus Hantavirus, 7% difference in amino acid sequences of the N and GPC proteins. The current ICTV criteria also include serological differences in virus neutralization, preventing virus classification without a cell culture isolate. However, a new proposal for species demarcation criteria (assigned code of the proposal: a,bM; available for download at talk.ictvonline.org), submitted by the ICTV Bunyaviridae Study Group, is currently under consideration which allows the classification solely based on genetic data. It is based on a concatenated multiple sequence alignment of complete amino acid sequences of the N and GPC proteins which is used to calculate PED (pairwise evolutionary distances) values using WAG amino acid substitution matrix. A species of the genus Hantavirus is defined by a PED value greater than 0.1. According to this criterion, BRNV clearly represents a new hantavirus species because the lowest PED value, observed for the most closely related LQUV, is 0.5. The obtained BRNV sequences were subjected to phylogenetic analyses within the Maximum Likelihood framework using MEGA7 (Kumar et al., 2016). Unfortunately, only partial L segment sequences are available for the majority of bat-borne hantaviruses. Therefore, we first based our analysis on a short L segment dataset (352 nt) which contains all currently recognized bat-borne hantaviruses (Fig. 1). BRNV clustered within the clade containing all bat-borne hantaviruses and shared the Table 1 Nucleotide and amino acid sequence identities (%) of three genome segments and corresponding encoded nucleocapsid protein (N), glycoprotein precursor (GPC) and RNA-dependent RNA polymerase (RdRp) between Brno virus (BRNV) and other representative bat-, insectivore- and rodent-borne hantaviruses a. Host Virus strain Country S segment/n M segment/gpc L segment/rdrp 1272 nt 424 aa 3411 nt 1137 aa 6435 nt 2145 aa Bats Longquan virus China b 80.5 b Laibin virus China Huangpi virus China 65.6 b 64 b 71.7 b 81.7 b Xuan Son virus Vietnam b 54.4 b 70 b 75.1 b Mouyassue virus Côte d'ivoire 73.4 b 78.9 b Magboi virus Sierra Leone 74.2 b 75.7 b Makokou virus Gabon 66.8 b 67.6 b Quezon virus Philippines Shrews Uluguru virus Tanzania b 42.9 b Altai virus Russia 56.9 b 52.6 b 54.8 b 48.9 b Cao Bang virus Vietnam Seewis virus Switzerland b 46.9 b 60.7 b 60.3 b Thottapalayam virus India Moles Nova virus Belgium Asama virus Japan b 40.3 b 64.8 b 64.1 b Rodents Puumala virus Finland Sin Nombre virus USA Seoul virus Korea Hantaan virus Korea Dobrava-Belgrade virus Greece Tula virus Czech Republic no sequence available. a Viral sequences used to generate sequence identities: Bat-borne hantaviruses: Longquan virus (JX465415, JX465397, JX465381), Laibin virus (KM102247, KM102248, KM102249), Huangpi virus (JX473273, JX465369), Xuan Son virus (KF704710, KJ000539, KF704715), Mouyassue virus (JQ287716), Magboi virus (JN037851), Makokou virus (KT316176), Quezon virus (KU950713, KU950714, KU950715); Shrew-borne hantaviruses: Uluguru virus (JX193695, JX193696, JX193697), Altai virus (KM361048, KM361053, KM361061), Cao Bang virus (EF543524, EF543526, EF543525), Thottapalayam virus (NC_010704, NC_010708, NC_010707), Seewis virus (EF636024, EF636025, EF636026); Mole-borne hantaviruses: Nova virus (KT004445, KT004446, KT004447), Asama virus (EU929072, EU929075, EU929078); Rodent-borne hantaviruses: Puumala virus (NC_005224, NC_005223, NC_005225), Sin Nombre virus (NC_005216, NC_005215, NC_005217), Seoul virus (NC_005236, NC_005237, NC_005238), Hantaan virus (NC_005218, NC_005219, NC_005222), Dobrava-Belgrade virus (NC_005233, NC_005234, NC_005235), Tula virus (NC_005227, NC_005228, NC_005226). b Comparison based on shorter sequences.
179 P. Straková et al. / Infection, Genetics and Evolution 48 (2017) Fig. 1. Maximum-Likelihood phylogenetic tree showing the phylogenetic position of Brno virus (BRNV; marked by black arrow and bold face) constructed on the basis of partial L segment nucleotide sequences (352 nt). Evolutionary analysis was conducted in MEGA7 (15). The evolutionary history was inferred by using the Maximum-Likelihood method based on the General Time Reversible (GTR) model with using a discrete Gamma distribution (+G) with 5 rate categories and by assuming that a certain fraction of sites are evolutionarily invariable (+I) which was estimated to be the Best-Fit substitution model according to Bayesian Information Criterion. The scale bars indicate an evolutionary distance in substitutions per position in the sequence. Bootstrap values 70%, calculated from 500 replicates, are shown at the tree branches. The insert shows the phylogenetic group containing all bat-borne hantaviruses (marked by bat pictogram) in greater detail. Rodent-borne hantaviruses associated with members of the families Muridae or Cricetidae are indicated by grey-shaded background. The list of the accession numbers used in the analysis is available from the authors upon request. Abbreviations: ALTV, Altai virus; ANDV, Andes virus; ARRV, Ash River virus; ARTV, Artybash virus; ASAV, Asama virus; ASIV, Asikkala virus; AZGV, Azagny virus; BAYV, Bayou virus; BCCV, Black Creek Canal virus; BOGV, Boginia virus; BOWV, Bowé virus; BRNV, Brno virus; CBNV, Cao Bang virus; CDV, Cano Delgadito virus; CHOV, Choclo virus; DOBV, Dobrava-Belgrade virus; HOKV, Hokkaido virus; HUPV, Huanqpi virus; HTNV, Hantaan virus; JEJV, Jeju virus; JMSV, Jemez Springs virus; KILV, Kilimanjaro virus; KKMV, Kenkeme virus; LAIV, Laibin virus; LHEV, Lianghe virus; LNV, Laguna Negra virus; LQUV, Longquan virus; MAKV, Makokou virus; MAPV, Maporal virus; MGBV, Magboi virus; MJNV, Imjin virus; MONV, Montano virus; MOUV, Mouyassué virus; MUJV, Muju virus; NVAV, Nova virus; OXBV, Oxbow virus; PHV, Prospect Hill virus; PUUV, Puumala virus; QDLV, Qiandao Lake virus; QZNV, Quezon virus; RIOMV, Rio Mamore virus; RKPV; Rockport virus; RPLV, Camp Ripley virus; SANGV, Sangassou virus; SEOV, Seoul virus; SERV, Serang virus; SNV, Sin Nombre virus; SWSV, Seewis virus; TANGV, Tanganya virus; TIGV, Tigray virus; THAIV, Thailand virus; TPMV, Thottapalayam virus; TULV, Tula virus; ULUV, Uluguru virus; VLAV, Vladivostok virus; XSV, Xuan Son virus. In cases of HTNV, PUUV, SWSV, and XSV, several sequences of the same virus were marked by grey curve to allow unambiguous designation of the taxa. most recent common ancestor with LQUV found in insectivorous Rhinolophus sp. bats in China. This pattern has been consequently observed in all other phylogenetic analyses including complete amino acid sequences for all three segments (phylogenetic trees based on partial sequences of S and M segments are shown in Supplementary Figs. 1 and 2).
180 130 P. Straková et al. / Infection, Genetics and Evolution 48 (2017) Conclusions In the present study a novel bat-borne hantavirus has been identified and its complete sequence of all coding genomic regions of has been determined. The successful determination of the genome segment sequences of BRNV provide reference data for improving detection methods and determining the genome sequences of further European bat-borne hantaviruses. Its phylogenetic relatedness to other bat-borne hantaviruses, high genetic distance to other known hantaviruses, and its independent detection in two distinct animals of the same species and in two organs led us to conclude that BRNV is an indigenous bat-borne hantavirus associated with common noctule bat (N. noctula). This study provided a missing molecular proof that bat-borne hantaviruses occur in Europe too, and need to be considered as putative public health threat. Acknowledgments This study was funded by grant no. LO1218 of the MEYS of the Czech Republic under the NPU I program (to D.R.), Ministry of Agriculture of the Czech Republic (RO0516 to D.R.), by the contract-research-project for the Bundeswehr Medical Service FV E/U2AD/CF512/DF557 META- InfRisk (to R.G.U.) and partially funded by the Slovak Scientific Grant Agency VEGA, grant number 2/0174/15 (to B.K.). The continuous support of Martin Beer is kindly acknowledged. Petra Straková acknowledges support by Erasmus + stipendium. Appendix A. Supplementary data Supplementary data to this article can be found online at doi.org/ /j.meegid References Arai, S., Nguyen, S.T., Boldgiv, B., Fukui, D., Araki, K., Dang, C.N., et al., Novel batborne hantavirus, Vietnam. Emerg. Infect. Dis. 19: /eid Arai, S., Taniguchi, S., Aoki, K., Yoshikawa, Y., Kyuwa, S., Tanaka-Taya, K., et al., Molecular phylogeny of a genetically divergent hantavirus harbored by the Geoffroy's rousette (Rousettus amplexicaudatus), a frugivorous bat species in the Philippines. Infect. Genet. Evol. 45: Guo, W.P., Lin, X.D., Wang, W., Tian, J.H., Cong, M.L., Zhang, H.L., et al., Phylogeny and origins of hantaviruses harbored by bats, insectivores, and rodents. PLoS Pathog. 9, e Hall, T.A., BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT. Nucleic Acids Symp. Ser. 41, Kearse, M., Moir, R., Wilson, A., Stones-Havas, S., Cheung, M., Sturrock, S., et al., Geneious Basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics 25: doi.org/ /bioinformatics/bts199. Klempa, B., Fichet-Calvet, E., Lecompte, E., Auste, B., Aniskin, V., Meisel, H., et al., Hantavirus in African wood mouse, Guinea. Emerg. Infect. Dis. 12: dx.doi.org/ /eid Krüger, D.H., Schönrich, G., Klempa, B., Human pathogenic hantaviruses and prevention of infection. Hum. Vaccin. 7: Kumar, S., Stecher, G., Tamura, K., MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets. Mol. Biol. Evol. 33: /molbev/msw054. Li, L., Victoria, J.G., Wang, C., Jones, M., Fellers, G.M., Kunz, T.H., et al., Bat guano virome: predominance of dietary viruses from insects and plants plus novel mammalian viruses. J. Virol. 84: Scheuch, M., Höper, D., Beer, M., RIEMS: a software pipeline for sensitive and comprehensive taxonomic classification of reads from metagenomics datasets. BMC Bioinf. 16:69. Sumibcay, L., Kadjo, B., Gu, S.H., Kang, H.J., Lim, B.K., Cook, J.A., et al., Divergent lineage of a novel hantavirus in the banana pipistrelle (Neoromicia nanus) in Cote d'ivoire. Virol. J. 9:34. Weiss, S., Witkowski, P.T., Auste, B., Nowak, K., Weber, N., Fahr, J., et al., Hantavirus in bat, Sierra Leone. Emerg. Infect. Dis. 18: eid Witkowski, P.T., Drexler, J.F., Kallies, R., Ličková, M., Bokorová, S., Mananga, G.D., et al., Phylogenetic analysis of a newfound bat-borne hantavirus supports a laurasiatherian host association for ancestral mammalian hantaviruses. Infect. Genet. Evol. 41: Xu, L., Wu, J., He, B., Qin, S., Xia, L., Qin, M., et al., Novel hantavirus identified in black-bearded tomb bats, China. Infect. Genet. Evol. 31: /j.meegid Zhang, Y.Z., Discovery of hantaviruses in bats and insectivores and the evolution of the genus Hantavirus. Virus Res. 187:
181 5 1
182
183 Research in Veterinary Science 102 (2015) Contents lists available at ScienceDirect Research in Veterinary Science journal homepage: Short Communication The common coot as sentinel species for the presence of West Nile and Usutu flaviviruses in Central Europe Petra Straková a,b, Silvie Šikutová a, Petra Jedličková a, Jiljí Sitko c, Ivo Rudolf a,b,,zdenekhubálek a,b a Institute of Vertebrate Biology v.v.i., Academy of Sciences, Brno, Czech Republic b Department of Experimental Biology, Faculty of Science, Masaryk University, Brno, Czech Republic c Comenius Museum, Ornithological Station, Přerov, Czech Republic article info abstract Article history: Received 23 March 2015 Received in revised form 20 July 2015 Accepted 2 August 2015 Keywords: West Nile virus Usutu virus Common coot Fulica atra Surveillance Mosquito-borne viruses Culex spp. We examined 146 common coots (Fulica atra) on fishponds in central Moravia, Czech Republic, for antibodies to West Nile (WNV) and Usutu (USUV) flaviviruses. Eighteen birds reacted in the plaque-reduction neutralization test against WNV; these WNV seropositive samples were then titrated in parallel against USUV and tick-borne encephalitis virus (TBEV) to exclude flavivirus cross-reactivity. Two birds (1.4% overall) had the highest titers against WNV while 9 birds (6.2% overall) were seropositive for USUV, and in 7 birds the infecting flavivirus could not be differentiated with certainty. Our results indicate that both WNV and USUV infections occur in common coots; these birds might serve as a sentinel species indicating the presence of these viruses at fishpond and wetland habitats in Central Europe Elsevier Ltd. All rights reserved. West Nile virus (WNV) and Usutu virus (USUV) belong to the genus Flavivirus (family Flaviviridae)(Hubálek, 2008). Both viruses circulate in nature between birds and bird-feeding mosquitoes. Migratory birds may be infected with WNV or USUV in their African wintering grounds and could carry the virus during spring migrations northward to European sites (Hannoun et al., 1972; Watson et al., 1972; Calistri et al., 2010). Usutu virus is an African virus but in 2001 it emerged surprisingly in Austria, causing fatal outbreaks in blackbirds (Turdus merula) and some other avian species (Weissenböck et al., 2002). In the following years, it spread to Hungary, Italy, Switzerland, Germany, Spain and Czechland (Bakonyi et al., 2007; Calzolari et al., 2010, 2012; Manarolla et al., 2010; Steinmetz et al., 2011; Jost et al., 2011; Becker et al., 2012; Vazquez et al., 2011; Hubálek et al., 2014). WNV and USUV can circulate together in certain ecosystems (Calzolari et al., 2010). In contrast to WNV, USUV has rarely caused human disease only in immunocompromised persons (Vazquez et al., 2011). However, neutralizing antibodies against Usutu virus were documented recently in sera of 3 patients with neuroinvasive disease (one patient presented with meningitis and two with meningoencephalitis) in Croatia (Vilibic-Cavlek et al., 2014). Corresponding author at: Institute of Vertebrate Biology, v.v.i., Academy of Sciences of the Czech Republic, Kvetna 8, CZ Brno, Czech Republic. address: rudolf@ivb.cz (I. Rudolf). In a previous study, we found that among 391 wild birds in Moravia (Czechland, i.e. territory of the Czech Republic), 13 had specific antibodies to WNV including several common coots (Fulica atra), and one coot had specific antibodies also against USUV (Hubálek et al., 2008a). We decided to assess prevalence of antibodies against WNV and USUV in this particular bird species in Moravia by examining a greater number of individuals. The birds were legally shot by fishermen and gamekeepers (they received a permit from Přerov and Kojetín municipalities) at fishponds in Záhlinice (49 17 N, E) near Přerov in central Moravia, Czech Republic, during September to October The serum samples were maintained at 20 C. All serum samples were inactivated at 56 C for 30 min and diluted 1:5 in Leibowitz L-15 medium. In a plaque-reduction neutralization microtest (PRNT: Hubálek et al., 2008a), the diluted serum samples (30 µl) were mixed in the microtiter plate wells with test dose of virus (30 µl, containing about 20 to 40 PFU) and incubated at 37 C for 60 min. Three viruses were used for neutralization tests WNV Eg- 101, TBEV Hypr, and USUV 939 all prepared as infected suckling mouse brain suspension in L-15 medium with 2% of fetal calf serum. During an initial screening (all sera diluted 1:5 and 1:10, i.e. final dilutions were 1:10 and 1:20), only WNV was used. Vero E6 cells grown at 37 C for 3 days in L-15 medium with 10% fetal calf serum and antibiotics were added to each well and incubated at 37 C for 4 h. After incubation, 120 μl of carboxymethylcellulose overlay was poured into each well, and after 3 to 5 days at 37 C, the cells were stained with 0.1% / 2015 Elsevier Ltd. All rights reserved.
184 160 P. Straková et al. / Research in Veterinary Science 102 (2015) solution of naphthalene black. The controls were titrations of test doses of the Eg-101 strain of WNV, immune mouse WNV reference serum, control negative bird serum and the cells without viruses (to reveal potential cytotoxic effect of individual avian sera). A 90% reduction of plaque-forming units (PFU) was used in this study as a measure of neutralization (PRNT 90 ), and reciprocal serum titers 20 or higher were considered positive. All WNV positive sera were then titrated in parallel with two other flaviviruses present in Czechland, i.e. USUV and TBEV, to exclude serological cross reactions. Serum samples from 146 common coots (F. atra)were first examined for the presence of WNV antibodies. During this initial screening, 18 coots were positive for WNV. However, when these sera were titrated against all three viruses in parallel, 9 tested birds were found to have specific antibodies against USUV, two birds had specific antibodies against WNV, while the prevalence of antibodies in 7 birds could not be differentiated by PRNT with certainty (Table 1). Local circulation of WNV in Czechland was first proved indirectly in 1985 and then in 1990 by hemagglutination-inhibition test in free-living wetland birds and sentinel ducks on South Moravian fishponds (Hubálek et al., 1989; Juřicová and Halouzka, 1993; Juřicová et al., 1993). After a big flood in Moravia in 1997, a higher prevalence rate of arboviruses in local mosquitoes was observed, and WNV-3 (Rabensburg) was isolated in that area repeatedly (Hubálek et al., 2000; Bakonyi et al., 2005). Moreover, WNV-2 was detected in south Moravia recently (Rudolf et al., 2014). In another study, 13 WNV specifically seroreactive birds were found, including 5 common coots (Hubálek et al., 2008a). These common coots came from fishponds at Zahlinice near Přerov. Interestingly, WNV antibodies were detected in coots also in other countries Spain (Figuerola et al., 2007), southern Russia (Lvov et al., 2008), Iran (Fereidouni et al., 2011) and India (Mishra et al., 2012). There are not enough data on the prevalence of USUV and antibodies against it because USUV is relatively new to Europe. Weissenböck et al. (2013) did a retrospective analysis of archived bird tissue samples and found USUV to be present in northern Italy as early as In Austria, USUV is endemic since its first occurrence in 2001 (Chvala et al., 2007; Meister et al., 2008). Bakonyi et al. (2007) tested dead birds in Hungary between years 2003 and 2006: they found one positive blackbird in 2005 and six positive blackbirds in Llorente et al. (2013) tested in parallel antibodies against WNV, Bagaza virus and USUV in partridges and pheasants in South Spain and recorded overall prevalence 10% against USUV. Steinmetz et al. (2011) noticed a mass mortality due to USUV in wild and captive songbirds and owls around the Zurich Zoo in Switzerland. In 2010, a strain of USUV was isolated from mosquitoes Culex pipiens pipiens in Germany where the first Table 1 Antibody reciprocal titers (PRNT 90 ) of 18 bird sera tested against three flaviviruses (West Nile, tick-borne encephalitis, Usutu). Specific reactions for particular viruses are printed in bold. Bird no. WNV TBEV USUV b b b b b b b b dead bird (mostly blackbirds) cases appeared in 2011 (Jost et al., 2011; Becker et al., 2012). In the same year, several blackbirds killed by USUV were reported in Czechland (Hubálek et al., 2014). Recent evidence of USUV RNA in Culex modestus in South Moravian fishponds indicates possible establishment of this virus in that country (Rudolf et al., in preparation). It is interesting that USUV strains from Germany, Switzerland, Austria, Hungary, Italy and Czechland are nearly identical in nucleotide sequence. Serological surveys sporadically detected antibodies to USUV in wild and game birds in additional European countries Great Britain (Buckley et al., 2003, 2006), Spain (Llorente et al., 2013) and Poland (Hubálek et al., 2008b). Reports on mosquito-borne viruses in the target bird of this study the common coot are sporadic. In India, Mishra et al. (2012) did a serosurvey of 1058 wild birds for WNV: 26 samples (2.5%) were positive (including common coots). In southern Spain, a total of 1213 birds belonging to 72 species were examined during preliminary screening for antibodies against WNV and 43 common coots reached positive WNV titres ranging from 1:20 to 1:640 (Figuerola et al., 2008). On the basis of this finding they focused on coots in Doñana NP, Spain, and detected WNV seroconversion in nine birds during the season (Figuerola et al., 2007). They also did parallel neutralization against USUV but all titers of 47 serum samples from the coots were higher to WNV than to USUV. According to an experimental study, American coots (Fulica americana) have very low competence to WNV (but only one bird was tested) and therefore another transmission mechanism should be taken into account, such as fecal oral transmission of WNV (Komar et al., 2003). A very interesting finding is that of Alkhovskij et al. (2003) who detected RNA of WNV in 15% of coots examined in the Volga delta which might indicate significant role of common coots in circulation and spread of WNV in that region. Detection of antibodies in migratory birds such as the common coot need not mean that the bird was infected at the place of sampling. For instance, the coots occurring in central Moravia during autumn migration (this study) breed in Czechland, but also in Poland and Baltic countries, while the coots breeding in Czechland usually migrate southwest to Austria, Switzerland, Italy, France and Spain (Cepák et al., 2008), where USUV might occur. This fact must be taken into account at interpretation of findings. Herein we examined serum samples obtained from 146 common coots in central Moravia for the specific WNV and USUV antibodies by PNRT 90. Two birds (1.4%) had specific antibodies against WNV and nine birds (6.2%) had specific antibodies against USUV. In conclusion, common coots might serve as a sentinel species indicating the presence of WNV and USUV at fishpond and wetland habitats in Central Europe and serological examinations of this species could be a potentially useful tool for surveillance of mosquito-borne viruses in Europe. Conflicts of interest The authors declare that they have no competing interests. Acknowledgments This study was funded by the EU grant FP EDENext and is cataloged as EDENext313. References Alkhovskij, S.V., Lvov, D.N., Samokhvalov, E.I., Prilipov, A.G., Lvov, D.K., Aristova, V.A., Gromashevskiĭ, V.L., Dzharkenov, A.F., Kovtunov, A.I., Deriabin, P.G., Odolevskiĭ, E.I., Ibragimov, R.M., Screening of birds in the Volga delta (Astrakhan region, 2001) for the West Nile virus by reverse transcription-polymerase chain reaction. Vopr. Virusol. 48, (in Russian). Bakonyi, T., Hubálek, Z., Rudolf, I., Nowotny, N., Novel flavivirus or new lineage of West Nile virus, Central Europe. Emerg. Infect. Dis. 11,
185 P. Straková et al. / Research in Veterinary Science 102 (2015) Bakonyi, T., Erdelyi, K., Ursu, K., Ferenczi, E., Csorgo, T., Lussy, H., Chvala, S., Bukovsky, C., Meister, T., Weissenbock, H., Nowotny, N., Emergence of Usutu virus in Hungary. J. Clin. Microbiol. 45, Becker, N., Jost, H., Ziegler, U., Eiden, M., Hoper, D., Emmerich, P., Fichet-Calvet, E., Ehichioya, D.D., Czajka, C., Gabriel, M., Hoffmann, B., Beer, M., Tenner-Racz, K., Racz, P., Gunther, S., Wink, M., Bosch, S., Konrad, A., Pfeffer, M., Groschup, M.H., Schmidt- Chanasit, J., Epizootic emergence of Usutu virus in wild and captive birds in Germany. PLoS One 7, e Buckley, A., Dawson, A., Moss, S.R., Hinsley, S.A., Bellamy, P.E., Gould, E.A., Serological evidence of West Nile virus, Usutu virus and Sindbis virus infection of birds in the UK. J. Gen. Virol. 84, Buckley, A., Dawson, A., Gould, E.A., Detection of seroconversion to West Nile virus, Usutu virus and Sindbis virus in U.K. sentinel chickens. Virol. J. 3, 71. Calistri, P., Giovannini, A., Hubálek, Z., Ionescu, A., Monaco, F., Savini, G., Lelli, R., Epidemiology of West Nile in Europe and in the Mediterranean basin. Open Virol. J. 4, Calzolari, M., Bonilauri, P., Bellini, R., Albieri, A., Defilippo, F., Mainli, G., Evidence of simultaneous circulation of West Nile and Usutu viruses in mosquitoes samples in Emilia-Romagna region (Italy) in PLoS One 5, e Calzolari, M., Gaibani, P., Bellini, R., Defilippo, F., Pieroo, A., Albieri, A., Maioli, G., Luppi, A., Rossini, G., Balzani, A., Tamba, M., Galletti, G., Gelati, A., Bonilauri, P., Mosquito, bird and human surveillance of West Nile and Usutu viruses in Emilia-Romagna region (Italy) in PLoS One 7, e Cepák, J., Klvaňa, P., Formánek, J., Horák, D., Jelínek, M., Schröpfer, L., Škopek, J., Zárybnický, J., Czech and Slovak Bird Migration Atlas. Aventinum, Praha (608 pp.). Chvala, C., Bakonyi, T., Bukovsky, C., Meister, T., Brigger, K., Rubel, F., Nowotny, N., Weissenböck, H., Monitoring of Usutu virus activity and spread by using dead bird surveillance in Austria, Vet. Microbiol. 122, Fereidouni, S.R., Ziegler, U., Linke, S., Niedrig, M., Modirrousta, H., Hoffmann, B., Groschup, M.H., West Nile virus monitoring in migrating and resident water birds in Iran: are common coots the main reservoirs of the virus in wetlands? Vector Borne Zoonotic Dis. 1, Figuerola, J., Soriguer, R., Rojo, G., Gómez Tejedor, C., Jimenez-Clavero, M.A., Seroconversion in wild birds and local circulation of West Nile virus, Spain. Emerg. Infect. Dis. 13, Figuerola, J., Jimenez-Clavero, M.A., Lopez, G., Rubio, C., Soriguer, R., Gomez-Tejedor, C., Tenorio, A., Size matters: West Nile virus neutralizing antibodies in resident and migratory birds in Spain. Vet. Microbiol. 132, Hannoun, C., Corniou, B., Bouchet, J., Role of migrating birds in arbovirus transfer between Africa and Europe. In: Cherepanov, A.I. (Ed.), Transcontinental Connections of Migratory Birds and their Role in the Distribution of Arboviruses. Nauka, Novosibirsk, pp Hubálek, Z., Mosquito-borne viruses in Europe. Parasitol. Res. 103, Hubálek, Z., Halouzka, J., Juřicová, Z., Pellantová, J., Hudec, K., Arboviruses associated with birds in southern Moravia, Czechoslovakia. Acta Sci. Nat. Brno 23, Hubálek, Z., Savage, H.M., Halouzka, J., Juřicová, Z., Sanogo, Y.O., Lusk, S., West Nile virus investigations in South Moravia, Czechland. Viral Immunol. 13, Hubálek, Z., Halouzka, J., Juřicová, Z., Šikutová, S., Rudolf, I., Honza, M., Janková, J., Chytil, J., Marec, F., Sitko, J., 2008a. Serologic survey of birds for West Nile Flavivirus in southern Moravia (Czech Republic). Vector Borne Zoonotic Dis. 8, Hubálek, Z., Wegner, E., Halouzka, J., Tryjanowski, P., Lerzak, J., Šikutová, S., Rudolf, I., Kruszewicz, A.G., Jaworski, Z., Wlodarczyk, R., 2008b. Serologic survey of potential vertebrate hosts for West Nile virus in Poland. Viral Immunol. 21, Hubálek, Z., Rudolf, I., Čapek, M., Bakonyi, T., Betášová, L., Nowotny, N., Usutu virus in blackbirds (Turdus merula), Czech Republic, Transbound. Emerg. Dis. 61, Jost, H., Bialonski, A., Maus, D., Sambri, V., Eiden, M., Groschup, M., Gunther, S., Becker, N., Schmidt-Chanasit, J., Isolation of Usutu virus in Germany. Am. J. Trop. Med. Hyg. 85, Juřicová, Z., Halouzka, J., Serological examination of domestic ducks in southern Moravia for antibodies against arboviruses of the groups A, B, California and Bunyamwera. Biologia (Bratislava) 48, Juřicová, Z., Hubálek, Z., Halouzka, J., Macháček, P., Virological examination of cormorants for arboviruses. Vet. Med. (Praha) 38, Komar, N., Langevin, S., Hinten, S., Nemeth, N., Edwards, E., Hettler, D., Davis, B., Bowen, R., Bunning, M., Experimental infection of North American birds with the New York 1999 strain of West Nile virus. Emerg. Infect. Dis. 9, Llorente, F., Pérez-Ramírez, E., Fernández-Pinero, J., Soriguer, R., Figuerola, J., Jiménez- Clavero, M.A., Flaviviruses in game birds, southern Spain, Emerg. Infect. Dis. 19, Lvov, D.K., Shchelkanov, M.I., Kolobukhina, L.V., Lvov, D.N., Galkina, I.V., Aristova, V.A., Morozova, T.N., Proshina, E.S., Kulikov, A.G., Kogdenko, N.V., Andronova, O.V., Pronin, N.I., Shevkoplias, V.N., Fontanetskiĭ, A.S., Vlasov, N.A., Nepoklonov, E.A., Serological monitoring of arbovirus infections in the estuary of the Kuban River (the data). Vopr. Virusol. 53, (in Russian). Manarolla, G., Bakonyi, T., Gallazzi, D., Crosta, L., Weissenböock, H., Dorrestein, G.M., Nowotny, N., Usutu virus in wild birds in northern Italy. Vet. Microbiol. 14, Meister, T., Lussy, H., Bakonyi, T., Šikutová, S., Rudolf, I., Vogl, W., Winkler, H., Frey, H., Hubálek, Z., Nowotny, N., Weissenböck, H., Serological evidence of continuing high Usutu virus (Flaviviridae) activity and establishment of herd immunity in wild birds in Austria. Vet. Microbiol. 127, Mishra, N., Kalaiyarasu, S., Nagarajan, S., Rao, M.V., George, A., Sridevi, R., Behera, S.P., Dubey, S.C., McCracken, T., Newman, S.H., Serological evidence of West Nile virus infection in wild migratory and resident water birds in eastern and northern India. Comp. Immunol. Microbiol. Infect. Dis. 35, Rudolf, I., Bakonyi, T., Šebesta, O., Mendel, J., Peško, J., Betášová, L., Blažejová, H., Venclíková, K., Straková, P., Nowotny, N., Hubálek, Z., West Nile virus lineage 2 isolated from Culex modestus mosquitoes in the Czech Republic, 2013: expansion of the European WNV endemic area to the North? Eurosurveillance 19, 2 5. Rudolf, I., Bakonyi, T., Šebesta, O., Mendel, J., Peško, J., Betášová, L., Blažejová, H., Venclíková, K., Straková, P., Nowotny, N., Hubálek, Z., Co-occurrence of Usutu virus and West Nile virus in a reed bed ecosystem (in preparation). Steinmetz, H.W., Bakonyi, T., Weissenbock, H., Hatt, M., Eulenberger, U., Robert, N., Hoop, R., Nowotny, N., Emergence and establishment of Usutu virus infection in wild and captive avian species in and around Zurich, Switzerland, genomic and pathologic comparison to other central European outbreaks. Vet. Microbiol. 148, Vazquez, A., Jimenez-Clavero, M., Franco, L., Donoso-Mantke, O., Sambri, V., Niedrig, M., Zeller, H., Tenorio, A., Usutu virus potential risk of human disease in Europe. Eurosurveillance 16, Vilibic-Cavlek, T., Kaic, B., Barbic, L., Pem-Novosel, I., Slavic-Vrzic, V., Lesnikar, V., Kurecic- Filipovic, S., Babic-Erceg, A., Listes, E., Stevanovic, V., Gjenero-Margan, I., Savini, G., First evidence of simultaneous occurrence of West Nile virus and Usutu virus neuroinvasive disease in humans in Croatia during the 2013 outbreak. Infection 42, Watson, G.E., Shope, R.E., Kaiser, M.N., An ectoparasite and virus survey of migratory birds in the eastern Mediterranean. In: Cherepanov, I.A. (Ed.), Transcontinental Connections of Migratory Birds and their Role in the Distribution of Arboviruses. Nauka, Novosibirsk, pp Weissenböck, H., Kolodziejek, J., Url, A., Lussy, H., Rebel-Bauder, B., Nowotny, N., Emergence of Usutu virus, an African mosquito-borne flavivirus of the Japanese encephalitis virus group, central Europe. Emerg. Infect. Dis. 8, Weissenböck, H., Bakonyi, T., Rossi, G., Mani, P., Nowotny, N., Usutu virus, Italy, Emerg. Infect. Dis. 19,
186
187 6 1
188
189 Vector-Borne and Zoonotic Diseases Vector-Borne and Zoonotic Diseases: Serologic survey for West Nile virus in wild artiodactyls, central Europe Journal: Vector-Borne and Zoonotic Diseases Manuscript ID Draft Manuscript Type: Original Research Date Submitted by the Author: n/a or Peer Review Only/Not for Distribution Complete List of Authors: Hubálek, Zdenek; Institute of Vertebrate Biology, Laboratory of Medical Zoology Juřicová, Zina; Institute of Vertebrate Biology, Academy of Sciences, Brno, Department of Medical Zoology; Strakova, Petra; Ustav Biologie Obratlovcu Akademie Ved Ceske Republiky vvi, Medical Zoology Blazejova, Hana; Ustav Biologie Obratlovcu Akademie Ved Ceske Republiky vvi, Medical Zoology Betášová, Lenka; Institute of Vertebrate Biology, v.v.i., Academy of Sciences, Medical Zoology Rudolf, Ivo; Institute of Vertebrate Biology, v.v.i., Academy of Sciences, Medical Zoology Keyword: Arbovirus(es), Flaviviridae, Surveillance, West Nile, Zoonosis Manuscript Keywords (Search Terms): Abstract: wildlife, serosurvey, deer, mouflon, wild boar, mammals Antibodies neutralizing West Nile virus (WNV) were tested in 1,023 wild Artiodactyla: 105 roe deer (Capreolus capreolus), 148 red deer (Cervus elaphus), 287 fallow deer (Dama dama), 71 mouflons (Ovis musimon), and 412 wild boars (Sus scrofa). The blood sera, sampled in South-Moravian district of Břeclav (Czech Republic) in the years , were examined by plaque-reduction neutralization test. Specific antibodies to WNV were detected in 5.9% of wild ruminants (4.8% roe deer, 4.1% red deer, 6.3% fallow deer, 9.9% mouflons), and 4.1% of wild boars, with titres between 1:20 and 1:320. The results indicate that WNV has circulated in wild artiodactyls at a variable frequency during the years in the area. Mary Ann Liebert, Inc., 140 Huguenot Street, New Rochelle, NY 10801
Epidemiologie nákaz vyvolaných hantaviry přenášených z volně žijících hlodavců na člověka - rizika při pobytu v přírodě
 Epidemiologie nákaz vyvolaných hantaviry přenášených z volně žijících hlodavců na člověka - rizika při pobytu v přírodě RNDr. Marie Vacková, CSc. Katedra epidemiologie Fakulta vojenského zdravotnictví
Epidemiologie nákaz vyvolaných hantaviry přenášených z volně žijících hlodavců na člověka - rizika při pobytu v přírodě RNDr. Marie Vacková, CSc. Katedra epidemiologie Fakulta vojenského zdravotnictví
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Epidemiologie. MUDr. Miroslava Zavřelová Ústav ochrany a podpory zdraví LF MU
 Epidemiologie MUDr. Miroslava Zavřelová Ústav ochrany a podpory zdraví LF MU Epidemiologie Studium hromadně se vyskytujících jevů Stanovení opatření intervence Analýza efektivity intervence Epidemiologie
Epidemiologie MUDr. Miroslava Zavřelová Ústav ochrany a podpory zdraví LF MU Epidemiologie Studium hromadně se vyskytujících jevů Stanovení opatření intervence Analýza efektivity intervence Epidemiologie
KRAJSKÁ HYGIENICKÁ STANICE MORAVSKOSLEZSKÉHO KRAJE SE SÍDLEM V OSTRAVĚ
 KRAJSKÁ HYGIENICKÁ STANICE MORAVSKOSLEZSKÉHO KRAJE SE SÍDLEM V OSTRAVĚ Nákazy přenášené různými přenašeči Tato skupina infekcí se vyznačuje tím, že zdrojem a rezervoárem nákazy obvykle bývají zvířata,
KRAJSKÁ HYGIENICKÁ STANICE MORAVSKOSLEZSKÉHO KRAJE SE SÍDLEM V OSTRAVĚ Nákazy přenášené různými přenašeči Tato skupina infekcí se vyznačuje tím, že zdrojem a rezervoárem nákazy obvykle bývají zvířata,
Očkování cestovatelů. 1. infekční klinika 2. lékařská fakulta, Univerzita Karlova v Praze
 Očkování cestovatelů Milan Trojánek 1. infekční klinika 2. lékařská fakulta, Univerzita Karlova v Praze Klinika infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce, Praha Cestovní a
Očkování cestovatelů Milan Trojánek 1. infekční klinika 2. lékařská fakulta, Univerzita Karlova v Praze Klinika infekčních, parazitárních a tropických nemocí Nemocnice Na Bulovce, Praha Cestovní a
Obecná epidemiologie. MUDr. Miroslava Zavřelová Ústav preventivního lékařství, odd. epidemiologie infekčních chorob
 Obecná epidemiologie MUDr. Miroslava Zavřelová Ústav preventivního lékařství, odd. epidemiologie infekčních chorob Epidemiologie Studium hromadně se vyskytujících jevů Stanovení opatření intervence Analýza
Obecná epidemiologie MUDr. Miroslava Zavřelová Ústav preventivního lékařství, odd. epidemiologie infekčních chorob Epidemiologie Studium hromadně se vyskytujících jevů Stanovení opatření intervence Analýza
KLÍŠŤOVÁ ENCEFALITIDA pohledem epidemiologa
 KLÍŠŤOVÁ ENCEFALITIDA pohledem epidemiologa MUDr. Renata Vaverková Krajská hygienická stanice Jihomoravského kraje se sídlem v Brně HVD - Hradec Králové 4. 10. 2013 KLÍŠŤOVÁ ENCEFALITIDA je nákazou s přírodní
KLÍŠŤOVÁ ENCEFALITIDA pohledem epidemiologa MUDr. Renata Vaverková Krajská hygienická stanice Jihomoravského kraje se sídlem v Brně HVD - Hradec Králové 4. 10. 2013 KLÍŠŤOVÁ ENCEFALITIDA je nákazou s přírodní
Obsah. IMUNOLOGIE... 57 1 Imunitní systém... 57 Anatomický a fyziologický základ imunitní odezvy... 57
 Obsah Předmluva... 13 Nejdůležitější pojmy používané v textu publikace... 14 MIKROBIOLOGIE... 23 Mikroorganismy a lidský organismus... 24 Třídy patogenních mikroorganismů... 25 A. Viry... 25 B. Bakterie...
Obsah Předmluva... 13 Nejdůležitější pojmy používané v textu publikace... 14 MIKROBIOLOGIE... 23 Mikroorganismy a lidský organismus... 24 Třídy patogenních mikroorganismů... 25 A. Viry... 25 B. Bakterie...
specifickou léčbu, 8. záškrt, 9. spalničky, 10. zarděnky.
 ODHAD RIZIKA A TYPOVÉ SITUACE PŘI PODEZŘENÍ NA VÝSKYT INFEKČNÍHO ONEMOCNĚNÍ NA PALUBĚ LETADLA PRO POTŘEBU SOUČINNOSTI SE SLOŽKAMI INTEGROVANÉHO ZÁCHRANNÉHO SYSTÉMU Přehled typových situací při podezření
ODHAD RIZIKA A TYPOVÉ SITUACE PŘI PODEZŘENÍ NA VÝSKYT INFEKČNÍHO ONEMOCNĚNÍ NA PALUBĚ LETADLA PRO POTŘEBU SOUČINNOSTI SE SLOŽKAMI INTEGROVANÉHO ZÁCHRANNÉHO SYSTÉMU Přehled typových situací při podezření
Chlíbek Roman. Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králov. lové
 MÁME ME SE BÁT B T PTAČÍ CHŘIPKY? Chlíbek Roman Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králov lové CHŘIPKA Chřipka typy A, B, C Subtyp A 2 povrchové proteiny: HA, NA Hemaglutitin
MÁME ME SE BÁT B T PTAČÍ CHŘIPKY? Chlíbek Roman Katedra epidemiologie Fakulta vojenského zdravotnictví UO Hradec Králov lové CHŘIPKA Chřipka typy A, B, C Subtyp A 2 povrchové proteiny: HA, NA Hemaglutitin
Změna klimatu a lidské zdraví. Brno, 4. května 2010
 Změna klimatu a lidské zdraví Brno, 4. května 2010 odborný konzultant v oblasti zdravotních a ekologických rizik e-mail: miroslav.suta (at) centrum.cz Světový den zdraví 2008 Globální hrozba pro zdraví
Změna klimatu a lidské zdraví Brno, 4. května 2010 odborný konzultant v oblasti zdravotních a ekologických rizik e-mail: miroslav.suta (at) centrum.cz Světový den zdraví 2008 Globální hrozba pro zdraví
Elektronoptický snímek viru mozaikové choroby tabáku. Mozaiková choroba tabáku. Schéma viru mozaikové choroby tabáku
 Obecná virologie Viry lat. virus šťáva, jed, v lékařské terminologii infekční činitel 1879 1882: první pokusný přenos virového onemocnění (mozaiková choroba tabáku) 1898: první pokusný přenos živočišného
Obecná virologie Viry lat. virus šťáva, jed, v lékařské terminologii infekční činitel 1879 1882: první pokusný přenos virového onemocnění (mozaiková choroba tabáku) 1898: první pokusný přenos živočišného
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354
 I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU OBECNÁ EPIDEMIOLOGIE MGR. IVA COUFALOVÁ
 STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU OBECNÁ EPIDEMIOLOGIE MGR. IVA COUFALOVÁ EPIDEMIOLOGIE je obor, který zkoumá rozložení infekčních chorob v populaci, sleduje
STŘEDNÍ ZDRAVOTNICKÁ ŠKOLA A VYŠŠÍ ODBORNÁ ŠKOLA ZDRAVOTNICKÁ ŽĎÁR NAD SÁZAVOU OBECNÁ EPIDEMIOLOGIE MGR. IVA COUFALOVÁ EPIDEMIOLOGIE je obor, který zkoumá rozložení infekčních chorob v populaci, sleduje
NEBUNĚČNÁ ŽIVÁ HMOTA VIRY
 NEBUNĚČNÁ ŽIVÁ HMOTA VIRY Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje 11.3.2011 Mgr.Petra Siřínková Rozdělení živé přírody 1.nadříše.PROKARYOTA 1.říše:Nebuněční
NEBUNĚČNÁ ŽIVÁ HMOTA VIRY Tento výukový materiál vznikl za přispění Evropské unie, státního rozpočtu ČR a Středočeského kraje 11.3.2011 Mgr.Petra Siřínková Rozdělení živé přírody 1.nadříše.PROKARYOTA 1.říše:Nebuněční
Název: Přijďte mezi vědce Ústavu biologie obratlovců AV ČR, v. v. i. Anotace:
 Týden vědy a techniky AV ČR Místo konání: Brno, Květná 170/8 Datum a doba otevření: 7. listopadu Kontakt: Ing. Pavel Jurajda, Dr., tel. 543 422 523, e-mail: jurajda@brno.cas.cz, Ing. Miroslav Čapek, CSc.,
Týden vědy a techniky AV ČR Místo konání: Brno, Květná 170/8 Datum a doba otevření: 7. listopadu Kontakt: Ing. Pavel Jurajda, Dr., tel. 543 422 523, e-mail: jurajda@brno.cas.cz, Ing. Miroslav Čapek, CSc.,
CZ.1.07/1.5.00/34.0527
 Projekt: Příjemce: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
Projekt: Příjemce: Digitální učební materiály ve škole, registrační číslo projektu CZ.1.07/1.5.00/34.0527 Střední zdravotnická škola a Vyšší odborná škola zdravotnická, Husova 3, 371 60 České Budějovice
Nákazová situace u zvířat v Ústeckém kraji
 Krajská veterinární správa Státní veterinární správy pro Ústecký kraj Sebuzínská 38 403 21 Ústí nad Labem Nákazová situace u zvířat v Ústeckém kraji Spolupráce SVS a KHS MVDr, Petr Pilous, Ústí nad Labem
Krajská veterinární správa Státní veterinární správy pro Ústecký kraj Sebuzínská 38 403 21 Ústí nad Labem Nákazová situace u zvířat v Ústeckém kraji Spolupráce SVS a KHS MVDr, Petr Pilous, Ústí nad Labem
Ústřední veterinární správa Státní veterinární správy. Nákazová situace u volně žijících zvířat v České republice a ve střední Evropě
 Nákazová situace u volně žijících zvířat v České republice a ve střední Evropě MVDr. Zbyněk Semerád, ústřední ředitel SVS, 15. září 2016 Nákazová situace u vybraných nákaz v Evropě 1. 1. 12. 8. 2016 (zdroj
Nákazová situace u volně žijících zvířat v České republice a ve střední Evropě MVDr. Zbyněk Semerád, ústřední ředitel SVS, 15. září 2016 Nákazová situace u vybraných nákaz v Evropě 1. 1. 12. 8. 2016 (zdroj
Virové hepatitidy. MUDr. Jana Bednářová, PhD. OKM FN Brno
 Virové hepatitidy MUDr. Jana Bednářová, PhD. OKM FN Brno Hepatitida A Taxonomie: Picornaviridae, Hepatovirus Morfologie: neobalený ssrna-virus pozitivní polarity, nesegmentovaný, 27 32 nm Stabilita: termostabilní
Virové hepatitidy MUDr. Jana Bednářová, PhD. OKM FN Brno Hepatitida A Taxonomie: Picornaviridae, Hepatovirus Morfologie: neobalený ssrna-virus pozitivní polarity, nesegmentovaný, 27 32 nm Stabilita: termostabilní
Strašák EBOLA TÝKÁ SE TAKÉ NÁS EVROPANY? Bc. Helena Marcinková
 Strašák EBOLA TÝKÁ SE TAKÉ NÁS EVROPANY? Bc. Helena Marcinková Ebola a Česká republika máme se bát? Jaké je riziko, že se Ebola dostane do České republiky a začne se tu šířit? Riziko pro turisty nebo obchodní
Strašák EBOLA TÝKÁ SE TAKÉ NÁS EVROPANY? Bc. Helena Marcinková Ebola a Česká republika máme se bát? Jaké je riziko, že se Ebola dostane do České republiky a začne se tu šířit? Riziko pro turisty nebo obchodní
Nebezpečí infekce. Zpracoval: Ondráček Zdeněk 2008
 Zpracoval: Ondráček Zdeněk 2008 Infekce je proces, při kterém se choroboplodné mikroorganismy (bakterie, viry, paraziti) dostávají do styku s hostitelským makroorganismem a vyvolávají jeho onemocnění.
Zpracoval: Ondráček Zdeněk 2008 Infekce je proces, při kterém se choroboplodné mikroorganismy (bakterie, viry, paraziti) dostávají do styku s hostitelským makroorganismem a vyvolávají jeho onemocnění.
Martina Havlíčková Helena Jiřincová. NRL pro chřipku, Státní zdravotní ústav
 Pandemic H1N1 2009 Martina Havlíčková Helena Jiřincová NRL pro chřipku, Státní zdravotní ústav Z historie H1N1 1916-1917 pravděpodobná cirkulace viru, malá ohniska, lokální epidemie ve vojenských táborech,
Pandemic H1N1 2009 Martina Havlíčková Helena Jiřincová NRL pro chřipku, Státní zdravotní ústav Z historie H1N1 1916-1917 pravděpodobná cirkulace viru, malá ohniska, lokální epidemie ve vojenských táborech,
Nové technologie v mikrobiologické laboratoři, aneb jak ovlivnit čas k získání klinicky relevantního výsledku
 B I O M E D I C AL Nové technologie v mikrobiologické laboratoři, aneb jak ovlivnit čas k získání klinicky relevantního výsledku Jaroslav Hrabák CHARLES UNIVERSITY Obsah prezentace Historie, vývoj a trendy
B I O M E D I C AL Nové technologie v mikrobiologické laboratoři, aneb jak ovlivnit čas k získání klinicky relevantního výsledku Jaroslav Hrabák CHARLES UNIVERSITY Obsah prezentace Historie, vývoj a trendy
Epidemie Q horečky v Nizozemí a situace v ČR
 Epidemie Q horečky v Nizozemí a situace v ČR Kateřina Fabiánová, Čestmír Beneš SZÚ Praha 24. Pečenkovy epidemiologické dny, 15. 17. 9.2010 České Budějovice Epidemiologické charakteristiky Původce: Coxiella
Epidemie Q horečky v Nizozemí a situace v ČR Kateřina Fabiánová, Čestmír Beneš SZÚ Praha 24. Pečenkovy epidemiologické dny, 15. 17. 9.2010 České Budějovice Epidemiologické charakteristiky Původce: Coxiella
Molekulární epidemiologie a možnosti zoonotického přenosu viru hepatitidy E v České republice
 Molekulární epidemiologie a možnosti zoonotického přenosu viru hepatitidy E v České republice P. Vašíčková, M. Kubánková Výzkumný ústav veterinárního lékařství, v.v.i. Brno HRADECKÉ VIROLOGICKÉ DNY 2016
Molekulární epidemiologie a možnosti zoonotického přenosu viru hepatitidy E v České republice P. Vašíčková, M. Kubánková Výzkumný ústav veterinárního lékařství, v.v.i. Brno HRADECKÉ VIROLOGICKÉ DNY 2016
MODUL č. III. Epidemiologie a Hygiena
 MODUL č. III Epidemiologie a Hygiena Definice epidemiologie a rozdělení Definice: Epidemiologie je nauka o teoretických a praktických otázkách ochrany před chorobami (infekčními i neinfekčními). Rozdělení
MODUL č. III Epidemiologie a Hygiena Definice epidemiologie a rozdělení Definice: Epidemiologie je nauka o teoretických a praktických otázkách ochrany před chorobami (infekčními i neinfekčními). Rozdělení
Změna klimatu, bezpečnost potravin a zdraví člověka
 20. Konference Monitoringu, Milovy, 6. 10. 2015 Změna klimatu, bezpečnost potravin a zdraví člověka Vladimír Ostrý, Marie Jefremová, Jiří Ruprich Státní zdravotní ústav v Praze Centrum zdraví, výživy a
20. Konference Monitoringu, Milovy, 6. 10. 2015 Změna klimatu, bezpečnost potravin a zdraví člověka Vladimír Ostrý, Marie Jefremová, Jiří Ruprich Státní zdravotní ústav v Praze Centrum zdraví, výživy a
Krvácivá horečka (Ebola)
 Krvácivá horečka (Ebola) Autor: Petra Grénarová Výskyt Virus Ebola je pojmenován podle řeky Ebola v jižním Súdánu, v jejíž blízkosti byl tento virus roku 1976 poprvé zaznamenán. Ve stejném roce se objevil
Krvácivá horečka (Ebola) Autor: Petra Grénarová Výskyt Virus Ebola je pojmenován podle řeky Ebola v jižním Súdánu, v jejíž blízkosti byl tento virus roku 1976 poprvé zaznamenán. Ve stejném roce se objevil
Zkušenosti s laboratorní diagnostikou infekcí virem Zika. Hana Zelená NRL pro arboviry Zdravotní ústav se sídlem v Ostravě
 Zkušenosti s laboratorní diagnostikou infekcí virem Zika Hana Zelená NRL pro arboviry Zdravotní ústav se sídlem v Ostravě Základní charakteristika viru Zika Čeleď Flaviviridae, rod Flavivirus obalený RNA
Zkušenosti s laboratorní diagnostikou infekcí virem Zika Hana Zelená NRL pro arboviry Zdravotní ústav se sídlem v Ostravě Základní charakteristika viru Zika Čeleď Flaviviridae, rod Flavivirus obalený RNA
Zdravotní nauka 3. díl
 Iva Nováková Zdravotní nauka 2. díl Učebnice pro obor sociální činnost Iva Nováková ISBN 978-80-247-3709-6 ISBN 978-80-247-3707-2 Grada Publishing, a.s., U Průhonu 22, 170 00 Praha 7 tel.: +420 234 264
Iva Nováková Zdravotní nauka 2. díl Učebnice pro obor sociální činnost Iva Nováková ISBN 978-80-247-3709-6 ISBN 978-80-247-3707-2 Grada Publishing, a.s., U Průhonu 22, 170 00 Praha 7 tel.: +420 234 264
Virus lidského imunodeficitu. MUDr. Jana Bednářová, PhD. OKM FN Brno
 Virus lidského imunodeficitu MUDr. Jana Bednářová, PhD. OKM FN Brno HIV Human Immunodeficiency Virus AIDS Acquired Immunodeficiency Syndrome SIDA Syndrome d immuno-déficience acquise Historie původně opičí
Virus lidského imunodeficitu MUDr. Jana Bednářová, PhD. OKM FN Brno HIV Human Immunodeficiency Virus AIDS Acquired Immunodeficiency Syndrome SIDA Syndrome d immuno-déficience acquise Historie původně opičí
Mezinárodní surveillance infekčních onemocnění. 24. Pečenkovy epidemiologické dny České Budějovice, září 2010
 Mezinárodní surveillance infekčních onemocnění 24. Pečenkovy epidemiologické dny České Budějovice, září 2010 Pavla Křížová Státní zdravotní ústav, Praha Koncepce surveillance byla založena již v šedesátých
Mezinárodní surveillance infekčních onemocnění 24. Pečenkovy epidemiologické dny České Budějovice, září 2010 Pavla Křížová Státní zdravotní ústav, Praha Koncepce surveillance byla založena již v šedesátých
Číslo projektu CZ.1.07/1.5.00/34.0743. Název školy. Moravské gymnázium Brno, s.r.o. Autor. Mgr. Martin Hnilo. Biologie 1 Nebuněční viry.
 Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno, s.r.o. Autor Mgr. Martin Hnilo Tematická oblast Biologie 1 Nebuněční viry. Ročník 1. Datum tvorby 10.10.2012 Anotace Pracovní
Číslo projektu CZ.1.07/1.5.00/34.0743 Název školy Moravské gymnázium Brno, s.r.o. Autor Mgr. Martin Hnilo Tematická oblast Biologie 1 Nebuněční viry. Ročník 1. Datum tvorby 10.10.2012 Anotace Pracovní
Klinické formy sezónn. M.Havlíčková, H.Jiřincová, J.Kynčl
 Klinické formy sezónn nní, aviárn rní a nové chřipky u člověka M.Havlíčková, H.Jiřincová, J.Kynčl Ptačí chřipka - byla, je i bude, rezervoár nových subtypů, u člověka často velmi těžký průběh Sezónní chřipka
Klinické formy sezónn nní, aviárn rní a nové chřipky u člověka M.Havlíčková, H.Jiřincová, J.Kynčl Ptačí chřipka - byla, je i bude, rezervoár nových subtypů, u člověka často velmi těžký průběh Sezónní chřipka
Infekce, patogenita a nástroje virulence bakterií. Karel Holada
 Infekce, patogenita a nástroje virulence bakterií Karel Holada khola@lf1.cuni.cz Klíčová slova Komenzalismus Mutualismus Parazitismus Normální flóra Patogenita Saprofyt Obligátní patogen Oportunní patogen
Infekce, patogenita a nástroje virulence bakterií Karel Holada khola@lf1.cuni.cz Klíčová slova Komenzalismus Mutualismus Parazitismus Normální flóra Patogenita Saprofyt Obligátní patogen Oportunní patogen
Hantavirové onemocnění s úmrtím. Mgr. Monika Kurucová - ÚP Kladno
 Hantavirové onemocnění s úmrtím Mgr. Monika Kurucová - ÚP Kladno Co jsou to hantaviry? řadí se dočeledi Bunyaviridae obalené RNA viry hantavirové infekce jsou zoonózy, jejich rezervoárem jsou běžní drobní
Hantavirové onemocnění s úmrtím Mgr. Monika Kurucová - ÚP Kladno Co jsou to hantaviry? řadí se dočeledi Bunyaviridae obalené RNA viry hantavirové infekce jsou zoonózy, jejich rezervoárem jsou běžní drobní
Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/
 I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
I n v e s t i c e d o r o z v o j e v z d ě l á v á n í Inovace studia molekulární a buněčné biologie reg. č. CZ.1.07/2.2.00/07.0354 Tento projekt je spolufinancován Evropským sociálním fondem a státním
Co víme nového o borelióze a klíšťové meningoencefalitidě?
 Co víme nového o borelióze a klíšťové meningoencefalitidě? Schánilec P. Hájek I. Agudelo C. F. Tato prezentace je spolufinancována Evropským sociálním fondem a státním rozpočtem České republiky. Rozšíření
Co víme nového o borelióze a klíšťové meningoencefalitidě? Schánilec P. Hájek I. Agudelo C. F. Tato prezentace je spolufinancována Evropským sociálním fondem a státním rozpočtem České republiky. Rozšíření
Co je prasečí chřipka?
 Co je prasečí chřipka? Prasečí chřipka je respirační onemocnění u prasat způsobené virem chřipky typu A, které u nich často propuká. Lidé za normálních okolností touto nemocí neonemocní, ale k nakažení
Co je prasečí chřipka? Prasečí chřipka je respirační onemocnění u prasat způsobené virem chřipky typu A, které u nich často propuká. Lidé za normálních okolností touto nemocí neonemocní, ale k nakažení
Základy mikrobiologie, hygieny a epidemiologie. Hygienické a epidemiologické oddělení Thomayerovy nemocnice
 Základy mikrobiologie, hygieny a epidemiologie Hygienické a epidemiologické oddělení Thomayerovy nemocnice Legislativa Zákon č.258/ 2000 Sb., o ochraně veřejného zdraví Díl 2 Ochranná dezinfekce,dezinsekce
Základy mikrobiologie, hygieny a epidemiologie Hygienické a epidemiologické oddělení Thomayerovy nemocnice Legislativa Zákon č.258/ 2000 Sb., o ochraně veřejného zdraví Díl 2 Ochranná dezinfekce,dezinsekce
Fatální forma influenzy drůbeţe v chovu krůt
 Fatální forma influenzy drůbeţe v chovu krůt Doc. MVDr. Petr Lány, Ph.D. Mgr. Kateřina Rosenbergová Ústav infekčních chorob a epizootologie MVDr. Miša Škorič, Ph.D. Ústav patologické morfologie Fakulta
Fatální forma influenzy drůbeţe v chovu krůt Doc. MVDr. Petr Lány, Ph.D. Mgr. Kateřina Rosenbergová Ústav infekčních chorob a epizootologie MVDr. Miša Škorič, Ph.D. Ústav patologické morfologie Fakulta
Cytosin Thymin Uracil
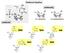 ukleové kyseliny fosfát - P - nukleotid nukleová báze C 2 3' 4' 5' cukr 2 1' 2' 5' báze C 2 1' 3' 2' 4' nukleosidy C 2 3' báze 1' b-d- ribofuranóza b-d-deoxyribofuranóza 4' 5' 2' - P - 2 - P - Cytosin
ukleové kyseliny fosfát - P - nukleotid nukleová báze C 2 3' 4' 5' cukr 2 1' 2' 5' báze C 2 1' 3' 2' 4' nukleosidy C 2 3' báze 1' b-d- ribofuranóza b-d-deoxyribofuranóza 4' 5' 2' - P - 2 - P - Cytosin
Nákazy s přírodní ohniskovostí. MUDr. Miroslava Zavřelová ÚPL LF MU
 Nákazy s přírodní ohniskovostí MUDr. Miroslava Zavřelová ÚPL LF MU Přírodní ohnisko nákazy oblast s jedním biotopem (konkrétními přírodními podmínkami) přítomnost zdrojů nákazy (rezervoárových zvířat)
Nákazy s přírodní ohniskovostí MUDr. Miroslava Zavřelová ÚPL LF MU Přírodní ohnisko nákazy oblast s jedním biotopem (konkrétními přírodními podmínkami) přítomnost zdrojů nákazy (rezervoárových zvířat)
OBSAH ZPRÁV CEM 2007, ROČNÍK 16
 Názvy článků jsou srovnány abecedně v rámci jednotlivých rubrik. V obsahu nejsou uvedeny příspěvky, které se pravidelně opakují v každém čísle v rubrice HLÁŠENÍ INFEKČNÍCH ONEMOCNĚNÍ V ČESKÉ REPUBLICE.
Názvy článků jsou srovnány abecedně v rámci jednotlivých rubrik. V obsahu nejsou uvedeny příspěvky, které se pravidelně opakují v každém čísle v rubrice HLÁŠENÍ INFEKČNÍCH ONEMOCNĚNÍ V ČESKÉ REPUBLICE.
Hepatitida E nejen akutní onemocnění. Petr Husa Klinika infekčních chorob, LF MU a FN Brno Hepatitida B v roce 2012, Praha, 28.4.
 Hepatitida E nejen akutní onemocnění Petr Husa Klinika infekčních chorob, LF MU a FN Brno Hepatitida B v roce 2012, Praha, 28.4.2012 Rozdělení virových hepatitid 1. Enterálně přenosné VH A chronicita dosud
Hepatitida E nejen akutní onemocnění Petr Husa Klinika infekčních chorob, LF MU a FN Brno Hepatitida B v roce 2012, Praha, 28.4.2012 Rozdělení virových hepatitid 1. Enterálně přenosné VH A chronicita dosud
Očkujete se před cestou do zahraničí?
 Očkujete se před cestou do zahraničí? Rozšiřuje se spektrum cestovatelských oblastí Měli byste! Rozšiřuje se spektrum infekčních onemocnění Rozšiřuje se spektrum doporučených očkování Některé státy při
Očkujete se před cestou do zahraničí? Rozšiřuje se spektrum cestovatelských oblastí Měli byste! Rozšiřuje se spektrum infekčních onemocnění Rozšiřuje se spektrum doporučených očkování Některé státy při
Infekční choroby - dotazník. 2. Jaké znáte původce infekčních onemocnění? Do jakých skupin v rámci systému je řadíme?
 8. PŘÍLOHY 8.1 Příloha 1: Dotazník předvýzkumu Infekční choroby - dotazník Pohlaví: muž/žena Věk: Zájem o biologii: vysoký/ střední/ nízký 1. Vysvětlete pojmy: infekční onemocnění, očkování. 2. Jaké znáte
8. PŘÍLOHY 8.1 Příloha 1: Dotazník předvýzkumu Infekční choroby - dotazník Pohlaví: muž/žena Věk: Zájem o biologii: vysoký/ střední/ nízký 1. Vysvětlete pojmy: infekční onemocnění, očkování. 2. Jaké znáte
SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom).
 SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom). Charakteristika: SARS je závažné respirační onemocnění probíhající převážně jako těžká atypická pneumonie, komplikovaná respirační
SARS - Severe Acute Respiratory Syndrome (těžký akutní respirační syndrom). Charakteristika: SARS je závažné respirační onemocnění probíhající převážně jako těžká atypická pneumonie, komplikovaná respirační
Vývoj vakcín proti horečkám dengue, chikungunya a Zika
 Vývoj vakcín proti horečkám dengue, chikungunya a Zika MUDr. Milan Trojánek, Ph.D. Klinika infekčních nemocí 2. lékařská fakulta, Univerzita Karlova v Praze Katedra infekčních nemocí Institut postgraduálního
Vývoj vakcín proti horečkám dengue, chikungunya a Zika MUDr. Milan Trojánek, Ph.D. Klinika infekčních nemocí 2. lékařská fakulta, Univerzita Karlova v Praze Katedra infekčních nemocí Institut postgraduálního
Chřipka jako zoonóza
 Chřipka jako zoonóza Doc. MVDr. Petr Lány, Ph.D. Prof. MVDr. Zdeněk Pospíšil, DrSc. Doc. MVDr. Dagmar Zendulková, CSc. Mgr. Kateřina Rosenbergová Ústav infekčních chorob a epizootologie Fakulta veterinárního
Chřipka jako zoonóza Doc. MVDr. Petr Lány, Ph.D. Prof. MVDr. Zdeněk Pospíšil, DrSc. Doc. MVDr. Dagmar Zendulková, CSc. Mgr. Kateřina Rosenbergová Ústav infekčních chorob a epizootologie Fakulta veterinárního
Lékařská mikrobiologie současné možnosti oboru v AČR
 Lékařská mikrobiologie současné možnosti oboru v AČR podplukovník MUDr. Petr DOUDA Ředitel Centra preventivní péče Ústřední vojenský zdravotní ústav České Budějovice Hlavní odborník Lékařské mikrobiologie
Lékařská mikrobiologie současné možnosti oboru v AČR podplukovník MUDr. Petr DOUDA Ředitel Centra preventivní péče Ústřední vojenský zdravotní ústav České Budějovice Hlavní odborník Lékařské mikrobiologie
Podíl VÚVeL Brno na řešení aktuálních zdravotních problémů v chovu prasat
 Podíl VÚVeL Brno na řešení aktuálních zdravotních problémů v chovu prasat Toman M., Karpíšková R., Nedbalcová, K., Prodělalová J., Matiašovic J., Vašíčková P., Rubeš, J., Skřivánek M. VetFair 2014 jjjjjjjjj
Podíl VÚVeL Brno na řešení aktuálních zdravotních problémů v chovu prasat Toman M., Karpíšková R., Nedbalcová, K., Prodělalová J., Matiašovic J., Vašíčková P., Rubeš, J., Skřivánek M. VetFair 2014 jjjjjjjjj
KORONAVIROVÉ INFEKCE PRASAT
 KORONAVIROVÉ INFEKCE PRASAT Jana Prodělalová Oddělení virologie Virové choroby prasat Výzkumný ústav veterinárního lékařství, v.v.i., Brno Evoluce koronavirů: 8 100 př.n.l. rekombinace, mutace adaptace
KORONAVIROVÉ INFEKCE PRASAT Jana Prodělalová Oddělení virologie Virové choroby prasat Výzkumný ústav veterinárního lékařství, v.v.i., Brno Evoluce koronavirů: 8 100 př.n.l. rekombinace, mutace adaptace
Paratuberkulóza u masného skotu
 Paratuberkulóza u masného skotu Mgr. Iva Slaná, Ph.D. Mgr. Radka Dziedzinská, Ph.D. Mgr. Petr Králík, Ph.D. Výzkumný ústav veterinárního lékařství, v. v. i., Brno Skalský Dvůr, 13.9.2018 VÚVeL - Oddělení
Paratuberkulóza u masného skotu Mgr. Iva Slaná, Ph.D. Mgr. Radka Dziedzinská, Ph.D. Mgr. Petr Králík, Ph.D. Výzkumný ústav veterinárního lékařství, v. v. i., Brno Skalský Dvůr, 13.9.2018 VÚVeL - Oddělení
Současné trendy v klinice a epidemiologii tropických virových infekcí. XX. hradecké virologické dny - Současný svět a virové infekce
 Současné trendy v klinice a epidemiologii tropických virových infekcí XX. hradecké virologické dny - Současný svět a virové infekce Hradec Králové, 12. října 2016 František Stejskal Klinika infekčních
Současné trendy v klinice a epidemiologii tropických virových infekcí XX. hradecké virologické dny - Současný svět a virové infekce Hradec Králové, 12. října 2016 František Stejskal Klinika infekčních
Pandemický plán Ústeckého kraje. MUDr. Josef Trmal Ph.D.
 Pandemický plán Ústeckého kraje MUDr. Josef Trmal Ph.D. Pandemický plán Ústeckého kraje Pandemický plán je zpracován v souladu s krizovým a havarijním plánováním a tvoří součást Krizového plánu Ústeckého
Pandemický plán Ústeckého kraje MUDr. Josef Trmal Ph.D. Pandemický plán Ústeckého kraje Pandemický plán je zpracován v souladu s krizovým a havarijním plánováním a tvoří součást Krizového plánu Ústeckého
Lékařská orální mikrobiologie I VLLM0421p
 Lékařská orální mikrobiologie I VLLM0421p Týden 8: Patogeneze infekce Ondřej Zahradníček zahradnicek@fnusa.cz Definice patogeneze Patogeneze: vysvětluje vznik a vývoj chorobných příznaků Co patří do patogeneze
Lékařská orální mikrobiologie I VLLM0421p Týden 8: Patogeneze infekce Ondřej Zahradníček zahradnicek@fnusa.cz Definice patogeneze Patogeneze: vysvětluje vznik a vývoj chorobných příznaků Co patří do patogeneze
Využití zvířat použitých k pokusným účelům v ČR v roce tabulka EK
 Využití zvířat použitých k pokusným účelům v ČR v roce 2014 - tabulka EK Údaje pro EU Počet zvířat Ano 232771 100,00% Ne Opětovné použití Počet zvířat Ne 227858 97,89% Ano 4913 2,11% Vytvoření nové geneticky
Využití zvířat použitých k pokusným účelům v ČR v roce 2014 - tabulka EK Údaje pro EU Počet zvířat Ano 232771 100,00% Ne Opětovné použití Počet zvířat Ne 227858 97,89% Ano 4913 2,11% Vytvoření nové geneticky
MUDr. Iva Šípová Nemocnice České Budějovice, a.s.
 MUDr. Iva Šípová Nemocnice České Budějovice, a.s. OBSAH Zhodnocení rizika pro populaci ČR Způsob přenosu nákazy Riziko jednotlivých infekcí Riziko pro zdravotnická zařízení AKTUÁLNÍ SITUACE POBYT CIZINCŮ
MUDr. Iva Šípová Nemocnice České Budějovice, a.s. OBSAH Zhodnocení rizika pro populaci ČR Způsob přenosu nákazy Riziko jednotlivých infekcí Riziko pro zdravotnická zařízení AKTUÁLNÍ SITUACE POBYT CIZINCŮ
Činnost veterinární služby na územíčeské republiky
 Činnost veterinární služby na územíčeské republiky prof. MVDr. Daniela Lukešová, CSc. ČZU v Praze, Fakulta tropického zemědělství 1. okruh činnosti SVS ČR Činnost rozčleněna do několika okruhů: 1. okruh
Činnost veterinární služby na územíčeské republiky prof. MVDr. Daniela Lukešová, CSc. ČZU v Praze, Fakulta tropického zemědělství 1. okruh činnosti SVS ČR Činnost rozčleněna do několika okruhů: 1. okruh
ZDRAVOTNICKÉ INFORMACE ECDC
 ZDRAVOTNICKÉ INFORMACE ECDC Často kladené otázky na téma virus chřipky A(H1N1) Aktualizováno 3. května 2009 1. Co je chřipkový virus A(H1N1)? Virus A(H1N1), který je příčinou současné epidemie chřipky,
ZDRAVOTNICKÉ INFORMACE ECDC Často kladené otázky na téma virus chřipky A(H1N1) Aktualizováno 3. května 2009 1. Co je chřipkový virus A(H1N1)? Virus A(H1N1), který je příčinou současné epidemie chřipky,
Hrozba epidemie, pandemie chřipka, HIV
 Inovace a zkvalitnění výuky v oblasti přírodních věd Člověk a příroda 8.ročník červenec 2012 Hrozba epidemie, pandemie chřipka, HIV Anotace: Kód: VY_52_INOVACE_ Čap-Z 8.,9.26 Vzdělávací oblast: Autor:
Inovace a zkvalitnění výuky v oblasti přírodních věd Člověk a příroda 8.ročník červenec 2012 Hrozba epidemie, pandemie chřipka, HIV Anotace: Kód: VY_52_INOVACE_ Čap-Z 8.,9.26 Vzdělávací oblast: Autor:
Maturitní témata - BIOLOGIE 2018
 Maturitní témata - BIOLOGIE 2018 1. Obecná biologie; vznik a vývoj života Biologie a její vývoj a význam, obecná charakteristika organismů, přehled živých soustav (taxonomie), Linného taxony, binomická
Maturitní témata - BIOLOGIE 2018 1. Obecná biologie; vznik a vývoj života Biologie a její vývoj a význam, obecná charakteristika organismů, přehled živých soustav (taxonomie), Linného taxony, binomická
Importované arbovirové infekce v intenzivní péči
 Importované arbovirové infekce v intenzivní péči MUDr. Milan Trojánek, Ph.D. Klinika infekčních nemocí 2. lékařská fakulta, Univerzita Karlova, Praha Katedra infekčních nemocí Institut postgraduálního
Importované arbovirové infekce v intenzivní péči MUDr. Milan Trojánek, Ph.D. Klinika infekčních nemocí 2. lékařská fakulta, Univerzita Karlova, Praha Katedra infekčních nemocí Institut postgraduálního
West Nile Virus, aneb je třeba být připraven
 West Nile Virus, aneb je třeba být připraven RNDr. Eva Křížová, Ph.D Transfuzní a tkáňové oddělení Fakultní nemocnice Brno Taxonomické zařazení a charakteristika WNV Rod: Flavivirus Charakteristika: RNA
West Nile Virus, aneb je třeba být připraven RNDr. Eva Křížová, Ph.D Transfuzní a tkáňové oddělení Fakultní nemocnice Brno Taxonomické zařazení a charakteristika WNV Rod: Flavivirus Charakteristika: RNA
Lidmila Hamplová a kol. Mikrobiologie, Imunologie, Epidemiologie, Hygiena pro bakalářské studium a všechny typy zdravotnických škol
 Lidmila Hamplová a kol. Mikrobiologie, Imunologie, Epidemiologie, Hygiena pro bakalářské studium a všechny typy zdravotnických škol Tato kniha ani žádná její část nesmí být kopírována, rozmnožována ani
Lidmila Hamplová a kol. Mikrobiologie, Imunologie, Epidemiologie, Hygiena pro bakalářské studium a všechny typy zdravotnických škol Tato kniha ani žádná její část nesmí být kopírována, rozmnožována ani
Maturitní témata Biologie MZ 2017
 Maturitní témata Biologie MZ 2017 1. Buňka - stavba a funkce buněčných struktur - typy buněk - prokaryotní buňka - eukaryotní buňka - rozdíl mezi rostlinnou a živočišnou buňkou - buněčný cyklus - mitóza
Maturitní témata Biologie MZ 2017 1. Buňka - stavba a funkce buněčných struktur - typy buněk - prokaryotní buňka - eukaryotní buňka - rozdíl mezi rostlinnou a živočišnou buňkou - buněčný cyklus - mitóza
AKTUÁLNE TRENDY V CESTOVNEJ MEDICÍNE A NOVINKY V OČKOVANÍ
 AKTUÁLNE TRENDY V CESTOVNEJ MEDICÍNE A NOVINKY V OČKOVANÍ Doc. MUDr. Rastislav Maďar, Ph.D., MBA, FFTM RCPS (Glasg.) Slovenský vakcinologický kongres 2017 Prednáška je podporená spoločnosťou Sanofi Pasteur
AKTUÁLNE TRENDY V CESTOVNEJ MEDICÍNE A NOVINKY V OČKOVANÍ Doc. MUDr. Rastislav Maďar, Ph.D., MBA, FFTM RCPS (Glasg.) Slovenský vakcinologický kongres 2017 Prednáška je podporená spoločnosťou Sanofi Pasteur
Škodlivé organismy veřejné zeleně jako riziko pro lidskou populaci
 Škodlivé organismy veřejné zeleně jako riziko pro lidskou populaci Úvodem Prezentace rizik některých škodlivých organismů pro lidskou populaci a vyskytujících se zejména pak v parcích, městských lesech,
Škodlivé organismy veřejné zeleně jako riziko pro lidskou populaci Úvodem Prezentace rizik některých škodlivých organismů pro lidskou populaci a vyskytujících se zejména pak v parcích, městských lesech,
Změna klimatu a lidské zdraví. Ústí nad Labem, 9. 11. 2011
 Změna klimatu a lidské zdraví Ústí nad Labem, 9. 11. 2011 odborný konzultant v oblasti zdravotních a ekologických rizik e-mail: miroslav.suta (at) centrum.cz Světový den zdraví 2008 Globální hrozba pro
Změna klimatu a lidské zdraví Ústí nad Labem, 9. 11. 2011 odborný konzultant v oblasti zdravotních a ekologických rizik e-mail: miroslav.suta (at) centrum.cz Světový den zdraví 2008 Globální hrozba pro
Akutní a chronické hepatitidy
 Akutní a chronické hepatitidy MUDr. Jana Bednářová, PhD. Oddělení klinické mikrobiologie FN Brno Hepatitida zánět a poškození jater různými etiologickými agens zahrnujícími neinfekční příčiny i různá infekční
Akutní a chronické hepatitidy MUDr. Jana Bednářová, PhD. Oddělení klinické mikrobiologie FN Brno Hepatitida zánět a poškození jater různými etiologickými agens zahrnujícími neinfekční příčiny i různá infekční
Vzdělávací materiál projektu Zlepšení podmínek výuky v ZŠ Sloup
 Kód: Vzdělávací materiál projektu Zlepšení podmínek výuky v ZŠ Sloup Název vzdělávacího materiálu Imunita a infekční nemoci Anotace Pracovní list seznamuje žáka s druhy infekčních chorob a se způsoby jejich
Kód: Vzdělávací materiál projektu Zlepšení podmínek výuky v ZŠ Sloup Název vzdělávacího materiálu Imunita a infekční nemoci Anotace Pracovní list seznamuje žáka s druhy infekčních chorob a se způsoby jejich
Autochtonní přenos horečky chikungunya ve Francii a v Itálii, srpen-září 2017
 Autochtonní přenos horečky chikungunya ve Francii a v Itálii, srpen-září 2017 - souhrn rychlého hodnocení rizika Evropského centra pro kontrolu a prevenci nemocí (ECDC), ke dni 13.9.2017 Souhrn: Aktuálně
Autochtonní přenos horečky chikungunya ve Francii a v Itálii, srpen-září 2017 - souhrn rychlého hodnocení rizika Evropského centra pro kontrolu a prevenci nemocí (ECDC), ke dni 13.9.2017 Souhrn: Aktuálně
VY_32_INOVACE_07_B_19.notebook. July 08, 2013
 1 Škola Autor Název Téma SOŠ a SOU Milevsko Mgr. Jaroslava Neumannová VY_32_INOVACE_07_B_19_ZDR Alimentární nákazy Datum tvorby 12.4.2013 Číslo projektu CZ.1.07/1.5.00/34.0557III/2 Inovace a zkvalitněnívýuky
1 Škola Autor Název Téma SOŠ a SOU Milevsko Mgr. Jaroslava Neumannová VY_32_INOVACE_07_B_19_ZDR Alimentární nákazy Datum tvorby 12.4.2013 Číslo projektu CZ.1.07/1.5.00/34.0557III/2 Inovace a zkvalitněnívýuky
Očkování proti klíšťové encefalitidě v létě a po přisátí klíštěte
 Očkování proti klíšťové encefalitidě v létě a po přisátí klíštěte Jan Smetana Fakulta vojenského zdravotnictví UO, Hradec Králové X. Hradecké vakcinologické dny, 2. - 4. 0. 204 2 Klíšťová encefalitida
Očkování proti klíšťové encefalitidě v létě a po přisátí klíštěte Jan Smetana Fakulta vojenského zdravotnictví UO, Hradec Králové X. Hradecké vakcinologické dny, 2. - 4. 0. 204 2 Klíšťová encefalitida
Nákazy s přírodní ohniskovostí. MUDr. Miroslava Zavřelová ÚPL LF MU
 Nákazy s přírodní ohniskovostí MUDr. Miroslava Zavřelová ÚPL LF MU Přírodní ohnisko nákazy oblast s jedním biotopem (konkrétními přírodními podmínkami) přítomnost zdrojů nákazy (rezervoárových zvířat)
Nákazy s přírodní ohniskovostí MUDr. Miroslava Zavřelová ÚPL LF MU Přírodní ohnisko nákazy oblast s jedním biotopem (konkrétními přírodními podmínkami) přítomnost zdrojů nákazy (rezervoárových zvířat)
Klíšťová encefalitida
 Klíšťová encefalitida Autor: Michaela Měkýšová Výskyt Česká republika patří každoročně mezi státy s vysokým výskytem klíšťové encefalitidy. Za posledních 10 let připadá přibližně 7 nakažených osob na 100
Klíšťová encefalitida Autor: Michaela Měkýšová Výskyt Česká republika patří každoročně mezi státy s vysokým výskytem klíšťové encefalitidy. Za posledních 10 let připadá přibližně 7 nakažených osob na 100
Neuroviry. MUDr. Jana Bednářová, PhD. OKM FN Brno
 Neuroviry MUDr. Jana Bednářová, PhD. OKM FN Brno Neuroviry virus klíšťové encefalitidy enteroviry virus parotitidy virus herpes simplex virus varicelly-zosteru cytomegalovirus virus vztekliny další arboviry
Neuroviry MUDr. Jana Bednářová, PhD. OKM FN Brno Neuroviry virus klíšťové encefalitidy enteroviry virus parotitidy virus herpes simplex virus varicelly-zosteru cytomegalovirus virus vztekliny další arboviry
356/2004 Sb. VYHLÁŠKA
 356/2004 Sb. VYHLÁŠKA ze dne 1. června 2004 o sledování (monitoringu) zoonóz a původců zoonóz a o změně vyhlášky č. 299/2003 Sb., o opatřeních pro předcházení a zdolávání nákaz a nemocí přenosných ze zvířat
356/2004 Sb. VYHLÁŠKA ze dne 1. června 2004 o sledování (monitoringu) zoonóz a původců zoonóz a o změně vyhlášky č. 299/2003 Sb., o opatřeních pro předcházení a zdolávání nákaz a nemocí přenosných ze zvířat
Vypracovaly: Martina Hejtmánková Michaela Stapajová
 Vypracovaly: Martina Hejtmánková Michaela Stapajová CAMPYLOBACTER Podmíněně patogenní bakterie Onemocnění alimentárního původu Alimentární původ= onemocnění z potravin MORFOLOGIE Gramnegativní bakterie
Vypracovaly: Martina Hejtmánková Michaela Stapajová CAMPYLOBACTER Podmíněně patogenní bakterie Onemocnění alimentárního původu Alimentární původ= onemocnění z potravin MORFOLOGIE Gramnegativní bakterie
Zdravotní aspekty migrace osob. Miroslava Zavřelová ÚOPZ LF MU
 Zdravotní aspekty migrace osob Miroslava Zavřelová ÚOPZ LF MU Představují uprchlíci epidemiologické riziko? Významné trasy migrace http://img.cz.prg.cmestatic.com/media/images/660xx/jun2015/1761711.jpg?2cc5
Zdravotní aspekty migrace osob Miroslava Zavřelová ÚOPZ LF MU Představují uprchlíci epidemiologické riziko? Významné trasy migrace http://img.cz.prg.cmestatic.com/media/images/660xx/jun2015/1761711.jpg?2cc5
The cell biology of rabies virus: using stealth to reach the brain
 The cell biology of rabies virus: using stealth to reach the brain Matthias J. Schnell, James P. McGettigan, Christoph Wirblich, Amy Papaneri Nikola Skoupá, Kristýna Kolaříková, Agáta Kubíčková Historie
The cell biology of rabies virus: using stealth to reach the brain Matthias J. Schnell, James P. McGettigan, Christoph Wirblich, Amy Papaneri Nikola Skoupá, Kristýna Kolaříková, Agáta Kubíčková Historie
VYŠETŘENÍ TĚL ULOVENÉ ZVĚŘE. Inovace předmětu Registrační číslo projektu
 Název inovace Inovace předmětu Registrační číslo projektu Název projektu Název příjemce podpory VYŠETŘENÍ TĚL ULOVENÉ ZVĚŘE H1DKZ - Hygiena a technologie drůbeže, králíků a zvěřiny CZ.1.07/2.2.00/15.0063
Název inovace Inovace předmětu Registrační číslo projektu Název projektu Název příjemce podpory VYŠETŘENÍ TĚL ULOVENÉ ZVĚŘE H1DKZ - Hygiena a technologie drůbeže, králíků a zvěřiny CZ.1.07/2.2.00/15.0063
V případě bodů a) a b) může být prohlášení podáno formou odkazu na publikovanou literaturu.
 TABULKA ZEVNÍCH PŮVODCŮ, NA KTERÉ MÁ BÝT VYŠETŘOVÁNO VE VZTAHU K OBECNÝM A DRUHOVĚ SPECIFICKÝM POKYNŮM K VÝROBĚ A KONTROLE SAVČÍCH VETERINÁRNÍCH VAKCÍN 1. VYSVĚTLUJÍCÍ POZNÁMKA V obecných požadavcích pro
TABULKA ZEVNÍCH PŮVODCŮ, NA KTERÉ MÁ BÝT VYŠETŘOVÁNO VE VZTAHU K OBECNÝM A DRUHOVĚ SPECIFICKÝM POKYNŮM K VÝROBĚ A KONTROLE SAVČÍCH VETERINÁRNÍCH VAKCÍN 1. VYSVĚTLUJÍCÍ POZNÁMKA V obecných požadavcích pro
Digitální učební materiál
 Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Odborná biologie, část biologie Společná pro
Digitální učební materiál Projekt CZ.1.07/1.5.00/34.0415 Inovujeme, inovujeme Šablona III/2 Inovace a zkvalitnění výuky prostřednictvím ICT (DUM) Tematická Odborná biologie, část biologie Společná pro
Jan Máca ARK FN Ostrava. Chřipka-up to date 2013
 Jan Máca ARK FN Ostrava Chřipka-up to date 2013 Obsah chřipkové viry aktuální epidemiologická situace v ČR strategie terapie a prevence dohled a organizace péče CHŘIPKOVÉ VIRY EPIDEMIOLOGICKÁ SITUACE Struktura
Jan Máca ARK FN Ostrava Chřipka-up to date 2013 Obsah chřipkové viry aktuální epidemiologická situace v ČR strategie terapie a prevence dohled a organizace péče CHŘIPKOVÉ VIRY EPIDEMIOLOGICKÁ SITUACE Struktura
1. Definice a historie oboru molekulární medicína. 3. Základní laboratorní techniky v molekulární medicíně
 Obsah Předmluvy 1. Definice a historie oboru molekulární medicína 1.1. Historie molekulární medicíny 2. Základní principy molekulární biologie 2.1. Historie molekulární biologie 2.2. DNA a chromozomy 2.3.
Obsah Předmluvy 1. Definice a historie oboru molekulární medicína 1.1. Historie molekulární medicíny 2. Základní principy molekulární biologie 2.1. Historie molekulární biologie 2.2. DNA a chromozomy 2.3.
Světový týden očkování
 Světový týden očkování 24. 4. 30. 4. 2019 Protected Together #VaccinesWork Vakcíny jsou bezpečné a účinné Každá vakcína s licencí je před schválením pro použití přísně kontrolována Trvale jsou monitorovány
Světový týden očkování 24. 4. 30. 4. 2019 Protected Together #VaccinesWork Vakcíny jsou bezpečné a účinné Každá vakcína s licencí je před schválením pro použití přísně kontrolována Trvale jsou monitorovány
Nebuněční Viry, viroidy, priony
 Nebuněční Viry, viroidy, priony Viry - Stavba virionu Virové kapsidy Nukleová kyselina viru a) DNA - dvouřetězcová - jednořetězcová (jen u virů) b) RNA -dvouřetězcová (jen u virů) - jednořetězcová Lytický
Nebuněční Viry, viroidy, priony Viry - Stavba virionu Virové kapsidy Nukleová kyselina viru a) DNA - dvouřetězcová - jednořetězcová (jen u virů) b) RNA -dvouřetězcová (jen u virů) - jednořetězcová Lytický
Přenosné nemoci v ČR v roce Infectious diseases in the CR in 2004
 Aktuální informace Ústavu zdravotnických informací a statistiky České republiky Praha 10.6.2005 23 Přenosné nemoci v ČR v roce 2004 Infectious diseases in the CR in 2004 Souhrn V této Aktuální informaci
Aktuální informace Ústavu zdravotnických informací a statistiky České republiky Praha 10.6.2005 23 Přenosné nemoci v ČR v roce 2004 Infectious diseases in the CR in 2004 Souhrn V této Aktuální informaci
Atestační otázky z oboru hygiena a epidemiologie
 Publikováno z 2. lékařská fakulta Univerzity Karlovy (https://www.lf2.cuni.cz) LF2 > Atestační otázky z oboru hygiena a epidemiologie Atestační otázky z oboru hygiena a epidemiologie Epidemiologie Obecná
Publikováno z 2. lékařská fakulta Univerzity Karlovy (https://www.lf2.cuni.cz) LF2 > Atestační otázky z oboru hygiena a epidemiologie Atestační otázky z oboru hygiena a epidemiologie Epidemiologie Obecná
Eradikace BVD v Německu naše zkušenosti
 Eradikace BVD v Německu naše zkušenosti MVDr. Kirsten Stemme Základní údaje o BVD Virus BVD - pestivirus - různé genotypy a subtypy - dva rozdílné biotypy (necytopatogenní, cytopatogenní) podle Heckerta
Eradikace BVD v Německu naše zkušenosti MVDr. Kirsten Stemme Základní údaje o BVD Virus BVD - pestivirus - různé genotypy a subtypy - dva rozdílné biotypy (necytopatogenní, cytopatogenní) podle Heckerta
Ekologie živočichů, téma 24 : Parasitismus
 Ekologie živočichů, téma 24 : Parasitismus Parazitismus: jedna z forem predace v širším pojetí parazit je na hostitele vázán jeho existence závisí na živém hostiteli Když hostitel uhyne: parazité se musí
Ekologie živočichů, téma 24 : Parasitismus Parazitismus: jedna z forem predace v širším pojetí parazit je na hostitele vázán jeho existence závisí na živém hostiteli Když hostitel uhyne: parazité se musí
Globální rizika. Neočekávané události, které mohou negativně ovlivnit státy a jejich ekonomiky v dalších 10 letech
 Globální rizika Neočekávané události, které mohou negativně ovlivnit státy a jejich ekonomiky v dalších 10 letech Global Risk Report ročenka analyzující globální rizika vydává Světové ekonomické fórum
Globální rizika Neočekávané události, které mohou negativně ovlivnit státy a jejich ekonomiky v dalších 10 letech Global Risk Report ročenka analyzující globální rizika vydává Světové ekonomické fórum
Chřipka prasat z pohledu veterinárního lékaře
 Chřipka prasat z pohledu veterinárního lékaře Pospíšil Z., Lány P., Zendulková D., Rosenbergová K. Ústav infekčních chorob a epizootologie Fakulta veterinárního lékařství VFU Brno Původce influenzy Orthomyxoviry
Chřipka prasat z pohledu veterinárního lékaře Pospíšil Z., Lány P., Zendulková D., Rosenbergová K. Ústav infekčních chorob a epizootologie Fakulta veterinárního lékařství VFU Brno Původce influenzy Orthomyxoviry
Konkrétní případy nutričně-epidemiologického hodnocení biologických škodlivin. MGR. ALEŠ PEŘINA, PH. D.
 Konkrétní případy nutričně-epidemiologického hodnocení biologických škodlivin. MGR. ALEŠ PEŘINA, PH. D. Biologická agens a zdraví Probiotické bakterie Původci onemocnění u lidí: paraziti, bakterie, viry,
Konkrétní případy nutričně-epidemiologického hodnocení biologických škodlivin. MGR. ALEŠ PEŘINA, PH. D. Biologická agens a zdraví Probiotické bakterie Původci onemocnění u lidí: paraziti, bakterie, viry,
Mikrobiální bezpečnost potravin rostlinného původu
 Mikrobiální bezpečnost potravin rostlinného původu P. Králík, M. Morávková, P. Vašíčková, M. Slaný Oddělení bezpečnosti potravin a krmiv Výzkumný ústav veterinárního lékařství, v.v.i. QJ1210114 Zelinářské
Mikrobiální bezpečnost potravin rostlinného původu P. Králík, M. Morávková, P. Vašíčková, M. Slaný Oddělení bezpečnosti potravin a krmiv Výzkumný ústav veterinárního lékařství, v.v.i. QJ1210114 Zelinářské
RNDr. Ivo Rudolf, Ph.D. Oddělení mikrobiologie a molekulární biotechnologie
 RNDr. Ivo Rudolf, Ph.D. Oddělení mikrobiologie a molekulární biotechnologie Zaměření oboru: Oddělení mikrobiologie a molekulární biotechnologie výchova erudovaných mikrobiologů se širokou perspektivou
RNDr. Ivo Rudolf, Ph.D. Oddělení mikrobiologie a molekulární biotechnologie Zaměření oboru: Oddělení mikrobiologie a molekulární biotechnologie výchova erudovaných mikrobiologů se širokou perspektivou
Viry jako původci NN. z pohledu epidemiologa. Hradecké virologické dny MUDr. Lenka Hobzová Nemocniční hygienik a epidemiolog
 Viry jako původci NN z pohledu epidemiologa Hradecké virologické dny MUDr. Lenka Hobzová Nemocniční hygienik a epidemiolog Druhy NN =Infekce spojené se zdravotní péčí Pneumonie Infekce místa operační rány
Viry jako původci NN z pohledu epidemiologa Hradecké virologické dny MUDr. Lenka Hobzová Nemocniční hygienik a epidemiolog Druhy NN =Infekce spojené se zdravotní péčí Pneumonie Infekce místa operační rány
