P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
|
|
|
- Richard Navrátil
- před 7 lety
- Počet zobrazení:
Transkript
1 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1
2 1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2015/2016) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Inaktivované povrchové antigeny ch ipkového viru (hemaglutinin a neuraminidáza)* následujících kmen : A/California/7/2009 (H1N1)pdm09 - varianta (A/Brisbane/10/2010, divoký typ) A/ Switzerland/ /2013 (H3N2) - varianta (A/South Australia/55/2014, divoký typ) 15 mikrogram HA** 15 mikrogram HA** B/Phuket/3073/2013 varianta (B/Utah/9/2014, divoký typ) 15 mikrogram HA** v dávce 0,5 ml. * pomnožené v Madin-Darbyho psích ledvinových (MDCK, Madin Darby Canine Kidney) bu kách ** hemaglutinin Vakcína spl uje doporu ení Sv tové zdravotnické organizace (pro severní polokouli) a rozhodnutí EU na sezónu 2015/2016 Úplný seznam pomocných látek viz bod LÉKOVÁ FORMA Injek ní suspenze v p edpln né injek ní st íka ce. irá až mírn opalescentní. 4. KLINICKÉ ÚDAJE 4.1 Terapeutické indikace Profylaxe ch ipky u dosp lých, zvlášt u osob se zvýšeným rizikem komplikací souvisejících s ch ipkovým onemocn ním. Vakcína Optaflu by m la být podávána v souladu s oficiálními doporu eními. 4.2 Dávkování a zp sob podání Dávkování Dosp lí starší 18 let: Jedna dávka 0,5 ml 2
3 Pediatrická populace Bezpe nost a ú innost p ípravku Optaflu u d tí a dospívajících mladších 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje. Podávání p ípravku Optaflu d tem a dospívajícím mladším 18 let se proto nedoporu uje (viz bod 5.1). Zp sob podání Imunizaci je t eba provád t intramuskulární injekcí do deltového svalu. 4.3 Kontraindikace Hypersenzitivita na lé ivé látky nebo na kteroukoli pomocnou látku uvedenou v bod 6.1. U pacient s hore natým onemocn ním i akutní infekcí je t eba imunizaci odložit. 4.4 Zvláštní upozorn ní a opat ení pro použití Stejn jako u všech ostatních injek n aplikovaných vakcín by m la být pokaždé zajišt na dostupnost vhodné léka ské lé by a léka ský dohled pro vzácn se vyskytující p ípad anafylaktického šoku po podání vakcíny. Optaflu se nesmí v žádném p ípad podávat intravaskulárn. Po každém o kování, n kdy i p ed ním, m že v d sledku psychogenní reakce na vpich jehly dojít k synkop (mdlobám), zejména u dospívajících jedinc. P i probírání se z mdlob se mohou objevit n které neurologické projevy, jako jsou p echodné poruchy vid ní, parestézie, tonicko-klonické pohyby kon etin. Je pot eba zavést opat ení proti úraz m v d sledku mdlob. Protilátková odpov u pacient s endogenní i iatrogenní imunosupresí nemusí být dostate ná. 4.5 Interakce s jinými lé ivými p ípravky a jiné formy interakce Optaflu lze podávat sou asn s jinými vakcínami. Imunizace má být provedena do r zných kon etin. Je t eba vzít v úvahu, že nežádoucí ú inky mohou být intenzivn jší. Imunologická odpov m že být snížena, jestliže pacient absolvuje lé bu imunosupresivy. Po o kování proti ch ipce mohou být u metody ELISA používané k detekci protilátek proti viru lidské imunodeficience 1 (HIV-1), viru hepatitidy C a zvlášt HTLV 1 zjišt ny falešn pozitivní výsledky sérologických test. Výsledky metody Western blot jsou v takových p ípadech negativní. P echodné falešn pozitivní výsledky mohou být zp sobovány tvorbou IgM v reakci na vakcínu. 4.6 Fertilita, t hotenství a kojení Bezpe nost Optaflu v t hotenství a p i kojení nebyla v klinických studiích hodnocena. T hotenství Celkové údaje o vakcinaci proti ch ipce u t hotných žen nenazna ují, že by s touto vakcínou byly spojeny nežádoucí ú inky týkající se plodu a matky. Studie na zví atech neprokazují reproduk ní toxicitu (viz bod 5.3 P edklinické údaje vztahující se k bezpe nosti). Použití vakcíny Optaflu lze považovat za vhodné po ínaje druhým trimestrem t hotenství. U t hotných žen, u nichž je zvýšené riziko komplikací ch ipky, je podání vakcíny doporu eno bez ohledu na stádium t hotenství. Kojení Neexistují žádné údaje o použití p ípravku Optaflu u lidí b hem kojení. Neo ekávají se žádné ú inky na kojeného novorozence/dít. P ípravek Optaflu se m že používat b hem kojení. 3
4 Fertilita Nejsou k dispozici žádné údaje o fertilit u lidí. Údaje získané u zví at nenazna ují žádné ú inky na fertilitu samic (viz bod 5.3). Fertilita samc nebyla u zí at hodnocena (viz bod 5.3). 4.7 Ú inky na schopnost ídit a obsluhovat stroje Optaflu má mírný vliv na schopnost ídit nebo obsluhovat stroje. 4.8 Nežádoucí ú inky a) Shrnutí bezpe nostního profilu Bezpe nost p ípravku Optaflu byla hodnocena v sedmi randomizovaných klinických studiích s aktivní kontrolou, realizovaných v rámci vývoje p ípravku. Celkem byla jedna dávka p ípravku Optaflu podána pacient m, z toho dosp lým ve v ku let a starším pacient m (ve v ku 61 let a starším). U všech jedinc bylo provád no hodnocení bezpe nosti a reaktivnosti b hem prvních 3 týdn po o kování, a závažné nežádoucí ú inky byly shromážd ny u vakcinovaných b hem následujících šesti m síc sledování. b) Shrnutí nežádoucích ú ink Nežádoucí ú inky jsou uvedeny podle etnosti: Velmi asté ( 1/10) asté ( 1/100 až < 1/10) Mén asté ( 1/1 000 až < 1/100) Vzácné ( 1/ až < 1/1 000) Velmi vzácné (< 1/10 000) Není známo (z dostupných údaj nelze ur it) V každé skupin etností jsou nežádoucí ú inky se azeny podle klesající závažnosti. Pozorovány byly tyto nežádoucí ú inky: Tabulka 1: etnost u dosp lých (ve v ku let) T ídy orgánových systém Poruchy nervového systému Cévní poruchy Velmi asté 1/10 - Bolest hlavy* asté 1/100 až < 1/10 Mén asté 1/1 000 až < 1/100 Vzácné 1/ až <1/1 000 Velmi vzácné < 1/ Neurologické poruchy jako je encefalomyelitida, neuritida a Guillain- Barrého syndrom - Vaskulitida s pravd podobným p echodným postižením ledvin Není známo (z dostupných údaj nelze ur it) 4
5 T ídy orgánových systém Poruchy imunitního systému Poruchy krve a lymfatického systému Poruchy svalové a kosterní soustavy a pojivové tkán Celkové poruchy a reakce v míst aplikace Poruchy k že a podkožní tkán Velmi asté 1/10 asté 1/100 až < 1/10 - Myalgie* - Artralgie* - Zarudnutí* - Bolest v míst injekce* - Malátnost* - Únava* - Otok* - Ekchymóza* - Indurace* - Hore ka více než 38 C* - T esavka / t es* - Gastrointesti-nální poruchy jako bolest b icha, pr jem nebo dyspepsie* - Pocení* Mén asté 1/1 000 až < 1/100 - Celkové kožní reakce se sv d ním, kop ivkou i nespecifickou vyrážkou Vzácné 1/ až <1/ Místní lymfadenopatie - Hore ka více než 39 C Velmi vzácné < 1/ Alergické reakce, ve velmi vzácných p ípadech vedoucí k anafylaktic -kému šoku - Trombocytopenie** Není známo (z dostupných údaj nelze ur it) - Angioedém - Rozsáhlý otok vakcinované kon etiny * Tyto reakce obvykle vymizely do 1 2 dní bez lé by. ** Trombocytopenie (n kolik velmi závažných p ípad s poklesem po tu krevních desti ek pod na mm 3 ). etnost nežádoucích ú ink u starších osob je podobná, krom myalgie, bolesti hlavy a bolesti v míst injekce po vakcinaci, které jsou podle etnosti pouze asté. Výskyt st ední a silné bolesti po vakcinaci p ípravkem Optaflu je podobný jako u vakcíny proti ch ipce p ipravené ve vejci; avšak lehce zvýšené riziko mírné, krátkodobé bolesti v míst vpichu bylo pozorováno u p ípravku Optaflu v podskupin starších osob (8 % ve srovnání se 6 % u vakcíny proti ch ipce p ipravené ve vejci). 5
6 Postmarketingové sledování: K dispozici jsou pouze omezené údaje z postmarketingových zkušeností s p ípravkem Optaflu. Následující nežádoucí ú inky byly zaznamenány b hem postmarketingového sledování p i podávání sezónních trivalentních vakcín p ipravených technologií, kde se k výrob používají vejce: Poruchy nervové soustavy: Neuralgie, parestezie, k e e, febrilní k e e. U vakcíny proti ch ipce, p ipravené ve vejci byly nežádoucí ú inky jako neuralgie, parestézie, febrilní k e e pozorovány vzácn ji. Hlášení podez ení na nežádoucí ú inky Hlášení podez ení na nežádoucí ú inky po registraci lé ivého p ípravku je d ležité. Umož uje to pokra ovat ve sledování pom ru p ínos a rizik lé ivého p ípravku. Žádáme zdravotnické pracovníky, aby hlásili podez ení na nežádoucí ú inky prost ednictvím národního systému hlášení nežádoucích ú ink uvedeného v Dodatku V. 4.9 P edávkování Nebyl zaznamenán žádný p ípad p edávkování p ípravkem Optaflu. 5. FARMAKOLOGICKÉ VLASTNOSTI 5.1 Farmakodynamické vlastnosti Farmakoterapeutická skupina: Vakcína proti ch ipce, ATC kód: J07BB02 Ú innost proti kultiva n potvrzené ch ipce Prob hlo mezinárodní (v USA, Finsku a Polsku) randomizované hodnocení se zaslepením pozorovatel a kontrolou placebem, jehož cílem bylo zhodnotit klinickou ú innost a bezpe nost p ípravku Optaflu b hem ch ipkové sezóny u dosp lých ve v ku 18 až 49 let. Do tohoto hodnocení bylo zahrnuto celkem subjekt, kte í dostali p ípravek Optaflu (N = 3 828), Agrippal (N = 3 676) nebo placebo (N = 3 900) v pom ru 1: 1: 1. Pr m rný v k celé populace zahrnuté do hodnocení byl 33 let, z ehož 55 % subjekt byly ženy, 84 % p íslušníci bílé rasy, 7 % p íslušníci erné rasy, 7 % hispánc a 2 % pat ila do jiné etnické skupiny. Ú innost p ípravku Optaflu byla definována jako prevence kultiva n potvrzené symptomatické ch ipky zp sobené viry, které antigenn odpovídaly vir m ve vakcín, ve srovnání s placebem. P ípady ch ipky byly identifikovány aktivním a pasivním sledováním onemocn ní podobného ch ipce (ILI). ILI bylo definováno v souladu s doporu eními center pro kontrolu a prevenci onemocn ní (CDC, Centers for Disease Control and Prevention) šlo o hore ku (teplota v dutin ústní 100,0 F / 38 C) a kašel i bolest v krku. Po epizod ILI byly provedeny st ry nosu a hrdla a byly odeslány k další analýze. Byly vypo teny ú innosti vakcín proti kmen m vir ch ipky odpovídajícím vakcina ním kmen m, proti všem kmen m vir ch ipky a proti jednotlivým podtyp m vir ch ipky (tabulka 2 a 3). 6
7 Tabulka 2: Ú innost vakcíny proti kultiva n potvrzené ch ipce Po et subjekt dle protokolu Po et subjekt s ch ipkou Frekvence epizod (%) % Ú innost vakcíny* Spodní limit jednostranného 97,5% intervalu spolehlivosti Antigenn odpovídající kmeny Optaflu ,19 83,8 61,0 Placebo , Všechny p ípady kultiva n potvrzené ch ipky Optaflu ,11 69,5 55,0 Placebo , * Simultánní jednostranné 97,5% intervaly spolehlivosti ú innosti jednotlivých vakcín proti ch ipce ve srovnání s placebem dle interval spolehlivosti skóre korigovaného dle Sidaka pro dv relativní rizika. Ú innost vakcíny = (1 relativní riziko) x 100 % Tabulka 3: Srovnávaná ú innost p ípravku Optaflu a placeba proti kultiva n potvrzené ch ipce dle podtyp vir ch ipky Frekvence epizod (%) Optaflu (N = 3 776) Po et subjekt s ch ipkou Frekvence epizod (%) Placebo (N =3 843) Po et subjekt s ch ipkou Ú innost vakcíny * % Spodní limit jednostranného 97,5% intervalu spolehlivosti Antigenn odpovídající kmeny A/H3N2 ** 0, A/H1N1 0,13 5 1, ,2 67,4 B ** 0 0 0, Všechny p ípady kultiva n potvrzené ch ipky A/H3N2 0,16 6 0, ,6 35,1 A/H1N1 0,16 6 1, ,3 73,0 B 0, , ,9 18,2 * Simultánní jednostranné 97,5% intervaly spolehlivosti ú innosti jednotlivých vakcín proti ch ipce ve srovnání s placebem dle interval spolehlivosti skóre korigovaného dle Sidaka pro dv relativní rizika. Ú innost vakcíny = (1 relativní riziko) x 100 % ** K adekvátnímu zhodnocení ú innosti vakcíny bylo pozorováno p íliš málo p ípad ch ipky zp sobené kmeny A/H3N2 nebo B odpovídajícími vakcina ním kmen m. Imunogenicita Séroprotekce je obecn dosáhnuto do 3 týdn, jak bylo pozorováno v hlavní klinické studii fáze III V58P4, u populace dosp lých a starších jedinc. V této srovnávací studii oproti vakcín proti ch ipce p ipravené ve vejci byla hodnocena na základ p edem definovaných kritérií procentuální séroprotekce* a procentuální nebo výrazn vyšší sérokonverze** a pom ry geometrických pr m r (GMR) pro protilátku anti-ha (m eno pomocí HI). U dosp lých jsou údaje následující (hodnoty v závorkách p edstavují 95 % interval spolehlivosti): 7
8 Tabulka 4: Imunogenicita u dosp lých Protilátka anti-ha specifická pro kmen A/H1N1 N=650 A/H3N2 N=650 B N=650 Procentuální séroprotekce 86% (83; 88) 98% (97; 99) 83% (80; 86) Procentuální nebo výrazn vyšší sérokonverze 63% (59; 67) 58% (54; 62) 78% (75; 81) GMR 7,62 (6,86; 8,46) 4,86 (4,43; 5,33) 9,97 (9,12; 11) * Séroprotekce = HI titry 40 ** Sérokonverze = negativní p edvakcina ní HI titr a postvakcina ní HI titr 40: výrazný nár st = pozitivní p edvakcina ní HI titr a alespo ty násobný nár st v postvakcina ní HI titru. U starších osob jsou údaje následující (hodnoty v závorkách p edstavují 95 % interval spolehlivosti): Tabulka 5: Imunogenicita u starších osob Protilátka anti-ha specifická pro kmen A/H1N1 N=672 A/H3N2 N=672 B N=672 Procentuální séroprotekce 76% (72; 79) 97% (96; 98) 84% (81; 87) Procentuální nebo výrazn vyšší sérokonverze 48% (44; 52) 65% (61; 68) 76% (72; 79) GMR 4,62 (4,2; 5,08) 5,91 (5,35; 6,53) 9,63 (8,77; 11) * Séroprotekce = HI titry 40 ** Sérokonverze = negativní p edvakcina ní HI titr ad povakcina ní HI titr 40: výrazný nár st = pozitivní p edvakcina ní HI titr a alespo ty násobný nár st v postvakcina ní HI titru. Nebyl pozorován žádný rozdíl mezi vakcínou p ipravenou v bun né kultu e a komparativní vakcínou p ipravenou ve vejci. U všech t í ch ipkových kmen vakcíny p ipravené ve vejci byl rozsah procentuální séroprotekce mezi 85 % a 98 %, procentuální nebo výrazn vyšší sérokonverze mezi 62 % a 73 % a rozsahy GMR byly mezi 5,52krát a 8,76krát nad základním HI titrem Doba postvakcina ní imunity v i kmen m zahrnutým ve vakcín, obvykle iní 6-12 m síc, jak bylo pozorováno ve studiích provád ných b hem klinického vývoje této vakcíny. Pediatrická populace P ípravek Optaflu nebyl studován u pediatrické populace, a proto pro tuto v kovou skupinu nejsou k dispozici údaje o imunitní odezv. Evropská agentura pro lé ivé p ípravky ud lila odklad povinnosti p edložit výsledky studií s p ípravkem Optaflu u jedné nebo více podskupin pediatrické populace v rámci prevence ch ipky (informace o použití u d tí viz bod 4.2). 5.2 Farmakokinetické vlastnosti Neuplat uje se. 5.3 P edklinické údaje vztahující se k bezpe nosti Neklinické údaje získané na základ konven ních studií toxicity po opakovaném podávání neodhalily žádné zvláštní riziko pro lov ka. Optaflu byl dob e snášen a byl imunogenní u myší a fretek. Studie toxicity po opakovaném podávání u králík neodhalila žádný d kaz systémové toxicity a vakcína byla lokáln dob e snášena. 8
9 Ve studiích, kde byla králi ím samicím podána dávka p ípravku Optaflu ur ená pro lov ka ješt p ed zab eznutím nebo b hem b ezosti, nebyly zjišt ny žádné známky reproduk ní i vývojové toxicity. 6. FARMACEUTICKÉ ÚDAJE 6.1 Seznam pomocných látek Chlorid sodný, Chlorid draselný, Hexahydrát chloridu ho e natého, Dihydrát hydrogenfosfore nanu sodného, Dihydrogenfosfore nan draselný Voda na injekci. 6.2 Inkompatibility Studie kompatibility nejsou k dispozici, a proto nesmí být tento lé ivý p ípravek mísen s jinými lé ivými p ípravky. 6.3 Doba použitelnosti 1 rok 6.4 Zvláštní opat ení pro uchovávání Uchovávejte v chladni ce (2 C 8 C). Chra te p ed mrazem. Uchovávejte p edpln nou injek ní st íka ku v krabi ce, aby byl p ípravek chrán n p ed sv tlem. 6.5 Druh obalu a obsah balení 0,5 ml suspenze v p edpln ných injek ních st íka kách (sklo typu I) s pístovou zátkou (bromobutylová pryž). Velikosti balení: 1, 10 nebo vícenásobná balení obsahující 20 (2 balení po 10) p edpln ných injek ních st íka ek, každá velikost balení s jehlou nebo bez jehly. Na trhu nemusí být všechny velikosti balení. 6.6 Zvláštní opat ení pro likvidaci p ípravku a pro zacházení s ním P ed podáním nechte vakcínu oh át na pokojovou teplotu. P ed použitím prot epejte. Obsah každé injek ní st íka ky s p ípravkem Optaflu p ed podáním zkontrolujte pohledem, zda v n m nejsou áste ky nebo zda se nezm nila jeho barva. Pokud ano, vakcínu nepodávejte. Veškerý nepoužitý lé ivý p ípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7. DRŽITEL ROZHODNUTÍ O REGISTRACI Emil-von-Behring-Strasse 76 D Marburg N mecko 9
10 8. REGISTRA NÍ ÍSLO(A) EU/1/07/394/001 EU/1/07/394/ DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE Datum první registrace: 01. ervna 2007 Datum posledního prodloužení registrace: 01. ervna DATUM REVIZE TEXTU Podrobné informace o tomto p ípravku jsou uve ejn ny na webových stránkách Evropské agentury pro lé ivé p ípravky 10
11 P ÍLOHA II A. VÝROBCE BIOLOGICKÉ LÉ IVÉ LÁTKY A VÝROBCE ODPOV DNÝ ZA PROPOUŠT NÍ ŠARŽÍ B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPE NÉ A Ú INNÉ POUŽÍVÁNÍ LÉ IVÉHO P ÍPRAVKU 11
12 A. VÝROBCE BIOLOGICKÉ LÉ IVÉ LÁTKY A VÝROBCE ODPOV DNÝ ZA PROPOUŠT NÍ ŠARŽÍ Název a adresa výrobce biologické lé ivé látky Emil-von-Behring-Strasse 76 D Marburg N mecko Název a adresa výrobce odpov dného za propoušt ní šarží Emil-von-Behring-Strasse 76 D Marburg N mecko V p íbalové informaci k lé ivému p ípravku musí být uveden název a adresa výrobce odpov dného za propoušt ní dané šarže. B. PODMÍNKY NEBO OMEZENÍ VÝDEJE A POUŽITÍ Výdej lé ivého p ípravku je vázán na léka ský p edpis. Ú ední propoušt ní šarží Podle lánku 114 sm rnice 2001/83/ES bude ú ední propoušt ní šarží provád t n která státní laborato nebo laborato k tomuto ú elu ur ená. C. DALŠÍ PODMÍNKY A POŽADAVKY REGISTRACE Pravideln aktualizované zprávy o bezpe nosti (PSUR) Zprávy PSUR pro tento lé ivý p ípravek mají být p edkládány v p lro ních intervalech, dokud CHMP neschválí jiný harmonogram. D. PODMÍNKY NEBO OMEZENÍ S OHLEDEM NA BEZPE NÉ A Ú INNÉ POUŽÍVÁNÍ LÉ IVÉHO P ÍPRAVKU Plán ízení rizik (RMP) Držitel rozhodnutí o registraci uskute ní požadované innosti a intervence v oblasti farmakovigilance podrobn popsané ve schváleném RMP uvedeném v modulu registrace a ve veškerých schválených následných aktualizacích RMP. Aktualizovaný RMP je t eba p edložit: na žádost Evropské agentury pro lé ivé p ípravky, p i každé zm n systému ízení rizik, zejména v d sledku obdržení nových informací, které mohou vést k významným zm nám pom ru p ínos a rizik, nebo z d vodu dosažení význa ného milníku (v rámci farmakovigilance nebo minimalizace rizik). Pokud se shodují data p edložení aktualizované zprávy o bezpe nosti (PSUR) a aktualizovaného RMP, je možné je p edložit sou asn. 12
13 P ÍLOHA III OZNA ENÍ NA OBALU A P ÍBALOVÁ INFORMACE 13
14 A. OZNA ENÍ NA OBALU 14
15 ÚDAJE UVÁD NÉ NA VN JŠÍM OBALU Kartonová krabi ka pro injek ní st íka ku (st íka ky) s jehlou - 1 p edpln ná injek ní st íka ka (0,5 ml) s jehlou - 10 p edpln ných injek ních st íka ek (0,5 ml) s jehlou Kartonová krabi ka pro injek ní st íka ku (st íka ky) bez jehly - 1 p edpln ná injek ní st íka ka (0,5 ml) bez jehly - 10 p edpln ných injek ních st íka ek (0,5 ml) bez jehly 1. NÁZEV LÉ IVÉHO P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2015/2016) 2. OBSAH LÉ IVÉ LÁTKY/LÉ IVÝCH LÁTEK) Inaktivované povrchové antigeny ch ipkového viru (hemaglutinin a neuraminidáza)* následujících kmen : A/California/7/2009 (H1N1)pdm09 - varianta kmene A/ Switzerland/ /2013 (H3N2) - varianta kmene 15 mikrogram HA** 15 mikrogram HA** B/ Phuket/3073/2013 varianta kmene 15 mikrogram HA** v dávce 0,5 ml * pomnožené v Madin-Darbyho psích ledvinových (MDCK, Madin Darby Canine Kidney) bu kách ** hemaglutinin Vakcína spl uje doporu ení Sv tové zdravotnické organizace (pro severní polokouli) a rozhodnutí EU na sezónu 2015/ SEZNAM POMOCNÝCH LÁTEK Chlorid sodný, chlorid draselný, hexahydrát chloridu ho e natého, dihydrát hydrogenfosfore nanu sodného, dihydrogenfosfore nan draselný a voda na injekci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Injek ní suspenze 1 p edpln ná injek ní st íka ka (0,5 ml) s jehlou 10 p edpln ných injek ních st íka ek (0,5 ml) s jehlou 1 p edpln ná injek ní st íka ka (0,5 ml) bez jehly 10 p edpln ných injek ních st íka ek (0,5 ml) bez jehly 15
16 5. ZP SOB A CESTA/CESTY PODÁNÍ Intramuskulární podání. P ed podáním nechte vakcínu oh át na pokojovou teplotu. P ed podáním prot epte. P ed použitím si p e t te p íbalovou informaci. 6. ZVLÁŠTNÍ UPOZORN NÍ, ŽE LÉ IVÝ P ÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH D TÍ Uchovávejte mimo dohled a dosah d tí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORN NÍ, POKUD JE POT EBNÉ Neaplikujte intravaskulárn. 8. POUŽITELNOST Použitelné do: 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v chladni ce. Chra te p ed mrazem. Uchovávejte p edpln nou injek ní st íka ku v krabi ce, aby byl p ípravek chrán n p ed sv tlem. 10. ZVLÁŠTNÍ OPAT ENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉ IVÝCH P ÍPRAVK NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Likvidujte v souladu s místními p edpisy. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI Emil-von-Behring-Strasse 76 D Marburg N MECKO 12. REGISTRA NÍ ÍSLO/ ÍSLA EU/1/07/394/001 EU/1/07/394/002 EU/1/07/394/004 EU/1/07/394/005 EU/1/07/394/007 EU/1/07/394/008 EU/1/07/394/010 EU/1/07/394/011 16
17 13. ÍSLO ŠARŽE.š.: 14. KLASIFIKACE PRO VÝDEJ Výdej lé ivého p ípravku vázán na léka ský p edpis. 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOV PÍSMU Nevyžaduje se - od vodn ní p ijato 17
18 ÚDAJE UVÁD NÉ NA VN JŠÍM OBALU VÍCENÁSOBNÉ BALENÍ - Krabi ka obsahující 2 krabi ky po 10 injek ních st íka kách (s jehlou nebo bez ní) Krabi ka bude obsahovat Blue Box. 1. NÁZEV LÉ IVÉHO P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2015/2016) 2. OBSAH LÉ IVÉ LÁTKY/LÉ IVÝCH LÁTEK) Inaktivované povrchové antigeny ch ipkového viru (hemaglutinin a neuraminidáza)* následujících kmen : A/California/7/2009 (H1N1)pdm09 - varianta kmene A/ Switzerland/ /2013 (H3N2) - varianta kmene 15 mikrogram HA** 15 mikrogram HA** B/ Phuket/3073/2013 varianta kmene 15 mikrogram HA** v dávce 0,5 ml * pomnožené v Madin-Darbyho psích ledvinových (MDCK, Madin Darby Canine Kidney) bu kách ** hemaglutinin Vakcína spl uje doporu ení Sv tové zdravotnické organizace (pro severní polokouli) a rozhodnutí EU na sezónu 2015/ SEZNAM POMOCNÝCH LÁTEK Chlorid sodný, chlorid draselný, hexahydrát chloridu ho e natého, dihydrát hydrogenfosfore nanu sodného, dihydrogenfosfore nan draselný a voda na injekci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Injek ní suspenze Vícenásobné balení: 20 (2 balení po 10) p edpln ných injek ních st íka ek (0,5 ml) bez jehly Vícenásobné balení: 20 (2 balení po 10) p edpln ných injek ních st íka ek (0,5 ml) s jehlou 18
19 5. ZP SOB A CESTA/CESTY PODÁNÍ Intramuskulární podání. P ed podáním nechte vakcínu oh át na pokojovou teplotu. P ed podáním prot epte. P ed použitím si p e t te p íbalovou informaci. 6. ZVLÁŠTNÍ UPOZORN NÍ, ŽE LÉ IVÝ P ÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH D TÍ Uchovávejte mimo dohled a dosah d tí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORN NÍ, POKUD JE POT EBNÉ Neaplikujte intravaskulárn. 8. POUŽITELNOST Použitelné do: 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v chladni ce. Chra te p ed mrazem. Uchovávejte p edpln nou injek ní st íka ku v krabi ce, aby byl p ípravek chrán n p ed sv tlem 10. ZVLÁŠTNÍ OPAT ENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉ IVÝCH P ÍPRAVK NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Likvidujte v souladu s místními p edpisy. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI Emil-von-Behring-Strasse 76 D Marburg N MECKO 12. REGISTRA NÍ ÍSLO/ ÍSLA EU/1/07/394/003 EU/1/07/394/006 EU/1/07/394/009 19
20 13. ÍSLO ŠARŽE.š.: 14. KLASIFIKACE PRO VÝDEJ Výdej lé ivého p ípravku vázán na léka ský p edpis. 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOV PÍSMU Nevyžaduje se - od vodn ní p ijato 20
21 ÚDAJE UVÁD NÉ NA VN JŠÍM OBALU VÍCENÁSOBNÉ BALENÍ - Vnit ní krabi ka s 10 p edpln nými injek ními st íka kami s jehlou - Vnit ní krabi ka s 10 p edpln nými injek ními st íka kami bez jehly Vnit ní krabi ka nebude obsahovat Blue Box. 1. NÁZEV LÉ IVÉHO P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2015/2016) 2. OBSAH LÉ IVÉ LÁTKY/LÉ IVÝCH LÁTEK Inaktivované povrchové antigeny ch ipkového viru (hemaglutinin a neuraminidáza)* následujících kmen : A/California/7/2009 (H1N1)pdm09 - varianta kmene A/ Switzerland/ /2013 (H3N2) - varianta kmene 15 mikrogram HA** 15 mikrogram HA** B/ Phuket/3073/2013 varianta kmene 15 mikrogram HA** v dávce 0,5 ml * pomnožené v Madin-Darbyho psích ledvinových (MDCK, Madin Darby Canine Kidney) bu kách ** hemaglutinin Vakcína spl uje doporu ení Sv tové zdravotnické organizace (pro severní polokouli) a rozhodnutí EU na sezónu 2015/ SEZNAM POMOCNÝCH LÁTEK Chlorid sodný, chlorid draselný, hexahydrát chloridu ho e natého, dihydrát hydrogenfosfore nanu sodného, dihydrogenfosfore nan draselný a voda na injekci. 4. LÉKOVÁ FORMA A OBSAH BALENÍ Injek ní suspenze 10 p edpln ných injek ních st íka ek s jehlou. Sou ást vícenásobného balení, samostatn neprodejné. 10 p edpln ných injek ních st íka ek bez jehly. Sou ást vícenásobného balení, samostatn neprodejné. 21
22 5. ZP SOB A CESTA/CESTY PODÁNÍ Intramuskulární podání. P ed podáním nechejte vakcínu oh át na pokojovou teplotu. P ed podáním prot epejte. P ed použitím si p e t te p íbalovou informaci. 6. ZVLÁŠTNÍ UPOZORN NÍ, ŽE LÉ IVÝ P ÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A DOSAH D TÍ Uchovávejte mimo dohled a dosah d tí. 7. DALŠÍ ZVLÁŠTNÍ UPOZORN NÍ, POKUD JE POT EBNÉ Neaplikujte intravaskulárn. 8. POUŽITELNOST Použitelné do: 9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ Uchovávejte v chladni ce. Chra te p ed mrazem. Uchovávejte p edpln nou injek ní st íka ku v krabi ce, aby byl p ípravek chrán n p ed sv tlem 10. ZVLÁŠTNÍ OPAT ENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉ IVÝCH P ÍPRAVK NEBO ODPADU Z NICH, POKUD JE TO VHODNÉ Likvidujte v souladu s místními p edpisy. 11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI Emil-von-Behring-Strasse 76 D Marburg N MECKO 12. REGISTRA NÍ ÍSLO/ ÍSLA EU/1/07/394/003 EU/1/07/394/006 EU/1/07/394/ ÍSLO ŠARŽE.š.: 22
23 14. KLASIFIKACE PRO VÝDEJ Výdej lé ivého p ípravku vázán na léka ský p edpis. 15. NÁVOD K POUŽITÍ 16. INFORMACE V BRAILLOV PÍSMU Nevyžaduje se - od vodn ní p ijato 23
24 MINIMÁLNÍ ÚDAJE UVÁD NÉ NA MALÉM VNIT NÍM OBALU P edpln ná injek ní st íka ka 1. NÁZEV LÉ IVÉHO P ÍPRAVKU A CESTA /CESTY PODÁNÍ Optaflu (sezóna 2015/2016) i.m. injekce 2. ZP SOB PODÁNÍ 3. POUŽITELNOST EXP 4. ÍSLO ŠARŽE Lot 5. OBSAH UDANÝ JAKO HMOTNOST, OBJEM NEBO PO ET 0,5 ml 6. JINÉ 24
25 B. P ÍBALOVÁ INFORMACE 25
26 P íbalová informace: informace pro uživatele Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) P e t te si pozorn celou p íbalovou informaci d íve, než Vám bude tato vakcína podána, protože obsahuje pro Vás d ležité informace. - Ponechte si p íbalovou informaci pro p ípad, že si ji budete pot ebovat p e íst znovu. - Máte-li jakékoli další otázky, zeptejte se svého léka e, lékárníka nebo zdravotní sestry. - Pokud se u Vás vyskytne kterýkoli z nežádoucích ú ink, sd lte to svému léka i, lékárníkovi nebo zdravotní sest e. Stejn postupujte v p ípad jakýchkoli nežádoucích ú ink, které nejsou uvedeny v této p íbalové informaci. Viz bod 4. Co naleznete v této p íbalové informaci 1. Co je Optaflu a k emu se používá 2. emu musíte v novat pozornost, než dostanete vakcínu Optaflu 3. Jak se Optaflu podává 4. Možné nežádoucí ú inky 5. Jak Optaflu uchovávat 6. Obsah balení a další informace 1. Co je Optaflu a k emu se používá Optaflu je vakcína proti ch ipce. Vzhledem ke zp sobu výroby neobsahuje p ípravek Optaflu ku ecí/vaje né bílkoviny. Po podání vakcíny si imunitní systém (p irozená obranyschopnost organismu) vytvo í vlastní ochranu proti viru ch ipky. Žádná ze složek vakcíny nem že vyvolat ch ipku. Optaflu se používá k prevenci ch ipky u dosp lých, zvlášt u osob se zvýšeným rizikem komplikací p i onemocn ní ch ipkou. Vakcína obsahuje t i kmeny viru ch ipky podle doporu ení Sv tové zdravotnické organizace na sezónu 2015/ emu musíte v novat pozornost, než dostanete vakcínu Optaflu Vakcínu Optaflu nesmíte dostat jestliže jste alergický(á) na vakcínu proti ch ipce nebo na kteroukoli další složku této vakcíny (uvedenou v bod 6), jestliže máte n jakou akutní infekci. Upozorn ní a opat ení P ed aplikací vakcíny Optaflu se pora te se svým léka em, lékárníkem nebo zdravotní sestrou. P ED podáním vakcíny informujte svého léka e, jestliže je Váš imunitní systém oslaben nebo jestliže absolvujete lé bu, která ovliv uje imunitní systém, nap. léky proti rakovin (chemoterapie) i kortikosteroidy (viz bod 2, Další lé ivé p ípravky a vakcína Optaflu ). 26
27 váš léka i zdravotní sestra zajistí léka ský dohled a okamžitou dostupnost vhodné lé by v p ípad vzácné anafylaktické reakce (velmi závažné alergické reakce s p íznaky jako jsou obtíže p i dýchání, závrat, slabý a rychlý tep a kožní vyrážka) po podání vakcíny. K této reakci m že dojít po podání Optaflu stejn jako všech ostatních vakcín podávaných injek n. po každé injekci, nebo dokonce p ed ní, m že dojít k mdlobám. Proto informujte léka e nebo zdravotní sestru, pokud Vás p i p edchozích injekcích postihly mdloby. jestliže trpíte n jakým akutním onemocn ním doprovázeným hore kou. Pokud budete muset v prvních týdnech hned po o kování vakcínou Optaflu podstoupit krevní testy ke zjišt ní p ípadné infekce, m že se stát, že výsledek test nebude správný. ekn te léka i, který bude test požadovat, že jste byl(a) v nedávné dob o kován(a) vakcínou Optaflu. Další lé ivé p ípravky a vakcína Optaflu Informujte svého léka e nebo zdravotní sestru o všech lécích, které užíváte, které jste v nedávné dob užíval(a) nebo které možná budete užívat, a to v etn voln prodejných p ípravk, nebo pokud jste byl(a) v nedávné dob o kován(a) n jakou jinou vakcínou. Jestliže užíváte léky proti rakovin (chemoterapii), kortikosteroidy (nap. kortizon) nebo jiné léky oslabující imunitní systém, m že se stát, že bude imunitní odpov Vašeho organismu oslabená. Vakcína pak m že být mén ú inná. Optaflu lze podávat sou asn s jinými vakcínami. V tom p ípad je t eba podat jednotlivé vakcíny do r zných kon etin. Vezm te v úvahu, že m že dojít k zesílení nežádoucích ú ink vakcín. T hotenství, kojení a plodnost T hotenství Pokud jste t hotná nebo kojíte, domníváte se, že m žete být t hotná, nebo plánujete ot hotn t, pora te se se svým léka em, který rozhodne, zda budete moci vakcínu Optaflu dostat. Omezené údaje o o kování proti ch ipce u t hotných žen nenazna ují, že by s touto vakcínou byly spojeny nep íznivé ú inky pro nenarozený plod. Použití vakcíny m že být zvažováno od druhého trimestru t hotenství. U t hotných žen, u nichž je zvýšené riziko komplikací ch ipky, je podání vakcíny doporu eno bez ohledu na stádium t hotenství. Kojení: P ípravek Optaflu se m že používat b hem kojení. Plodnost: Nejsou k dispozici žádné údaje o fertilit u lidí. Údaje získané u zví at nenazna ují žádné ú inky na fertilitu samic. ízení dopravních prost edk a obsluha stroj Optaflu má mírný vliv na schopnost ídit nebo obsluhovat stroje. P ípravek Optaflu obsahuje chlorid sodný a chlorid draselný Tato vakcína obsahuje mén než 1 mmol (23 mg) sodíku v jedné dávce, tj. v podstat je bez sodíku. Tato vakcína obsahuje mén než 1 mmol (39 mg) draslíku v jedné dávce, tj. v podstat je bez draslíku. 3. Jak se Optaflu podává Optaflu podává Váš léka nebo zdravotní sestra. V žádném p ípad nesmí být vakcína Optaflu podána p ímo do krevní cévy. Dosp lí starší 18 let: 27
28 Jedna dávka 0,5 ml Optaflu je podáván injek n do svalu v horní ásti paže (deltový sval). Použití u d tí a dospívajících: Podávání d tem mladším 18 let se nedoporu uje, protože nejsou dostupné žádné informace. 4. Možné nežádoucí ú inky Podobn jako všechny léky m že mít i Optaflu nežádoucí ú inky, které se ale nemusí vyskytnout u každého. V klinických hodnoceních a b hem postmarketingového sledování byly zaznamenány tyto nežádoucí ú inky: Velmi závažné nežádoucí ú inky Pokud se u vás projeví následující nežádoucí ú inky, informujte ihned léka e i vyhledejte pohotovostní odd lení v nejbližší nemocnici možná budete pot ebovat rychlou léka skou pomoc i hospitalizaci: Není známo (z dostupných údaj nelze ur it) otok, nejvýrazn ji hlavy a krku, v etn obli eje, rt, jazyka, hrdla, nebo jakékoli jiné ásti t la (angioedém) Velmi vzácné (u mén než 1 z uživatel ): potíže p i dýchání, závrat, slabý a rychlý tep a kožní vyrážka, které jsou p íznaky anafylaktické reakce (velmi závažné alergické reakce) Vzácné (u 1 až 10 uživatel z ): znecitliv ní a pocit brn ní bolestivé poruchy nerv, nap. záchvaty prudké bolesti v obli eji, hrdle i uších záchvaty (k e e) (pozorováno pouze u vakcín proti ch ipce p ipravených ve vejci) Rovn ž informujte ihned léka e i vyhledejte pohotovostní odd lení v nejbližší nemocnici, pokud se u vás projeví jakýkoli z následujících nežádoucích ú ink možná budete pot ebovat léka skou pomoc: Velmi vzácné (u mén než 1 z uživatel ): kožní vyrážka, hore ka, bolest kloub i problémy s ledvinami, které jsou p íznaky zán tu krevních cév hore ka, bolest hlavy, zvracení a ospalost vedoucí ke kómatu nebo k záchvat m (k e ím), které jsou p íznaky zán tu mozku a míchy slabost za ínající v dolních kon etinách, která se ší í do paží a je provázena znecitliv ním a pocitem brn ní, které jsou p íznaky zán tu nerv Závažné nežádoucí ú inky Pokud se u vás projeví jakékoli z následujících nežádoucích ú ink, informujte ihned léka e možná budete pot ebovat léka skou pomoc: Není známo (z dostupných údaj nelze ur it) rozsáhlý otok vakcinované kon etiny Velmi vzácné (u mén než 1 z uživatel ): krvácení i podlitiny, které jsou p íznaky nízkého po tu krevních desti ek 28
29 Lehké nežádoucí ú inky Velmi asté (u víc než 1 z 10 uživatel ): p íznaky podobné ch ipce jako jsou bolest hlavy, neklid, únava, bolest sval. bolest v míst injekce, zarudnutí. Tyto reakce jsou obvykle lehké a trvají pouze n kolik dní. Bolest v míst injekce a bolest hlavy jsou ast jší u starších jedinc. asté (u 1 až 10 uživatel ze 100): pocení, bolest kloub, t esavka, zatvrdnutí nebo otok v míst injekce, podlitiny, hore ka, chv ní. gastrointestinální poruchy, jako bolest b icha, pr jem nebo porucha trávicího traktu. Tyto reakce jsou obvykle mírné a trvají pouze n kolik dní. Mén asté (u 1 až 10 uživatel z 1 000): celkové kožní reakce jako jsou sv d ní, pupínky na k ži i nespecifická vyrážka Vzácné (u 1 až 10 uživatel z ): otok a bolest lokálních lymfatických uzlin hore ka vyšší než 39 C Hlášení nežádoucích ú ink Pokud se u Vás vyskytne kterýkoli z nežádoucích ú ink, sd lte to svému léka i, lékárníkovi nebo zdravotní sest e. Stejn postupujte v p ípad jakýchkoli nežádoucích ú ink, které nejsou uvedeny v této p íbalové informaci. Nežádoucí ú inky m žete hlásit také p ímo prost ednictvím národního systému hlášení nežádoucích ú ink uvedeného v Dodatku V. Nahlášením nežádoucích ú ink m žete p isp t k získání více informací o bezpe nosti tohoto p ípravku. 5. Jak Optaflu uchovávat Vakcínu uchovávejte mimo dohled a dosah d tí. Vakcínu nepoužívejte po uplynutí doby použitelnosti uvedené na štítku a krabi ce za ozna ením Použitelné do:. Doba použitelnosti se vztahuje k poslednímu dni uvedeného m síce. Uchovávejte v chladni ce (2 C až 8 C). Chra te p ed mrazem. P edpln né injek ní st íka ky uchovávejte v krabi ce, aby byl p ípravek chrán n p ed sv tlem. Nevyhazujte žádné lé ivé p ípravky do odpadních vod nebo domácího odpadu. Zeptejte se svého lékárníka, jak naložit s p ípravky, které již nepoužíváte. Tato opat ení pomáhají chránit životní prost edí. 6. Obsah balení a další informace Co Optaflu obsahuje Lé ivými látkami jsou inaktivované povrchové antigeny ch ipkového viru (hemaglutinin a neuraminidáza)* následujících kmen : A/California/7/2009 (H1N1)pdm09 - varianta (A/Brisbane/10/2010, divoký typ) A/ Switzerland/ /2013 (H3N2) - varianta (A/South Australia/55/2014, divoký typ) 15 mikrogram HA** 15 mikrogram HA** 29
30 B/ Phuket/3073/2013 varianta (B/Utah/9/2014, divoký typ) 15 mikrogram HA** v dávce 0,5 ml. * pomnožené v Madin-Darbyho psích ledvinových (MDCK, Madin Darby Canine Kidney) bu kách (speciální bun ná kultura ve které se virus ch ipky p stuje) ** hemaglutinin Pomocnými látkami jsou: chlorid sodný, chlorid draselný, hexahydrát chloridu ho e natého, dihydrát hydrogenfosfore nanu sodného, dihydrogenfosfore nan draselný a voda na injekci. Jak Optaflu vypadá a co obsahuje toto balení Optaflu je injek ní suspenze v p edpln né injek ní st íka ce (st íka ka p ipravená k použití). Optaflu je irá až mírn opalescentní suspenze. Jedna injek ní st íka ka obsahuje 0,5 ml injek ní suspenze. Optaflu je k dispozici v baleních obsahujících 1 nebo 10 p edpln ných injek ních st íka ek a ve vícenásobných baleních tvo ených 2 krabi kami, z nichž každá obsahuje 10 p edpln ných injek ních st íka ek. Všechna balení jsou k dispozici s jehlou nebo bez jehly. Držitel rozhodnutí o registraci a výrobce Emil-von-Behring-Strasse 76 D Marburg N mecko Další informace o tomto p ípravku získáte u místního zástupce držitele rozhodnutí o registraci: België/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: Te.: eská republika Novartis s.r.o. Tel: Danmark Tel: Deutschland Hexal AG Tel: Eesti Novartis Poland Sp.z o.o. Tel.: Lietuva Novartis Poland Sp.z o.o. Tel.: Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: Magyarország Novartis Hungária Kft. Tel: Malta Tel: Nederland Tel: Norge Tel:
31 Novartis Vaccines Influenza S.r.l. Tel: España Novartis Farmacéutica, S. A. Tel: France Novartis Pharma SAS Tél: Hrvatska Tel: Ireland Tel: Ísland Tel: Italia Novartis Vaccines Influenza S.r.l. Tel: Novartis Vaccines Influenza S.r.l. Tel: Latvija Novartis Poland Sp.z o.o. Tel.: Österreich Novartis Pharma GmbH Tel: Polska Novartis Poland Sp.z o.o. Tel.: Portugal Novartis Farma - Produtos Farmacêuticos, S.A. Tel: România Tel: Slovenija Novartis s.r.o Tel: Slovenská republika Novartis s.r.o Tel: Suomi/Finland Tel: Sverige Tel: United Kingdom Novartis Vaccines and Diagnostics Limited Tel: Tato p íbalová informace byla naposledy revidována {MM.RRRR} Další zdroje informací Podrobné informace o tomto p ípravku jsou uve ejn ny na webových stránkách Evropské agentury pro lé ivé p ípravky na adrese 31
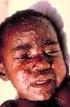
A/California/7/2009 (H1N1)pdm09, použitá varianta A/Brisbane/10/2010, divoký typ
 1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV P ÍPRAVKU Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) (sezóna 2013/2014) 2. KVALITATIVNÍ A KVANTITATIVNÍ
P íbalová informace: informace pro uživatele
 P íbalová informace: informace pro uživatele Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) P e t te si pozorn
P íbalová informace: informace pro uživatele Optaflu injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti ch ipce (inaktivovaný povrchový antigen p ipravený v bun né kultu e) P e t te si pozorn
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) Přečtěte si pozorně
Příbalová informace: informace pro uživatele Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) Přečtěte si pozorně
Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře)
 1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna 2015/2016) 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna 2015/2016) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující adjuvans MF59C.1 (Sezóna 2013/2014)
 sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
sp.zn.sukls133533/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU FLUAD Injekční suspenze v emulzi v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
Souhrn údajů o přípravku
 Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls201931/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) Přečtěte si pozorně
Příbalová informace: informace pro uživatele Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) Přečtěte si pozorně
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU. Léčivý přípravek již není registrován
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna
Souhrn údajů o přípravku
 sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
sp. zn. sukls208148/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Povrchové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Optaflu injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaný povrchový antigen připravený v buněčné kultuře) (sezóna
Souhrn údajů o přípravku
 Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Sp.zn. sukls120620/2013 1. NÁZEV PŘÍPRAVKU Souhrn údajů o přípravku Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna 2013/2014 2. KVALITATIVNÍ A KVANTITATIVNÍ
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) vakcíny
3. LÉKOVÁ FORMA Injekční suspenze vpředplněné injekční stříkačce; bezbarvá průhledná tekutina, v jednodávkových inj. stříkačkách (sklo, typu I).
 Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
Příloha č.2 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Influvac Injekční suspenze (vakcína proti chřipce, povrchový antigen, inaktivovaná) Sezóna
Složení vakcíny odpovídá doporučení SZO (pro severní polokouli) a EU rozhodnutí pro sezónu2007/2008
 Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
Příbalová informace - RP Informace pro použití, čtěte pozorně! Begrivac (vakcína proti chřipce) Injekční suspenze Sezóna 2007/2008 Držitel rozhodnutí o registraci a výrobce Novartis Vaccines and Diagnostics
P íbalová informace: informace pro uživatele
 P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
P íbalová informace: informace pro uživatele Menveo prášek a roztok pro p ípravu injek ního roztoku Konjugovaná vakcína proti meningokokové skupin A, C, W135 a Y P e t te si pozorn tuto p íbalovou informaci
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010
 Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp. zn. sukls123741/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls66943/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele CELVAPAN injekční suspenze Vakcína proti chřipce (H1N1)v (celý virion, namnožená na buňkách Vero, inaktivovaná) Přečtěte si pozorně
B. PŘÍBALOVÁ INFORMACE 1 Příbalová informace: informace pro uživatele CELVAPAN injekční suspenze Vakcína proti chřipce (H1N1)v (celý virion, namnožená na buňkách Vero, inaktivovaná) Přečtěte si pozorně
1. NÁZEV P ÍPRAVKU. IDflu 15 mikrogram /kmen injek ní suspenze Vakcína proti ch ipce (št pený virion, inaktivovaný)
 1. NÁZEV P ÍPRAVKU IDflu 15 mikrogram /kmen injek ní suspenze Vakcína proti ch ipce (št pený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus ch ipky (inaktivovaný, št pený) následujících
1. NÁZEV P ÍPRAVKU IDflu 15 mikrogram /kmen injek ní suspenze Vakcína proti ch ipce (št pený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus ch ipky (inaktivovaný, št pený) následujících
3. LÉKOVÁ FORMA Injekční suspenze v předplněné injekční stříkačce. Vakcína, po jemném protřepání, je lehce bělavá a opalizující tekutina.
 sp. zn. sukls79480/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vaxigrip, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná, štěpený virion). 2. KVALITATIVNÍ A
sp. zn. sukls79480/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vaxigrip, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná, štěpený virion). 2. KVALITATIVNÍ A
Souhrn údajů o přípravku
 sp. zn. sp. sukls348430/2017 Souhrn údajů o přípravku Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
sp. zn. sp. sukls348430/2017 Souhrn údajů o přípravku Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
SOUHRN ÚDAJŮ O PŘÍPRAVKU. A/California/7/2009 (H1N1)pdm09 použitá varianta kmene (NIB-74xp) odvozená
 sp. zn. sukls122237/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls122237/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls154601/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU VAXIGRIP, injekční suspenze v předplněné injekční stříkačce. Vakcína proti chřipce (inaktivovaná,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls73676/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls199540/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluad, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
sp.zn. sukls199540/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fluad, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná, obsahující
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna)
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než necháte Vaše dítě
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE HBVAXPRO 5 mikrogramů, injekční suspenze Vakcína proti hepatitidě typu B (rdna) Přečtěte si pozorně celou příbalovou informaci dříve, než necháte Vaše dítě
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU
 P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
P ÍLOHA I SOUHRN ÚDAJ O P ÍPRAVKU 1 1. NÁZEV P ÍPRAVKU IXIARO, injek ní suspenze Vakcína proti japonské encefalitid (inaktivovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml)
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010
 Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příloha č. 3 ke sdělení sp.zn. sukls75515/2010 1. Název přípravku Begrivac Souhrn údajů o přípravku Sezóna 2008/2009 Injekční suspenze v předplněných injekčních stříkačkách Vakcína proti chřipce (inaktivovaná,
Příbalová informace: informace pro uživatele. Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa)
 Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Infanrix injekční suspenze Vakcína proti difterii (D), tetanu (T), pertusi (acelulární komponenta) (Pa) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. FINEX 5 mg potahované tablety (finasteridum)
 sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls106165/2015 Příbalová informace: informace pro uživatele FINEX 5 mg potahované tablety (finasteridum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
Příbalová informace: Informace pro pacienta. Neoclarityn 5 mg perorální lyofilizát desloratadinum
 Příbalová informace: Informace pro pacienta Neoclarityn 5 mg perorální lyofilizát desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace: Informace pro pacienta Neoclarityn 5 mg perorální lyofilizát desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože obsahuje
Příbalová informace. GlaxoSmithKline Biologicals S.A., Rue de l Institut 89, 1330 Rixensart, Belgie
 Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
Příbalová informace Informace pro použití, čtěte pozorně! INFANRIX Vakcína proti difterii, tetanu a pertusi (acelulární) (injekční suspenze) Výrobce GlaxoSmithKline Biologicals S.A., Rue de l Institut
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Porcilis PCV M Hyo injekční emulze pro prasata 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každá dávka 2 ml obsahuje: Léčivé látky:
Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná), které nejsou uvedeny v
 INFORMACE PRO UŽIVATELE Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) vakcínou. Máte-l, které nejsou uvedeny v V : 1. Co je vakcína Synflorix a k 2. nflorix. 3. Jak se vakcína Synflorix
INFORMACE PRO UŽIVATELE Pneumokoková polysacharidová konjugovaná vakcína (adsorbovaná) vakcínou. Máte-l, které nejsou uvedeny v V : 1. Co je vakcína Synflorix a k 2. nflorix. 3. Jak se vakcína Synflorix
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. FLECTOR EP GEL gel (diclofenacum epolaminum)
 sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
sp. zn. sukls168363/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE FLECTOR EP GEL gel (diclofenacum epolaminum) Přečtěte si pozorně tuto příbalovou informaci dříve, než začnete tento přípravek používat,
Příbalová informace: informace pro uživatele. Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum
 Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
Příbalová informace: informace pro uživatele Zovirax 200 mg Zovirax 400 mg Zovirax 800 mg tablety aciclovirum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
ANALERGIN NEO Potahované tablety 20 x 5 mg
 ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
ANALERGIN NEO Potahované tablety 20 x 5 mg Příbalová informace: informace pro uživatele Analergin Neo 5 mg potahované tablety levocetirizini dihydrochloridum Přečtěte si pozorně celou příbalovou informaci
Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y
 Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
Příbalová informace: informace pro uživatele Menveo prášek a roztok pro injekční roztok Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si pozorně tuto příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aldurazyme, 100 U/ml koncentrát pro přípravu infuzního roztoku Laronidasum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
B. P ÍBALOVÁ INFORMACE
 B. P ÍBALOVÁ INFORMACE 23 P íbalová informace: informace pro uživatele Bexsero injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti meningokok m skupiny B (rdna, komponentní, adsorbovaná) Tento
B. P ÍBALOVÁ INFORMACE 23 P íbalová informace: informace pro uživatele Bexsero injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti meningokok m skupiny B (rdna, komponentní, adsorbovaná) Tento
Podrobný popis výrobku BEGRIVAC 10X0.5ML+JE Injekční suspenze. Čtěte pečlivě příbalovou informaci. Kód výrobku: 20802.
 Podrobný popis výrobku BEGRIVAC 10X0.5ML+JE Injekční suspenze Čtěte pečlivě příbalovou informaci. Kód výrobku: 20802 Kód SUKL: 0032679 Stránka 1 z 6 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.
Podrobný popis výrobku BEGRIVAC 10X0.5ML+JE Injekční suspenze Čtěte pečlivě příbalovou informaci. Kód výrobku: 20802 Kód SUKL: 0032679 Stránka 1 z 6 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
P ÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 P ÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOSTAVAX Prášek pro p ípravu injek ní suspenze s rozpoušt dlem vakcína proti pásovému oparu (herpes zoster) (živá) P e t te si pozorn celou p íbalovou informaci
P ÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ZOSTAVAX Prášek pro p ípravu injek ní suspenze s rozpoušt dlem vakcína proti pásovému oparu (herpes zoster) (živá) P e t te si pozorn celou p íbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Aerius 0,5 mg/ml perorální roztok desloratadinum
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Aerius 0,5 mg/ml perorální roztok desloratadinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat. - Ponechte si příbalovou
Příbalová informace: Informace pro uživatele. Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná)
 Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: Informace pro uživatele Prevenar 13 injekční suspenze Pneumokoková polysacharidová konjugovaná vakcína (13valentní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Očkovací látka proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Očkovací látka proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls57447/207 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
sp. zn. sukls57447/207 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli
Příbalová informace: informace pro uživatele. Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum
 Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příbalová informace: informace pro uživatele Gliolan 30 mg/ml prášek pro perorální roztok Acidi aminolevulinici hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 sp. zn. sukls122237/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) Přečtěte si pozorně
sp. zn. sukls122237/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Fluarix, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná) Přečtěte si pozorně
DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DYSPORT 500 SPEYWOOD JEDNOTEK Botulini toxinum typus A Prášek pro přípravu injekčního roztoku Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci
 Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké zdůvodnění a zdůvodnění změny podmínek rozhodnutí o registraci Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizovaných zpráv o bezpečnosti (PSUR)
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Silgard, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Silgard, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls171917/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
sp. zn. sukls171917/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE
 PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 A. OZNAČENÍ NA OBALU 2 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA INJEKČNÍ LAHVIČKA NA 10 DÁVEK 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU PANDEMIC INFLUENZA VACCINE
PŘÍLOHA III OZNAČENÍ NA OBALU A PŘÍBALOVÁ INFORMACE 1 A. OZNAČENÍ NA OBALU 2 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU KRABIČKA INJEKČNÍ LAHVIČKA NA 10 DÁVEK 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU PANDEMIC INFLUENZA VACCINE
EU/1/97/029/001-002 EU/1/97/029/006-010
 Příbalová informace - Rp. Informace pro použití, čtěte pozorně! J07BC20 TWINRIX PAEDIATRIC injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě
Příbalová informace - Rp. Informace pro použití, čtěte pozorně! J07BC20 TWINRIX PAEDIATRIC injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Procto-Glyvenol 400 mg + 40 mg čípky
 sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
sp.zn. sukls74884/2015 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE Procto-Glyvenol 400 mg + 40 mg čípky (tribenosidum, lidocaini hydrochloridum monohydricum) Přečtěte si pozorně tuto příbalovou informaci
Rotarix perorální suspenze v Živá rotavirová vakcína
 INFORMACE PRO UŽIVATELE Rotarix perorální suspenze v Živá rotavirová vakcína Vaše dí - - Máte- - - Pokud s V : 1. Co je Rotarix a k 2. 3. Jak se Rotarix podává 4. 5 Jak Rotarix uchovávat 6. Další informace
INFORMACE PRO UŽIVATELE Rotarix perorální suspenze v Živá rotavirová vakcína Vaše dí - - Máte- - - Pokud s V : 1. Co je Rotarix a k 2. 3. Jak se Rotarix podává 4. 5 Jak Rotarix uchovávat 6. Další informace
Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná).
 1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Ambirix injekční suspenze Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), (adsorbovaná). 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1 ml) obsahuje:
PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum
 PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum - - - Musíte se poradit s po 2 týdnech. - Bez porady s - V 1. Co je PANTOLOC Control a k 2. 3. Jak se PANTOLOC Control používá 4. Možné nežádoucí
PANTOLOC Control 20 mg enterosolventní tablety Pantoprazolum - - - Musíte se poradit s po 2 týdnech. - Bez porady s - V 1. Co je PANTOLOC Control a k 2. 3. Jak se PANTOLOC Control používá 4. Možné nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vakcína proti chřipce (štěpený virion, inaktivovaná, připravovaná na buněčných kulturách)
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREFLUCEL Injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná, připravovaná na buněčných kulturách 2. KVALITATIVNÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREFLUCEL Injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (štěpený virion, inaktivovaná, připravovaná na buněčných kulturách 2. KVALITATIVNÍ
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014
 sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
sp.zn. sukls50128/2012 a sp.zn. sukls209283/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO PACIENTA Agnucaston potahované tablety Agni casti fructus extractum siccum Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: informace pro uživatele
 sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
sp.zn. sukls120097/2014 Příbalová informace: informace pro uživatele TYPHIM Vi Injekční roztok v předplněné injekční stříkačce Typhoidi capsulae Vi polysaccharidum purificatum (stripe Ty2) - (polysacharidová
Příbalová informace: informace pro pacienta. Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky
 sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
sp.zn. sukls227576/2009 Příbalová informace: informace pro pacienta Neo-angin bez cukru 1,2 mg/0,6 mg/5,72 mg pastilky alcohol dichlorobenzylicus, amylmetacresolum, levomentholum Přečtěte si pozorně tuto
A/Victoria/361/2011 (H3N2)-varianta kmene (NYMC X-223A) odvozená z A/Texas/50/ mikrogramů HA** B/Massachusetts/02/ mikrogramů HA**
 1. NÁZEV PŘÍPRAVKU IDflu 15 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus chřipky (inaktivovaný, štěpený) následujících
1. NÁZEV PŘÍPRAVKU IDflu 15 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus chřipky (inaktivovaný, štěpený) následujících
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU IDflu 9 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus chřipky
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU IDflu 9 mikrogramů/kmen injekční suspenze Vakcína proti chřipce (štěpený virion, inaktivovaný) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Virus chřipky
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010
 Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Příloha č. 3 k rozhodnutí o prodloužení registrace sp.zn. sukls203045/2009 a příloha k sp.zn.: sukls243186/2010 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Rotavirus RIX4414 humanum vivum attenuatum* ne mén než 10 6,0 CCID 50
 1. NÁZEV P ÍPRAVKU Rotarix perorální suspenze v p edpln ném perorálním aplikátoru Živá rotavirová vakcína 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1,5 ml) obsahuje: Rotavirus RIX4414 humanum vivum
1. NÁZEV P ÍPRAVKU Rotarix perorální suspenze v p edpln ném perorálním aplikátoru Živá rotavirová vakcína 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (1,5 ml) obsahuje: Rotavirus RIX4414 humanum vivum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Sp.zn.sukls125875/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Selenase injekční roztok 500 µg, injekční roztok 50 µg/ml 500 mikrogramů selenu v 10 ml injekčního roztoku Léčivá látka: natrii selenis
Příbalová informace: informace pro uživatele. FLUAD 2014/2015, injekční suspenze v předplněné injekční stříkačce
 sp.zn. sukls199540/2014 Příbalová informace: informace pro uživatele FLUAD 2014/2015, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná,
sp.zn. sukls199540/2014 Příbalová informace: informace pro uživatele FLUAD 2014/2015, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce, obsahující povrchový antigen, inaktivovaná,
Vaxigrip bude Vás nebo Vaše dítě chránit proti třem virovým kmenům obsaženým ve vakcíně asi za 2-3 týdny po očkování.
 Sp.zn.sukls71847/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vaxigrip, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaná, štěpený virion) Přečtěte si pozorně celou
Sp.zn.sukls71847/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Vaxigrip, injekční suspenze v předplněné injekční stříkačce Vakcína proti chřipce (inaktivovaná, štěpený virion) Přečtěte si pozorně celou
SOUHRN ÚDAJŮ O PŘÍPRAVKU. 1 dávka - 0,5 ml obsahuje: Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty2)..25 mikrogramů
 sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp. zn. sukls183609/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti břišnímu tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ
sp.zn.sukls73280/2013
 sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
sp.zn.sukls73280/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ONCOZOL 2,5 MG, potahované tablety (letrozolum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat.
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Příloha č. 1 k rozhodnutí o změně registrace sp.zn.: sukls237437/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Cetixin 10 mg, potahované tablety cetirizini dihydrochloridum Přečtěte si pozorně tuto
Bexsero injek ní suspenze v p edpln né injek ní st íka ce Vakcína proti meningokok m skupiny B (rdna, komponentní, adsorbovaná)
 Tento lé ivý p ípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpe nosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podez ení na nežádoucí ú inky. Podrobnosti
Tento lé ivý p ípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpe nosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podez ení na nežádoucí ú inky. Podrobnosti
Příbalová informace: informace pro uživatele
 sp. zn. sukls219224/2017 a k sp. zn. sukls220004/2017 a sp. zn sukls220006/2017 Příbalová informace: informace pro uživatele Fluarix Tetra injekční suspenze v předplněné injekční stříkačce Vakcína proti
sp. zn. sukls219224/2017 a k sp. zn. sukls220004/2017 a sp. zn sukls220006/2017 Příbalová informace: informace pro uživatele Fluarix Tetra injekční suspenze v předplněné injekční stříkačce Vakcína proti
Příbalová informace: informace pro pacienta. Lutinus 100 mg vaginální tablety Progesteronum
 Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Sp.zn.sukls30449/2014 Příbalová informace: informace pro pacienta Lutinus 100 mg vaginální tablety Progesteronum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat,
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Příloha č. 2a) k rozhodnutí o změně registrace sp.zn. sukls112037/2011 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Boostrix inj. stříkačka, injekční suspenze v předplněné injekční stříkačce Adsorbovaná
Tato vakcína může obsahovat stopy neomycinu použitého v průběhu výrobního procesu (viz bod 4.3).
 1. NÁZEV PŘÍPRAVKU Twinrix Paediatric, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ
1. NÁZEV PŘÍPRAVKU Twinrix Paediatric, injekční suspenze v předplněné injekční stříkačce Vakcína proti hepatitidě A (inaktivovaná) a proti hepatitidě B (rdna) (HAB), adsorbovaná. 2. KVALITATIVNÍ A KVANTITATIVNÍ
Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu)
 sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
sp. zn. sukls85525/2014 Nálepka na lahvičku (nahrazuje text příbalové informace a text na vnějším obalu) OZNAČENÍ NA OBALU 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Gaviscon Liquid Peppermint perorální suspenze 2. OBSAH
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.:sukls59594/25009, a příloha k sp.zn.: sukls230271/2012 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
sp.zn.sukls94010/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU LIVOSTIN oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr suspenze obsahuje levocabastinum 0,50 mg jako levocabastini
Příbalová informace: informace pro uživatele. PAMBA tablety (acidum aminomethylbenzoicum)
 sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
sp.zn. sukls63940/2012 Příbalová informace: informace pro uživatele PAMBA tablety (acidum aminomethylbenzoicum) Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek užívat,
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
B. PŘÍBALOVÁ INFORMACE 35 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Menveo prášek a roztok pro přípravu injekčního roztoku Konjugovaná vakcína proti meningokokové skupině A, C, W135 a Y Přečtěte si
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Monkasta 10 mg potahované tablety pro dospělé a dospívající od 15 let věku montelukastum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls42748/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Monkasta 10 mg potahované tablety pro dospělé a dospívající od 15 let věku montelukastum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp. zn. sukls150094/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
sp. zn. sukls150094/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Suspenze pro injekci v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
Příloha č. 1 k rozhodnutí o změně registrace sp. zn. sukls97832/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE INFLUVAC Suspenze pro injekci v předplněné injekční stříkačce Vakcína proti chřipce (povrchový
S O UH R N Ú D AJ Ů O P ŘÍPR AVK U
 sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
sp. zn. sukls223864/2013 S O UH R N Ú D AJ Ů O P ŘÍPR AVK U 1. NÁZEV PŘÍPRAVKU Flavamed 15 mg/5 ml perorální roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml perorálního roztoku obsahuje ambroxoli hydrochloridum
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Gardasil, injekční suspenze Vakcína proti lidskému papilomaviru [typy 6, 11, 16, 18] (rekombinantní, adsorbovaná) Přečtěte si pozorně celou příbalovou informaci
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
Příloha č. 2 k rozhodnutí o prodloužení registrace sp.zn.: sukls20204/2009 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TYPHIM Vi, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína
sp. zn. sukls82959/2013
 sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
sp. zn. sukls82959/2013 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Lamisil Sprej kožní sprej, roztok Terbinafini hydrochloridum Přečtěte si pozorně tuto příbalovou informaci, protože obsahuje pro vás
Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)
![Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná)](/thumbs/33/16328748.jpg) 1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
1. NÁZEV PŘÍPRAVKU Cervarix injekční suspenze Vakcína proti lidskému papilomaviru [typy 16, 18] (rekombinantní, adjuvovaná, adsorbovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5 ml) obsahuje:
B. PŘÍBALOVÁ INFORMACE
 B. PŘÍBALOVÁ INFORMACE 40 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Focetria injekční suspenze Vakcína proti pandemické chřipce (H1N1) (inaktivovaný povrchový antigen, s adjuvans) Přečtěte si pozorně
B. PŘÍBALOVÁ INFORMACE 40 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Focetria injekční suspenze Vakcína proti pandemické chřipce (H1N1) (inaktivovaný povrchový antigen, s adjuvans) Přečtěte si pozorně
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. APO-LETROZOL 2,5 mg Potahované tablety Letrozolum
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls193293/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-LETROZOL 2,5 mg Potahované tablety Letrozolum Přečtěte si pozorně celou příbalovou
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls193293/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE APO-LETROZOL 2,5 mg Potahované tablety Letrozolum Přečtěte si pozorně celou příbalovou
