Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
|
|
|
- Daniel Navrátil
- před 7 lety
- Počet zobrazení:
Transkript
1 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
2 Video o aplikaci injekce do sklivce BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
3 Obsah Obecné informace... 2 Terapeutické indikace... 2 Informace o přípravku... 2 Zvláštní upozornění pro uchovávání... 2 Doporučení pro dávkování... 3 Kontraindikace... 3 Zvláštní upozornění a opatření pro použití... 4 Příprava injekce... 5 Návod k použití/manipulaci: předplněná stříkačka... 5 Návod k použití/manipulaci: lahvička... 6 Postup aplikace injekce... 8 Po injekci... 9 Nežádoucí účinky Předávkování Příslušné lokální bezpečnostní informace BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
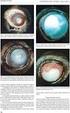
4 Před zahájením léčby přípravkem EYLEA musí být každému pacientovi, kterému je předepsán přípravek EYLEA, poskytnuta informační brožura, včetně zvukového CD a příbalové informace. Za poskytování těchto materiálů pacientovi je zodpovědný lékař. Kromě toho musí být pacientovi anti-vegf léčba detailně vysvětlena. Specificky by měly být vysvětleny jakékoli známky a příznaky závažných nežádoucích účinků a situace, kdy je třeba vyhledat lékařskou pomoc. Obecné informace Terapeutické indikace Přípravek EYLEA je indikován u dospělých k léčbě neovaskulární (vlhké) formy věkem podmíněné makulární degenerace (VPMD) poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) poruchy zraku způsobené diabetickým makulárním edémem (DME) Informace o přípravku EYLEA 40 mg/ml injekční roztok Přípravek EYLEA je určen pouze pro injekci do sklivce. Přípravek EYLEA musí být podáván pouze kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce. Roztok je čirý, bezbarvý až světle žlutý a isoosmotický. Před podáním je třeba roztok vizuálně zkontrolovat, zda nejsou přítomny jakékoli cizorodé částice a/nebo zabarvení, případně změněn fyzikální vzhled. Pozorujete -li takové změny, léčivý přípravek zlikvidujte. Předplněná injekční stříkačka a injekční lahvička jsou pouze na jedno použití. Kvalitativní a kvantitativní složení Jedna předplněná injekční stříkačka obsahuje 90 mikrolitrů, to odpovídá 3,6 mg afliberceptu. To poskytuje využitelné množství pro dodání jedné dávky 50 mikrolitrů obsahujících 2 mg afliberceptu. Předplněná stříkačka obsahuje množství převyšující doporučenou dávku 2 mg. Extrahovatelný objem stříkačky (90 mikrolitrů) není celý určen k použití. Přebytečný objem musí být před aplikací injekce vytlačen. Jedna injekční lahvička obsahuje extrahovatelný objem 100 mikrolitrů, což odpovídá 4 mg afliberceptu. To poskytuje využitelné množství pro dodání jedné dávky 50 mikrolitrů obsahujících 2 mg afliberceptu. Lahvička obsahuje množství převyšující doporučenou dávku 2 mg. Extrahovatelný objem lahvičky (100 mikrolitrů) není celý určen k použití. Přebytečný objem musí být před aplikací injekce vytlačen. Aplikace celého objemu injekce může mít za následek předávkování. Pro vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak, aby byla cylindrická báze kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (odpovídající 50 mikrolitrům, tzn. 2 mg afliberceptu). Zvláštní upozornění pro uchovávání Uchovávejte v chladničce (2 C 8 C). Chraňte před mrazem. Uchovávejte předplněnou injekční stříkačku v blistru a krabičce, aby byl přípravek chráněn před světlem. 2 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
5 Uchovávejte lahvičku v krabičce, aby byl přípravek chráněn před světlem. Před použitím mohou být neotevřená lahvička nebo blistr přípravku EYLEA uchovávány při pokojové teplotě (do 25 C) po dobu až 24 hodin. Neotvírejte sterilní blistr s předplněnou stříkačkou mimo sterilní místnost. Po otevření blistru nebo lahvičky pokračujte při aseptických podmínkách. Doporučení pro dávkování Doporučená dávka přípravku EYLEA je 2 mg afliberceptu, což odpovídá 50 mikrolitrům. Vezměte prosím na vědomí, že doporučené dávkování je jiné pro VPMD, CRVO a DME a je popsáno níže: VPMD Na začátku léčby přípravkem EYLEA se podává jedna injekce měsíčně ve třech po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Není žádný požadavek na kontroly mezi injekcemi. Po prvních 12 měsících léčby přípravkem EYLEA může být na základě výsledků vyšetření zraku a anatomických poměrů léčebný interval prodloužen. V tomto případě by měl ošetřující lékař určit plán kontrol, kontroly můžou být plánovány častěji v porovnání s plánem podání injekcí. Makulární edém v důsledku CRVO Po první injekci je léčba aplikována jednou měsíčně. Interval mezi dvěma dávkami nemá být kratší než jeden měsíc. Jestliže po prvních třech injekcích nedojde ke zlepšení výsledků vyšetření zraku a anatomických poměrů, další léčba se nedoporučuje. Léčba jednou měsíčně pokračuje, dokud nedojde ke stabilizaci výsledků vyšetření zraku a anatomických poměrů na základě tří měsíčních vyhodnocení. Poté má být zvážena potřeba další léčby. Pokud je to nutné, léčba může pokračovat s postupně narůstajícími léčebnými intervaly, aby byly udrženy stabilní výsledky vyšetření zraku a anatomických poměrů. Jestliže byla léčba přerušena, výsledky vyšetření zraku a anatomických poměrů mají být sledovány a v případě jejich zhoršení by měla být léčba znovu zahájena. Obvykle má být při aplikaci injekce provedena kontrola. Během prodlouženého léčebného intervalu až do ukončení léčby má ošetřující lékař stanovit plán kontrol na základě individuální odpovědi pacienta. Kontroly mohou být plánovány častěji v porovnání s plánem podávání injekcí. Diabetický makulární edém Na začátku léčby přípravkem EYLEA se podává jedna injekce měsíčně v pěti po sobě jdoucích dávkách, následně se podává jedna injekce každé dva měsíce. Není žádný požadavek na kontroly mezi injekcemi. Po prvních 12 měsících léčby přípravkem EYLEA může být na základě výsledků vyšetření zraku a anatomických poměrů léčebný interval prodloužen. Plán kontrol by měl určit ošetřující lékař. Pokud výsledky vyšetření zraku a anatomických poměrů naznačují, že pacient nemá z pokračující léčby přínos, léčba přípravkem EYLEA by měla být ukončena. Kontraindikace Hypersenzitivita na aflibercept nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1 v Souhrnu údajů o přípravku. Aktivní oční nebo periokulární infekce nebo podezření na ni. Aktivní závažný intraokulární zánět. 3 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
6 Zvláštní upozornění a opatření pro použití Další Jako u jiných typů intravitreální anti -VEGF léčby u VPMD, CRVO a DME platí také následující: Endoftalmitida Injekce do sklivce, včetně injekcí afliberceptu, byly spojeny s endoftalmitidou. Při aplikaci přípravku EYLEA musí být vždy používány vhodné aseptické techniky aplikace injekce. Pacienti musí být informováni, aby ihned hlásili všechny příznaky, které mohou svědčit pro endoftalmitidu a tyto příznaky by měly být léčeny na základě klinické praxe. Poučte, prosím, pacienta, aby si aplikoval širokospektré antibiotické oční kapky několik dní před a několik dní po aplikaci. Zvýšení nitroočního tlaku Během 60 minut po aplikaci injekce do sklivce, včetně aplikace přípravku EYLEA, bylo pozorováno zvýšení nitroočního tlaku. Zvláštní opatření je nutné u pacientů s nedostatečně kontrolovaným glaukomem (neaplikujte injekci přípravku EYLEA, pokud je nitrooční tlak 30 mmhg). Ve všech případech musí být sledovány a na základě klinické praxe léčeny jak nitrooční tlak, tak perfuze papily optického nervu. Imunogenita Vzhledem k tomu, že se jedná o terapeutický protein, existuje při použití přípravku EYLEA riziko imunogenity. Pacienti musí být instruováni, aby hlásili jakékoli známky intraokulárního zánětu např. bolest, fotofobii nebo zarudnutí, které by mohly souviset s hypersenzitivitou. Systémové účinky Po injekčním intravitreálním podání inhibitorů VEGF byly zaznamenány systémové nežádoucí účinky, zahrnující krvácení mimo oko a arteriální tromboembolické příhody, a je zde teoretické riziko, že mohly souviset s inhibicí VEGF. 4 Bezpečnost a účinnost léčby přípravkem EYLEA podávaným do obou očí současně nebyla systematicky studována. Rizikové faktory spojené s vývojem trhliny pigmentového epitelu sítnice po podání anti - -VEGF léčby zahrnují rozsáhlé a/nebo značné odchlípení pigmentového epitelu sítnice. U pacientů s těmito rizikovými faktory pro vznik trhlin pigmentového epitelu sítnice je třeba dbát opatrnosti při zahájení léčby přípravkem EYLEA. Léčba by měla být vysazena u pacientů s rhegmatogenním odchlípením sítnice nebo u makulárních otvorů stupně 3 nebo 4. Při výskytu retinální trhliny je třeba dávku vynechat a léčba by neměla být obnovena, dokud se trhlina adekvátně nezhojí. V následujících případech se musí dávka vynechat a v plánované léčbě se nesmí pokračovat: při poklesu nejlépe korigované ostrosti zraku (Best Corrected Visual Acuity, BCVA) o 30 písmen oproti předchozímu stanovení ostrosti zraku, při výskytu subretinálního krvácení, zahrnujícího střed fovey nebo když je velikost hemoragie 50 % celkové plochy léze. Dávka nemá být podávána během 28 dní před plánovaným očním chirurgickým zákrokem a 28 dní po provedeném očním chirurgickém zákroku. Přípravek EYLEA nemá být používán během těhotenství, pokud možný přínos nepřeváží možné riziko pro plod. Ženy ve fertilním věku musí během léčby a minimálně 3 měsíce po poslední injekci afliberceptu do sklivce používat účinnou antikoncepci. K dispozici jsou omezené zkušenosti s léčbou pacientů s ischemickou chronickou CRVO. U pacientů s klinickými příznaky ireverzibilní ztráty zraku v důsledku ischemie se léčba nedoporučuje. BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:06
7 Návod na použití / manipulaci Příprava injekce Injekce do sklivce musí být prováděny podle lékařských standardů a příslušných zásad a podávány kvalifikovaným lékařem, který má zkušenosti s aplikací injekcí do sklivce. Obecně musí být zajištěny odpovídající anestézie a asepse, zahrnující lokální širokospektrý mikrobicidní prostředek (např. jodovaný povidon aplikovaný na kůži kolem oka, oční víčko a povrch oka). Doporučuje se chirurgická dezinfekce rukou, sterilní rukavice, sterilní rouška a sterilizované spekulum (nebo ekvivalentní náhrada). Pro injekci do sklivce by měla být použita injekční jehla 30 Gauge ½ palce. Předplněná stříkačka: 1. Až budete připraveni aplikovat přípravek EYLEA, otevřete krabičku a vyjměte sterilní blistr. Opatrně otevřete blistr při zajištění sterility jeho obsahu. Nechte stříkačku ve sterilním zásobníku, dokud nejste připraveni k sestavení. 2. Pomocí aseptické techniky vyjměte stříkačku ze sterilního blistru. 3. Sejměte víčko stříkačky tak, že jednou rukou držte stříkačku a druhou ruku použijte pro uchopení víčka stříkačky pomocí palce a ukazováku. Pamatujte si, prosím: Ulomte (neotáčejte nebo nevykrucujte) víčko stříkačky. 4. Nezatahujte zpět píst, abyste neohrozili sterilitu přípravku. 5. Pomocí aseptické techniky pevně nasaďte otočením injekční jehlu na Luer -lock hrot stříkačky. 6. Sejměte plastové víčko jehly. 7. Držte stříkačku s jehlou směřující nahoru a zkontrolujte, zda v ní nejsou bubliny. Pokud jsou bubliny přítomny, jemně poklepejte na stříkačku prstem, dokud se bubliny nedostanou nahoru. 5 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:07
8 ml 8. Pro odstranění všech bublin a vytlačení přebytečného léčivého přípravku pomalu stlačte píst tak, aby byla cylindrická báze kupolovité zátky zarovnána s černou dávkovací čárkou na stříkačce (ekvivalent 50 mikrolitrů). Před aplikací injekce přípravku EYLEA je třeba vytlačit přebytečný objem, aby se předešlo předávkování. Vzduchová bublina Roztok Kupolovitý plunžrový píst Roztok po odstranění vzduchových bublin a přebytečného léku Okraj kupolovitého plunžrového pístu Dávkovací čárka 9. Předplněná stříkačka je pouze na jedno použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. Lahvička 1. Sejměte plastové víčko a dezinfikujte vnější část pryžové zátky lahvičky. 2. Nasaďte 18 G jehlu s filtrem o velikosti 5 mikronů dodávanou v balení na sterilní Luer -lock 1 ml stříkačky ml 3. Zasuňte jehlu s filtrem do středu zátky lahvičky, aby byla jehla zasunuta do lahvičky celá a hrotem se dotýkala dna nebo okraje dna lahvičky. 4. Pomocí aseptické techniky natáhněte celý obsah lahvičky s přípravkem EYLEA do stříkačky a držte přitom lahvičku ve svislé poloze mírně nakloněnou pro usnadnění úplného nasátí. Abyste zabránili natáhnutí vzduchu, zajistěte, aby byl zkosený hrot jehly s filtrem ponořen v tekutině. Během plnění stříkačky udržujte lahvičku nakloněnou tak, aby byl skosený hrot jehly ponořený v tekutině. 6 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:09
9 . 5. Ujistěte se, že plunžrový píst je při vyprazdňování lahvičky vytažen dostatečně daleko tak, aby jehla s filtrem byla úplně vyprázdněna. 6. Sejměte jehlu s filtrem a správně ji zlikvidujte. Pozn.: Jehla s filtrem není určena pro aplikaci do sklivce. 7. Při dodržení aseptické techniky pevně otáčením nasaďte 30G ½ palcovou injekční jehlu na špičku Luer -lock stříkačky. 8. Jakmile jste připraveni aplikovat přípravek EYLEA, sejměte plastový kryt jehly ml Držte stříkačku s jehlou směřující nahoru, zkontrolujte, zda nejsou ve stříkačce bubliny. Pokud jsouí bubliny přítomny, jemně na stříkačku poklepejte prstem, dokud se bubliny nedostanou nahoru ml 10. Odstraňte všechny bubliny a vytlačte přebytečný léčivý přípravek pomalým stlačením plunžrového pístu tak, že hrot plunžrového pístu bude zarovnán s čárkou, která označuje 0,05 ml na stříkačce. Před aplikací injekce přípravku EYLEA je třeba vytlačit přebytečný objem, aby se předešlo předávkování. Dávkovací čárka Roztok po vytlačení vzduchových bublin a přebytečného léku Plochý okraj plunžrového pístu 11. Lahvička je určena pouze na jedno použití. Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními požadavky. 7 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:12
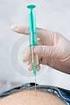
10 Postup aplikace injekce Při lokálním použití antibiotik se řiďte klinickými doporučenými postupy. 1. Aplikujte lokální anestézii. 2. Nakapejte dezinfekční prostředek (například 5% roztok jodovaného povidonu nebo ekvivalentní náhradu) na oční víčka, okraje očních víček a do spojivkového vaku. 3. Dezinfekční prostředek (například 10% roztok jodovaného povidonu nebo ekvivalentní náhrada) může být také aplikován na kůži kolem oka, oční víčka a oční řasy. Vyhněte se nadměrnému tlaku na oční žlázy. 3,5 4,0 mm 4. Překryjte sterilní rouškou a vložte sterilní spekulum. 5. Informujte pacienta, aby se díval směrem od místa aplikace injekce. Zajistěte správné postavení oka. V oblasti 3,5 4,0 mm posteriorně od limbu označte místo aplikace injekce. 6. Zaveďte injekční jehlu do prostoru sklivce, vyhněte se horizontálnímu meridiánu a zaměřte ji do centra oční koule. Pak se pomalu aplikuje objem injekce 0,05 ml; následující injekce je nutné aplikovat v jiném místě skléry. 8 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
11 Další informace o postupu aplikace injekce do sklivce naleznete: Evolving guidelines for intravitreous injections. Aiello LP, Brucker AJ, Chang S, et al. Retina. 2004;24:3-19 Guidelines for Intravitreal Injections Procedure The Royal College of Ophthalmologists. K dispozici na: asp?section=451&search=. Accessed October 23, Age -Related Macular Degeneration: Guidelines for Management, September Available at: asp?section=451. Accessed October 23, 2013 Guidelines for intravitreal injections. Korobelnik JF, Weber M, Cohen SY et al. J Fr Ophtalmol. 2009;32(4): Video k postupu aplikace injekce do sklivce Po injekci Ihned po aplikaci injekce zkontrolujte zrak (pomocí pohybu ruky nebo počítání prstů). Ihned po podání do sklivce musí být pacienti sledováni s ohledem na zvýšení nitroočního tlaku. Vhodné monitorování může zahrnovat kontrolu prokrvení papily optického nervu nebo tonometrii. Je -li to nutné, mělo by být k dispozici sterilní vybavení pro paracentézu. Po aplikaci do sklivce musí být pacienti informováni, aby ihned hlásili všechny příznaky, které mohou svědčit pro endoftalmitidu (např. bolest oka, zarudnutí oka, fotofobie, rozmazané vidění). Aplikace antibiotických očních kapek se má řídit postupy oftalmologických společností. Zvažte aplikaci širokospektrých antibiotických kapek několik dní před a několik dní po podání injekce do sklivce. 9 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
12 Nežádoucí účinky Rozmazané vidění Bolest oka Abnormální pocit v oku Pocit cizího tělesa v oku Zvýšená tvorba slz Překrvení spojivky nebo oka Krvácení do spojivek v místě aplikace injekce U pacientů může dojít k zarudnutí oka v důsledku krvácení z malých krevních cév ve vnějších vrstvách oka. Bolest nebo podráždění v místě aplikace injekce Keratitis punctata Abraze nebo eroze či defekt epitelu rohovky Pacienti mohou zaznamenat bolest, zarudnutí, zvýšenou tvorbu slz, fotofobii a změny zraku. Podráždění nebo otok očního víčka Korneální edém Pacienti mohou vnímat náhlé záblesky světla, fotofobii a změny zraku. Přechodné zvýšení nitroočního tlaku Pacienti mohou mít náhlé záblesky světla, zarudnutí oka, nevolnost a zvracení a změny zraku. Zarudnutí přední komory Hypopyon Iritida nebo iridocyklitida či vitritida nebo uveitida U pacientů se může vyskytnout bolest oka, fotofobie, zarudnutí oka nebo změny zraku. Endoftalmitida U pacientů se mohou objevit bolest oka nebo zvýšené nepohodlí, zhoršení zarudnutí oka, fotofobie nebo citlivost na světlo, otok a změny zraku, jako je náhlé zhoršení zraku nebo rozmazané vidění. Hypersenzitivita U pacientů se může objevit bolest, fotofobie nebo zarudnutí oka. Katarakta (traumatická, nukleární, subkapsulární, kortikální) nebo zakalení čočky Pacienti mohou vnímat méně jasné linie a tvary, stíny a barvy, dále se u nich mohou vyskytnout změny zraku. Sklivcové vločky nebo krvácení Odloučení sklivce Pacienti mohou pozorovat záblesky světla a výskyt sklivcových vloček nebo zvýšení počtu sklivcových vloček. Trhlina v sítnici Degenerace sítnice Odchlípení sítnice U pacientů může dojít k náhlým zábleskům světla a výskytu nebo zvýšení počtu sklivcových vloček, zastření části zorného pole a ke změnám zraku. Trhlina nebo odchlípení pigmentového epitelu sítnice V rámci studií fáze III s vlhkou formou VPMD byla pozorována zvýšená incidence konjunktiválního krvácení u pacientů, kteří dostávali antitrombotika. Tato zvýšená incidence byla srovnatelná mezi pacienty, kteří dostávali ranibizumab či přípravek EYLEA. Arteriální tromboembolické příhody jsou nežádoucí účinky potenciálně související se systémovou inhibicí VEGF. Po intravitreálním použití inhibitorů VEGF existuje teoretické riziko arteriální tromboembolické příhody. Informujte, prosím, pacienta o příznacích arteriálních tromboembolických příhod: bolest na hrudníku, dušnost, pocení, nevolnost, bolest hlavy, zvracení, slabost nebo ochabnutí svalů (obzvláště na jedné straně), setřelá řeč nebo poruchy vidění. Jako u všech terapeutických proteinů existuje u přípravku EYLEA riziko imunogenity. 10 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
13 Zajistěte, aby Váš pacient mohl vždy při výskytu jakékoli nežádoucího účinku, který by ho znepokojil, ihned navštívit oftalmologa. Správná léčba všech nežádoucích účinků, včetně těch, které jsou spojené s postupem aplikace injekce do sklivce, by měla být prováděna podle klinické praxe a/nebo doporučených postupů. Předávkování V klinických studiích byly použity dávky až 4 mg v měsíčních intervalech a objevily se izolované případy předávkování při dávce 8 mg. Předávkování při větším objemu injekce může vést ke zvýšení nitroočního tlaku. Proto by v případě předávkování měl být monitorován nitrooční tlak a je -li to podle ošetřujícího lékaře nezbytné, měla by být zahájena odpovídající léčba. Příslušné lokální bezpečnostní informace Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Hlášení podezření na nežádoucí účinky Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na adresu: Státní ústav pro kontrolu léčiv Šrobárova 48, Praha 10 Webové stránky: Při hlášení je třeba uvést i přesný obchodní název a číslo šarže léčivého přípravku. Nežádoucí účinky mohou být hlášeny také na: Tel : Fax : pharmacovigilance.czech@bayer.com BAYER, s. r. o. Siemensova 2717/4, Praha 5 Česká republika 11 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
14 Poznámky 12 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
15 BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
16 BAYER s. r. o., Siemensova 2717/ Praha 5 L.CZ.SM BAYER-EYLEA_PrecriberBooklet_A4_CZ2015_04.indd :13:16
INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE
 Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
Injekce do sklivce Doporučení pro léčbu přípravkem INFORMACE PRO PŘEDEPISUJÍCÍHO LÉKAŘE Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v
Informace pro předepisujícího lékaře
 Injekce do sklivce Doporučení pro léčbu přípravkem (aflibercept solution for injection) Informace pro předepisujícího lékaře Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v Souhrnu údajů
Injekce do sklivce Doporučení pro léčbu přípravkem (aflibercept solution for injection) Informace pro předepisujícího lékaře Další informace a podrobnosti o přípravku EYLEA jsou uvedeny v Souhrnu údajů
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce. Informace pro předepisujícího lékaře
 EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
EDUKAČNÍ MATERIÁLY Doporučení pro léčbu přípravkem EYLEA (afliberceptum) Injekce do sklivce Informace pro předepisujícího lékaře Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání
VÁŠ PRŮVODCE PRO PŘÍPRAVEK. (aflibercept solution for injection)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
VÁŠ PRŮVODCE PRO PŘÍPRAVEK Před zahájením léčby přípravkem EYLEA si, prosím, pečlivě přečtěte celý tento informační materiál, včetně přiložené příbalové informace pro pacienta a poslechněte si zvukové
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 mililitr injekčního roztoku obsahuje 40
VÁŠ PRŮVODCE PRO PŘÍPRAVEK
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA se používá k léčbě poruchy zraku způsobené makulárním edémem v důsledku okluze centrální retinální žíly (CRVO) Tento léčivý přípravek podléhá dalšímu sledování. Další informace
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA. EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME)
 VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME) Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku
VÁŠ PRŮVODCE PRO PŘÍPRAVEK EYLEA EYLEA se používá k léčbě poruchy zraku způsobené diabetickým makulárním edémem (DME) Tento léčivý přípravek podléhá dalšímu sledování. Další informace a podrobnosti o přípravku
Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře
 Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře Tento návod obsahuje informace o doporučované injekční technice a významných rizicích spojených s aplikací
Edukační materiály OZURDEX 700 mikrogramů intravitreální implantát v aplikátoru. Návod pro lékaře Tento návod obsahuje informace o doporučované injekční technice a významných rizicích spojených s aplikací
Příbalová informace: informace pro uživatele
 Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Příbalová informace: informace pro uživatele Eylea 40 mg/ml injekční roztok v injekční lahvičce Afliberceptum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti.
Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis
 EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
EDUKAČNÍ MATERIÁLY Lucentis (ranibizumab) Leták pro lékaře Rizika spojená s aplikací intravitreálních injekcí Stručný průvodce bezpečnostním profilem přípravku Lucentis Jakékoli podezření na závažný nebo
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
Příbalová informace: informace pro pacienta. Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum
 Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
Příbalová informace: informace pro pacienta Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce Afliberceptum Přečtěte si pozorně celou příbalovou informaci dříve, než Vám bude tento přípravek
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Eylea 40 mg/ml injekční roztok v předplněné injekční stříkačce 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden mililitr injekčního roztoku obsahuje afliberceptum*
Návod k použití EDUKAČNÍ MATERIÁLY. mecasermin. Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex
 EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
EDUKAČNÍ MATERIÁLY mecasermin Návod k použití Tento leták je rychlým návodem k přípravě a podání injekce přípravku Increlex Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových
Nebido EDUKAČNÍ MATERIÁL. Jak úspěšně aplikovat přípravek. (testosterone undecanoate)
 EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
EDUKAČNÍ MATERIÁL Jak úspěšně aplikovat přípravek Nebido (testosterone undecanoate) Tento edukační materiál Vám poskytne informace o některých aspektech aplikace přípravku Nebido za účelem rozšíření Vašich
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
Váš průvodce léčbou vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu vlhké
Souhrn údajů o přípravku. Typhoidi capsulae Vi polysaccharidum purificatum (stirpe Ty 2)
 sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp. zn. sukls133524/2015 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix, injekční roztok v předplněné injekční stříkačce Polysacharidová vakcína proti tyfu 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn. sukls294169/2016
 sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
sp.zn. sukls294169/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Arufil 20 mg/ml oční kapky, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Jeden ml roztoku obsahuje povidonum K30 20 mg (= 24 kapek).
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis
 Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Tato brožura Vám pomůže lépe pochopit léčbu vlhké (neovaskulární) formy věkem podmíněné makulární degenerace (AMD) přípravkem Lucentis Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
Váš průvodce léčbou poškození zraku v důsledku diabetického makulárního edému (DME) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Voda na injekci Viaflo 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Každé balení obsahuje 100% w/v aqua pro iniectione. 3. LÉKOVÁ FORMA Rozpouštědlo pro parenterální
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
For Internal Use Only
 Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
Souhrnná informace o přípravku NovoSeven stabilního při pokojové teplotě a návod na připravení roztoku Předmět: Poskytuje souhrnné informace, ke kterým došlo u přípravku NovoSeven stabilního
ZNALOST POTENCIÁLNÍCH RIZIK JE PRVNÍM KROKEM K JEJICH PREVENCI OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU
 OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU Tato prezentace přináší přehled: Metod doporučených pro aplikaci IVT injekce založených na zrevidované dohodě odborníků Protokol injekce
OPATŘENÍ SNIŽUJÍCÍ RIZIKO IVT INJEKCE VYVINUTÉ PRO VAŠI PODPORU Tato prezentace přináší přehled: Metod doporučených pro aplikaci IVT injekce založených na zrevidované dohodě odborníků Protokol injekce
ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum)
 sp. zn. sukls55121/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum) Přečtěte si pozorně celou příbalovou informaci
sp. zn. sukls55121/2015 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE ILUVIEN 190 mikrogramů intravitreální implantát v aplikátoru (fluocinoloni acetonidum) Přečtěte si pozorně celou příbalovou informaci
BIOVISC ORTHO M. Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci.
 Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Česky BIOVISC ORTHO M Sterilní viskoelastický roztok kyseliny hyaluronové k intraartikulární injekci. NÁVOD K POUŽITÍ SLOŽENÍ Jeden ml obsahuje: Kyselina hyaluronová Mannitol 20 mg 5 mg Fosfátem pufrovaný
Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.: sukls19325/2006 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU TYPHERIX 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
sp.zn. sukls221052/2013 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1 g očních kapek Pomocná
Používání Apidry v 10 ml injekčních lahvičkách
 NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
NÁVOD, JAK POUŽÍVAT INJEKČNÍ LAHVIČKY APIDRA 10 ml Apidra 100 jednotek/ml injekční roztok v lahvičce je čirý, bezbarvý vodný roztok, bez jakýchkoli viditelných částic. Každá injekční lahvička obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příloha č.3 ke sdělení sp.zn.sukls44100/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Fucithalmic oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Acidum fusidicum hemihydricum 10 mg v 1
Příprava a podání injekce
 Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Doporučené dávkování je uvedeno na stranách 2 a 10 Příprava a podání injekce ILARIS 150 mg, prášek pro injekční roztok Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní
Dospělí: Jeden čípek ráno, večer a po každém vyprázdnění střev. Zavést do rekta zaobleným koncem.
 sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
sp.zn. sukls186765/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU PREPARATION H čípky 23 mg / 69 mg 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivé látky: Faecis extractum fluidum 1,00 % hmot., t.j. 23
SOUHRN ÚDAJŮ O PŘÍPRAVKU. PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová
 sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
sp.zn.sukls44523/2015 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU PNEUMO 23, injekční roztok v předplněné injekční stříkačce Vakcína proti pneumokokům polysacharidová 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum
 Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Příloha č.2 k rozhodnutí o prodloužení registrace sp.zn.sukls83901/2008 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE L- Carnitin,,Fresenius 1 g injekční roztok levocarnitinum Přečtěte si pozorně celou
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab)
 Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Váš průvodce léčbou poškození zraku způsobeného makulárním edémem v důsledku okluze retinální žíly (RVO) přípravkem Lucentis (ranibizumab) Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit
Příbalová informace: informace pro uživatele
 sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
sp.zn. sukls136451/2013 a sp.zn. sukls36933/2014 Příbalová informace: informace pro uživatele Aprokam50 mg prášek pro injekční roztok cefuroximum Přečtěte si pozorně celou příbalovou informaci dříve, než
*Ranibizumab je fragment humanizované monoklonální protilátky produkovaný buňkami Escherichia coli rekombinantní DNA technologií.
 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum*. Jedna injekční lahvička obsahuje 2,3 mg ranibizumabum v 0,23 ml roztoku.
Propofol MCT Fresenius 10 mg/ml: Jeden ml obsahuje propofolum 10 mg. Propofol MCT Fresenius 20 mg/ml: Jeden ml obsahuje propofolum 20 mg.
 ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU 1x 50 ml předplněná injekční stříkačka 1. NÁZEV LÉČIVÉHO PŘÍPRAVKU Propofol MCT Fresenius 10 mg/ml injekční/infuzní emulze v předplněné injekční stříkačce Propofol MCT Fresenius
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls10153/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou
Příloha č. 2 k rozhodnutí o změně registrace sp.zn. sukls10153/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou
Edukační materiály. KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře
 Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Edukační materiály KADCYLA (trastuzumab emtansin): Edukační materiál pro lékaře Informace pro lékaře EU Listopad 2013 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací
Příloha III. Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace
 Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příloha III Úpravy příslušných částí Souhrnu údajů o přípravku a Příbalové informace Poznámka: Tento Souhrn údajů o přípravku, Označení na obalu a Příbalová informace jsou výsledkem posuzovacího řízení.
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA)
 Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
Příprava a podání injekce Návod pro pacienty a lékaře pro přípravu a podání ILARIS pro léčbu systémové juvenilní idiopatické artritidy (SJIA) ILARIS 150 mg, prášek pro injekční roztok Doporučené dávkování
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok
 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok Kalii iodidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat tento přípravek
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE JODID DRASELNÝ 2% UNIMED PHARMA oční kapky, roztok Kalii iodidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete používat tento přípravek
s energií 172 kev (91 %) a 246 kev (94 %). Vnitřní konverzí vzniká záření rentgenové s energií 23 kev a 26 kev.
 sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
sp.zn. sukls101319/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Indium (In111) Chloride 370 MBq/ml, radionuklidový prekurzor, roztok 2. KVALITATIVNÍ I KVANTITATIVNÍ SLOŽENÍ Obsah lahvičky k datu a
RÁDCE PACIENTA. Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu
 RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
RÁDCE PACIENTA Pro aplikaci přípravku Metoject 50 mg/ml injekční roztok, předplněné injekční stříkačky s obsahem metotrexátu RYCHLÝ PŘEHLED Tento materiál je určen výhradně pacientům užívajícím přípravek
Příbalová informace: informace pro uživatele
 Sp. zn. sukls113502/2018 a k sp. zn. sukls111628/2018, sukls111940/2018 Příbalová informace: informace pro uživatele Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injekční roztok tropicamidum / phenylephrini
Sp. zn. sukls113502/2018 a k sp. zn. sukls111628/2018, sukls111940/2018 Příbalová informace: informace pro uživatele Mydrane 0,2 mg/ml + 3,1 mg/ml + 10 mg/ml injekční roztok tropicamidum / phenylephrini
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
CNV. Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab)
 CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
CNV Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura Vám pomůže lépe pochopit léčbu poškození
JETREA 0,375 mg/0,3 ml injekční roztok Ocriplasminum
 Příbalová informace: Informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Příbalová informace: Informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Eylea. afliberceptum. Co je Eylea? K čemu se přípravek Eylea používá? Souhrn zprávy EPAR určený pro veřejnost
 EMA/677928/2015 EMEA/H/C/002392 Souhrn zprávy EPAR určený pro veřejnost afliberceptum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European public assessment report, EPAR) pro přípravek.
EMA/677928/2015 EMEA/H/C/002392 Souhrn zprávy EPAR určený pro veřejnost afliberceptum Tento dokument je souhrnem Evropské veřejné zprávy o hodnocení (European public assessment report, EPAR) pro přípravek.
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls186703/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vasopos N oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tetryzolini hydrochloridum 0,5 mg v 1 ml (cca 30 kapek) Úplný seznam
sp.zn.sukls186703/2016 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Vasopos N oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Tetryzolini hydrochloridum 0,5 mg v 1 ml (cca 30 kapek) Úplný seznam
KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin. Informace pro lékaře EU
 EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
EDUKAČNÍ MATERIÁLY KADCYLA (Trastuzumab emtansin): Edukační materiál pro lékaře o riziku záměny mezi přípravky Kadcyla a Herceptin Listopad 2016 Informace pro lékaře EU Tento léčivý přípravek podléhá dalšímu
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011. Souhrn údajů o přípravku
 Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
Příloha č. 2 k rozhodnutí o změně registrace sp.zn.sukls124916/2011 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU Typherix 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka vakcíny (0,5 ml) obsahuje 25
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Canigen Puppy 2b 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Složení v dávce 1 ml Léčivá látka: Parvovirus enteritidis canis attenuatum
Příbalová informace: Informace pro uživatele. NovoThirteen IU prášek a rozpouštědlo pro injekční roztok
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek a rozpouštědlo pro injekční roztok catridecacogum (rekombinantní koagulační faktor XIII) Přečtěte si pozorně celou příbalovou informaci
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
sp.zn.sukls29736/2015 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU TEARS NATURALE II oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje dextranum 70 1,0 mg a hypromelosum 3,0
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU. APIGUARD gel (25% Thymolum) pro podání ve včelím úlu
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU APIGUARD gel (25% Thymolum) pro podání ve včelím úlu Vyhrazený veterinární léčivý přípravek 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Thymolum
sp.zn.: sukls165485/2011
 sp.zn.: sukls165485/2011 Příbalová informace: informace pro uživatele SPERSALLERG antazolini hydrochloridum, tetryzolini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
sp.zn.: sukls165485/2011 Příbalová informace: informace pro uživatele SPERSALLERG antazolini hydrochloridum, tetryzolini hydrochloridum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete
* Přípravek MabThera s.c. je indikován pouze k léčbě dospělých pacientů s non-hodgkinským lymfomem (NHL):
 Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Tyto edukační materiály týkající se bezpečného a účinného používání přípravku MabThera 1 400 mg roztoku pro subkutánní injekci (dále jen MabThera s.c.) je příručkou pro lékaře, zdravotní sestry a lékárníky.
Příbalová informace: informace pro uživatele. Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok. Latanoprostum
 Sp.zn. sukls116684/2014 Příbalová informace: informace pro uživatele Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete užívat
Sp.zn. sukls116684/2014 Příbalová informace: informace pro uživatele Xaloptic 0,005% (0,05 mg/ml), oční kapky, roztok Latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete užívat
Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1
![Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1 Alofisel. Edukační materiály. (darvadstrocel) Pokyny pro příjem a uchovávání léku. [PŘÍRUČKA pro LEKÁRNÍKY] Verze: 1](/thumbs/102/154291766.jpg) Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Edukační materiály
Kelapril 5mg 7x14tbl.
 Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Kelapril 5mg 7x14tbl. Popis zboží: PŘÍBALOVÁ INFORMACE KELAPRIL 5 mg, potahované tablety pro psy kočky 1. JMÉNO A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI A DRŽITELE POVOLENÍ K VÝROBĚ ODPOVĚDNÉHO ZA UVOLNĚNÍ
Co je Voltaren Ophtha CD Léčivou látkou přípravku Voltaren Ophtha CD je diklofenak sodný (diclofenacum natricum).
 Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příloha č.1 ke sdělení sp.zn.sukls23896/2012 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE VOLTAREN OPHTHA CD oční kapky, roztok (diclofenacum natricum) Přečtěte si pozorně celou příbalovou informaci dříve,
Příbalová informace: informace pro uživatele. Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum
 Příbalová informace: informace pro uživatele Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
Příbalová informace: informace pro uživatele Latanoprost Apotex 0,005% oční kapky, roztok latanoprostum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat, protože
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Borgal 200/40 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml obsahuje: Léčivé látky: Sulfadoxinum 200 mg Trimethoprimum
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn.sukls107109/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIOSTAT INTRAOCULAR SOLUTION Oční inzert 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje carbacholum 100 mikrogramů. 1 lahvička
sp.zn.sukls107109/2014 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MIOSTAT INTRAOCULAR SOLUTION Oční inzert 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 ml roztoku obsahuje carbacholum 100 mikrogramů. 1 lahvička
Příbalová informace: Informace pro uživatele. NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem
 Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: Informace pro uživatele NovoThirteen 2 500 IU prášek pro přípravu injekčního roztoku s rozpouštědlem catridecacogum (rekombinantní koagulační faktor XIII) Tento přípravek podléhá dalšímu
Příbalová informace: informace pro uživatele. Ofloxacin-POS 3 mg/ml oční kapky, roztok. Ofloxacinum
 Sp. zn. sukls201848/2013 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls201848/2013 Příbalová informace: informace pro uživatele Ofloxacin-POS 3 mg/ml oční kapky, roztok Ofloxacinum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil. Informace pro pacienty léčené přípravkem OZURDEX
 OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil Informace pro pacienty léčené přípravkem OZURDEX V případě, že chcete další informace o přípravku OZURDEX, požádejte
OZURDEX (intravitreální implantát obsahující 0,7 mg dexametazonu) a okluze retinálních žil Informace pro pacienty léčené přípravkem OZURDEX V případě, že chcete další informace o přípravku OZURDEX, požádejte
Příbalová informace: informace pro uživatele. VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa
 Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
Příbalová informace: informace pro uživatele VPRIV 400 jednotek prášek pro infuzní roztok velaglucerasum alfa Přečtěte si pozorně celou příbalovou informaci před použitím tohoto přípravku, protože obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU IMOVAX POLIO, injekční suspenze v předplněné injekční stříkačce Vakcína proti poliomyelitidě (inaktivovaná) 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ 1 dávka (0,5
Oftalmologie atestační otázky
 Platnost: od 1.1.2015 Oftalmologie atestační otázky Okruh všeobecná oftalmologie 1. Akomodace, presbyopie a její korekce 2. Refrakce oka, způsoby korekce, komplikace (mimo kontaktní čočky) 3. Kontaktní
Platnost: od 1.1.2015 Oftalmologie atestační otázky Okruh všeobecná oftalmologie 1. Akomodace, presbyopie a její korekce 2. Refrakce oka, způsoby korekce, komplikace (mimo kontaktní čočky) 3. Kontaktní
XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
 OS ČLK Ústí nad Labem Oční klinika FZS UJEP Krajská zdravotní, a. s. Masarykova nemocnice v Ústí nad Labem, o. z. za organizační spolupráce BOS. org s. r. o. pořádají XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
OS ČLK Ústí nad Labem Oční klinika FZS UJEP Krajská zdravotní, a. s. Masarykova nemocnice v Ústí nad Labem, o. z. za organizační spolupráce BOS. org s. r. o. pořádají XXVII. ÚSTECKÝ OFTALMOLOGICKÝ DEN
Příbalová informace: informace pro uživatele. Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum
 Sp. zn. sukls203996/2015 Příbalová informace: informace pro uživatele Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Sp. zn. sukls203996/2015 Příbalová informace: informace pro uživatele Dorzoptic 20 mg/ml oční kapky, roztok Dorzolamidum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls92752/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls92752/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solusin 50 mikrogramů/ml Oční kapky, roztok (latanoprostum) oční kapky, roztok Přečtěte
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls92752/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE Solusin 50 mikrogramů/ml Oční kapky, roztok (latanoprostum) oční kapky, roztok Přečtěte
Příbalová informace: Informace pro pacienta. JETREA 0,375 mg/0,3 ml injekční roztok Ocriplasminum
 Příbalová informace: Informace pro pacienta JETREA Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
Příbalová informace: Informace pro pacienta JETREA Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli
JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO
 JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO NEŽ ZAČNETE JEDNORÁZOVÉ PŘEDPLNĚNÉ INJEKČNÍ PERO POUŽÍVAT Umyjte si ruce. Najděte si vhodnou pracovní plochu (čistý stůl nebo pracovní deska linky). Připravte si všechny
JAK POUŽÍVAT PŘEDPLNĚNÉ INJEKČNÍ PERO NEŽ ZAČNETE JEDNORÁZOVÉ PŘEDPLNĚNÉ INJEKČNÍ PERO POUŽÍVAT Umyjte si ruce. Najděte si vhodnou pracovní plochu (čistý stůl nebo pracovní deska linky). Připravte si všechny
SOUHRN ÚDAJŮ O PŘÍPRAVKU. Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Vanguard R injekční suspenze pro psy, kočky, skot, prasata, ovce, kozy, koně a fretky 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace
 Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
Příloha III Dodatky, které je třeba přidat do příslušných bodů souhrnu údajů o přípravku a příbalové informace Poznámka: Tyto úpravy souhrnu údajů o přípravku a příbalové informace jsou platné v okamžiku
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV VETERINÁRNÍHO LÉČIVÉHO PŘÍPRAVKU Feligen CRP Lyofilizát pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Lyofilizovaná složka Léčivé
PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE. CAMILIA perorální roztok v jednodávkovém obalu
 sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
sp.zn. sukls179376/2014 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE CAMILIA perorální roztok v jednodávkovém obalu Chamomilla vulgaris 9 CH, Phytolacca decandra 5 CH, Rheum 5 CH Přečtěte si pozorně tuto
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
Příloha č. 3 k rozhodnutí o registraci sp.zn. sukls174802/2010 1. NÁZEV PŘÍPRAVKU SOUHRN ÚDAJŮ O PŘÍPRAVKU DICLOABAK 1 mg/ml, oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Diclofenacum natricum...1
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU
 PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum. Jedna injekční lahvička obsahuje
PŘÍLOHA I SOUHRN ÚDAJŮ O PŘÍPRAVKU 1 1. NÁZEV PŘÍPRAVKU Lucentis 10 mg/ml injekční roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml obsahuje 10 mg ranibizumabum. Jedna injekční lahvička obsahuje
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
1. NÁZEV PŘÍPRAVKU TETAVAX Injekční suspenze Vakcína proti tetanu (adsorbovaná) SOUHRN ÚDAJŮ O PŘÍPRAVKU 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Léčivá látka: 1 dávka (0,5 ml) obsahuje Tetani anatoxinum
Popis přípravku : Prášek: bílý lyofilizát. Rozpouštědlo: čirá bezbarvá tekutina
 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU MENINGOCOCCAL POLYSACCHARIDE A+C VACCINE Prášek pro přípravu injekční suspenze s rozpouštědlem 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jedna dávka (0,5 ml) rozpuštěné
Příloha I. Vědecké závěry a zdůvodnění změny v registraci
 Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
Příloha I Vědecké závěry a zdůvodnění změny v registraci 1 Vědecké závěry S ohledem na hodnotící zprávu výboru PRAC týkající se pravidelně aktualizované zprávy / aktualizovaných zpráv o bezpečnosti (PSUR)
POKYNY PRO POUŽITÍ. Budete potřebovat následující položky, které jsou obsaženy v balení:
 POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
POKYNY PRO POUŽITÍ Jak používat předplněné pero PegIntron Následující pokyny vysvětlují, jak si můžete aplikovat injekci sám/sama pomocí předplněného pera. Prosím, přečtěte si pečlivě pokyny a krok za
PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA. EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum
 PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
PŘÍBALOVÁ INFORMACE:INFORMACE PRO PACIENTA EFFLUMIDEX Liquifilm oční kapky, suspenze fluorometholonum Přečtěte si pozorně celou příbalovou informaci dříve, než začnete tento přípravek používat. - Ponechte
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011
 Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DICLOABAK 1 mg/ml, oční kapky, roztok Diclofenacum
Příloha č. 1 k rozhodnutí o změně registrace sp.zn. sukls100905/2011 a příloha ke sp.zn.sukls258988/2011 PŘÍBALOVÁ INFORMACE: INFORMACE PRO UŽIVATELE DICLOABAK 1 mg/ml, oční kapky, roztok Diclofenacum
Oddíl 1 O přípravku Lucentis
 mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
mcnv Váš průvodce léčbou poškození zraku způsobeného choroidální neovaskularizací (CNV) sekundární k patologické myopii (PM) přípravkem Lucentis (ranibizumab) 2 Oddíl 1 O přípravku Lucentis Tato brožura
JETREA 0,5 mg/0,2 ml koncentrát pro injekční roztok Ocriplasminum
 Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Příbalová informace:informace pro pacienta Ocriplasminum Tento přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Můžete přispět tím, že nahlásíte jakékoli nežádoucí
Souhrn údajů o přípravku
 sp. zn.: sukls35258/2013 a sp. zn.: sukls151801/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml očních
sp. zn.: sukls35258/2013 a sp. zn.: sukls151801/2014 Souhrn údajů o přípravku 1. NÁZEV PŘÍPRAVKU EFFLUMIDEX Liquifilm 1 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml očních
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 sp.zn. sukls193081/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Predni-POS 5 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje prednisoloni acetas 5,0 mg
sp.zn. sukls193081/2017 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Predni-POS 5 mg/ml oční kapky, suspenze 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Jeden ml suspenze obsahuje prednisoloni acetas 5,0 mg
OZURDEX injekce: návod
 OZURDEX injekce: návod Dexamethasonum 700 mikrogramů, intravitreální implantát v aplikátoru Makulární edém po uzávěru větve retinální žíly nebo po uzávěru centrální retinální žíly Souhrn údajů o přípravku
OZURDEX injekce: návod Dexamethasonum 700 mikrogramů, intravitreální implantát v aplikátoru Makulární edém po uzávěru větve retinální žíly nebo po uzávěru centrální retinální žíly Souhrn údajů o přípravku
NeuroBloc. botulinový toxin typu B injekční roztok, U/ml
 NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
NeuroBloc botulinový toxin typu B injekční roztok, 5 000 U/ml Důležité bezpečnostní informace určené lékařům Účelem této příručky je poskytnout lékařům, kteří jsou oprávněni předepisovat a aplikovat přípravek
ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum
 PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
PŘÍBALOVÁ INFORMACE INFORMACE PRO UŽIVATELE ANTITHROMBIN III NF BAXTER Prášek pro přípravu infuzního roztoku s rozpouštědlem Antithrombinum humanum Přečtěte si pozorně celou příbalovou informaci dříve,
SOUHRN ÚDAJŮ O PŘÍPRAVKU
 Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
Sp.zn. sukls277451/2012 SOUHRN ÚDAJŮ O PŘÍPRAVKU 1. NÁZEV PŘÍPRAVKU Azelastin COMOD 0,5 mg/ml oční kapky, roztok 2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ Azelastini hydrochloridum 0,05 % (0,50 mg/ml) Jedna
